-
Medical journals
- Career
Management dyslipidemií u žen
Authors: Šatný M.; Vrablík M.
Authors‘ workplace: Centrum preventivní kardiologie, III. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
Published in: Kardiol Rev Int Med 2019, 21(2): 73-77
Overview
Přestože byl v posledních desetiletích zaznamenán výrazný pokles mortality spojené s kardiovaskulárními onemocněními (KVO), zůstávají tyto i přes rozsáhlá preventivní opatření a nové léčebné modality vedoucí příčinou úmrtí v rozvinutých zemích, a to zejména u žen. Je známo, že pro ženskou populaci představuje dyslipidemie (DLP) nejvýznamnější rizikový faktor aterosklerotických KVO, které se spolu s DLP typicky manifestují až v průběhu menopauzy. Hlavním sledovaným parametrem lipidogramu je nezávisle na pohlaví LDL cholesterol, přičemž u žen se v některých studiích objevuje také úzká asociace KV rizika s hladinami HDL cholesterolu či triglyceridů. Ze současných guidelines pro management DLP z roku 2016 nevyplývají žádné pohlavně specifické výstupy, resp. samostatnými kapitolami jsou období menopauzy, indikace hormonální substituční léčby, užívaní hormonální antikoncepce či těhotenství. Explicitně doporučení zmiňují důkladné zhodnocení KV rizika, abychom předcházeli zbytečnému zahájení léčby u nízce rizikových pacientek. U žen, tak jako je tomu u obecné populace, platí cílové hodnoty LDL cholesterolu dle kategorie KV rizika; zlatý standard léčby DLP pak představují statiny, které lze dle potřeby kombinovat s dalšími preparáty.
Klíčová slova:
dyslipidemie – ženská populace – diagnostika a léčba dyslipidemie – hormonální antikoncepce – hormonální substituční léčba – těhotenství
Trocha epidemiologie úvodem…
Pokud se podíváme na poslední dostupná data Ústavu pro zdravotnické informace a statistiku z roku 2017, zůstávají kardiovaskulární onemocnění (KVO) (dlouhodobě) hlavní příčinou úmrtí v ČR, kdy se podílely na standardizované úmrtnosti 40 % mužů a 48 % žen [1]. Obdobná situace panuje ve všech rozvinutých zemích Evropy i USA [2].
Uvádí se, že až polovina KV úmrtí je podmíněna ischemickou chorobou srdeční (ICHS), přičemž u žen je typicky její rozvoj opožděn přibližně o 10 let; manifestuje se tedy nejčastěji v době nástupu menopauzy [3]. Předpokládá se ochranný vliv estrogenů, jejichž pokles v tomto období nepřímo koreluje s nárůstem KV rizika. Z práce Vaccarina et al zabývající se výskytem infarktů myokardu (IM) v závislosti na pohlaví vyplynulo, že ženy umírají na první IM častěji než muži. Následně mají až 2× vyšší riziko rozvoje srdečního selhání či recidivy IM [4].
Framinghamská studie doložila, že ženy mají vyšší celoživotní riziko cévní mozkové příhody (CMP); například v populaci 55–70 let se předpokládá o 3–7 % vyšší riziko CMP než u mužů [5].
Celosvětově je až 75 % všech KVO způsobeno třemi rizikovými faktory (RF) – DLP, kouřením, arteriální hypertenzí či jejich kombinacemi, přičemž pro populaci žen představuje nejvýznamnější RF právě DLP [6]. Její prevalence je však těžko stanovitelná, jelikož nemáme přesnou definici – spíše hovoříme o cílových hodnotách lipidů a lipoproteinových částic pro jednotlivé kategorie KV rizika. Z české studie zabývající se léčbou arteriální hypertenze a mimo jiné sledující výskyt dalších RF vyplynulo, že DLP se vyskytovala u 94,7 % mužů, resp. 93,7 % žen s arteriální hypertenzí. Vztaženo tedy obecně na naší populaci hypertoniků, kde udávaná prevalence hypertenze je přibližně 40 % u osob ve věku 25–64 let, má valná většina z nich současně DLP [7].
Za hlavní sledovaný parametr lipidového spektra podílející se na vzniku a progresi KVO je považován nezávisle na pohlaví LDL cholesterol (LDL-c), avšak u žen se dle některých studií objevuje také úzká asociace KV rizika s hladinami HDL cholesterolu (HDL-c) či triglyceridů (TG). Dle studie Lipid Research Clinics Follow-up Study byla hypertriglyceridemie > 2,25 mmol/ l asociována se zvýšeným rizikem KV mortality [2].
Liší se lipidogram u žen?
Do puberty se lipidový profil dívek a chlapců liší zcela minimálně, avšak s jejím nástupem dochází díky ženským pohlavním hormonům k řadě změn – zvýší se HDL-c, nepatrně klesne LDL-c, nonHDL-c i TG; současně je popisována také větší průměrná velikost LDL partikulí.
S počátkem menopauzy a poklesem „ochranně“ působících estrogenů nastávají změny vyúsťující až do vzniku aterogenní dyslipidemie, avšak v literatuře popisované odchylky lipidogramu jsou relativně malé a často nekonzistentní. Některé práce dokumentují nárůst LDL-c, vystupňovanou syntézu malý denzních LDL částic či nepatrný pokles HDL-c, což bývá markantnější u žen s tzv. arteficiální menopauzou, u nichž je navíc zaznamenávána zvýšená koncentrace lipoproteinu (a) (Lp (a)). Na vzniku DLP u postmenopauzálních žen se mohou podílet další doprovodné změny spojené s tímto stavem, a sice nárůst tělesného, resp. viscerálního tuku či inzulinová rezistence [8].
Pokud se zabýváme DLP u žen, je nutno zmínit i jednu zcela specifickou, ale fyziologickou situaci – těhotenství, během kterého dochází vlivem hormonálních změn k nárůstu celkového cholesterolu, LDL-c, HDL-c i TG.
Jakou roli hraje hormonální antikoncepce či hormonální substituční léčba?
Léčba estrogeny vede k alteraci metabolizmu lipidů – při jejím podávání je pozorován nárůst HDL-c (až o 15 %), pokles LDL-c (až o 15–20 %), Lp (a) (až o 20–25 %), dále pak nárůst TG, apolipoproteinu AI za současného poklesu apolipoproteinu B. Svým působení mohou estrogeny vést u predisponovaných jedinců k manifestaci těžké hypertriglyceridemie či chylomikronemického syndromu. Stran ovlivnění hladin krevních tuků je zásadní způsob podání exogenních estrogenů. Platí, že nejmenší efekt na lipidogram mají estrogeny podávané transdermálně, které lze proto s výhodou využít zejména u pacientek se známou abnormalitou metabolismu TG [9].
Další diskutovanou skupinou ženských steroidních hormonů jsou progestiny, jimž jsou připisovány účinky podobné androgenům, tj. při jejich podávání dochází k poklesu HDL-c a TG bez větší změny LDL-c, což může být mitigováno současným podáváním s estrogeny [8].
U fertilních žen užívajících kombinované hormonální preparáty je nutné brát v potaz, že během menstruačního cyklu fluktuuje nejen plazmatická koncentrace hladin lipidů a lipoproteinových částic, ale i objem plazmy, proto by měly být odběry prováděny vždy ve stejné fázi cyklu, abychom získali srovnatelné výsledky [2,8].
Stran rizika ICHS spojeného s hormonální antikoncepcí (HAK) je k dispozici rozporuplná evidence. Výsledky starších prospektivních studií poukazovaly na zvýšení rizika IM u pacientek užívajících HAK, zejména pak těch současně kouřících, avšak například velká švédská populační studie s novějšími typy HAK (nízké dávky estrogenů v kombinaci s progestiny
2. či 3. generace) nedokumentovala žádný vztah mezi užíváním HAK a výskytem IM [10]. Chakhtoura et al v roce 2011 publikovali práci, která si kladla za cíl zhodnotit možný vliv progesteronové HAK na výskyt IM; ten opět prokázán nebyl [11]. Poněkud odlišná je situace u CMP, kdy je popisován až 2× vyšší výskyt CMP u žen užívajících HAK [2].Máme k dispozici řadu studií, jež hodnotily „risk vs. benefit“ hormonální substituční terapie (HRT) ve vztahu ke KVO; souhrnně lze konstatovat, že u mladších žen, které jsou krátkou dobu v klimakteriu, lze očekávat při HRT žádný, nebo mírně pozitivní vliv této léčby na výskyt KVO, zatímco u těch již delší dobu postmenopauzálních bude dopad léčby spíše negativní [9]. Dle aktuálních guidelines není HRT doporučována v rámci prevence KVO [12].
Jak tedy postupovat při diagnostice a léčbě DLP u žen?
Současná evropská doporučení pro management DLP nerozlišují žádné pohlavně specifické diagnostické, režimové či léčebné postupy, avšak z epidemiologických dat je zřejmé, že právě u žen je zcela zásadní role primární prevence KVO, tj. časné rozpoznání KV rizika a na něj navazující adekvátní léčebná intervence.
Pokud je zjištěna jakákoliv forma DLP, musíme vždy v úvodu vyloučit její možnou sekundární etiologii. Nejčastěji pomýšlíme na hypotyreózu, primozáchyt diabetes mellitus, onemocnění ledvin, jater, abúzus alkoholu či na polékovou etiologii (HAK, psychofarmaka, betablokátory, kortikoterapie, …). Vstupní laboratorní náběry by proto měly zahrnovat kromě lipidogramu také vyšetření jaterních testů, renálních funkcí vč. vyšetření moči, glykemie (případně glykovaného hemoglobinu) či funkce štítné žlázy.
Je-li sekundární DLP vyloučena, cíleně pátráme po dalších RF KVO a hodnotíme celkové KV riziko. K jeho určení slouží u jinak zdravých pacientek starších 50 let, případně postmenopauzálních, tabulky SCORE (tab. 1); dle nich vypočtené riziko může být dodatečně modifikováno například pozitivní rodinnou anamnézou KVO či dalšími parametry uvedenými v tab. 2. U mladších žen pak můžeme s výhodou využít také tabulky relativního rizika (tab. 3). V posledních doporučených postupech je explicitně zmíněno důkladné zhodnocení KV rizika, abychom předcházeli zbytečnému zahájení léčby u nízce rizikových pacientek.
Table 1. Tabulka SCORE. Převzato z [12]. ![Tabulka SCORE. Převzato z [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/0e6c392d7fc8fb42617e7ae8aed6d9bc.png)
Table 2. Faktory modifi kující riziko vypočtené dle SCORE. Upraveno dle [12]. ![Faktory modifi kující riziko vypočtené
dle SCORE. Upraveno dle [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/c7013430ec4b3c468647e137522b59ac.png)
Table 3. Tabulka relativního rizika. Upraveno dle [12]. ![Tabulka relativního rizika. Upraveno dle [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/cbc7bfd37d85b5f5085d2d360bdf8a74.png)
Pro přehlednost jsou v tab. 4 shrnuty klinické situace, kdy nemocné automaticky řadíme do kategorie vysokého či velmi vysokého KV rizika.
Table 4. Kategorie KV rizika. Upraveno dle [12]. ![Kategorie KV rizika. Upraveno dle [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/1e2137a3d8a7a8dc270c5cefca461ff4.png)
KV – kardiovaskulární; CMP – cévní mozková příhoda; RF – rizikový faktor; GFR – glomerulární filtrace Jaké jsou cílové hodnoty krevních lipidů? Jakými prostředky jich dosáhnout?
V souladu s posledními poznatky zůstává i nadále hlavním sledovaným lipidovým parametrem LDL-c, pro který jsou stanoveny cílové hodnoty dle kategorie KV rizika, tj. pro kategorii velmi vysokého rizika pod 1,8 mmol/ l (nebo snížení hladiny LDL-c alespoň o 50 %, pokud byla výchozí hodnota mezi 1,8–3,5 mmol/ l), resp. pod 2,6 mmol/ l (nebo snížení hladiny LDL-c alespoň o 50 %, pokud byla výchozí hodnota mezi 2,6–5,2 mmol/ l) pro kategorii rizika vysokého. Ženy ve středním či nízkém KV riziku bychom pak měli směřovat k cílovým hodnotám LDL-c pod 3 mmol/ l.
Jako sekundární léčebný cíl byl stanoven non-HDL-c, jehož cílové hodnoty opět zohledňují kategorie KV rizika, a to < 2,6 mmol/ l pro velmi vysoké KV riziko, < 3,4 mmol/ l pro riziko vysoké a < 3,8 mmol/ l pro riziko střední [12].
Doporučené hodnoty HDL-c a TG jsou pak > 1,2 mmol/ l, resp. < 1,7 mmol/ l na lačno.
Základem léčby u každé pacientky s DLP by měla být nefarmakologická, resp. režimová opatření – tj. zanechání kouření či zabránění jeho expozici, pravidelná pohybová aktivita (dbát pravidla: „Každý pohyb se počítá“) a samozřejmě vhodná dieta.
Práce zabývající se dietními zvyklostmi napříč evropským kontinentem došly k závěru, že jako nejvhodnější se jeví dieta středomořská, a to hlavně díky vysokému obsahu zeleniny, ovoce, celozrnných produktů, ryb, nenasycených mastných kyselin obsažených v olivovém oleji, malé konzumaci alkoholu a červeného masa, avšak nutno podotknout, že efekt diety na ovlivnění KV rizika se u žen dosud jednoznačně neprokázal (tab. 5) [12].
Table 5. Doporučené složení diety. Upraveno dle [12]. ![Doporučené složení diety. Upraveno dle [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/c0df49034ea128cde50cd0dc525a7160.png)
Pokud není dosaženo cílových hodnot LDL-c režimovými opatřeními zahajujeme medikamentózní terapii, přičemž máme k dispozici celou škálu terapeutických možností.
Zlatým standardem léčby jsou statiny (v ČR – atorvastatin, rosuvastatin, simvastatin, fluvastatin), které se ukázaly být dostatečně účinné u obou pohlaví, a to jak v primární, tak sekundární prevenci (tab. 6).
Table 6. Redukce relativní rizika (RRR) ve „statinových studiích“ u žen. Upraveno dle [14]. ![Redukce relativní rizika (RRR) ve „statinových studiích“ u žen. Upraveno dle [14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/2fa46594d0af8b6d400a039187b8d3f4.png)
NAP – nestabilní angina pectoris; ICHS – ischemická choroba srdeční; IM –infarkt myokardu; CMP – cévní mozková příhoda Při podávání statinů u pacientek ve fertilním věku se doporučuje současná antikoncepce, jelikož nejsou dostupná data o možné teratogenitě těchto preparátů. Avšak velká kohortová studie, která zahrnovala takřka 900 000 dokončených těhotenství – z nich 0,13 % u pacientek léčených statiny, prokázala relativní riziko malformace plodu 1,07, tj. takřka zanedbatelné [13]. V případě plánovaného těhotenství je pak nutno statiny alespoň 3 měsíce předem vysadit; jejich navrácení je možné po ukončení laktace. V průběhu těhotenství lze bezpečně využít pouze 2 léčebné modality, a sice sekvestranty žlučových kyselin (cholestyramin) a u nemocných se závažnou DLP (např. homozygotní familiární hypercholesterolemie) pak LDL-aferézu, která se provádí na několika pracovištích v ČR.
Dalším, velmi účinným a často opomíjeným lékem je ezetimib, který blokuje absorpci cholesterolu a rostlinných sterolů ze střeva, proto je dobře využitelný v kombinacích se synergicky působícími statiny (ty by měly být v případě indikace ezetimibu použity vždy, i ve velmi malé dávce či v rámci alternativního způsobu podávání).
U pacientek se smíšenou DLP (případně diabetes mellitus 2. typu) doprovázenou těžší hypertriglyceridemií lze s výhodou přidat do kombinace ke statinu také fenofibrát, který mimo jiné zabraňuje vzniku, resp. progresi diabetické retinopatie.
Od léta 2018 máme pro nejrizikovější pacientky, které nedosahují konvenční léčbou cílových hodnot LDL-c či tuto netolerují, k dispozici také subkutánně aplikovanou léčbu inhibitory PCSK9; na trhu jsou t. č. 2 preparáty – alirocumab a evolocumab, podávané ve 14 denních intervalech.
Nikdy však neléčíme pouze „cholesterol“, ale jedince jako celek, proto aktivně pátráme po dílčích RF a snažíme se všechny dostat „pod kontrolu“, tj. dosáhnout kýžených cílových hodnot pro daný RF (tab. 7).
Table 7. Rizikové faktory KVO a jejich cílové hodnoty. Upraveno dle [12]. ![Rizikové faktory KVO a jejich cílové hodnoty. Upraveno dle [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/59b8f810552a351037f0f1764a72c261.png)
BMI – Body Mass Index Ke zvýšení adherence k léčbě je vždy nasnadě se zamyslet, zda na trhu nemáme k dispozici fixní kombinace léčiv, kterými bychom stávající hypolipidemika či antihypertenziva u léčených pacientek nahradili (tab. 8).
Table 8. Fixní kombinace využitelné při léčbě dyslipidemie, event. dalších rizikových faktorů kardiovaskulárních onemocnění. 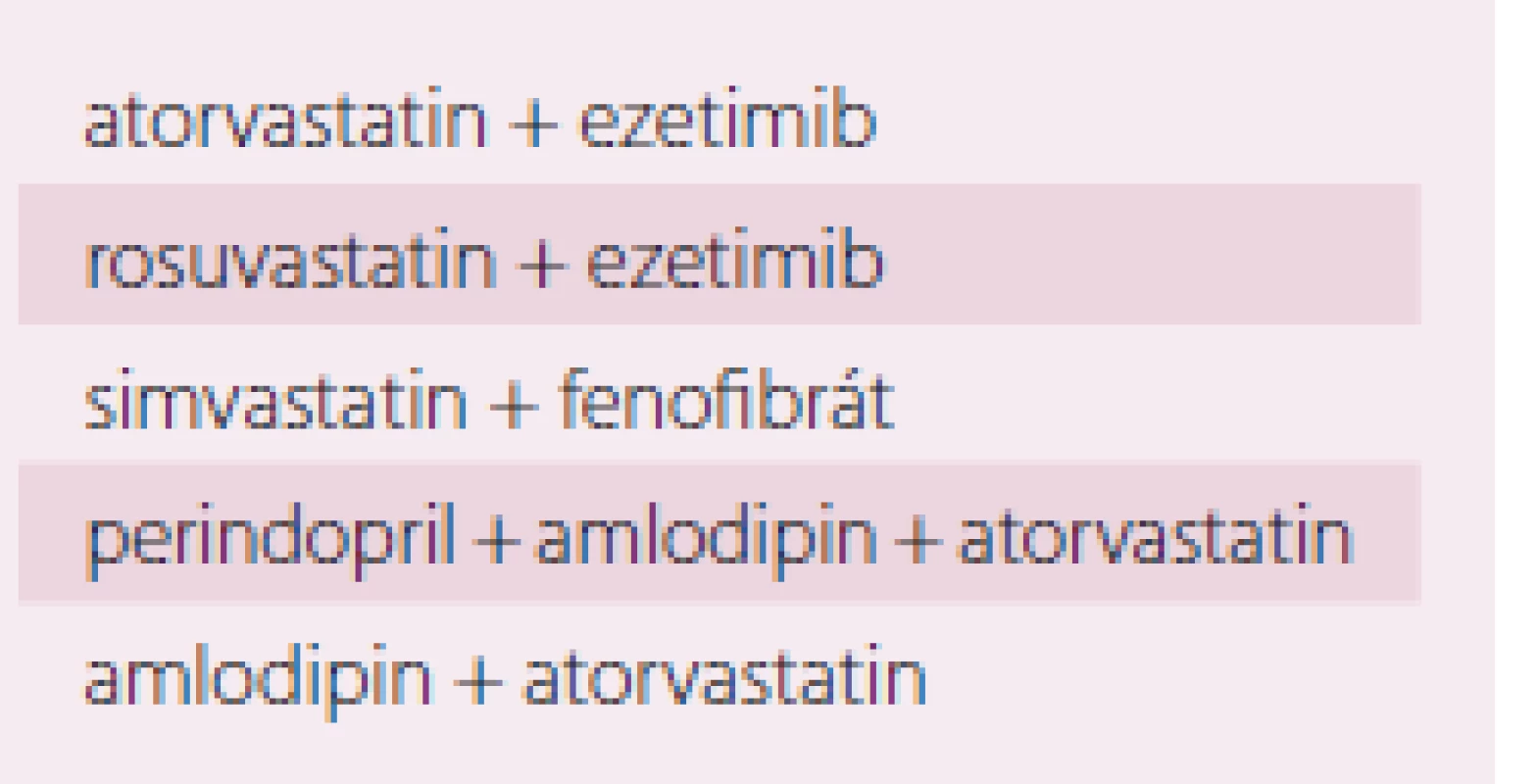
„Take home message“
I přes veškeré snahy zůstávají KVO vedoucí příčinou úmrtnosti v rozvinutých zemích, a to především u žen, u nichž se právě DLP považuje za nejvýznamnější RF KVO. S nástupem menopauzy jejich KV riziko prudce stoupá – uvádí se, že první manifestace KVO, často smrtelná, je opožděna přibližně o 10 let oproti mužům, což poukazuje na zásadní roli primárně preventivních opatření. V současnosti máme efektivní léčbu, která je schopna KV riziko významně snížit; kruciálním však zůstává jeho časná identifikace a navazující adekvátní léčebná intervence.
Podpořeno MZ ČR – RVO VFN64165
Doručeno do redakce: 23. 4. 2019
Přijato po recenzi: 2. 5. 2019
MU Dr. Martin Šatný
www.vfn.cz
Sources
1. Zemřelí 2017. Praha: ÚZIS ČR 2018.
2. Cífková R, Krajčoviechová A. Dyslipidemia and cardiovascular disease in women. Current cardiology reports 2015; 17(7): 609. doi: 10.1007/ s11886-015-0609-5.
3. Yusuf S, Hawken S, Ôunpuu S et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364(9438): 937–952. doi: 10.1016/ S0140-6736(04)17018-9.
4. Vaccarino V, Parsons L, Every NR et al. Sex-based differences in early mortality after myocardial infarction. N Eng J Med 1999; 341(4): 217–225. doi: 10.1056/ NEJM199907223410401.
5. Seshadri S, Beiser A, Kelly-Hayes M et al. The lifetime risk of stroke: estiamates from the Framingham Study. Stroke 2006; 37(2): 345–350. doi: 10.1161/ 01.STR.0000199613.38911.b2.
6. World Health Organization. The world health report 2002: Reducing risk, promoting healthy life. Geneva: World Health Organization 2002.
7. Jozífová M, Cífková R, Lánská V et al. Porovnání léčby hypertenze a rizikového profilu hypertoniků v obecné populaci a na specializovaném pracovišti. Cor Vasa 2003; 45(11): 533–541.
8. Feingold K, Brinot EA, Grunfeld C. The effect of endocrine disorders on lipids and lipoproteins. In: De Groot LJ, Chrousos G, Dungan K et al. (eds) Endotext. South Dartmouth (MA): MDText.com, Inc.; 2000. Available at: https:/ / www.ncbi.nlm.nih.gov/ books/ NBK409608.
9. Šatný M, Vrablík M. Dyslipidemie u vybraných endokrinopatií. Kardiol Rev Int Med 2018; 20(3): 188–196.
10. Margolis K, Adami H, Lou J et al. A prospective study of oral contraceptive use and risk of myocardial infarction among Swedish women. Fertil Steril 2007; 88(2): 310–316. doi: 10.1016/ j.fertnstert.2006.11.
206.11. Chakhtoura Z, Canonico M, Gompel A et al. Progestogen-only contraceptives and the risk of acute myocardial infarction: a meta-analysis. J Clinl Endocrinol Metab 2011; 96(4): 1169–1174. doi: 10.1210/ jc.2010-2065.
12. Catapano AL, Graham I, De Backer G et al. 2016 ESC/ EAS Guidelines for the management of dyslipidaemias. Eur Heart J 2016; 37(39): 2999–3058. doi: 10.1093/ eurheartj/ ehw272.
13. Bateman BT, Hernandez-Diaz S, Fischer MA
et al. Statins and congenital malformations: cohort study. BMJ 2015; 350 : 1035. doi: 10.1136/ bmj.h1035.14. Toth P, Phan BA. Dyslipidemia in women: etiology and management. Int J Womens Health 2014; 6 : 185–194. doi: 10.2147/ IJWH.S38133.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2019 Issue 2-
All articles in this issue
- Vzpomínka na prof. Miloše Štejfu (28. 5. 1929–20. 5. 2015)
- Novinky o familiární hypercholesterolemii pro kardiology
- Update role Lp (a) při určení kardiovaskulárního rizika a možnosti jeho ovlivnění
- Variabilita lipidov
- Management dyslipidemií u žen
- Minimum o mechanických podporách srdca – klasifikácia, indikácie, princípy, klinické skúsenosti
- Betablokátory u kardiovaskulárních onemocnění – pro a proti
- Účinnosť a bezpečnosť nových antikoagulancií v reálnej klinickej praxi
- Tvorba a ověření ošetřovatelského standardu edukace pacientů po infarktu myokardu
- Kouření – ovlivnitelný rizikový faktor nemocí srdce a cév
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Betablokátory u kardiovaskulárních onemocnění – pro a proti
- Update role Lp (a) při určení kardiovaskulárního rizika a možnosti jeho ovlivnění
- Minimum o mechanických podporách srdca – klasifikácia, indikácie, princípy, klinické skúsenosti
- Novinky o familiární hypercholesterolemii pro kardiology
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

