-
Medical journals
- Career
Srdeční selhání, kardiomyopatie a gravidita
Authors: Krejčí J.
Authors‘ workplace: I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně
Published in: Kardiol Rev Int Med 2018, 20(4): 256-259
Overview
V průběhu těhotenství a při porodu dochází k řadě hemodynamických změn, které mohou mít závažný dopad na nemocné s přítomností srdečního selhání (SS), případně vést k jeho manifestaci u předtím asymptomatické ženy. Diagnostika SS v těhotenství může být komplikována přítomností průvodních obtíží gravidity, které mohou zakrýt skutečnou příčinu tohoto stavu. Pokud je SS známo již před graviditou, je naším úkolem podílet se na prekoncepčním poradenství, zhodnocení rizika gravidity pro matku i plod, na úpravách medikace v průběhu těhotenství a diskuzi o opatřeních zajišťujících bezpečný průběh porodu. Nejčastější příčinou SS v graviditě jsou kardiomyopatie. Nejde o homogenní skupinu onemocnění, u některých typů je těhotenství snášeno dobře, existují ale případy, které jsou kontraindikací pro plánovanou graviditu, popř. mohou být důvodem k přerušení již probíhajícího těhotenství. Mnohé formy kardiomyopatií jsou geneticky vázané, a jsou tak spojeny s možným přenosem onemocnění na potomka. Pro optimalizaci péče o ženy se SS, které plánují graviditu či jsou již těhotné, je žádoucí vytvořit specializované multioborové týmy, jejichž důležitou součástí je i kardiolog.
Klíčová slova:
srdeční selhání – kardiomyopatie – těhotenství
Úvod
Srdeční selhání (SS) je syndrom charakterizovaný skutečností, že srdce při normálních plnicích tlacích levé komory (LK) srdeční není schopné zabezpečit dostatečnou perfuzi organizmu. Můžeme při něm tedy nalézt buď nedostatečný minutový výdej, nebo zvýšené plnicí tlaky LK, kvůli kterým může být dopředný výdej za klidových podmínek udržen; v závažnějších případech potom vídáme kombinaci obou těchto patologií. SS se obvykle projevuje dušností, otoky, nevýkonností, slabostí, zvýšenou únavností či nechutenstvím. Matoucí pro diagnostiku v průběhu gravidity může být skutečnost, že řada z těchto příznaků může být přičítána samotnému těhotenství, a být tak ze strany jak dotyčné ženy, tak jejich lékařů přehlížena či bagatelizována. Při objektivním vyšetření nalézáme známky kongesce, jako je zvýšená náplň krčních žil, nepřízvučné chrůpky na plicích, přítomnost pleurálního výpotku či otoky dolních končetin. Případná hepatomegalie může být v pozdějších stadiích gravidity obtížně hodnotitelná. Dalším krokem v diagnostice je průkaz strukturálního či funkčního postižení LK srdeční při echokardiografickém vyšetření, který může být podpořen elevací hladin natriuretických peptidů – nicméně si musíme být vědomi toho, že tyto jsou v graviditě ve srovnání s negravidními ženami zvýšené [1,2].
Nejčastější diagnózou vedoucí ke vzniku SS v celé populaci je ischemická choroba srdeční (ICHS), ta se však týká zejména vyšších věkových kategorií, a proto se jí v tomto textu věnovaném SS v těhotenství budeme věnovat jen okrajově. Problematice vrozených srdečních vad a chlopenních vad jako dalším možným příčinám SS jsou věnovány separátní články v tomto čísle, podobně tak peripartální kardiomyopatii (KMP), která je podle některých dat nejčastější příčinou SS v graviditě, a proto zde nebudou rozebírány [3,4].
Kardiomyopatie a gravidita
Nejdůležitější skupinou onemocnění, která jsou asociována se SS v těhotenství, jsou tedy KMP [4,5]. Mezi ně řadíme onemocnění srdečního svalu charakterizovaná jeho funkčními a strukturálními abnormitami, které nejsou způsobeny ICHS, hypertenzí, chlopenními či vrozenými srdečními vadami. Evropská klasifikace KMP je dělí podle morfologického obrazu na hypertrofickou (HKMP), dilatační (DKMP), restriktivní (RKMP) a arytmogenní KMP (AKMP); dále mohou být rozděleny na skupinu geneticky vázaných (tzv. familiárních) nebo získaných (nefamiliárních) [6].
KMP jsou spojeny se zvýšeným rizikem vzniku SS, ať už se zachovanou ejekční frakcí levé komory (EF LK) srdeční (heart failure with preserved ejection fraction – HFpEF), nebo se sníženou EF LK (heart failure with reduced ejection fraction – HFrEF). Vedle toho jsou spojeny rovněž s vyšším rizikem závažných arytmií či náhlé smrti [1,5].
Zejména familiární formy KMP (ale nejen ty) se mohou manifestovat v mladším věku, a postihovat tak ženy ve fertilním věku. Je tedy jasné, že řada z žen s přítomnou KMP bude konfrontována se situací, kdy bude chtít uvažovat o možnosti těhotenství či otěhotnění, aniž by graviditu plánovaly.
Úlohou kardiologa je podílet se na poradenství, na stratifikaci rizika, úpravě léčby před početím a v průběhu gravidity, zajištění podmínek pro co nejhladší průběh těhotenství i samotného porodu a v neposlední řadě ve spolupráci s gynekologem a neonatologem se pokusit minimalizovat dopady onemocnění matky či její farmakoterapie na plod či novorozence. Součástí prekoncepčního poradenství by měla být konzultace s genetikem, a to zejména v případech KMP s jasnou formou dědičnosti a s identifikovanými patogenními mutacemi, jako je tomu u HKMP či AKMP [4– 6].
Pro odhad rizika těhotenství byla vypracována WHO klasifikace kardiovaskulárního (KV) rizika, která byla recentně modifikována a je uvedena hned v editorialu tohoto čísla [7]. Třída I dle mWHO značí nejnižší riziko (u SS či KMP se s ní ovšem nesetkáme), naopak třída IV, která je spojena s extrémně vysokým rizikem mateřské mortality a morbidity, znamená kontraindikaci těhotenství či indikaci k přerušení těhotenství [4].
Patofyziologie oběhových změn v těhotenství
Z patofyziologického hlediska je přítomnost KMP spojena se sníženou KV rezervou. Tato skutečnost se v souvislosti s hemodynamickými změnami, k nimž v průběhu těhotenství dochází, může stát příčinou manifestace symptomů či progrese samotného onemocnění, k čemuž mnohdy přispívá i nutnost vysazení některých zavedených léků, jejichž podávání je v těhotenství kontraindikováno. Zhoršení SS se sníženým srdečním výdejem naopak negativně ovlivňuje placentární průtok, což má logicky nepříznivý vliv na vývoj plodu [3,4,8].
V průběhu těhotenství dochází k nárůstu intravaskulárního volumu, zvýšení srdečního výdeje (v první polovině gravidity zejména v důsledku zvýšení tepového objemu, v druhé polovině kvůli nárůstu tepové frekvence) a poklesu periferní vaskulární rezistence. V průběhu porodu dochází k náhlému vzestupu intravaskulárního volumu (až o 500 ml při každé kontrakci), vzestupu minutového výdeje, zejména ve druhé fázi narůstá afterload, těsně po porodu se v důsledku autotransfuze krve z uteroplacentárního systému dále zvyšuje preload. Opačným směrem působí krevní ztráty v průběhu porodu. Je tedy jasné, že těhotenství a porod jsou pro KV systém značnou zátěží [4,5,9].
V dalším textu bychom popsali klinický průběh, zhodnocení rizika a opatření v průběhu těhotenství u žen s nejčastějšími příčinami SS.
Hypertrofická kardiomyopatie
Diagnóza HKMP se opírá o průkaz zbytnění stěn LK na ≥ 15 mm, které nemá vysvětlení např. v chlopenní vadě či přítomnosti hypertenze (obr. 1). Prevalence v populaci je odhadována na 1 : 500 [6]. Pod obrazem HKMP se manifestuje řada tzv. fenokopií, ty však u mladších žen nejsou příliš časté, a tak se v těhotenství budeme setkávat v drtivé většině s „klasickou“ sarkomerickou HKMP. Ta je poměrně dobře geneticky zmapována, byť mutace jsou extrémně variabilní. Obvykle jde o monogenně podmíněné onemocnění s autozomálně dominantním přenosem, což znamená, že polovina potomků postižené matky má riziko mutaci zdědit [10].
Image 1. Echokardiografický obraz hypertrofické kardiomyopatie se zesílením mezikomorového septa na 40 mm. Zdroj: Archiv autora. 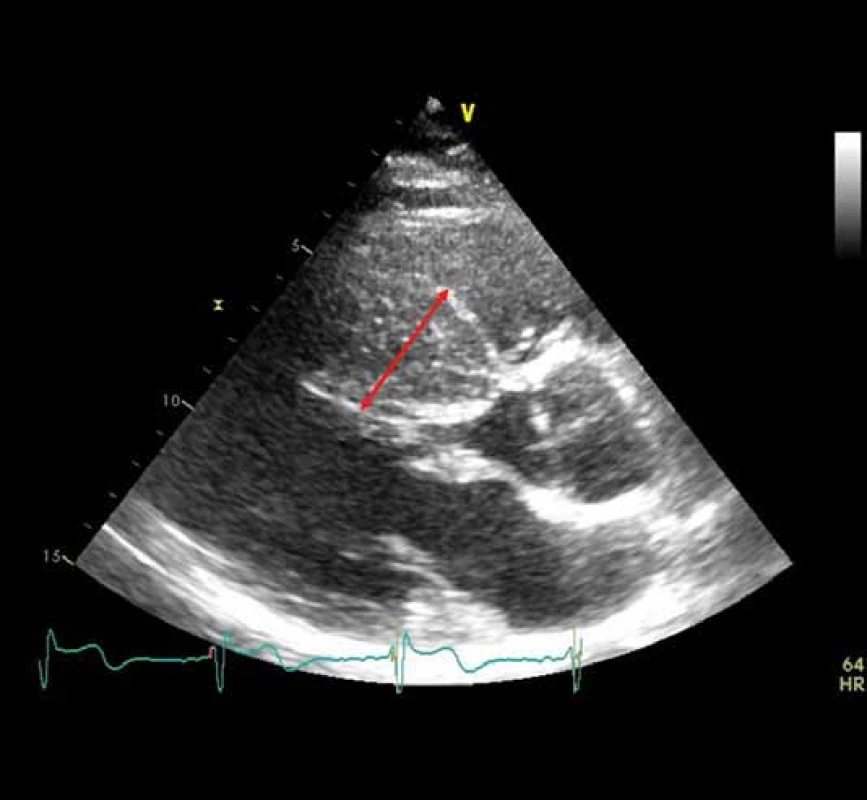
Image 2. Dilatační kardiomyopatie při zobrazení na magnetické rezonanci s dilatací levé komory srdeční s end-diastolickým rozměrem 68 mm. Zdroj: Archiv Kliniky zobrazovacích metod FN u sv. Anny v Brně. 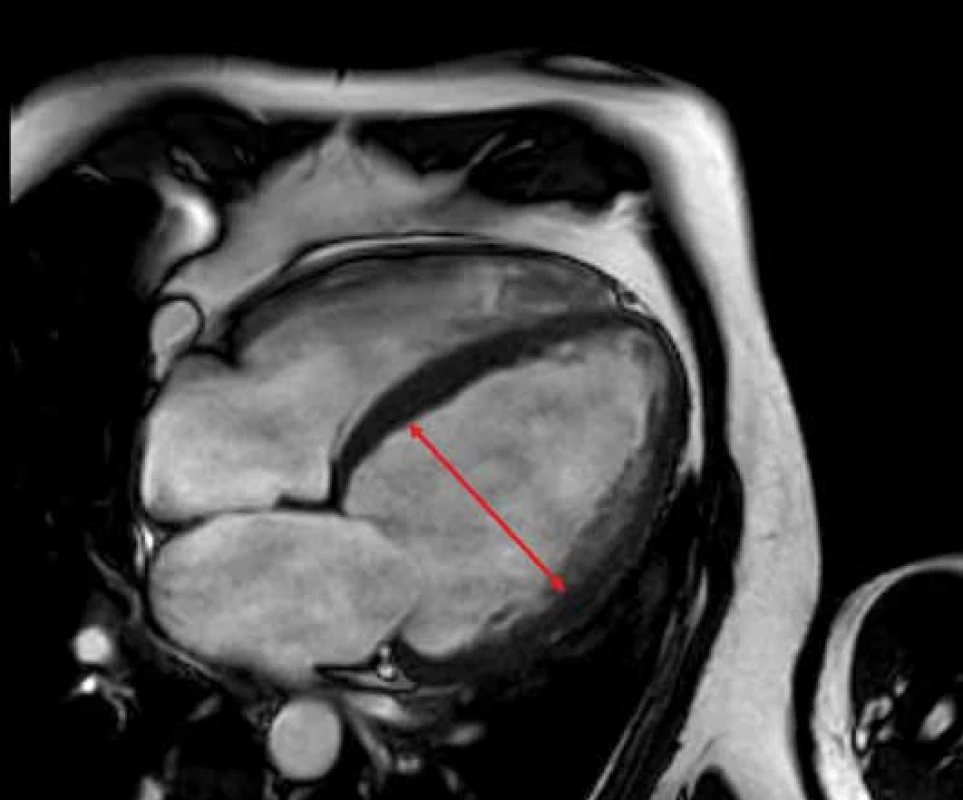
Klinický průběh je velmi variabilní od asymptomatického přes výrazně limitující SS, přítomnost arytmických příznaků, jako jsou palpitace či závratě nebo synkopy, až k výskytu náhlé srdeční smrti. HKMP se obvykle fenotypově manifestuje v časné dospělosti a vzhledem k mírným příznakům si většina žen přeje graviditu. Ta je obvykle dobře tolerována, nicméně podle recentních dat je přesto udávána mateřská mortalita 0,5 % a komplikace či zhoršení příznaků onemocnění se objevuje až u 29 % těhotných. Mortalita plodu je obdobná jako u zdravé populace, nicméně riziko předčasného porodu je vyšší (26 %). Rizikovým momentem jsou těžké symptomy, významná obstrukce ve výtokovém traktu levé komory (left ventricular outflow tract – LVOT), porucha systolické funkce LK, přítomnost těžších stupňů diastolické dysfunkce a arytmií [11]. Většina těhotných žen s HKMP se nachází ve mWHO třídě II– III, a tak by měly být echokardiograficky monitorovány po 1– 3 měsících, v případě nárůstu gradientu v LVOT spíše častěji [12]. Terapie se opírá o podávání betablokátorů, které by mělo pokračovat i v průběhu gravidity, v případě jejich intolerance lze zvážit verapamil. Pokud se objeví fibrilace síní, která často HKMP doprovází, je nutná antikoagulační léčba, provedení elektrické kardioverze je možné. V případě závažných komorových dysrytmií, zejména při naplnění dalších rizikových parametrů, je třeba zvážit implantaci kardioverter-defibrilátoru (ICD) [13]. Tu je jistě lépe realizovat prekoncepčně, nicméně v případě nutnosti je možná implantace i v průběhu gravidity – samozřejmě se snahou o minimalizaci expozice plodu RTG záření. Amiodaron je kontraindikován, sotalol je možné podávat i v průběhu těhotenství.
Porod u žen s HMKP obvykle doporučujeme spontánní cestou, opatrnosti je třeba u žen s vysokým gradientem v LVOT, kdy anestezie kvůli vazodilatačnímu efektu může tento gradient dále navýšit [4,5].
Dilatační kardiomyopatie
DKMP je onemocnění s udávanou prevalencí 1 : 2 500, jež je charakterizováno dilatací a dysfunkcí LK (obr. 1) [6]. Asi třetina případů je familiárních, ostatní mohou mít celou řadu příčin (mj. infekční/ postinfekční, toxické, posttachykardické). Těhotná může mít již prekoncepčně známou DKMP, v jiných případech ale může dojít k manifestaci symptomů u předtím asymptomatické dysfunkce LK až v průběhu gravidity a poté je odlišení od peripartální KMP (PPKMP) velmi obtížné. Bývá udáváno, že k manifestaci preexistující DKMP dochází již ve druhém trimestru, kdy je nejvyšší hemodynamická zátěž, zatímco PPKMP se manifestuje obvykle až v závěru gravidity či ještě typičtěji krátce postpartálně [14].
Gravidita u DKMP je spojena se zvýšeným rizikem KV komplikací. Bylo popsáno, že kardiální komplikace se vyskytly až u 39 % z nich [7]. Dále bylo zjištěno, že těhotenství bývá spojeno s progresí onemocnění, předčasným porodem a nízkou porodní váhou novorozenců. Příznivou prognózu má těhotenství tehdy, pokud je EF LK nad 40– 45 %, není přítomná významná funkční limitace (žena je před těhotenstvím ve funkční třídě NYHA I– II) a v předchorobí se nevyskytly žádné komplikace spojené s DKMP. Naopak při EF LK < 30 % a funkční třídě NYHA III– IV je riziko komplikací vysoké a gravidita není doporučována [4,5,8].
Před plánovanou graviditou je nutné vysadit léky, jejichž podávání může být pro plod nebezpečné – to se v první řadě týká inhibitorů angiotenzin konvertujícího enzymu (ACEI), sartanů či ARNI (inhibitor neprilysinu a blokátor angiotenzinových receptorů), a také verospironu a ivabradinu. Pokud po této redukci terapie dojde ke zhoršení funkce LK, není možné těhotenství doporučit. Terapii betablokátory je vhodné ponechat (preferenčně beta-1 selektivní), v těhotenství lze použít také digoxin a diuretika, případně nitráty či přímá vazodilatancia. Kojení u stabilních nemocných lze doporučit, je ovšem třeba zkontrolovat, zda jsou podávané léky bezpečné z hlediska možného ovlivnění plodu. V kritických případech je nutné kojení přerušit a umožnit agresivní farmakologickou a dle potřeby i nefarmakologickou léčbu. V případě akutního těžkého SS v průběhu gravidity je třeba referovat těhotnou do nemocnice s možností zavedení mechanické srdeční podpory a těhotenství ukončit bez ohledu na stáří plodu.
U hemodynamicky stabilních pacientek je možné doporučit vaginální porod, pokud není z gynekologické indikace rozhodnuto jinak [4,15].
Restriktivní kardiomyopatie
RKMP se vyznačuje přítomností poruchy plnění LK při normální či téměř normální systolické funkci LK. Vyskytuje se vzácně a je spojena se špatnou prognózou [6]. Hemodynamické změny, k nimž dochází v průběhu gravidity, mohou průběh onemocnění nepříznivě ovlivnit. Dat o průběhu těhotenství u žen s RKMP je velmi málo a většina autorů se shoduje na tom, že těhotenství u žen s touto KMP není doporučováno [4,5].
Arytmogenní kardiomyopatie
AKMP je geneticky podmíněné onemocnění s odhadovanou prevalencí 1 : 5 000 v neselektované populaci. Jejím typickým rysem je postupně progredující náhrada svaloviny pravé komory, LK nebo obou komor fibrózní a tukovou tkání. Postihuje častěji muže, u kterých je rovněž výraznější fenotypová exprese [6]. Jejím základním projevem je výskyt arytmií, druhou nejčastější manifestací je SS, zejména při biventrikulárním postižení [16]. Farmakologická léčba je založena na betablokátorech či sotalolu (oba mohou být podávány i v graviditě), popřípadě amiodaronu (v graviditě kontraindikován). U arytmicky rizikových nemocných je prognostickým výkonem implantace ICD. Dostupná data týkající se průběhu těhotenství u žen s touto diagnózou naznačují, že gravidita je obvykle dobře tolerována a riziko vážných arytmií či výbojů ICD se proti období před těhotenstvím významně nezvyšuje. Na způsob vedení porodu existují kontroverzní názory, v přítomnosti arytmických příhod či známek SS bývá preferován císařský řez [4,6,17].
Ischemická choroba srdeční
Výskyt akutních koronárních příhod v průběhu těhotenství je relativně nízký (udává se v rozmezí 1,7– 6,2/ 100 000 porodů), přesto je odhadováno, že více než 20 % mateřských úmrtí je způsobeno ICHS. To může souviset mimo jiné s narůstajícím věkem matek, ačkoli v těhotenství převládají ne-aterosklerotické příčiny infarktů myokardu (IM), jako je spontánní koronární disekce či tromboembolická okluze koronární tepny [18,19].
U žen po předchozím IM by mělo být těhotenství odloženo o 12 měsíců a povoleno v případě, že není přítomna reziduální ischemie a těžká deprese systolické funkce LK. Betablokátory a nízké dávky kyseliny acetylsalicylové mohou být podávány i v průběhu gravidity, ACEI nikoli. Při vzniku IM v průběhu těhotenství je preferována perkutánní koronární intervence před trombolytickou léčbou, podávání P2Y12 inhibitorů není doporučováno, snad s výjimkou klopidogrelu na nezbytně dlouhou (tedy co nejkratší) dobu. Tomu by měla být přizpůsobena i strategie intervenční léčby. Porod je optimální odložit alespoň o 14 dní po akutní příhodě, preferována je vaginální cesta [4].
Závěr
Přítomnost KMP a SS nepředstavuje absolutní kontraindikaci těhotenství. Neplatí to ovšem pro všechny typy KMP a pochopitelně také ne pro všechna stadia SS. Za jednoznačnou kontraindikaci je pokládána přítomnost RKMP, u ostatních případů se orientujeme podle míry systolické dysfunkce LK (kontraindikace při EF LK < 30 %) a tíže symptomů (kontraindikace u nemocných ve funkčních třídách NYHA III a IV). V každém případě je nezbytné pečlivé kardiologické zhodnocení onemocnění před graviditou, monitoring symptomů a echokardiografického nálezu v průběhu těhotenství, konzultace před porodem při rozhodování o způsobu jeho vedení a také dostupnost kardiologa v časném postpartálním období. Nejzávažnější případy by měly být v průběhu gravidity pravidelně konzultovány ve specializovaných centrech pro léčbu SS s dostupností nefarmakologických terapeutických přístupů. Součástí takového centra by měl být multioborový tým, jehož členem musí být i kardiolog. Takto koncipovaná mezioborová spolupráce by nepochybně vedla k optimalizaci péče o ženy se SS a KMP v průběhu těhotenství i porodu.
Doručeno do redakce: 25. 10. 2018
Přijato po recenzi: 1. 11. 2018
doc. MU Dr. Jan Krejčí, Ph.D.
Sources
1. Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2016; 18(8): 891– 975. doi: 10.1002/ ejhf.592.
2. Roos-Hesselink JW, Duvekot JJ, Thorne SA. Pregnancy in high risk cardiac conditions. Heart 2009; 95(8): 680– 686. doi: 10.1136/ hrt.2008.148932.
3. Ng AT, Duan L, Win T et al. Maternal and fetal outcomes in pregnant women with heart failure. Heart 2018; pii: heartjnl-2018-313156. doi: 10.1136/ heartjnl-2018-313156.
4. Regitz-Zagrosek V, Roos-Hesselink JW, Bauersachs J et al. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy. Eur Heart J 2018; 39(34): 3165– 3241. doi: 10.1093/ eurheartj/ ehy340.
5. Golia E, Gravino R, Rea A et al. Management of pregnancy in cardiomyopathies and heart failure. Future Cardiol 2017; 13(1): 81– 96. doi: 10.2217/ fca-2015-0004.
6. Elliott P, Andersson B, Arbustini E et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on myocardial and pericardial diseases. Eur Heart J 2008; 29(2): 270– 276. doi: 10.1093/ eurheartj/ ehm342.
7. Krejčí J. Editorial. Proč bychom měli věnovat pozornost problematice kardiovaskulárních onemocnění v těhotenství? Kardiol Rev Int Med 2018; 20(4): 249– 250.
8. Grewal J, Siu SC, Ross H et al. Pregnancy outcomes in women with dilated cardiomyopathy. J Am Coll Cardiol 2009; 55(1): 45– 52. doi: 10.1016/ j.jacc.2009.08.036.
9. Stergiopoulos K, Shiang E, Bench T. Pregnancy in patients with pre-existing cardiomyopathies. J Am Coll Cardiol 2011; 58(4): 337– 350. doi: 10.1016/ j.jacc.2011.04.014.
10. van Tintelen JP, Pieper PG, Van Spaendonck-Zwarts KY et al. Pregnancy, cardiomyopathies, and genetics. Cardiovasc Res 2014; 101(4): 571– 578. doi: 10.1093/ cvr/ cvu014.
11. Schinkel AF. Pregnancy in women with hypertrophic cardiomyopathy. Cardiol Rev 2014; 22(5): 217– 222. doi: 10.1097/ CRD.0000000000000010.
12. Shin J, Kim M, Lee J et al. Pregnancy in hypertrophic cardiomyopathy with severe left ventricular outflow tract obstruction. J Cardiovasc Ultrasound 2016; 24(2): 158– 162. doi: 10.4250/ jcu.2016.24.2.158.
13. Elliott PM, Anastasakis A, Borger MA et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the task force for the diagnosis and management of hypertrophic cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35(39): 2733– 2779. doi: 10.1093/ eurheartj/ ehu284.
14. Sliwa K, Hilfker-Kleiner D, Petrie MC et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy. Eur J Heart Fail 2010; 12(8): 767– 778. doi: 10.1093/ eurjhf/ hfq120.
15. Bozkurt B, Colvin M, Cook J et al. Current diagnostic and treatment strategies for specific dilated cardiomyopathies: a scientific statement from the American Heart Association. Circulation 2016; 134(23): e579– e646. doi: 10.1161/ CIR.0000000000000455.
16. Calkins H, Corrado D, Marcus F. Risk stratification in arrhythmogenic right ventricular cardiomyopathy. Circulation 2017; 136(21): 2068– 2082. doi: 10.1161/ CIRCULATIONAHA.117.030792.
17. Iriyama T, Kamei Y, Kozuma S et al. Management of patient with arrhythmogenic right ventricular cardiomyopathy during pregnancy. J Obstet Gynaecol Res 2013; 39(1): 390– 394. doi: 10.1111/ j.1447-0756.2012.01954.x.
18. Bush N, Nelson-Piercy C, Spark P et al. Myocardial infarction in pregnancy and postpartum in the UK. Eur J Prev Cardiol 2013; 20(1): 12– 20. doi: 10.1177/ 1741826711432117.
19. Elkayam U, Jalnapurkar S, Barakkat MN et al. Pregnancy-associated acute myocardial infarction: A review of contemporary experience in 150 cases between 2006 and 2011. Circulation 2014; 129(16): 1695– 1702. doi: 10.1161/ CIRCU-LATIONAHA.113.002054.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2018 Issue 4-
All articles in this issue
- Hypertenze v těhotenství
- Srdeční selhání, kardiomyopatie a gravidita
-
Peripartální kardiomyopatie –
diagnostika a léčba - Těhotenství po transplantaci srdce
- Těhotenství a chlopenní vady
- Problematika těhotenství u žen s vrozenou srdeční vadou
- Poruchy srdečního rytmu v graviditě
- Plicní arteriální hypertenze a těhotenství
- Diagnóza a manažment angioedému
- Hypertenze není jen nemoc s nutností léků
- Index kotník-paže u diabetiků – jaká je nejvhodnější metoda měření?
- Arteriální hypertenze a syndrom spánkové apnoe
- Deprese u seniorů s chronickým selháním srdce
- Vliv terapie perindoprilem na kardiovaskulární přínosy v České republice
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hypertenze v těhotenství
- Poruchy srdečního rytmu v graviditě
- Diagnóza a manažment angioedému
-
Peripartální kardiomyopatie –
diagnostika a léčba
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

