-
Medical journals
- Career
Hypertenze a srdeční selhání
Authors: M. Bláha
Authors‘ workplace: II. interní klinika LF MU a FN U sv. Anny v Brně
Published in: Kardiol Rev Int Med 2017, 19(2): 92-97
Overview
Hypertenze zahrnuje široké spektrum změn v geometrii a remodelaci levé komory (LK), vč. poruch srdeční funkce – od asymptomatické hypertrofie LK (ať již koncentrické, či excentrické) až po srdeční selhání (SS – ať již SS se zachovalou ejekční frakcí – HFpEF, či SS se sníženou ejekční frakcí – HFrEF). Zaznamenáváme velkou interindividuální variabilitu progrese hypertenze do hypertrofie LK jak ve změnách masy LK, tak v její geometrii (komorová dilatace nebo ztluštění její stěny). Na převažujícím typu remodelace a velikosti LK se zřejmě podílí variabilita samotného tlakového přetížení, tedy variabilita výšky tlakové zátěže, její trvání a rychlost vzestupu tlaku během vývoje hypertenzní nemoci, antihypertenzní léčba, neurohumorální aktivace a ještě ne zcela jasné genetické vlivy. Přeměna z koncentrické hypertrofie do HFrEF s dilatací LK bez předchozího infarktu myokardu není obvyklou patologickou změnou. Někteří hypertonici však mohou dospět do HFrEF i bez prodělaného infarktu myokardu či bez předchozí koncentrické hypertrofie. Dosud nebylo zcela objasněno, proč někteří hypertonici reagují dilatací, zatímco jiní koncentrickou hypertrofií LK. Stejně tak mechanizmus přeměny z asymptomatické koncentrické hypertrofie do HFpEF není zcela vysvětlen. Zdá se, že jedním z hlavních faktorů jsou progresivní patologické změny v extracelulární matrix a vzestup levokomorového plnicího tlaku. Léčba hypertenze u pacientů se SS musí brát v úvahu jeho typ. Obecně platí, že pacienti s hypertenzí a HFrEF by měli být pokud možno léčeni ACE inhibitory (alternativně antagonisty receptoru pro angiotenzin II) nebo antagonisty receptoru angiotenzinu a neprilysinu, betablokátory a antagonisty mineralokortikoidních receptorů. Diuretika se používají k léčbě symptomatické hypervolemie (plicního a/ nebo periferního edému) nebo k dalšímu snížení TK, pokud je to nutné u hypervolemických pacientů. Optimální léčba hypertenze u pacientů s HFpEF není zcela jasná. Většina antihypertenziv však může snížit hmotnost LK, zabránit či podstatně redukovat hypertrofii LK, což je velmi podstatné pro snížení rizika SS.
Klíčová slova:
hypertenze – hypertrofie levé komory – srdeční selhání se zachovalou ejekční frakcí – srdeční selhání se sníženou ejekční frakcíÚvod
Diagnostika a zejména léčba vysokého krevního tlaku (TK) je nesporně jedním z největších úspěchů moderní medicíny 20. a 21. století. Komplexní přístup k řešení tohoto onemocnění nepochybně zachránil miliony lidí od předčasného úmrtí na kardiovaskulární (KV) komplikace. Přesto všechno hypertenze zůstává i v současné době jedním z největších zdravotnických problémů, neboť je stále spojena se značnou morbiditou a mortalitou.
Déletrvající hypertenze je jednou z nejvážnějších příčin rozvoje pozdějšího srdečního selhání (SS). Prevalence hypertenze u osob s chronickým srdečním selháním (CHSS) je 60 – 70 %. Uvádí se, že právě dlouhodobé působení vysokého TK zvyšuje pravděpodobnost SS dvojnásobně u mužů a dokonce trojnásobně u žen [1]. Hypertenze zvyšuje podstatně práci srdce s následným rozvojem srdeční hypertrofie a pozdějšího diastolického SS (SS se zachovalou ejekční frakcí – heart failure with preserved ejection fraction – HFpEF). Je rovněž jedním z hlavních rizikových faktorů aterosklerózy. Přispívá ke vzniku koronárního onemocnění, které svými projevy – infarkt myokardu (IM) – velmi často vyústí do systolické dysfunkce levé komory (LK), tedy později do symptomatického systolického SS (SS se sníženou ejekční frakcí – heart failure with reduced ejection fraction – HFrEF). Je nutno se zmínit i o dalších klinických důsledcích hypertenze, jako jsou např. arytmie. Zvýšený arytmogenní potenciál podmiňuje jak srdeční hypertrofie, tak systolická dysfunkce [2,3]. Riziko vzniku SS představuje zvýšený systolický, diastolický i pulzní tlak, trvání hypertenze a vzrůstající věk. Dokonce se ukázalo, že riziko SS existuje již i pro lineárně se zvyšující hodnoty ještě v rozmezí normálního TK [1]. Důsledná léčba vysokého TK snižuje rozvoj SS až o 50 %. Léčba hypertenze u již manifestního SS jeho projevy snižuje a zlepšuje srdeční dysfunkci [2,4,5].
Progresivní vývoj hypertenzní nemoci a patofyziologie vztahu TK a SS
TK jednoduše odráží vztah mezi srdeční funkcí a cévní rezistencí. Střední tlak je určován zejména velikostí srdečního výdeje (CO), systémovou cévní rezistencí (SVR) a centrálním žilním tlakem (CŽT). Situaci ukazuje jednoduchý matematický vztah: střední TK = (CO × SVR) + CŽT. U jedinců s normální srdeční funkcí se TK zvyšuje především s rostoucí vaskulární rezistencí. Poruší-li se funkce LK, dostává se vztah mezi cévní rezistencí a srdečním výdejem poněkud do jiné roviny. Snížení TK je pak spíše obrazem sníženého srdečního výdeje a je většinou nepříznivým prognostickým ukazatelem [1]. V klinické praxi pak musíme často podstatně redukovat antihypertenzní léčbu u dlouhodobých hypertoniků, u nichž se s rozvojem SS objeví hypotenze [1,2,5].
Výsledkem působení zvýšeného či vysokého TK jsou strukturální a funkční změny srdečně cévního systému, které označujeme jako remodelace. Na klinické úrovni je charakterizována změnami objemu a tvaru srdečních dutin, tloušťky stěn a strukturálními změnami myokardu až na buněčné a molekulární úrovni, jež jsou mimo jiné ovlivněny i genetickými faktory, v klinice obtížně pozorovatelné či měřitelné [6].
Klasické paradigma hypertenzní choroby je narůstající tloušťka stěny LK, která je kompenzačním mechanizmem minimalizujícím její napětí. Obr. 1 ukazuje možné cesty vývoje hypertenze k srdečnímu selhání [2].
Image 1. Možné cesty vývoje hypertenze k srdečnímu selhání. 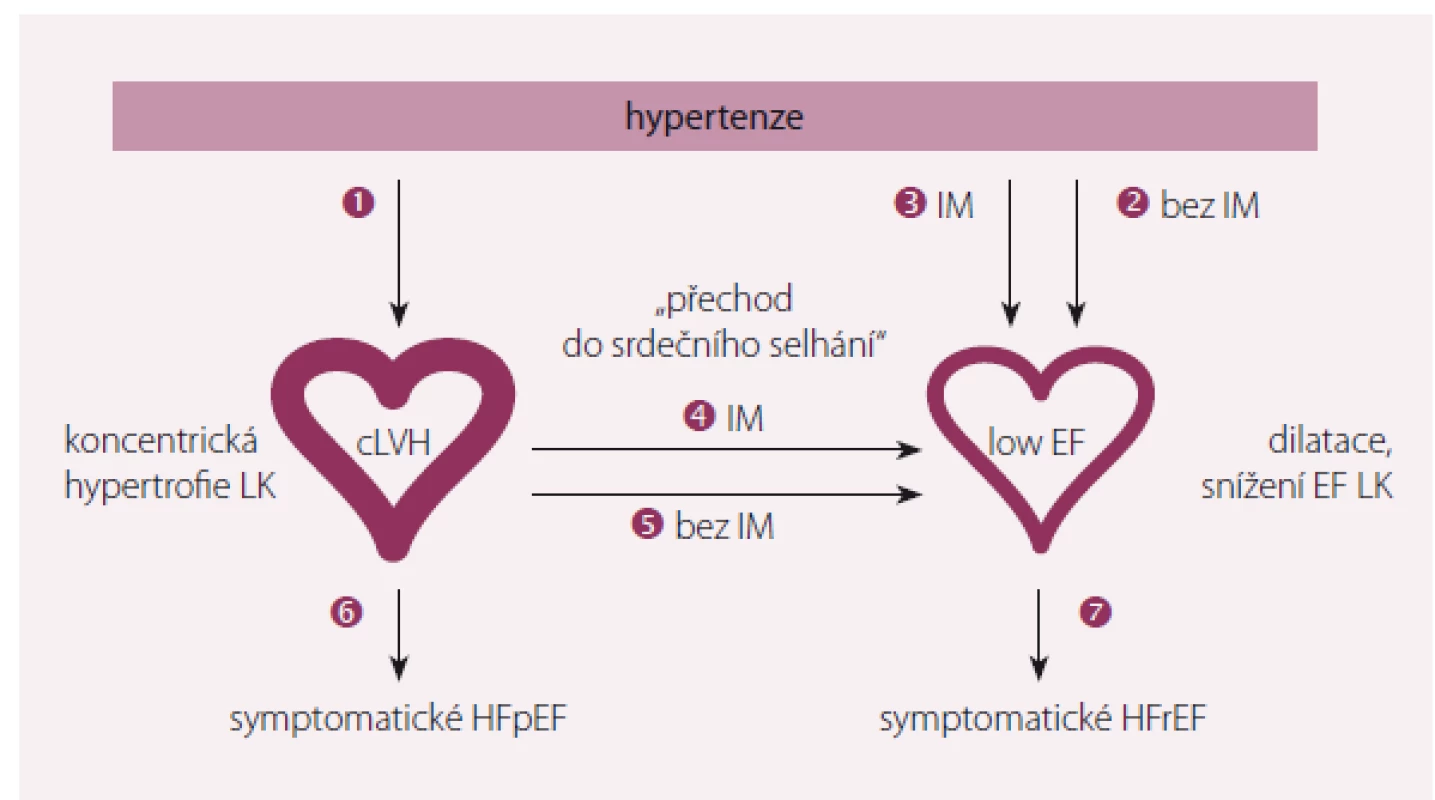
Upraveno dle [2]. Existuje sedm patologických cest progrese hypertenze do SS [2]. První obvyklou cestou je vznik koncentrické hypertrofie LK. Další možnou cestou je přímé vyústění hypertenze do dilatace LK s postupně se snižující ejekční frakcí (zvýšený levokomorový objem se snížením EF) u nemocných s předchozím IM nebo bez předchozího IM. Postupná přeměna koncentrické hypertrofie do dilatace LK se snížením EF se rovněž obvykle děje po předchozím IM. Nicméně systolická dysfunkce LK se vyvine i u 13 – 15 % hypertoniků bez ischemické choroby srdeční (ICHS). U pacientů s koncentrickou hypertrofií LK, kteří neprodělali koronární příhodu, však tato přeměna není příliš obvyklá. U nemocných s koncentrickou hypertrofií LK se obvykle vyvine symptomatické HFpEF, zatímco u hypertoniků s již dilatovanou LK symptomatické HFrEF [2].
Od hypertenze k hypertrofii LK
Hypertrofie LK následkem déletrvajícího působení vysokého TK je důležitým postulátem vzniku pozdějšího SS. Je většinou definována jako zvýšení masy LK. Patologické změny zahrnují růst velikosti kardiomyocytů a alteraci extracelulární matrix [2]. Aktivují se fibrotické procesy, především defektní produkce kolagenu a zvýšená agregace amyloidu. Mírné zvýšení kolagenní frakce podmiňuje jemné snížení myokardiální masy. Samotné kardiomyocyty však zvyšují svůj objem a jsou nuceny vynaložit více energie pro požadovanou deformaci myokardu. Podle několika posledních prací je fibróza myokardu nezávislým prognostickým faktorem KV mortality a morbidity. „Fyziologicky“ se zvyšuje obsah fibrotické tkáně během stárnutí. Další urychlení tohoto procesu podmiňuje kromě hypertenze i diabetes mellitus, ICHS, kardiomyopatie či chlopenní vady. Fibróza myokardu snižuje poddajnost srdečního svalu, což později může vyústit v HFpEF. Zvyšující se podíl fibrózy však také zhoršuje kontrakční schopnosti myokardu a tímto mechanizmem může přispět i k rozvoji systolické dysfunkce. Patologické změny v kardiomyocytech a intersticiu jsou rovněž doprovázeny i abnormalitami intramyokardiální vaskulatury zahrnující hypertrofii médie a perivaskulární fibrózu [2].
V rozvoji a velikosti srdeční hypertrofie existuje interindividuální variabilita. Například hypertonici černoši ve srovnání s bělochy vykazují větší masu LK a trpí rovněž závažnější diastolickou dysfunkcí. Přitom známé rizikové faktory vč. výšky systolického TK vysvětlují variabilitu masy LK jen z 50 – 68 % (echokardiografické studie a měření pomocí magnetické rezonance). Předpokládá se i působení ostatních faktorů, zejména vlivu dědičnosti [6].
Masa LK narůstá jak při ztluštění stěny, tak při dilataci LK. Ztluštění stěny se obvykle objevuje jako následek tlakového přetížení, komorová dilatace spíše při přetížení objemovém. Změny v srdeční geometrii lze charakterizovat podle změn relativní tloušťky stěny LK, což je poměr tloušťky stěny k diastolickému rozměru LK měřenému echokardiograficky. Nárůst relativní tloušťky stěny LK charakterizuje koncentrickou hypertrofii. Pokud relativní tloušťka zvýšena není, jde o hypertrofii excentrickou. Termín koncentrická remodelace pak označuje zvýšenou hodnotu relativní tloušťky stěny při normální levokomorové mase [2].
Zatím není zcela jasné, proč se u některých hypertenzních pacientů vyvine koncentrická a u jiných excentrická hypertrofie. Důležitou roli hraje jistě různá závažnost a vzájemný poměr působení objemového a tlakového přetížení a kontraktilní dysfunkce. Nepochybně bude rovněž významná i variabilita samotného tlakového přetížení, tedy variabilita výšky tlakové zátěže, její trvání a rychlost vzestupu TK během vývoje hypertenzní nemoci. Jedinci s koncentrickou hypertrofií mají ve srovnání s hypertoniky s excentrickou hypertrofií vyšší systolický TK a celkovou periferní rezistenci. Jejich ambulatorní TK byl rovněž vyšší. Z demografických údajů vyplývá, že černoši ve srovnání s bělochy mají vyšší dispozice k vývoji koncentrické hypertrofie. U žen s izolovanou systolickou hypertenzí byla častější koncentrická, zatímco u mužů této skupiny naopak excentrická hypertrofie. Echokardiografické studie i magnetická rezonance potvrzují, že stoupající věk je rovněž spojován spíše s vývojem koncentrické hypertrofie. Zdá se, že i komorbidity obvyklé u hypertoniků mohou mít určitý vliv na typ remodelace LK. Ve studii „Losartan intervention for end point reduction in hypertension study“ u hypertoniků s ICHS převažovala excentrická hypertrofie. Diabetes mellitus byl naopak více spojován s koncentrickou hypertrofií, zatímco obézní hypertonici vlivem objemového přetížení měli hypertrofii spíše excentrickou. Jiné studie to naopak nepotvrzují [2,6].
Od hypertrofie LK k SS
Z výše uvedených skutečností a výsledků experimentálních i klinických studií plyne, že hypertonici s různým stupněm a typem srdeční remodelace a navíc s různými komorbiditami mohou být postiženi jak HFrEF, tak HFpEF. Oba typy mají shodné symptomy (únava, dušnost, snížená tolerance zátěže) a podobné klinické známky (zvýšená náplň krčních žil, otoky dolních končetin, plicní městnání, svalový rytmus). Dále se oba typy vyznačují sníženou spotřebou kyslíku při zátěži a neurohumorální aktivací. Hodnoty natriuretických peptidů (NP) jsou u nemocných s HFpEF ve srovnání s pacienty s HFrEF méně zvýšené. Diastolické napětí stěny LK, které je hlavním podnětem pro jejich syntézu, je u jedinců s HFpEF při menším poloměru a více zesílené stěně LK nepoměrně nižší než u pacientů s dilatací LK a známkami systolické dysfunkce [7]. Dilataci srdečního stínu na RTG hrudníku můžeme zaznamenat také u obou typů SS. U HFpEF je však podmíněn dilatací srdečních síní (projev zvýšeného plnicího tlaku LK). Mezi oběma typy jsou rovněž rozdíly jak v rizikových faktorech, tak v epidemiologii. Nemocní s HFpEF jsou ve srovnání s pacienty s HFrEF zhruba o 10 – 15 let starší, jsou to častěji ženy a trpí častěji hypertenzí (60 – 80 %) nebo fibrilací síní (20 – 40 %). Nemocní s HFpEF mají méně často v anamnéze IM a symptomatickou formu ICHS, i když se u nich vyskytuje poměrně často němá koronární ateroskleróza, která vede v dalším průběhu ke snížení systolické funkce LK a jasně zhoršuje prognózu těchto jedinců. U ambulantně sledovaných je mortalita pacientů s HFpEF ve srovnání s HFrEF nižší. Pokud však již tito jedinci byli hospitalizováni pro symptomatické SS, jejich prognóza se významně zhorší a je velmi podobná nemocným s HFrEF.
Byť se nemocní s oběma typy SS v mnoha ohledech liší, je nutno připomenout fakt, že většina nemocných s HFrEF má také diastolickou dysfunkci a naopak u většiny pacientů s HFpEF lze prokázat abnormality systolické funkce. Mezi HFrEF a HFpEF však existuje jakási šedá zóna. Jedná se o nemocné mající hodnotu EF LK v rozmezí 0,40 – 0,49. Pro ně se začal používat termín SS ve středním pásmu (mid-range) – HFmrEF. Zdá se, že tito pacienti mají odlišný fenotyp a lepší léčebný účinek spironolaktonu ve srovnání s nemocnými s EF LK nad 0,50. Usuzuje se, že tito jedinci tvoří zhruba 10 – 20 % všech pacientů se SS. Mají pravděpodobně primárně lehkou systolickou dysfunkci, ale s rysy dysfunkce diastolické [5].
Narušené diastolické parametry LK jistě přispívají ke vzniku SS. Je nutno si však uvědomit, že hlavně starší hypertonici, kteří netrpí SS, mají již často abnormální diastolické vlastnosti LK, zejména zpomalenou časnou diastolickou relaxaci při zvýšené pasivní tuhosti LK, event. zvýšený TK v levé síni (tj. známky diastolické dysfunkce). Tito nemocní vykazují normální nebo jen lehce sníženou hodnotu EF, což nevylučuje i přítomnost subklinické systolické dysfunkce, která se projeví sníženou kontraktilní rezervou při zátěži [4]. V této situaci je významným negativním faktorem zvýšená tuhost velkých tepen, která je podmíněna ztrátou elastické komponenty stěny velkých cév při hypertenzi (rovněž při stárnutí, cukrovce, ledvinném onemocnění). Důsledkem je pak vzrůst pulzatilního zatížení srdce s následnou koncentrickou remodelací LK, fibrózou myokardu, a tím narušení diastolické funkce. Tato patofyziologická situace při zachovalé kontrakční schopnosti LK zvyšuje závislost výkonu LK na aktuální náplni a při jejím kolísání podněcuje zvýšenou labilitu systémového arteriálního tlaku. Projevy selhávání LK tak mohou výrazně kolísat. Vzestup TK při vrůstající zátěži podmíní zvýšený přesun krve do nízkotlaké, nejvíce poddajné cévní oblasti, tj. plicního řečiště s následným vznikem plicního edému. Naopak při poklesu zátěže se neúměrně sníží cirkulující objem s následkem těžké hypotenze [4]. Rovněž diuretická léčba může podstatně snížit srdeční (minutový) výdej s následnou tkáňovou hypoperfuzí a např. rozvojem selhání ledvin prerenálního typu. Fyziologická reakce na zátěž je tedy těžce alterována komplexně. Jde o narušení chronotropních, vazodilatačních a komorových diastolických a systolických rezervních funkcí, v periferních svalech je pak rovněž porušena spotřeba kyslíku a jeho využití [7]. Ve srovnání se zdravými je vzestup enddiastolického, a tedy i tepového objemu u nemocných s HFpEF při snížené relaxaci LK omezen. Srdeční výdej u nich pak více závisí na urychlení tepové frekvence. Právě chronotropní intolerance při zátěži může být u nemocných s HFpEF příčinou klinických projevů SS [4,7].
Vyšetření tkání získaných od nemocných s HFpEF ukazují, že možnou příčinou hypertrofické remodelace srdce a cév by mohla být nízká aktivita intracelulárních signálních drah oxidu dusnatého (NO) a NP. Tyto dráhy ovlivňují enzym guanylátcyklázu umožňující vznik cyklického guanozin-monofosfátu (cGMP), který aktivuje proteinkinázu G (PKG). Pacienti s HFpEF prokazují sníženou aktivitu PKG v myokardu, zřejmě v důsledku relativně nízkých hladin NP. Dalším možným faktorem je i nedostatek NO způsobený pozánětlivým stavem. K diastolické dysfunkci některých starších pacientů s HFpEF může přispět rovněž depozice amyloidogenního proteinu transtyretinu (TTR) v myokardu [3]. Předpokládá se, že v progresi myokardiální fibrózy a zvyšující se tuhosti stěny LK u HFpEF se uplatňuje rovněž aktivace mineralokortikoidních receptorů. U nemocných s hypertrofií LK a pozdějším symptomatickým SS byly zjištěny i vyšší hladiny tkáňového inhibitoru metaloproteinázy-1, které jsou spojeny se vzrůstající akumulací kolagenu. Ukázalo se, že rovněž sérové hladiny metaloproteinázy-2 a -9 a dále aminopeptidu prokolagenu typu 3 jsou nezávislými prediktory identifikujícími nemocné s HFpEF. Tato zjištění jasně prokazují, že progresivní změny v extracelulární matrix jsou pravděpodobně odpovědné za vyústění levokomorové hypertrofie do HFpEF [2].
Při hypertenzi a pozdějším SS se nemění jen struktura a funkce LK, ale i ostatních srdečních oddílů. Pokud je plicní arteriální tlak normální a není přítomno postižení LK, pak se zdá, že pravá komora srdeční (PK) slouží jen jako rezervoár a „potrubí“ pro odkysličenou krev. Avšak v patologických podmínkách mohou být změny její struktury a funkce ve srovnání s LK důležitějším ukazatelem progrese SS a prognózy nemocného. Vysvětlení lze hledat ve skutečnosti, že ve vzniknuvší dysfunkci PK se celkově sumarizují změny levokomorové systolické i diastolické dysfunkce. Systolická dysfunkce PK je přítomna u 20 – 30 % nemocných s HFpEF a bývá často asociována s fibrilací síní [6].
Srdeční síně jsou rovněž podstatně ovlivňovány změnami hemodynamické situace při hypertenzi a SS. U zdravých fungují jako nízkotlaký rezervoár krve během systoly komor. Síňová dilatace je obvykle známkou vzrůstajícího komorového diastolického tlaku a je doprovázena zvýšenou plazmatickou koncentrací NP, jež je ukazatelem SS. Remodelace síní se jeví jako důležitý podnět pro vznik síňové fibrilace. U SS se vyskytuje velmi často a obvykle zhoršuje hemodynamickou situaci nemocného. Fibrilace síní často předchází SS. Síňová dilatace s rostoucím objemem zabraňuje po určitou dobu vzestupu síňového tlaku během systoly komor. Tato důležitá funkce může být limitována síňovou hypertrofií a fibrózou, což snižuje compliance síňového myokardu. Kontraktilní funkce síní – ejekční frakce klesá jak při diastolické dysfunkci samotného síňového myokardu, tak při vzestupu enddiastolického tlaku v komoře. Dilatace levé síně u hypertoniků s HFpEF podobně jako zvýšení plicního arteriální tlaku (nad 35 mm Hg) koreluje s jejich zvýšeným enddiastolickým tlakem v LK [6,10].
Mnoho studií na zvířecích modelech i v klinice ukazuje, že koncentrická hypertrofie LK u hypertoniků může rovněž předcházet rozvoji HFrEF s dilatací LK (obr. 2). Progrese koncentrické hypertrofie do HFrEF byla také potvrzena u nemocných s aortální stenózou a hypertrofickou kardiomyopatií, u nichž běžně nacházíme supranormální kontrakční schopnost LK s vysokou hodnotou EF. Nicméně sofistikovaná měření a sledování vrcholové rychlosti zkrácení obvodového vlákna a napětí stěny LK potvrzují jemné abnormality systolické funkce u těchto nemocných navzdory normální či zvýšené hodnotě EF. Lze tedy vyvodit, že u nich proces postupného rozvoje HFrEF s dilatací LK zřejmě již začal probíhat [2].
Image 2. Variabilita změn geometrie levé komory při hypertenzi. 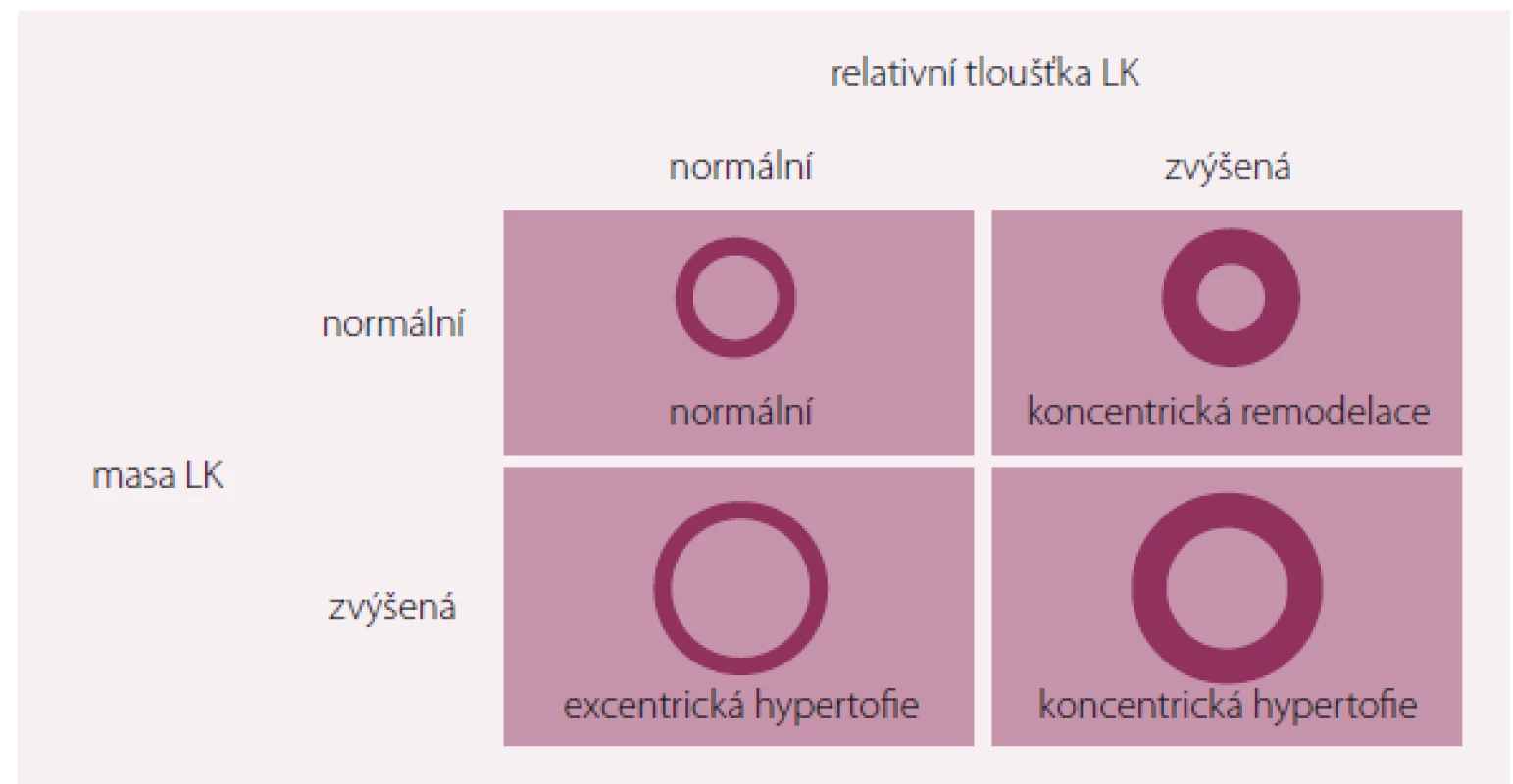
Upraveno dle [2]. Je celkem jasné, že progresi hypertenze do HFrEF urychlují a podmiňují event. klinické projevy ICHS, např. IM. Hypertrofie LK je rizikovým faktorem pro koronární postižení. Je provázena subklinickou koronární aterosklerózou, což dokumentují nálezy zvýšeného obsahu kalcia a probíhající zánětlivé procesy ve stěně koronárních tepen. První echokardiografické studie dokumentovaly, že excentrická hypertrofie (podobně jako koncentrická hypertrofie) je stejně běžným nálezem u hypertenzní populace. Není však zcela jasné, zda u těchto nemocných koncentrická hypertrofie nepředcházela [3].
Hypertenze a akutní SS
V poslední době se objevily některé studie, z jejichž výsledků vyplývá, že u nemocných s již rozvinutým akutním a snad i CHSS by vyšší TK mohl mít určitý ochranný vliv na mortalitu. Jde o tzv. reverzní epidemiologii. Výsledky studie EFICA prokazují, že anamnéza hypertenze, vysoký TK při příjmu do nemocnice a EKG známky hypertrofie LK snižují čtyřtýdenní mortalitu pacientů s kardiogenním šokem (nemocní bez akutního koronárního syndromu). Naopak studie SHOCK (nemocní s kardiogenním šokem při IM) ukazuje významně negativní roli hypertenze na zhoršení dlouhodobé mortality. Zdá se, že fenomén reverzní epidemiologie u akutního SS se opírá pouze o vstupní hodnoty TK při přijetí do nemocnice [1].
Registr AHEAD v ČR dokládá výskyt hypertenze u nemocných s akutním SS na 73,1 %, a je tak nejčastější komorbiditou u těchto nemocných. Hypertenzní krize jako vyvolávající příčina akutního SS se vyskytovala v 4,3 % [1]. Hodnota TK při přijetí u nemocných s akutním SS je významná pro krátkodobou hospitalizační mortalitu. Odráží tíži kardiogenního šoku, jež je v registru AHEAD nejsilnějším předpovědním faktorem mortality. Nízká hodnota TK při přijetí je nezávislým nepříznivým ukazatelem rovněž u nemocných bez kardiogenního šoku či plicního edému. Zdá se, že tento trend se uplatňuje i v dlouhodobé prognóze. Je nutno ho však hodnotit jako nepřímý klinický ukazatel nízkého srdečního výdeje a kontraktilní rezervy myokardu, což je prognosticky zcela jiná situace než dlouhodobá zátěž KV systému při hypertenzi. Výsledky AHEAD totiž ukazují, že nemocní s dlouhodobou hypertenzí mají střednědobé přežití spíše horší ve srovnání s nemocnými bez hypertenze [1].
Léčba hypertenze u SS
Léčba hypertenze u SS musí být komplexní a přitom diferencovaná. TK by měl být udržován dlouhodobě na požadovaných hodnotách tak, aby nekontrolovaná hypertenze nepřispěla ke vzniku symptomatického SS či již existující nepříznivý hemodynamický stav dále nezhoršovala. Antihypertenzní léčba by měla být sestavena rovněž podle převažujícího typu SS. Podle toho, zda se jedná o převážně systolickou dysfunkci u HFrEF, jejímž primárním postižením je narušená kontrakční schopnost komorového myokardu, nebo primární abnormalitou je diastolická dysfunkce u HFpEF či HFmrEF s limitovaným diastolickým plněním a zvýšenou tuhostí komorového myokardu. Právě převažující typ SS je pro výběr komplexní antihypertenzní léčby a zároveň terapie SS zřejmě jedním z nejdůležitějších faktorů [5,8].
Léčba hypertenze u HFrEF
Základem antihypertenzní léčby hypertoniků s HFrEF je snížení jak předtížení – preloadu (ústup kongesce) nasazením diuretik, tak afterloadu – dotížení (zvýšení srdečního výdeje) vazodilatačními farmaky, zejména antagonisty renin-angiotenzin-aldosteronové osy (RAAS). Podobně jako blokáda RAAS, tak i blokáda sympatoadrenálního systému betablokátory zlepšuje funkci LK a snižuje TK. Nedílnou součástí léčby HFrEF jsou i antagonisté mineralokortikoidních receptorů (MRA).
Diuretika užíváme především k léčbě symptomatického převodnění (plicní městnání, periferní otoky) a zároveň k dalšímu snížení TK u hypervolemických pacientů. Vhodné jsou kombinace kličkového diuretika s kalium šetřícími a thiazidovými diuretiky u hypertoniků se SS a otoky.
Inhibitory angiotenzin-konvertujícího receptoru (ACEI) jsou v léčbě SS i hypertenze používány více než 20 let. Kormě inhibice přeměny neaktivního angiotenzinu I na biologicky vysoce účinný angiotenzin II snižují degradaci bradykininu, který má příznivé vazodilatační a natriuretické účinky. ACEI zvyšují srdeční výdej, zmírňují symptomatické městnání a zpomalují progresi srdeční dysfukce. Prokazatelně snižují celkovou mortalitu i morbiditu nemocných ve všech stadiích SS.
Antagonisté receptoru AT1 angiotenzinu II (ARB) nejsou lepší v léčbě hypertenze ani ve snížení mortality nemocných ve srovnání s ACEI. Jejich využití zůstává alternativou pro nemocné, kteří netolerují léčbu ACEI (dráždivý kašel až u 10 % pacientů užívajících ACEI).
Betablokátory, zejména karvedilol, metoprolol, bisoprolol a nebivolol, snižují celkovou i KV mortalitu, snižují riziko náhlé smrti redukcí výskytu maligních arytmií a rovněž zpomalují progresi SS. Spolu s ACEI je v tomto směru jejich účinek aditivní. Zahajujeme léčbu co nejnižší dávkou s titrací do dávky co nejvyšší doporučené, ale tolerované.
MRA pro aldosteron – spironolakton (u jedinců s gynekomastií selektivní blokátor receptoru pro aldosteron – eplerenon, studie EMPHASIS-HF) u pacientů v pokročilém stadiu CHSS v kombinaci s ACEI a kličkového diuretika furosemidu prokazatelně zlepšují prognózu nemocných. Snižují celkovou mortalitu, riziko náhlé srdeční smrti, úmrtí z progrese SS a riziko hospitalizace.
Blokátory kalciového kanálu – amlodipin a felodipin – nesnižují srdeční funkci a nezvyšují mortalitu. Zdá se, že jsou bezpečné a dobře tolerované v léčbě pacientů s hypertenzí a koexistujícím SS.
Mezi poměrně nové léky ve farmakoterapii SS patři ivabradin zpomalující aktivitu sinusového uzlu, a tím snižující tepovou frekvenci. Má příznivý efekt na mortalitu a morbiditu nemocných s HFrEF (studie SHIFT publikována v roce 2010). V roce 2014 byly prezentovány výsledky studie PARADIGM-HF [9] prokazující příznivý efekt kombinovaného preparátu sakubitril-valsartan (angiotenzin receptor/ neprilysin inhibitor – ARNI) na snížení KV i celkové mortality [9,10].
Léčba hypertenze a HFpEF
Optimální léčba hypertenze u nemocných s HFpEF je nejasná. Léčebné strategie, které byly u pacientů s HFrEF spojeny se sníženou nemocností a se zlepšením prognózy, se ukázaly být u nemocných s HFpEF neúspěšné. Jen pacienti s HFmrEF reagovali lépe na účinek spironolaktonu ve srovnání s nemocnými s EF nad 0,50. U symptomatických nemocných s projevy městnání lze užít diuretika a event. venodilatační farmaka. Avšak často pak pozorujeme, že u jedinců s malou tuhou LK při takto léčbou navozené podstatné redukci preloadu klesá významně plnění LK, a tedy srdeční výdej, a nemocný může být těžce hypotenzní. Nejúspěšnějším preventivním a léčebným opatřením hypertoniků s diastolickou dysfunkcí a popř. již s HFpEF je regrese hypertrofie LK důslednou léčbou hypertenze [5].
Prevence SS
Vzniku SS lze zabránit nebo ho alespoň oddálit jak důslednou kontrolou všech ovlivnitelných rizikových faktorů, tak léčbou asymptomatické systolické dysfunkce LK.
Ze závěrů mnoha klinických studií vyplývá, že kontrola arteriální hypertenze snižuje nebo zpožďuje vznik SS a prodlužuje život hypertonikům. Téměř všechny hlavní skupiny antihypertenziv se ukázaly být v tomto směru účinné – diuretika, ACEI, sartany, blokátory kalciových kanálů a betablokátory. Zatím není zcela jednotný názor na cílové hodnoty TK. Nedávno zveřejněné závěry klinické studie SPRINT potvrdily, že léčba hypertenze u starších jedinců (75 let a více) nebo u osob s vysokým rizikem, bez cukrovky, podstatně snižující TK hluboko pod cílové hodnoty (systolický TK < 120 mm Hg vs. systolický TK < 140 mm Hg) zmenšuje riziko KV onemocnění, úmrtí a hospitalizace pro SS [11].
Nové a dnes již v klinické praxi běžně zavedené perorální antidiabetikum empagliflozin (inhibitor sodíko-glukózového kotransportéru v ledvinách) snižuje TK a zlepšuje prognózu – pokles celkové mortality a počtu hospitalizací pro SS u nemocných s diabetes mellitus 2. typu.
Kouření nesporně zvyšuje KV riziko, i když nebylo jasně prokázáno, že zanechání kouření přímo snižuje riziko vzniku SS. Mírná konzumace alkoholu (do sedmi drinků týdně) znamená nejnižší riziko rozvoje SS, větší příjem může naopak podnítit vznik dilatační alkoholové kardiomyopatie. Vyšší dávky tělesné aktivity (větší než dosud doporučovaná minimální zátěž) rovněž snižují riziko SS.
Léčba statiny redukuje výskyt KV příhod a mortalitu. Zabraňuje SS či oddaluje jeho vznik. Pozitivní preventivní účinky léčby ACEI betablokátory na vznik a vývoj SS jsou rovněž dnes nesporné.
Primární koronární angioplastika u STEMI (akutní IM s elevací úseku ST) zmenšuje velikost infarktové nekrózy, a tím snižuje riziko následné remodelace LK s pozdějším rozvojem HFrEF. Stejně tak zahájení léčby ACEI, betablokátory, MRA a statiny časně po prodělaném IM, zejména je-li provázen systolickou dysfunkcí LK, podstatně redukuje riziko hospitalizací pro SS a mortalitu [5,9,10].
Doručeno do redakce: 28. 5. 2017
Přijato po recenzi: 8. 6. 2017
doc. MU Dr. Mojmír Blaha, CSc.
www.fnusa.cz
mojmir.blaha@fnusa.cz
Sources
1. Felšöci M, Špinar J. Hypertenze a akutní srdeční selhání. In: Jiří Widimský jr. Arteriální hypertenze – současné klinické trendy XIV. Praha: Triton, 2016.
2. Drazner MH. The progression of hypertensive heart disease. Circulation 2011; 123(3): 327 – 334. doi: 10.1161/ CIRCULATIONAHA.108.845792.
3. Hwang SJ, Melenovsky V, Borlaugh BA. Implications od coronary artery disease in heart failure with preserved ejection fraction. J Am Coll Cardiol 2014; 63 (25 Pt A): 2817 – 2827. doi: 10.1016/ j.jacc.2014.03.034.
4. Redfield MM. Heart failure with preserved ejection fraction. N Engl J Med 2016; 375(19): 1868 – 1877.
5. Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. The Task Force for the diag-nosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37(27): 2129 – 2200. doi: 10.1093/ eurheartj/ ehw128.
6. Cleland JG. Cardiac remodeling: what has changed over the past 10 years? Dialogues Cardiovasc Med 2015; 20 : 85 – 104.
7. Borlaugh BA, Lam CS, Roger VL et al. Contractility and ventricular systolic stiffening in hypertensive heart disease: insights into pathogenesis of heart failure with preserved ejection fraction. J Am Coll Cardiol 2009; 54(5): 410 – 418. doi: 10.1016/ j.jacc.2009.05.013.
8. James PA, Oparil S, Carter BL et al. 2014 Evidence-based guideline for management of high blood pressure in adults: report from the panel members appointed to the Eighth Joint National Committee (JNC 8). JAMA 2014; 311(5): 507 – 520. doi: 10.1001/ jama.2013.284427.
9. McMurray JJ, Packer M, Desai AS et al. PARADIGM-HF Investigators and Committees. Angiotensin-neprilysin inhibitor versus enalapril in heart failure. N Engl J Med 2014; 371(11): 993 – 1004. doi: 10.1056/ NEJMoa1409077.
10. Hradec J. Sacubitril/ valsartan – nový duální inhibitor neprilysinu a receptorů pro angiotensin II. Remedia 2016; 26 : 102 – 108.
11. Wright JT, Williamson JD, Whelton PK et al. The SPRINT Research Group. A randomized trial of intensive versus standard blood-pressure control. N Engl J Med 2015; 373(22): 2103 – 2116. doi: 10.1056/ NEJMoa1511939.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2017 Issue 2-
All articles in this issue
- Léčba hypertenze ve stáří
- Kontrola krevního tlaku v primární a sekundární prevenci cévní mozkové příhody
- Endokrinní hypertenze
- Vztah mezi krevním tlakem a bolestí – co už víme?
- Vybrané poznámky ke studii FOURIER
- Implementace Doporučení pro diagnostiku a léčbu srdečního selhání 2016 do klinické praxe – úloha ivabradinu
- Farmakologická léčba srdečního selhání se zachovalou ejekční frakcí
- Elektrokardiogram a kardiostimulace
- Jaké jsou cílové hodnoty krevního tlaku u srdečního selhání?
- Nové fixní kombinace antihypertenziv
- Hypertenze a srdeční selhání
- Hypertenze a ischemická choroba srdeční – dva nebezpeční sourozenci
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Jaké jsou cílové hodnoty krevního tlaku u srdečního selhání?
- Nové fixní kombinace antihypertenziv
- Elektrokardiogram a kardiostimulace
- Farmakologická léčba srdečního selhání se zachovalou ejekční frakcí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

