-
Medical journals
- Career
Možnosti endovaskulární léčby akutní končetinové ischemie
: J. Krátký 1; D. Kučera 1,2; M. Válka 1; J. Kozák 1; D. Maděřič 1; V. Jetmar 1; J. Bezecný 1
: Vaskulární centrum, Vítkovická nemocnice a. s., Ostrava 1; II. interní klinika kardiologie a angiologie 1. LF UK a VFN v Praze 2
: Kardiol Rev Int Med 2016, 18(3): 179-186
Akutní končetinová ischemie je vážná zdravotní komplikace, která bez adekvátní terapie ohrožuje životaschopnost končetiny. Pokud není pacient adekvátně léčen, k amputaci dochází v rozmezí od 5 do 30 % a úmrtnost těchto pacientů dosahuje až 18 %. Poruchy prokrvení dolních končetin jsou způsobeny buď trombózou, a/nebo embolizací do arteriálního kmene tepen dolních končetin. Ve většině případů je akutní končetinové ischemie způsobena periferní embolizací intrakardiálního trombu, obvykle v důsledku fibrilace síní. Klinická manifestace se odvíjí od lokalizace a rozsahu tepenného uzávěru. Klinický stav pacientů, fyzikální vyšetření a diagnostika pomocí zobrazovacích metod postižené končetiny mají rozhodující význam pro strategii další léčby. Co se týče možností léčby, je možné v dnešní době volit mezi endovaskulárními technikami, chirurgickou revaskularizací či antikoagulační terapií. Tato práce je zaměřena na možnosti endovaskulární rekanalizace akutních tepenných uzávěrů za použití farmakologických či mechanických endovaskulárních způsobů léčby. Farmakologickou endovaskulární léčbu představuje aplikace rekombinantního tkáňového aktivátoru plazminogenu přímo do uzávěru za pomoci speciálních perforovaných trombolytických katetrů. Mechanická endovaskulární rekanalizace je zastoupena systémem Rotarex. Sdělení prezentuje soubor pacientů léčených endovaskulárními postupy ve Vaskulárním centru Vítkovické nemocnice a. s.
Klíčová slova:
akutní končetinová ischemie – endovaskulární rekanalizace – lokální trombolýza – Rotarex®Úvod
Akutní končetinová ischemie (acute limb ischeamia – ALI) je definována jako náhlý pokles perfuze končetiny, anamnesticky ne starší než 14 dnů [1–3], která ohrožuje životaschopnost končetiny. Tato situace je spojena s vážnou prognózou. K amputaci dochází v rozmezí od 5 do 30 % a úmrtnost těchto pacientů dosahuje až 18 % [4,5]. Poruchy prokrvení dolních končetin jsou způsobeny buď trombózou tepny, nebo embolizací do periferní tepny. Poměr embolických a aterotrombotických uzávěrů periferních tepen se uvádí v poměru 4 : 1 [6]. Ve většině případů je ALI způsobena periferní embolizací intrakardiálního trombu, obvykle v důsledku fibrilace síní. Méně časté mechanizmy embolie jsou trombemboly z trombotizovaných tepenných aneuryzmat, z oblasti trombotizovaných pseudoaneuryzmat anastomoz bypassů, paradoxní embolizace či iatrogenní embolizace po katetrizačních výkonech. Trombotický uzávěr vzniká nejčastěji u pacientů s preexistující aterosklerózou tepen, kdy uzávěr nasedá na aterosklerotický plát. Z klinického hlediska bývá embolizační uzávěr charakterizován rychlým rozvojem projevů ischemie, neboť embolie často postihuje cévní řečiště bez vytvořeného kolaterálního oběhu. Klinická manifestace se odvíjí od lokalizace tepenného uzávěru či místa embolizace. K embolickému uzávěru nejčastěji dochází v místech větvení tepen, na kterých se embolus uchytí (aortální či femorální bifurkace, větvení distální popliteální tepny na bércové tepny). Aterotrombotický uzávěr je nejčastěji lokalizován v oblasti arteria femoralis superficialis (AFS). Symptomy bývají přítomny po dobu několika hodin až dnů. Klinicky je přítomno typických 6P = paresthesia, pain, pallor, paralysis, poikilothermia, and pulselessness [7]. Klinický stav pacientů a fyzikální vyšetření postižené končetiny mají velký význam pro strategii další léčby. Rutherford et al [7] navrhli klasifikaci, která je nejčastěji používanou metodou pro popis ALI. Podle klasifikace Rutherford je ALI rozdělena do tří hlavních tříd: pacienti s životaschopnou končetinou (stupeň I), pacienti s ohroženou končetinou jsou dle míry ischemie děleni na stupeň IIa (přítomen senzitivní deficit, bez motorického deficitu) a IIb (přítomen senzitivní i motorický deficit) a konečně stupeň III (neviabilní končetina, kompletní senzomotorický deficit, dopplerometricky není detekovatelný tepenný ani žilní tok). Pacienti ve stupni I nevyžadují emergentní revaskularizační zákrok, je možné nasadit antikoagulační terapii (LMHW nebo heparin) a strategii revaskularizace určit až po kompletním diagnostickém procesu. U pacientů ve stupni ALI II již je bezprostřední ohrožení končetiny, a proto vyžadují urgentní revaskularizační výkon. Dle charakteru postižení je možné užít endovaskulární či chirurgickou léčbu. Endovaskulární techniky jsou preferovány ve stadiu I a IIa a u stadia IIb jsou upřednostňovány chirurgické zákroky. Nicméně díky zlepšení možností endovaskulární terapie v poslední době je možné užít endovaskulární léčbu i ve stadiu IIb [7–12]. Ve stadiu III již revaskularizace není možná a je indikována amputace postižené končetiny [7].
Diagnostika
Diagnostiku zahajujeme především pečlivým odběrem anamnézy a fyzikálním vyšetřením. Přítomnost pulzu či jeho absence napovídá o přibližné lokalizaci uzávěru. Zhodnocení „6P“ umožňuje určit stupeň ischemie. Metodou volby je dopplerovské sonografické vyšetření, které nás spolehlivě informuje o přítomnosti, lokalizaci a velikosti uzávěru. Dle charakteru sonografického obrazu lze velmi často rozpoznat, zda se jedná o embolický či aterotrombotický uzávěr (při embolickém uzávěru vidíme hladkou intimu, při aterotrombotickém uzávěru je přítomno aterosklerotické postižení, kalcifikované pláty). Senzitivita a specifita ultrazvukového vyšetření při diagnostice tepenných postižení je 70, resp. 90 % [13,14]. Další metodou volby při diagnostice ALI je provedení CT angiografie. Technologický pokrok vedoucí ke zvýšení počtu detektorových řad z 16 až na 64, 128 či 265 zlepšil zobrazení a zkrátil vyšetření. Současné přístroje umožňují přesnější zobrazení bércových tepen, což bylo dříve značnou limitací [15]. Nejpřesnější metodou diagnostiky rozsahu uzávěru je invazivní angiografické vyšetření [16], které ukazuje přesný rozsah a lokalizaci uzávěru a velikost kolaterálního oběhu. Dle charakteru angiografického nálezu jsme často schopni posoudit, zda se jedná o embolizační či aterotrombotický uzávěr.
Terapie
Léčba akutní končetinové ischemie spočívá v užití:
- endovaskulární techniky s farmakologickým či mechanickým odstraněním trombembolických hmot,
- chirurgické revaskularizace a
- antikoagulační terapie.
V rámci endovaskulární léčby můžeme užít farmakologickou terapii pomocí rekombinantního tkáňového aktivátoru plazminogenu (rt-PA) s provedením lokální trombolýzy (LKT) a/nebo mechanickou rekanalizaci uzávěru za pomocí systému Rotarex®. Obě metody mají své výhody i nevýhody.
Lokální kontinuální trombolýza
LKT je efektivní metodou k revaskularizaci aterotrombotického či embolického uzávěru nativních tepen či bypassů na dolních končetinách. Mezi rozhodující výhody této metody patří možnost aplikace léčiva přímo do místa uzávěru. Hlavní nevýhodou této metody jsou možné krvácivé komplikace. I když se LKT používá obvykle u pacientů se stářím uzávěru do 14 dnů, byl prokázán úspěch této terapie i u pacientů se stářím uzávěru až šest týdnů [12,17,18]. LKT je vyhrazena pro pacienty, kde bezprostředně nehrozí ztráta končetiny, a lze tedy vyčkat efektu vlastní trombolýzy. Je volena zejména u pacientů s klinickým stadiem ALI I a IIa. Vlastní podstatou terapie je aplikace rt-PA (Actilyse®) do trombu, kde usnadňuje lýzu sraženin přeměnou plazminogenu na plazmin, který dále degraduje fibrin a fibrinogen na jejich další produkty [1,12]. Přímé podání rt-PA do trombu za pomoci trombolytického katetru při lokální trombolýze je spojeno s větším lytickým efektem než systémové podání trombolytika [19]. Zároveň je oproti systémové trombolýze díky nižší celkové dávce rt-PA sníženo riziko krvácivých komplikací [20,21]. Není samozřejmě možné použít tuto techniku u všech pacientů s akutní končetinovou ischemií. Mezi absolutní kontraindikace patří aktivní krvácení do gastrointestinálního traktu, proběhlá hemoragická cévní mozková příhoda (CMP) a gravidita. Relativní kontraindikace LKT tvoří všechny stavy, které by mohly vést ke vzniku krvácivých komplikací, např. recentně proběhlé chirurgické zákroky, přítomnost onkologických onemocnění, anamnesticky prodělaná vředová choroba gastroduodenální, traumata, ischemická CMP v průběhu posledních šesti měsíců, chronická renální insuficience, obtížně korigovatelná hypertenze či věk pacienta. V neposlední řadě je nutno zhodnotit spolupráci pacienta a jeho schopnost absolvovat často několikadenní proceduru. Všechny tyto stavy je pak nutné individuálně posuzovat u každého pacienta.
Ve studiích STILE (the Surgery versus Thrombolysis for Ischemia of the Lower Extremity) [22] a TOPAS (the Thrombolysis Or Peripheral Arterial Surgery) [23] byl prokázán pozitivní vliv lokální trombolýzy u pacientů, kteří se následně podrobili chirurgickému zákroku, a to ve smyslu redukce rozsahu a náročnosti zákroku pacientů s ALI. Ve studii STILE byli randomizováni pacienti s projevy akutní ischemie < 14 dnů. Po šesti měsících sledování byla intervenovaná končetina zachráněna v 89 % případů v endovaskulární větvi oproti 70 % ve větvi chirurgické [24]. Ve studii TOPAS byli randomizováni pacienti s projevy ALI < 14 dnů s uzávěry nativních tepen či bypassů s provedením LKT či chirurgické revaskularizace. Během 12 měsíců od intervence došlo k amputaci intervenované končetiny ve 35 % případů v endovaskulární větvi proti 31,1 % v chirurgické větvi, krvácivé komplikace ve 12 % případů v endovaskulární větvi oproti 5,05 % v chirurgické větvi [23,25].
Lokální kontinuální trombolýza je ve Vaskulárním centru Vítkovické nemocnice a. s., užívána jako standardní metoda od jeho vzniku v roce 2001. Nejprve je na katetrizačním sále provedena angiografie tepen dolních končetin. Přístup do tepenného řečiště je určen lokalizací uzávěru. Nejčastější přístupovou cestou je a. femoralis communis (AFC), a to buď ipsilaterálně s antegrádním přístupem nebo retrográdně s cross-over přístupem do kontralaterální končetiny. Další možností je přístup z a. brachialis (nejčastěji používány při LKT uzávěru ramének Ao-bifem bypassů). Při angiografii je verifikován rozsah uzávěru. Poté za pomoci endovaskulárních vodičů a katetrů pronikáme do uzávěru, kde umístíme katetr k lokální trombolýze. Na našem pracovišti jsou používány trombolytické katetry Fountain® se speciálním perforovaným koncem pro aplikaci rt-PT o pracovním konci 5–50 cm. V průběhu lokální trombolyzy je pacient hospitalizován na JIP, kde je kontinuálně do trombolytického katetru aplikována Actilyse® v dávce 0,2–1,0 mg/hod a heparin v dávce 300 j/hod, do sheatu je aplikován heparin v dávce 500–1 200 j/hod k prevenci perikatetrální trombózy. Během trombolýzy je v šestihodinových intervalech kontrolována koagulace pacienta s tím, že hodnota sérového fibrinogenu by neměla klesnout pod 1 g/l a hodnotu aPTT (aktivovaný parciální tromboplastinovaný čas) se snažíme držet v optimálním terapeutické rozmezí 60–90 s. Pokud je hodnota aPTT nízká i při vysokých dávkách podávaného heparinu, je pacient převeden na parenterální aplikaci nízkomolekulárního heparinu. Kontrolní angiografie (AG) je většinou prováděna následující den po zahájení trombolýzy, obvykle po 24 hod. Dle nálezu na kontrolní AG je indikováno buď pokračování trombolýzy, nebo se trombolýza ukončuje a podle potřeby je prováděn další endovaskulární výkon. Při embolických uzávěrech většinou není nutný další endovaskulární výkon. Při aterotrombotických uzávěrech naopak musí být ve většině případů provedena buď prostá balonková plastika, či implantace stentu do oblasti reziduálních stenóz, které jsou ve valné většině případů příčinou aterotrombotických uzávěrů. V případě trombolytické terapie bypassů jsou po úspěšné lýze indikovány buď angioplastiky stenotizací na anastomózách (nejčastěji za pomoci lékem potahovaných balonkových katetrů), nebo je indikována chirurgická revize anastomóz. Po ukončení endovaskulárního výkonu je po poklesu aPTT vytažen sheat s naložením komprese systémem Femostop a 24hod klidem na lůžku. V některých případech je místo punkce ošetřeno pomocí techniky clossure device, na našem pracovišti užíváme systém Angioseal®.
Během let 2011–2013 byla ve Vaskulárním centru Vítkovické nemocnice a. s., užita lokální kontinuální trombolýza k léčbě akutní končetinové ischemie celkem ve 491 případech. Byly prováděny trombolýzy ve všech etážích tepen dolních končetin (graf 1). Lokální trombolýza byla úspěšná v 425 případech (86,5 %). Rekanalizace uzávěrů pomocí LKT dle jednotlivých etáží arteriálního systému dolních končetin je prezentována v grafu 2. Během sledovaného období nedošlo k žádnému úmrtí pacienta, které by bylo v přímé souvislosti s prováděnou trombolytickou terapií. Nezaznamenali jsme žádný případ intrakraniálního krvácení. Pokud se zaměříme na významné krvácivé komplikace (major bleeding complications), mezi které jsme zařadili krvácení do plic, do retroperitonea, krvácení do třísla vyžadující chirurgickou revizi, krvácení do gastrointestinálního traktu a lokální krvácení, tyto komplikace se v našem souboru vyskytly celkem u 36 pacientů, což je 7,3 % (graf 3). Pacienti, u kterých je plánovaná trombolytická terapie, jsou samozřejmě již předem selektováni a jsou vyloučeni všichni pacienti s kontraindikací této terapie. Přesto jsme v našem souboru pacientů zaznamenali signifikantní nárůst krvácivých komplikací u pacientů starších 80 let (graf 4).
1. Celkový počet trombolýz dle anatomických lokalizací v letech 2011–2013. 
2. Graf zobrazuje procentuální úspěšnost lokální kontinuální trombolýzy v jednotlivých anatomických oblastech tepen dolních končetin. 
3. Procentuální zastoupení závažných krvácivých komplikací z celkového počtu pacientů léčených lokální kontinuální trombolýzou. 
4. Krvácivé komplikace v závislosti na věku pacienta. Graf zobrazuje předpokládaný nárůst krvácivých komplikací především ve věkové skupině > 80 let v %. 
Kazuistika 1
Šestašedesátiletá pacientka, doposud bez cévních onemocnění, přichází k dopplerovskému vyšetření pro akutně vzniklé, asi týden trvající krátké klaudikace pravé dolní končetiny (PDK) po 15 m chůze. Bez klidových bolestí. Dle klinického vyšetření je absence hmatných pulzací na periferii PDK, bez vyjádřeného senzomotorického deficitu, stav hodnocen jako ALI stadium I. Dle provedeného dopplerovského vyšetření verifikace uzávěru popliteální tepny a odstupu bércových tepen, etiologicky vs. embolizační. Při absenci kontraindikací bylo indikováno provedení LKT. Tato provedena z antegrádního přístupu z pravé AFC. Angiografický nález verifikuje hladkou povrchní stehenní tepnu bez výraznějších aterosklerotických změn, uzávěr popliteální tepny (obr. 1–3). Do uzávěru zaveden trombolytický katetr Fountaine® s pěticentimetrovým pracovním koncem (obr. 4). Kontrolní AG po 24 hod zobrazuje rekanalizovaný uzávěr (obr. 5), pro reziduální trombotické hmoty LKT pokračuje. Kontrolní AG po 48 hod s optimálním nálezem (obr. 6), plná rekanalizace uzávěru APo, bez přítomnosti reziduální stenotizace či trombembolických hmot. Na bérci chronický uzávěr distální ATP, bez známek periferní embolizace (obr. 7). Po výkonu pacientka nastavena na antikoagulační terapii a v ambulantním režimu naplánováno došetření zdroje embolizace.
1. Angiografie levé povrchní femorální tepny, která je bez známek výraznějšího aterosklerotického postižení. 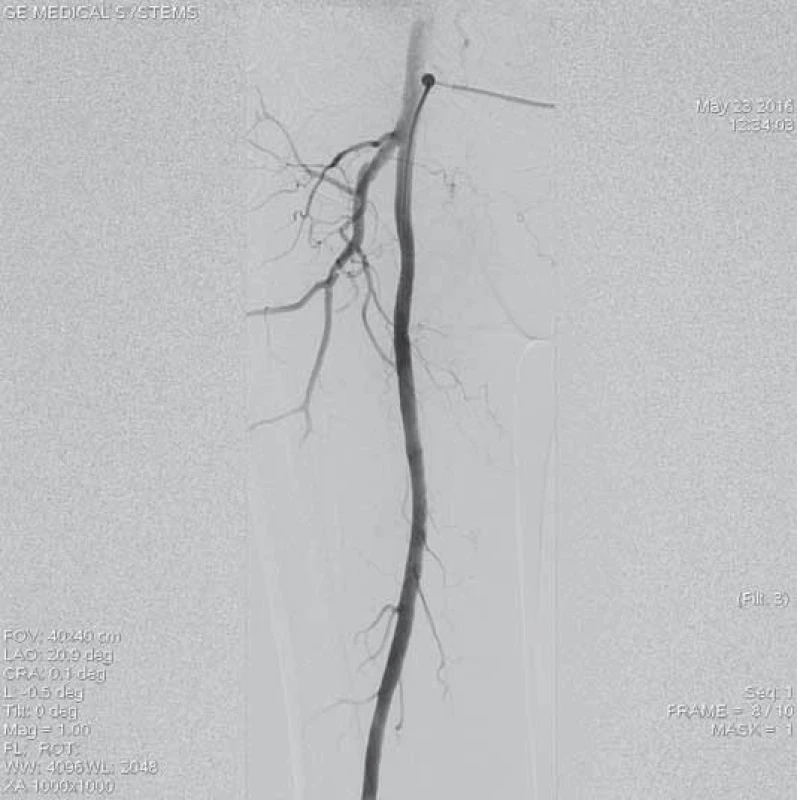
2. Uzávěr popliteální tepny s přesahem do odstupu bércových tepen. Na začátku uzávěru je charakteristický obraz „račích klepet“ typický pro embolický původ uzávěru. 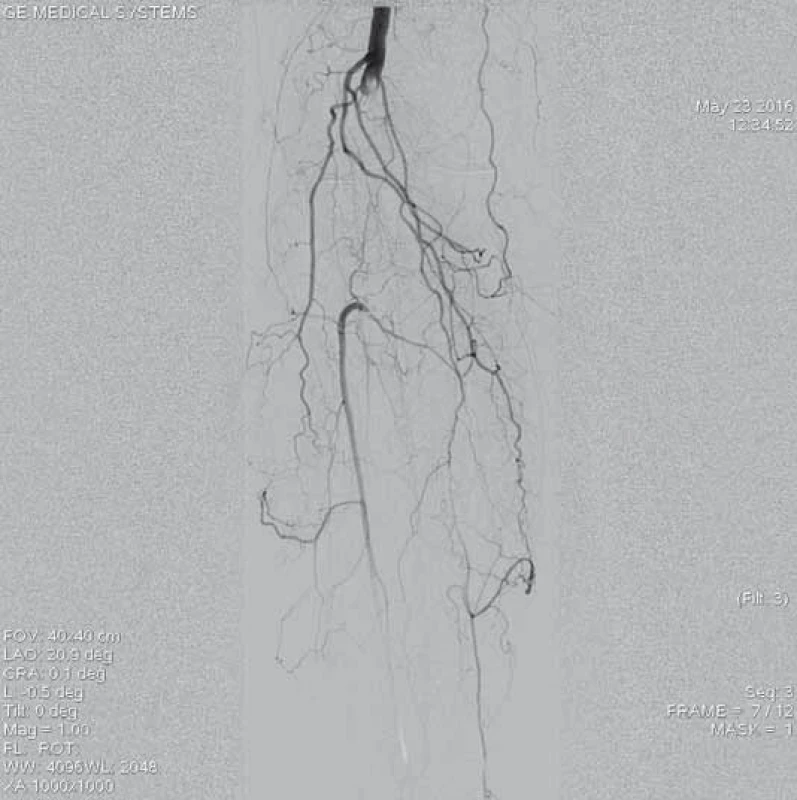
3. Výtokový trakt na bérci před lokální trombolýzou. 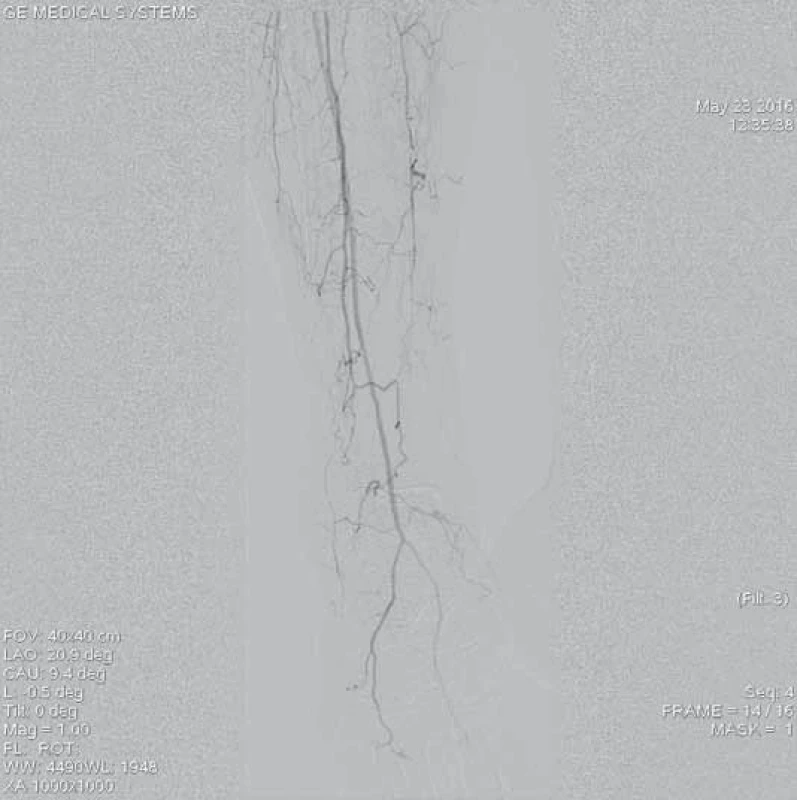
4. Zavedený katetr k lokální trombolýze Fountain s 5cm pracovní plochou. 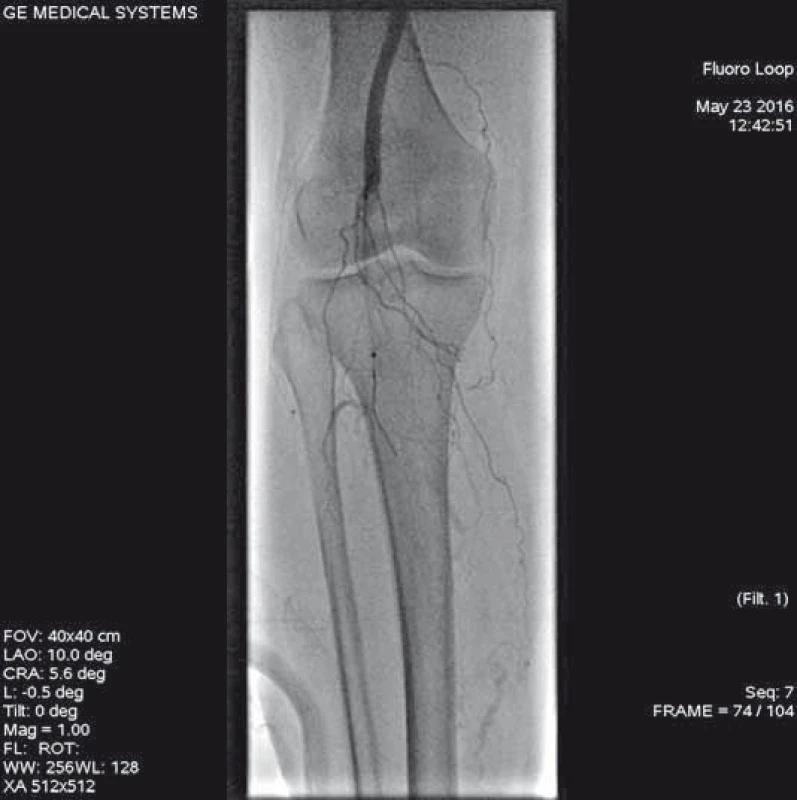
5. Kontrolní angiografie po 24 hod trvání trombolýzy prokazuje přítomné reziduální nástěnné tromby ve střední části podkolenní tepny, pro které bylo indikováno pokračování v lokální trombolýze. 
6. Kontrolní angiografie místa uzávěru při větším zvětšení obrazu po 48 hod trvání trombolýzy prokazuje kompletní lýzu trombotických hmot, bez přítomnosti reziduálních stenotizací, bez nutnosti provedení další intervence. 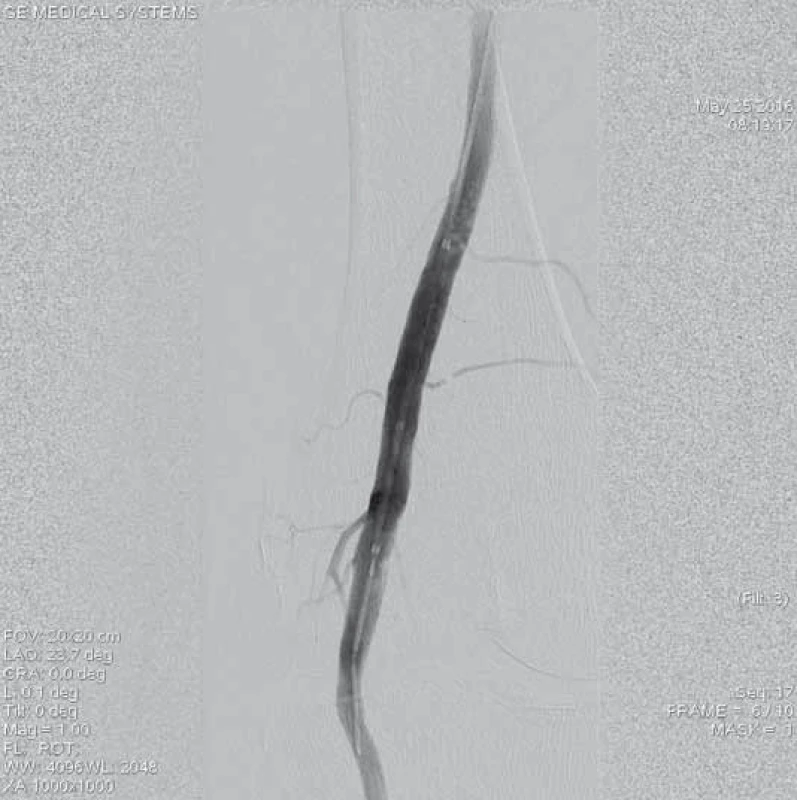
7. Angiografie výtokového traktu po ukončení trombolýzy prokazuje průchodnou ATA a AFIb bez známek periferní embolizace, je přítomný chronický uzávěr ATP, na kterém pro odeznění akutní ischemie neintervenováno. 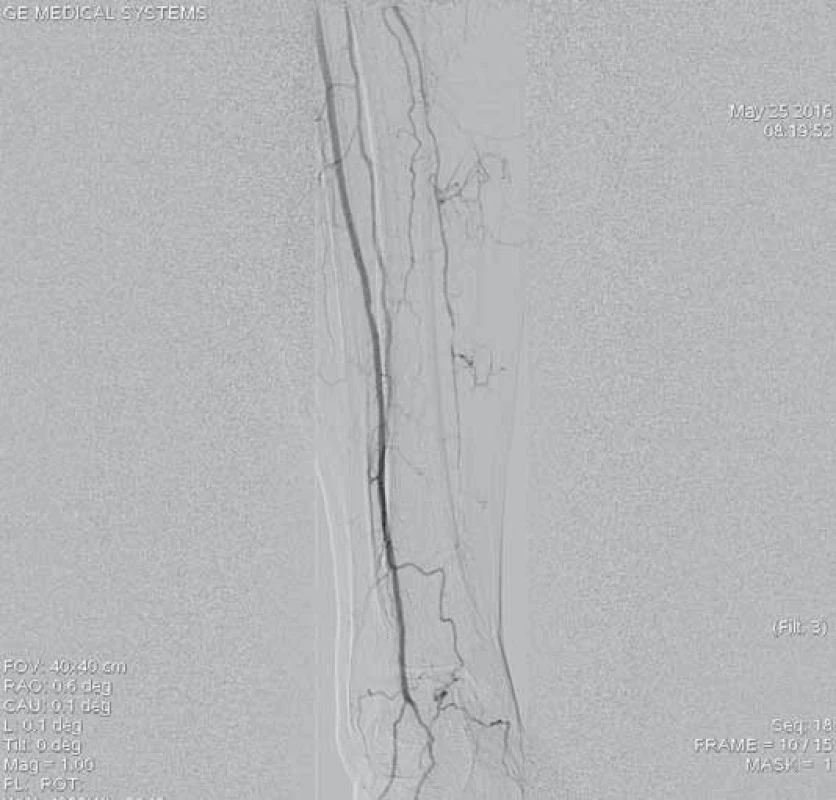
ATA – a. tibialis anterior, AFIb – a. fibularis, ATP – a. tibialis posterior Mechanická rekanalizace systémem Rotarex®
Endovaskulární mechanická trombektomie je další metodou arteriální rekanalizace, která se používá při léčbě akutní končetinové ischemie [26]. Účinnost mechanické trombektomie s aspirací uvolněného materiálu pomocí katetru ROTAREX® se odhaduje v literatuře až na 97,5 % [26–29]. Je to rychlá a efektivní metoda umožňující obnovení průchodnosti cév často již do 30 min. Z těchto důvodů je možno užít mechanickou rekanalizaci i u pacientů se závažnou mírou akutní ischemie stadia IIb, u kterých není možné provádět LKT, při které efekt nastupuje až s odstupem několika hodin. Perkutánní systémem Rotarex® (obr. 8) pracuje, podobně jako Archimedův šroub, na podkladě spirálovitého konce rotujícího vysokou rychlostí. Konec katetru se skládá z dvojitého válce zaostřeného na okrajích a šroubovitého dopravníku, který se nachází uvnitř katetru a je spojen s hnací jednotkou pomocí magnetické spojky. Rotační zařízení vytváří vír a podtlak, který v kombinaci se speciální strukturou katetru způsobuje uvolnění, aspiraci, fragmentaci a odstranění tromboembolického materiálu z tepny přes katetr do sběrného vaku. Katetr se musí v tepně pohybovat po vodicím drátu, což výrazně zvyšuje bezpečnost postupu a minimalizuje možnost perforace tepny. V současné době jsou k dispozici dvě velikosti zařízení 8F a 6F, které se používají v závislosti na průměru postižené tepny. Rychlost rotace systému 8F je cca 40 000 ot/min, zatímco 6F je cca 60 000 ot/min. Maximální kapacita pro aspiraci tekutiny z tepenného systému je 45 ml/min v případě systému 6F a 75 ml/min při použití 8F systému. I tento systém má své limity. Není vhodný v situacích, kdy došlo k subintimálnímu průchodu uzavřenou tepnou, pokud jsou přítomny tepenné spazmy, došlo-li k okluzi na podkladě fraktury stentu nebo při postižení bércových tepen. V těchto případech je riziko perforace tepenného systému, což je hlavní komplikace při této formě terapie. V malém procentu případů se setkáváme s tím, že pracovní konec systému „přetne“ vodič, jehož distální část je poté nutno odstranit z tepenného systému. Na rozdíl od lokální trombolýzy je při užití systému Rotarex® vyšší riziko vzniku periferní embolizace rozdrcenými trombotickými hmotami z původního uzávěru. Embolizace je však dobře řešitelná následnou aspirací k tomu uzpůsobenými aspiračními katetry. I při úspěšné rekanalizaci uzávěru je často nutné výkon doplnit o provedení perkutánní transluminární angioplastiky či implantaci stentu. Na základě našich dlouholetých zkušeností považujeme lokální kontinuální trombolýzu za metodu spojenou s kompletnější lýzou tepenného uzávěru vč. kolaterální cirkulace a z tohoto důvodu mechanickou rekanalizaci užíváme při velmi krátkých akutních uzávěrech či u pacientů, kde je trombolytická terapie kontraindikována.
8. Detail pracovního konce systému Rotarex<sup>®</sup> k mechanické rekanalizaci akutních a subakutních tepenných uzávěrů. 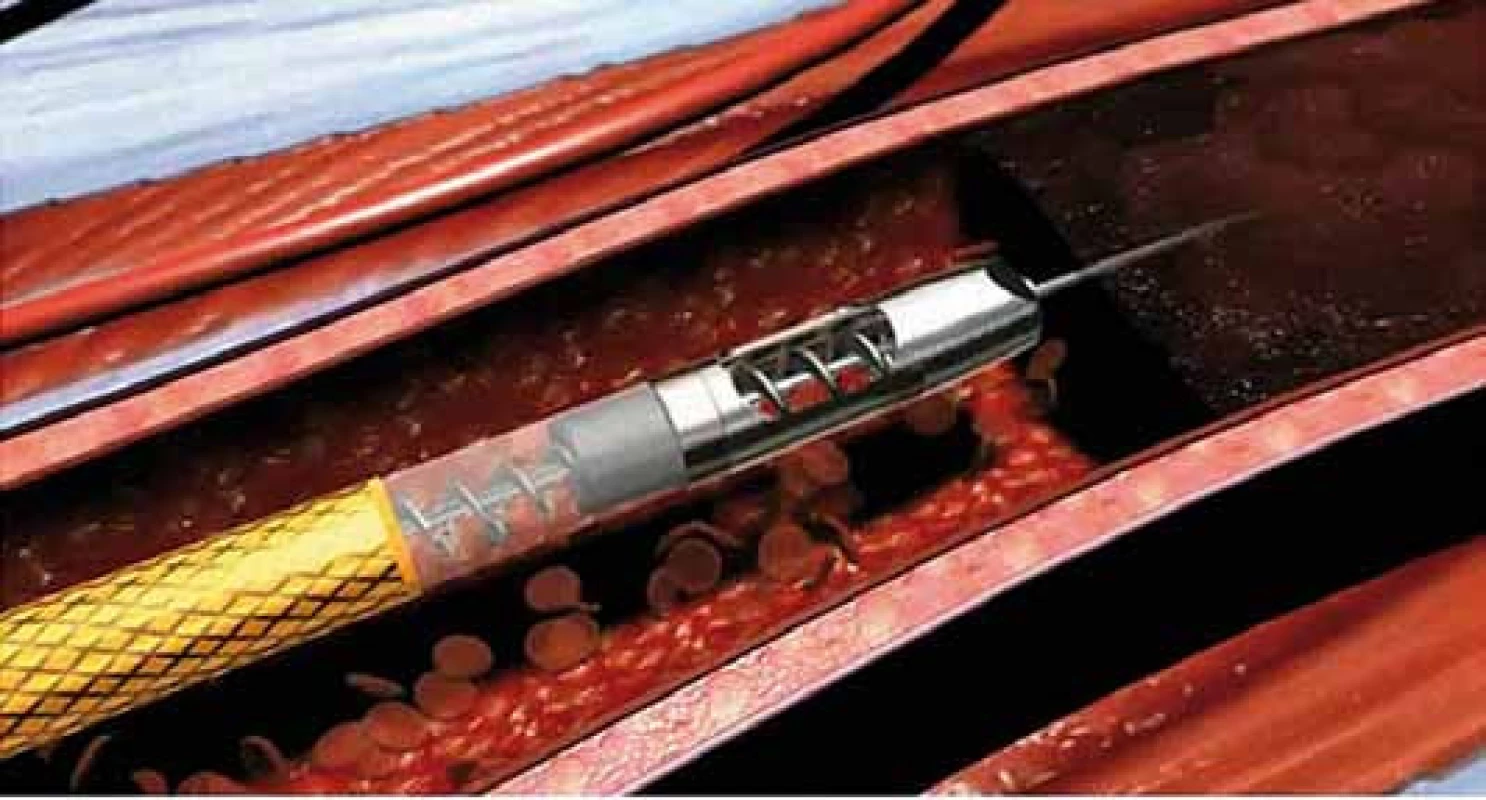
Kazuistika 2
Jedenašedesátiletá pacientka přijata pro anamnézu čtyři dny trvající krátké klaudikace levé dolní končetiny. Dle dopplerovského vyšetření byl verifikován aterotrombotický uzávěr střední části povrchní stehenní tepny vlevo. Pacientka byla indikována k endovaskulární revaskularizaci. Z antegrádního přístupu přes levou AFC zobrazen uzávěr (obr. 9), přes který bylo intraluminárně proniknuto vodičem. Následoval opakovaný průchod uzávěrem systémem Rotarex® 6F (obr. 10). Kontrolní angiografie zobrazuje zprůchodněnou tepnu, ale s přítomnými stenotizacemi na proximálním i distálním konci původního uzávěru (obr. 10). Provedena angioplastika balonkovým katetrem 5 × 120 mm. Pro přetrvávající stenotizace byly implantovány samoroztažitelné stenty velikosti 5 × 60 a 5 × 40 mm. Angiografie prokazuje optimální nález bez stenotizace či disekcí (obr. 12). Angiografie bércového řečiště neprokazuje periferní embolizaci (obr. 13). Pacientka byla po výkonu nastavena na antiagregační terapii kyselinou acetylsalicylovou.
9. Angiografie aterotrombotického uzávěru střední části levé povrchní stehenní tepny. 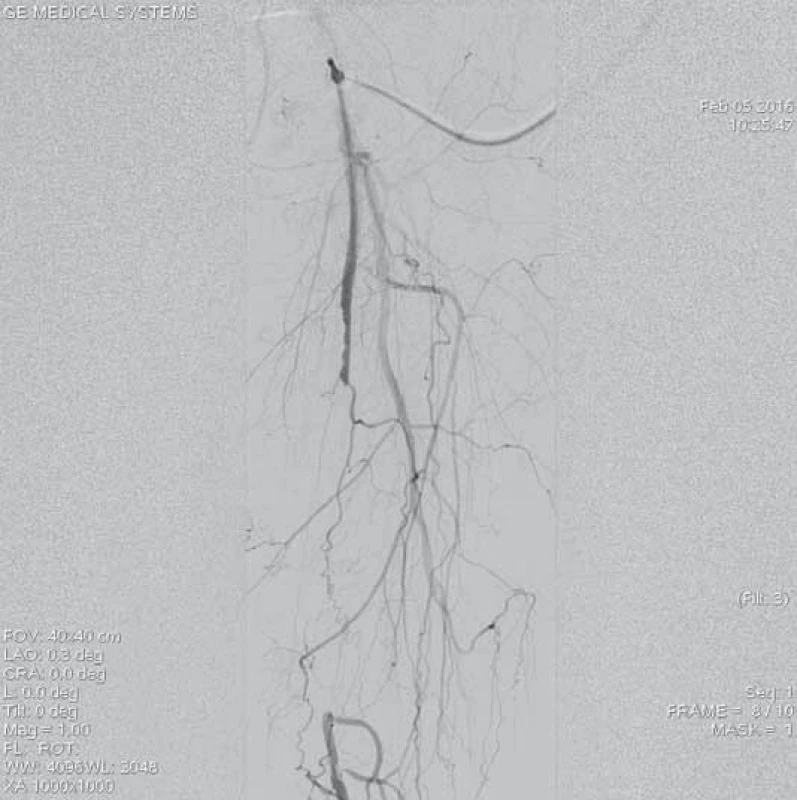
10. Do místa uzávěru zaveden systém Rotarex<sup>®</sup> 6F k provedení mechanické rekanalizace. Zařízení je zavedeno po ultratenkém vodiči, který musí projít uzávěrem intraluminálně. 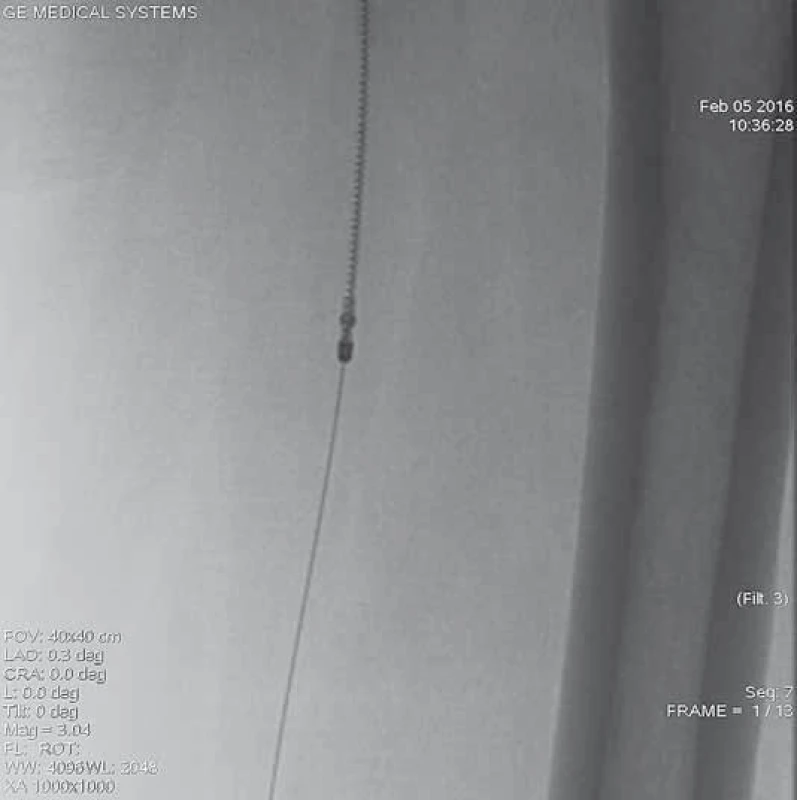
11. Kontrolní angiografie po opakovaných pasážích systému Rotarex<sup>®</sup> 6F skrz uzávěr prokazuje reziduální stenotizace v proximálním a distálním konci uzávěru. 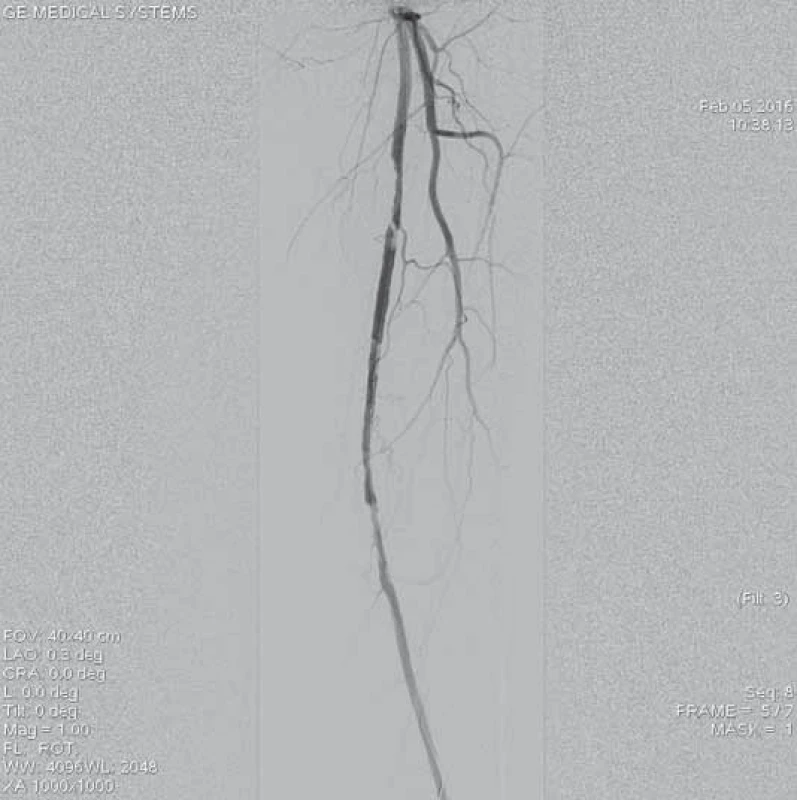
12. Výsledná angiografie po implantaci stentů Lifestent<sup>®</sup> 5 x 60 mm a 5 x 40 mm do proximálního a distálního konce původního uzávěru. 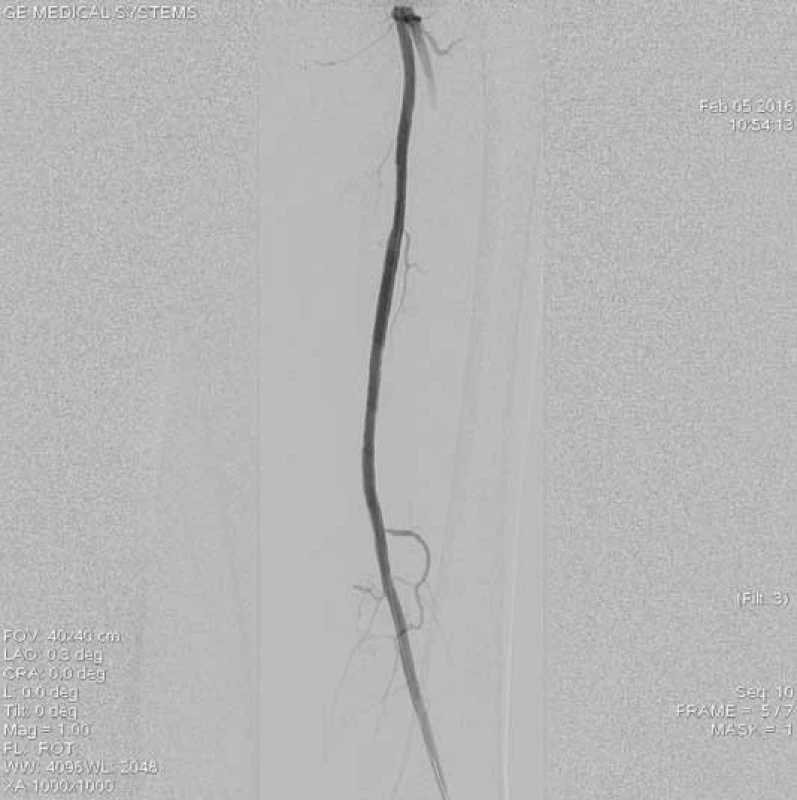
13. Angiogfrafie bércového řečiště zobrazuje volně průchodné dvě bércové tepny, bez průkazu periferní embolizace po úspěšné mechanické rekanalizaci. 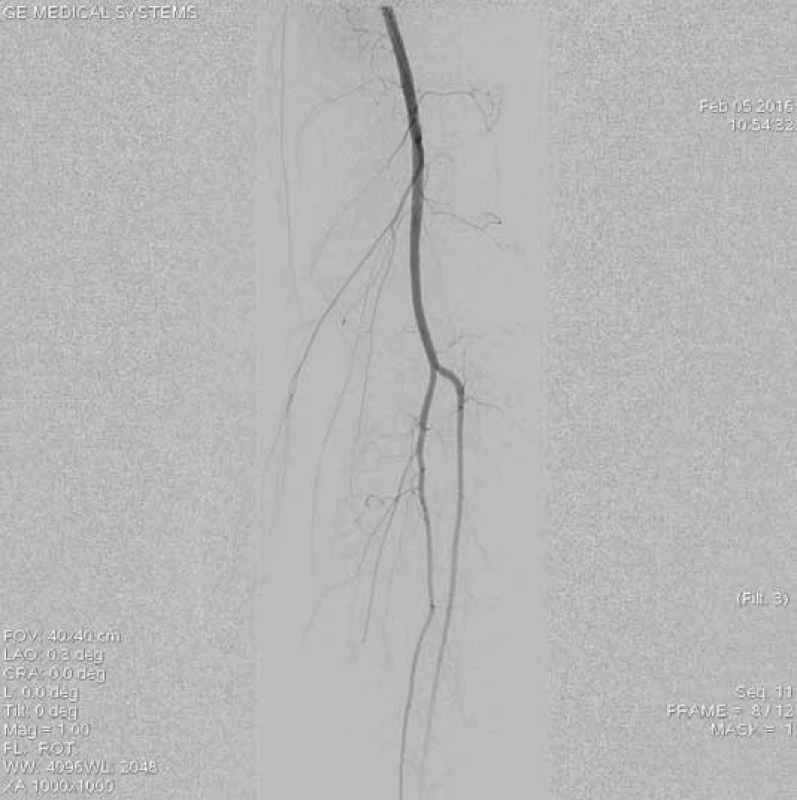
Závěr
Farmakologická i mechanická endovaskulární rekanalizace akutních uzávěrů tepen dolních končetin jsou bezpečnou a efektivní metodou terapie akutní končetinové ischemie. Představují pro pacienta menší zátěž než chirurgické formy terapie a umožňují cílené ošetření příčiny akutní končetinové ischemie. Pokud jsou adekvátně dodržována indikační kritéria, jsou tyto metody zatíženy nízkým rizikem závažných komplikací.
Doručeno do redakce: 6. 8. 2016
Přijato po recenzi: 18. 8. 2016
MUDr. Jaroslav Krátký
nemocnicevitkovice.agel.cz
j.kratky@vtn.agel.cz
Sources
1. Lurie F, Vaidya V, Comerota AJ. Clinical outcomes and cost-effectiveness of initial treatment strategies for nonembolic acute limb ischemia in real-life clinical settings. J Vasc Surg 2015; 61 : 138–146. doi: 10.1016/j.jvs.2014.07.086.
2. Malgor RD, Alalahdab F, Elraiyah TA et al. A systematic review of treatment of intermittent claudication in the lower extremities. J Vasc Surg 2015; 61 (3 Suppl): 54S–73S. doi: 10.1016/j.jvs.2014.12.007.
3. Ravari H, Pezeshki Rad M, Bahadori A et al. Comparison of conventional angiographic findings between trauma patients with or without runoff. Bull Emerg Trauma 2014; 2 : 72–76.
4. Eliason JL, Wainess RM, Proctor MC et al. A national and single institutional experience in the contemporary treatment of acute lower extremity ischemia. Ann Surg 2003; 238 : 382–389. doi: 10.1097/01.sla.0000086663.49670.d1.
5. Earnshaw JJ, Whitman B, Foy C. National Audit of Thrombolysis for Acute Leg Ischemia (NATALI): clinical factors associated with early outcome. J Vasc Surg 2004; 39 : 1018–1025. doi: 10.1016/j.jvs.2004.01.019.
6. Karetová D, Staněk F et al. Angiologie pro praxi. 2. rozšířené vyd. Praha: Maxdorf 2007.
7. Rutherford RB. Clinical staging of acute limb ischemia as the basis for choice of revascularization method: when and how to intervene. Semin Vasc Surg 2009; 22 : 5–9. doi: 10.1053/j.semvascsurg.2008.12.003.
8. Creager MA, Kaufman JA, Conte MS. Clinical practice. Acute limb ischemia. N Engl J Med 2012; 366 : 2198–2206. doi: 10.1056/NEJMcp1006054.
9. Acosta S, Kuoppala M. Update on intra-arterial thrombolysis in patients with lower limb ischemia. J Cardiovasc Surg (Torino) 2015; 56 : 317–324.
10. Byrne RM, Taha AG, Avgerinos E et al. Contemporary outcomes of endovascular interventions for acute limb ischemia. J Vasc Surg 2014; 59 : 988–995. doi: 10.1016/j.jvs.2013.10.054.
11. Grip O, Kuoppala M, Acosta S et al. Outcome and complications after intra-arterial thrombolysis for lower limb ischaemia with or without continuous heparin infusion. Br J Surg 2014; 101 : 1105–1112. doi: 10.1002/bjs.9579.
12. Khosla S, Jain P, Manda R et al. Acute and long-term results after intra-arterial thrombolysis of occluded lower extremity bypass grafts using recombinant tissue plasminogen activator for acute limb-threatening ischemia. Am J Ther 2003; 10 : 3–6.
13. Leiner T, Kessels AG, Nelemans PJ et al. Peripheral arterial disease: comparison of color duplex US and contrast-enhanced MR angiography for diagnosis. Radiology 2005; 235 : 699–708.
14. Favaretto E, Pili C, Amato A et al. Analysis of agreement between duplex ultrasound scanning and arteriography in patients with lower limb artery disease. J. Cardiovasc Med 2007; 8 : 337–341.
15. Shareghi S, Gopal A, Gul K et al. Diagnostic accuracy of 64 multidetector computed tomographic angiography in peripheral vascular disease. Catheter Cardiovasc Interv 2010; 75 : 23–31. doi: 10.1002/ccd.22228.
16. Tendera M, Aboyans V, Bartelink ML et al. European Stroke Organisation. ESC Committee for Practice Guidelines. ESC guidelines on the diagnosis and treatment of peripheral artery diseases: document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC). Eur Heart J 2011; 32 : 2851–2906. doi: 10.1093/eurheartj/ehr211.
17. Wongwanit C, Hahtapornsawan S, Chinsakchai K et al. Catheter-directed thrombolysis for acute limb ischemia caused by native artery occlusion: an experience of a university hospital. J Med Assoc Thai 2013; 96 : 661–668.
18. Pascoe H, Robertson D. Catheter-directed thrombolysis for acute limb ischaemia: An audit. Australas Med J 2014; 7 : 471–475. doi: 10.4066/AMJ.2014.2065.
19. Zhang F, Zhang H, Luo X et al. Catheter-directed thrombolysis-assisted angioplasty for chronic lower limb ischemia. Ann Vasc Surg 2014; 28 : 590–595. doi: 10.1016/j.avsg.2013.05.015.
20. Kearon C, Akl E, Comerota A et al. American College of Chest Physicians. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice Guidelines. Chest 2012; 141 (Suppl 2): e419S–e494S.
21. Alonso-Coello P, Bellmunt S, McGorrian C et al. antithrombotic therapy in peripheral artery disease: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141 (Suppl 2): e669S–e690S. doi: 10.1378/chest.11-2307.
22. Graor R, Comerota A, Douville Y et al. Results of a prospective randomized trial evaluating surgery versus thrombolysis for ischemia of the lower-extremity-the stile trial. Ann Surg 1994; 220 : 251–266.
23. Ouriel K, Veith FJ, Sasahara AA. A comparison of recombinant urokinase with vascular surgery as initial treatment for acute arterial occlusion of the legs. Thrombolysis or Peripheral Arterial Surgery (TOPAS) Investigators. N Engl J Med 1998; 338 : 1105–1111.
24. Weaver FA, Comerota AJ, Youngblood M et al. Surgical revascularization versus thrombolysis for nonembolic lower extremity native artery occlusions: results of a prospective randomized trial. The STILE Investigators. Surgery versus Thrombolysis for Ischemia of the Lower Extremity. J Vasc Surg 1996; 24 : 513–521.
25. Berridge DC, Kessel DO, Robertson I. Surgery versus thrombolysis for initial management of acute limb ischaemia. Cochrane Database Syst Rev 2013; 6: CD002784. doi: 10.1002/14651858.CD002784.pub2.
26. Duc SR, Schoch E, Pfyffer M et al. Recanalization of acute and subacute femoropopliteal artery occlusions with the rotarex catheter: one year follow-up, single center experience. Cardiovasc Intervent Radiol 2005; 28 : 603–610.
27. Wissgott C, Kamusella P, Andresen R. Recanalization of acute and subacute venous and synthetic bypass-graft occlusions with a mechanical rotational catheter. Cardiovasc Intervent Radiol 2013; 36 : 936–942. doi: 10.1007/s00270-012-0507-9.
28. Zeller T, Frank U, Bürgelin K et al. Langzeitergebnisse nach Rekanalisation akuter und subakuter thrombotischer arterieller Verschlüsse der unteren Extremitäten mit einem Rotations Thrombektomiekatheter. Rofo 2002; 174 : 1559–1565.
29. Wissgott C, Kamusella P, Richter A et al. Mechanical rotational thrombectomy for treatment thrombolysis in acute and subacute occlusion of femoropopliteal arteries: retrospective analysis of the results from 1999 to 2005. Rofo 2008; 180 : 325–331. doi: 10.1055/s-2008-1027144.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2016 Issue 3-
All articles in this issue
- A complete endovascular revascularisation of atherothrombotic occlusion of popliteal artery and below-the-knee arteries in a polymorbid patient – a case report
- Endovascular treatment of iliofemoral deep venous thrombosis
- Beta-blockers with the smallest negative impact on cardiorespiratory fitness in healthy people
- Project MedPed – spotlight on patients with familial hypercholesterolaemia
- Significance of periprocedural decrease in left ventricular outflow tract gradient after alcohol septal ablation in patients with hypertrophic obstructive cardiomyopathy
- Endovascular treatment of cerebrovascular accident
- Results of endovascular treatment and management of carotid stenosis at the Vítkovice Hospital
- Endovascular treatment of type B aortic dissection and ischaemic complications accompanying aortic dissections
- Type B aortic dissection with severe visceral and limb ischaemia treated with a complete endovascular revascularisation – a case report
- Possibilities of endovascular treatment of acute limb ischaemia
- Organisation of podiatric care in patients with critical limb ischaemia
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Beta-blockers with the smallest negative impact on cardiorespiratory fitness in healthy people
- Endovascular treatment of iliofemoral deep venous thrombosis
- Possibilities of endovascular treatment of acute limb ischaemia
- Type B aortic dissection with severe visceral and limb ischaemia treated with a complete endovascular revascularisation – a case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

