-
Medical journals
- Career
Jak nejlépe blokovat renin-angiotenzinový systém u nemocných s hypertenzí a diabetes mellitus?
Authors: J. Špác
Authors‘ workplace: II. interní klinika LF MU a FN U sv. Anny v Brně
Published in: Kardiol Rev Int Med 2016, 18(1): 13-16
Category: Cardiology Review
Motto: Metaanalýza je jako párek nebo klobása – nikdo, kromě řezníka, neví, co obsahuje.
Overview
Cílem článku je zhodnotit účinnost a bezpečnost různých způsobů blokády systému renin-angiotenzin-aldosteron (RAAS) u nemocných s diabetem 2. typu. Jak nejvhodněji a nejúčinněji blokovat systém RAAS u diabetiků, není zcela jasné, protože chybí údaje z randomizovaných klinických studií u diabetiků. Znalosti o způsobu léčby u této skupiny nemocných jsou získávány jen z analýz podskupin a z metaanalýz, jejichž výsledky mohou být méně spolehlivé. Kombinační terapie s ACE inhibitory a sartany by mohla lépe blokovat RAAS, ale dosavadní poznatky ukazují rozporuplné výsledky, zvláště pokud se týká bezpečnosti nemocných.
Klíčová slova:
diabetes mellitus 2. typu – hypertenze – renin-angiotenzin-aldosteron systém
Systém renin-angiotenzin-aldosteron (RAAS) je zásadním regulačním mechanizmem k udržení homeostázy a zajištění optimální regulace krevního tlaku (TK), vodního a minerálního prostředí a perfuze tkání v podmínkách s nízkým obsahem sodíku. V dávné minulosti byl RAAS podmínkou přežití, ale v moderní civilizaci s vysokou spotřebou sodíku se působení RAAS systému jeví jako přítěž a v řadě patologických situací (např. hypertenze, srdeční nedostatečnost či diabetes mellitus (DM)) spojených s chronickým zvýšením aktivity presorických systémů je škodlivé.
V problematice inhibice RAAS je stále mnoho nejasností vzhledem k tomu, že tento systém je komplexní s tkáňovou a cirkulující složkou, obsahuje klasickou i alternativní cesty aktivace a je spojen s metabolizmem vazodilatačních mediátorů. V klinické praxi jsou v současnosti dvě lékové skupiny zaměřené na blokádu nadměrně aktivovaného RAAS – ACE inhibitory (ACEI – inhibitory enzymu konvertujícího angiotenzin – inhibují proteázu ACE) a blokátory angiotenzinogenového receptoru typu 1 – nazývané také sartany. Nadějně vypadající skupina přímých inhibitorů reninu byla stažena z běžné praxe pro výskyt vedlejších účinků hlavně na ledvinné funkce a ze stejného důvodu není doporučována kombinace sartanů a ACEI. Běžně používané betablokátory vedou jen k neúplné inhibici systému RAAS.
Patofyziologický podklad blokády RAAS – rozdíly mezi sartany a ACE
Inhibice osy RAAS pomocí inhibitorů ACE a sartanů se v některých patofyziologických aspektech liší, účinek sartanů, a ACEI není proto plně srovnatelný.
Hlavní rozdíly jsou v následujících bodech:
- Proteáza ACE vedle konverze angiotenzinu I(Ang I) na angiotenzin II (Ang II) omezuje též degradaci důležitého vazodilatačního a natriuretického peptidu – bradykininu (obr. 1). Působením ACEI se zvýší nabídka bradykininu s aktivací jeho receptoru. Antihypertenzní účinek ACEI je ve srovnání se sartany mírně výraznější a tento jev se může podílet na rozdílné účinnosti na kardiovaskulární (KV) systém [1].
- Obě lékové skupiny ACE a sartany rozdílně ovlivňují hladiny Ang I, která je vysoká při léčbě ACEI, a hladiny Ang II zvyšující se naopak po podání sartanů. Vzhledem k tomu, že oba angiotenziny jsou metabolizovány na řadu dalších biologicky aktivních peptidů, je i tento aspekt významný. Angiotenzin konvertující enzym 2 (ACE 2) vede k přeměně Ang II na Ang (1 – 7) a k přeměně Ang I na Ang (1 – 9). Ang (1 – 7) je heptapeptid, který má vazodilatační, antifibrotický a natriuretický účinek. ACE 2 není blokován ACEI. Rozdílný farmakodynamický účinek sartanů a ACEI tak může být podmíněn stimulací receptorů pro Ang II typu AT2 (zprostředkující vazodilataci a mitogenní účinek) a AT3 (stimulující aktivaci trombocytů) a působením Ang (1 – 7) při použití sartanů [2].
- Mechanizmem účinku sartanů je účinnější blokáda receptorů Ang II (AT1). Konverze Ang Ina Ang II je zprostředkována vedle ACE též nespecifickými tkáňovými proteázami (katepsin, chymáza – tzv. alternativní cesta RAAS systému) a za patologických stavů význam nespecifických tkáňových proteáz roste. Aktivují se zpětné vazby vedoucí k vyšší produkci reninu a jeho vazbám na ledvinné receptory.
Image 1. Schéma RAAS systému – klasická, alternativní cesta a bradykininový systém. 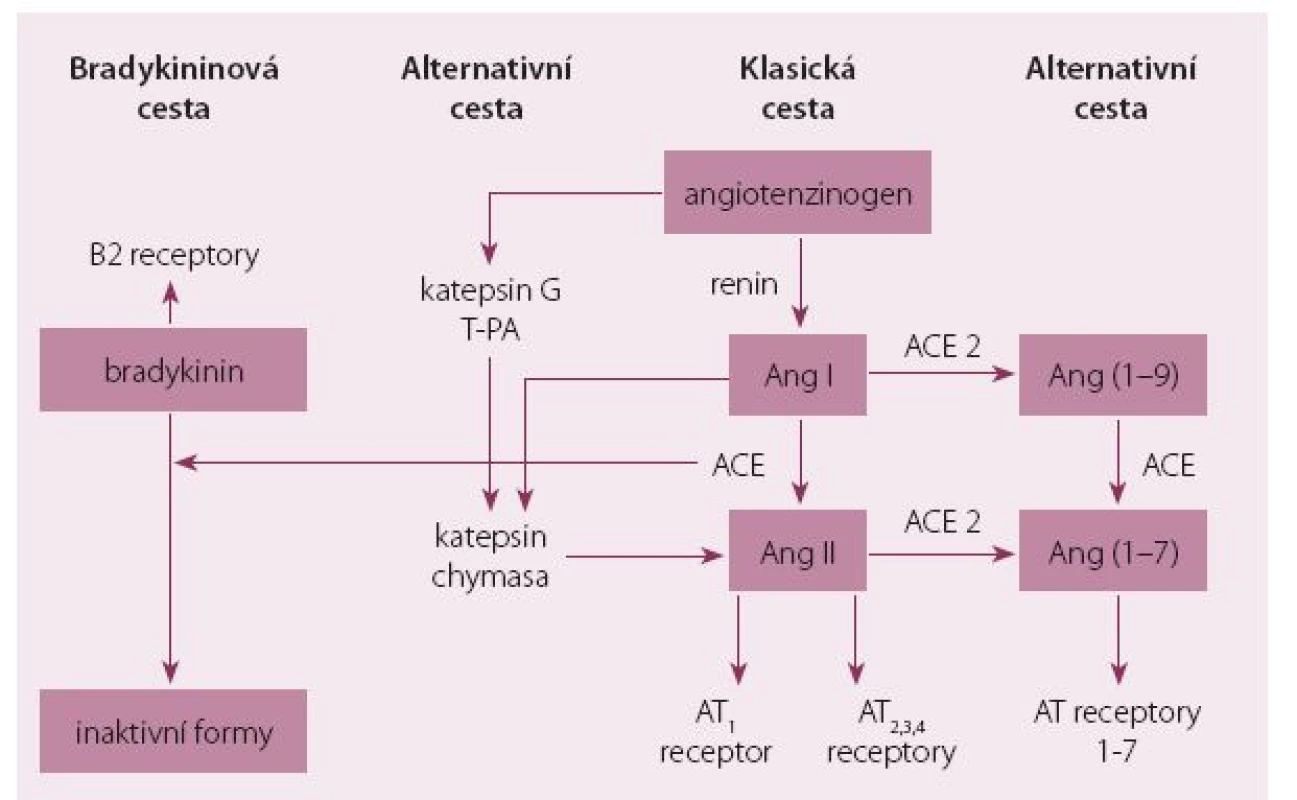
Obecně má inhibice RAAS kardio - a nefroprotektivní vliv, i když z farmakologického pohledu je jasné, že tyto dvě lékové skupiny mají odlišný vliv na řadu biologických ukazatelů. I tím může být ovlivněn výsledek léčby (tab. 1). Na základě prací sledujících antihypertenzní účinek farmakoekvivalentních dávek sartanů a ACEI bylo konstatováno, že díky zvýšení nabídky natriureticky a vazodilatačně působícímu bradykininu jsou ACEI na snížení TK i na úpravu endoteliální dysfunkce mírně účinnější.
Table 1. Ovlivnění jednotlivých složek RAAS ACE inhibitory a sartany. 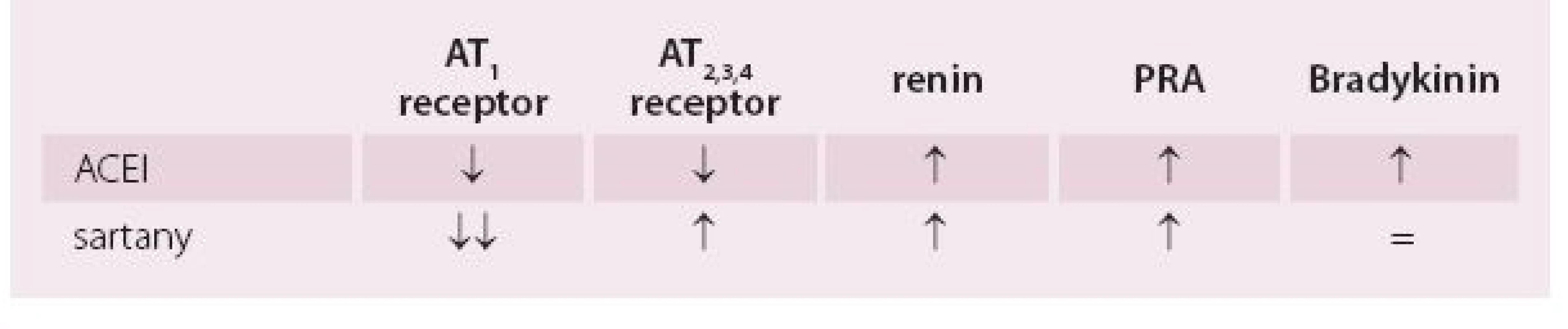
Z pohledu praktického klinického použití jsou obě skupiny dle doporučených postupů při léčbě hypertenze rovnocenné. Také při použití v indikaci sekundární prevence aterosklerózy jsou ACEI a sartany považovány za rovnocenné. Výsledky klinických studií v indikaci prevence či zpomalení progrese diabetické i nediabetické nefropatie jsou u obou skupin srovnatelné, i když v některých studiích vedla léčba sartany ke snížení renálních funkcí ve srovnání s placebem. U chronického srdečního selhání (SS) jsou výhodnější ACEI a sartany indikujeme pouze při nemožnosti podat ACEI. Doklady o příznivém vlivu sartanů na mortalitu a morbiditu jsou u chronického SS výrazně menší (studie ELITE II, VALHEFT, CHARM).
Blokáda RAAS u nemocných s hypertenzí a nemocných s vysokým rizikem aterosklerózy nebo jejími komplikacemi
Obě lékové skupiny, jak ACEI, tak sartany, jsou mezi pěti základními lékovými skupinami, které byly Evropskou i Českou hypertenzní společností označeny jako léky první volby v léčbě hypertenze, a jsou používány při zahájení léčby u velké části nemocných.
Největší studie ONTARGET porovnávající ACEI ramipril a zástupce ze skupiny sartanů telmisartan u 25 000 nemocných s manifestním KV onemocněním nebo u vysoce rizikových nemocných nezjistila žádné rozdíly v KV a celkové mortalitě mezi ramiprilem a telmisartanem [3]. Sartany měly zcela srovnatelnou účinnost s ACEI s výhodou menšího výskytu vedlejších účinků a lepší compliance. Studie LIFE byla jedinou, která prokázala výhody sartanů (losartan) oproti jiné aktivní léčbě hypertenze, i když zde byla léčba losartanem srovnávána oproti nedostatečně dávkovanému atenololu a řada nemocných léčených losartanem měla diuretikum [4]. Ve studii VALUE nebyl zjištěn rozdíl v účinnosti valsartanu nebo amlodipinu na KV ukazatele, sekundární parametr výskyt infarktu myokardu (IM) byl mírně vyšší u skupiny léčené valsartanem [5]. Teprve metaanalýza vlivu sartanů z roku 2011 vyvrátila podezření, že u nemocných léčených sartany může být vyšší výskyt IM [6]. Také další randomizované klinické studie srovnávající vliv placeba + běžné ostatní léčby oproti sartanům nemají příliš povzbuzující výsledky (tab. 2).
Table 2. Přehled randomizovaných studií s placebem + ostatní běžnou léčbou oproti některému typu sartanu. 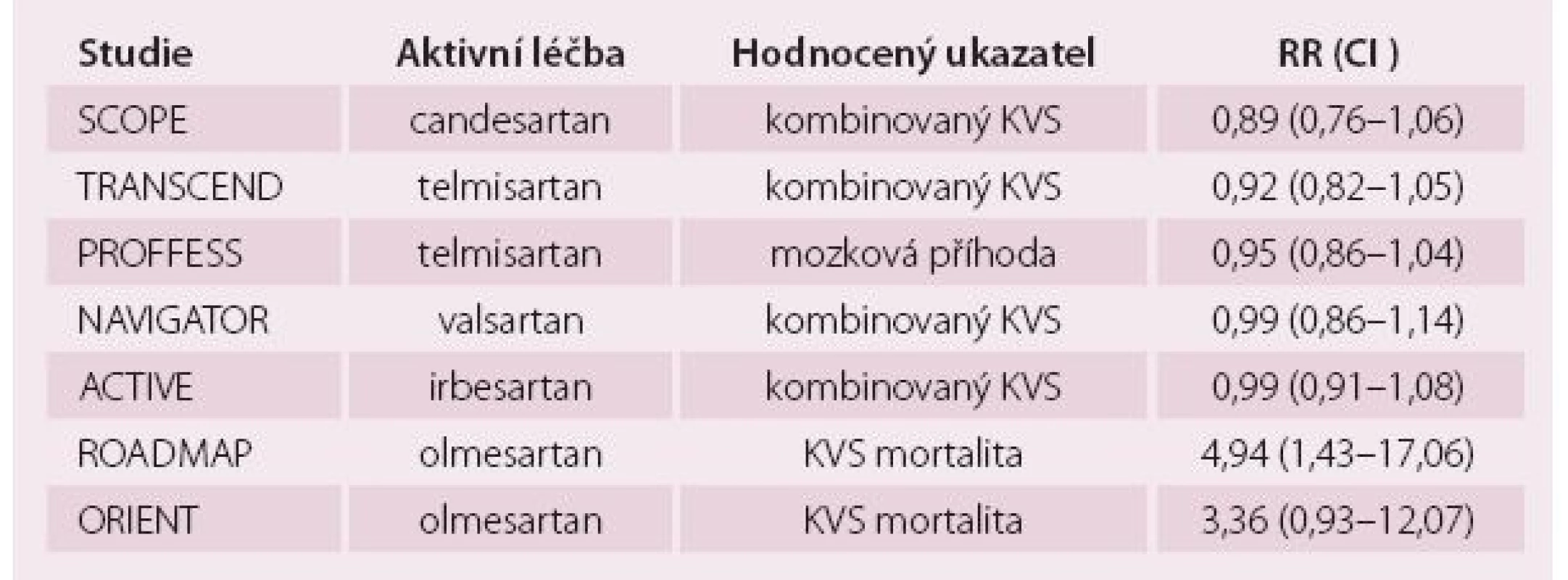
KVS – kardiovaskulární ukazatel, RR – relativní riziko Van Varková et al v roce 2012 provedli metaanalýzu u více než 150 000 pacientů s léčenou hypertenzí v klinických studiích provedených po roce 2000. Zjistili, že ke snížení celkové mortality vede jen léčba ACEI (o 5 % oproti kontrolní skupině, která měla placebo ve 33 %, a ostatní léčeni jinými antihypertenzivy). KV mortalita se snížila o 7 %. U sartanů nebylo snížení statisticky významné a celková mortalita nebyla ovlivněna, i když rozdíl mezi oběma lékovými skupinami nedosahoval statistické významnosti [7]. Této metaanalýze je vytýkáno především nezahrnutí některých, z pohledu sartanů zásadních studií, jako je např. studie ONTARGET.
Savarese et al v roce 2013 provedli další metaanalýzu 26 randomizovaných studií více než 100 000 pacientů u vysoce rizikových pacientů bez SS. Jak ACEI, tak sartany snižovaly kombinovaný cílový ukazatel (IM, cévní mozkové příhody (CMP) a KV mortalitu), snížily výskyt CMP a nově vzniklý DM. Celkovou mortalitu a výskyt IM však snižovaly jen ACEI [8]. Porovnávané soubory nemocných mezi oběma lékovými skupinami ovšem nebyly homogenní, proto srovnání v této metaanalýze má jen omezenou výpovědní hodnotu pro praxi. Autoři proto považují sartany za cennou alternativu pro pacienty nesnášející ACEI. Jsou tyto údaje přenostitelné také na nemocné s diabetes mellitus?
Blokáda RAAS u diabetiků s hypertenzí
Studie MEDINA provedená českými autory ukázala, že asi 4/ 5 diabetiků s hypertenzí potřebují k dosažení cílových hodnot TK kombinaci antihypertenziv [9]. Experimentální práce ukázaly, že blokátor systému RAAS by měl být vždy součástí kombinace vzhledem k jeho výjimečnému nefroprotektivnímu účinku. Dochází k dilataci především eferentních arteriol, klesá proteinurie a zpomaluje se progrese diabetické nefropatie. Příznivě ovlivňuje centrální aortální tlak spojený se změnami tuhosti cév, které jsou u diabetiků silně vyjádřeny. Inhibitory RAS systému jsou metabolicky neutrální a v experimentu mají kromě svého hypotenzního účinku ještě další příznivé vlastnosti, které se mohou podílet na jejich protektivních vlastnostech. Studie Ravida et al ukázala, že diabetici s proteinurií i při normálních hladinách TK mají prospěch z dlouhodobé léčby enalaprilem [10]. Nefroprotektivita u diabetiků 2. typu byla následně v roce 2000 v klinické studii prokázána pro ACEI [11] a později i pro losartan [12], irbesartan [13] a valsartan. Blokáda RAAS snižuje inzulinovou rezistenci, která je patofyziologickým podkladem metabolického syndromu a diabetu 2. typu [14]. Předpokládaným mechanizmem je zlepšení perfuze svalstva a pankreatických buněk a také přímý vliv Ang II na pankreatické betabuňky v rámci lokálního RAAS pankreatu.
Otázka, zda u nemocných s hypertenzí a DM jsou výhodnější ACEI nebo blokátory A1 receptorů, je zatím nezodpovězena. Nebyla provedena žádná randomizovaná studie na diabetické populaci zabývající se touto otázkou, všechna data máme jen z analýzy podskupin nemocných. Obě lékové skupiny – ACEI a sartany – mají pravděpodobně stejný vliv na prevenci vzniku DM, jak ukazují dvě velké metaanalýzy. Ve srovnání s diuretiky se incidence nově vzniklého DM snížila o 20 – 30 %. Jejich vliv na snížení KV ukazatelů a celkové mortality se nezdá tak homogenní, jak bychom mohli usuzovat z preklinických a experimentálních studií. V roce 2014 byla uveřejněna metaanalýza 35 studií, která posoudila zvláště vliv ACEI a sartanů na celkovou mortalitu, KV úmrtí a větší KV příhody u pacientů s DM [15]. Primárním cílem metaanalýzy byl vliv ACEI a sartanů na celkovou mortalitu, KV úmrtí a KV příhody. Do metaanalýzy byly zařazeny jen klinické studie trvající nejméně 12 měsíců s podskupinami diabetiků. Celkem u 32 827 nemocných v 23 z 35 nalezených studií se porovnával vliv ACEI oproti placebu nebo jiné aktivní léčbě. Celkem 13 studií porovnalo sartany s kontrolami bez léčby u 23 867 pacientů. ACEI snížily celkovou mortalitu o 13 %, KV mortalitu o 17 % a velké KV příhody jako KV úmrtí, nefatální IM, CMP a revaskularizace myokardu nebo SS více než sartany, jak ukazuje obr. 2.
Image 2. Výsledky metaanalýzy Chenga et al srovnávající relativní změny při léčbě hypertoniků s DM pomocí ACE inhibitorů a sartanů [15]. ![Výsledky metaanalýzy Chenga et al srovnávající relativní změny při léčbě hypertoniků s DM pomocí ACE inhibitorů a sartanů [15].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/928f677e7c12313cfdccd37d318686b9.jpg)
V porovnání s jinými antihypertenzivy nesnížily výrazněji riziko CMP u diabetiků ani ACEI ani sartany. Metanalýza má své slabé stránky – porovnávané klinické studie s ACEI a sartany nejsou ekvivalentní – skupina ACE studií byla mnohem větší než skupiny léčené sartany (23 oproti 13) s více nemocnými (32 827 oproti 23 867). Také charakteristika a stupeň rizika nemocných byl v jednotlivých studiích různý. U nemocných s vyšší hodnotou TK a s vyšším KV rizikem je vliv léčby aktivní látkou samozřejmě větší a výsledky přesvědčivější. Je také možné, že u nemocných s méně pokročilou formou onemocnění můžeme více ovlivnit průběh onemocnění než u nemocných s pokročilou formou onemocnění (podobný jev je znám z diabetologie). Obě lékové skupiny – ACEI a sartany – nejsou homogenní, obě skupiny mají různé zástupce s odlišnými farmakokinetickými i farmakodynamickými vlastnostmi. Metaanalýzy předpokládají „class efekt“ lékových skupin, nicméně jak jednotlivé ACEI, tak sartany mají velmi rozdílné vlastnosti. Také uspořádání klinických studií v obou skupinách bylo odlišné – různé cílové hodnoty TK, různá taktika léčby, různé věkové složení nemocných apod. Studie s ACEI jsou z let 1992 – 2005, studie ze sartany z let 2001 – 2011. Většina nemocných s DM vyžaduje vícečetnou antihypertenzní medikaci, ta byla na konci minulého tisíciletí jiná než o deset let později. Také vyšší procento nemocných bylo léčeno statiny a prokazovat větší účinnost léčby u nemocných s dokonalejší léčbou rizikových faktorů je těžší než u nemocných méně intenzivně léčených. Metaanalýzy také mohou zahrnovat klinické studie, kde bylo selhání aktivní léčby způsobeno neadekvátním uspořádáním studie a nikoli selháním testovaného léku. Porovnání dvou lékových skupin na základě metaanalýz je nespolehlivé a přednost jedné z lékových skupin lze prokázat pouze v randomizované zaslepené studii [16].
Výsledky metaanalýzy ukazují, že lékem první volby u diabetiků by měly být ACEI, které jsou také výhodnější u nemocných se SS či po překonané KV či CMP. Menší účinnost sartanů v některých indikacích je vyvážena jejich lepší snášenlivostí, zejména významně nižší je výskyt kašle a angioedému, což vede ke zlepšení compliance k léčbě s méně častým přerušením léčby.
Dvojitá blokáda RAAS
Do kombinované léčby ACEI a sartany u nemocných s DM a hypertenzí se vkládaly velké naděje vzhledem k popisovanému pozitivnímu vlivu blokády RAAS na proteinurii. Některé menší práce ukázaly, že přidání sartanu k ACEI je lepší než zdvojnásobení dávky ACEI. Velká randomizovaná studie s touto kombinací u nemocných normoalbuminurických nebo mikroalbuminurických (ONTARGET) měla neutrální výsledek s nárůstem vedlejších účinků, studie u nemocných s proteinurickou diabetickou nefropatií (VA NEPHRON a ALTITUDE) byly předčasně ukončeny z důvodu nárůstu hyperkalemie a akutního poškození ledvin, resp. z nárůstu mozkových příhod ve větvi s kombinační léčbou RAAS systému. Všechny výše uvedené studie jsou ale napadány hlavně nefrology kvůli metodologickým nedostatkům těchto klinických studií. Věk nemocného, stupeň hypertenze, množství proteinurie a sekvence léčby (nejprve léčba ACEI a posléze přidání sartanů) jsou pravděpodobně zásadními parametry při výběru této léčby a v klinických studiích nebyly dle kritiků tyto parametry zcela zohledněny. Svoji roli sehrává u diabetiků i přítomnost autonomní dysfunkce. Myšlenka co nejúčinnější blokády RAAS kombinační léčbou nebyla opuštěna. Někteří se domnívají, že u mladších nemocných s vyššími hodnotami TK s proteinurií nemusí být tato léčba nepříznivá. Nedávno vyšla metaanalýza 157 randomizovaných studií u 43 256 nemocných s chronickým onemocněním ledvin a DM a výsledky duální kombinace RAAS se nezdají tak špatné, jak se jeví při pohledu na velké randomizované studie [17]. Nejlepší nefroprotektivní potenciál měla kombinace inhibitorů RAAS a sartanů (snížení relativního rizika o 38 %, na druhém místě monoterapie sartany (o 23 %). Účinek byl nezávislý na TK. Žádná kombinace nezlepšila oproti placebu celkovou mortalitu. Hyperkalemie a akutní poškození ledvin se vyskytovaly v menší míře. Dle odhadů z této metaanalýzy by se na 1 000 nemocných léčených kombinací ACEI a sartany po dobu jednoho roku zabránilo třem selháním ledvin a zlepšila by se albuminurie u 90 nemocných. Vzniklo by ale 38 případů akutního poškození ledvin a 65 případů hyperkalemie. Menší metaanalýza španělských autorů zahrnující devět klinických studií s 11 543 nemocnými ukázala neutrální vliv na mortalitu s nárůstem výskytu hyperkalemie a hypotenze, bez zvýšeného výskytu akutního poškození ledvin [18]. K podobným výsledkům došla i metaanalýza dvojité blokády RAAS u nemocných s chronickým onemocněním ledvin [19].
doc. MU Dr. Jiří Špác, CSc.
www.fnusa.cz
jiri.spac@fnusa.cz
Doručeno do redakce: 19. 1. 2016
Přijato po recenzi: 3. 2. 2016
Sources
1. Ceconi C, Francolini G, Olivares A et al. Angiotensin-converting enzyme (ACE) inhibitors have different selectivity for bradykinin binding sites of human somatic ACE. Eur J Pharmacol 2007; 577 : 1 – 6.
2. Crackower MA, Sarao R, Oudit GY et al. Angiotensin-converting enzyme 2 is an essential regulator of heart function. Nature 2002; 417 : 822 – 828.
3. Yusuf S, Teo KK, Pogue J et al. The ONTARGET Investigators. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008; 358 : 1547 – 1559. doi: 10.1056/ NEJMoa0801317.
4. Lindholm LH, Ibsen H, Dahlöf B et al. Cardiovascular morbidity and mortality in patients with diabetes in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet 2002; 359 : 1004 – 1010.
5. Julius S, Kjeldsen SJ, Weber M et al. The VALUE Trial Group. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial. Lancet 2004; 363 : 2022 – 2031.
6. Bangalore S, Kumar S, Wetterslev J et al. Angiotensin receptor blockers and risk of myocardial infarction: meta-analyses and trial sequential analyses of 147,020 patients from randomised trials. BMJ 2011; 342: d2234. doi: 10.1136/ bmj.d2234.
7. van Vark LC, Bertrand M, Akkerhuis KM et al. Angiotensin-converting enzyme inhibitors reduce mortality in hypertension: a meta-analysis of randomized clinical trials of renin-angiotensin-aldosterone system inhibitors involving 158,998 patients. Eur Heart J 2012; 33 : 2088 – 2097. doi: 10.1093/ eurheartj/ ehs075.
8. Savarese G, Constanzo P, Cleland JG et al. A meta-analysis reporting effects of angiotensin-converting enzyme inhibitors and angiotensin receptor blockers in patiens without heart failure. J Am Coll Cardiol 2013; 61 : 131 – 142. doi: 10.1016/ j.jacc.2012.10.011.
9. Špinar J, Vítovec J, Souček M. Anti-hypertensive strategies in patients with MEtabolic parameters, DIabetes mellitus and/ or NephropAthy (the MEDINA study). Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2013; 158 : 412 – 421. doi: 10.5507/ bp.2013.053.
10. Ravid M, Land R, Rachmani R et al. Long term renoprotective effect of angiotensin-converting enzyme inhibition in non-insulin-dependent diabetes mellitus: a 7 - year follow-up study. Arch Intern Med 1996; 156 : 286 – 289.
11. The Heart Outcomes Prevention Evaluation Study Investigators. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICRO-HOPE substudy. Lancet 2000; 355 : 253 – 259.
12. Brenner BM, Cooper ME, de Zeeuw D et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001; 345 : 861 – 869.
13. Lewis EJ, Hunsicker LG, Clarke WR et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 345 : 851 – 860.
14. Jandeleit-Dahm KA, Tikellis C, Reid CM et al. Why blockade of the renin-angiotensin system reduces the incidence of new-onset diabetes. J Hypertens 2005; 23 : 463 – 443.
15. Cheng J, Zhang W, Zhang X et al. Effect of angiotensin-converting enzyme inhibitors and angiotensin ii receptor blockers on all-cause mortality, cardiovascular deaths, and cardiovascular events in patiens with diabetes mellitus: a meta-analysis. JAMA Intern Med 2014; 174 : 773 – 785. doi: 10.1001/ jamainternmed.2014.348.
16. Václavík J, Slíva J. Inhibitory ACE, nebo sartany v léčbě hypertenze: zbytečná diskuze. Cor Vasa 2014; 56 : 477 – 479.
17. Palmer SC, Mavridis D, Navarese E et al. Comparative efficacy and safety of blood pressure-lowering agents in adults with diabetes and kidney disease: a network meta analysis. Lancet 2015; 385 : 2047 – 2056. doi: 10.1016/ S0140-6736(14)62459-4.
18. Catala Lopez F, Macias Saint-Gerons D. Diabetes mellitus and risks of dual blockade of the renin-angiotensin-aldosterone system. Rev Esp Cardiol 2013; 66 : 403 – 415. doi: 10.1016/ j.rec.2012.11.010.
19. Susantitaphong P, Sewaralthahab K, Balk EM et al. Efficacy and safety of combined vs. single renin-angiotensin - aldosterone system blockade in chronic kidney disease: a meta-analysis. Am J Hypertens 2013; 26 : 424 – 441. doi: 10.1093/ ajh/ hps038.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2016 Issue 1-
All articles in this issue
- Infekční komplikace u pacientů s akutním srdečním selháním – přehled
- Přidružená onemocnění a jejich význam pro prognózu akutního srdečního selhání – AHEAD score
- Tělesný trénink a rehabilitace u srdečního selhání
- Kardiálna kachexia
- Kvalita života pacientů s akutní dekompenzací chronického systolického srdečního selhání hodnocená pomocí standardizovaných dotazníků
- Hyperurikémia, kardiovaskulárne choroby a srdcové zlyhávanie
- Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní
- Místo sitagliptinu v léčbě pacientů s diabetem 2. typu po studii TECOS
- Na jaké hodnoty snižovat systolický krevní tlak? Studie SPRINT
- Evropský konsenzus k otázkám aterogenní dyslipidemie a kombinační léčbě statinem a fibrátem
- Inhibitory protonové pumpy – nové molekuly, nové poznatky
- Nové pohledy na patofyziologii, diagnostiku a léčbu srdečního selhání se zachovanou ejekční frakcí
- Jak nejlépe blokovat renin-angiotenzinový systém u nemocných s hypertenzí a diabetes mellitus?
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Inhibitory protonové pumpy – nové molekuly, nové poznatky
- Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní
- Kardiálna kachexia
- Hyperurikémia, kardiovaskulárne choroby a srdcové zlyhávanie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

