-
Medical journals
- Career
Srdeční zástava a poresuscitační péče
Authors: A. Krüger
Authors‘ workplace: Kardiocentrum, Nemocnice Na Homolce, Praha
Published in: Kardiol Rev Int Med 2015, 17(3): 230-233
Category: Cardiology Review
Overview
K oběhové zástavě mimo nemocnici dochází u 35 – 40 jedinců na 100 000 obyvatel za rok, srdeční zástava v nemocnici nastane v 1 – 5 případech z 1 000 hospitalizací. Šance na přežití do propuštění nemocného je cca 10 % u zástavy mimo nemocnici, u fibrilace komor jakožto primárního rytmu je tato šance řádově dvojnásobná. U oběhových zástav v nemocnici je přežití o něco málo vyšší, tedy 15 – 20 %, u defibrilovatelných rytmů (fibrilace komor, komorová tachykardie) až 25 %. Co nejdříve zahájená kardiopulmonální resuscitace spolu s kvalitní poresuscitační péčí přestavuje základní předpoklad pro přežití pacienta s dobrým neurologickým výsledkem.
Klíčová slova:
oběhová zástava – mírná terapeutická hypotermie – extrakorporální resuscitace
Jako kardiopulmonální resuscitaci (KPR) označujeme souhrn úkonů směřujících k neprodlenému obnovení oběhu okysličené krve u jedince, u kterého došlo k zástavě dechu a/ nebo oběhu. KPR je prvním předpokladem záchrany pacienta s dechovou či oběhovou zástavou. Nezbytným krokem k záchraně života po srdeční zástavě je co nejdříve zahájená zevní srdeční masáž a obnovení vlastní spontánní cirkulace. Šance na přežití je dána celkovým stavem nemocného před vlastním incidentem v podobě srdeční zástavy, dále časem, kdy je zahájena laická resuscitace (včetně její efektivity), co nejrychlejší defibrilací u defibrilovatelných rytmů a v neposlední řadě komplexní poresuscitační péčí. Postupy vedoucí k přežití pacienta s oběhovou zástavou jsou zahrnuty v pomyslném „řetězci přežití“ tvořeném čtyřmi kruhy, z nichž první představuje časné rozpoznání kritické situace a časné přivolání kvalifikované pomoci, druhý časně zahájenou KPR, třetí časnou defibrilaci a čtvrtý poresuscitační péči. Vzhledem k tomu, že oběhová zástava je nejčastěji primárně kardiální příčiny (> 80 %), je kladen důraz na účinnou a nepřerušovanou zevní srdeční masáž a časnou defibrilaci (obr. 1).
Image 1. Řetězec přežití (European Resuscitation Council Guidelines for Resuscitation 2005). 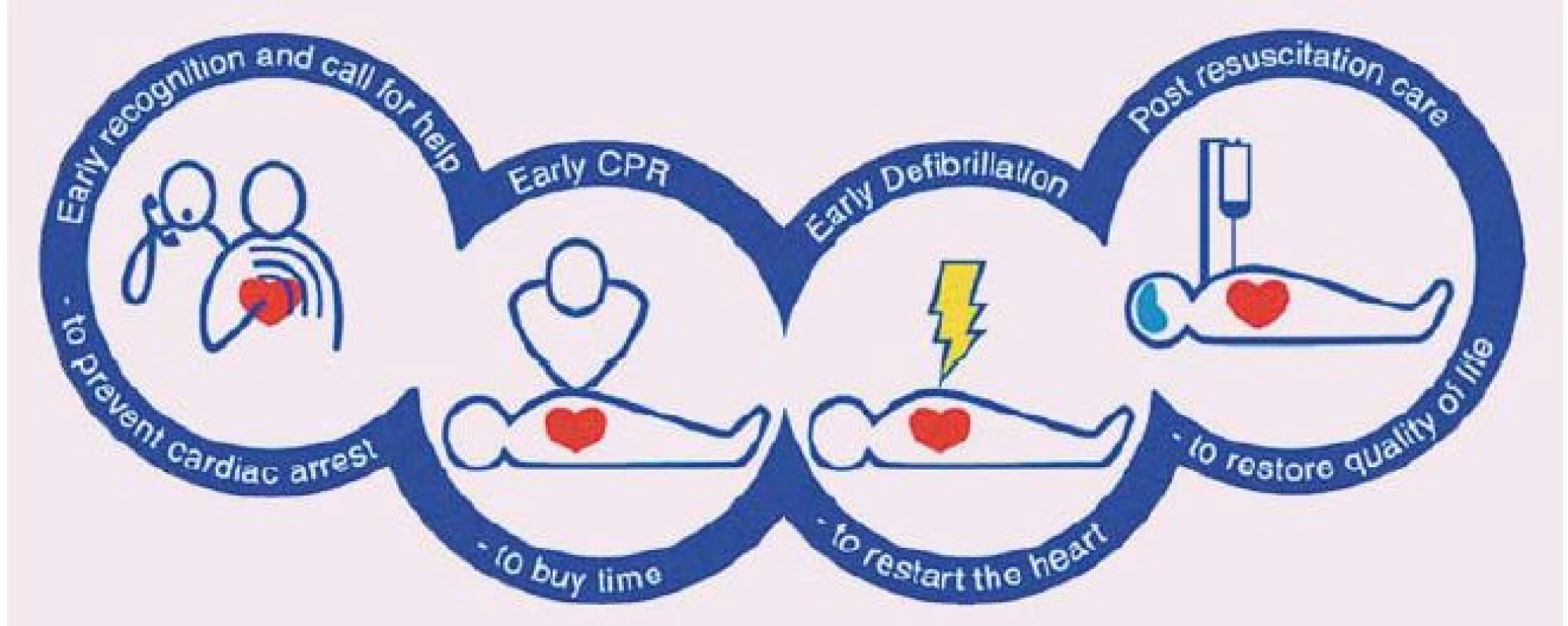
Mezi základní KPR patří známé A, B, C – tedy zajištění dechových cest (A – airway), dýchání (B – breathing), cirkulace (C – circulation); dále rozšířená KPR prováděná již školenými záchranáři D, E, F – aplikace léků (D – drugs), natočení EKG (E), podání tekutin (F – fluids). Telefonicky asistovaná neodkladná resuscitace (TANR) je telefonická instruktáž volajících k provádění kvalitní neodkladné resuscitace a v zajištění optimální organizace na místě vzniku události. Každá jedna minuta zpoždění defibrilace snižuje šanci na přežití cca o 10 %.
V poslední době se rozšiřuje používání systémů na automatickou srdeční masáž, které umožňují efektivně provádět zevní srdeční masáž a popřípadě převézt takového nemocného za kontinuální masáže do specializovanějšího centra s možností akutní koronarografie a v některých případech třeba i s možností aplikace ECLS (extracorporeal life support) u nemocných s refrakterní srdeční zástavou.
Se zevním automatickým systémem Lucas (Physio ‑ Control, Lund, Sweden) proběhla poměrně velká studie LINC (Lucas IN Cardiac arrest), která srovnávala tento systém s manuální kompresí hrudníku u pacientů v oběhové zástavě mimo nemocnici (obr. 2). Primárním cílovým ukazatelem bylo přežití v prvních čtyřech hodinách, sekundárním endpointem šestiměsíční přežití s dobrým neurologickým výsledkem. Do studie bylo v letech 2008 – 2013 zařazeno celkem 2 589 pacientů. V obou skupinách (mechanická vs. manuální komprese) nebyl zjištěn významný rozdíl jak ve čtyřhodinovém (23,6 vs. 23,7 %), tak v šestiměsíčním (8,5 vs. 7,6 %) přežití. Výsledky této studie tedy deklarovaly noninferioritu tohoto zevního masážního systému ve srovnání s manuální kompresí hrudníku [1]. Zásadním přínosem těchto systémů (i když zatím neověřeným ve velkých klinických studiích) je potom možnost při pokračující resuscitaci provádět za kontinuální srdeční masáže skiaskopii, koronarografii a případně koronární intervenci, což v případě manuální srdeční masáže možné není.
Image 2. Zevní automatický masážní systém Lucas. 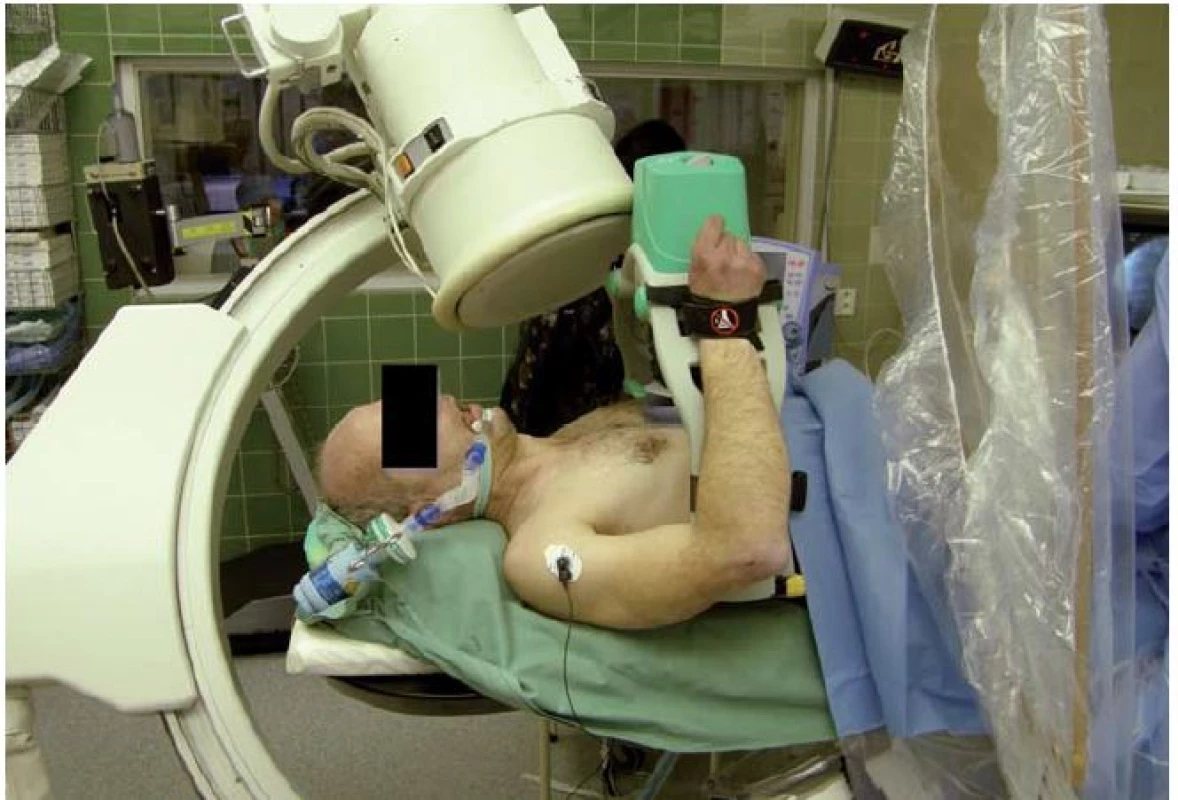
Image 3. ECLS (extracorporeal life support), schéma zapojení (vlevo), krevní pumpa Levitronix s oxygenátorem (vpravo). 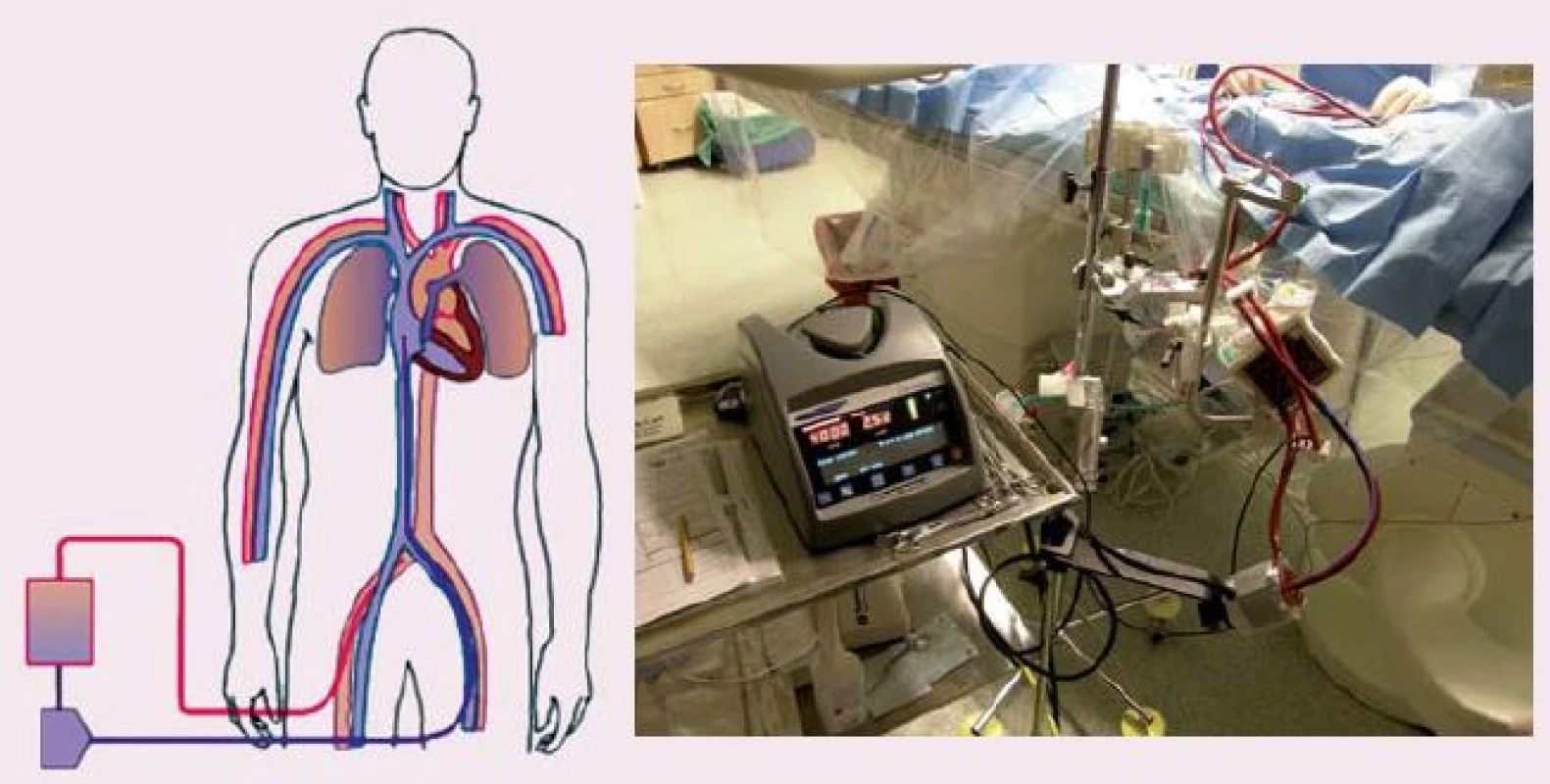
ECLS představuje metodu, která je schopna kompletně nahradit funkci srdce a plic (obr. 3). Je možné zvládnout i tak závažný stav, jako je srdeční zástava refrakterní ke standardní KPR, a tím zvýšit šanci na přežití. Jedná se o akutní zavedení mimotělního oběhu, kdy nasáváme žilní neokysličenou krev z pravé síně, odkud je krevní pumpou vháněna do oxygenátoru, zde dochází k výměně plynů a již okysličená krev se vrací zpět do velkých tepen. Použití ECLS za kardiopulmonální resuscitace bylo opakovaně publikováno v rámci nerandomizovaných studií, většinou jako jednotlivé případy nebo v podobě malých souborů. Jsou práce, které ukazují přínos použití ECLS i u srdeční zástavy v nemocnici [2 – 4].
Vysoká úmrtnost pacientů, ke které i po obnovení cirkulace dochází, je způsobena patofyziologickým procesem, který vede k postižení mnoha orgánů, tzv. ischemicko‑reperfuzním poškozením. Tento stav bývá v klinické praxi označován jako „postresuscitační nemoc“ nebo též jako „post cardiac arrest syndrome“ (PCAS). Pochody podílející se na PCAS zahrnují čtyři komponenty: I. poškození mozku, II. dysfunkci myokArdu, III. systémovou ischemicko‑reperfuzní reakci a IV. perzistující základní onemocnění. Závažnost těchto stavů po obnovení cirkulace se u jednotlivých nemocných liší a závisí na intenzitě ischemického poškození, na příčině srdeční zástavy a předchozím stavu pacienta.
Velmi často je možno diagnostikovat akutní koronární syndrom; akutní infarkt byl diagnostikován ve více než 50 % případů, plicní embolie se vyskytuje až u 10 % případů srdeční zástavy. Primární plicní onemocnění, jako např. chronická obstruktivní plicní choroba, astma či pneumonie, mohou vést k respiračnímu selhání a srdeční zástavě. Je‑li srdeční zástava způsobena respiračním selháním, bývá po obnovení cirkulace plicní funkce zhoršena. Redistribuce krve v plicním řečišti může vést k plicnímu edému nebo alespoň zvýšit alveolo ‑ arteriální kyslíkový gradient. Některé příčiny srdeční zástavy, jako např. předávkování léky a intoxikace, vyžadují specifický přístup; ten musí být koordinován se specifickou podporou kardiovaskulárního a nervového systému.
V posledních letech bylo vyvinuto značné úsilí na zlepšení výsledků léčby nemocných po srdeční zástavě, většina testovaných terapeutických intervencí však nebyla spojena se zlepšením výsledků léčby. Jeden z mála postupů, u kterých bylo prokázáno, že zlepšují prognózu pacientů po srdeční zástavě, je mírná terapeutická hypotermie. Dvě randomizované klinické studie a jejich metaanalýza ukázaly, že mírná hypotermie vede ke zlepšení výsledků u pacientů, kteří zůstávali v bezvědomí po resuscitaci pro srdeční zástavu [5,6]. Zdá se, že úspěch hypotermie v ovlivnění ischemicko‑reperfuzního poškození spočívá v jejím příznivém působení na řadu paralelně probíhajících procesů.
V rámci léčby poresuscitačního syndromu se snažíme o časnou koronární reperfuzi, kontrolu teploty (mírná terapeutická hypotermie), optimalizaci hemodynamiky a výměny plynů a v neposlední řadě i neurologickou diagnostiku a prognostifikaci nemocného.
Časná koronární reperfuze
Metodika rozhodování o správním načasování koronarografie zahrnuje natočení dvanáctisvodového EKG. V případě průkazu akutního infarktu myokardu s elevacemi ST úseku nebo blokádou levého raménka Tawarova (STEMI) je indikována urgentní selektivní koronarografie a případně perkutánní koronární intervence podobně jako u nemocných bez srdeční zástavy. V případě absence elevace ST úseku na EKG pokračujeme v diagnostice za použití zobrazovacích technik (ECHO, SONO hrudníku, CT hlavy/ hrudníku) a laboratorních parametrů. Na podkladě těchto údajů společně se známými anamnestickými daty se rozhodujeme o indikaci koronarografického vyšetření (obr. 4).
Image 4. Strategie indikace akutního koronarografického vyšetření (upraveno podle European Association for Percutaneous Cardiovascular Interventions, EuroIntervention; 2014). 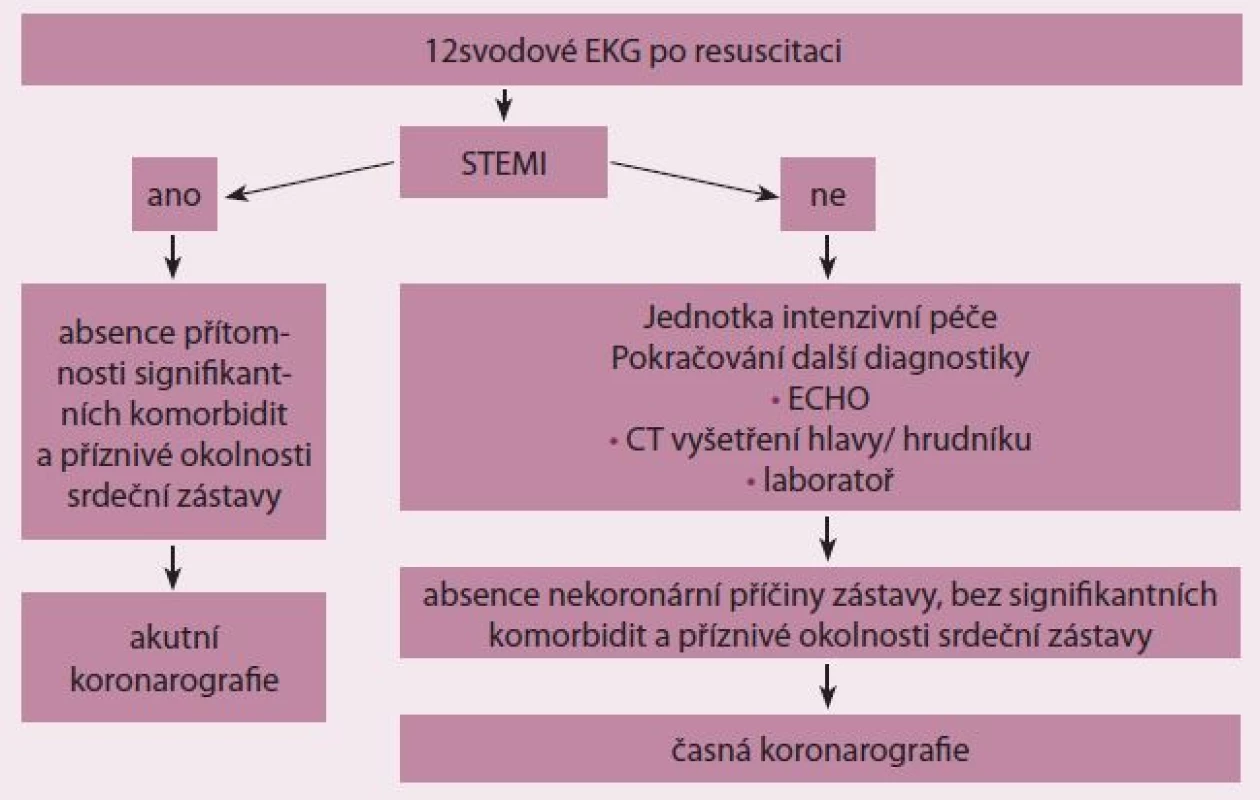
Všichni nemocní mají akutně provedené echokardiografické vyšetření, kdy se snažíme alespoň orientačně zhodnotit funkci obou komor a vyloučit zásadnější patologii na chlopních, jako např. aortální stenóza. Snažíme se vyloučit disekci typu A (mezi nepřímé echokardiografické známky patří aortální regurgitace, dilatace ascendentní aorty a perikardiální výpotek). Vylučujeme akutní cor pulmonale (plicní embolie), srdeční tamponádu či mechanickou komplikaci infarktu myokardu. Mezi standardní vstupní vyšetření patří již SONO hrudníku k posouzení patologických změn hrudníku (pneumotorax, fluidotorax, pneumonie, plicní kongesce). Všichni nemocní mají skiagram hrudníku, v některých případech je vhodné doplnění i CT vyšetření (hlava, hrudník), popřípadě bronchoskopii při podezření na aspiraci.
Kontrola tělesné teploty
Navození terapeutické mírné hypotermie patří v současné době mezi doporučené postupy u nemocných se spontánní cirkulací (ROSC) po oběhové zástavě. Kontrola teploty tělesného jádra by měla být zahájena co nejdříve – rychlé ochlazení na 33 °C, alternativně udržování centrální tělesné teploty 36 °C [7]. Primární teplotní čidlo je nejčastěji umístěno v močovém katetru, zároveň používáme sekundární (bezpečnostní) čidlo v podobě povrchového snímání teploty v axile, jícnu nebo cestou plicnicového katetru. Na našem pracovišti používáme nejčastěji endovaskulární hypotermii systémem Thermogard XP (Zoll, USA) v kombinaci s aplikací chladného fyziologického roztoku (obr. 5, graf 1). Kromě endovaskulárních systémů lze používat systémy povrchové jako ArcticSun (Medivance Incorporated, USA) nebo Blanketrol (Cinncinnatti Sub Zero, USA) či intranazální chlazení systémem RhinoChillem (Benechill Inc., San Diego, USA). Účinně chladit lze také za použití kontinuálních dialyzačních technik nebo chlazením cestou mimotělního oběhu.
Image 5. Endovaskulární hypotermie – system Thermogard. 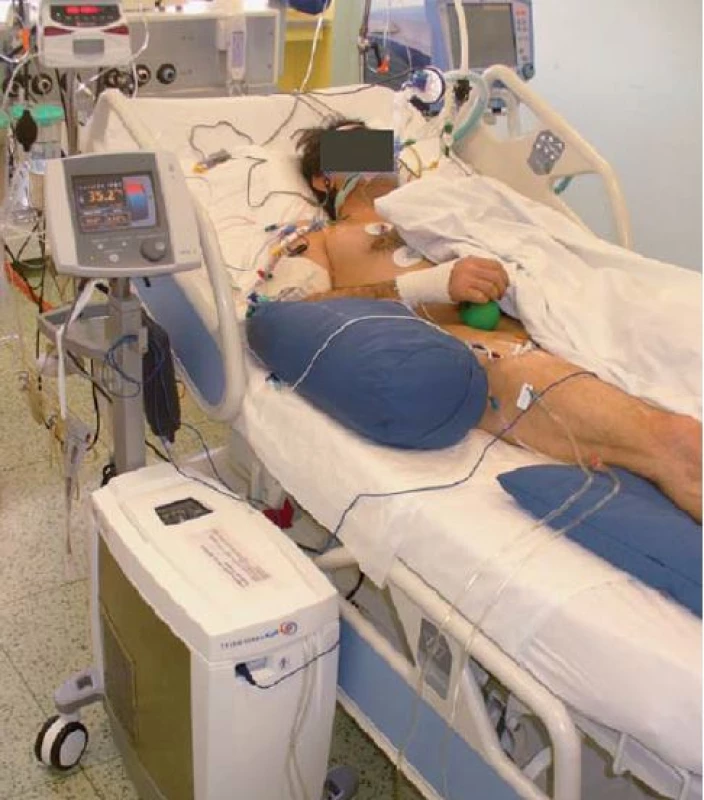
Graph 1. Grafický záznam teploty – rychlé ochlazení, udržování hypotermie, řízený ohřev a následně udržování normotermie. 
Hemodynamická stabilizace, optimalizace ventilace a oxygenace
Většina nemocných po KPR má projevy hemodynamické nestability – hypotenze, známky nízkého srdečního výdeje. Všichni nemocní mají mít zavedenou arteriální kanylu ke kontinuální monitoraci systémového tlaku a kontrole krevních plynů; dále zavádíme centrální žilní katetr k posouzení preloadu pravé komory a možnosti aplikace vazoaktivních přípravků nebo tekutin. V některých případech je vhodné monitorování plicnicových tlaků a tlaků zaklínění. Aplikací některých plicnicových katetrů či centrálního žilního katetru opatřeného optickým senzorem můžeme sledovat kontinuálně okysličení žilní krve (SvO2). Hemodynamické parametry je možné také monitorovat s pomocí echokardiografie.
Léčba křečí a myoklonální aktivity
Křeče či svalové záškuby se vyskytují přibližně u 40 % nemocných, proto je nutná sedace (propofol, midazolam, fentanyl) event. v kombinaci s myorelaxací. Většinou u těchto nemocných doplňujeme EEG vyšetření k vyloučení epileptických paroxysmů a případně k posouzení indikace léčby antiepileptiky.
Neurologická prognostifikace
V neposlední řadě se snažíme o časnou prognostifikaci nemocného pravidelným neurologickým vyšetřením, dále pomocí nejrůznějších zobrazovacích metod, jako je CT či NMR mozku, EEG (elektroencefalogram), SSEP (somatosenzorické evokované potenciály). I hodnoty některých biochemických parametrů, jako je neuronspecifická enoláza (NSE), protein S ‑ 100B či kopeptin korelují s tíží mozkového deficitu.
Závěr
Komplexní poresuscitační péče o tyto nemocné by měla být koncentrována do specializovaných center (Cardiac Arrest Centrum), která jsou schopna poskytnout všechna výše uvedená vyšetření po dobu 24 hod denně. Je zde nutná mezioborová spolupráce zahrnující kardiology, anesteziology, intenzivisty, neurology, rentgenology a další specialisty. Nezbytnou podmínkou je dostatečný počet intenzivních lůžek k zajištění těchto akutních hospitalizací.
Doručeno do redakce: 18. 8. 2015
Přijato po recenzi: 2. 9. 2015
MU Dr. Andreas Krüger
www.homolka.cz
andreas.kruger@post.cz
Sources
1. Rubertsson SE, Lindgren E, Smekal D et al. Mechanical chest compressions and simultaneous defibrillation vs conventional cardiopulmonary resuscitation in out ‑ of ‑ hospital cardiac arrest: the LINC randomized trial. JAMA 2014; 311 : 53 – 61. doi: 10.1001/ jama.2013.282538.
2. Wang CH, Chou NK, Becker LB et al. Improved outcome of extracorporeal cardiopulmonary resuscitation for out ‑ of ‑ hospital cardiac arrest ‑ a comparison with that for extracorporeal rescue for in‑hospital cardiac arrest. Resuscitation 2014; 85 : 1219 – 1224. doi: 10.1016/ j.resuscitation.2014.06.022.
3. Lin JW, Wang MJ, Yu HY et al. Comparing the survival between extracorporeal rescue and conventional resuscitation in adult in‑hospital cardiac arrests: propensity analysis of three‑year data. Resuscitation 2010; 81 : 796 – 803. doi: 10.1016/ j.resuscitation.2010.03.002.
4. Chou TH, Fang CC, Yen ZS et al. An observational study of extracorporeal CPR for in‑hospital cardiac arrest secondary to myocardial infarction. Emerg Med J 2014; 31 : 441 – 447. doi: 10.1136/ emermed ‑ 2012 ‑ 202173.
5. Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med 2002; 346 : 549 – 556.
6. Bernard SA, Gray TW, Buist MD at al. Treatment of comatose survivors of out ‑ of ‑ hospital cardiac arrest with induced hypothermia. N Engl J Med 2002; 346 : 557 – 563.
7. Nielsen N, Wetterslev J, Cronberg T et al. Target temperature management at 33 °C versus 36 °C after cardiac arrest. N Engl J Med 2013; 369 : 2197 – 2206. doi: 10.1056/ NEJMoa1310519.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2015 Issue 3-
All articles in this issue
- 25th European Meeting on Hypertension and Cardiovascular Protection, Milan 2015
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
- Novinky v koronárních intervencích
- Mnohočetné postižení věnčitých tepen diagnostikované při pPCI pro STEMI: kompletní revaskularizace nebo konzervativní léčba. Studie Prague‑ 13.
- Farmakologická a nefarmakologická léčba fibrilace síní – současný pohled
- Léčebné postupy u námahové anginy pectoris
- Srdeční zástava a poresuscitační péče
- Komentovaná zkrácená verze evropských doporučení pro diagnostiku a management akutní plicní embolie z roku 2014
- Co přinesla nová evropská guidelines pro trvalou kardiostimulaci a srdeční resynchronizační léčbu (2013) v oblasti diagnostiky arytmií pomocí dlouhodobého monitorování EKG – současné technické aspekty a typy dlouhodobého monitorování EKG
- Fixní trojkombinace antihypertenziv a subklinické orgánové poškození – kazuistika
- Studie IMPROVE‑ IT u pacientů s diabetes mellitus
- Studie TECOS – efekt sitagliptinu na kardiovaskulární příhody u diabetes mellitus 2. typu
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Srdeční zástava a poresuscitační péče
- Léčebné postupy u námahové anginy pectoris
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

