-
Medical journals
- Career
Prevence náhlé srdeční smrti u akutního infarktu myokardu
Authors: J. Bytešník
Authors‘ workplace: Odd. arytmologie na Klinice kardiologie IKEM
Published in: Kardiol Rev Int Med 2010, 12(Supplementum): 13-16
Overview
S rozvojem časné reperfuzní léčby akutního infarktu myokardu je patrný trend ke snížení výskytu náhlé srdeční smrti při uvedené diagnóze. Při určitém klinickém průběhu – zejména při srdečním selhávání – zůstává riziko náhlé smrti vysoké. V úvodní fázi koronární příhody hraje zásadní roli monitorace EKG a neodkladná zevní defibrilace komorové fibrilace, která je hlavní příčinou náhlé srdeční smrti. Zatím není k dispozici spolehlivá riziková stratifikace v časném období po akutním infarktu myokardu pro indikaci implantabilního kardioverteru-defibrilátoru. Významnou roli kromě detekce a léčby závažných arytmií hraje i účinná léčba srdečního selhávání a ochrana myokardu před sympatoadrenergní reakcí – beta-blokátory – již od časné fáze AIM.
Klíčová slova:
náhlá srdeční smrt – fibrilace komor – defibrilace – akutní koronární syndromÚvod
Přes významné pokroky v diagnostice a léčbě kardiovaskulárních onemocnění v posledních třech desetiletích zůstává problém náhlé srdeční smrti (NSS) jedním z nejpalčivějších témat současné medicíny. V Evropě dle kvalifikovaných odhadů odpovídá NSS za 2 500 úmrtí denně. V ekonomicky vyspělých zemích má hlavní podíl na výskytu NSS koronární nemoc. Odhaduje se, že více než 80–85 % náhlých kardiálních úmrtí u dospělých osob je podmíněno akutními či chronickými formami tohoto onemocnění [1,2]. Dle některých studií byl až u 90 % pacientů s NSS při koronární nemoci zjištěn nález tzv. aktivní koronární léze (fissura či eroze arterosklerotického plátu v koronární tepně, destičkový trombus či plně vyvinutý akutní – červený – trombus v koronárním řečišti) [3,4]. Při shrnutí historických milníků péče o pacienty se symptomy akutní koronární nedostatečnosti je pro snížení časné mortality na arytmické komplikace nepochybný přínos zavedení odpovídající sítě koronárních jednotek a dobře organizované, vybavené a vyškolené rychlé záchranné služby, umožňující urgentní poskytnutí účinné kardiopulmonální resuscitace včetně elektrické defibrilace či dočasné – transtorakální – stimulace již v přednemocniční fázi [5,6]. V dnešní době je léčba akutního infarktu myokardu cílena na co nejčasnější obnovení perfuze myokardu a zabránění následné remodelaci a systolické dysfunkci levé komory. Již tento postup, vedoucí k záchraně dobré systolické funkce levé komory a omezení vývoje arytmogenního substrátu, znamená účinnou prevenci pozdějšího výskytu NSS. Je však třeba si uvědomit, že ne u všech pacientů je docíleno včasného zprůchodnění infarktové tepny a účinného ošetření případných dalších stenóz věnčitých tepen, důsledkem čehož je významnější irreverzibilní poškození kontraktilní funkce levé srdeční komory a hrozící další ischemické poškození myokardu. Dalším faktem je, že akutní koronární syndromy včetně akutního infarktu myokardu (AIM) s elevacemi ST i bez elevací ST na EKG mohou být provázeny výskytem závažných arytmií, které jsou příčinou NSS v přednemocniční fázi u tohoto postižení (obr. 1). Následující sdělení shrnuje patofyziologický podklad arytmií, připomenutí některých předchozích medicínských postupů a současných možností zabránění NSS u AIM.
Image 1. Záznam z monitorace EKG u pacienta se stenokardií a sinusovou tachykardií. V modifikovaných končetinových svodech jsou patrné deprese úseku ST, časná KES (první ektopický komplex) spustila polymorfní komorovou tachykardii, která přešla rychle do fibrilace komor. 
Léčebné postupy u pacientů se zvýšeným rizikem NSS v období po odeznění akutní fáze AIM, kdy hraje významnou roli implantabilní kardioverter-defibrilátor, jsou obsahem dalšího sdělení.
Patogeneze arytmií u akutní ischemie myokardu
Akutní ischemie myokardu může být provázena tachyarytmiemi i bradyarytmiemi. Hlavní podíl na výskytu NSS mají komorové tachyarytmie.
Při vzniku akutní ischemie určité oblasti myokardu dochází uvnitř ischemické zóny k podstatným změnám průběhu akčního potenciálu srdečních myocytů. Tyto změny postihují aktivní i pasivní vlastnosti buněčné membrány. Již v prvních minutách ischemie myokardu jsou patrné změny aktivních vlastností membrány a projevují se snížením rychlosti depolarizace, změnou amplitudy a trvání akčního potenciálu. V prvních 10–15 min je posun klidového membránového potenciálu o 20–25 mV ve směru menší negativity. Sníží se též amplituda a strmost fáze 0 akčního potenciálu. V prvních minutách ischemie dochází též ke zkrácení fáze plateau a tím je způsobeno zkrácení celého akčního potenciálu, refrakternosti a zvýšení excitability v dané oblasti myokardu. Pokud ischemie přetrvává, dojde naopak k prodloužení refrakternosti a k diskrepanci mezi délkou akčního potenciálu a refrakterností. Dochází ke zpomalení vedení vzruchu či dokonce k blokádě šíření vzruchu. Výsledkem jsou tak rozdílné elektrofyziologické vlastnosti sousedících skupin myocytů na různě velkém okrsku myokardu a tato heterogenita může vést k manifestaci arytmogenního mechanizmu.
Klíčovou roli v patogenezi arytmií u akutní ischemie myokardu hraje vzestup koncentrace extracelulárního kalia v důsledku porušené funkce buněčné membrány. V ischemické oblasti se nacházejí vedle sebe myocyty, vystavené různým koncentracím extracelulárního kalia, což je ovlivněno různým stupněm poruchy perfuze. Buňky s mírným vzestupem extracelulárního kalia mají zvýšenou excitabilitu i rychlost vedení vzruchu a kratší refrakternost. Naopak buňky vystavené vysokým koncentracím extracelulárního kalia mají sníženou excitabilitu, výrazně zpomalené vedení vzruchu a dlouhou refrakternost. Tyto disperze refrakterností, excitability a rychlosti vedení vzruchu jsou podkladem arytmogenního mechanizmu typu návratného vzruchu (reentry). Klinickým projevem jsou komorové tachyarytmie. Akutní ischemie vede i ke změnám nitrobuněčné homeostázy kalcia a magnezia, což podporuje manifestaci dalších arytmogenních mechanizmů, především typu spouštěné aktivity na podkladě následné depolarizace [7,8].
Přibližně mezi 15.–20. minutou akutní ischemie myokardu se objevují změny pasivních vlastností buněčné membrány – jako je zvýšení odporu elektrických buněčných spojů (gap junkce) s poruchou vedení vzruchu. Tato porucha elektrického spojení buněk je ovlivněna dalšími faktory, které jsou vyjádřeny při ischemii – pokles tkáňového PO2, vzestup volného kalcia v buněčném cytozolu, nitrobuněčnou acidózou, deplecí ATP, nahromaděním některých metabolitů [7]. Proarytmický efekt v dané situaci mají i lokálně uvolňované katecholaminy i cirkulující katecholaminy, které přispívají k abnormální automacii.
Lze shrnout, že při akutní ischemii myokardu se jednotlivé arytmogenní mechanizmy a proarytmické faktory rychle mění, mají komplexní, dynamický charakter a vzájemně se mohou potencovat.
V následujícím období – po odeznění akutní fáze AIM – se již uplatňuje probíhající proces hojení s nárůstem podílu kolagenních vláken (tj. vazivové tkáně) v myokardu s probíhající remodelací myokardu, kdy se prolínají okrsky plně funkčních myocytů s oblastmi částečně poškozených myocytů a s okrsky vazivové tkáně, což zhoršuje (zpomaluje) šíření vzruchu a vede k nehomogennímu šíření vzruchu (tzv. anizotropie vedení vzruchu) – to může podmiňovat vznik arytmogenního reentry mechanizmu. V této subakutní a následné chronické fázi po AIM se již typickým způsobem mohou uplatňovat tři hlavní komponenty geneze arytmií (obr. 2). Jsou to:
- arytmogenní substrát (tj. anatomický a funkční stav pracovního myokardu, převodního systému a nervových zakončení v srdeční tkáni)
- spouštěcí faktory
- modulující faktory
Image 2. Schéma tří hlavních komponent, přispívajících ke vzniku a udržení tachyarytmií. 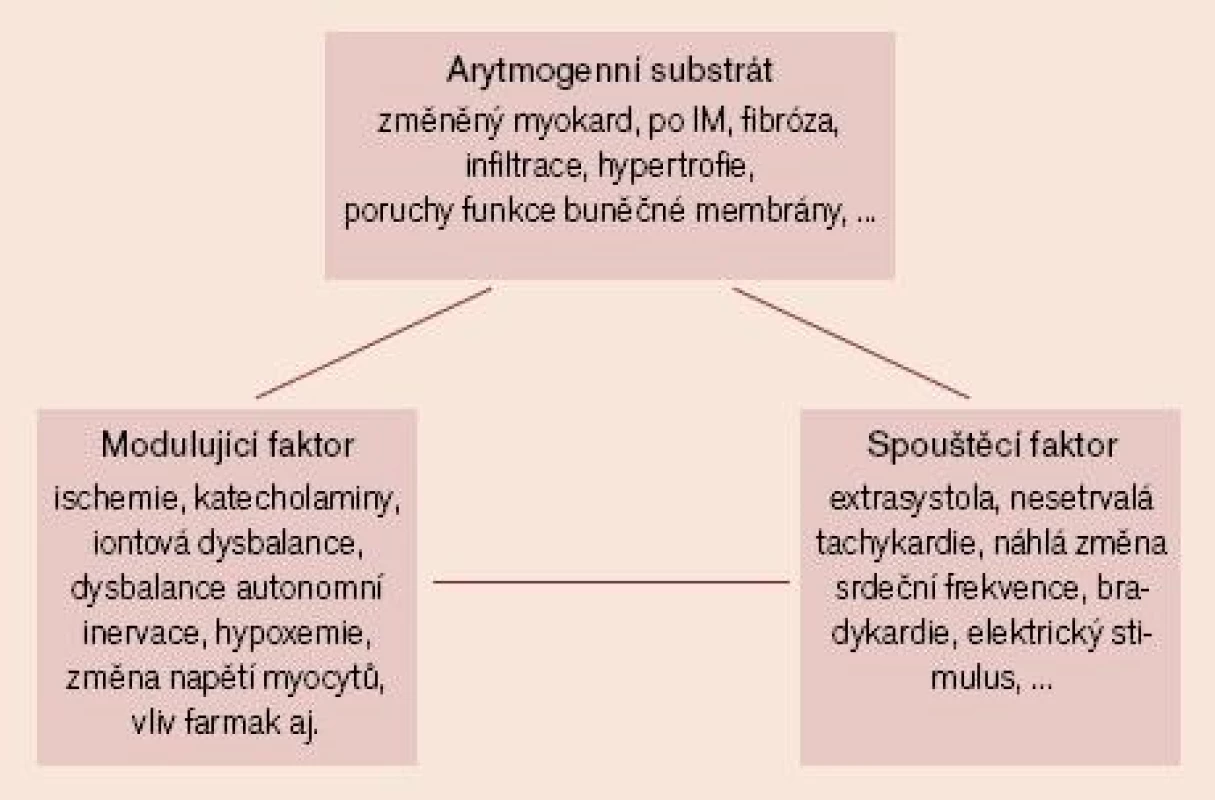
Posouzení uvedených komponent umožňuje určitou stratifikaci rizika NSS. Zatím pozitivní prediktivní hodnota jednotlivých stratifikačních testů je poměrně nízká. Přesto je pokrok v tomto směru patrný a výzkum v tomto směru dále pokračuje. Problematice rizikové stratifikace po AIM a otázce výběru léčby u individuálních pacientů je věnováno jiné sdělení.
Prevence NSS v přednemocniční fázi AIM – historie a současnost
Při manifestaci symptomů svědčících pro akutní koronární syndrom je třeba zajistit převoz pacienta ke specializovanému vyšetření a následné léčbě v souladu s obecně uznávanými doporučeními [10,11]. Standardním požadavkem je zabezpečení kontinuální monitorace srdečního rytmu během převozu pacienta do nemocnice [5,6,12,13]. Klíčovou roli pro snížení výskytu NSS při oběhové zástavě na podkladě arytmických komplikací má co nejčasnější kardiopulmonální resuscitace včetně účinné defibrilace a pokračování kvalifikované další podpory vitálních funkcí v rámci koncepce „řetězce přežití“ (chain of survival), na jehož jednotlivých funkčních a na sebe navazujících článcích závisí celkový úspěch resuscitace pro oběhovou zástavu. Jednotlivé články lze shrnout následovně [12,13]:
- rozpoznání varovných příznaků a neodkladná aktivace záchranné služby (v ČR telefonní číslo 155, v Evropě většinou číslo 112)
- zahájení základní resuscitace (podpory životních funkcí – masáž srdeční, řízené dýchání)
- co nejčasnější defibrilace
- pokročilá podpora srdeční činnosti a životních funkcí (monitorace EKG, účinná ventilace, oxygenace, intravenózní farmakologická podpora)
Výše je uvedena složitá a rychle se měnící patofyziologická situace, podmiňující arytmie při AIM. Zatím není možné jednoduchou a účinnou medikamentózní léčbou ovlivnit tyto proměnlivé arytmogenní mechanizmy a faktory, které se na genezi arytmií při AIM podílejí.
V éře před reperfuzní terapií AIM byl přikládán velký význam záchytu „varovných arytmií“ při kontinuální monitoraci na koronárních jednotkách [5,6,14]. V této éře bylo referováno o výskytu časné (primární) fibrilace komor (FK) u cca 10 % pacientů hospitalizovaných pro AIM, přičemž 80 % z těchto maligních komorových tachyarytmií bylo v prvních 12 hod monitorace na koronární jednotce. Suverénní léčbou těchto primárních FK je elektrická defibrilace. Primární komorová fibrilace je určitým ukazatelem predikujícím zvýšenou hospitalizační mortalitu po AIM, ale u nemocných úspěšně resuscitovaných pro tuto arytmii v časné fázi (během prvních čtyř hodin po vzniku AIM) není po propuštění z nemocnice prognóza horší než u pacientů, u nichž se fibrilace komor v akutní fázi IM nevyskytla [15,16].
Podstatně závažnějším problémem jsou tzv. sekundární FK, provázející kardiogenní šok či závažné selhávání mechanické srdeční funkce. Zde je mortalita vysoká a přechodné zvládnutí arytmie nemá podstatný dopad na nepříznivou prognózu pacienta. Ta však v současné době může být zlepšena přechodnou aplikací některé formy mechanické srdeční podpory.
Dříve byl přeceňován nález fenoménu „R-on-T“, tedy časné komorové extrasystoly, přicházející do tzv. vulnerabilní fáze vlny T na elektrokardiogramu [14]. V té době byl příklon k preventivní aplikaci antiarytmik k zabránění setrvalé komorové tachykardie (KT) či FK. Následné studie ukázaly na proarytmické riziko paušálně podávaných antiarytmik a ukázaly malou senzitivitu a specificitu nálezu „R-na-T“ [17-20]. Platí to především v současné éře, kdy je léčebná snaha soustředěna na docílení časné reperfuze myokardu u AIM [10,15,21].
Dříve používaná rutinní aplikace Lidocainu (a analogicky Trimecainu (Mesocainu)) v rámci farmakologické prevence NSS v přednemocniční fázi AIM není dle současných poznatků indikována [2,19,20]. Po odklonu od preventivního podávání antiarytmik a rozpoznání jejich proarytmického efektu u AIM byla snaha o využití dalších léků k prevenci NSS.
Snaha o stabilizaci srdečního rytmu a prevenci NSS při vzniku koronární příhody byla cílena na tlumení bolesti, stresové situace a anxiety a na potlačení proarytmického účinku katecholaminů. Byl například ověřován efekt co nejčasnější aplikace perorální medikace tramadolu, flunitrazepamu a metipranololu [22]. Účinnost těchto postupů však nebyla ověřena validními studiemi splňujícími požadavky medicíny založené na důkazech. Na druhé straně byl jasně dokumentován rozhodující přínos co nejčasnějšího zprůchodnění infarktové tepny pro další prognózu pacienta s AIM. Proto v časné fázi u AIM je nyní rozhodující snaha o rychlé docílení reperfuze myokardu, snaha o udržení odpovídající oxygenace a dle možnosti přiměřená blokáda adrenergních receptorů a analgosedace pacienta.
Zmíněná aplikace beta-blokátorů již v akutní fázi AIM byla jediným jasně pozitivním výsledkem v oblasti antiarytmické medikamentózní prevence NSS [23,24].
Kontinuální monitorace EKG má v této fázi zcela zásadní význam a v případě záchytu hemodynamicky významné KT či dokonce KF je nejefektivnější léčbou transtorakální elektrická kardioverze či defibrilace [10,25]. V souvislosti s časnou aplikací účinných antitrombotických léků, korekcí poruch acidobazické rovnováhy, iontové dysbalance, hypoxemie a vlivem časnějšího použití beta-blokátorů již v přednemocniční fázi u AIM a docílením časné reperfuze myokardu koronární intervencí výskyt primární FK v posledních letech klesá. Při hemodynamicky tolerované komorové tachykardii lze použít aplikace bolusu amiodaronu nitrožilně (150–300 mg), eventuálně následované infuzí tohoto antiarytmika [2].
Pokud u pacienta vznikne oběhová zástava na podkladě KT/KF jako první manifestace akutního koronárního syndromu, záleží jeho další osud na tom, zda k tomu došlo za přítomnosti svědků a zda je co nejčasněji zahájena účinná kardiopulmonální resuscitace. To je podmíněno rychlou dostupností záchranné zdravotní služby, edukací obyvatelstva o provádění resuscitace a rychlou dostupností elektrické transtorakální defibrilace (např. v podobě automatických externích defibrilátorů, vybavení dalších složek integrovaného záchranného systému defibrilátory aj.) [2,12,13].
Stratifikace rizika NSS po AIM
Pacienti, kteří prodělali AIM, mají větší riziko následného výskytu NSS ve srovnání s ostatní populací. Řada studií ukázala, že toto riziko je nejvyšší během prvního měsíce po infarktu myokardu. Některé studie udávají výskyt NSS u 5–10 % pacientů během prvního měsíce po AIM [2,21,26]. Dále pokračuje trend výskytu NSS s podstatně nižší frekvencí (mezi 1–2 %/rok) během dlouhodobého sledování. Zvýšené riziko NSS je zejména u osob, u nichž po IM došlo k remodelaci levé komory a manifestaci její výraznější systolické dysfunkce [1,2]. Srdeční selhávání je nejsilnějším prediktorem náhlé srdeční smrti po infarktu myokardu [21,26]. U této rizikové populace rovněž selhala prevence NSS antiarytmiky – např. v rámci studie CAST a dle dalších studií [2,17,18]. Naopak je možné, že ke zlepšení elektrické stability srdce a tím snížení rizika NSS v časné fázi AIM může přispět ochrana myokardu před sympatoadrenergní reakcí beta-blokátory v kombinaci s benzodiazepiny, a to již od začátku symptomů svědčících pro akutní koronární syndrom [27]. Lze však shrnout, že v současnosti zatím zůstává hlavním postupem ke snížení výskytu NSS v přednemocniční fázi léčby AIM využití dobře organizované rychlé záchranné služby s možností co nejčasnější účinné resuscitace arytmické oběhové zástavy [2,12,13]. V pozdějším období po prodělaném infarktu myokardu je nejspolehlivější léčbou k potlačení výskytu NSS implantabilní kardioverter-defibrilátor, případně v kombinaci se srdeční resynchronizační léčbou [2]. Tato problematika je obsahem dalšího sdělení.
Závěr
S rozvojem léčby AIM se nejspíš mění i epidemiologie výskytu NSS, vztahující se k akutní koronární příhodě. Riziko NSS zřejmě klesá po prvním měsíci a je poměrně nízké a stabilní v následujících několika letech. Je to nejspíš v souvislosti s tím, jak se zlepšuje léčba ischemie, dociluje časné reperfuze myokardu se zachováním dobré globální systolické funkce levé komory, jak se zlepšuje léčba srdečního selhávání a jak se účinněji ovlivňují rizikové faktory koronární nemoci. V přednemocniční fázi a v časné fázi léčby AIM má pro prevenci NSS zásadní význam monitorace EKG a včasný léčebný zásah v případě vzniku závažných arytmických komplikací. Dle některých studií se po prvních 30 dnech po propuštění další výskyt náhlé srdeční smrti pohybuje mezi 1–1,5 % ročně. Nicméně některé klinické ukazatele – zejména srdeční selhávání – zvyšují riziko náhlé srdeční smrti více než čtyřikrát. Její prevence v tomto nejčasnějším období po ukončení hospitalizace pro AIM zůstává velkým klinickým problémem. Zatím není spolehlivá riziková stratifikace pro indikaci implantace defibrilátoru časně po AIM. V tomto směru potřebujeme data z dalších studií zaměřených na uvedenou periodu v léčbě AIM. Zdá se pravděpodobné, že klíčovou roli pro prevenci náhlé srdeční smrti v časném období po infarktu myokardu budou hrát zlepšení léčby akutního infarktu a jeho časných komplikací včetně srdečního selhávání. Ke zlepšení elektrické stability srdce a tím snížení rizika NSS může přispět i ochrana myokardu před sympatoadrenergní reakcí beta-blokátory (případně v kombinaci s benzodiazepiny) již od počáteční klinické manifestace AIM.
MUDr. Jan Bytešník, CSc.
Odd. arytmologie na Klinice kardiologie IKEM
jan.bytesnik@ikem.cz
Sources
1. Myerburg RJ, Interian A jr, Simmons J et al. Sudden Cardiac Death. In: Zipes DP, Jalife J (eds). Cardiac Electrophysiology. From cell to bedside. Philadelphia: Saunders 2004, 720–731.
2. Zipes PD, Camm AJ, Borggrefe M et al. ACC/ AHA/ESC Guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. J Am Coll Cardiol 2006; 48 : 1064–1108.
3. Mehta D, Curwin J, Gomes A et al. Sudden death in coronary artery disease: Acute ischemia versus myocardial substrate. Circulation 1997; 96 : 3215–3223.
4. Taylor AJ, Burke AP, O´Malley PG et al. A comparison of the Framingham risk index, coronary artery calcification, and culprit plaque morphology in sudden cardiac death. Circulation 2000; 101 : 1243–1248.
5. Pantridge JF, Geddes JS. A mobile intensive care unit in the management of myocardial infarction. Lancet 1967; 2 : 271–273.
6. Lown B, Fakhro AM, Hood WB et al. The coronary care unit: New perspectives and directions. JAMA 1967; 199 : 188–198.
7. Carmeliet F. Cardiac ionic currents and acute ischemia: From channels to arrhythmia. Phys Rev 1999; 79 : 917–1017.
8. Bytešník J. Mechanizmy vzniku arytmií. In: Aschermann M (ed.). Kardiologie. Praha: Galén 2004 : 1085–1099.
9. Peters NS, Witt AL. Gap junction remodeling in infarction: does it play a role in arrhythmogenesis? J Cardiovasc Electrophysiol 2000; 11 : 488–490.
10. Van de Werf F, Bax J, Betriu A et al. Task Force of the ESC: Acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2008; 29 : 2909–2945.
11. Bělohlávek J, Aschermann M. Doporučený postup pro diagnostiku a léčbu akutních koronárních syndromů bez elevací ST úseků na ekg. Cor Vasa 2008; 50 (Suppl.): 1S7–1S23.
12. Cummins RO, Ornato JP, Thies WH et al. Improving survival from sudden cardiac arrest: The „chain of survival“ concept: a statement for health professionals from the Advanced Life Support subcommittee and the Emergency Cardiac Care Committee, AHA. Circulation 1991; 83 : 1832–1847.
13. European Resuscitation Council. ERC Guidelines for resuscitation 2005. Resuscitation 2005; 67: S3–S189.
14. El-Sherif N, Myerburg RJ, Sherlag BJ et al. Electrocardiographic antecedents of primary ventricular fibrillation: value of the R-on-T phenomenon in myocardial infarction. Br Heart J 1976; 38 : 415–422.
15. Vojáček J, Rozsíval V, Kolář J et al. Ischemická srdeční choroba. In: Vojáček J, Kettner J (eds). Klinická kardiologie. Hradec Králové: Nucleus HK 2009 : 95–207.
16. Henkel DM, Witt BJ, Gersh BJ et al. Ventricular arrhythmias after acute myocardial infarction: a 20-year community study. Am Heart J 2006; 151 : 806–812.
17. The Cardiac Arrhythmia Suppression Trial (CAST) Investigators. Preliminary report: effect of encainide and flecaainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med 1989; 321 : 406–412.
18. Teo KK, Yusuf S, Furberg CD. Effects of prophylactic antiarrhythmic drug therapy in acute myocardial infarction. An overview of results from randomized controlled trials. JAMA 1993; 270 : 1589–1595.
19. Mac Mahon S, Collins R, Peto R et al. Effects of prophylactic lidocain in suspected acute myocardial infarction: an overview of results from the randomized controlled trials. JAMA 1988; 260 : 1910–1916.
20. Hine LK, Laird N, Hewitt P, et al. Meta-analytic evidence against profylactic use of Lidocaine in acute myocardial infarction. Arch Intern Med 1989; 149 : 2694–2698.
21. Adabag AS, Therneau TM, Gersh BJ et al. Sudden death after myocardial infarction. infarction. JAMA 2008; 300 : 2022–2029.
22. Fejfar Z, Vrána M. Prevence náhlé koronární smrti svépomocí. Vnitřní Lék 1992; 38 : 937–944.
23. Hjalmarson A, Herlitz J, Holmberg S et al. Tle Goteborg metoprolol trial: Effects on mortality and morbidity in acute myocardial infarction. Circulation 1983; 67: I26–I32.
24. Norris RM, Barnaby PF, Brown PM et al. Prevention of ventricular fibrillation during acute myocardial infarction by intravenous propranolol. Lancet 1984; 2 : 883.
25. Ideker RE, Juany J, Walcott GP. Defibrillation waveforms. In: Zipes DP, Jalife J (eds). Cardiac Electrophysiology. From Cell to bedside. Philadelphia: Saunders 2004 : 426–432.
26. Lenderink T, Hernández AV, Boersma E et al. Prediction of 30-day mortality in older patients with a first acute myocardial infarction. Cardiology 2010; 115 : 1–9.
27. Honzák R, Staněk V, Pokorný J et al. Emoce a psychické poruchy při infarktu myokardu – jejich diagnostika a léčba. Farmakoterapie 2009; 5 : 550–600.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2010 Issue Supplementum-
All articles in this issue
- Kardiopulmonální resuscitace: komentované doporučení ERC 2005
- Prevence náhlé srdeční smrti u akutního infarktu myokardu
- Supraventrikulární arytmie u akutního infarktu myokardu
- Bradykardie u akutního infarktu myokardu
- Antiarytmika vs implantabilní kardiovertery-defibrilátory v prevenci náhlé srdeční smrti: definitivně vyřešená otázka?
- Katetrová ablace elektrické bouře po infarktu myokardu
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Bradykardie u akutního infarktu myokardu
- Kardiopulmonální resuscitace: komentované doporučení ERC 2005
- Supraventrikulární arytmie u akutního infarktu myokardu
- Prevence náhlé srdeční smrti u akutního infarktu myokardu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

