-
Medical journals
- Career
Katetrizační ablace fibrilace síní: naděje pro všechny výrazně symptomatické pacienty
Authors: M. Fiala; J. Chovančík; R. Neuwirth; R. Nevřalová; O. Jiravský; I. Nykl; M. Branny
Authors‘ workplace: oddělení kardiologie, Kardiocentrum, Nemocnice Podlesí, a. s., Třinec
Published in: Kardiol Rev Int Med 2006, 8(Supplementum): 28-32
Overview
Fibrilace síní (FS) je nejčastější poruchou srdečního rytmu, která je spojená se zvýšenou morbiditou a mortalitou. Užitek z udržení sinusového rytmu je na jedné straně zjevný, antiarytmická léčba je na druhé straně omezeně účinná. Katetrizační ablace nabízí kurativní léčbu FS. Ablační strategie jsou založeny na ovlivnění spouštění a udržování arytmie. Dlouhodobé odstranění paroxyzmální FS je v současnosti podle zkušeností jednotlivých pracovišť dosahováno u 70-90 % pacientů. Ablace pro chronickou FS má nižší účinnost, všeobecně nepřesahující 60 %. U pacientů se srdečním selháním a FS představuje ablace FS podle přítomnosti základního strukturálního postižení srdce potenciál ke zlepšení či úplné úpravě systolické funkce levé komory srdeční. Ablace paroxyzmální FS rezistentní na antiarytmika u vysoce symptomatických pacientů se stává rutinní realitou dneška. V blízké budoucnosti lze očekávat rozvoj ablace FS jako metody první volby nebo metody používané v časných stadiích nemoci.
Klíčová slova:
fibrilace síní - paroxyzmální fibrilace síní - chronická fibrilace síní - srdeční selhání - katetrizační ablaceÚvod
Fibrilace síní (FS) je nejčastější poruchou srdečního rytmu, která postihuje asi 5 % lidí ve věku mezi 60 až 70 lety a jejíž prevalence se zvyšuje s věkem [1-3]. Výskyt FS stále stoupá a společně s metabolickým syndromem a srdečním selháním je považována za jednu z kardiovaskulárních epidemií 21. století. FS je příčinou zvýšené morbidity i mortality, často se pojí se srdečním selháním a zhoršuje morbiditu a mortalitu tohoto stavu [4-7].
FS je spojena se symptomy, které mohou být individuálně nevýrazné, ale i zásadně limitující. Riziko tromboembolické komplikace je u pacientů s FS bez chlopenní vady oproti populaci bez arytmie více než 5krát zvýšené. FS zhoršuje srdeční selhání u preexistujících strukturálních postižení srdce, ale samotná může být skrze elektrofyziologickou a posléze anatomickou remodelaci srdce příčinou srdečního selhání [4-7].
Léčba FS je svízelná. Antiarytmika jsou účinná v omezené míře a dočasně [8,9]. Nedávné studie AFFIRM a RACE sice postavily na stejnou úroveň ponechání běžící arytmie s udržováním trvalé antikoagulační léčby a snahu udržet sinusový rytmus antiarytmiky I. nebo III. třídy [10,11], tyto studie však zahrnuly pacienty s průměrným věkem téměř 70 let, méně symptomatické a s vyšším rizikem tromboembolické komplikace. Mladší, vysoce symptomatičtí pacienti pravděpodobně do této studie nevstupovali a podstupovali katetrizační ablaci. Antiarytmika I. a III. třídy kromě toho nikdy nebyla spojena s pozitivním účinkem na mortalitu [12-16].
Výsledky nerandomizované studie ukázaly, že provedení katétrové ablace u pacientů s FS je spojeno se snížením morbidity i mortality oproti antiarytmické léčbě [17]. Katétrová ablace pro FS je v současnosti klinicky zavedenou metodou s potenciálem trvalého vyléčení, tak jak se to stalo u ostatních supraventrikulárních tachyarytmií.
Anatomie levé srdeční síně a patofyziologie fibrilace síní
Levá srdeční síň je tvořena vpředu vestibulem mitrální chlopně, nad níž vystupuje dopředu ouško. Do zadní tzv. venózní části vstupují plicní žíly (PŽ), které jsou obvykle 4, v jejich počtu a především tvaru je však značná variabilita (obr. 1). Stěna levé srdeční síně je tvořena vnitřní a vnější svalovou vrstvou; v těchto vrstvách jsou svalové snopce uspořádány do určitých svazků. Jak endokardiální tzv. septoatriální Papézův svazek, tak i epikardiální tzv. septopulmonární Papézův svazek při svém průchodu stropem a zadní stěnou levé srdeční síně vydávají longitudinální i cirkulární vlákna do stěny ústí PŽ. Pravá a levá síň jsou spojeny svalovými snopci, především tzv. Bachmanovým svazkem se snopci septálními. Koronární sinus má vlastní myokardiální obal, který je spojen svalovými vlákny s myokardem levé síně. Koronární sinus je současně dalším spojením se síní pravou. V ústích PŽ jsou myokardiální vlákna neuspořádaná a přerušovaná [18]. Uspořádání myokardu v plicních žilách stejně jako celé levé síni tvoří substrát pro mechanizmus reentry. Strukturální změny, geometrické i anatomicko-histologické, které vznikají v důsledku různých kardiopatií a také v důsledku strukturální remodelace při samotné FS, tento substrát dotvářejí.
Image 1. Anatomie levé srdeční síně. 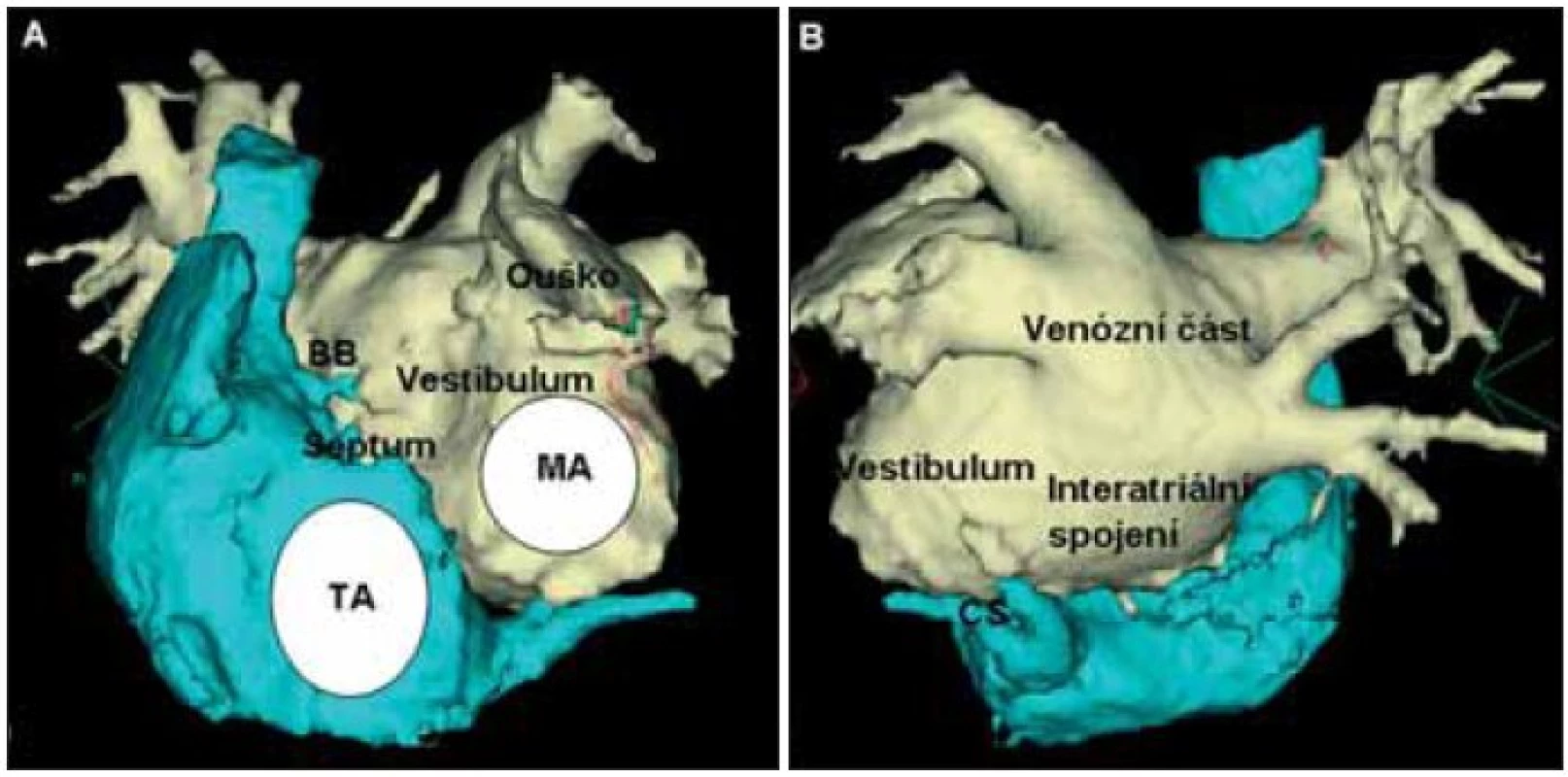
Na obrázku je CT-zobrazení pravé a levé srdeční síně zepředu (A) a zezadu (B). Do zadní venózní části levé síně vstupují 4 plicní žíly, jejich přechod do levé síně tvoří nálevkovitě utvářená antra. Plicní žíly jsou zdrojem spouštění a udržování záchvatovité fibrilace síní. TA – trikuspidální prstenec; MA – mitrální prstenec; BB – Bachmanův svazek; CS – koronární sinus. Moe a později Allesie se spolupracovníky rozpracovali teorii, že FS je udržována kroužením elektrické depolarizace po mnoha proměnlivých reentry okruzích především v levé srdeční síni. Udržování FS závisí na trvání refrakterní periody, rychlosti šíření impulzu, disperzi refrakterních period a dostatečné velikosti masy myokardu, ve kterém se arytmie udržuje [19,20].
Nedávno se zjistilo, že FS se spouští a iniciálně udržuje ektopickou aktivitou, vycházející z myokardu v stěně ústí PŽ [21]. Ačkoliv nebyla jednoznačná přítomnost nodálních buněk v této oblasti u lidí prokázána, mechanizmus elektrické aktivity v PŽ může být pravděpodobně fokální (abnormální automacie nebo spuštěná aktivita) i reentry. Je zjevné, že v některých případech je FS udržována rychlou aktivitou vycházející z PŽ nebo jejich nálevkovitě tvarovaných anter.
O tom, že reentry okruhy pro udržování FS nejsou vždy až zcela náhodné, svědčí studie prokazující přítomnost relativně stabilních reentry okruhů (tzv. mateřských okruhů nebo rotorů) [22,23]. Jejich lokalizace je soustředěná do zadní venózní části levé síně do anter PŽ i mimo ně. Byly pozorovány u pacientů s paroxyzmální FS, kdežto u pacientů s chronickou FS nebyla existence těchto tzv. rotorů jednoznačně prokázána a udržování arytmie je v takových případech zřejmě difuzní proces zasahující celou levou síň a možná i síň pravou.
V poslední době se také diskutuje význam autonomní inervace levé srdeční síně v mechanizmu arytmie. Pleteně se zakončeními sympatického a parasympatického nervového systému se vyskytují epikardiálně v těsné blízkosti plicních žil a jejich aktivita může ovlivňovat vznik a udržování FS [24].
Strategie ablace
První pokusy o katetrizační ablaci pro FS byly pokusem napodobit chirurgické výkony (tzv. procedura Maze) v pravé i levé srdeční síni [25,26]. S objevem spouštěcí ektopické aktivity se začala veškerá snaha o zásah do mechanizmu arytmie soustředit na zadní stěnu levé síně a ústí PŽ.
Technika ablace zavedená na pracovišti v Bordeaux je založena na snímání elektrické aktivity v PŽ pomocí cirkulárního katétru. Ablace se provádí ablačním katétrem v ústí PŽ a cílem je nekróza myokardiálních vláken a přerušení elektrického spojení mezi svalovinou PŽ a levé síně a dosažení tzv. elektrické izolace PŽ [27,28]. Elektrické vzruchy z PŽ pak nemohou FS spouštět. Ablace a hodnocení cílového momentu se může provádět jak při FS, tak i při sinusovém rytmu nebo stimulaci síní, při níž se sleduje vedení z levé síně do PŽ a izolace PŽ je přesně hodnotitelná podle vymizení elektrické aktivity snímané v PŽ (obr. 2). V případě, že se ablace provádí při běžící fibrilaci, arytmie končí izolací některé PŽ u většiny pacientů s paroxyzmální FS, což prokazuje význam PŽ v udržování arytmie. Tato technika je proveditelná pomocí konvenčního mapování pod skiaskopickou kontrolou bez nutnosti 3rozměrného mapování. Její nevýhodou je omezená použitelnost při rozšíření ablační strategie. Kromě toho aplikace ablační energie ve vlastním ústí PŽ je spojena s 0,5-2% rizikem významné stenózy PŽ a asi s 8% rizikem nevýznamných zúžení PŽ. Klinická účinnost této metody je dosahována asi u 70 % pacientů s paroxyzmální FS.
Image 2. Konvenční mapování a ablace fibrilace síní. 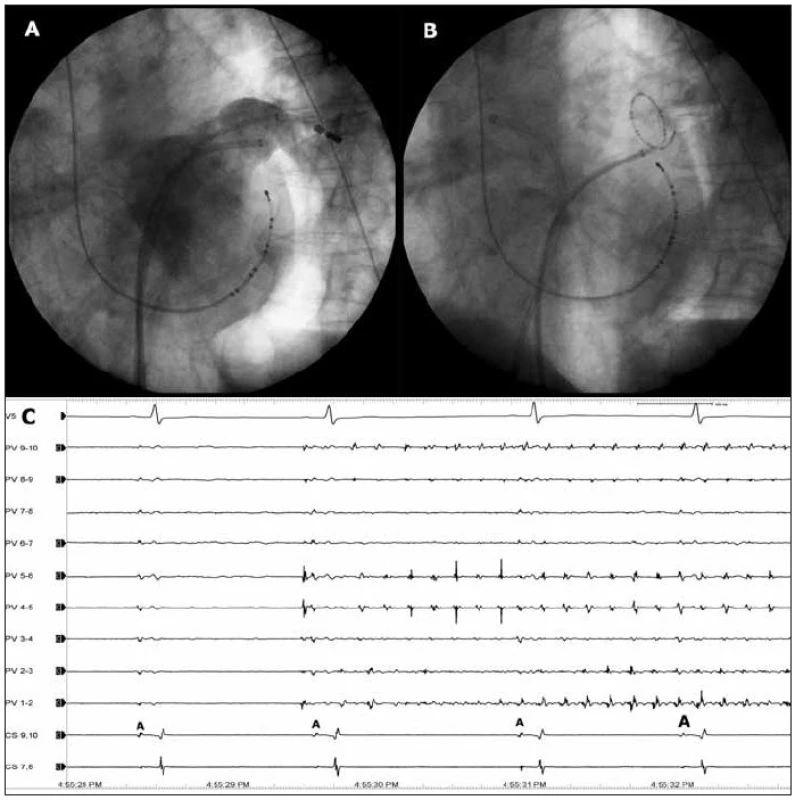
Na obrázku (A) je skiaskopické zobrazení velké společné levé plicní žíly přímou angiografií v levé šikmé projekci. Na obrázku (B) je vidět cirkulární katétr Lasso zavedený do této žíly a mapující zde elektrickou aktivitu. Na obrázku (C) snímá cirkulární katétr po provedené izolaci této plicní žíly rychlou ektopickou aktivitu (svody PV1–2 až PV9–10), zatímco v samotné levé síni je sinusový rytmus (snímaný katétrem v koronárním sinu = CS 7,8 a CS 9,10). Síňové potenciály znázorňující aktivaci v koronárním sinu (a tedy v levé síni) jsou označeny písmenem A. Rychlost posunu EKG je 100 mm/s. Technika zavedená na pracovišti v Miláně je založená na 3rozměrném zobrazení levé síně a plicních žil a aplikaci radiofrekvenční energie ve formě širších souvislých obkružujících lézí kolem anter PŽ [29,30]. Výhodou této metody je provedení ablace na síňové straně žilních ústí s prakticky nulovým rizikem rozvoje žilní stenózy a izolace i těch etopických ložisek, která jsou uložena v antrech PŽ. Součástí efektu této ablace je dále přerušení potenciálních reentry okruhů kolem ústí PŽ a zmenšení masy myokardu nutné pro udržování arytmie. Kromě toho se při této ablaci mohou více ovlivnit vagová zakončení [24]. Ablační strategii lze rozšířit o případné lineární léze zasahující dále do arytmogenního substrátu v levé síni [29,30] (obr. 3). Nevýhodou metody v podání jejího zakladatele je absence přesného hodnocení momentu izolace plicních žil. Proto mnoho dalších pracoviště obě metody s výhodou kombinuje, tj. provádí elektroanatomicky navigované obkružující léze a současně hodnotí izolaci PŽ cirkulárním katétrem [31]. Referovaná klinická účinnost této metody je dosahována u více než 90 % pacientů s paroxyzmální FS.
Image 3. Trojrozměrné mapování a katétrová ablace fibrilace síní. 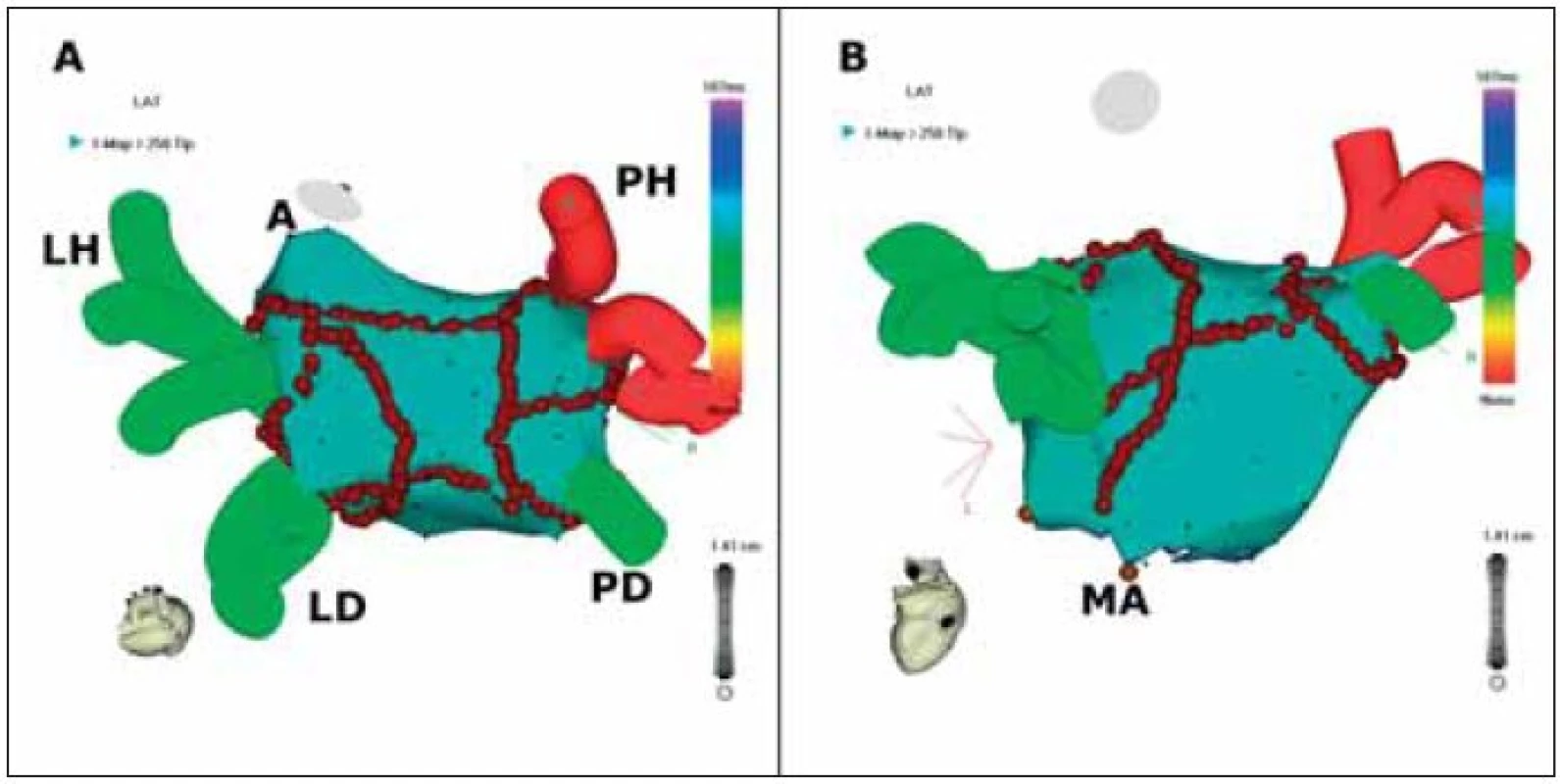
Na obrázku je znázorněna anatomická rekonstrukce levé síně a plicních žil. Hnědé body znázorňují místa aplikace radiofrekvenční energie. Pohled na obrázku (A) ukazuje obkružující léze kolem plicních žil (LH = levá horní, LD = levá dolní, PH = pravá horní, PD = pravá dolní) a spojující lineární léze ve stropě levé síně a mezi dolními plicními žilami. Na obrázku (B) je lépe zobrazena lineární léze spojující levou dolní plicní žílu a mitrální prstenec (MA); A = ouško levé síně. Jiná technika je založená na vyhledávání oblastí s komplexními frakcionovanými potenciály, reprezentujících tzv. rotory (viz výše) a na ablaci těchto míst pomocí nakupení radiofrekvenčních lézí [34]. Tito autoři prezentují účinnost metody u 90 % pacientů.
Někteří autoři limitovali ablační pokusy na autonomní pleteně s vagovými zakončeními identifikované podle podprahové stimulace. Obě poslední techniky vyžadují další ověření zkušenostmi na více pracovištích.
Předablační příprava a péče o pacienty po ablaci
Předablační příprava je zaměřená především na prevenci tromboembolické komplikace. Pacienti až na výjimky užívají warfarin v terapeutickém rozmezí po dobu nejméně 4-5 týdnů. Podle zvyklostí pracovišť se warfarin několik dní před výkonem vysazuje a nahrazuje se nízkomolekulárním heparinem. Před výkonem je nezbytné vyloučit přítomnost trombu v levé síni jícnovou nebo intrakardiální echokardiografií. Při výkonu se podává heparin s hodnotou ACT 300-350 s. Po výkonu se opět nasazuje warfarin a podle zvyklostí pracovišť se ponechává po dobu 6 týdnů až 6 měsíců.
Ostatní příprava je standardní předkatetrizační, důležitou informací je zhodnocení strukturálního stavu srdce.
Před ablací se většinou ponechává dosavadní antiarytmická léčba a dočasně se v ní pokračuje i po ablaci s cílem stabilizovat síně po dobu hojení radiofrekvenčních lézí. Jinou možností je antiarytmickou léčbu vysadit před ablací a k antiarytmické léčbě se uchýlit jen podle potřeby.
Provedení ablace
Katetrizační ablace pro FS přestavuje jeden z nejdelších a nejsložitějších výkonů v katetrizační praxi. Zahrnuje standardní provedení dvojité transseptální punkce a zavedení 2 dlouhých a preformovaných zavaděčů do levé srdeční síně. Na mnoha pracovištích se stále provádí přímá angiografie PŽ k jejich zobrazení a zvolení správného průměru cirkulárního katétru. Angiografické zobrazení PŽ je nyní často nahrazováno zobrazením pomocí počítačové tomografie (CT) nebo magnetické rezonance (MR). Pokud se používá 3rozměrné mapování (Carto, NavX), vlastní ablaci předchází 3rozměrná elektroanatomická rekonstrukce levé síně a PŽ. V současnosti se do klinické praxe zavádí možnost přenesení 3rozměrné mapy levé síně a PŽ z CT nebo MR přímo do systémů Carto nebo NavX (tzv. integrace zobrazení). Ablační katétr se pak navádí v ještě přesnějším anatomickém prostředí, než jaké je vytvářeno postupným dotykem katétru o stěnu levé síně. Některá pracoviště používají jako přídatnou metodu intrakardiální ultrazvuk, který jim umožňuje snazší transseptální punkci, přídatný pohled na ústí PŽ a sledování účinnosti ablace podle vzniku mikrobublin [33].
Vlastní ablace je pracná a časově náročná, podávají se při ní mnohočetné na sebe navazující aplikace radiofrekvenční energie. Podávání energie do jednoho místa se doporučuje omezit na kratší dobu, zatímco katétr se postupně posunuje podél zamýšlené ablační linie. Tento způsob se využívá hlavně při použití 3rozměrné navigace katétru a redukuje riziko výskytu tzv. fenoménu popu (tj. nahromadění a erupce vodních par v myokardu pod katétrem), a tím riziko perforace. Grafické obkroužení PŽ je poměrně rychlé, skutečné dosažení úplné izolace je mnohem obtížnější, zvláště při periantrální ablaci, kde je myokard již souvislý a poměrně silný.
Komplikace ablace pro fibrilaci síní
Komplikace ablace zahrnují typické katetrizační komplikace. Nejzávažnější je výlev krve do perikardu s rozvojem srdeční tamponády. Ablace v levé síni spojená s rozsáhlými aplikacemi radiofrekvenční energie je spojena se zvýšeným rizikem vzniku trombu a tromboembolické komplikace.
Specifickou komplikací je vznik stenózy PŽ. Významná stenóza PŽ je definovaná jako zúžení původního průměru lumina žíly na 50 %. Riziko je zanedbatelné při 3rozměrně navigované periantrální ablaci [29]. Původní, dnes již nepoužívaná metoda, při níž se radiofrekvenční energie aplikovala přímo v PŽ v místě ektopického ložiska, byla spojena až se 42% výskytem stenózy PŽ [34]. V současné době i při použití konvenční metody může být výskyt stenózy plicní žíly menší než 1 % [35]. V důsledku může vést stenóza PŽ k plicní hypertenzi. Její léčba pomocí angioplastiky se stentem je poměrně obtížná s vyšším výskytem restenózy [36].
Závažnou, naštěstí však velice vzácnou komplikací, je vznik atrioezofageální píštěle [37]. Doposud bylo na světě popsáno po katetrizační ablaci asi 20 případů. Tato komplikace je záludná tím, že se rozvíjí až za několik dní po výkonu (za 2 dny až 4 týdny), většinou až po propuštění pacientů z hospitalizace. Projeví se septickým stavem, vzduchovou embolií, hematemézou a ve většině případů končí smrtí.
Registr komplikací u 8 754 pacientů ze 181 center, u nichž byla provedena ablace pro FS v letech 1995-2002, ukázal souhrnný 6% výskyt všech komplikací [38]. Ke smrti v souvislosti s výkonem došlo u 0,05 % pacientů, k tamponádě u 1,22 % pacientů, k CMP u 0,28 % pacientů a k TIA u 0,66 % pacientů.
Chronická fibrilace síní, fibrilace síní a chronické srdeční selhání
Ablace pro chronickou FS se provádí podstatně méně a klinické účinnosti se dosahuje u sotva 60 % pacientů. Ablační strategie se liší, většinou je nutné kromě izolace PŽ doplnit zásahy na jiných místech síní. Výsledky z nejlepších pracovišť referují o účinnosti až u 80 % pacientů.
Ablace FS u pacientů se srdeční slabostí prokázala signifikantní zlepšení ejekční frakce levé komory a zmenšení enddiastolického rozměru levé komory a ústup symptomů srdečního selhání po úspěšné ablaci FS. Snížená ejekční frakce levé komory (průměrná hodnota před ablací byla 35 %) se vrátila v období 1 roku po ablaci do normálních hodnot u 72 % pacientů. Zlepšení bylo dosaženo nejen u pacientů bez preexistujícího strukturálního postižení srdce a se špatnou kontrolou frekvence komor, u nichž by se dala předpokládat větší pravděpodobnost navození arytmogenní kardiomyopatie [39].
Při FS se stejně jako u srdečního selhání aktivuje systém renin-angiotenzin-aldosteron. Uzavírá se tak začarovaný kruh, který vede ke strukturální remodelaci srdce s vazivovou náhradou myokardu, k rozvoji chronické formy arytmie a vzájemnému zhoršování obou stavů. Nastoluje se otázka, zda léčba FS ablací nebude v budoucnu prováděna v časných stadiích arytmie s cílem zamezit rozvoji patofyziologických mechanizmů vedoucích k chronické formě FS a rozvoji srdečního selhání.
Jaká je současnost a jaká je budoucnost?
Doposud jsou ke katetrizační ablaci převážně indikováni pacienti, kteří jsou vysoce symptomatičtí, kteří neúčinně užívají antiarytmika I. nebo III. třídy a kteří mají víceméně jinak zdravé srdce. V této indikaci není ablace již v současnosti nadějí, ale skutečností.
V poslední době stále více podstupují ablaci pacienti, kteří mají málo subjektivních potíží, ale nemohou např. pro antikoagulační léčbu vykonávat své zaměstnání. Dále jsou stále více indikováni pacienti s chronickou FS, pacienti s výrazným strukturálním postižením srdce, včetně pacientů po náhradě chlopní a také pacienti s pokročilým srdečním selháním. Pro mnohé z nich bude úspěšná ablace znamenat záchranu před dočasným symptomatickým řešením ablací AV-junkce s implantací kardiostimulátoru a případně i před transplantací srdce v budoucnosti.
Katétrová ablace v současnosti dosahuje u pacientů s paroxyzmální FS 70-90% klinické účinnosti. Poměrně často je nutné výkon opakovat. Příčinou recidivy FS je obvykle zotavení myokardu v místě ablace a obnovení spojení svaloviny levé síně a PŽ. Kromě toho ablace samotná může změnit mechanizmus arytmie a vést ke vzniku organizovanějších forem FS nebo atypického flutteru, které jsou závislé na reentry šíření elektrické aktivace ve vlastním myokardu levé síně. Klinický cíl ablace je u FS do jisté míry odlišný od ostatních arytmií. Opakování ablace může vést teoreticky až k absolutní účinnosti. Pro mnohé pacienty je však významná redukce jejich potíží takovým přínosem pro život, že další invazivní řešení již nevyžadují. Indikace k opakované ablaci záleží také na adherenci k medikamentózní léčbě, pracovním zařazení a dalších aktivitách nemocného.
Klinická praxe v léčbě FS se v České republice výrazně liší. Indikace k ablaci pro FS i v běžných indikacích, nemluvě o indikacích pacientů se složitějším arytmogenním substrátem, a následná úspěšnost a bezpečnost provedení výkonu závisí ve velké míře na schopnostech a zkušenostech jednotlivých center a vyšetřujících. Na některých pracovištích je ablace prováděna rutinně se skiaskopickými časy nepřesahujícími 15 až 20 minut. Navzdory podobnému vybavení pracovišť jsou ale stále šance pacientů v jednotlivých regionech a v jednotlivých elektrofyziologických centrech velmi různé a situace se mění jen pomalu. Je to způsobeno obtížností výkonu. Kromě toho někteří elektrofyziologové v centrech s menšími počty výkonů vstupují přímo do éry ablace FS, aniž by získali erudici u stovek výkonů pro jednodušší a středně složité arytmie. Je to důsledek ubývání počtu méně složitých ablací díky rozšíření ablační léčby. Vzhledem k tomu, že v blízké budoucnosti lze očekávat rozvoj ablace pro FS jako metody první volby nebo alespoň metody používané v časné fázi nemoci, je třeba, aby se s technickým vývojem výkon zásadně zjednodušil a zrychlil. Jedině tehdy bude rutinně proveditelný ve všech elektrofyziologických centrech.
MUDr. Martin Fiala, Ph.D.
MUDr. Jan Chovančík
MUDr. Radek Neuwirth
MUDr. Renáta Nevřalová
MUDr. Otakar Jiravský
MUDr. Igor Nykl
prim. MUDr. Marian Branny
oddělení kardiologie, Kardiocentrum, Nemocnice Podlesí, a.s., Třinec
MUDr. Martin Fiala, Ph.D. (1963)
Promoval na LF Univerzity Palackého v Olomouci (1988). Získal 1. atestaci v oboru vnitřní lékařství (1991) a 2. atestaci v oboru kardiologie (1997). Obhájil disertační práci na téma Katétrová ablace flutteru síní I. typu a byl mu udělen titul Ph.D. (2001). Po studiích působil jako sekundární lékař nejprve na interním oddělení nemocnice v Moravské Třebové (1998–1990), poté na I. interní klinice LF UP a FN Olomouc (1990–2001) a posléze jako odborný asistent tamtéž (2001–2004), přitom souběžně pracoval na kardiologického oddělení Nemocnice Podlesí v Třinci (od r. 2001) a nyní souběžně působí na na Interní kardiologické klinice LF MU a FN Brno (od r. 2004). Působil také jako výzkumný pracovník v Department of Cardiological Sciences, St. George’s Hospital Medical School v Londýně (1996–97). Zaměřuje se na kardiologii a především klinickou elektrofyziologii, kardiostimulaci a ICD. Je autorem českých Doporučení pro diagnostiku a léčbu supraventrikulárních tachyarytmií. Je členem České lékařské společnosti, dále České kardiologické společnosti (Pracovní skupina pro arytmie a kardiostimulaci) a je členem redakční rady časopisu Intervenční a akutní kardiologie.
Sources
1. Wolf PA, Benjamin EJ, Belanger AJ et al. Secular trends in the prevalence of atrial fibrillation: the Framingham Study. Am Heart J 1996; 131 : 790-795.
2. Go AS, Hylek EM, Phillips KA et al. Prevalence of diagnosed atrial fibrillation in adults. National implications for rhythm management and stroke prevention: The Anticoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285 : 2370-2375.
3. Furberg CD, Psaty BM, Manolio TA et al. CHS Collaborative Research Group. Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular Health Study). Am J Cardiol 1994; 74 : 236-241.
4. Benjamin EJ, Wolf PA, D´Agostino RB et al. Impact of atrial fibrillation on the risk of death: The Framingham Heart Study. Circulation 1998; 98 : 946-952.
5. Wolf PA, Mitchell JB, Baker CS et al. Impact of atrial fibrillation on mortality, stroke, and medical costs. Arch Intern Med 1998; 158 : 229-234.
6. Dries DL, Aarons D, Exner DV et al. Atrial fibrillation is associated with an increased risk for mortality and heart failure progression in patients with asymptomatic and symptomatic left ventricular dysfunction. A retrospective analysis of the SOLVD trials. J Am Coll Cardiol 1998; 32 : 695-703.
7. Pedersen OD, Bagger H, Keller N et al. Efficacy of dofetilide in the treatment of atrial fibrillation-flutter in patients with reduced left ventricular function: A danish investigators of arrhythmia and mortality on dofetilide (diamond) substudy. Circulation 2001; 104 : 292-296.
8. Fromer MA. Indications and limitations of class I antiarrhytmic drugs in atrial fibrillation. Pacing Clin Electrophysiol 1994; 17 : 1016-1018.
9. Hohnloser SH. Indications and limitations of class II and III antiarrhytmic drugs in atrial fibrillation. Pacing Clin Electrophysiol 1994; 17 : 1019-1025.
10. The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002; 347 : 1825-1833.
11. Van Gelder IC, Hagens VE, Bosker HA et al. A comparison of rate control and ryhthm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 2002; 347 : 1834-1840.
12. Echt DS, Liebson PR, Mitchel LB et al. Mortality and morbidity in patients receiving encainide, flecainide, or placebo: the Cardiac Arrhythmia Suppression Trial. N Engl J Med 1991; 324 : 781-788.
13. The Cardiac Arrhythmia Suppression Trial Investigators. Effect of the antiarrhythmic agent moricizine on survival after myocardial infarction. N Engl J Med 1992; 327 : 227-233.
14. Waldo AL, Camm AJ deRuyter H et al. Effect of d-sotalol on mortality in patients with left ventricular dysfunction after recent and remote myocardial infarction. Lancet 1996; 348 : 7-12.
15. Julian DG, Camm AJ, Franglin G et al for the European Myocardial Infarct Amiodarone Trial Investigators. Randomized trial of effect of amiodarone on mortality in patients with left ventricular dysfunction after recent myocardial infarction: EMIAT. Lancet 1997; 349 : 667-674.
16. Cairns JA, Conolly SJ, Roberts R et al. for the Canadian Amiodarone Myocardial Infarction Arrhythmia Trial Investigators: Randomized trial of outcome after myocardial infarction in patients with frequent repetitive premature depolarisations: CAMIAT. Lancet 1997; 349 : 675-682.
17. Pappone C, Rosanio S, Augello G et al. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation. J Am Coll Cardiol 2003; 42 : 185-197.
18. Ho SY, Sanchez-Quintana D, Cabrera JA et al. Anatomy of the left atrium: Implications for radiofrequency ablation of atrial fibrillation. J Cardiovasc Eletrophysiol; 1999; 10 : 1525-1533.
19. Moe GK, Rheinboldt WC, Abildskov JA et al. A computer model of atrial fibrillation. Am Heart J 1964; 67 : 200-220.
20. Allesie MA, Lammers WJEP, Bonke FIM et al. Experimental evaluation of Moe´s zavelet hypothesis of atrial fibrillation. In: Zipes DP, Kalife J (eds). Cardiac Electrophysiology and Arrhythmias. Orlando: Grune & Stratton 1985.
21. Haïssaguerre M, Jais P, Shah DC et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339 : 659-666.
22. Mandapati R, Skanes A, Chen J et al. Stable microreentrant sources as a mechanism of atrial fibrillation in the isolated sheep heart. Circulation 2000; 101 : 194-199.
23. Jalife J, Berenfeld O, Mansour M. Mother rotors and fibrillatory conduction: A mechanism of atrial fibrillation. Cardiovasc Res 2002; 54 : 204-216.
24. Pappone C, Santinelli V, Mantiso F et al. Pulmonary vein denervation enhances long-term benefit after circumferential ablation for paroxysmal atrial fibrillation. Circulation 2004; 109 : 327-334.
25. Haïssaguerre M, Jais P, Shah DC et al. Right and left atrial radiofrequency catheter therapy of paroxysmal atrial fibrillation. J Cardiovasc Electrophysiol 1996; 7 : 1132-1144.
26. Maloney JD, Milner L, Barold S et al. Two-staged biatrial linear and focal ablation to restore sinus rhythm in patients with refractory chronic atrial fibrillation. Pacing Clin Electrophysiol 1998; 21 : 2527-2532.
27. Haïssaguerre M, Shah DC, Jais P et al. Electrophysiological breakthroughs from the left atrium to the pulmonary veins. Circulation 2000; 101 : 1409-1417.
28. Marrouche NF, Dresing T, Cole C et al. Circular mapping and ablation of the pulmonary vein for treatment of atrial fibrillation. J Am Coll Cardiol 2002; 40 : 464-474.
29. Pappone C, Oreto G, Rosanio S et al. Atrial electroanatomic remodelling after circumferential radiofrequency pulmonary vein ablation. Efficacy of an anatomic approach in a large cohort of patients with atrial fibrillation. Circulation 2001; 104 : 2539-2544.
30. Oral H, Scharf C, Chugh A et al. Catheter ablation for paroxysmal atrial fibrillation: segmental pulmonary vein ostial ablation versus left atrial ablation. Circulation 2003; 108 : 2355-2360.
31. Ouyang F, Bänsch D, Ernst S et al. Complete isolation of left atrium surrounding the pulmonary veins. New insights from the double-lasso technique in paroxysmal atrial fibrillation. Circulation 2004; 110(15): 2090-2096.
32. Nademanee K, Mckenzie J, Kosar E et al. A new approach for catheter ablation of atrial fibrillation: mapping of the electrophysiologic substrate. J Am Coll Cardiol 2004; 43 : 2044-2053.
33. Marrouche NF, Martin DO, Wazni O et al. Phased-Array intracardiac echocardiography monitoring during pulmonary vein isolation in patients with atrial fibrillation. Impact on outcome and complications. Circulation 2003; 107 : 2710-2716.
34. Chen SA, Hsieh MH, Tai CT et al. Initiation of atrial fibrillation by ectopic beats originating from the pulmonary veins: electrophysiologic characteristics, pharmacologic responses, and effects of radiofrequency ablation. Circulation 1999; 100 : 1879-1886.
35. Macle L, Jaïs P, Weerasooriya R et al. Irrigated-tip catheter ablation of pulmonary veins for treatment of atrial fibrillation. J Cardiovasc Electrophysiol 2002; 13 : 1067-1073.
36. Packer DL, Keelan P, Munger TM et al. Clinical presentation, investigation, and management of pulmonary vein stenosis complicationg ablation for atrial fibrillation. Circulation 2005; 111 : 546-554.
37. Pappone C, Oral H, Santinelli V et al. Atrio-esophageal fistula as a complication of percutaneous transcatheter ablation of atrial fibrillation. Circulation 2004; 109 : 2724-2726.
38. Cappato R, Calkins H, Chen SA et al. Worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circulation 2005; 111 : 1100-1105.
39. Hsu LF, Jaïs P, Sanders P et al. Catheter ablation for atrial fibrillation in congestive heart failure. N Engl J Med 2004; 351 : 2373-2383.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2006 Issue Supplementum-
All articles in this issue
- Katetrizační ablace srdečních arytmií v České republice – současný stav
- Neselektivní ablace AV-uzlu: nové aspekty v době kurativní léčby fibrilace síní a srdeční resynchronizační terapie
- Katetrizační ablace atrioventrikulární nodální reentry tachykardie: léčba první volby?
- Katetrizační ablace akcesorních spojek: vyřešená otázka?
- Katetrizační léčba typického flutteru síní včera a dnes
- Katetrizační ablace fibrilace síní: naděje pro všechny výrazně symptomatické pacienty
- Katetrizační ablace postincizionálních tachykardií: konečné řešení nebo paliativní léčba?
- Katetrizační ablace komorových tachykardií
- Katetrizační ablace fibrilace komor: realita nebo fikce?
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Katetrizační ablace atrioventrikulární nodální reentry tachykardie: léčba první volby?
- Katetrizační léčba typického flutteru síní včera a dnes
- Katetrizační ablace akcesorních spojek: vyřešená otázka?
- Neselektivní ablace AV-uzlu: nové aspekty v době kurativní léčby fibrilace síní a srdeční resynchronizační terapie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


