-
Medical journals
- Career
Neselektivní ablace AV-uzlu: nové aspekty v době kurativní léčby fibrilace síní a srdeční resynchronizační terapie
: M. Táborský; P. Neužil
: Kardiologické oddělení Nemocnice Na Homolce, Praha
: Kardiol Rev Int Med 2006, 8(Supplementum): 10-12
Řada studií o hovoří o pozitivním efektu ablace AV-junkce a implantace kardiostimulátoru u fibrilace síní rezistentní na farmakoterapii. Stimulace z hrotu pravé komory u nemocných s pokročilým srdečním selháním, fibrilací síní a síňokomorovou blokádou však znamená riziko zhoršení srdeční výkonnosti. Biventrikulární stimulace vede u těchto pacientů ke zlepšení systolické funkce levé komory a kvality života.
Klíčová slova:
fibrilace síní - ablace AV-junkce - srdeční resynchronizační terapieÚvod
Výskyt fibrilace síní (FS) a chronického srdečního selhání (CHSS) je v obecné populaci udáván v 1-2 % s jasnou závislostí prevalence na zvyšujícím se věku. FS je nejčastější supraventrikulární arytmií u nemocných s CHSS. Data z Framinghamské studie udávají vznik FS u 21 % pacientů s CHSS v průběhu 38letého sledování [1]. To znamená, že CHSS je spojeno s rizikem 4,5násobně, resp. 5,9násobně vyšším (muži/ženy) ve smyslu vývoje chronické FS než srovnatelná populace bez CHSS. Největší množství recentních dat o FS je k dispozici z analýz výsledků randomizovaných studií věnovaných CHSS z posledních 10-15 let. Např. ve studii CONCENSUS s enalaprilem byl výskyt FS u pacientů s pokročilým CHSS, funkční klasifikací NYHA IV až 50% [2]. Naproti tomu ve studii SOLVD, která zahrnovala nemocné s dysfunkcí levé komory (LK) bez symptomatického srdečního selhání, byl výskyt FS pouze 4% [3]. Z metaanalýzy těchto studií je možno vysledovat určitou závislost závažnosti CHSS a prevalence FS [4], i když tato skutečnost bude jistě ovlivněna řadou dalších faktorů (ischemická vs neischemická kardiomyopatie, chlopenní vady, přidružená onemocnění, adekvátní léčba CHSS aj). Zajímavá je otázka prognostického významu FS u nemocných se srdečním selháním. Přestože máme k dispozici jasné údaje o zvýšené mortalitě nemocných s FS v obecné populaci a u nemocných po infarktu myokardu, o otázce vlivu FS na mortalitu pacientů s CHSS je možno najít v literatuře zcela kontroverzní data. Řada prací deklaruje negativní vliv FS na mortalitu u CHSS, např. Wyse et al ve studii AVID s 2 848 nemocnými s významnou dysfunkcí LK udává FS jako nezávislý rizikový faktor mortality (p = 0,019) [5]. Několik prací pak udává nesignifikantní ovlivnění mortality této populace nemocných [6]. Přesto lze konstatovat, že FS je možno na základě výsledků velkých randomizovaných studií obecně považovat za nezávislý rizikový faktor mortality nemocných se srdečním selháním.
Změna postavení neselektivní ablace AV-junkce v současnosti
Neselektivní ablace AV-junkce (AVJ) vedoucí k vytvoření AV-blokády 3. stupně je účinným postupem ke kontrole komorové odpovědi u symptomatických nemocných s FS. Historicky byla indikována u nemocných, jejichž symptomy byly následkem nepravidelné komorové odpovědi nebo v případech, v nichž nebylo možno efektivně kontrolovat frekvenci komor medikamentózně, resp. v nichž byla antiarytmika blokující antegrádní převod kontraindikována a v nichž došlo k vývoji tachykardické kardiomyopatie. Počátky neselektivní ablace AVJ je možno datovat do období ablací výbojem stejnosměrného proudu, kdy byla často život zachraňujícím výkonem (např. u WPW-syndromu s velmi rychlým vedením přídatnou dráhou aj). Ještě v roce 1995 bylo celosvětově provedeno více než 15 000 radiofrekvenčních ablací AVJ s implantací kardiostimulátoru [7].
Po zavedení kurativní léčby FS – izolace plicních žil katetrizační cestou a procedury MAZE kardiochirurgickou cestou - se postavení neselektivní ablace AVJ postupně mění. V současné době považujeme tuto léčbu, a to zejména u nemocných s normální funkcí levé komory za „ultima ratio“. Přesto, pokud byly vyčerpány možnosti farmakologické i nefarmakologické léčby a není možno jiným způsobem dosáhnout ovlivnění symptomů (palpitace, dyspnoe, srdeční selhání, frekvence komor > 120/min), je neselektivní ablace AVJ v kombinaci s implantací kardiostimulátoru plně indikována [8]. To platí velmi dobře zejména pro starší nemocné (věk > 75 let), u nichž by měla být naším cílem také snaha o „fyziologičtější stimulaci pravé komory po provedené ablaci AVJ“, např. septální poloha pravokomorové elektrody s aktivací blížící se fyziologické sekvenci.
Neselektivní ablace AV-junkce u pokročilého srdečního selhání s komorovou dyssynchronií
Radiofrekvenční ablace AVJ a stimulace pravé komory mohou zmírnit symptomy a zlepšit kvalitu života u řady nemocných s FS refrakterní na kontrolu komorové odpovědi [9]. V mnoha případech vedou i k zvýšení ejekční frakce. Nicméně existují nemocní, u kterých může dojít po provedení výše uvedené léčby naopak k progresi CHSS. Abnormální aktivace levé komory, způsobená stimulací pravé komory z oblasti hrotu, může u nemocných s výraznou dysfunkcí LK vést k absenci očekávaného zlepšení symptomů, které můžeme pozorovat u skupiny s normální, nebo jen lehce sníženou funkcí LK.
Stimulace z hrotu pravé komory s typickou morfologií blokády levého raménka Tawarova a prodloužením trváním komplexu QRS vede k podobným hemodynamickým a echokardiograficky dokumentovaným změnám (snížení EF LK, systolického tlaku LK, srdečního výdeje aj) jako nativní BLRT [10]. To je také pravděpodobným vysvětlením kontroverzních výsledků studie ABLATE and PACE [11] a studie PAVE [12]. Srdeční resynchronizační terapie kompenzuje mechanické a elektrofyziologické abnormality spojené s přítomností inter - a intraventrikulárního zpoždění v populaci nemocných s dysfunkcí levé komory a komorovou dyssynchronií. Výsledkem je zlepšení funkční kapacity, ústup symptomatologie a zvýšení kvality života. V poslední době byl prokázán i příznivý dopad na prognózu nemocných – tj. pokles mortality [13-15]. Přestože jsou v současné době k dispozici výsledky studií s více než 4 000 nemocnými se srdeční resynchronizační léčbou, pouze minimum bylo provedeno u pacientů s permanentní FS. Jedinou výjimkou je studie MUSTIC-AF [16], která sledovala 53 nemocných s FS při resynchronizační terapii (tab. 1). V publikovaných datech není možno jednoznačně dohledat, kolik nemocných ze souboru podstoupilo ablaci AVJ. Jednou z mála prací, která systematicky studovala efekt resynchronizační léčby u nemocných s FS a AV-blokádou, byla Hayova studie z Johns Hopkins Hospital (Baltimore, MD, USA) [17], která srovnávala akutní hemodynamický efekt stimulace z pravé komory (apex nebo výtokový trakt), levé komory, bifokální pravokomorové a biventrikulární stimulace. Simultánní biventrikulární stimulace vedla k signifikantnímu zlepšení systolické a diastolické funkce LK ve srovnání s pravokomorovou nebo izolovanou levokomorovou stimulací u nemocných s komorovou dyssynchronií, FS a pokročilou AV-blokádou (tab. 2). Naopak programace různých hodnot zpoždění aktivace pravé a levé komory neprokázala další aditivní hemodynamický efekt. Leon et al prokázali v 6měsíčním sledování 21 nemocných s chronickou FS, kteří byli indikováni k srdeční resynchronizační léčbě a kterým byla provedena neselektivní ablace AVJ, signifikantní zlepšení systolické funkce LK, funkční klasifikace a kvality života. Kromě toho ověřil i snížení endsystolického a enddiastolického rozměru LK a dále významný pokles opětovných hospitalizací pro srdeční selhání [18]. První zprávy z malých souborů nemocných hovoří také o možnosti nastolení sinusového rytmu po správném provedení biventrikulární stimulace, a to i u pacientů s několikaletou anamnézou chronické FS [19].
1. SRT – přehled randomizovaných studií. 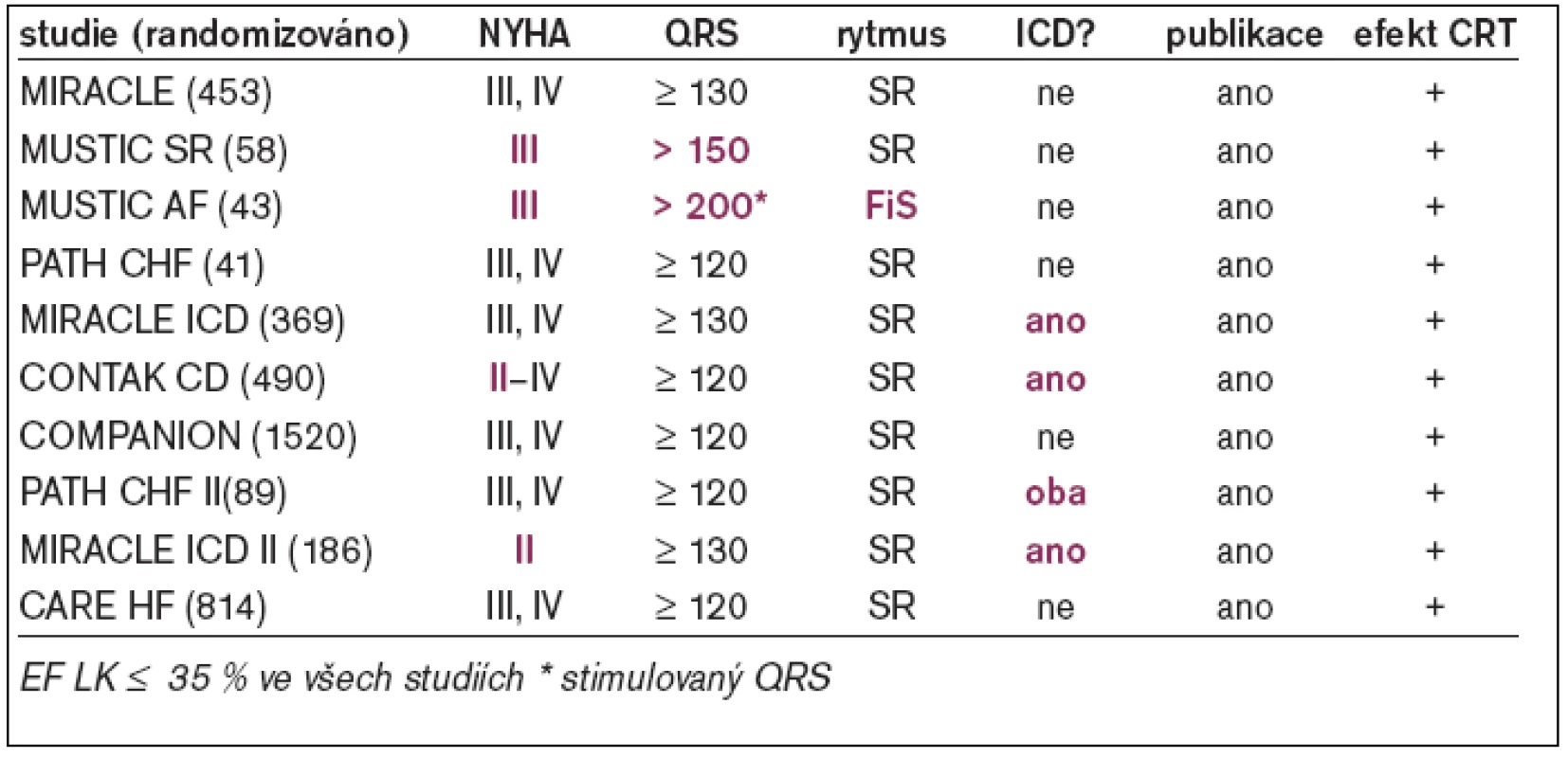
2. Systolická funkce LK vs různé stimulační režimy. 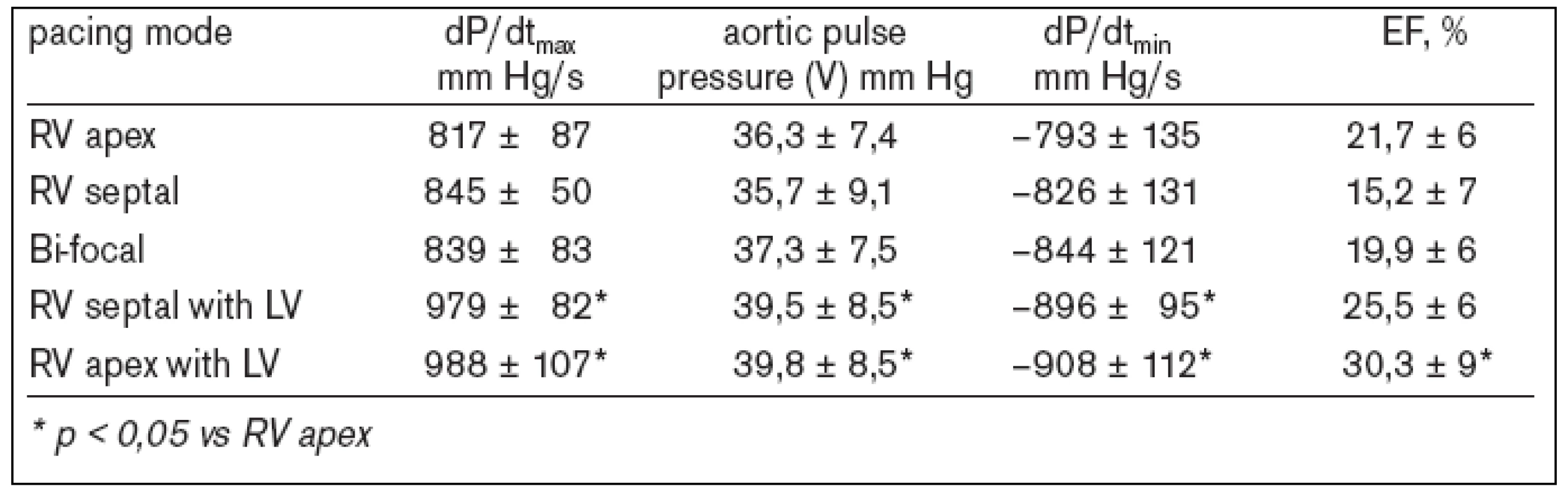
Technické aspekty a rizika neselektivní ablace AV-junkce
Elektrofyziologickým cílem radiofrekvenční ablace AVJ je dosažení kompletní AV-blokády s pokud možno zachovaným stabilním junkčním rytmem. Technicky se obvykle jedná o nejjednodušší typ ablace vůbec. Úspěšnost výkonu se pohybuje okolo 100 %, výjimečně je ablace z žilního přístupu nemožná, a je nutno provést přerušení AV-převodu retrográdně z výtokového traktu levé komory [20]. U nemocných s pokročilým srdečním selháním, výraznou remodelací LK, mitrální regurgitací a dilatací pravé síně, může být problémem stabilita ablačního katétru v oblasti Hisova svazku. Ta může být zlepšena použitím dlouhých a preformovaných stabilizačních zavaděčů. Jistou alternativou katetrizačního přerušení AVJ je modifikace AV-uzlu s cílem zpomalení AV-převodu. Ablace je v tomto případě prováděna v oblasti středního septa [21]. Efektu lze dosáhnout asi u 70 % nemocných, cca 30 % vyžaduje implantaci kardiostimulátoru. Lepší výsledky lze očekávat u nemocných s prokázanou funkční dualitou AV-uzlu. Výhodou tohoto přístupu je kontrola komorové odpovědi u řady nemocných bez nutnosti trvalé kardiostimulace. Nevýhodou je riziko pozdního vzniku AV-blokády, manifestace polymorfních komorových tachykardií a menší symptomatická úleva ve srovnání s kompletní ablací AVJ [22].
Po ablaci následuje implantace kardiostimulátoru, optimálně s frekvenční adaptací a s možností aktivní fixace komorové elektrody. Příklad RTG-obrazu nemocného s implantovaným biventrikulárním systémem, septálně uloženou komorovou elektrodou a duální levokomorovou stimulací je uveden na obr. 1. Zda implantovat také síňovou elektrodu, není jednoznačné. Konverze na sinusový rytmus je spíše výjimečná, na druhé straně mohou data ze síňového kanálu přispět ke zlepšení specificity a senzitivity algoritmů diferenciace supraventrikulárních a komorových tachykardií u implantabilních kardioverterů-defibrilátorů.
1. SRT u chronické FiS – po RFA AVJ. 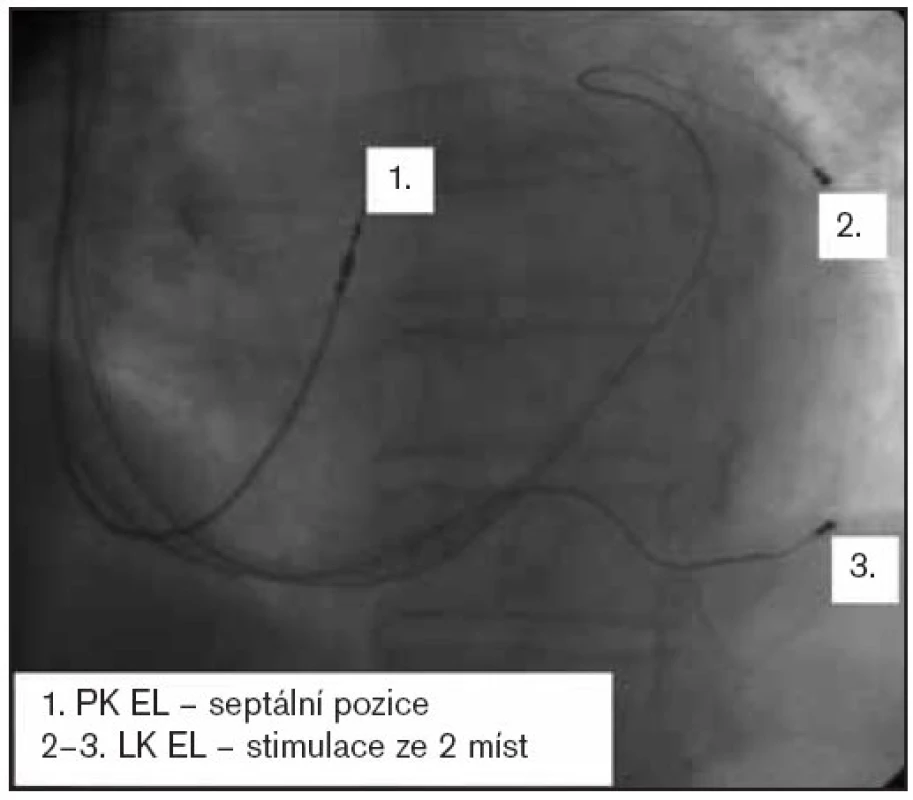
Důležité je, že stimulační frekvence by se měla v průběhu prvních 4-6 týdnů po ablaci AVJ pohybovat v rozmezí 80-90/min s cílem prevence polymorfních komorových tachykardií nebo fibrilace komor spouštěných relativní bradykardií. Tento proarytmogenní efekt může být následkem iniciálního prodloužení a zpomalení repolarizace díky akutnímu poklesu srdeční frekvence a změnám sekvence elektrické aktivace komor. Elektrická nestabilita se vyskytuje u méně než 1 % nemocných po ablaci AVJ [23].
Nedílnou součástí péče o tyto nemocné je antikoagulační léčba s cílovým dosažením INR 2,5-3,5 [24]. V některých případech může dojít ke krvácení do kapsy kardiostimulátoru, resp. ICD při podávání nízkomolekulárního heparinu během výkonu. Přítomnost hematomu zvyšuje riziko sekundární infekce. Proto doporučujeme zajistit místo implantace Redonovým drénem po dobu minimálně 24 hodin.
Závěry
Neselektivní ablace AVJ s vytvořením AV-blokády 3. stupně je účinným postupem ke kontrole komorové odpovědi u vysoce symptomatických nemocných s FS nebo atypickým flutterem síní. Díky současným možnostem léčby FS a CHSS bychom měli ke kontrole komorové frekvence pomocí radiofrekvenční ablaci AVJ přistupovat následujícím způsobem:
- Jasně preferovat kurativní výkony u FS (izolace plicních žil, MAZE).
- V současné době je nepřípustné provedení katetrizační ablace AVJ u paroxyzmální FS, u níž je možné kauzální řešení.
- K radiofrekvenční ablaci AVJ jsou indikováni vysoce symptomatičtí nemocní, u nichž není efektivní jiný nefarmakologický, nebo farmakologický přístup, nebo u nichž jsou limitací přidružená onemocnění, věk, vedlejší účinky antiarytmické léčby aj.
- Katetrizační ablace AVJ je účinná u nemocných s pokročilým CHSS, komorovou dyssynchronií a chronickou FS, kteří jsou indikováni k biventrikulární stimulaci [25]. Zlepšení symptomů CHSS a FS je ovlivněno regularizací rytmu a umožněním 100% resychronizace komor se všemi pozitivními důsledky této léčby.
MUDr. Miloš Táborský, CSc.
MUDr. Petr Neužil, CSc.
kardiologické oddělení Nemocnice Na Homolce, Praha
MUDr. Miloš Táborský, CSc. (1962)
Promoval na FVL Univerzity Karlovy v Praze (1986). Získal atestaci v oboru kardiologie (1995). Obhájil disertační práci na téma Srdeční resynchronizační léčba (2001) a byla mu udělena hodnost CSc. (2001). Působí na kardiologickém oddělení Nemocnice Na Homolce (od r. 1989), nyní jako vedoucí kardiostimulačního centra. Je členem České kardiologické společnosti (předseda Pracovní skupiny Arytmie a trvalá kardiostimulace), dále Deutsche Kardiologische Gesellschaft a Electrophysiology Society (USA). Je autorem 92 publikací, 11 zahraničních, 21 zahraničních přednášek.
Sources
1. Kannel WB, Wolf PA, Benjamin EJ, Lewy D. Prevalence, incidence, prognosis, and predisposing conditions for atrial fibrillation: Population-based estimates. Am J Cardiol 1998; 82(8A): 2-9.
2. The CONCENSUS trial study group. Effects of enalapril on mortality in severe congestive heart failure. N Engl J Med 1987; 316 : 1429-35.
3. Johnstone D, Limacher M, Rousseau M et al. Clinical characteristics of patients in studies of left ventricular dysfunction (SOLVD). Am J Cardiol 1992; 70(9): 894-900.
4. Crijns HJCG, Tjeerdsma G, deKam PJ et al. Prognostic value of presence and development of atrial fibrillation in patients with advanced chronic heart failure. Eur Heart J 2000; 21(15): 1238-45.
5. Wyse DG, Love JC, Tao O et al. Atrial fibrillation: a risk factor for increased mortality - an AVID registry analysis. J Interv Card Electrophysiol 2001; 5(3): 267-73.
6. Convert G, Delaye J, Beaune J et al. Prognosis of primary non-obstructive cardiomyopathies. Arch Mal Coeur Vaiss 1980; 73(3): 227-37.
7. Bernstein AD, Parsonnet V. Survey of cardiac pacing and defibrillation in the United States in 1995. Am J Cardiol 1996; 78 : 178-196.
8. Fiala M. Doporučené postupy pro diagnostiku a léčbu supraventrikulárních tachyarytmií. Cor Vasa 2005; 47, 9 : 18-39.
9. Wood MA, Brown-Mahoney C, Kay GN et al. Clinical outcomes after ablation and pacing therapy for atrial fibrillation: a meta-analysis. Circulation 2000; 101 : 1138-44.
10. Rosenquist M, Brandt J, Schuller H. Long term pacing in sinus node disease: effects of stimulation mode on cardiovascular morbidity and mortality. Am Heart J 1988; 116 : 16-22.
11. Kay GN, Ellenbogen KA, Giudici M et al. The Ablate and Pace Trial: a prospective study of catheter ablation of the AV conduction system and permanent pacemaker implantation for treatment of atrial fibrillation. J Interv Card Electrophysiol 1998; 2 : 121-35.
12. Daoud E, Doshi R, Fellows C et al. Ablate and pace with cardiac resynchronization therapy for patients with reduced ejection fraction: Subgroup analysis of PAVE study. Heart Rhythm 2004; 1: S59 (Abstract 181).
13. Bardy GH, Lee KL, Mark DB et al for the Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) investigators. Amiodarone or implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med 2005; 352 : 225-37.
14. Bristow MR, Saxon LA, Boehmer J et al for COMPANION investigators. Cardiac –resynchronization therapy without an implantable defibrillator in advanced chronic heart failure. N Engl J Med 2004; 350 : 2140-50.
15. Cleland JGF, Daubert JC, Erdmann E et al. for CARE-HF Study investigators. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005; 352 : 1539-49.
16. Leclerq C, Walker S, Linde C et al. Comparative effects of permanent biventricular and right-univentricular pacing in heart failure patients with chronic atrial fibrillation. European Heart J 2002; 23 : 1780-1787.
17. Hay I, Melenovsky V, Fetics BJ et al. Short-term effects of righrt-left heart sequential cardiac resynchronization in patients with heart failure, chronic atrial fibrillation, and atrioventricular block. Circulation 2004; 110 : 3404-3410.
18. Leon RL, Greenberg JM, Kanuru N et al. Cardiac resynchronization in patients with congestive herat failure and c hronic atrial fibrillation. J Am Coll Cardiol 2002; 39 : 1258-1263.
19. Valls-Bertault V, Fatemi M, Gilard M et al. Assessment of upgrading to biventricular pacing in patients with right ventricular pacing and congestive heart failure after atrioventricular junctional ablation for chronic atrial fibrillation. Europace 2004; 6 : 438-443.
20. Toubol P. Atrioventricular nodal ablation and pacemaker implantation in patients with atrial fibrillation. Am J Cardiol 1999; 83(5B): 241-245.
21. Morrady F, Hasse C, Stricberger SA et al. Long-term follow-up after radiofrequency modification of atrioventricular mode in patients with atrial fibrillation. J Am Coll Cardiol 1997; 29 : 113-121.
22. Proclemer A, DellaBellaP, Tondo C et al. Radiofrequency ablation of atrioventricular junction and pacemaker implantattion versus modulation of atrioventricular conduction in drug refractory atrial fibrillation. Am J Cardiol 199; 83 : 1437-1442.
23. Geelen P, Brugada J, Andries E et al. Ventricular fibrillation and sudden cardiac death after radiofrequency catheter ablation of the atrioventricular junction. PACE 1997; 20 : 343-348.
24. Čihák R, Heinc P. Doporučení pro léčbu fibrilace síní. Cor Vasa 2004; 46(5K): 67-77.
25. Táborský M, Kautzner J, Bytešník J et al. Zásady pro implantace kardiostimulátorů, implantabilních kardioverterů-defibrilátorů a srdeční resynchronizační léčbu. Cor Vasa 2005; 47 : 59-68.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2006 Issue Supplementum-
All articles in this issue
- Catheter ablations of cardiac arrhytmias in Czech republic: contemporary state
- AV node ablation: new aspects in the time of curative therapy of atrial fibrillation and cardiac resynchronization therapy
- Catheter ablation of atrioventricular nodal reentrant tachycardia: therapy of the first choise?
- Catheter ablation of accessory links: solved question?
- Catheter-based treatment of common atrial flutter yesterday and today
- Catheter ablation of atrial fibrillation: hope for all highly symptomatic patients.
- Catheter ablation of postincisional tachycardias: final solution or palliative treatment?
- Catheter ablation of ventricular tachycardia
- Catheter ablation of ventricular fibrillation: reality or fiction?
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Catheter ablation of atrioventricular nodal reentrant tachycardia: therapy of the first choise?
- Catheter-based treatment of common atrial flutter yesterday and today
- Catheter ablation of accessory links: solved question?
- AV node ablation: new aspects in the time of curative therapy of atrial fibrillation and cardiac resynchronization therapy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


