-
Medical journals
- Career
Monitorování počítačem zpracovaného EEG v anestezii II
Authors: M. Horáček
Authors‘ workplace: Katedra anesteziologie a intenzivní medicíny, Institut postgraduálního vzdělávání ve zdravotnictví, Praha ; Klinika anesteziologie, resuscitace a intenzivní medicíny, 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole, Praha
Published in: Anest. intenziv. Med., 33, 2022, č. 3-4, s. 153-160
Category: Review Article
doi: https://doi.org/10.36290/aim.2022.025Overview
Monitorování počítačem zpracovaného EEG (pEEG) se v současnosti používá ve čtyřech indikacích. Přínos byl prokázán u zkrácení dob probouzení a zotavení a ke snížení rizika nechtěné bdělosti v průběhu anestezie technikou TIVA, kdežto v indikacích prevence příliš hluboké anestezie a personalizace vedení anestezie je prozatím sporný. Intuitivně se zdá, že personalizované vedení anestezie s využitím údajů nejenom z pEEG, ale i z dalších základních monitorů by výsledky zlepšit mohlo. Příslušné studie ještě probíhají. Pro personalizaci anestezie jsou vhodné právě spektrogramy, které se získávají Fourierovou transformací syrové EEG křivky. Ve spektrogramech jsou mezi jednotlivými anestetiky výrazné rozdíly, které jsou podmíněny různým mechanismem účinků a různým ovlivněním neuronových okruhů v mozku. Užitečné jsou rovněž parametry jako mediánová frekvence a frekvence spektrálního okraje (Spectral Edge Frequency). Spektrogramy zobrazují monitory, které jsou v ČR již běžně dostupné, jako SedLine Sedation Monitor, Conox či přístroje BIS novější generace. K titraci antinocicepce v anestezii lze využít nejen pEEG, ale i další parametry ze základního monitorování, jako jsou compliance dýchacího systému, rozdíl mezi vdechovanou a vydechovanou koncentrací kyslíku, Surgical Plethysmography Index z pulzní oxymetrie. Změny EEG při stárnutí a využití spektrogramů v úvodu, při vedení a probouzení z anestezie budou předmětem třetí části tohoto souboru článků.
Klíčová slova:
anestezie – EEG – index hloubky anestezie – spektrogram – Fourierova transformace
Úvod
V první části tohoto souboru přehledových článků o monitorování počítačem zpracovaného EEG (pEEG) v anestezii byly představeny jeho dvě počáteční etapy [1]. V první se jednalo o vedení anestezie především podle indexů její hloubky (BIS, entropie) v druhé se k indexům přidalo hodnocení frekvence, amplitudy a tvarů syrové křivky EEG (burst suppression (BS) a phase‑amplitude coupling). Stručně byly rovněž popsány i v ČR zřejmě nejpoužívanější přístroje jako Bispectral Index monitor firmy Medtronic (USA) a Entropy Module firmy Datex‑Ohmeda (Finsko), resp. GE Healthcare (USA).
K indikacím monitorování pEEG patří:
1. prevence nechtěné bdělosti v průběhu operace. Při anestezii technikou TIVA je monitorování pEEG nyní jednoznačně podpořeno odbornými společnostmi včetně ČSARIM [2], ale podle doporučení ze září 2021 ze Spojeného království (UK) by se mělo uvážit i u doplňované anestezie založené na inhalačních látkách [3].
2. prevence příliš hluboké anestezie. V této indikaci je cílem předejít nebo alespoň snížit riziko emergentního či pooperačního deliria a/nebo kognitivní dysfunkce. Přínos pEEG však podle dostupných poznatků nebyl ani u jednoho z těchto výsledků dosud bezpečně prokázán.
3. zkrácení doby probouzení a doby zotavení z anestezie. V tomto byl užitek pEEG nepochybně potvrzen [4], takže proto lze pEEG používat v klinické praxi i mimo studie [5]. Bohužel, většinou jde o úsporu jen asi 5 minut, což zřejmě není příliš významné.
4. personalizované vedení anestezie. Cílem je vyhnout se příliš mělké i příliš hluboké anestezii a optimalizovat analgezii vhodnou titrací hypnotické i antinociceptivní složky celkové anestezie. Titrace je možná proto, že pEEG ukazuje reakci mozku jednotlivého pacienta na stimulace během výkonu i na podávané látky, kdežto hodnoty MAC (minimální alveolární koncentrace) jsou populačním, nikoliv individuálním parametrem, jenž je definován absencí reakce na kožní řez. Navíc, i kožní řez na různých místech těla představuje různě intenzivní podnět (na hrudníku oproti na dolní končetině, např. v kardiochirurgii). Při personalizaci anestezie se využívají kromě indexů hloubky anestezie posuzovaných vždy spolu s křivkami EEG právě i spektrogramy.
V tomto článku je popsáno, jak se provádí spektrální analýza EEG a jak vypadají spektrogramy používaných anestetik. Stručně budou rovněž představeny i přístroje SedLine® Sedation Monitor firmy Masimo a Conox (Quantium Medical, resp. Fresenius Kabi), které spektrogramy stejně jako monitory BIS nové generace zobrazují. V navazujícím třetím článku se bude pojednávat o změnách EEG při stárnutí a o využití spektrogramů v jednotlivých stadiích anestezie, tj. při úvodu, vedení a probouzení.
Spektrální analýza
Elektroencefalografie (EEG) snímá, registruje, zpracovává a zobrazuje na monitoru postsynaptické potenciály vytvářené neurony v kůře mozku (rytmy). V současnosti se křivka a/nebo křivky z více svodů snímajících rozdíl potenciálů mezi dvěma místy na lebce zpracovávají počítačem (pEEG). Hodnotí se tvary, frekvence a amplituda oscilací, v případě více svodů i jejich korelace (lineární závislost ve vybraných kmitočtových pásmech mezi jednotlivými oblastmi kůry) a koherence (měřítko synchronie mezi dvěma signály téže frekvence). Dnešní EEG monitory jsou digitální, křivky snímají v diskrétních okamžicích v čase s určitou vzorkovací frekvencí, ale hodnoty amplitud (voltáž) se interpolují do spojité křivky.
EEG křivku jako signál lze zkoumat v doméně časové (jak se mění v čase, změny od bdělosti až k isoelektrické linii), nebo frekvenční (kolik výkonu signálu leží v každém daném frekvenčním pásmu v rozsahu snímaných frekvencí). Stejným způsobem se dají zpracovávat i záznamy ostatních fyziologických funkcí, které jsou v podobě vln, např. EKG, krevní tlak.
Ve frekvenční doméně je signál měnící se v čase vyjádřen součtem vhodných periodických funkcí, např. sinusoid (Fourierův teorém). Výpočet se provádí po segmentech (epocha) EEG křivky, které trvají několik sekund (obvykle 2–3 s) a částečně (např. až ze 75 %) se překrývají. Mezi časovou a frekvenční doménou lze signál vzájemně převádět. Fourierova transformace (FT) převádí časovou funkci na součet sinusoid různých frekvencí (1/s, tj. Hertz, Hz), amplitud (μV) a fázového posunu (stupně, nebo radiány, π) jejich začátku (obr. 1). Tyto tři parametry každou sinusoidu plně charakterizují. Každá sinusoida představuje jednu frekvenční složku spektra přítomných frekvencí. Analogií FT je rozklad bílého světla na složky po průchodu optickým hranolem. Frekvenční pásma ve spektru se rozdělují obvyklým způsobem, tj. od pomalých vln (SW, Slow Waves, < 0,5–1 Hz) až po γ (gama, > 30 Hz), byť hranice mezi nimi nejsou vždy zcela jednotné.
Image 1. Parametry sinusoid vytvořených Fourierovou transformací: frekvence f (1/s = Hertz, Hz), amplituda A (μV), fázový posun θ (stupně, nebo radiány) 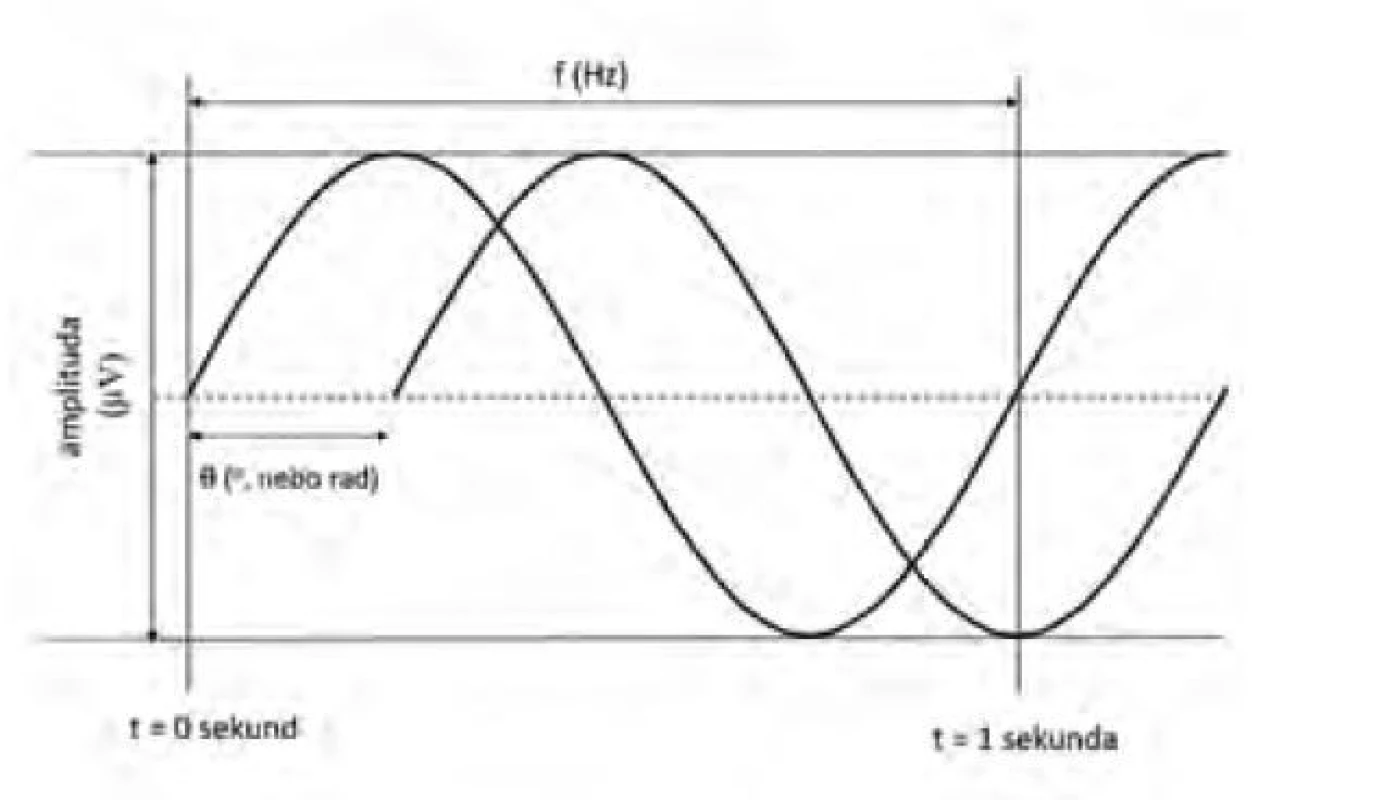
Frekvenční spektrum zobrazuje frekvence přítomné v křivce EEG, jejich amplitudy a fáze posunu v období jedné epochy. Je prostorové, a proto je možné pozorovat ho ze strany amplitud (frekvence na ose x, amplituda na ose y, amplitudové či výkonové spektrum, obr. 2), resp. ze strany fází (frekvence na ose x vs. fáze na ose y, fázové spektrum).
Image 2. Schéma Fourierovy transformace dvou sinusoid s frekvencemi 1 a 2 Hz se stejnou amplitudou a fází z časové do frekvenční domény 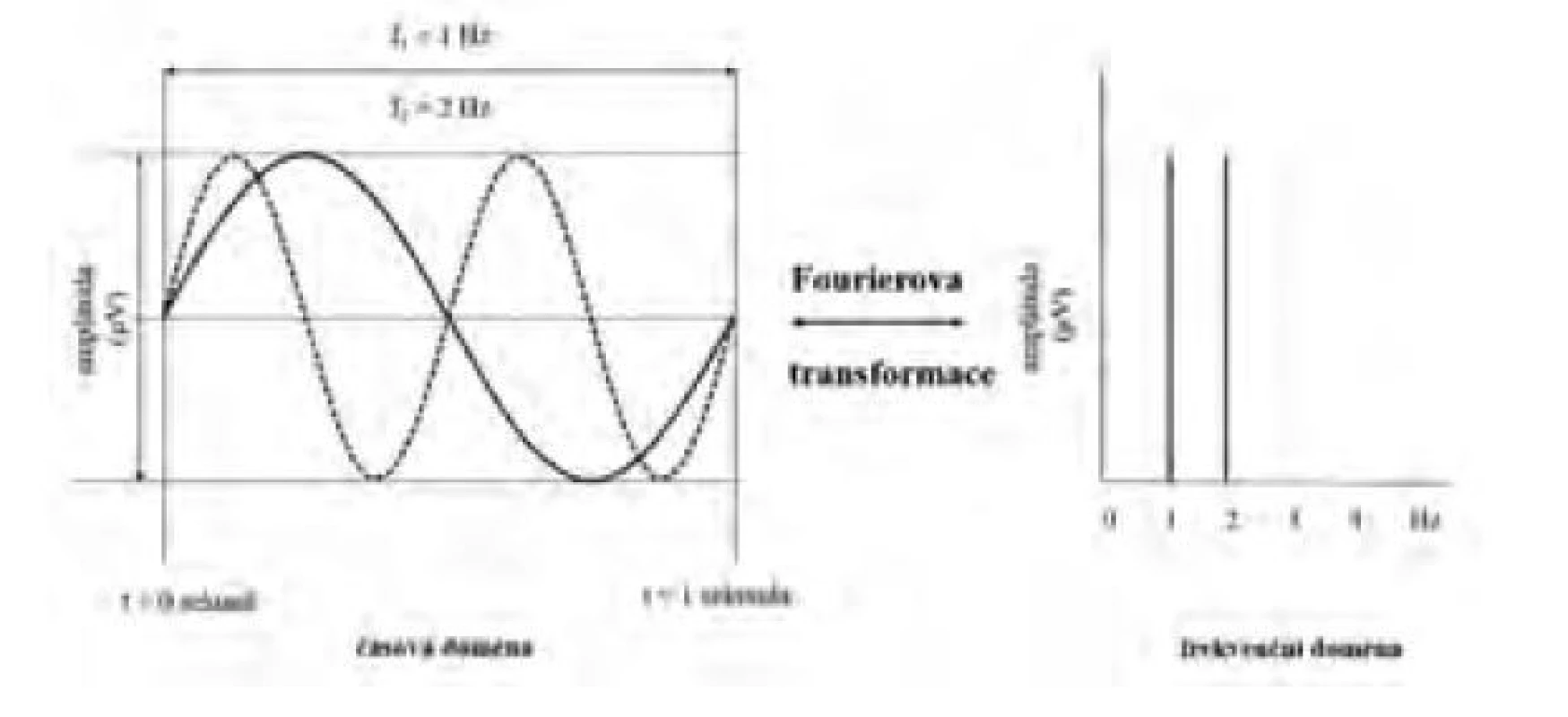
Fourierova transformace (analýza) je na výpočet složitá a časově náročná, a proto se v praxi nahrazuje výpočtem podle algoritmu rychlé FT (Fast FT, FFT). Z frekvenční domény lze inverzní FT (Fourierovou syntézou) vytvořit zpět signál v časové doméně.
Výkonové (power) spektrum ukazuje, jaký (tepelný) výkon by měla daná frekvenční složka signálu, pokud by byla chápána jako elektrické napětí U měnící se v čase (Ut) na jednotkovém odporu. Okamžitý výkon je U2/R, je‑li R = 1, lze ho zanedbat. Proto jsou jednotkou výkonu ve výkonovém spektru EEG μV2. Jelikož se však amplitudy jednotlivých frekvencí mohou měnit řádově, používá se na ose y pro výkon často logaritmická stupnice a jednotky decibely (dB) jako u zvukových signálů.
Výkonové spektrum je zobrazeno rovněž za trvání jedné epochy, tj. za období obvykle asi 2 sekund. Jelikož anestezie trvá mnohem déle, lze vývoj v čase postihnout řazením výkonových spekter za sebou podle osy zezadu směrem dopředu. Toto zobrazení se označuje jako trojrozměrný spektrogram (3D spektrogram, Compressed Spectral Array), na ose x je frekvence, na ose y výkon (μV2, dB), na ose z čas. Bohužel, stále se jedná o trojrozměrné zobrazení, jehož hodnocení je obtížné. Pro zjednodušení se proto 3D spektrogram převádí na dvourozměrný spektrogram (Density Spectral Array), a to rotací CSA zobrazení doleva o 90o. Frekvence se tak z osy x posune na svislou osu y, zatímco čas z osy z se dostane na osu x, přičemž amplituda z osy y se nyní kóduje barevně. Vyšší amplitudy jsou červené (25 dB), nižší postupně oranžové, žluté, zelené a nejnižší modré (-25 dB, záporné hodnoty proto, že jde o logaritmy, tj. hodnoty dB nižší než 1. Citlivost lze upravit, aby byly oscilace zejména v α pásmu jasně patrné). Celý postup od syrové EEG křivky až po 2D spektrogram je znázorněn na obr. 3.
Image 3. Transformace syrové EEG křivky do dvourozměrného spektrogramu. a) syrová EEG křivka v jedné epoše, b) zjednodušené schéma Fourierovy transformace syrové EEG křivky na dvě sinusoidy, červená s pomalou frekvencí, bílá s rychlejší frekvencí, c) výkonové spektrum epochy, vyznačena mediánová frekvence a frekvence spektrálního okraje (SEF95), tj. frekvence, pod nimiž je 50 %, resp. 95 % výkonu, d) trojrozměrný spektrogram, v němž jsou jednotlivá výkonová spektra řazena v čase odzadu dopředu, výkon (dB) je na ose y a současně je vyznačen barevně, e) dvourozměrný spektrogram, v němž je čas na ose x, frekvence na ose y a výkon (dB) kódován barevně 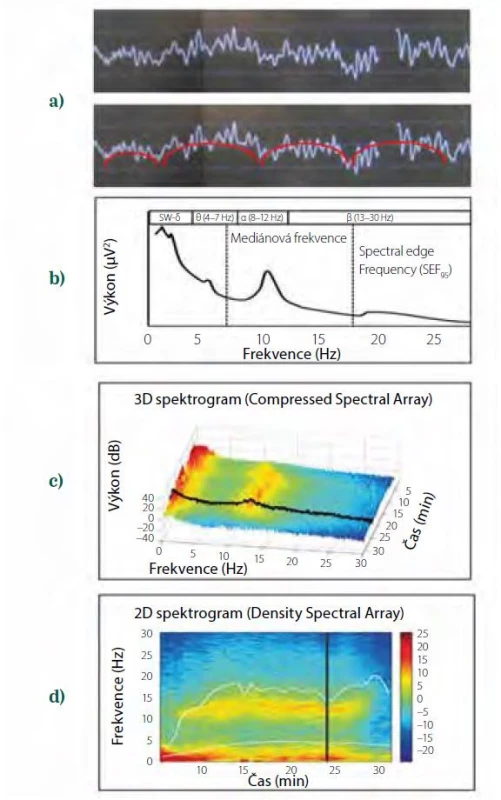
Současné monitory zobrazují vedle grafického spektra i další spektrální parametry. Mediánová frekvence je frekvence, která rozděluje výkon ve spektru na dvě poloviny. Spectral edge frequency (SEF, frekvence spektrálního okraje) je frekvence, pod níž leží 90 (SEF90) nebo 95 (SEF95) % výkonu ve spektru. Oba parametry usnadňují posouzení, kam se výkon ve spektru při změně hloubky anestezie posunuje. Čím je anestezie hlubší, tím jsou tyto hodnoty u anestetik působících prostřednictvím GABA nižší.
Příliš hluboká anestezie vede na syrové křivce až k jevu burst suppression (BS), resp. až k isoelektrické linii. Obraz BS na spektrogramu tvoří střídání svislých černých linií s tmavě modrou patkou, což jsou období supresí, kdy je amplituda křivky EEG nižší než prahová, s bursty (obr. 4). Znovu je třeba upozornit, že algoritmy automatické detekce nemusí skutečný výskyt BS detekovat přesně [6, 7]. Navíc, bursty (křivka i spektrum), se také mění s použitým anestetikem a s věkem [8].
Image 4. Burst suppression: EEG a spektrogram u 75leté pacientky (propofol, sufentanil, sevofluran). V horní části syrové EEG křivky, zleva 3 sekundy isoelektrická linie, v čtvrté sekundě burst, hodnota PSI (Patient State Index) 21, v dolní části Suppression Ratio (SR) 22 (ideálně 0, EEG bez BS), na spektrogramu za posledních 20 minut v pravé části obraz BS: černé sloupce s modrou patkou přerušující spektrum 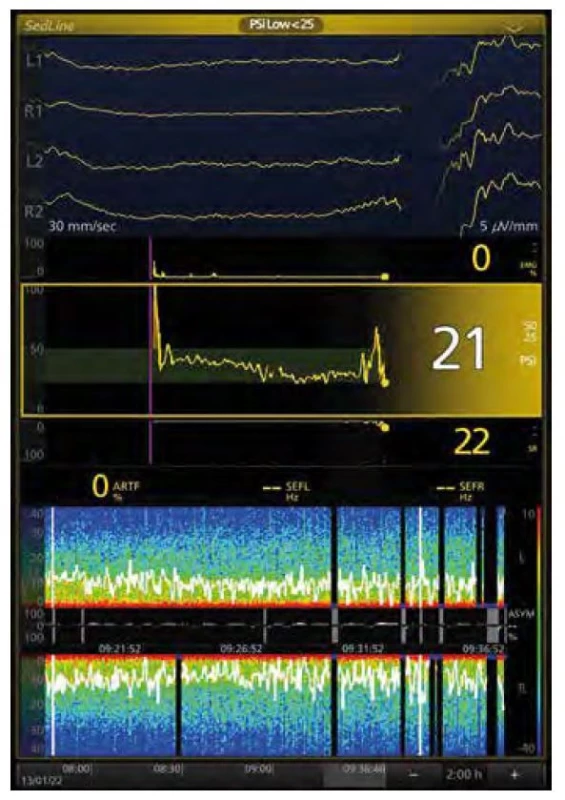
Spektrogramy jednotlivých celkových anestetik
Celková intravenózní i inhalační anestetika působí na celou řadu buněčných struktur (jde o tzv. „dirty“ drugs), mají svá molekulární spektra účinku, působí různě na různé okruhy v mozku. Na syrových EEG křivkách jsou však rozdíly mezi jednotlivými anestetiky okem většinou jen těžko rozeznatelné, kdežto na spektrogramech jsou patrné jasně.
Propofol: oscilace SW‑δ + α
Propofol je nejužívanější látkou k úvodu do celkové anestezie, používá se i k jejímu vedení nebo k sedaci. Váže se na GABAA receptory, zejména s podjednotkou β3. Vazba vyvolává proud chloridů směrem do nitra neuronů, což vede k jejich hyperpolarizaci a inhibici. Propofol působí na mnoha místech v CNS, v kůře, thalamu, mozkovém kmeni i v míše, vždyť 25 % všech neuronů reaguje na GABA.
Mechanismus bezvědomí navozeného propofolem není prozatím zcela objasněn. Spektrogram anestezie propofolem je charakterizován nekohorentními pomalými oscilacemi v pásmu SW‑δ (< 4 Hz), k nimž se krátce po úvodu přidávají koherentní rychlejší oscilace v pásmu α (8–12 Hz) (obr. 5). Pomalé oscilace jsou zřejmě vyvolávány přímou inhibicí kůry a/nebo snížením excitace kůry GABAergní inhibicí center bdělosti v mozkovém kmeni, resp. inhibicí thalamu. Tyto pomalé oscilace narušují přenos informací v kůře na větší (> 2 cm) vzdálenosti. Rychlejší oscilace v pásmu α zase ukazují poruchu funkce v kortiko‑thalamo (ncl. reticularis thalami)-kortikálním okruhu. V hluboké anestezii se objevuje obraz burst suppression (BS). Jeho pravděpodobnost je tím vyšší, čím je dávka propofolu vyšší, pacient starší, s kognitivní dysfunkcí či více přidruženými chorobami a čím je amplituda α oscilací nižší (vulnerabilní mozek) [9]. Převažuje názor, že je vhodné se BS, zejména v období vedení anestezie, vyhnout.
Image 5. EEG křivka a spektrogram anestezie propofolem 69letého pacienta. EEG křivka při PSI 40 (není na obrázku), na spektrogramu jsou patrné výrazné oscilace v pásmech SW-δ (< 4 Hz) a α (8-12 Hz), SEF95 kolísá velmi málo, což svědčí o dostatečné antinocicepci 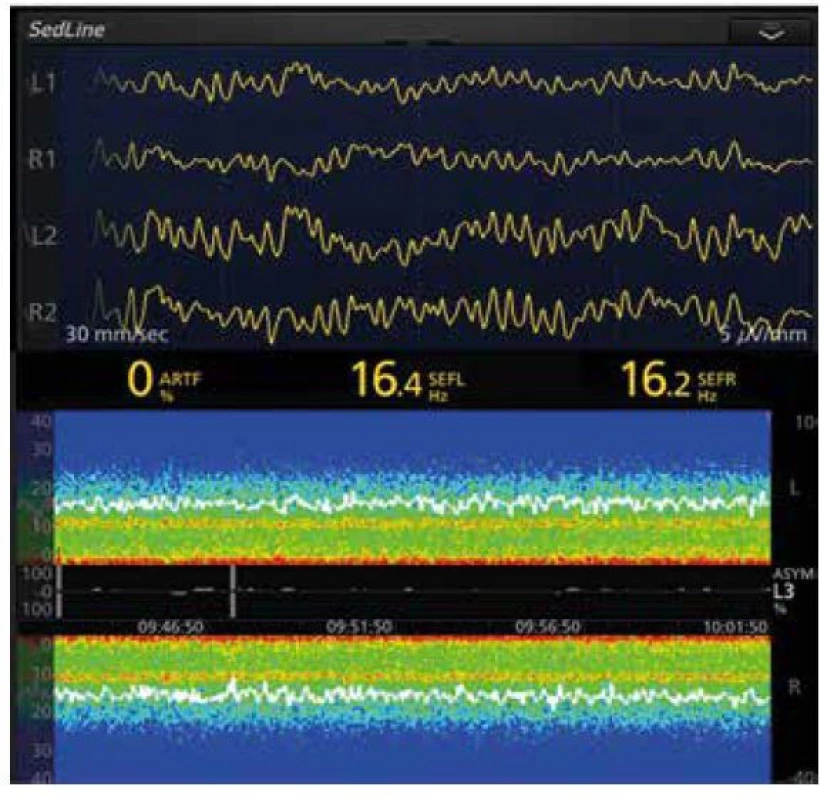
Inhalační anestetika: halogenované étery: oscilace SW‑δ + θ + α
Halogenované étery (iso-, sevo - a desfluran) mají v podstatě totožná spektra [10]. Účinkují rovněž blokádou GABAA receptorů stejně jako propofol, na rozdíl od něj však ovlivňují i četné další struktury neuronů, jako jsou dvoupórové kaliové kanály, hyperpolarizací aktivované a cyklickými nukleotidy řízené kanály (HCN) a NMDA receptory. Na EEG se tyto účinky projevují podobně jako u propofolu oscilacemi v pásmech SW-δ (< 4 Hz) a α (8–12 Hz, obr. 6a). V hlubší anestezii (> 1 MAC, s opioidy a u seniorů i při nižší hodnotě) se na rozdíl od propofolu objevují navíc nekoherentní oscilace v pásmu θ (theta, 4–7 Hz), jež jsou zřejmě způsobeny ne‑GABAergními účinky (obr. 6 b). Tento obraz se označuje jako vyplnění (fill‑in). Pokud koncentrace anestetika opět klesne, θ oscilace zase vymizí. Při ještě vyšších koncentracích může rovněž dojít k BS, přičemž u sevofluranu jsou amplituda burstů i aktivita neuronů v obdobích suprese vyšší, kdežto u propofolu je vyšší frekvence burstů čili kůra je na podněty citlivější než v sevofluranové anestezii.
Image 6. EEG křivky a spektrogramy anestezie sevofluranem (úvod propofolem, sufentanil). a) muž, 72 let, plastika a. femoralis, mělčí doplňovaná anestezie, PSI 38 (není na obrázku), MAC neuvedena, na spektrogramu jsou patrné výrazné oscilace v pásmech SW-δ (< 4 Hz) a α (8-12 Hz), hodnoty SEF95 do 15 Hz svědčí o dostatečné antinocicepci, b) žena, 69 let, aorto-ilický bypass, doplňovaná anestezie, PSI 31, MAC korigovaná k věku 0,9 (není na obrázku), na spektrogramu jsou patrné výrazné oscilace v pásmech SW-δ (< 4 Hz), θ (4-7 Hz) i α (8-12 Hz), tj. fenomén fill-in, SEF95 poněkud kolísá, proto ještě přidán sufentanil 25 μg i. v. (označeno druhou svislou bílou linií), antinocicepce posílena 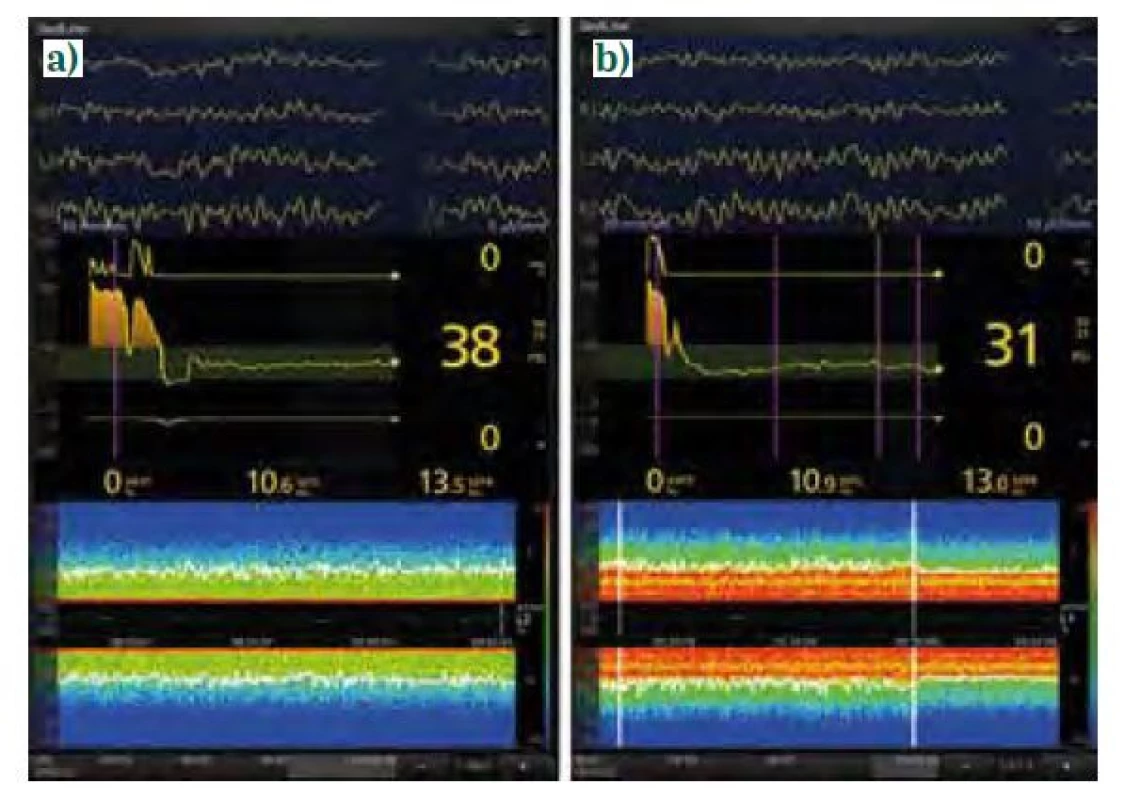
Oxid dusný (N2O): oscilace záleží na jeho koncentraci
Tento plyn je slabé anestetikum (MAC 105 %), které se používá jako sedativum (snižuje MAC ostatních inhalačních anestetik) a jako analgetikum, jehož účinek odpovídá standardní dávce opioidu. Působí hlavně prostřednictvím NMDA receptorů excitačního neurotransmiteru glutamátu, ale ovlivňuje i opioidní a muskarinové receptory.
EEG spektrum N2O záleží na přiváděné koncentraci. Pro koncentrace nižší než 40 % jsou na spektrogramu charakteristické výrazné oscilace v pásmech β (12–25 Hz) a γ (> 25 Hz) a relativně nižší v pásmech δ a θ, kdežto pro koncentrace 50–70 % svědčí pomalé oscilace SW‑δ vyvolané zřejmě blokádou excitačních glutamátových impulsů z mozkového kmene do thalamu a kůry [11]. Přidání vysokých koncentrací N2O k inhalační anestezii vede zpočátku k poklesu výkonu v pásmech SW‑δ a α (červená barva přechází do oranžové a žluté). Pak se přechodně objeví výrazné (na spektru červené) oscilace SW‑δ, přičemž rychlejší oscilace vymizí (modrá barva, obr. 7). Po několika minutách začnou pro N2O typické oscilace v pásmech β a γ.
Image 7. EEG křivky a spektrogramy při doplňované anestezii kombinací sevofluran + sufentanil při ventilaci směsí kyslík + vzduch (vlevo), nebo s 70% oxidem dusným (vpravo) u 71letého pacienta podstupujícího plastiku a. femoralis 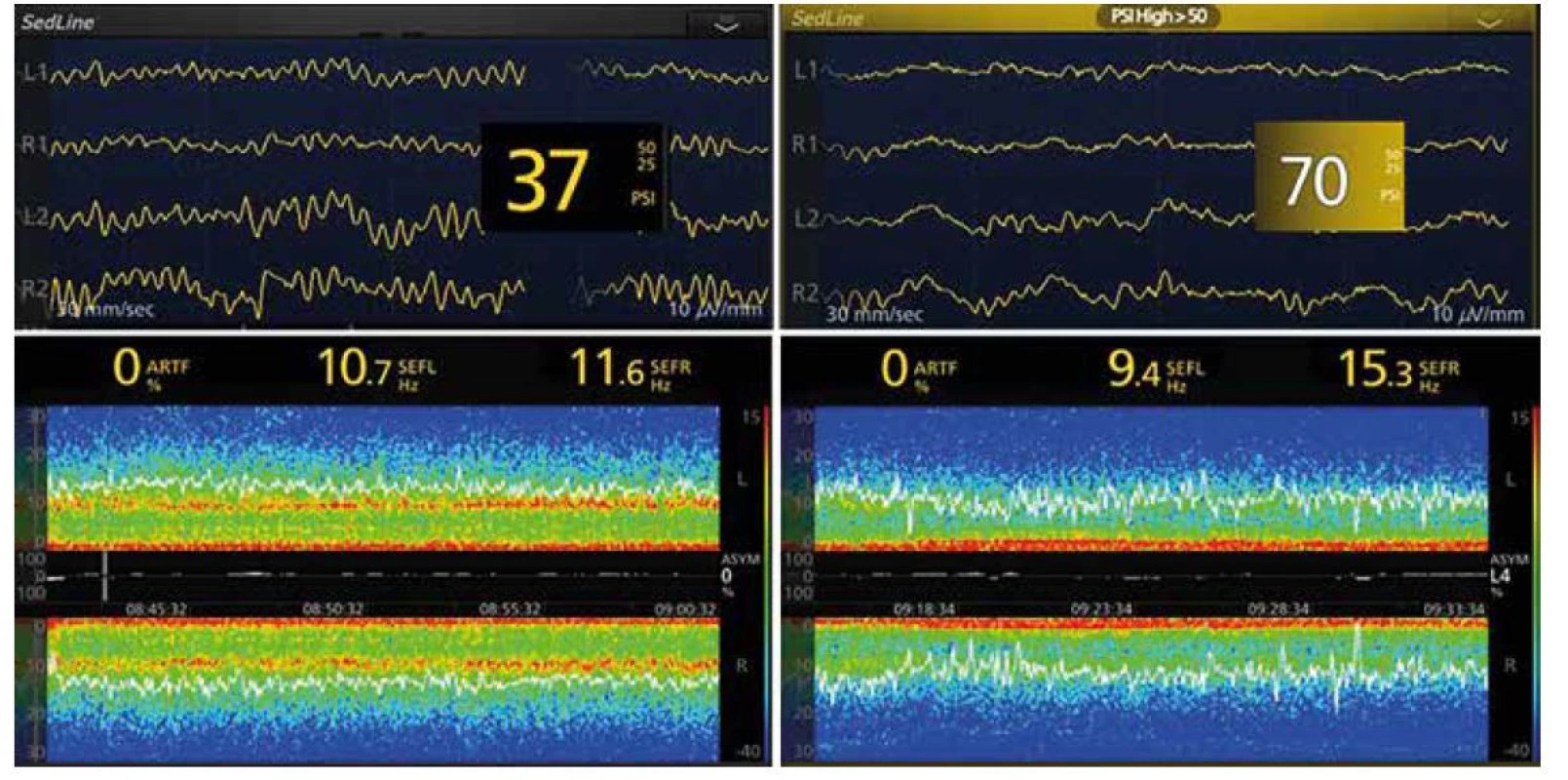
Je zajímavé, že N2O je sice považován za látku aditivní, tzn. že snižuje MAC, což je vlastně efektivní dávka inhalačního anestetika, která u 50 % pacientů brání pohybové reakci na kožní řez (ED50), ale přidání N2O v koncentraci 60 % zvyšuje koncentraci isofluranu, která na EEG vyvolává isoelektrickou linii (ED50iso), a to z hodnoty 3,68 % ve skupině ventilované 40% kyslíkem se vzduchem na hodnotu 4,08 % ve skupině ventilované 60% N2O se vzduchem. Koncentraci isofluranu vedoucí k obrazu BS však N2O významně nemění [12]. Autorovi se přesto zdá, že obraz BS mizí po přidání N2O dříve než jen změlčováním inhalační anestezie navazující na indukci propofolem (osobní nepotvrzené pozorování!).
Ketamin: bursty střídají pomalé oscilace
Ketamin je disociační anestetikum, váže se především na N‑metyl‑Daspartátové receptory excitačního neurotransmiteru glutamátu spojené s nespecifickým kationtovým kanálem na neuronech v mozku i v míše. Vazba brání excitaci. Nižší dávky ovlivňují převážně inhibiční interneurony, takže následující (down‑stream) pyramidové neurony přestanou být inhibovány a jsou aktivnější (halucinace, euforie, dysforie, zvýšení metabolismu mozku). Analgezie je vyvolána zřejmě účinkem na ganglia zadních míšních kořenů. Vyšší dávky pak inhibují i excitační glutamátergní neurony, narušují fronto‑parietální konektivitu v kůře, což vede k ztrátě vědomí. Ketamin (asi jeho metabolit hydroxynorketamin) má i rychlé antidepresivní účinky.
Na spektrogramu vyvolává ketamin v nižších, tj. disociačních dávkách rychlé oscilace v pásmech β a γ a relativně snižuje amplitudu oscilací v pásmu α. Po bolusovém podání anestetických dávek se objevují „γ bursty“ střídající se s pomalými oscilacemi v pásmech SW‑δ a θ. Bursty postupně mizí a stabilizují se oscilace v pásmech SW‑δ, θ a β/γ (obr. 8 [13]). Tím se ketamin zásadně odlišuje od látek působících prostřednictvím GABA. Analogií jeho účinku by mohl být šum na telefonní lince nebo v rozhlasovém vysílání, jenž brání porozumění mluvenému slovu. Výměna informací v mozku sice probíhá, ale je „zašuměna“.
Image 8. Spektrogram anestezie ketaminem po předchozím podání midazolamu a fentanylu. Silná červená linie na začátku je svalový artefakt, na ni navazuje obraz γ burstů přecházejících do oscilací v pásmu β/γ a posléze (isofluran) v pásmech SW-δ, θ a α/β. Obrázek je upraven z [13] ![Spektrogram anestezie ketaminem po předchozím podání midazolamu
a fentanylu. Silná červená linie na začátku je svalový artefakt, na ni
navazuje obraz γ burstů přecházejících do oscilací v pásmu β/γ a posléze
(isofluran) v pásmech SW-δ, θ a α/β. Obrázek je upraven z [13]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ed251109c0cb1d097c4cd456812d4a12.jpg)
Dexmedetomidin: oscilace SW‑δ a vřetena jako v non‑REM spánku
Dexmedetomidin se používá jako sedativum jak v anestezii, tak i v intenzivní medicíně. Pacienty lze snadno probudit, nejsou dezorientovaní jako po benzodiazepinech. Látka nemá dechově depresivní účinek. Působí zejména na presynaptických α2-adrenergních receptorech pouhých asi 20–50 000 neuronů v locus coeruleus v pontu. Svou vazbou tyto neurony hyperpolarizuje, takže se snižuje uvolňování budivého noradrenalinu v mozku. Neurony v area preoptica hypothalamu pak svými GABAergními a galaninergními projekcemi tlumí centra bdělosti, což vede k sedaci. Inhibiční působení neuronů v area preoptica spouští non-REM spánek.
Na EEG (obr. 9 [10]) způsobuje infuze dexmedetomidinu v nízké dávce oscilace v pásmu SW‑δ, na něž nasedají 1–2sekundové bursty rychlejších oscilací v pásmu 9–15 Hz, které se podobají spánkovým vřetenům charakteristickým pro stadium II non‑REM spánku. Na spektrogramu jsou tyto bursty patrné jako oranžové (mají nižší amplitudu než typické α oscilace u GABA‑anestetik) proužky v pásmu α/nízká β nad kontinuálními oscilacemi v pásmu SW‑δ. Při vyšší dávce vřetena mizí podobně jako ve stádiu III non‑REM spánku a roste amplituda oscilací v pásmu SW ‑ δ (mění se do červené). Dexmedetomidinová stejně jako spánková vřetena nebo kontinuální oscilace v pásmu α u propofolu či sevofluranu jsou vyvolána účinkem na kortiko‑thalamo‑kortikální smyčku, pomalé oscilace mají stejný mechanismus jako u propofolu či sevofluranu (viz výše). Inhibice navozená dexmedetomidinem je však stejně jako ve spánku slabší, proto lze pacienty probudit na rozdíl od anestezie.
Image 9. Spektrogram dexmedetomidinu v sedativní dávce. Na spektrogramu jsou patrné pomalé oscilace v pásmu SW-δ a vřetena v pásmu α/β (9-15 Hz). Upraveno z [10] ![Spektrogram dexmedetomidinu v sedativní dávce. Na spektrogramu
jsou patrné pomalé oscilace v pásmu SW-δ a vřetena v pásmu α/β
(9-15 Hz). Upraveno z [10]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/5431db9b7a13609cff0656369cb2b242.jpg)
Opioidy
Opioidy působí především na subkortikální úrovni synergicky s celkovými anestetiky, a proto EEG příliš neovlivňují. Tradiční představou je, že opioidy potencují účinek celkových anestetik. Ani ve vysokých dávkách však dostatečně nebrání somatickým reakcím na chirurgickou stimulaci, a proto je možná přesnější opačný názor, že celková anestetika potencují účinek opioidů [14]. Při monitorování EEG opioidy snižují hodnoty indexů hloubky anestezie, nebo při týchž hodnotách snižují pravděpodobnost probuzení. Vyšší dávky opioidů oscilace EEG zpomalují, na spektrogramu snižují hodnotu SEF a její kolísání (obr. 6 b).
SedLine® Sedation Monitor
Systém SedLine sestává z monitoru Root a z modulu SedLine, jenž prostřednictvím senzoru se šesti elektrodami snímá čtyřkanálové EEG z čela pacienta z pozic Fp1, Fp2, F7, a F8, referenční elektroda je uprostřed v poloze Fpz, zemnící elektroda o 1 cm výše. Na displeji zobrazuje status elektrod (impedance do 5 kΩ), čtyři kanály EEG, ve střední části hodnoty a trendy parametrů Patient State Index (PSI), EMG, Suppression Ratio (SR), přítomnost artefaktů, dole spektrogramy (na displeji posledních 20 minut, ale lze posunovat až 2 hodiny zpět) levé a pravé strany s hodnotami SEF (obr. 6a, 6 b). PSI se vypočítává patentovaným algoritmem po eliminaci artefaktů ze spektrálních a bispektrálních parametrů výkonu a koherence. Výsledek se pohybuje v rozmezí 0–100, čím je hodnota nižší, tím je pravděpodobnost dostatečného nevnímání vyšší. Jako u BIS je i u PSI určitá prodleva mezi křivkami a hodnotou indexu. Je možné exportovat snímky obrazovky (screenshot), hodnoty i syrové EEG křivky k dalším off‑line analýzám. Systém se používá na operačních sálech, ale i na JIP k monitorování sedace, protože hodnoty PSI korelují s RASS (Richmond Agitation‑Sedation Scale) [15]. Není určen pro děti do 18 let.
Conox: dva monitory v jednom
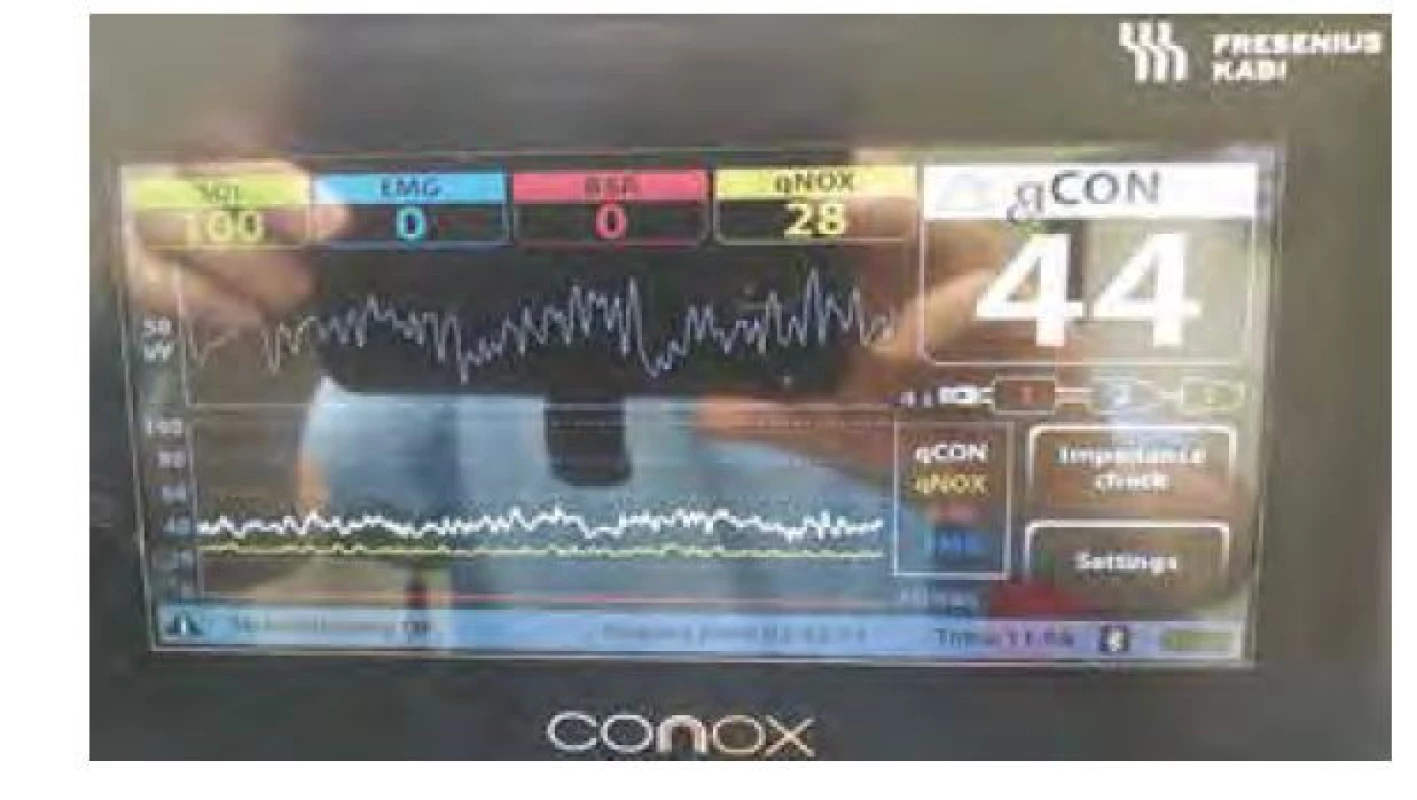
Entropy Module a právě Conox španělské firmy Quantium Medical (v ČR Fresenius Kabi) jsou monitory, které informují nejenom o hypnotickém (State Entropy [SE], resp. qCON), ale i o antinociceptivním účinku (Response Entropy [RE], resp. qNOX) celkové anestezie. Conox je velmi snadno přenosný, přes Bluetooth ho lze připojit k mobilnímu telefonu. Vedle obou indexů zobrazuje i kvalitu signálu, EMG, Burst Suppression Ratio a spektrogramy (obr. 10).
Conox pracuje v systému ANFIS (Adaptive Neuro Fuzzy Inference System), což je umělá neuronová síť s pěti vrstvami a fuzzy logikou. K učebnímu procesu pro výpočet indexu qCON byla použita databáze EEG od 1 110 pacientů, resp. pro qNOX 590 pacientů. Vstupem byly poměry výkonů v různých frekvenčních pásmech k celkovému výkonu signálu a přítomnost BS. Index qCON se aktualizuje každou sekundu. Oba indexy jsou stejně jako BIS měřítkem pravděpodobnosti, že je pacient při vědomí (qCON), resp. že bude reagovat pohybem na nociceptivní podnět (qNOX). Čím nižší je hodnota indexu, tím menší je pravděpodobnost. Doporučené rozmezí pro anestezii je pro qCON 40–60, je ‑ li qNOX 40–60, je pohyb nepravděpodobný [16]. BIS, State Entropy i qCON vzájemně korelují u pacientů podstupujících flexibilní bronchoskopii v lokální anestezii a sedaci propofolem [17].
Adekvátnost anestezie
Hloubka anestezie se musí přizpůsobovat intenzitě chirurgického dráždění. Požadavek na adekvátnost anestezie vyjádřil již dávno anglický anesteziolog Michael Dennis Nosworthy (1902–1980) rčením, že „anestezie musí být tak hluboká, jak je třeba, a tak mělká, jak jen lze.“ Intuitivně se zdá, že tato informace musí být obsažena v EEG snímaném v průběhu operace.
Systémy Entropy Module a Conox již k hodnocení adekvátnosti anestezie využívají parametry jako RE či rozdíl RE‑SE, resp. qNOX, ale i jiné monitory mohou napovědět (obr. 11). Bude ‑ li se pacient na chirurgickou stimulaci reagovat, lze očekávat, že dojde k těmto změnám:
Image 11. Využití monitorů k titraci antinocicepce. Červeně jsou označeny parametry, které lze k titraci využít 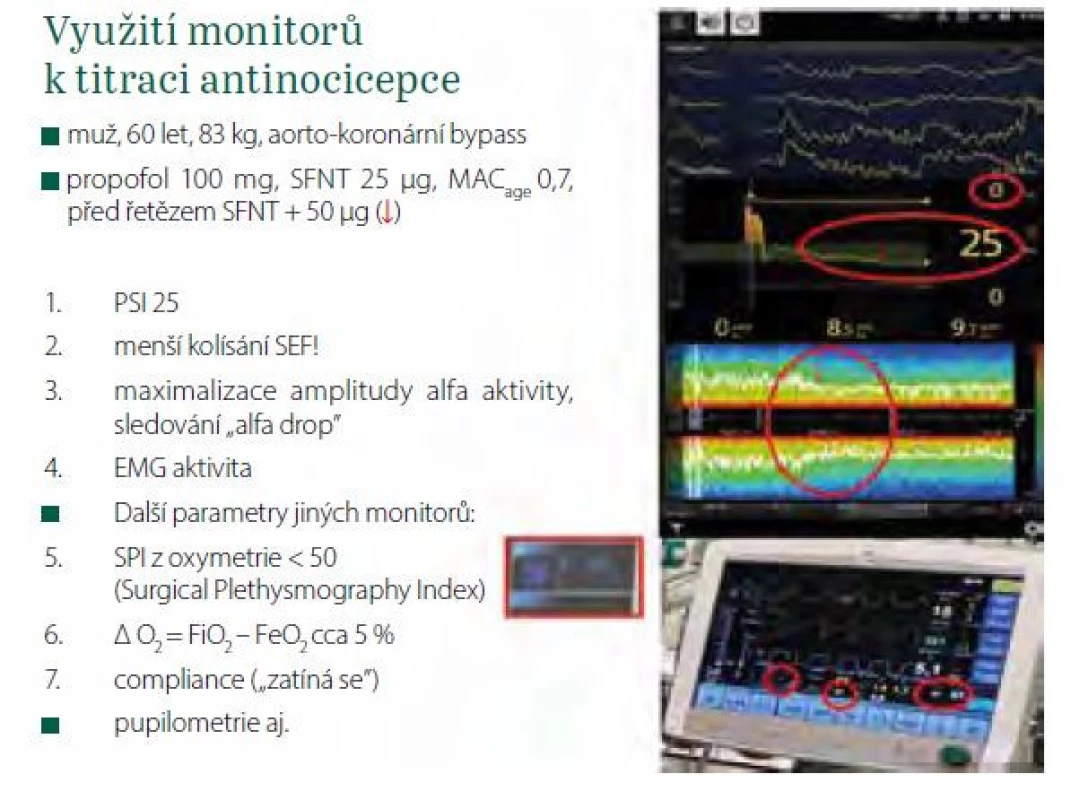
• indexy hloubky anestezie se budou zvyšovat
• EMG aktivita, kterou současné monitory EEG snímají z čela pacienta, bude stoupat, když se pacient začne „zatínat“. Pacient totiž může spontánně ventilovat přes laryngeální masku (např. operace varixů) a současně mít při dostatečné antinocicepci EMG na čele 0
• při zvýšení svalového tonu na hrudníku klesne compliance dýchacího systému (při vyloučení jiných příčin), kterou lze monitorovat na displejích ventilátorů. Autor si ukládá křivku před těsně řezem a sleduje průběžně její změny
• zvýší se spotřeba kyslíku, což se projeví zvýšením rozdílu mezi vdechovanou a vydechovanou frakcí kyslíku, zejména při anestezii s nízkým či minimálním příkonem čerstvých plynů
• hodnoty indexu SPI (Surgical Pleth Index, rozmezí 0–100) se budou zvyšovat. SPI se vypočítává z parametrů snímaných pulzním oxymetrem (amplituda pletysmografické vlny a variabilita srdeční frekvence), je‑li SPI < 30, je antinocicepce dostatečná, hodnoty > 50 mohou vyžadovat intervenci. SPI se může využít i k predikci pooperační bolesti ještě před probuzením [18]
Dalším parametrem rovnováhy mezi nocicepcí a antinocicepcí získávaným z EEG je tzv. Composite Variability Index (CVI), který publikovali Sahinovic et al. [19]. Vypočítává se patentovaným algoritmem z průměrné hodnoty BIS a ze směrodatných odchylek BIS a EMG za poslední 3 minuty. Tuto znalost lze v klinické praxi jednoduše využít tak, že se hodnotí index hloubky anestezie (BIS, SE, PSI, qCON) a jeho kolísání, resp. stabilita v čase a přítomnost EMG aktivity. Je ‑ li index v žádoucím rozmezí a kolísá ‑ li v čase jen málo (stejně jako hodnoty SEF ve spektrogramu) a je ‑ li EMG aktivita na čele nulová a pacient hemodynamicky stabilní, je velmi pravděpodobné, že antinocicepce je dostatečná.
Závěr
Spektrogramy jasně zobrazují rozdíly mezi jednotlivými anestetiky a s využitím parametrů jako kolísání indexů hloubky anestezie, průběhů SEF i údajů z dalších monitorů (compliance dýchacího systému, Surgical Plethysmography Index aj.) dovolují personalizovat vedení anestezie. Dosud však nebylo prokázáno, že personalizované vedení anestezie zlepšuje výsledky pacientů, protože příslušné studie stále probíhají [20–23]. Další spektrografické obrazy jako α dropout, β arousal a δ arousal informující rovněž o míře antinocicepce budou představeny ve třetí části tohoto souboru stejně jako změny EEG při stárnutí a využití pEEG v úvodu, vedení a při probouzení z anestezie.
Sources
1. Horáček M. Monitorování počítačem zpracovaného EEG v anestezii I. Anest intenziv Med. 2022;33(2):79-89.
2. Doporučený postup ČSARIM. Zásady bezpečné anesteziologické péče. Available from: https://www.csarim.cz/getmedia/bf2afe85-bd5b-4050-acd6-0cd4583aff9b/ doporuceny‑postup‑zasady‑bezpecne‑anesteziologicke‑pece - 2017.pdf.aspx (cited 11. 07. 2022)
3. Klein AA, Meek T, Allcock E, Cook TM, Mincher N, Morris C, et al. Recommendations for standards of monitoring during anaesthesia and recovery 2021: Guideline from the Association of Anaesthetists. Anaesthesia. 2021 Sep;76(9):1212-1223. doi: 10.1111/ anae.15501. PMID: 34013531.
4. Lewis SR, Pritchard MW, Fawcett LJ, Punjasawadwong Y. Bispectral index for improving intraoperative awareness and early postoperative recovery in adults. Cochrane Database Syst Rev. 2019 Sep 26;9(9):CD003843. doi: 10.1002/14651858.CD003843. pub4. PMID: 31557307.
5. Evered LA, Goldstein PA. Reducing Perioperative Neurocognitive Disorders (PND) Through Depth of Anesthesia Monitoring: A Critical Review. Int J Gen Med. 2021 Jan 14;14 : 153 - 162. doi: 10.2147/IJGM.S242230.
6. Muhlhofer WG, Zak R, Kamal T, Rizvi B, Sands LP, Yuan M, et al.: Burst‑suppression ratio underestimates absolute duration of electroencephalogram suppression compared with visual analysis of intraoperative electroencephalogram. Br J Anaesth. 2017 May 1;118(5):755 - 761. doi: 10.1093/bja/aex054. PMID: 28486575.
7. Fleischmann A, Georgii MT, Schuessler J, Schneider G, Pilge S, Kreuzer M. Always Assess the Raw Electroencephalogram: Why Automated Burst Suppression Detection May Not Detect All Episodes. Anesth Analg. 2022 Jun 3. Online ahead of print. doi: 10.1213/ ANE.0000000000006098. PMID: 35653440.
8. Kratzer S, Schneider M, Obert DP, Schneider G, García PS, Kreuzer M. Age‑Related EEG Features of Bursting Activity During Anesthetic‑Induced Burst Suppression. Front Syst Neurosci. 2020 Dec 3;14 : 599962. doi: 10.3389/fnsys.2020.599962. eCollection 2020. PMID: 33343307.
9. Shao YR, Kahali P, Houle TT, Deng H, Colvin C, Dickerson BC, et al. Low Frontal Alpha Power Is Associated With the Propensity for Burst Suppression: An Electroencephalogram Phenotype for a „Vulnerable Brain“. Anesth Analg. 2020 Nov;131(5):1529-1539. doi: 10.1213/ANE.0000000000004781.
10. Purdon PL, Sampson A, Pavone KJ, Brown EN. Clinical Electroencephalography for Anesthesiologists: Part I: Background and Basic Signatures. Anesthesiology. 2015 Oct;123(4):937-60. doi: 10.1097/ALN.0000000000000841.
11. Pavone KJ, Akeju O, Sampson AL, Ling K, Purdon PL, Brown EN. Nitrous oxide‑induced slow and delta oscillations. Clin Neurophysiol. 2016 Jan;127(1):556-564. doi: 10.1016/j.clinph.2015. 06. 001.
12. Niu B, Xiao JY, Fang Y, Zhou BY, Li J, Cao F, et al.: Sevoflurane ‑ induced isoelectric EEG and burst suppression: differential and antagonistic effect of added nitrous oxide. Anaesthesia. 2017 May;72(5):570-579. doi: 10.1111/anae.13843.
13. Akeju O, Song AH, Hamilos AE, Pavone KJ, Flores FJ, Brown EN, et al. Electroencephalogram signatures of ketamine anesthesia ‑ induced unconsciousness. Clin Neurophysiol. 2016 Jun;127(6):2414-22. doi: 10.1016/j.clinph.2016. 03. 005. PMID: 27178861.
14. Sleigh JW, Sanders RD. Intraoperative analgesic titration: the hunting of the snark. Anesth Analg. 2014 Aug;119(2):234-236. doi: 10.1213/ANE.0000000000000312.
15. Idei M, Seino Y, Sato N, Yoshida T, Saishu Y, Fukui K, et al. Validation of the Patient State Index for monitoring sedation state in critically ill patients: a prospective observational study. J Clin Monit Comput. 2022 Jun 4. doi: 10.1007/s10877-022-00871-9.
16. Jensen EW, Valencia JF, López A, Anglada T, Agustí M, Ramos Y, et al. Monitoring hypnotic effect and nociception with two EEG‑derived indices, qCON and qNOX, during general anaesthesia. Acta Anaesthesiol Scand. 2014 Sep;58(8):933-41. doi: 10.1111/aas.12359.
17. Muller J.N., Kreuzer M., Garcia P. S., Schneider G., Hautmann H. Monitoring depth of sedation: evaluating the agreement between the Bispectral Index, qCON and the Entropy Module’s State Entropy during flexible bronchoscopy. Minerva Anestesiol. 2017;83 : 563-573.
18. Ledowski T, Schneider M, Gruenewald M, Goyal RK, Teo SR, Hruby J. Surgical pleth index: prospective validation of the score to predict moderate ‑ to ‑ severe postoperative pain. Br J Anaesth. 2019 Aug;123(2):e328-e332. doi: 10.1016/j.bja.2018. 10. 066.
19. Sahinovic MM, Eleveld DJ, Kalmar AF, Heeremans EH, De Smet T, Seshagiri CV, et al. Accuracy of the composite variability index as a measure of the balance between nociception and antinociception during anesthesia. Anesth Analg. 2014 Aug;119(2):288 - 301. doi: 10.1213/ANE.0000000000000274. PMID: 2489280.
20. Gaskell A, Pullon R, Hight D, Termaat J, Mans G, Voss L, et al. Modulation of frontal EEG alpha oscillations during maintenance and emergence phases of general anaesthesia to improve early neurocognitive recovery in older patients: protocol for a randomised controlled trial. Trials. 2019 Feb 22;20(1):146. doi: 10.1186/s13063-019-3178-x.
21. Shanker A, Abel JH, Narayanan S, Mathur P, Work E, Schamberg G, et al. Perioperative Multimodal General Anesthesia Focusing on Specific CNS Targets in Patients Undergoing Cardiac Surgeries: The Pathfinder Feasibility Trial. Front Med (Lausanne). 2021 Oct 14;8 : 719512. doi: 10.3389/fmed.2021.719512. eCollection 2021. PMID: 34722563.
22. Gruber BU, Girsberger V, Kusstatscher L, Funk S, Luethy A, Jakus L, et al. Comparing propofol anaesthesia guided by Bispectral Index monitoring and frontal EEG wave analysis with standard monitoring in laparoscopic surgery: protocol for the ‘EEG in General Anaesthesia - More Than Only a Bispectral Index’ Trial, a multicentre, double‑blind, randomised controlled trial. BMJ Open. 2022 Jun 10;12(6):e059919. doi: 10.1136/ bmjopen-2021-059919. PMID: 35688587.
23. Tang CJ, Jin Z, Sands LP, Pleasants D, Tabatabai S, Hong Y, et al. ADAPT-2: A Randomized Clinical Trial to Reduce Intraoperative EEG Suppression in Older Surgical Patients Undergoing Major Noncardiac Surgery. Anesth Analg. 2020 Oct;131(4):1228-1236. doi: 10.1213/ANE.0000000000004713. PMID: 32925344.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2022 Issue 3-4-
All articles in this issue
- Sdělení redakční rady
- Covid (nejen) z pohledu intenzivní medicíny
- Je etické použití ECMO za účelem „udržení“ dárce orgánů?
- Evaluation of the Utility of the Advance Care Planning and Decision‑Making Supportive Tool
- Infekční komplikace po etomidátu versus propofolu v souvislosti s indukcí do celkové anestezie v kardiochirurgii
- Monitoring of processed EEG under anesthesia II
- Specificity léčby bolesti u kriticky nemocných dospělých pacientů s BMI ≥ 40
- Rocuronium‑induced anaphylactic shock in pregnancy successfully treated with sugammadex
- Dlouhodobý covid-19 syndrom a perspektivy
- Septický šok a vitamin C?
- VV‑ECMO in organ donor after brain death – case report and review of the issue
- Eighty years since the clinical use of d‑tubocurarine and 70 years since the clinical use of succinylcholine. History of muscle relaxants
- Barva moči z pohledu klinické fyziologie
- Zpráva z kongresu SSAIM
- Informace o vzniku výzkumné iniciativy pro paliativní medicínu a etiku v intenzivní péči : Research Initiative in Palliative Care and Ethics in the Intensive Care Unit (RIPE‑ ICU)
- Mechanická síla – jak vlastně souvisí s traumatizací plic při umělé ventilaci?
- Abstrakty z XXVIII. kongresu ČSARIM
- The effect of two different anesthesia regimens on annexin V levels and early postoperative complications in CABG
- Aspiration pneumonia after cerebrovascular stroke: a comparison between patients with and without dysphagia
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Barva moči z pohledu klinické fyziologie
- Monitoring of processed EEG under anesthesia II
- Rocuronium‑induced anaphylactic shock in pregnancy successfully treated with sugammadex
- Aspiration pneumonia after cerebrovascular stroke: a comparison between patients with and without dysphagia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career