-
Medical journals
- Career
Použití methylenové modři v terapii refrakterního distributivního šoku
Authors: M. Pořízka 1; H. Říha 1,2; M. Balík 1
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. lékařská fakulta Univerzity Karlovy, a Všeobecná fakultní nemocnice, Praha 1; Klinika anesteziologie a resuscitace, Kardiocentrum, Institut klinické a experimentální medicíny, Praha 2
Published in: Anest. intenziv. Med., 32, 2021, č. 4-5, s. 211-216
Category: Review Article
Overview
Refrakterní distributivní šok představuje u kriticky nemocných stav s excesivní smrtností. Neadrenergní vasopresory, mezi které patří i methylenová modř, získávají stále na významu jako tzv. záchranná léčba u vazoparalytických stavů. V tomto přehledového článku shrnujeme dosavadní literární evidenci použití methylenové modři v indikaci refrakterního šoku u kriticky nemocných pacientů.
Klíčová slova:
methylenová modř – distributivní šok – refrakterní šok – vazoplegie – vaskulární hyporesponzivita
Úvod
Oběhový šok je definován jako akutní klinický syndrom charakterizovaný oběhovým selháním s hypotenzí a tkáňovou hypoperfuzí [1]. Navzdory medicínskému pokroku posledních let představuje nadále u kriticky nemocných stav s vysokou nemocniční smrtností, často přesahující 50 % [1]. Nezávisle na etiologii oběhového selhání je jeho progrese do tzv. refrakterního šoku, který je definován jako šok s noradrenergní podporou vyšší než 0,5 μg/kg/min [2], spojena s dalším významným navýšením smrtnosti [3]. V literatuře se též můžeme setkat se synonymy, jako je refrakterní vazodilatace, vazoplegický syndrom či vaskulární hyporesponzivita. Mechanismem je vždy různě závažná distributivní forma šoku spouštěná systémovou hypoperfuzí tkání vedoucí k rozvoji systémové zánětlivé odpovědi a generalizované vazodilataci. Patofyziologicky se nejvíce uplatňuje cytokiny indukovaná hyperprodukce oxidu dusnatého, aktivace ATP‑senzitivních draselných kanálů v cévním endotelu, deficience endogenního vasopresinu či relativní kortikosteroidní insuficience [4]. Základem léčby refrakterního šoku zůstávají postupy optimalizující orgánovou perfuzi a dodávku kyslíku do tkání, mezi něž patří adekvátní tekutinová, inotropní a vazopresorická léčba [1]. Noradrenalin představuje dle recentních doporučení nadále vazopresor první volby, nicméně jeho vysoká dávka u refrakterního šoku může vést k četným nežádoucím účinkům [5]. Ty nejzávažnější zahrnují srdeční arytmie, akrální a splanchnickou ischemii, hyperglykemii či imunosupresi [5].
V poslední době se při refrakterním distributivním šoku neovlivnitelným běžnými vazopresory začaly používat další farmakologické postupy jako záchranná léčba (tzv. „rescue“ terapie) s cílem omezit nežádoucí účinky vysokých dávek katecholaminů. Patří sem substituce kortikosteroidů a použití tzv. neadrenergních vazopresorů, jako jsou vasopresin, terlipresin či angiotenzin II. Výsledky klinických studií provedené s těmito prostředky potvrzují příznivé ovlivnění šoku ve smyslu poklesu dávek vazopresivně působících katecholaminů a rychlejšího zvládnutí šoku, nicméně efekt na smrtnost zůstává prozatím nejasný [5]. Methylenová modř (MM) představuje jeden z těchto neadrenergních vazopresorů, který je v případě refrakterního distributivního šoku stále častěji užíván v off‑label indikaci jako „ultimum refugium“ při neefektivitě výše zmíněných postupů. Mechanismus jejího účinku je založen na selektivní inhibici signální cesty oxidu dusnatého v periferních cévách, specificky v potlačení tvorby cyklického guanosin‑fosfát mononukleotidu a ve svém důsledku pak v periferní cévní vasokon-strikci [6]. Účelem předkládaného přehledového článku je shrnout dosavadní literární evidenci použití MM v indikaci refrakterního šoku u kriticky nemocných pacientů.
Metody
Byla provedena rozsáhlá analýza elektronických zdrojů v medicínských databázích PubMed, Web of Science a Scopus zahrnující období 1970–2021 s použitím následujících klíčových slov: „methylene blue“, „refractory shock“, „vasoplegic syndrome“, „nitric oxide“. Celkově bylo identifikováno 90 relevantních publikací, z toho 8 randomizovaných kontrolovaných studií, 29 prospektivních a retrospektivních kohortových studií, 26 případových studií, 3 dopisy editorovi, 6 metaanalýz a 18 přehledových článků. Po kritickém zhodnocení a analýze dat nalezených publikací byla autory vypracována předkládaná narativní přehledová studie.
Fyziologie oxidu dusnatého
Oxid dusnatý (NO) zastává v lidském organismu mnoho důležitých funkcí. Zásadním způsobem se podílí na regulaci cévního tonu, ovlivňuje genovou transkripci a translaci mRNA a neposlední řadě funguje jako nitrobuněčný druhý posel [7]. Oxid dusnatý je produkován z L‑argininu působením enzymu NO‑syntetázy (NOS). Ta se vyskytuje ve 3 izoformách, a to jako neuronální v neuronech mozku a míchy, endoteliální v cévním endotelu a trombocytech a dále formě inducibilní v makrofázích, enterocytech, hepatocytech či buňkách cévní hladké svaloviny [8]. Endoteliální isoforma NOS patří k hlavním regulátorům cévního tonu, k vedlejším efektům patří inhibice agregace a adheze trombocytů k endotelu [9]. Signální cesta NO spočívá v jeho volné difuzi do buněk cévní hladké svaloviny, kde aktivuje solubilní formu enzymu guanylyl‑cyklázy katalyzující přeměnu guanosin‑trifosfátu na cyklický guanosin‑monofosfát (cGMP), ten aktivuje multifunkční cGMP‑dependentní proteinkinázu, která trojím mechanismem navozuje relaxaci buněk hladké svaloviny cév (obr. 1) [10]. Hlavní mechanismus myorelaxace spočívá ve snížení koncentrace intracelulárního kalcia inhibicí jeho výdeje ze sarkoplazmatického retikula, k dalším patří přímé snížení senzitivity myosinu ke kalciu a aktivace ATP‑senzitivních K+-kanálů. Exprese inducibilní formy NOS je aktivována prozánětlivými cytokiny, interleukiny či bakteriálním lipopolysacharidem [11]. NO přímo snižuje aktivitu mikrobiálních enzymů obsahující ve svém katalytickém centru hemovou skupinu, a tudíž představuje jeden z hlavních pilířů vrozené nespecifické imunity [12]. Extrémní nadprodukce NO při distributivním šoku vede na druhou stranu k progresi vazodilatace a rozvoji cévní hyporesponzivity [9].
Farmakologický profil methylenové modři
Methylenová modř (methylthioninii chloridum) je syntetická, ve vodě rozpustná, heterocyklická aromatická sloučenina bez chuti a zápachu. Chemicky se jedná o fenothiazin (3,7-bis-(dimethylamino)fenothiazin-5-ylium chlorid hydrát) se silně vyjádřenými oxido‑redukčními a fotochemickými vlastnostmi (obr. 2) [13]. V medicíně byla tradičně užívána jako redukční činidlo při léčbě methemoglobinemie, terapii malárie či jako barevný indikátor k průkazu patologické komunikace v gastrointestinálním a vylučovacím ústrojí. Mechanismus účinku MM v terapii refrakterního šoku spočívá v interferenci se signální cestou NO v endotelu a buňkách hladké svaloviny cévní stěny. MM inhibuje aktivitu inducibilní NOS v cévním endotelu a tím snižuje množství produkovaného NO a dále přímo degraduje již uvolněný NO [6]. V buňce hladké svaloviny vazbou na hemovou skupinu solubilní guanylát‑cyklázy inhibuje její aktivitu a tím snižuje množství cGMP, který je odpovědný za výsledný vazodilatační efekt [14].
Image 1. Schéma signální cesty oxidu dusnatého (NO) v regulaci cévního tonu a jeho ovlivnění methylenovou modří (MM). 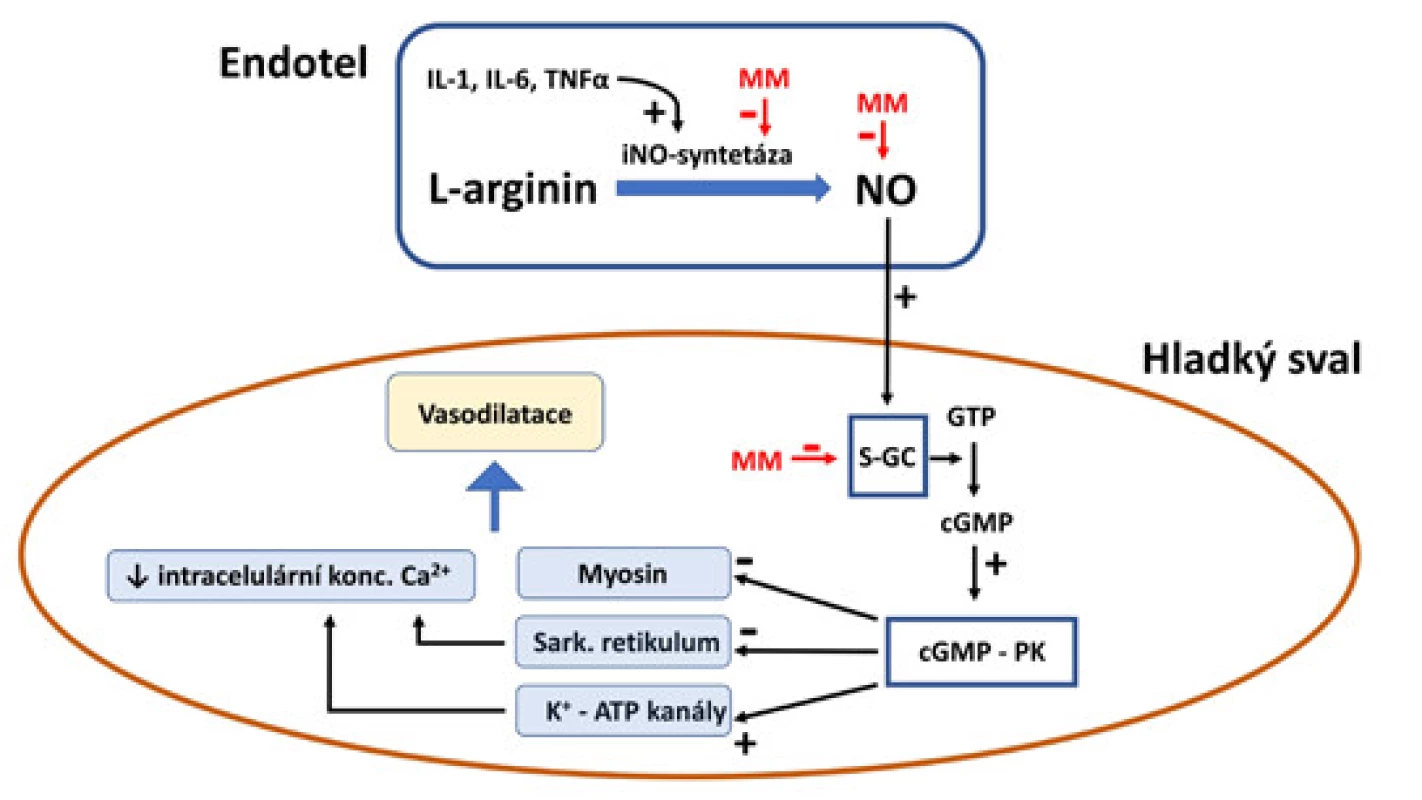
S-GC – solubilní guanylyl-cykláza; GTP – guanosin-trifosfát; cGMP – cyklický guanosin-monofosfát; cGMP-PK – cGMP-dependentní proteinkináza Image 2. Chemický vzorec methylenové modři 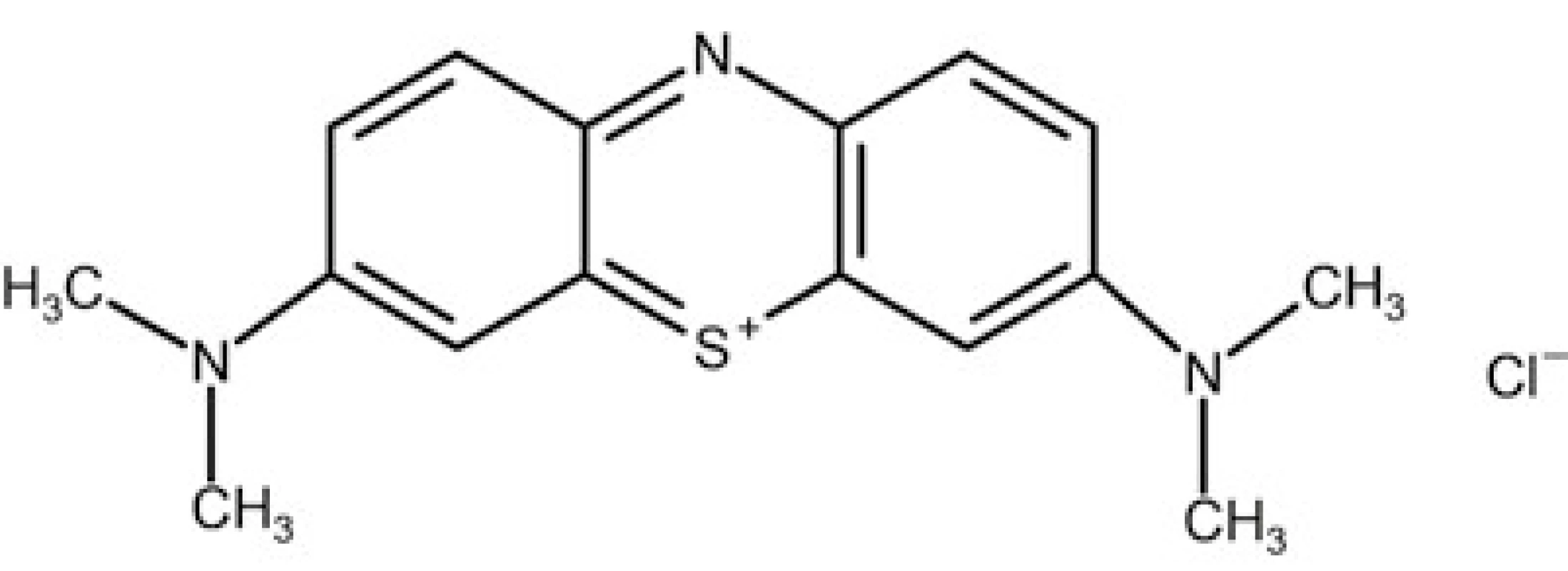
MM má velký distribuční objem (255 ± 58 L) a vykazuje vysokou afinitu k vazbě na plazmatické bílkoviny (94 %) [15]. Po jednorázovém intravenózním bolusu MM je dosaženo vrcholové koncentrace do 30 min. s odpovídajícím nástupem účinku od 30 do 60 min. po podání. Ve tkáních je MM redukována na leuko‑methylenovou modř a následně v této formě vylučována žlučí, močí a stolicí s odpovídajícím eliminačním poločasem 5 až 6 hodin. Po oxidaci se vzdušným kyslíkem získávají sekrety opět zeleno‑modré zbarvení [14, 16]. Dávkování MM v indikaci refrakterního šoku bývá v literatuře uváděno jako bolusové 1–2 mg/kg s eventuálně krátkou kontinuální infuzí 0,25–2 mg/kg/hod. po dobu 48–72 hod. [15].
Použití MM v septickém šoku
Sepse a septický šok zůstávají stále zatíženy vysokou smrtností navzdory všem pokrokům v léčbě z posledních let. Současný standard léčby sepseje založen na eradikaci infekčního ložiska, časné antibiotické terapii a adekvátní resuscitaci funkce kardiovaskulárního systému tekutinami, vazopresory či případně inotropiky při rozvoji septické kardiomyopatie [17]. Hlavní hemodynamickou charakteristikou časné fáze septického šoku je rozvoj generalizované vazodilatace při výše popsané excesivní nadprodukci NO inducibilní formou NOS. Pokusy o zvládnutí refrakterní vazoplegie podáním neselektivních kompetitivních inhibitorů NOS skončily neúspěchem, a to jak v animálních modelech [18], tak v humánních studiích, kdy byla zaznamenána zvýšená smrtnost v intervenované skupině [19]. Naopak selektivní inhibice signální cesty NO‑cGMP methylenovou modří vedla k úspěšnému zvládnutí refrakterního septického šoku, jak dokládají mnohé observační studie a série kazuistik [20, 21], tak i malé randomizované studie testující efekt MM proti placebu. V randomizované studii Memis et al. s 30 pacienty v septickém šoku zvýšila MM v dávkování 0,5 mg/kg/hod. jako kontinuální infuze po dobu 6 hodin střední arteriální tlak (MAP) ze 74,1 ± 10,2 mmHg na 85 ± 14 mmHg (P < 0,05), a to se signifikantním rozdílem proti placebu [22]. V další randomizované studii Kirova et al. s 20 pacienty v septickém šoku zvýšil bolus MM v dávce 2 mg/kg s následnou kontinuální infuzí 2 mg/kg/hod. po dobu 4 hodin bezprostředně po aplikaci bolusu MAP z 84 ± 18 mmHg na 109 ± 31 mmHg (P < 0,01) se snížením noradrenergní podpory o 87 %. Hemodynamické parametry se nicméně v obou zmiňovaných studiích vrátily k původním hodnotám do 2–4 hod. po ukončení infuze [23]. Hemodynamická měření pomocí plicnicového katétru v provedených studiích dokumentovala vzestup systémové a plicní cévní rezistence s minimálním vlivem na srdeční výdej po podání MM [21]. Úspěšné zvládnutí refrakterního šoku MM bylo též publikováno u imunokompromitovaných nemocných po transplantaci jater [24] a dále u pacientů s rozvojem syndromu cytokinové bouře po podání anti‑thymocytárního globulinu v rámci léčby rejekce ledvinného štěpu [25]. Obecně lze shrnout, že podání MM u pacientů v refrakterním septickém šoku vede k významnému, nicméně pouze přechodnému vzestupu arteriálního krevního tlaku s poklesem vazopresorické podpory. Ani jedna ze zmiňovaných observačních či randomizovaných studií neprokázala rozdíl v nemocniční smrtnosti [23].
Slibně se jeví možný renoprotektivní efekt MM u pacientů v septickém šoku. Ve studii Heemskerk et al. vedlo podání infuze MM v dávce 1 mg/kg/hod. po dobu 4 hod. u 9 pacientů v septickém šoku k významnému poklesu renální exkrece markerů tubulárního poškození (cytoplazmatická gluthation‑S-transferáza) a metabolitů NO, simultánně se zvýšením clearance kreatininu o 51 % během prvních 24 hod. po podání [26]. Tento příznivý efekt MM byl autory vysvětlován kromě globálního zlepšení hemodynamického stavu též selektivní akumulací MM v ledvinách [26], s následně nižším toxickým efektem peroxynitritu a superoxidu, jejichž tvorba je právě NO indukována [27]. Oxid dusnatý hraje mimo jiné též důležitou úlohu v regulaci zánětlivé reakce v organismu. Aktivací nukleárního faktoru kappa‑B se podílí na amplifikaci syntézy protizánětlivých cytokinů [28], a tudíž podání MM by tak teoreticky mohlo snížit celkový rozsah zánětlivé odpovědi. To podporují experimentální práce na buněčných kulturách, kdy aplikace MM vedla k poklesu koncentrace TNF‑α (tumor necrosis factor α) a metabolitů NO v Kupfferových buňkách jater [29]. Tyto poznatky nicméně nebyly potvrzeny v klinických studiích, ve kterých podání MM nemělo vliv na plazmatickou koncentraci hlavních prozánětlivých cytokinů, jako jsou interleukin-1, interleukin-10 a TNF‑α [21, 23]. Vzhledem k výše zmíněné, velmi omezené vědecké evidenci MM zatím nepatří k rutinním postupům léčby septického šoku. Rovněž poslední doporučení pro léčbu sepse Surviving Sepsis Campaign použití MM v terapii septického šoku neuvádějí [17].
Použití MM v anafylaktickém šoku
Methylenová modř byla rovněž úspěšně použita v terapii těžkého anafylaktického šoku. Anafylaxe představuje nejzávažnější typ alergické reakce s život ohrožujícími komplikacemi zahrnujícími respirační selhání při bronchospazmu či oběhové selhání při rozvoji distributivní formy šoku [30]. Hlavní patofyziologický mechanismus je založen na masivním uvolnění vazodilatačně působících látek, a to histaminu, bradykininu či dalších leukotrienů [31]. Dominantním účinkem histaminu je aktivace signální cesty NO zvýšenou expresí inducibilní [32] a endoteliální NOS [33]. Současná evidence použití MM v terapii anafylaxe je též limitována jen na případové studie či série kazuistik. Ve studii Neto et al. [34] bylo popsáno úspěšné použití MM v bolusové dávce 1,5–2 mg/kg u tří pacientů (u jednoho pacienta následováno 2hodinovou infuzí v dávce 2 mg/kg/hod.) v refrakterním anafylaktickém šoku po podání RTG kontrastní látky. U všech tří pacientů došlo do 20 minut k permanentní stabilizaci hemodynamiky s obnovou adekvátního krevního tlaku. Z nežádoucích účinků byla popsána několik minut trvající epizoda pomalého nodálního rytmu u jednoho pacienta. Další úspěšné použití MM v dávce 100 mg u dvou pacientů s anafylaktickým šokem po podání protaminu a aprotininu bylo reportováno ve studii Del Duca et al. [35]. Autoři též popisují promptní a trvalý hemodynamický efekt do 15 min. po podání bez incidence nežádoucích účinků. V kazuistice Rodrigues et al. [36] vedlo použití MM v dávce 1,5 mg/kg ke zvrácení anafylaktické reakce na latex komplikované těžkým brochospazmen a generalizovaným angioedémem. Zajímavostí bylo, že se jednalo o hemodynamicky stabilního pacienta bez rozvoje šokového stavu.
Použití MM při letální otravě blokátory kalciového kanálu
Další možnou indikací MM je refrakterní šok způsobený letální intoxikací vazodilatancii, zejména pak blokátory vápníkového kanálu. Podobně jako v případě anafylaktického šoku existují jen případové studie dokumentující úspěšné podání MM v této indikaci [37, 38]. Ve studii Laese et al. byla MM podána v dávce 2 mg/kg u pacienta s těžkou vazoplegií při letální otravě atenololem, amlodipinem a valsartanem. Během 2 hodin po podání došlo postupně k poklesu noradrenergní podpory na 50 % původní dávky a úplnému vysazení fenylefrinu. Hemodynamická měření získaná použitím plicnicového katétru potvrdila téměř pětinásobný vzestup periferní cévní rezistence při pouze mírném snížení srdečního výdeje [37]. Experimentální studie na zvířatech prokázaly, že podání amlodipinu vede k aktivaci endoteliální NO‑syntetázy a vzestupu koncentrace nitrobuněčné koncentrace NO, což by mohlo vysvětlovat efektivitu MM i v této indikaci [39].
Použití MM u kardiochirurgických pacientů
Většina kardiochirurgických výkonů se provádí s použitím mimotělního oběhu (MO). Komplexní imunologická odpověď na vlastní výkon a MO je navozena především ischemicko‑reperfuzním poškozením myokardu a plic, uvolněním endotoxinu ze slizničních povrchů a aktivací komplementu při kontaktu krve s umělým povrchem jednotlivých komponent MO [40]. Mezi nejdůležitější mediátory, jejichž koncentrace se zvyšuje, patří volné kyslíkové radikály, NO, tromboxan A2 a prostaglandiny; délka MO koreluje se vzestupem tvorby inducibilní izoformy NOS [41]. Zvýšené koncentrace těchto molekul korelují s rozvojem systémové zánětlivé odpovědi [42]. Ta může vést až k rozvoji vazoplegického šoku, který je charakterizován systémovou hypoperfuzí tkání na podkladě generalizované vazodilatace při normálním anebo dokonce zvýšeném srdečním výdeji [43]; incidence se u kardiochirurgických výkonů pohybuje mezi 5–45 % [43–45]. Refrakterní vazodilatace byla popsána i u aortokoronárního bypassu bez použití MO [46]. Mezi rizikové faktory pro rozvoj tohoto stavu patří systolická dysfunkce (nízká ejekční frakce) levé komory a délka MO [44], a také předoperační léčba ACE inhibitory nebo beta‑blokátory [47]. Chronické srdeční selhání spojené se zvýšenou koncentrací prozánětlivých mediátorů může být také jedním z predisponujících faktorů [48].
Základním terapeutickým opatřením u refrakterního distributivního šoku je obnova vaskulárního tonu. K tomu jsou využívány katecholaminové i nekatecholaminové vazopresory. Podobně jako v jiných situacích (viz výše) je první volbou noradrenalin, který má ovšem u pacientů po kardiochirurgickém výkonu v případě vyšších dávek řadu nežádoucích účinků, především tachykardii a arytmie (nejčastěji fibrilace síní). Proto jsou u refrakterních stavů využívány nekatecholaminové vazopresory, mezi které je řazena také MM. Její úspěšná aplikace u kardiochirurgických pacientů byla od druhé poloviny 90. let minulého století popsána v mnoha kazuistikách [49, 50]; nejčastěji použité dávkovací rozmezí bylo 1–2 mg/kg/10–30 min. Následovaly malé prospektivní studie, které u vazoplegického syndromu v kardiochirurgii potvrdily silný účinek MM ve smyslu zvýšení krevního tlaku a zároveň upozornily na možné snížení smrtnosti [51, 52]. Někteří autoři se zabývali profylaktickým podáním MM, tedy aplikací MM ještě před vlastním kardiochirurgickým výkonem; ve studii zahrnující 100 pacientů s vysokým rizikem rozvoje vazoplegického syndromu vedlo profylaktické podání MM (2 mg/kg) k výraznému snížení výskytu vazoplegického syndromu (0 vs. 26 %) [53]. Analýza 9 356 pacientů, kteří podstoupili kardiochirurgický výkon s MO, identifikovala vazoplegii s četností 12,5 % během MO; aplikace MM (průměrně 1,88 mg/kg během 20 min.) vedla ke zvýšení krevního tlaku a snížení dávky vazopresorů (zde noradrenalin a vazopresin) s lepším přežíváním do propuštění z nemocnice [54]. Z negativních studií je vhodné upozornit na retrospektivní analýzu, která zahrnula 226 kardiochirurgických pacientů (57 léčených MM vs. 169 bez aplikace MM) [55]. V této studii bylo podání MM spojeno s vyšším výskytem renálního selhání a vyšší smrtností; pacienti, kteří dostali MM, byli ovšem rizikovější, a navíc autoři při použití analýzy pomocí propensity skóre tyto závěry nepotvrdili. I když MM in vitro antagonizuje účinky heparinu, in vivo se toto nepotvrdilo [56].
Refrakterní vazodilatace je častá i v oblasti mechanických srdečních podpor, tedy v situaci, kdy větší část anebo celý krevní průtok zajišťuje namísto myokardu krevní pumpa. U současných levostranných mechanických srdečních podpor, které generují kontinuální nepulzatilní krevní průtok, byla incidence vazoplegického syndromu 33,1 % ve skupině 118 pacientů; tento stav byl spojen s delší dobou hospitalizace na jednotce intenzivní péče a vyšší smrtností jak během pobytu v intenzivní péči, tak během následujícího roku [57]. U 45 pacientů s extrakorporální membránovou oxygenací (38× veno‑arteriální a 7× veno‑venózní konfigurace), kterým byla v indikaci vazoplegického šoku podána MM, došlo v průběhu dvou hodin ke zvýšení krevního tlaku o více než 10 % se současným snížením dávky noradrenalinu u 55,6 % pacientů; ti měli zároveň lepší přežívání do propuštění z nemocnice oproti pacientům, u kterých nebyla odpověď na MM adekvátní [58].
Použití MM u kardiochirurgických pacientů bylo předmětem mnoha Pro‑Con diskuzí [59, 60], které ji zasadily do rámce léčebné strategie refrakterního distributivního šoku. Ve většině center se jedná o tzv. rescue podání, kdy objemová léčba a vazopresory první volby (noradrenalin a vazopresin) nevedou k zajištění adekvátní systémové cévní rezistence; důležitým faktorem může být i načasování aplikace MM, protože k odpovědi na MM už nemusí dojít v případě závažné hypoxie/ischemie tkání [61]. Závěrem je nicméně nutné zdůraznit, že jakémukoliv použití alternativních neadrenergních metod léčby refrakterní vazodilatace musí vždy předcházet promptní a komplexní diferenciální diagnostika příčin život ohrožující hypotenze v průběhu či po odpojení od MO.
Nežádoucí účinky
Kromě typického modro‑zeleného zbarvení tělesných tekutin jsou jako nežádoucí účinky v literatuře popisovány rozvoj dušnosti, křečí, zvracení, koronární vazokonstrikce a bolestí na hrudi, a to zejména při použití vyšších dávek MM [16, 62]. Dalším vedlejším efektem může být vznik serotoninového syndromu, který je způsoben inhibicí enzymu monoamino‑oxidázy A [63]. Jeho výskyt po podání MM je potencován některými antidepresivy 3. generace, která inhibují zpětné vychytávání serotoninu (SSRI a SARI); tato léčiva jsou často užívána např. u chronického srdečního selhání. Častými klinickými projevy serotoninového syndromu jsou tremor, hyperreflexie a hypertonus; projevem ovšem může být také jinak nevysvětlitelné koma s opožděnou vigilizací po kardiochirurgickém výkonu [64]. Při překročení toxické dávky 7 mg/kg pak MM indukuje paradoxní methemoglobinemii nebo akutní hemolytickou anémii s těžkou hyperbilirubinemií, a to zejména u pacientů s deficitem glukózo-6-fosfát dehydrogenázy [65]. Dále je popisována plicní oxygenační dysfunkce při MM indukované poruše hypoxické plicní vazokonstrikce a alveolo‑kapilární výměny kyslíku [66]. Vzhledem k vysokému riziku placentární vazokonstrikce a hypoxie plodu je MM kontraindikována v těhotenství [67]. MM též inhibuje jaterní cytochrom P450 a může tak ovlivnit metabolismus mnoha léků, zejména těch s úzkým terapeutickým indexem [66]. K důležitému vedlejšímu efektu patří falešně nízké hodnoty pulzní oxymetrie způsobené posunem absorpčního spektra při modro‑zeleném zbarvení tkání [68].
Závěr
Intravenózní podání MM v dávce 1–2 mg/kg patří v současnosti k tzv. záchranné léčbě pacientů s refrakterní formou distributivního šoku. Hlavní efekt MM spočívá v interferenci se signální cestou oxidu dusnatého v cévní stěně a její hemodynamická účinnost byla prokázána v mnoha retrospektivních i několika randomizovaných studiích. Při překročení doporučeného dávkování je nutno mít na paměti celou řadu možných nežádoucích účinků a lékových interakcí, zejména u látek ovlivňujících serotoninergní transmisi. Zásadní efekt na klinické výsledky a smrtnost zůstává nicméně značně nejistý, zejména použití MM v léčbě septického šoku není aktuálně doporučováno. Obecně vzato nelze žádný z dostupných neadrenergních vazopresorů včetně MM stran účinnosti preferovat před druhým. Jako rozumné se v případě refrakterní vazodilatace jeví postupné nasazování alternativních vazopresorů v rámci předem stanoveného algoritmu se snahou omezení jejich maximálních dávek a tím i potenciálních nežádoucích účinků [69].
PROHLÁŠENÍ AUTORŮ: Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média. Střet zájmů: Finanční příspěvek firmy Provepharm pro vznik publikace byl poskytnut České společnosti intenzivní medicíny (ČSIM) na náklady spojené s výročním kongresem ČSIM v roce 2021. Firma neměla vliv na obsah, rozsah, formát ani odborné názory autorů článku. Podíl autorů: Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína. MP: analýza dat, psaní rukopisu, HR: analýza dat, psaní rukopisu, MB: analýza dat, psaní rukopisu. Financování: Žádné.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Michal Pořízka, Ph.D., E.D.I.C.
michal.porizka@vfn.czČlánek přijat redakcí: 25. 6. 2021
Článek přijat k tisku: 14. 9. 2021;
Sources
- Bassi E, Park M, Azevedo LC. Therapeutic strategies for high‑dose vasopressor‑dependent shock. Crit Care Res Pract. 2013; 2013 : 654708. doi: 10.1155/2013/654708.
- De Backer D, Biston P, Devriendt J, Madl C, Chochrad D, Aldecoa C, et al.; SOAP II Investigators. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med. 2010; 362(9): 779–789. doi: 10.1056/NEJMoa0907118.
- Jenkins CR, Gomersall CD, Leung P, Joynt GM. Outcome of patients receiving high dose vasopressor therapy: a retrospective cohort study. Anaesth Intensive Care. 2009; 37(2): 286–289.
- Levy B, Collin S, Sennoun N, Ducrocq N, Kimmoun A, Asfar P, et al. Vascular hyporesponsiveness to vasopressors in septic shock: from bench to bedside. Intensive Care Med. 2010 Dec; 36(12): 2019–2029. doi: 10.1007/s00134-010-2045-8.
- Russell JA, Gordon AC, Williams MD, Boyd JH, Walley KR, Kissoon N. Vasopressor Therapy in the Intensive Care Unit. Semin Respir Crit Care Med. 2021 Feb; 42(1): 59–77. doi: 10.1055/s-0040-1710320.
- Jang DH, Nelson LS, Hoffman RS. Methylene blue for distributive shock: a potential new use of an old antidote. J Med Toxicol. 2013; 9(3): 242–249. doi: 10.1007/s13181-013-0298-7.
- Forstermann U, Sessa W. Nitric oxide synthases: regulation and function. Eur Heart J. 2012; 33(829–837): 837a–837d.
- Elbers P, Ince C. Mechanisms of critical illness - classifying microcirculatory flow abnormalities in distributive shock. Crit Care. 2006; 10(4): 221.
- Cauwels A. Nitric oxide in shock. Kidney Int. 2007; 72 : 557–565.
- Lambden S, Creagh‑Brown BC, Hunt J, Summers C, Forni LG. Definitions and Pathophysiology of vasoplegic shock. Crit Care. 2018; 22(1): 174.
- MacNaul KL, Hutchinson NI. Differential expression of iNOS and cNOS mRNA in human vascular smooth muscle cells and endothelial cells under normal and inflammatory conditions. Biochem Biophys Res Commun. 1993; 196(3): 1330–1334.
- Losada AP, Bermúdez R, Faílde LD, Quiroga MI. Quantitative and qualitative evaluation of iNOS expression in turbot (Psetta maxima) infected with Enteromyxum scophthalmi. Fish Shellfish Immunol. 2012; 32(2): 243–248. doi: 10.1016/j.fsi.2011. 11. 007.
- Juřica J. Methylenová modř. Remedia. 2018; 28 : 264–271.
- Lenglet S, Mach F, Montecucco F. Methylene blue: potential use of an antique molecule in vasoplegic syndrome during cardiac surgery. Expert Rev Cardiovasc Ther. 2011 Dec; 9(12): 1519–1525. doi: 10.1586/erc.11.160.
- Clifton J, Leikin JB. Methylene blue. Am J Ther. 2003; 10(4): 289–291.
- Tchen S, Sullivan JB. Clinical utility of midodrine and methylene blue as catecholamine‑sparing agents in intensive care unit patients with shock. J Crit Care. 2020 Jun; 57 : 148–156. doi: 10.1016/j.jcrc.2020. 02. 011.
- Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017 Mar; 43(3): 304–377. doi: 10.1007/s00134-017-4683-6.
- Peng Q, Brown SB, Moan J, Nesland JM, Wainwright M, Griffiths J, et al. Biodistribution of a methylene blue derivative in tumor and normal tissues of rats. J Photochem Photobiol B. 1993 Sep; 20(1): 63–71. doi: 10.1016/1011-1344(93)80132-s.
- Watson D, Grover R, Anzueto A, Lorente J, Smithies M, Bellomo R, et al. Glaxo Wellcome International Septic Shock Study Group. Cardiovascular effects of the nitric oxide synthase inhibitor NG‑methyl‑L-arginine hydrochloride (546C88) in patients with septic shock: results of a randomized, double‑blind, placebo‑controlled multicenter study (study no. 144-002). Crit Care Med. 2004 Jan; 32(1): 13–20. doi: 10.1097/01.CCM.0000104209.07273.FC.
- Gachot B, Bedos JP, Veber B, Wolff M, Regnier B. Short‑term effects of methylene blue on hemodynamics and gas exchange in humans with septic shock. Intensive Care Med. 1995; 21(12): 1027–1031. https://doi.org/10.1007/bf01700666.
- Park BK, Shim TS, Lim CM, Lee SD, Kim WS, Kim DS, et al. The effects of methylene blue on hemodynamic parameters and cytokine levels in refractory septic shock. Korean J Intern Med. 2005; 20(2): 123–128. doi: 10.3904/kjim.2005. 20. 2.123.
- Memis D, Karamanlioglu B, Yuksel M, Gemlik I, Pamukcu Z. The influence of methylene blue infusion on cytokine levels during severe sepsis. Anaesth Intensive Care. 2002; 30(6): 755–762. doi: 10.1177/0310057X0203000606.
- Kirov MY, Evgenov OV, Evgenov NV, Egorina EM, Sovershaev MA, Sveinbjørnsson B, et al. Infusion of methylene blue in human septic shock: a pilot, randomized, controlled study. Crit Care Med. 2001 Oct; 29(10): 1860–1867. doi: 10.1097/00003246-200110000-00002. PMID: 11588440.
- Ramamoorthy S, Patel S, Bradburn E, Kadry Z, Uemura T, Janicki P, et al. Use of methylene blue for treatment of severe sepsis in an immunosuppressed patient after liver transplantation. Case Rep Transplant. 2013; 2013 : 203791. doi: 10.1155/2013/203791.
- Denny JT, Burr AT, Balzer F, Tse JT, Denny JE, Chyu D. Methylene blue treatment for cytokine release syndrome‑associated vasoplegia following a renal transplant with rATG infusion: A case report and literature review. Exp Ther Med. 2015 May; 9(5): 1915–1920. doi: 10.3892/etm.2015.2349.
- Heemskerk S, van Haren FM, Foudraine NA, Peters WH, van der Hoeven JG, Russel FG, et al. Short‑term beneficial effects of methylene blue on kidney damage in septic shock patients. Intensive Care Med. 2008 Feb; 34(2): 350–354. doi: 10.1007/s00134-007-0867-9.
- Beckman JS, Koppenol WH. Nitric oxide, superoxide, and peroxynitrite: the good, the bad, and ugly. Am J Physiol. 1996; 271(5 Pt 1): C1424–C1437. doi: 10.1152/ajpcell. 1996.271. 5. C1424.
- Blackwell TS, Christman JW. Sepsis and cytokines: current status. Br J Anesth. 1996; 77 : 110–117.
- Harbrech BG, Wang SC, Simmons RL, Billiar TR. Cyclic GMP and guanylate cyclase mediate lipopolysaccharide‑induced Kupffer cell tumor necrosis factor‑α sysnthesis. J Leukoc Biol. 1995; 57 : 297–302.
- Lieberman P. The use of antihistamines in the prevention and treatment of anaphylaxis and anaphylactoid reactions. J Allergy Clin Immunol. 1990; 86(4 Pt 2): 684–686. doi: 10.1016/s0091-6749(05)80241-6.
- Enjeti S, Bleecker ER, Smith PL, Rabson J, Permutt S, Traystman RJ. Hemodynamic mechanisms in anaphylaxis. Circ Shock. 1983; 11(4): 297–309.
- Tanimoto A, Wang KY, Murata Y, Kimura S, Nomaguchi M, Nakata S, et al. Histamine upregulates the expression of inducible nitric oxide synthase in human intimal smooth muscle cells via histamine H1 receptor and NF‑kappaB signaling pathway. Arterioscler Thromb Vasc Biol. 2007; 27(7): 1556–1561. doi: 10.1161/ATVBAHA.106.139089.
- Li H, Burkhardt C, Heinrich UR, Brausch I, Xia N, Förstermann U. Histamine upregulates gene expression of endothelial nitric oxide synthase in human vascular endothelial cells. Circulation. 2003; 107(18): 2348–2354. doi: 10.1161/01.CIR.0000066697.19571.AF.
- Oliveira Neto AM, Duarte NM, Vicente WV, Viaro F, Evora PR. Methylene blue: an effective treatment for contrast medium‑induced anaphylaxis. Med Sci Monit. 2003 Nov; 9(11): CS102–6.
- Del Duca D, Sheth SS, Clarke AE, Lachapelle KJ, Ergina PL. Use of methylene blue for catecholamine‑refractory vasoplegia from protamine and aprotinin. Ann Thorac Surg. 2009 Feb; 87(2): 640–642. doi: 10.1016/j.athoracsur.2008. 07. 017.
- Rodrigues JM, Pazin Filho A, Rodrigues AJ, Vicente WV, Evora PR. Methylene blue for clinical anaphylaxis treatment: a case report. Sao Paulo Med J. 2007 Jan 4; 125(1): 60–62. doi: 10.1590/s1516-31802007000100012.
- Laes JR, Williams DM, Cole JB. Improvement in Hemodynamics After Methylene Blue Administration in Drug‑Induced Vasodilatory Shock: A Case Report. J Med Toxicol. 2015 Dec; 11(4): 460–463. doi: 10.1007/s13181-015-0500-1.
- Jang DH, Nelson LS, Hoffman RS. Methylene blue in the treatment of refractory shock from an amlodipine overdose. Ann EmergMed. 2011; 58 : 565–567.
- Lenasi H, Kohlstedt K, Fichtlscherer B, Mülsch A, Busse R, Fleming I. Amlodipine activates the endothelial nitric oxide synthase by altering phosphorylation on Ser1177 and Thr495. Cardiovasc Res. 2003; 59 : 844–853.
- Hall RI, Smith MS, Rocker G. The systemic inflammatory response to cardiopulmonary bypass: Pathophysiological, therapeutic, and pharmacological considerations. Anesth Analg. 1997; 85 : 766–782.
- Wan S, LeClerc JL, Vincent JL. Inflammatory response to cardiopulmonary bypass: Mechanisms involved and possible therapeutic strategies. Chest. 1997; 112 : 676–692.
- Kerbaul F, Guidon C, Lejeune PJ, Mollo M, Mesana T, Gouin F. Hyperprocalcitonemia is related to noninfectious postoperative severe systemic inflammatory response syndrome associated with cardiovascular dysfunction after coronary artery bypass graft surgery. J Cardiothorac Vasc Anesth. 2002; 16 : 47–53.
- Gomes WJ, Carvalho AC, Palma JH, Teles CA, Branco JN, Silas MG, et al. Vasoplegic syndrome after open heart surgery. J Cardiovasc Surg (Torino). 1998; 39 : 619–623.
- Levin MA, Lin HM, Castillo JG, Adams DH, Reich DL, Fischer GW. Early on‑cardiopulmonary bypass hypotension and other factors associated with vasoplegic syndrome. Circulation. 2009; 120 : 1664–1671.
- Mets B, Michler RE, Delphin ED, Oz MC, Landry DW. Refractory vasodilation after cardiopulmonary bypass for heart transplantation in recipients on combined amiodarone and angiotensin‑converting enzyme inhibitor therapy: a role for vasopressin administration. J Cardiothorac Vasc Anesth. 1998; 12 : 326–329.
- Raja SG, Dreyfus GD. Vasoplegic syndrome after off‑pump coronary artery bypass surgery: an unusual complication. Tex Heart Inst J. 2004; 31 : 421–424.
- Weis F, Kilger E, Beiras‑Fernandez A, Nassau K, Reuter D, Goetz A. Association between vasopressor dependence and early outcome in patients after cardiac surgery. Anaesthesia. 2006; 61 : 938–942.
- Sundaram V, Fang JC. Gastrointestinal and liver issues in heart failure. Circulation. 2016; 133 : 1696–1703.
- Yiu P, Robin J, Pattison CW. Reversal of refractory hypotension with single‑dose methylene blue after coronary artery bypass surgery. J Thorac Cardiovasc Surg. 1999; 118 : 195–196.
- Říha H, Říhová L, Pinďák M, Březina A, Pirk J. Metylénova modř v léčbě vazoplegického syndromu po kardiochirurgické operaci. Čas Lék Česk. 2006; 145 : 322–324.
- Levin RL, Degrange MA, Bruno GF, Del Mazo CD, Taborda DJ, Griotti JJ, et al. Methylene blue reduces mortality and morbidity in vasoplegic patients after cardiac surgery. Ann Thorac Surg. 2004; 77 : 496–499.
- Maslow AD, Stearns G, Butala P, Schwartz CS, Gough J, Singh AK. The hemodynamic effects of methylene blue when administered at the onset of cardiopulmonary bypass. Anesth Analg. 2006; 103 : 2–8.
- Ozal E, Kuralay E, Yildirim V, Kilic S, Bolcal C, Kücükarslan N, et al. Preoperative methylene blue administration in patients at high risk for vasoplegic syndrome during cardiac surgery. Ann Thorac Surg. 2005; 79 : 1615–1619.
- Kofler O, Simbeck M, Pichlmaier M, Zwissler B, Von Dossow V. Treatment of vasoplegic syndrome during cardiopulmonary bypass with methylene blue restores hemodynamic function and affects the overall survival: A 10-years retrospective large‑volume cohort study abstract. Eur J Anaesthesiol. 2018; 35 : 188.
- Weiner MM, Lin HM, Danforth D, Rao S, Hosseinian L, Fischer GW. Methylene blue is associated with poor outcomes in vasoplegic shock. J Cardiothorac Vasc Anesth. 2013; 27 : 1233–1238.
- Metz S, Horrow JC, Goel IP, Kuretu ML, Bellwoar C. Methylene blue does not neutralize heparin after cardiopulmonary bypass. J Cardiothorac Vasc Anesth. 1996; 10 : 474–476.
- de Waal EEC, van Zaane B, van der Schoot MM, Huisman A, Ramjankhan F, van Klei WA, et al. Vasoplegia after implantation of a continuous flow left ventricular assist device: Incidence, outcomes and predictors. BMC Anesthesiol. 2018; 18 : 185.
- Ortoleva J, Roberts RJ, Devine LT, French A, Kawabori M, Chen F, et al. Methylene blue for vasoplegia during extracorporeal membrane oxygenation support. J Cardiothorac Vasc Anesth. 2020 Dec 29:S1053-0770(20)31389-6. doi: 10.1053/j. jvca.2020. 12. 042.
- Říha H, Augoustides JG. Pro: Methylene blue as a rescue therapy for vasoplegia after cardiac surgery. J Cardiothorac Vasc Anesth. 2011; 25 : 736–738.
- Andritsos MJ. Con: methylene blue should not be used routinely for vasoplegia perioperatively. J Cardiothorac Vasc Anesth. 2011; 25 : 739–743.
- Pořízka M, Kopecký P, Dvořáková H, Kunstyr J, Lips M, Michalek P, et al. Methylene blue administration in patients with refractory distributive shock – a retrospective study. Sci Rep. 2020; 10 : 1828.
- Evora PR, Ribeiro PJ, Vicente WV, Reis CL, Rodrigues AJ, Menardi AC, et al. Methylene blue for vasoplegic syndrome treatment in heart surgery: fifteen years of questions, answers, doubts and certainties. Rev Bras Cir Cardiovasc. 2009; 24(3): 279–288. doi: 10.1590/s0102-76382009000400005
- Héritier Barras AC,Walder B, SeeckM. Serotonin syndrome following methylene blue infusion: a rare complication of antidepressant therapy. J Neurol Neurosurg Psychiatry. 2010 Dec; 81(12): 1412–1413. doi: 10.1136/jnnp.2009.172221.
- Martino EA, Winterton D, Nardelli P, Pasin L, Calabrò MG, Bove T, et al. The Blue Coma: The Role of Methylene Blue in Unexplained Coma After Cardiac Surgery. J Cardiothorac Vasc Anesth. 2016; 30(2): 423–427. doi: 10.1053/j.jvca.2015. 09. 011.
- Goluboff N, Wheaton R. Methylene blue‑induced cyanosis and acute hemolytic anemia complicating the treatment of methemoglobinemia. J Pediatr. 1961; 58 : 86–89.
- Weingartner R, Oliveira E, Oliveira ES, Sant’Anna UL, Oliveira RP, Azambuja LA, et al. Blockade of the action of nitric oxide in human septic shock increases systemic vascular resistance and has detrimental effects on pulmonary function after a short infusion of methylene blue. Braz J Med Biol Res. 1999; 32(12): 1505–1513.
- Puntillo F, Giglio M, Pasqualucci A, Brienza N, Paladini A, Varrassi G. Vasopressor‑Sparing Action of Methylene Blue in Severe Sepsis and Shock: A Narrative Review. Adv Ther. 2020 Sep; 37(9): 3692–3706. doi: 10.1007/s12325-020-01422-x.
- Kessler MR, Eide T, Humayun B, Poppers PJ. Spurious pulse oximeter desaturation with methylene blue injection. Anesthesiology. 1986; 65(4): 435–436.
- Busse LW, Barker N, Petersen C. Vasoplegic syndrome following cardiothoracic surgery–review of pathophysiology and update of treatment options. Crit Care. 2020; 24(1): 36.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2021 Issue 4-5-
All articles in this issue
- Ohlédnutí za světovým kongresem anesteziologů
- Evaluation of patients referred to brain death scintigraphy
- Peroperační FiO2 a dlouhodobá pooperační mortalita
- Peroperační PEEP u obezních pacientů/pacientek
- Antagonization of neuromuscular blockade by sugammadex vs. neostigmine in patients undergoing robotic‑assisted urological procedures – effect on extubation time and quality of the recovery – monocentric prospective randomized study
- Post‑operative sleep‑disordered breathing with different anesthesia techniques: an observational study
- Methylene blue administration in refractory distributive shock
- Prophylaxis of venous thromboembolism in critically ill patients
- Extraglottic devices on the battlefield
- Our article after ten years: Awake cardiac surgery
- Upper airway and esophageal burn injury
- Centrální anticholinergní syndrom – zapomenutá diagnóza?
- Patron anesteziologů, sv. René, má svátek 28. 11.
- Nové zkušební otázky k atestaci
- Limity v přežití úspěšné akutní intenzivní péče
- Pooperační únavový syndrom
- Výběr z „NEJM Guideline Watch 2021“
- Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2021
- Porodnická anestezie a srdeční choroby v klinickém pohledu
- Kognitivní omezení a dysfunkce po sepsi
- Zajímavosti, tipy a triky, informace z jiných oborů
- Současný pohled na dobu předoperačního lačnění novorozenců
- Vzpomínka na MUDr. Zdeňka Bystřického, CSc.
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Upper airway and esophageal burn injury
- Pooperační únavový syndrom
- Methylene blue administration in refractory distributive shock
- Prophylaxis of venous thromboembolism in critically ill patients
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

