-
Medical journals
- Career
Rok 2020 v přehledu – Intenzivní medicína
Authors: J. Beneš 1,2,3; J. Zatloukal 1,2; J. Kletečka 1,2; J. Chvojka 1,2,3,4,5; J. Horák 3,4,5; T. Karvunidis 3,4,5; J. Pouska 1,2; M. Matějovič 3,4,5
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní medicíny, Lékařská fakulta v Plzni, Univerzita Karlova 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Plzeň 2; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova 3; JIP, I. interní klinika, Lékařská fakulta v Plzni, Univerzita Karlova 4; JIP, I. interní klinika, Fakultní nemocnice Plzeň 5
Published in: Anest. intenziv. Med., 31, 2020, č. 6, s. 265-276
Category: Review Articles
Overview
Rok 2020 byl ve znamení pandemie onemocnění COVID-19, nicméně byla v jeho průběhu publikována celá řada prací týka jících se diagnostiky a podpory selhávajících orgánových systémů (respiračního, kardiovaskulárního), ale také problematiky sepse, náhrady funkce ledvin a obecné problematiky poskytování obecné kvalitní intenzivní péče.
Klíčová slova:
intenzivní péče – sepse – multiorgánová dysfunkce
Úvod
Rok 2020 znamenal pro intenzivní medicínu jako obor zcela jinou výzvu než jakýkoli předchozí. Personální a klinická zátěž v důsledku pandemie onemocnění COVID-19 je přirovnatelná snad jen ke globálním válečným konfliktům. Na lokální úrovni (oblastí a států) potom snese příměr s epidemiemi polia – událostmi, které „udělaly intenzivní medicínu“ [1]. Momentálně se díky této pandemii intenzivní medicína dostává do velmi podobné situace. Není proto divu, že většina renomovaných i menších časopisů, stejně jako zájem většiny výzkumných týmů, se v uplynulém období zaměřil hlavně na problematiku onemocnění způsobeného virem SARS‑CoV - 2. Z dnešního pohledu je zajímavé sledovat vývoj publikační aktivity uplynulého roku. Počínaje kazustickými vstupy a porovnáním s epidemiemi předchozích koronavirových onemocnění, přes první observační a fyziologické práce až po dnešní publikace metodicky vyvážených robustních randomizovaných studií. Zajímavé bylo také sledovat chování běžných lékařů v průběhu uplynulého roku – oscilujíce mezi „puristickou“ podpůrnou terapií až po poskytování léčby založené někdy více na přáních než fyziologické plauzibilitě (která se ale v naprosté většině ukázala neopodstatněná). Přesto byla v oblasti „necovidové“ intenzivní péče (IP) publikována celá řada zajímavých článků a důležitých poznatků. V našem textu se věnujeme právě jim, neboť s roční perspektivou je patrné, že při absenci „magických kulek“ zůstává „dobrá intenzivní péče“ tím absolutním základem péče o jakéhokoli (a tedy i „covidového“) pacienta.
Příkladem může být PEPTIC trial [2] – mezinárodní klinická randomizovaná studie zabývající se otázkou vlivu podání blokátorů protonové pumpy (PPI) oproti blokátorům histaminových H2 receptorů (H2RB) jako profylaxe vzniku žaludečních vředů na snížení 90denní mortality. Zařazeni byli nemocní vyžadující umělou plicní ventilaci (UPV) vyjma pacientů se základní diagnózou krvácení z horní části GIT. Zúčastnilo se jí 50 center v celkem 5 zemích mezi lety 2016–2019. Bylo zařazeno 26 982 pacientů – šlo tedy o studii s největší kalkulovanou silou (power analysis) v historii intenzivní medicíny! Každé centrum bylo zařazeno do skupiny PPI anebo H2RB, a následně podle zařazení užívalo příslušné farmakum jako primární profylaxi stresového žaludečního vředu. Následně po 6 měsících došlo ke crossoveru centra mezi skupinami a byl tedy primárně podáván druhý preparát. Primární cíl – 90denní mortalita – byl mezi skupinami bez statisticky signifikantního rozdílu (18,3 % PPI vs. 17,5 % H2RB, p = 0,054). Mezi sekundárními cíli byl statisticky signifikantní rozdíl vzniku klinicky závažného krvácení do GIT (1,3 % PPI vs. 1,8 % H2RB; RR 0,73 (CI 0,57–0,92)) a rozdíl v mortalitě u pacientů, kteří podstoupili kardiochirurgický výkon (2,5 % PPI vs. 1,9 % H2RB; RR 1,27 (CI 1,04–1,57)). Jako hlavní nepřesnost studie je uváděn crossover farmak mezi skupinami (ve skupině H2RB obdrželo 20 % pacientů PPI), dále pak také sběr dat z databází, které mají celosvětově odlišnou přesnost získávání a interpretace dat. V nedávné minulosti publikovaná SUP‑ICU trial [3] neprokázala superioritu použití PPI v profylaxi pacientů na JIP oproti placebu, přičemž zde byli zařazováni také neventilovaní pacienti a populace byla s nižší závažností stavu. Studie PEPTIC zaznamenala nižší výskyt akutního krvácení z GIT při použití PPI vs. H2RB, zároveň ale ukazuje, že užívání PPI je spojeno s trendem k vyšší mortalitě oproti H2RB. Vysvětlení tohoto trendu je však nejasné, zejména když studie neprokázala vyšší rizika clostridiové kolitidy či nozokominálních pneumonií u nemocných léčených PPI. Volbu mezi PPI a H2RB tak určuje především rizikovost krvácení do GIT. PPI jsou nadále lékem volby u pacientů s prokázaným krvácením z GIT a u nemocných s vysokým rizikem krvácení (např. šokové stavy, koagulopatie, jaterní selhání, mimotělní metody, anamnéza vředové nemoci apod.)
Respirační systém
Problematika je aktuální především s ohledem na masivní výskyt ARDS při současné epidemii COVID-19, nicméně v průběhu posledního roku bylo publikováno několik prací, které se věnovaly i jiným otázkám.
Kyslík – rizika hypoxie/hyperoxie
Léčba kyslíkem, respektive rizika hyperoxie či hypoxie patří mezi témata, která jsou hojně diskutovaná v posledních několika letech. V roce 2018 vyšla metaanalýza Dereka Chu [4], která poukazovala na negativní mortalitní efekt liberální kyslíkové terapie u kriticky nemocných, a i další studie pacientů po infarktu myokardu nebo mozkové ischemii varovaly před liberálním použitím kyslíku. V loňském roce pak byla publikována ICU‑ROX study [5], která neprokázala klinicky významný rozdíl u pacientů na umělé plicní ventilaci (UPV) při použití konzervativní a zvyklé terapie kyslíkem. V letošním roce se tomuto tématu věnovala práce Barrota [6]. Jednalo se o multicentrickou randomizovanou studii na 13 jednotkách intenzivní péče ve Francii. Studovanou skupinou byli pacienti na UPV z důvodu ARDS. V konzervativní skupině byl cílem PaO2 7,3–9,3 kPa, SpO2 88–92 %. V kontrolní (liberální) skupině byl cíl PaO2 12–14 kPa, SpO2 ≥ 96 % po dobu prvních 7 dnů. Bylo zařazeno pouze 205 pacientů z celkově plánovaných 850 a studie byla předčasně ukončena z bezpečnostních důvodů. Nebyl shledán rozdíl v 28denní mortalitě mezi skupinami (primární outcome), která byla 34,3 % v konzervativní skupině a 26,5 % v liberální skupině. 90denní mortalita byla signifikantně vyšší v konzervativní skupině 44,4 % vs. 30,4 %, stejně jako výskyt mezenteriální ischemie. Tato studie poukázala na možná rizika restriktivního použití kyslíku u pacientů s ARDS, a to i v rozmezích, která jsou obecně doporučována ARDS network.
Tématu se týkala i sekundární analýza dat z LUNG SAFE study [7], kterou provedla skupina Fabiany Madotto. Práce analyzovala prevalenci a důsledky nadměrného použití kyslíku u pacientů s ARDS. Ve studované skupině 2 005 pacientů se hyperoxémie (PaO2 ≥ 100 mmHg) v prvním dni vyskytovala u 30 % pacientů, hyperoxémie přetrvávající 2 dny u 12 % a excesivní užití kyslíku během hyperoxémie (FiO2 ≥ 0,6) u 66 % pacientů. I přes frekventní vystavení pacientů vlivu hyperoxémie nevedla tato skutečnost k žádným klinicky významným negativním důsledkům ve srovnání s normoxemickou skupinou. I s ohledem na výše citovanou studii Barrota [5] se zdá, že naše současné universální vnímání lehké hypoxémie u pacientů s ARDS jako neškodné a hyperoxémie jako škodlivé nemá zcela jistě absolutní platnost.
Tracheální intubace
Tracheální intubace, a to především za obtížných podmínek, patří mezi stále velmi živé téma v anesteziologii i intenzivní medicíně. Z tohoto důvodu je velmi zajímavý doporučený postup Difficult airway society pro intubaci při vědomí [8]. Jedná se o postup, který lze použít v prostředí intenzivní péče i operačního sálu. Doporučený postup založený na názoru expertů v oboru přehledně shrnuje indikace a provedení intubace při vědomí pacienta, stejně jako možné komplikace a jejich řešení. Za zmínku stojí doporučení vždy oxygenovat pacienta pomocí vysoko‑průtokové nosní kanyly během celé procedury, jasný postup pro topickou anestezii s preferencí 10% lidokainu, a to až v dávce 20–30 vstřiků jakož i možnost podání cestou nebulizace. Doporučení vhodné sedace s preferencí remifentanilu či dexmedetomidinu kombinovaného případně s midazolamem. Provedení výkonu s použitím fibroskopu či videolaryngoskopu a vždy dvojí kontrolu umístění endotracheální rourky – vizuálně a pomocí kapnometrie – před uvedením pacienta do celkové anestezie. Postup obsahuje i několik užitečných tipů a triků, které mohou danou proceduru usnadnit.
Postupy u ARDS
Nejen s ohledem na aktuálně probíhající pandemii COVID-19, ale i vzhledem k obecně stále většímu rozšiřování oxygenoterapie vysoko‑průtokovou nosní kanylou (HFNC) v klinické praxi považujeme za důležité zmínit aktuální review publikované Ricardem, které se týká použití HFNC u akutního respiračního selhání [9]. V tomto přehledném článku shrnují autoři princip a význam použití HFNC v intenzivní péči o pacienty s akutní respirační insuficiencí, a to především hypoxického typu. Článek shrnuje data z recentních studií, které se zabývaly použitím HFNC v různých situacích a dokládá její význam ve snížení četnosti intubace a také mortalitní efekt u některých subpopulací kriticky nemocných. Z praktického hlediska je pak zajímavý algoritmus použití tzv. ROX indexu ([(SpO2/FiO2) / dechová frekvence]) k predikci rizika selhání HFNC a nutnosti intubace pacienta.
Jednou z „klasických“ intervencí u pacientů s ARDS, a to především s jeho těžkou variantou, je kontinuální nervosvalová blokáda v iniciální fázi UPV. Jistou pochybnost o přínosu nervosvalové blokády u těchto pacientů přinesla loňská studie Mosse [10], která neprokázala mortalitní benefit nervosvalové blokády. Metaanalýza Changa [11] uveřejněná letos v časopise Critical Care se snaží prokázat platnost přínosu nervosvalové blokády v časné fázi středně těžkého a těžkého ARDS. Tato práce vycházela ze 7 randomizovaných studií (5 z nich však bylo provedeno na malém vzorku pacientů). V metaanalýze byl prokázán benefit nervosvalové blokády u pacientů s ARDS na mortalitu a výskyt barotraumatu. Autoři spatřují význam nervosvalové blokády především u pacientů s těžkou formou ARDS, kteří vyžadují hlubokou farmakologickou sedaci. S ohledem na výše citovanou práci Mosse [10] ovšem autoři přiznávají nutnost dalších randomizovaných studií týkajících se této problematiky.
Prevence ventilátorové pneumonie
Zajímavou prací z konce roku 2019 týkající se této problematiky je multicentrická randomizovaná, dvojitě zaslepená studie týkající se pacientů s mimonemocniční zástavou oběhu s defibrilovatelným rytmem, u nichž byl uplatněn „targeted temperature management (32–34 °C)“ [12]. Studovanou intervencí bylo časné podání antibiotik (amoxicilin + klavulanát 1,2 g à 8 hodin po dobu 2 dnů, zahájený nejpozději 6 h po zástavě) jako prevence vzniku VAP v intervenční skupině a placeba ve skupině kontrolní. Cílem bylo snížit výskyt ventilátorové pneumonie v prvních 7 dnech hospitalizace. Bylo zařazeno 194 pacientů. Incidence VAP v intervenční skupině byla statisticky signifikantně nižší než ve skupině kontrolní – 19 % vs. 34 % (p = 0,03). V ostatních sledovaných parametrech včetně 28denní mortality nebyl shledán signifikantní rozdíl. Zdá se, že rutinní podání ATB u pacientů po mimonemocniční zástavě může přinést jistý klinický benefit a mohlo by se stát rutinním postupem v rámci resuscitační péče.
COVID-19 a respirační systém
Pandemii COVID-19 se bohužel ve stati věnované respiračnímu selhání nelze úplně vyhnout, a proto zmiňujeme i dvě práce týkající se této ožehavé problematiky. První z nich je studie týkající se postupu do nedávné doby v podstatě neznámého, kterým je pronace spontánně ventilující pacienta při vědomí. Tomuto tématu se věnuje v současné době nejrozsáhlejší prospektivní, multicentrická, observační studie zabývající se přínosem pronační polohy (PP) u neintubovaných, bdělých pacientů s COVID-19 pneumonií s nutností oxygenoterapie pomocí HFNC [13]. Zapojeno bylo 36 center ve Španělsku. Screenováno bylo 1 076 pacientů v rozmezí 3 měsíců, zařazeno bylo 199 pacientů, u nichž byla použita HFNC jako primární forma pokročilé oxygenoterapie. Padesátpět (27,6 %) pacientů bylo pronováno (HFNC + PP) na dobu ≥ 16 h/den (v součtu). Intubace a UPV byla nutná u 22 (40 %) pacientů HFNC + PP a 60 (41 %) HFNC pacientů. PP jako doplňující terapie k HFNC nesnížila riziko intubace, pouze jej byla schopna oddálit o 1 den (HFNC medián 1 den (Inter‑qvartilové rozpětí (IQR) 1–2,5), HFNC + PP medián 2 dny (IQR 1–3)), přičemž oddálená intubace nezvýšila 28denní mortalitu pacientů. Autoři přiznávají řadu limitací studie, nicméně lze říct, že hlavní benefit bdělé pronační polohy lze spatřovat v oddálení intubace, což může být v prostředí přehlcené intenzivní péče důležité. Další data v tomto směru může přinést probíhající intervenční randomizovaná studie APPROVE‑CARE study [14].
Použití extrakorporální membránové oxygenace (ECMO) zažilo svoji renesanci v souvislosti s pandemií chřipky v letech 2009–2010 a tak není divu, že při současné pandemii je tato záchranná terapie také využívána. Využití a přínosu ECMO u pacientů s COVID-19 se věnuje recentní multicentrická, mezinárodní, observační studie Barbara a MacLarena [15]. Byla získána data od 1 035 pacientů léčených pomocí ECMO, a to z Extracorporeal Life Support Organization (ELSO) registru. Data byla získána z 213 nemocnic v 36 zemích. Studie přináší velmi podrobný popis této populace pacientů, z nichž vybíráme: medián věku 49 let, mužské pohlaví 74 %, napojení na ECMO v periferní nemocnici a transport do centra 47 % pacientů, medián času od intubace do zahájení ECMO 4 dny (IQR 1,8–6,4 dní), veno‑venozní ECMO 94 % případů. Medián trvání ECMO byl 13,9 dne, nejčastější byly mechanické komplikace, a to u 28 % pacientů. V době finální analýzy byl jasný osud 94 % pacientů. 57 % (588) pacientů přežilo, z toho: 30 % bylo propuštěno domů nebo do rehabilitačního centra, 10 % do dlouhodobé intenzivní péče, 17 % přeloženo do jiné nemocnice. 39 % (380) pacientů zemřelo, z toho: 81 % do 24 hodin od odpojení z ECMO, kdy ve většině případů byla terapie ukončena z důvodu špatné prognózy. Dle závěrů této studie a taktéž na základě jejího srovnání se studií EOILA [16] vyplývá, že použití ECMO jako ultimu refugium u pacientů s COVID-19 pneumonií je účelnou terapií a výsledky se neliší od jeho použití u jiných forem těžké akutní respirační insuficience potažmo ARDS.
Kardiovaskulární systém
Téma kardiovaskulárního systému stálo v uplynulém roce zdánlivě v pozadí. Coronavirové onemocnění je sice spojeno s mírnou oběhovou nestabilitou, klinicky potřebné intervence ale jistě nepotřebují významně sofistikované postupy. Z pohledu běžné intenzivní terapie se v průběhu roku objevilo několik menších prací, které poskytují spíše kousíčky skládanky než celé obrazce.
Klinické cíle hemodynamických intervencí
Celá řada autorů se věnovala problematice cílů hemodynamické péče; tedy hlavně hodnotám cílových tlaků v iniciální (resuscitační) fázi a otázce dalších možných parametrů. Vztah chronických hodnot arteriálního tlaku a potřeby vazopresorů v průběhu iniciální fáze kritického onemocnění sledovala skupina Hanny Wunsch [17]. Elektronické záznamy všech dospělých pacientů přijatých v období 2012–2018 na 4 jednotky intenzivní péče v Calgary (Kanada) (n = 3 542) byly podrobeny retrospektivní analýze. Výsledky studie jsou poněkud kontraintuitivní – pacienti skupiny s chronicky nízkými hodnotami krevního tlaku (SBP ≤ 100 mmHg) vyžadovali v průběhu iniciální fáze delší dobu a vyšší dávky vazopresorické podpory než osoby s chronicky normálními nebo vysokými hodnotami krevního tlaku. Vzhledem k tomu, že cílový MAP nebyl v rámci studie nijak ovlivňován a řídil se tudíž zvyklými doporučeními, byly tyto hodnoty porovnatelné v jednotlivých skupinách (MAP 63–73 mmHg). To pro skupiny s chronicky normálním a vyšším tlakem znamenalo iniciální „permisivní“ hypotenzní management. Za těchto okolností je již pochopitelné, že osoby s chronicky vyšším tlakem dosáhly dříve vysazení vazopresorické podpory přestože nedosáhly svých normálních hodnot. Paradoxně sekundární cíle poukázali na horší klinické výstupy (delší hospitalizace na JIP, v nemocnici a vyšší mortalita) u skupiny s dlouhodobě nižšími tlaky – zde je ovšem nutno zohlednit i heterogenitu skupin ve smyslu vyvolávajícího onemocnění, a tudíž nízkou statistickou sílu těchto závěrů. Jiná retrospektivní práce na více než 1 000 pacientech s kardiogenním šokem [18] poukázala na to, že průměr středních arteriálních tlaků monitorovaných v průběhu prvních 24 hodin pod 65 mmHg je významně asociován s mortalitou (adjustované odds ratio 2,05 (1,38–3,02) p < 0,001). Na druhou stranu i zde platí, že cílové hodnoty krevního tlaku nebyly individualizovány, a tudíž hodnoty pod 65 mmHg znamenají spíše neschopnost tohoto cíle dosáhnout (pro což svědčí i vyšší tíže onemocnění atd.) – vyšší mortalita v této skupině tedy není překvapivá. Vedlejší informací této práce zůstává, že u pacientů v kardiogenním šoku s MAP 65–75 mmHg a > 75 mmHg byl rozdíl v klinických cílech (nemocniční prevalence akutního renálního postižení 44,1 vs. 40,9 %, délka hospitalizace 13,7 ± 18,5 vs. 11,7 ± 12,5 dne nebo mortalita 29,8 % vs. 26,9 %) již významně menší. Třetí rozsáhlá práce věnovaná problematice relativní hypotenze u pacientů v iniciální fázi kritického onemocnění pochází ze skupiny ANZICS [19]. V této prospektivní observační studii ze 7 pracovišť intenzivní péče bylo sledováno 302 pacientů převážně se septickým šokem. Medián nedostatečného perfuzního tlaku (definovaný jako rozdíl MAP‑CVP) s ohledem na chronické hodnoty byl pozorován v 19 % sledovaného období a pokles MPP o více než 20 % byl sledován v 54 % sledovaných časových bodů. Expozice relativní hypotenzi ve sledované kohortě tedy byla vzdor probíhající vazopresorické podpoře enormní. Hodnoty MPP deficitu i poklesu o více než 20 % přitom korelovali s rozvojem AKI. Pravděpodobně nejrobustnější výsledky k této problematice přinesla randomizovaná multicentrická práce na 2 600 pacientech starších 65 let s tzv. „vazodilatační“ hypotenzí (v 80 % z důvodu sepse) [20]. Devadesátidenní mortalita pacientů ve skupině s iniciálním cílovým MAP v pásmu 60–65 mmHg byla srovnatelná se skupinou s tradičním MAP ≥ 65 mmHg. Ovšem při adjustaci na komorbidity a ostatní klinické parametry dosáhl pokles mortality ve skupině s permisivní hypotenzí statistické významnosti (poměr šancí 0,82 (95% konfidenční interval 0,68–0,98). I zde bylo patrné nesignifikantní navýšení výskytu AKI (3,2 vs. 2,5 %) ve skupině s nižším cílem MAP, expozice vazopresorům byla signifikantně nižší. Je nutno podotknout, že reálné hodnoty MAP se v obou skupinách pohybovaly minimálně o 5 mmHg výše, než bylo plánované cílové rozmezí. Poslední článek, který se zabývá problematikou arteriálních tlaků, nepřináší nové poznatky z pacientských populací, ale přehledně upozorňuje na úskalí přímého měření arteriálního tlaku a podmínky, jež je nutno splnit, aby námi monitorované hodnoty byly relevantní [21]. Vedle problematiky cílových hodnot MAP se v minulém roce několik autorských skupin věnovalo i zkoumání jiných hemodynamických resuscitačních cílů. Rozsáhlá prospektivní observace Chena et al. [22] aktuální praxe ve 34 amerických centrech sledovala vliv libovolného fyziologického zhodnocení stavu pomocí rozšířené hemodynamické monitorace (vč. ECHO/USG) oproti „klasické“, empiricky vedené, iniciální (vstupních 24 hodin) péči o kriticky nemocné. Práce ukázala, že nejčastější metodou rozšířené monitorace je právě využívání ECHO/USG (79 %) a dominantně pro pacienty vyšší tíže onemocnění/hemodynamické nestability. Rozšířená monitorace nevedla k podávání většího množství tekutin, ale bylo pozorováno významné navýšení vazopresorické podpory. Obě skupiny pacientů měli totožnou délku hospitalizace i mortalitu, což (pokud vstupní tíže byla vyšší u skupiny s rozšířenou monitorací) je spíše nepřímým pozitivním zjištěním podporujícím postupy rozšířené monitorace.
Tekutiny
K problematice iniciálního podávání tekutin a vazopresorické podpoře byla publikována opět spíše řada menších prací, nebo metaanalýz než významná robustní data. Otázkou liberální a restriktivní terapie v iniciální fázi sepse se zabývala metaanalýza Meyhoffa et al. [23], bohužel získaná data z 9 randomizovaných prací (637 subjektů) neumožnila poskytnout statisticky validní výsledky. Trendová data spíše nasvědčovala pro výhodu nižšího množství podané resuscitační tekutiny. Na druhou stranu prospektivní observační data skupiny VOLUME‑CHASERS [24] poukazují na asociaci mezi dávkou vazopresoru v prvních 6 hodinách septického šoku (v ekvivalentech noradrenalinu) a 30denní mortalitou. Podané množství tekutin (0–3 000 ml) v příslušných skupinách se stejnou dávkou vazopresoru 30denní mortalitu naopak snižovalo. V kontextu objemové resuscitace stojí za zmínku ještě další publikace, které sledovaly objemový efekt 20% albuminu [25], hemodynamický efekt transfuzí [26] a perorálního podání tekutin [27]. V první zmíněné práci Hahn et al. [25] prokázali, že u zdravých dobrovolníků stejně jako u popálených pacientů ve fázi stabilizace (medián 7. den), vykazuje intravenózní podání 3 ml/kg 20% albuminu téměř dvojnásobný volum‑expanzní efekt, který přetrvává řadu hodin (medián u popálených 5,9 a zdravých dobrovolníků 6,9 hodin). Naopak, hemodynamický efekt podání transfuze, není podle metaanalytických dat z 31 prospektvních studií spojen s významným nárůstem srdečního výdeje (nárůstem hodnoty hemoglobinu samozřejmě dojde k signifikantnímu nárůstu dodávky kyslíku a saturace kyslíku v žilní krvi) [26]. Poměrně zajímavou informaci o efektu 500 ml enterálně vs. parenterálně podané tekutiny u osob v šoku přinesla francouzská Water study [27]. Vliv na centrální hemodynamiku (nárůst tepového objemu, srdečního výdeje i krevního tlaku) byl v obou skupinách porovnatelný. Bohužel data byla publikována pouze ve velmi limitované formě „research letter“ a chybí nám tedy celá řada dalších informací o zkoumané populaci atp. Získané výsledky jsou z tohoto pohledu spíše hypotézu‑generující.
Vazoaktivní látky
Co se týká vazoaktivních látek, nepřinesl poslední rok žádné významné informace, které by otřásly výsostnou pozicí noradrenalinu (NA) jako vazopresoru první volby. Naopak podle metaanalýzy Li et al. [28] je včasné nasazení NA u pacientů v septickém šoku spojeno s lepším přežíváním, časnějším dosažením predefinovaných hemodynamických cílů a nižší objemovou náloží. I zde je ale nutno pamatovat na data z americké prospektivní práce [24], v níž skupina s 15 μg/min NA a tekutinovou náloží 1 000 ml měla totožnou 30denní mortalitu (34 %) jako skupina s 25 μg/min NA a 2 000 ml. Z pohledu časné iniciace podávání NA jsou důležité výsledky retrospektivní analýzy amerického registru [29] a metaanalýzy 9 publikovaných prací [30]. Z těchto dat vyplývá, že aplikace NA do periferního řečiště je zatížena minimálním množstvím komplikací, které se dají dále minimalizovat při využití periferní kanyly minimálně 20-Gauge a časovém omezení periferního podávání NA na 24 hodin. Problematice „druhého/alternativního vazopresoru“ se věnovalo několik publikací. Pravděpodobně nejdůležitější jsou data z metaanalýzy Belleti et al. [31], která poukazují na ekvipotentní efekt adrenalinu u septických pacientů stran mortality, rozvoje renální dysfunkce a řady dalších klinicky relevantních parametrů. Je ovšem nutno podotknout, že naprostá většina z 12 zařazených randomizovaných studií je staršího data a pouze 4 je možno považovat za recentní s nízkou mírou bias. Obdobně, retrospektivní data z japonské databáze více než 5 000 septických pacientů z let 2010–2016 [32] poukazují na fakt, že kombinace NA + adrenalin a NA + vazopresin jsou ekvivalentní stran nemocniční mortality a potřeby náhrady funkce ledvin. U pacientů s předchozí kardiovaskulární komorbiditou byla ale kombinace NA + vasopresin spojena s menším rizikem úmrtí.
Deresuscitace kardiovaskulárních podpor
S kardiovaskulární problematikou se ovšem vedle iniciální resuscitace pojí i následná fáze stabilizace a případného odnímání (deresuscitace). Jak ukázala data z dotazníkové práce mezi britskými intenzivisty jsou deresuscitační postupy extrémně heterogenní [33]. Poměrně významná shoda byla zaznamenána v rámci indikace negativní bilance u pacientů se známkami zhoršení plicních funkcí a intersticiálního plicního otoku. Již menší (přesto významná) byla shoda v případě známek celkové pozitivní bilance, nárůstu hmotnosti a přítomnost otoků. Minimalizace podaných tekutin v rámci resuscitace (cca 45 % respondentů), vyloučení tzv. udržovacích infuzí a minimalizace ředění podávaných léků (cca 78 % respondentů) a aplikace diuretik v případě známek přetížení (cca 85 % respondentů) byly nejdůležitější postupy racionální tekutinové terapie. Ukončováním vazopresorické podpory se zabývala publikace Wu et al. [34], jakkoli identifikované práce pro tuto metaanalýzu tvořila spíše retrospektivní data. Výsledky nasvědčují, že dřívější přerušení NA s ponecháním vazopresinové podpory je spojeno s vyšší incidencí hypotenze, efekt na hospitalizační mortalitu ovšem nebyl pozorován. Obdobně, snaha o umožnění weaningu z NA pomocí midodrinu (u nás dostupný jako preparát Gutron) nepřineslo významný efekt v randomizované studii MIDAS [35].
Metabolická resuscitace
Posledním z velkých témat dotýkající se jak problematiky kardiovaskulárního systému, tak sepse je tzv. metabolická resuscitace propagovaná prof. Marikem. Na podkladě jeho retrospektivní a až zázračné práce uveřejněné v r. 2017 v CHEST [36] bylo zahájeno několik robustních studií, které si kladly za cíl ověřit efektivitu kombinace hydrokortison, vitamin C a thiamin (HAT) u pacientů v sepsi. Bohužel, všechny dosud publikované randomizované práce (ACTS [37], ORANGES [38], VITAMINS [39], HYVCTTSSS [40] a ViCTOR [41]) nepotvrdily výsledky původní retrospektivy a HAT terapie (nebo jen užívání vitaminu C a thiaminu – [42, 43]) zůstává poněkud obskurní praxí nepodloženou důkazy. Jak ale krásně ukázala práce [44] – používání HAT vzrostlo po uveřejnění Marikovy práce mnohonásobně, jakkoli výsledný efekt na zlepšení pacientských klinických cílů není možno sledovat. Příběh HAT se tak, zdá se, zařadí po boku jiných zázračných medicín, v něž jsme více doufali, než by bylo ve světě racionální medicíny záhodno. I naše recentní zkušenosti s léčbou v rámci pandemie COVID-19 jasně poukazují na to, že paradigma „méně je někdy více“ je hlavní mantrou medicíny, a že masivní nasazení léčby, která nemá podklad v důkazech, nás může zavést na scestí.
Neurointenzivní péče
Epilepsie a monitorace EEG
Pravděpodobně nejvýznamnější publikací v uplynulém roce je studie ESETT [45]. Jde o randomizovanou multicentrickou studii, srovnávající účinek tří antiepileptik u rozvinutého konvulzivního epileptického statu, nereagujícího na benzodiazepiny. V současné době je nejčastější volbou levetiracetam, nicméně studie porovnávající jeho efekt s ostatními farmaky, používanými v této indikaci (valproát, fenytoin), chyběla. V rámci práce bylo randomizováno 384 nemocných bez ohledu na věk a typ epilepsie, s vyloučením intubovaných pacientů, nemocných s čerstvým traumatem nebo hypoxickým postižením. Hlavní sledovaný cíl byl definován pouze klinicky a poměrně volně – vymizení křečí a zlepšení stavu vědomí jednu hodinu po podání. Všechna sledovaná antikonvulziva měla srovnatelný efekt – ke kontrole stavu došlo v cca 45 % případů. Počet pacientů přijatých do IP, stejně jako výskyt nežádoucích účinků, se mezi skupinami nelišil. V současné době jde o jedinou robustní práci srovnávající antiepileptika druhé volby, slabinou je velmi heterogenní populace, zejména zahrnutí dětí, neumožňující detailnější analýzu. Zajímavá je celkově nízká efektivita antiepileptik druhé volby, absence použití EEG ve studii a poměrně velká dávka levetiracetamu (60 mg/kg), která byla v práci použita. S ohledem na nežádoucí účinky fenytoinu a valproátu (byť jejich výskyt nebyl v práci signifikantně vyšší) se levetiracetam již stal v klinické praxi preferovaným léčivem v této indikaci. Jednou z nedořešených otázek v neurointenzivní péči je efektivita použití kontinuálního EEG. Prolongovaný záznam je spojen s vyšším zatížením ošetřovatelského personálu, klade vyšší časové nároky na popis a nese s sebou i vyšší riziko dekubitů pod elektrodami. Multicentrická studie Rosetti et al. [46] srovnávala vliv použití kontinuálního (délka záznamu 30–48 hodin) nebo intermitentního EEG (2 × 20 minut) na neurologický outcome pacientů. Indikací byla diferenciální diagnostika nonkonvulzivní poruchy vědomí v intenzivní péči. U 364 zařazených nemocných neměla zvolená modalita vliv na sledovaný primární cíl – mortalitu po šesti měsících. V případě použití kontinuálního EEG došlo k významně vyššímu záchytu epileptogenní aktivity, která vedla k úpravám terapie, nicméně bez vlivu na outcome. EEG se v posledních letech stalo běžně dostupnou metodou v prostředí intenzivní péče. Zásadním problémem většiny pracovišť zůstává nízká dostupnost neurologa s potřebnou erudicí. Přestože se nejedná o výzkum, stojí publikace Anderson et al. [47] za zmínku. Tento „primer“ s bohatou obrazovou přílohou popisuje základní EEG patologie, se kterými se může lékař v akutní péči setkat.
Poranění mozku
Podání kyseliny tranexamové (TXA) se po publikaci studie CRASH-2 [48] stalo rutinní součástí urgentní péče o pacienty s traumatickým krvácením. Role TXA u závažných poranění mozku ale dosud není plně objasněna. V loňském roce vydaná studie CRASH-3 [49] prokázala redukci mortality po podání TXA u lehčích kranicerebrálních poranění. V aktuálně publikované metaanalýze [50] autoři nacházejí vliv TXA na redukci objemu traumatického hematomu, vliv na mortalitu nebo výsledné neurologické postižení však prokázán nebyl. Metaanalýza potvrzuje minimální nežádoucí účinky TXA.
Přestože terapeutická hypotermie není součástí doporučení pro léčbu kraniocerebrálního poranění, je na řadě pracovišť používána jako záchranný postup u refrakterních vzestupů nitrolebního tlaku. Metaanalýza [51], zahrnující i nedávnou studii POLAR [52], nenalezla vliv hypotermie na snížení mortality v této indikaci, ale naopak její možné zvýšení. Možný benefit hypotermie byl prokázán u podskupiny nemocných, kde byla regulace teploty použita nikoli jako prevence, ale jako terapie zvýšeného nitrolebního tlaku, nebo v návaznosti na kraniektomii.
V souhrnu nejvýznamnějších publikací z minulého roku by neměla chybět dvě doporučení, týkající se péče o nemocné s poraněním mozku. Prvním jsou algoritmizovaná doporučení panelu expertů pro terapii těžkých kraniocerebrálních poranění u nemocných s měřeným nitrolebním tlakem [53]. Publikace poskytuje velmi přehledný přístup k terapii, byť s nižší úrovní kvality evidence než postupy Brain Trauma Foundation. Druhým jsou pak nová doporučení Neurocritical Care Society k léčbě edému mozku [54], zaměřená především na osmoterapii. Guidelines jasně preferují hypertonický chlorid sodný před mannitolem u většiny akutních postižení mozku, byť míra evidence zůstává velmi malá.
Predikce outcome a stanovení mozkové smrti
Jako podklad pro připravovanou aktualizaci doporučení ERC a ESICM k poresuscitační péči bylo sestaveno rozsáhlé systematické review Sandronim et al. [55]. Review shrnuje provedené studie metod umožňujících predikci špatného neurologického výstupu u nemocných po srdeční zástavě. Oproti předchozí publikované verzi zahrnuje větší počet prací věnovaných EEG, především nálezu časných patologických vzorců a reaktivitě pozadí. Větší prostor je také věnován biomarkerům, především neuron‑specifické enoláze a dynamice změn jejích hladin v prvních dnech po inzultu, a dále zobrazovacím metodám. Za pozornost dále stojí konsenzuální stanovisko vydané The World Brain Death Project [56]. V diagnostice, klinických a legislativních kritériích smrti mozku stále existují významné rozdíly mezi jednotlivými zeměmi. Zmíněná publikace si klade za cíl definovat na základě dostupné literatury a názoru expertů doporučení pro minimální rozsah klinických vyšetření, nutných ke stanovení mozkové smrti. Je jistě vhodné podotknout, že ačkoli je proces stanovení smrti mozku v České republice s těmito doporučeními kompatibilní, jednotlivé postupy jsou v publikaci velmi kvalitně popsány a diskutovány na podkladě aktuálních důkazů.
Problematika ledvin a očišťování krve
Diagnostika
Akutní poškození ledvin (AKI) zůstává nadále jednou z dominantních orgánových dysfunkcí v intenzivní péči. S různou tíží postihuje až 60 % pacientů na jednotkách intenzivní péče. Je asociováno s nepříznivou prognózou, rizikem trvalé renální dysfunkce, s dlouhodobou morbiditou a mortalitou. Snaha nalézt především ideální ukazatel trvalého poškození ledvin či potřeby náhrady funkce ledvin (RRT) naráží na nízkou senzitivitu a specificitu nejen klasických markerů typu urey, kreatininu, přítomnosti oligurie, ale i novějších biomarkerů měřených v plazmě i moči (NGAL, cystatin C, IL-18).
Přesto časná predikce rozvoje AKI stále představuje absolutní priority současného výzkumu. Cirkulující solubilní receptor pro plasminogen urokinázového typu (suPAR) je již několik let zkoumán jako biomarker inflamace a imunitní aktivace. Zvýšené plazmatické koncentrace suPAR predikují mortalitu nejen u kriticky nemocných a nemocných v sepsi, ale i u pacientů s nádory, jaterním či kardiovaskulárním onemocněním. Zdá se však, že suPAR není pouhý epifenomén odrážející imuno‑inflamatorní odpověď neutrofilů, monocytů a makrofágů. Cirkulující suPAR je schopen přímé aktivace β3-integrinu v podocytech ledvin. Důsledkem je podocytární dysfunkce, proteinurie a glomerulární jizvení. Popsaný mechanismus nicméně nevysvětluje jeho úlohu v patogenezi AKI, kde primárním viníkem je tubulární systém a peritubulární mikrovaskulatura. Souvislostmi mezi suPAR a AKI se detailně zabývala studie Hayeka et al. [57]. Autoři měřili plazmatické hladiny suPAR u tří skupin pacientů v riziku rozvoje AKI: 1) periprocedurálně u nemocných podstupujících koronární angiografii (n = 3 827 pacientů), 2) u pacientů po kardiochirurgické operaci (n = 250) a 3) u kriticky nemocných v době jejich přijetí na jednotku intenzivní péče (n = 692). Primárním cílem bylo riziko rozvoje AKI v prvních 7 dnech, sekundárním cílem byla mortalita a AKD v 90 dnech. Riziko rozvoje AKI narůstalo v těsné korelaci s nárůstem hladin suPAR ve všech třech kohortách pacientů: neadjustované riziko vzniku AKI bylo 3,8násobně vyšší u hladin suPAR v nejvyšším kvartilu hodnot. Toto riziko přetrvávalo i po adjustaci na řadu významných kovariet (adjustované odds ratio 2,66, 95% CI 1,77–3,99). Incidence AKI u pacientů s nejvyšším kvartilem hodnot suPAR byla ve srovnání s nejnižším kvartilem v jednotlivých skupinách následující: po koronarografii 14 % vs. 4 %, po kardiochirurgickém výkonu 40 % vs. 16 %, u kriticky nemocných 53 % vs. 15 %. Významným počinem autorů je i mechanistický vhled do úlohy suPAR v patogenezi AKI. V myším experimentu s endogenní overexpresí suPAR nebo exogenní aplikací suPAR prokázali autoři výraznější poškození ledvin po podání kontrastní látky. Společným mechanismem bylo zvýšení energetických nároků a mitochondriální tvorba superoxidu. Neutralizace suPAR podáním monoklonální protilátky zmírnila funkční a histologické projevy AKI. Studie tak prokázala schopnost suPAR predikovat rozvoj AKI nezávisle na řadě klinických proměnných (včetně výchozí funkce ledvin), a to napříč skupinami s nízkým i vysokým rizikem rozvoje AKI. V tomto poznání se komentovaná práce výrazně liší od většiny recentně studovaných biomarkerů, jejichž hladiny se zvyšují až po renálním inzultu a nemají proto prediktivní význam. Zejména zpřesnění predikce peri‑procedurálního rozvoje AKI (operační trauma, kontrastní látky apod.) a rozpoznání vysoce rizikových pacientů může otevřít cestu k nalezení a uplatnění intervencí směřujících k minimalizaci procedurálních forem AKI. Nicméně, jak zmiňuje Tacke ve výborném doprovodném editorialu, interpretace zvýšených hladin suPAR nebude v klinické praxi vůbec jednoduchá [58]. Absolutní hladiny suPAR definující pacienty s nejvyšším rizikem AKI se ve studii významně lišily mezi jednotlivými kohortami nemocných. Hodnocení dílčích hodnot bez klinického kontextu tak zcela jistě nebude možné, podobně jako u jakéhokoliv jiného biomarkeru. Navíc významná asociace mezi suPAR hladinami a orgánovým poškozením se netýká pouze ledvin. Podobné vztahy byly popsány např. u jaterního selhání či u řady inflamatorních stavů (infekce, nádory, kardiovaskulární nemoci, diabetes). Hladiny suPAR tak nebude možné u pacientů s řadou přidružených akutních i chronických chorob vnímat jako specifické pro poškození ledvin. Cenné může být také poznání patogenetické úlohy suPAR v rozvoji AKI (a možná nejen AKI). Experimentální část studie naznačuje, že suPAR není pouhým biomarkerem, ale i přímou součástí patogeneze akutního orgánového poškození, kdy ovlivněním buněčné bioenergetiky a oxidačním stresem zvyšuje náchylnost tubulárního systému k dalšímu poškození. Odstranění suPAR z cirkulace či neutralizace jeho biologického účinku mohou představovat plauzibilní terapeutické cíle a současně podněty pro další translační výzkum.
Kromě biochemických ukazatelů AKI se pozornost intenzivistů obrací k jiným možnostem, jak stratifikovat nepříznivou trajektorii AKI kriticky nemocného. Ultrazvuk je již nedílnou součástí „armamentaria“ intenzivisty, a přestože předchozí studie zatím nepřinesly příliš povzbudivé výsledky [59], objevila se v letošním roce další práce zkoumající význam a přínos dopplerometrického měření rezistivního indexu (RI) ledvin u neselektovaných „medical‑ICU“ pacientů [60]. Tato relativně malá studie francouzských autorů hodnotila na 100 pacientech prediktivní přínos ultrazvukových metod společně s hodnocením dalšího ze série nových tubulárních biomarkerů součinu močového tkáňového inhibitoru metaloproteinázy-2 (TIMP2) a vazebného proteinu pro inzulinu podobný růstový faktor 7 (IGFBP7) v hodnocení rizika přechodu AKI do perzistující renální dysfunkce. Přítomnost a tíže AKI byly definovány dle jednotlivých KDIGO kritérií založených na hodnotách sérového kreatininu (sCr) a močového výdeje. Přechodné/tranzientní AKI bylo definováno dle stejných kritérií jako pokles sCr, zlepšení močového výdeje bez diuretické terapie či potřeba náhrady funkce ledvin (RRT) za 72 hodin od zařazení do studie. Vylučovacími kritérii byly věk < 18 let, přítomnost terminální fáze renálního selhání (ESRD), těhotenství, anurie, přítomnost ledvinného transplantátu, obstrukce vylučovacího systému ledvin, závažná srdeční arytmie, jaterní cirhóza. Více jak 50 % pacientů představovali pacienti se septickým šokem. Močové vzorky na přítomnost markerů tubulárního poškození (TIMP2xIGFBP7) byly analyzovány v čase 0 a dále za 6, 12, 24 hodin a následně denně do dimise pacienta z jednotky intenzivní péče. Hodnoty RI byly získány dvěma nezávislými sonografisty 12 hodin po přijetí pacienta a následně po hemodynamické stabilizaci. V predikci trvalé renální dysfunkce oba močové biomarkery selhaly s plochou pod křivkou ROC 0,57 (95% CI, 0,45–0,68), 0,58 (95% CI, 0,47–0,69), 0,61 (95% CI, 0,50–0,72), 0,57 (95% CI, 0,46–0,68) v čase 0, 6, 12 a 24 hodin. Plocha pod křivkou ROC renálního rezistivního indexu byla 0,93 (95% CI, 0,89–0,98). Renální RI vyšší nebo rovný 0,685 předpovídal perzistující ledvinné poškození s 78% (95% CI, 64–88 %) senzitivitou a s 90% (95% CI, 78–97 %) specificitou. Přestože tato data nejsou nikterak robustní a s přihlédnutím k předchozím studiím nelze zatím vyvodit jednoznačný závěr, lze se minimálně v dalších studiích zaměřit na potencionálně slibný přínos jiných než biochemických parametrů predikujících reverzibilitu akutního poškození ledvin.
Načasování přístrojové náhrady funkce ledvin
Zatímco rozhodnutí zahájit náhradu funkce ledvin (RRT) u pacienta s urgentní indikací charakteru život ohrožující hyperkalémie, anurie s převodněním, urémie, nebo při otravě dialyzovatelným toxinem nečiní intenzivistům obvykle problém, rozhodování u pacienta bez těchto kritérií, typicky u pacienta s AKI, které je součástí syndromu multiorgánové dysfunkce, je mnohem těžší, komplexnější a často striktně individuální. Roli při rozhodování o zahájení mimotělní metody hraje na jedné straně potencionální přínos v podobě časnější kontroly homeostázy, volémie, možná i inflamatorní odpovědi a na straně druhé nezanedbatelná rizika spojená se zajištěním cévního přístupu, plynoucí z bio‑inkompatibility dané metody, z rizik spojených s antikoagulací, ze ztráty vitaminů, aminokyselin a nečitelného ovlivnění farmakokinetiky léčiv (především antibiotik). Nelze také opominout zvyklosti a zkušenosti daného pracoviště či stránku ekonomickou. Recentně publikované práce analyzující mortalitní dopad časného versus pozdního napojení (ELAIN [61], AKIKI [62], ICU‑IDEAL [63]) skončily heterogenními a protichůdnými závěry a nešlo tak z nich vyvodit žádná specifická doporučení. V tomto roce publikována studie STARRT‑AKI [64] tak byla s napětím očekávána. Tato studie analyzovala 3 019 pacientů z jednotek intenzivní péče z 15 zemí světa mezi lety 2015–2019. Pacienti museli splňovat kritéria těžkého AKI (alespoň jedna ze tří podmínek: dvojnásobné zvýšení sCr oproti výchozí hodnotě, sCr > 354 μmol/l, močový výdej < 6 ml/kg po dobu 12 hodin). Ze studie byli vyřazeni pacienti splňující v době zařazení urgentní indikační kritéria pro zahájení RRT. Stejně tak nebyli analyzováni pacienti se specifickými příčinami AKI (např. rychleprogredující glomerulonefritis, trombotická trombocytopenická purpura/hemolyticko‑uremický syndrom) a pacienti s pokročilým chronickým onemocněním ledvin. Napojení do 12 hodin od zařazení do studie bylo definováno jako časné a bylo srovnáváno s napojením pozdním/odloženým, které bylo zahájeno teprve při perzistujícím AKI s nárůstem kreatininu o > 50 % nad hodnotu v čase randomizace nebo pokud pacient naplnil absolutní urgentní kritéria k zahájení RRT. V gesci ošetřujících lékařů byla ponechána volba modality (CRRT 68 vs. 70 %, IHD 27 vs. 25 %, SLEDD 5 vs. 4 %). Zatímco v časném rameni napojení dospělo k RRT 97 %, v rameni odložené RRT tomu bylo jen u 62 % pacientů. Primárním outcomem byla 90denní mortalita, která se mezi oběma skupinami nelišila (44 %). Pacienti randomizovaní do větve časného napojení měli signifikantně vyšší pravděpodobnost dependence na RRT 90. den (10 vs. 6 %) a častější potřeby rehospitalizace (21 vs. 7 %). Stejně tak frekvence hypofosfatémie a hypotenze byla v této skupině vyšší. Všechny sekundární cíle studie (mortalita na JIP, mortalita v nemocnici a ostatní předdefinované cíle) se mezi sebou nelišily. Jak tedy výsledky s přihlédnutím k předchozím studiím interpretovat? Všechny multicentrické studie shodně ukazují, že časné zahájení RRT (jakkoliv problematicky je otázka načasování definovatelná) nepřináší pacientům větší naději na přežití a shodně také dokládají, že časná intervence vede ke zbytečnému napojení nemalého počtu pacientů na mimotělní metodu. STARRT‑AKI [64] navíc vysílá silný signál, že časné a zřejmě i každé zbytečné napojení pacienta na RRT může negativně ovlivnit reparaci renálních funkcí. STARRT‑AKI také podporuje závěry studie IDEAL ‑ ICU [63], a sice že ani samotná populace AKI pacientů v sepsi či septickém šoku nemá z časné indikace RRT žádný prospěch. Velmi důrazně tak zpochybňuje, resp. vyvrací stále živé teoretické naděje, že kromě klasických účinků (kontrola volémie, acidobáze, elektrolytů, očištění od uremických toxinů) může RRT příznivě ovlivnit osud pacientů svými „non‑klasickými“ účinky (očištění od toxických mediátorů – prozánětlivých cytokinů a damage associated molecular paterns – DAMPS). Je potřeba konečně přijmout skutečnost, že stávající konvenční metody náhrady funkce ledvin nemají enigmatické pluripotentní účinky, tj. schopnost zasáhnout příznivě do složité patofyziologie kritických stavů.
Metody náhrady funkce ledvin mají v péči o kriticky nemocné zcela jistě své nezastupitelné místo. Díky studiím STARRT‑AKI [64], AKIKI [61] a IDEAL‑ICU [63] se nicméně pozvolna řadí po bok jiným intervencím z prostředí intenzivní péče, u kterých zdrženlivější konzervativní přístup (strategie „watchful waiting“ či dokonce „less is more“) vedl k lepším léčebným výsledkům či přinejmenším non‑inferioritě. Ukazuje se také, že jsme si diskuzí nad časným verzus odloženým načasováním RRT zřejmě kladli špatnou otázku. Ptejme se nyní při úvahách o indikaci k napojení pacienta na některou z metod RRT „proč“, nikoliv „kdy“. RRT jsou a zřejmě na dlouho ještě zůstanou pouze částečnou náhradou funkce ledvin, bez jiných „enigmatických“ účinků.
Plazmaferéza a další metody mimotělního očišťování krve
Mimotělní metody sehrávají roli také v léčbě pacientů s některými nepříliš častými diagnózami, např. ANCA‑asociovanými vaskulitidami. Přestože základním pilířem léčby je imunosupresivní terapie, léčebná výměna plazmy, plazmaferéza (PEX), byla dlouhodobě součástí iniciální terapie u pacientů s těžkým průběhem. Její význam stran ovlivnění mortality či ovlivnění terminálního poškození ledvin měla osvětlit tento rok publikovaná studie PEXIVAS [65]. Studie byla navržená faktoriálním způsobem 2 × 2, kdy se testovala léčba s a bez plazmaferézy a vysoké a nízké dávky glukokortikoidů. Do studie byli zařazeni pacienti s nově zjištěnou mikroskopickou polyangiitidou či granulomatózou, dále pacienti s relapsem a pozitivním testem na protilátky proti myeloperoxidáze nebo peroxidáze 3. Přítomno muselo být současně poškození ledvin s glomerulární filtrací < 50 ml/min/1,73 m2 nebo difuzní alveolární hemoragie. Pro stanovení diagnózy nebyla podmínkou renální biopsie. Po randomizaci byli pacienti rozřazeni do čtyř větví: s plazmaferézou a standardní dávkou glukokortikoidů, s plazmaferézou a redukovanou dávkou glukokortikoidů, bez plazmaferézy se standardní dávkou glukokortikoidů a bez plazmaferézy s redukovanou dávkou glukokortikoidů. V úvodu byli pacienti rozléčeni cyklofosfamidem či rituximabem a následně bylo zahájeno intravenózní podávání metylprednisolonu v dávce 1–3 g. V prvním týdnu byly všechny skupiny léčeny stejnou dávkou prednisonu či prednisolonu, následně se ve skupině se standardní dávkou snižovala od třetího týdne. V rameni s redukovanou dávkou se od druhého týdne dávka kortikoidu snižovala o 50 % oproti standardnímu rameni. V ramenech s plazmaferézou byla současně zahájena výměna plazmy v dávce 60 ml albuminu/kg s tím, že u pacientů s vysokým rizikem krvácení bylo připuštěno použití plazmy místo albuminu. Následovalo sedm procedur v průběhu 14 dní, a pak byla plazmaferéza ukončena. Primárním sledovaným výsledným ukazatelem byla přítomnost terminálního selhání ledvin (ESRD) či úmrtí z jakékoli příčiny. Celkem bylo do studie zařazeno 704 pacientů. Medián sledování byl 2,9 let. V intention‑to‑treat analýze se neprokázal přínos plazmaferézy oproti skupině bez výměny plazmy. K úmrtí či rozvoji ESRD došlo u 28,4 % pacientů léčených plazmaferézou oproti 31 % pacientům bez plazmaferézy (odds ratio 0,86; 95% CI, 0,65–1,13). Nebyl prokázán rozdíl v jakýchkoli sekundárních cílech. Současně nebyla prokázána non‑inferiorita redukované dávky kortikoidu. Přestože takto prezentovaná data svádějí k odmítnutí plazmaferézy jako léčebné modality pacientů s ANCA‑vaskulitidami, hodnocení studie není zcela jednoznačné. Pouze 27 % pacientů zařazených do studie mělo přítomné krvácení do plic. U nich byl pozorován trend k lepším výsledkům při použití plazmaferézy, ale vzhledem k malým počtům a širokým intervalům spolehlivosti nedosáhly signifikantní významnosti. Současně většina z nich neměla přítomné renální selhání vyžadující náhradu funkce ledvin. Otázka tedy je, zda populace s nejtěžším průběhem ANCA‑asociovaných vaskulitid nemůže mít z výměny plazmy prospěch a na tuto otázku budou muset odpovědět studie budoucí. Většina autorit se však za současného stavu poznání přiklání k indikaci PEX u život ohrožujících forem difuzní alveolární hemoragie spojené s ANCA asociovanými vaskulitidami. Podobně plazmaferéza zůstává metodou volby u pulmorenálních syndromů způsobených anti‑GBM protilátkami (Goodpasture syndrom).
Antikoagulace a RRT
O tom, že citrátová antikoagulace zůstává nadále preferenční volbou u pacientů indikovaných k přístrojové náhradě ledvinných funkcí, máme dostatek důkazů z předchozích studií. V tomto roce v JAMA publikovaná studie německých autorů pouze potvrdila, že oproti systémové antikoagulaci nefrakcionovaným heparinem má antikoagulace citrátem jasnou výhodu stran délky přežití hemofiltru, neměla však v této studii dopad na mortalitu [66]. Zajímavým sekundárním zjištěním však byla vyšší incidence zjištěných infekcí u pacientů na citrátu. Tento efekt bude zasluhovat dále pozornost.
COVID-19 a ledviny
V souvislosti s rokem 2020 nelze nezmínit pandemii viru SARS‑CoV - 2 a onemocnění COVID-19, které zaměstnaly intenzivisty po celém světě. Již od úvodu globální pandemie se začaly ve vědecké literatuře objevovat zprávy udávající prevalenci AKI u populace COVID-19 nemocných pacientů až 43 %. Vysoký rozptyl epidemiologických dat byl dán heterogenitou ve sledovaných populacích, různou definicí AKI, rozdílnou tíží stonání. Možné mechanismy vedoucí k AKI u pacientů s tímto onemocněním nejsou zcela jasné. Data včetně některých post‑mortem analýz ledvinné tkáně nevylučují přímé virové poškození ledvin, ale ve hře jsou i faktory nepřímé, jako tendence k hyperkoagulaci, inflamací mediovaná systémová zánětlivá odpověď či hemodynamická nestabilita. Nejvyšší mortalita byla pozorována u pacientů s AKI v terénu transplantovaných ledvin, kdy v některých pracích dosahovala až 44 % [67]. Úroveň aktuálního poznání také zatím limituje dostupná konsenzuální terapeutická doporučení vydaná expertním panelem ADQI (Acute Disease Quality Initiative), která se v obecné rovině neodlišují od jiné populace kriticky nemocných [68]. Z pohledu sklonu k hyperkoagulačnímu stavu COVID-19 pacientů je vhodné snížit riziko srážení okruhu CRRT limitací filtrační frakce tím, že jako preferovanou modalitu zvolíme veno‑venózní hemodialýzu.
Jelikož velmi malá podskupina COVID-19 nemocných se prezentuje hyperinflamatorním stavem s „cytokinovou bouří“, okamžitě se objevily kazuistické zprávy o použití rozličných hemoadsorpčních metod použitých k eliminaci prozánětlivých cytokinů a tím k modulaci zánětlivé odpovědi organismu. Přínos těchto metod byl u fenotypicky podobných pacientů, např. septických pacientů, opakovaně ve velkých studiích vyvrácen, a zatímco přínos těchto metod zůstává nadále především v čistě teoretické rovině, možný nežádoucí dopad neindikovaně předčasně zahájených mimotělních metod je prokazován opakovaně [69]. Naposledy ve výše uvedené STARRT‑AKI studii. Racionální pohled na význam hemoadsorpčních mimotělních očišťovacích metod v léčbě kriticky nemocných přinesl v letošním roce také článek Horáka et al., publikovaný v tomto časopise [70].
Problematika sepse
Téměř pět let již uplynulo od publikace dosud poslední definice sepse označované jako SEPSIS-3 [71] formulované na základě v té době recentních poznatků patofyziologických mechanismů syndromu, který stále zůstává nejčastější příčinou úmrtí na nekoronárních jednotkách intenzivní péče. Vytvořený koncept sepse, tedy život ohrožující orgánové dysfunkce rozvíjející se na podkladě neregulované odpovědi hostitelského organismu vymezený kritérii přítomné infekce a de novo rozvinuté či akutně progredující poruchy funkce jednoho či více orgánů, se postupně implementoval do klinické praxe řady medicínských oborů, kterých se tato problematika týká. Jednoduchý třístupňový proces rozpoznání infekce, zhodnocení a klasifikace stupně orgánové dysfunkce s následnou iniciací léčby je nezpochybnitelnou výhodou tohoto konceptu. Současná definice však naráží na značně heterogenní průběh onemocnění, jehož podkladem je významná interindividuální variabilita genetické (a epigenetické) dispozice a imunitně‑zánětlivé a metabolické odpovědi na přítomnost infekčního agens. Nikoliv první myšlenkou, nicméně unikátní rozsahem, byla recentně publikovaná analýza databází se selekcí více než 20 tisíc septických pacientů, jejímž cílem byla fenotypizace nemocných na základě snadno dostupných kritérií s následným vytvořením clusterů s podobným klinickým obrazem a prognózou [72]. I přesto, že obdobná klasifikace je zatím hudbou budoucnosti, jedná se o první krok k individualizaci léčby a prognostikace septických pacientů.
Právě značně heterogenní průběh sepse vede k tomu, že stále existuje populace pacientů, která, navzdory užití doporučených kritérií (qSOFA/SOFA) stále uniká časné diagnóze [73]. SEPSIS-3 doporučená kritéria, určená zejména pro rychlou diagnostiku a triáž septických pacientů (qSOFA), byla opakovaně recentně evaluována v kontextu klinické praxe. Z analýzy četných studií vyplývá relativně nižší senzitivita (variabilně) okolo 50 % (při qSOFA ≥ 2), ale vysoká specificita (variabilně) přes 85 % (při qSOFA ≥ 2) [74]. Dle některých retrospektivních analýz vykazují tato kritéria dokonce nižší diagnostickou schopnost než původně užívaná kritéria SIRS; predikce nemocniční mortality je však významně přesnější [75]. Nezbytnost náležitého klinického vyšetření nemocného proto zůstává nadále nepodkročitelnou součástí diagnostiky. Přítomnost známek periferní hypoperfuze – mramoráž kůže, zpomalený kapilární návrat a teplotní gradient prsty‑předloktí významně souvisí s mortalitou a nepříznivým průběhem sepse/septického šoku [74] a je významným diagnostickým nástrojem.
Kapilární návrat (CRT; čas potřebný k návratu krve do nehtového lůžka po jeho 5vteřinové kompresi), respektive jeho normalizace, se díky studii ANDROMEDA‑SHOCK [76], která srovnávala vliv dosažení cílů (normalizace CRT verzus pokles laktatémie) na průběh stonání a mortalitu pacientů v septickém šoku, stala zajímavým terapeutickým cílem, a to především díky neinvazivnímu a snadno reprodukovatelnému způsobu provedení u lůžka nemocných. Post‑hoc analýza této studie prokázala vyšší mortalitu pacientů, kteří měli vstupně normální hodnoty CRT, ale byli zařazení do větve s cílem normalizace laktatémie a k dosažení tohoto cíle vyžadovali více terapeutických snah (zejména tekutinové resuscitace) [77].
Navzdory nezpochybnitelnému pokroku na poli klinického a preklinického výzkumu nadále neexistuje cílená léčba sepse. Ta se nadále opírá o časně zahájenou antimikrobiální léčbu, resuscitaci oběhu a podporu orgánových funkcí. Neselektivní zásah do excesivní inflamatorní odpovědi v podobě adsorbčních systémů má své stoupence i oponenty, nicméně jeho užití není v současné době podloženo dostatečně robustní evidencí [70]. Také nadšení, které vypuklo v úvodu zavedení intravenózní aplikace kombinace megadávek kyseliny askorbové, thiaminu a hydrokortizonu, na základě negativních výsledků řady studií [37–41, 43], jak již bylo zmíněno, pozvolna uvadá.
Problematika onkologických pacientů v IP
V posledních několika letech jsme svědky skutečně významných pokroků v diagnostice a léčbě maligních onemocnění. Nové poznatky v nádorové biologii vedou ke klinickému použití nových molekul jako biomarkerů nemoci i jako terapeutických cílů. Mluvíme o (personalizované) imunoterapii maligních onemocnění: monoklonální protilátky, check‑point inhibitory, buněčná terapie, imunogenetická terapie (protinádorová vakcinace) a jejich případné kombinace. V důsledku je aktivně léčeno mnohem více nemocných, více nemocných pokročilého věku a polymorbidních a léčba je v mnoha případech agresivnější. Dochází ke zlepšení krátkodobé, ale i dlouhodobé mortality nádorových onemocnění [78–80], ale současně i k větší incidenci závažných komplikací samotných maligních chorob a zejména jejich léčby. Počet onkologických nemocných v intenzivní péči narůstá a tento trend bude jistě pokračovat i v budoucnu. Racionálně a individualizovaně interdisciplinárně rozvážené včasné přijetí onkologických nemocných do IP by mělo být v současně době již standardem [81, 82].
Život ohrožující komplikace protinádorové imunoterapie
Klasická protinádorová léčba (chemoterapie a imunosupresivní léčba) je spojena s imunokompromitací a infekčními komplikacemi. Naopak, moderní imunomodulační terapie vede k významné selektivní aktivaci imunokompetentních elementů. Důsledky a vážnými komplikacemi mohou tedy být hyperinflamatorní reakce či autoimunitní onemocnění (immune‑related adverse events – IRAE) [83]. Jejich incidence je značně variabilní (např. cytokin‑release syndrom – CRS při CAR‑TC 15–30 % [84]; IRAE při check‑point inhibitorech 70–85 % [83]) a celá řada z nich může mít rychlý a život ohrožující průběh. Významná část klinických projevů těchto nežádoucích reakcí věrně imituje septický šok a variabilní orgánové postižení (CRS při BAB a CAR‑TC) či jiná orgánově specifická onemocnění (CAR‑TC, check‑point inhibitory) (tab. 1). Pro úspěšnou léčbu je nezbytné na tyto specifické nežádoucí účinky léčby maligních onemocnění včas pomýšlet. Adekvátní, včasná, resp. správně načasovaná léčba a mezioborová spolupráce zvyšují nejen šanci na vyřešení akutní (příp. život ohrožující) komplikace, ale i na úspěšnou dlouhodobou léčbu malignity [83–86].
Table 1. Vybraná imunomodulační léčba malignit, její toxicita, komplikace a léčba 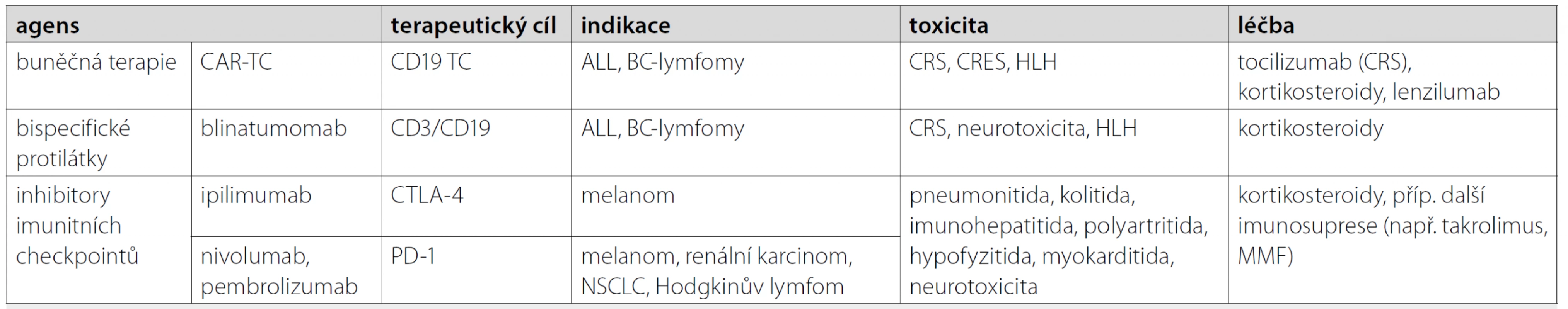
CAR-TC – T-lymfocyty s chimérickým antigenním receptorem; ALL – akutní lymfoblastická leukemie; BC-lymfomy – B-buněčné lymfomy; CRS – cytokin release syndrom; CRES – CAR-TC-related encephalopathy syndrome (neurotoxicita); HLH – hemofagocytární lymfohistiocytóza; CTLA-4 – cytotoxic T-lymphocyte-associated protein 4; PD-1 – programmed death receptor 1; NSCLC – nemalobuněčný karcinom plic; MMF – mykofenolát mofetil Akutní respirační selhání u onkologických nemocných
Akutnímu respiračnímu selhání (ARF) čelí až 50 % hemato‑onkologických nemocných (nejčastěji nemocní s akutní myeloidní leukemií a po transplantaci kmenových buněk krvetvorby/kostní dřeně) a až 15 % nemocných se solidními nádory (nejčastěji karcinomy plic) [87]. ARF je současně nejčastějším důvodem jejich přijetí do IP [87] a je asociováno se stále vysokou mortalitou 40–60 % [88]. Obecné diagnostické a terapeutické postupy se příliš neliší od běžně užívaných. Nicméně včasná identifikace příčiny ARF je zde zcela zásadní pro adekvátní strategii léčby a její úspěšnost. Napříč množstvím studií je ARF nejasné etiologie v populaci onkologických kriticky nemocných jasně asociována se signifikantně vyšší mortalitou [89, 90].
Použití diagnostické bronchoskopie (BSK) ve snaze o identifikaci příčiny ARF je u této skupiny nemocných stále kontroverzní. I přes potenciální významný přínos v identifikaci příčiny ARF vedoucí ke změně léčebné strategie (např. difuzní alveolární hemoragie, identifikace kauzálního patogenu atd.) může být její použití spojeno s významnými komplikacemi a vyšší mortalitou, jak ukazuje velká multicentrická observační studie 1 611 imunokompromitovaných nemocných s ARF [91]. Tento prostý závěr by však mohl být zavádějící a vést k odklonu od BSK v této indikaci. Je tedy potřeba upozornit, že použití BSK v této studii nebylo randomizováno a nemocní, kteří podstoupili BSK diagnostiku, měli vyšší riziko rozvoje závažné infekce a nepříznivého průběhu díky nediagnostikované příčině ARF, což zřejmě hrálo podstatnou roli v indikaci BSK. Zavádějící může být rovněž variabilní načasování BSK v průběhu stonání, což nebylo v uvedené studii zohledněno. Část nemocných byla bronchoskopována v pozdějším průběhu ARF, zřejmě z důvodu nelepšícího se stavu, progrese ARF. Závěrem lze konstatovat, že BSK může být silným diagnostickým nástrojem v identifikaci etiologie ARF zejména iniciálně při přijetí onkologických nemocných s ARF do IP a v situaci, kdy lze zajistit adekvátní oxygenaci během vlastního výkonu (BSK na NIV či UPV). Zkušenost ve zhodnocení benefitu a rizik, v načasování, vlastním provedení a také interpretaci výsledů (mikrobiologie, flowcytometrie atd.) je nezbytná.
Dalším klíčovým bodem správné strategie léčby onkologických nemocných s ARF je zajištění včasné a adekvátní oxygenace, současně se snížením dechové frekvence, resp. dechové práce, úlevou od dušnosti a stresu a zlepšením komfortu nemocného. Na základě recentních (a stále rozporuplných) dat nelze s jistotou uvést, zda je k dosažení uvedených cílů (pokud není rovnou indikovaná UPV), vhodnější iniciálně použít NIV či HFNC [92]. Ani jedna z uvedených modalit nevykazuje superioritu (ve srovnání se standardní oxygenoterapií) a jejich případné selhání a následná potřeba invazivní ventilace se nezdají přímo asociované s maligním onemocněním či imunosupresí [92, 93]. Naopak, zdá se, že daleko důležitější a racionálnější je včasná identifikace nemocných s významným rizikem selhání neinvazivních forem oxygenoterapie (na základě klinických charakteristik/rizik a radiologických nálezů) a včasné zahájení UPV [94]. Snaha vyhnout se UPV tak není správnou strategií, přestože mortalita onkologických či imunosuprimovaných nemocných na UPV je stále vysoká. Odlišit, zda se jedná o efekt přímo asociovaný s vlastní UPV (jako terapeutickým, resp. podpůrným prostředkem) nebo obecně s mnohem větší tíží stavu nemocných na UPV, není jednoduché. Mechanika UPV může také přinést další prognostické informace [95].
Závěr
Jak ukázal náš průřez zajímavými publikacemi roku 2020, vzdor tomu, že naprostá většina zdrojů intenzivní medicíny se upínala k péči o osoby s onemocněním COVID-19, dočkali jsme se výsledků řady důležitých studií v celé šíři našeho oboru. Z tohoto pohledu bude jistě zajímavé, jaké spektrum nabídnou renomované časopisy v následujícím roce; útlum vědecko‑výzkumné aktivity, který s sebou zákonitě přinesla pandemie COVID-19 se totiž spíše projeví až nyní, nebo v příštích letech. Důležité ovšem je, že vzdor lákadlům líbivých a nadějných „rychlých“ terapií udržuje lékařská komunita racionální přístup medicíny založené na důkazech, zkušenostech a fyziologických principech.
PROHLÁŠENÍ AUTORŮ: Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média. Střet zájmů: Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce. Podíl autorů: Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína. Financování: 1. Program rozvoje vědních oborů Univerzity Karlovy (Progres – projekt Q39). 2. Projekt CZ.02.1 .01/0.0/0.0/16_019/0000787, Centrum výzkumu infekčních onemocnění, udělený MŠMT ČR, financovaný z EFRR.
KORESPONDENČNÍ ADRESA AUTORA:
Článek přijat redakcí: 20. 11. 2020; Článek přijat k tisku: 24. 11. 2020
doc. MUDr. Jan Beneš, Ph.D.
Cit. zkr: Anest intenziv Med. 2020; 31(6): 265–276
Sources
1. Reisner‑Sénélar L. The birth of intensive care medicine: Björn Ibsen’s records. Intensive Care Medicine 2011; 37.
2. Young PJ, Bagshaw SM, Forbes AB, Nichol AD, Wright SE, Bailey M, et al. Effect of Stress Ulcer Prophylaxis with Proton Pump Inhibitors vs. Histamine-2 Receptor Blockers on In‑Hospital Mortality among ICU Patients Receiving Invasive Mechanical Ventilation: The PEPTIC Randomized Clinical Trial. JAMA – Journal of the American Medical Association 2020; 323.
3. Krag M, Marker S, Perner A, Wetterslev J, Wise MP, Schefold JC, et al. Pantoprazole in Patients at Risk for Gastrointestinal Bleeding in the ICU. New England Journal of Medicine 2018; 379.
4. Chu DK, Kim LHY, Young PJ, Zamiri N, Almenawer SA, Jaeschke R, et al. Mortality and morbidity in acutely ill adults treated with liberal versus conservative oxygen therapy (IOTA): a systematic review and meta‑analysis. The Lancet 2018; 391.
5. Conservative Oxygen Therapy during Mechanical Ventilation in the ICU. New England Journal of Medicine 2020; 382 : 989–998. doi: 10.1056/NEJMoa1903297.
6. Barrot L, Asfar P, Mauny F, Winiszewski H, Montini F, Badie J, et al. Liberal or Conservative Oxygen Therapy for Acute Respiratory Distress Syndrome. New England Journal of Medicine 2020; 382.
7. Madotto F, Rezoagli E, Pham T, Schmidt M, McNicholas B, Protti A, et al. Hyperoxemia and excess oxygen use in early acute respiratory distress syndrome: Insights from the LUNG SAFE study. Critical Care 2020; 24.
8. Ahmad I, El‑Boghdadly K, Bhagrath R, Hodzovic I, McNarry AF, Mir F, et al. Difficult Airway Society guidelines for awake tracheal intubation (ATI) in adults. Anaesthesia 2020; 75.
9. Ricard JD, Roca O, Lemiale V, Corley A, Braunlich J, Jones P, et al. Use of nasal high flow oxygen during acute respiratory failure. Intensive Care Medicine 2020.
10. Early Neuromuscular Blockade in the Acute Respiratory Distress Syndrome. New England Journal of Medicine 2019; 381.
11. Chang W, Sun Q, Peng F, Xie J, Qiu H, Yang Y. Validation of neuromuscular blocking agent use in acute respiratory distress syndrome: A meta‑analysis of randomized trials. Critical Care 2020; 24.
12. François B, Cariou A, Clere‑Jehl R, Dequin P‑F, Renon‑Carron F, Daix T, et al. Prevention of Early Ventilator‑Associated Pneumonia after Cardiac Arrest. New England Journal of Medicine 2019; 381.
13. Ferrando C, Mellado‑Artigas R, Gea A, Arruti E, Aldecoa C, Adalia R, et al. Awake prone positioning does not reduce the risk of intubation in COVID-19 treated with high‑flow nasal oxygen therapy: A multicenter, adjusted cohort study. Critical Care 2020; 24.
14. Tavernier E, McNicholas B, Pavlov I, Roca O, Perez Y, Laffey J, et al. Awake prone positioning of hypoxaemic patients with COVID-19: protocol for a randomised controlled open‑label superiority meta‑trial. BMJ Open 2020; 10.
15. Barbaro RP, MacLaren G, Boonstra PS, Iwashyna TJ, Slutsky AS, Fan E, et al. Extracorporeal membrane oxygenation support in COVID-19: an international cohort study of the Extracorporeal Life Support Organization registry. The Lancet 2020; 396.
16. Combes A, Hajage D, Capellier G, Demoule A, Lavoué S, Guervilly C, et al. Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome. New England Journal of Medicine 2018; 378.
17. Gershengorn HB, Stelfox HT, Niven DJ, Wunsch H. Association of Premorbid Blood Pressure with Vasopressor Infusion Duration in Patients with Shock. American journal of respiratory and critical care medicine 2020; 202.
18. Burstein B, Tabi M, Barsness GW, Bell MR, Kashani K, Jentzer JC. Association between mean arterial pressure during the first 24 hours and hospital mortality in patients with cardiogenic shock. Critical Care 2020; 24.
19. Panwar R, Tarvade S, Lanyon N, Saxena M, Bush D, Hardie M, et al. Relative Hypotension and Adverse Kidney‑related Outcomes among Critically Ill Patients with Shock. A Multicenter, Prospective Cohort Study. American Journal of Respiratory and Critical Care Medicine 2020; 202.
20. Lamontagne F, Richards‑Belle A, Thomas K, Harrison DA, Sadique MZ, Grieve RD, et al. Effect of Reduced Exposure to Vasopressors on 90-Day Mortality in Older Critically Ill Patients with Vasodilatory Hypotension: A Randomized Clinical Trial. JAMA – Journal of the American Medical Association 2020; 323.
21. Saugel B, Kouz K, Meidert AS, Schulte‑Uentrop L, Romagnoli S. How to measure blood pressure using an arterial catheter: A systematic 5-step approach. Critical Care 2020; 24.
22. Chen JT, Roberts R, Fazzari MJ, Kashani K, Qadir N, Cairns CB, et al. Variation in fluid and vasopressor use in shock with and without physiologic assessment: A multicenter observational study. Critical Care Medicine 2020.
23. Meyhoff TS, Møller MH, Hjortrup PB, Cronhjort M, Perner A, Wetterslev J. Lower vs. Higher Fluid Volumes During Initial Management of Sepsis: A Systematic Review With Meta‑Analysis and Trial Sequential Analysis. Chest 2020; 157.
24. Roberts RJ, Miano TA, Hammond DA, Patel GP, Chen JT, Phillips KM, et al. Evaluation of vasopressor exposure and mortality in patients with septic shock. Critical Care Medicine 2020.
25. Zdolsek M, Hahn RG, Sjöberg F, Zdolsek JH. Plasma volume expansion and capillary leakage of 20% albumin in burned patients and volunteers. Critical Care 2020; 24.
26. dos Santos EC, Orbegozo D, Mongkolpun W, Galfo V, Nan W, Bogossian EG, et al. Systematic review and meta‑analysis of effects of transfusion on hemodynamic and oxygenation variables. Critical Care Medicine 2020.
27. Guinot PG, Nguyen M, Duclos V, Soudry‑Faure A, Bouhemad B, Guinot PG, et al. Oral water ingestion in the treatment of shock patients: a prospective randomized study. Intensive Care Medicine 2020; 46.
28. Li Y, Li H, Zhang D. Timing of norepinephrine initiation in patients with septic shock: A systematic review and meta‑analysis. Critical Care 2020; 24.
29. Pancaro C, Shah N, Pasma W, Saager L, Cassidy R, van Klei W, et al. Risk of Major Complications after Perioperative Norepinephrine Infusion through Peripheral Intravenous Lines in a Multicenter Study. Anesthesia and Analgesia 2020.
30. Tran QK, Mester G, Bzhilyanskaya V, Afridi LZ, Andhavarapu S, Alam Z, et al. Complication of vasopressor infusion through peripheral venous catheter: A systematic review and meta‑analysis. American Journal of Emergency Medicine 2020.
31. Belletti A, Nagy A, Sartorelli M, Mucchetti M, Putzu A, Sartini C, et al. Effect of continuous epinephrine infusion on survival in critically ill patients: A meta‑analysis of randomized trials. Critical Care Medicine 2020.
32. Aso S, Matsui H, Fushimi K, Yasunaga H. Vasopressin versus epinephrine as adjunct vasopressors for septic shock. Intensive Care Medicine 2020; 46.
33. Silversides JA, McAuley DF, Blackwood B, Fan E, Ferguson AJ, Marshall JC. Fluid management and deresuscitation practices: A survey of critical care physicians. Journal of the Intensive Care Society 2020; 21.
34. Wu Z, Zhang S, Xu J, Xie J, Huang L, Huang Y, et al. Norepinephrine vs. Vasopressin: Which Vasopressor Should Be Discontinued First in Septic Shock? A Meta‑Analysis. Shock 2020; 53.
35. Santer P, Anstey MH, Patrocínio MD, Wibrow B, Teja B, Shay D, et al. Effect of midodrine versus placebo on time to vasopressor discontinuation in patients with persistent hypotension in the intensive care unit (MIDAS): an international randomised clinical trial. Intensive Care Medicine 2020; 46.
36. Marik PE, Khangoora V, Rivera R, Hooper MH, Catravas J. Hydrocortisone, Vitamin C, and Thiamine for the Treatment of Severe Sepsis and Septic Shock: A Retrospective Before‑After Study. Chest 2017; 151.
37. Moskowitz A, Huang DT, Hou PC, Gong J, Doshi PB, Grossestreuer A, et al. Effect of Ascorbic Acid, Corticosteroids, and Thiamine on Organ Injury in Septic Shock: The ACTS Randomized Clinical Trial. JAMA 2020; 324.
38. Iglesias J, Vassallo A, Patel V, Sullivan JB, Cavanaugh J, Elbaga Y. Outcomes of Metabolic Resuscitation Using Ascorbic Acid, Thiamine, and Glucocorticoids in the Early Treatment of Sepsis: The ORANGES Trial. Chest 2020; 158.
39. Fujii T, Luethi N, Young PJ, Frei DR, Eastwood GM, French CJ, et al. Effect of Vitamin C, Hydrocortisone, and Thiamine vs. Hydrocortisone Alone on Time Alive and Free of Vasopressor Support among Patients with Septic Shock: The VITAMINS Randomized Clinical Trial. In: JAMA – Journal of the American Medical Association 2020.
40. Chang P, Liao Y, Guan J, Guo Y, Zhao M, Hu J, et al. Combined Treatment With Hydrocortisone, Vitamin C, and Thiamine for Sepsis and Septic Shock: A Randomized Controlled Trial. Chest 2020; 158.
41. Menon V, Mohamed ZU, Prasannan P, Moni M, Edathadathil F, Prasanna P, et al. Vitamin C Therapy for Routine Care in Septic Shock (ViCTOR) Trial: Effect of Intravenous Vitamin C, Thiamine, and Hydrocortisone Administration on Inpatient Mortality among Patients with Septic Shock. Indian Journal of Critical Care Medicine 2020; 24.
42. Miyamoto Y, Aso S, Iwagami M, Yasunaga H, Matsui H, Fushimi K, et al. Association between IV Thiamine and Mortality in Patients with Septic Shock: A Nationwide Observational Study. Critical Care Medicine 2020; 48.
43. Hwang SY, Ryoo SM, Park JE, Jo YH, Jang DH, Suh GJ, et al. Combination therapy of vitamin C and thiamine for septic shock: a multi ‑ centre, double‑blinded randomized, controlled study. Intensive Care Medicine 2020; 46.
44. Vail EA, Wunsch H, Pinto R, Bosch NA, Walkey AJ, Lindenauer PK, et al. Use of Hydrocortisone, Ascorbic Acid, and Thiamine in Adults with Septic Shock. American Journal of Respiratory and Critical Care Medicine 2020.
45. Kapur J, Elm J, Chamberlain JM, Barsan W, Cloyd J, Lowenstein D, et al. Randomized Trial of Three Anticonvulsant Medications for Status Epilepticus. New England Journal of Medicine 2019; 381.
46. Rossetti AO, Schindler K, Sutter R, Rüegg S, Zubler F, Novy J, et al. Continuous vs. Routine Electroencephalogram in Critically Ill Adults with Altered Consciousness and No Recent Seizure: A Multicenter Randomized Clinical Trial. JAMA Neurology 2020; 77.
47. Anderson D, Jirsch JD, Wheatley MB, Brindley PG. Electroencephalogram patterns in critical care: A primer for acute care doctors. Journal of the Intensive Care Society 2020.
48. Roberts I, Shakur H, Coats T, Hunt B, Balogun E, Barnetson L, et al. The CRASH-2 trial: A randomised controlled trial and economic evaluation of the effects of tranexamic acid on death, vascular occlusive events and transfusion requirement in bleeding trauma patients. Health Technology Assessment 2013; 17.
49. Effects of tranexamic acid on death, disability, vascular occlusive events and other morbidities in patients with acute traumatic brain injury (CRASH-3): a randomised, placebo‑controlled trial. The Lancet 2019; 394.
50. Lawati K, Sharif S, Maqbali S, Rimawi H, Petrosoniak A, Belley‑Cote EP, et al. Efficacy and safety of tranexamic acid in acute traumatic brain injury: a systematic review and meta‑analysis of randomized ‑ controlled trials. Intensive Care Medicine 2020.
51. Chen H, Wu F, Yang P, Shao J, Chen Q, Zheng R. A meta‑analysis of the effects of therapeutic hypothermia in adult patients with traumatic brain injury. Critical Care 2019; 23.
52. Cooper DJMD, Nichol ADMBP, Bailey MP, Bernard SMMD, Cameron PAMD, Pili‑Floury SMDP, et al. Effect of Early Sustained Prophylactic Hypothermia on Neurologic Outcomes Among Patients With Severe Traumatic Brain Injury: The POLAR Randomized Clinical Trial: The Journal of the American Medical Association. JAMA 2018; 320.
53. Hawryluk GWJ, Aguilera S, Buki A, Bulger E, Citerio G, Cooper DJ, et al. A management algorithm for patients with intracranial pressure monitoring: the Seattle International Severe Traumatic Brain Injury Consensus Conference (SIBICC). In: Intensive Care Medicine 2019.
54. Cook AM, Morgan Jones G, Hawryluk GWJ, Mailloux P, McLaughlin D, Papangelou A, et al. Guidelines for the Acute Treatment of Cerebral Edema in Neurocritical Care Patients. Neurocritical Care 2020; 32.
55. Sandroni C, D’Arrigo S, Cacciola S, Hoedemaekers CWE, Kamps MJA, Oddo M, et al. Prediction of poor neurological outcome in comatose survivors of cardiac arrest: a systematic review. Intensive Care Medicine 2020; 46.
56. Greer DM, Shemie SD, Lewis A, Torrance S, Varelas P, Goldenberg FD, et al. Determination of Brain Death/Death by Neurologic Criteria: The World Brain Death Project. JAMA – Journal of the American Medical Association 2020; 324.
57. Hayek SS, Leaf DE, Samman Tahhan A, Raad M, Sharma S, Waikar SS, et al. Soluble Urokinase Receptor and Acute Kidney Injury. New England Journal of Medicine. 2020; 382.
58. Tacke F. Risk Prediction for Acute Kidney Injury – Super Important, Now suPAR Easy? New England Journal of Medicine 2020; 382.
59. Darmon M, Bourmaud A, Reynaud M, Rouleau S, Meziani F, Boivin A, et al. Performance of Doppler‑based resistive index and semi‑quantitative renal perfusion in predicting persistent AKI: results of a prospective multicenter study. Intensive Care Medicine 2018; 44.
60. Garnier F, Daubin D, Larcher R, Bargnoux AS, Platon L, Brunot V, et al. Reversibility of Acute Kidney Injury in Medical ICU Patients: Predictability Performance of Urinary Tissue Inhibitor of Metalloproteinase-2 x Insulin‑Like Growth Factor‑Binding Protein 7 and Renal Resistive Index. Critical Care Medicine 2020.
61. Zarbock A, Kellum JA, Schmidt C, van Aken H, Wempe C, Pavenstädt H, et al. Effect of early vs. delayed initiation of renal replacement therapy on mortality in critically ill patients with acute kidney injury: The elain randomized clinical trial. JAMA – Journal of the American Medical Association 2016; 315.
62. Gaudry S, Hajage D, Schortgen F, Martin‑Lefevre L, Pons B, Boulet E, et al. Initiation Strategies for Renal‑Replacement Therapy in the Intensive Care Unit. New England Journal of Medicine 2016; 375.
63. Barbar SD, Clere‑Jehl R, Bourredjem A, Hernu R, Montini F, Bruyère R, et al. Timing of Renal‑Replacement Therapy in Patients with Acute Kidney Injury and Sepsis. New England Journal of Medicine 2018.
64. Bagshaw SM, Wald R, Adhikari NKJ, Bellomo R, da Costa BR, Dreyfuss D, et al. Timing of initiation of renal‑replacement therapy in acute kidney injury. New England Journal of Medicine 2020; 383.
65. Walsh M, Merkel PA, Peh C‑A, Szpirt WM, Puéchal X, Fujimoto S, et al. Plasma Exchange and Glucocorticoids in Severe ANCA‑Associated Vasculitis. New England Journal of Medicine 2020; 382.
66. Zarbock A, Küllmar M, Kindgen‑Milles D, Wempe C, Gerss J, Brandenburger T, et al. Effect of Regional Citrate Anticoagulation vs. Systemic Heparin Anticoagulation During Continuous Kidney Replacement Therapy on Dialysis Filter Life Span and Mortality Among Critically Ill Patients With Acute Kidney Injury. JAMA 2020; 324.
67. Alberici F, Delbarba E, Manenti C, Econimo L, Valerio F, Pola A, et al. A single center observational study of the clinical characteristics and short‑term outcome of 20 kidney transplant patients admitted for SARS‑CoV2 pneumonia. Kidney International 2020; 97.
68. Nadim MK, Forni LG, Mehta RL, Connor MJ, Liu KD, Ostermann M, et al. COVID-19-associated acute kidney injury: consensus report of the 25th Acute Disease Quality Initiative (ADQI) Workgroup. Nature Reviews Nephrology 2020.
69. Clark EG, Hiremath S, McIntyre L, Wald R, Hundemer GL, Joannidis M. Haemoperfusion should only be used for COVID-19 in the context of randomized trials. Nature Reviews Nephrology 2020.
70. Horák J, Chvojka J, Tégl V, Nalos L, Peltanová M, Beneš J, et al. Hemadsorpční metody u kriticky nemocných – dvojitá sázka naslepo? Anest intenziv Med 2020; 31(4): 172–175.
71. Singer M, Deutschman CS, Seymour CW, Shankar‑Hari M, Annane D, Bauer M, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). Jama 2016; 315 : 801–810. doi:10.1001/jama.2016.0287.
72. Seymour CW, Kennedy JN, Wang S, Chang CCH, Elliott CF, Xu Z, et al. Derivation, Validation, and Potential Treatment Implications of Novel Clinical Phenotypes for Sepsis. In: JAMA – Journal of the American Medical Association 2019.
73. Rhee C, Kadri SS, Danner RL, Suffredini AF, Massaro AF, Kitch BT, et al. Diagnosing sepsis is subjective and highly variable: A survey of intensivists using case vignettes. Critical Care 2016; 20.
74. Horak J, Martinkova V, Radej J, Matejovič M. Back to Basics: Recognition of Sepsis with New Definition. Journal of Clinical Medicine 2019; 8.
75. Waligora G, Gaddis G, Church A, Mills L. Rapid Systematic Review: The Appropriate Use of Quick Sequential Organ Failure Assessment (qSOFA) in the Emergency Department. Journal of Emergency Medicine 2020.
76. Hernández G, Ospina‑Tascón GA, Damiani LP, Estenssoro E, Dubin A, Hurtado J, et al. Effect of a Resuscitation Strategy Targeting Peripheral Perfusion Status vs. Serum Lactate Levels on 28-Day Mortality Among Patients With Septic Shock: The ANDROMEDA‑SHOCK Randomized Clinical Trial. JAMA 2019; 321 : 654–664. doi:10.1001/jama.2019.0071.
77. Hernández G, Kattan E, Ospina‑Tascón G, Bakker J, Castro R. Capillary refill time status could identify different clinical phenotypes among septic shock patients fulfilling Sepsis-3 criteria: a post hoc analysis of ANDROMEDA‑SHOCK trial. Intensive Care Medicine 2020; 46.
78. Ferlay J, Colombet M, Soerjomataram I, Dyba T, Randi G, Bettio M, et al. Cancer incidence and mortality patterns in Europe: Estimates for 40 countries and 25 major cancers in 2018. European Journal of Cancer 2018; 103.
79. Allemani C, Matsuda T, di Carlo V, Harewood R, Matz M, Nikšić M, et al. Global surveillance of trends in cancer survival 2000–14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population‑based registries in 71 countries. The Lancet 2018; 391.
80. Spika D, Bannon F, Bonaventure A, Woods LM, Harewood R, Carreira H, et al. Life tables for global surveillance of cancer survival (the CONCORD programme): Data sources and methods. BMC Cancer 2017; 17.
81. Karvunidis T, Lysák D, Matějovič M. Dospělý onkologický nemocný v intenzivní péči. Je již čas říci „ano, zvážíme to“než říkat „ne“?! Anest intenziv Med. 2017; 28.
82. Azoulay E, Schellongowski P, Darmon M, Bauer PR, Benoit D, Depuydt P, et al. The Intensive Care Medicine research agenda on critically ill oncology and hematology patients. Intensive Care Medicine 2017; 43.
83. Kroschinsky F, Stölzel F, von Bonin S, Beutel G, Kochanek M, Kiehl M, et al. New drugs, new toxicities: Severe side effects of modern targeted and immunotherapy of cancer and their management. Critical Care 2017; 21.
84. Azoulay E, Darmon M, Valade S. Acute life‑threatening toxicity from CAR T ‑ cell therapy. Intensive Care Medicine 2020; 46.
85. Fessas P, Possamai LA, Clark J, Daniels E, Gudd C, Mullish BH, et al. Immunotoxicity from checkpoint inhibitor therapy: clinical features and underlying mechanisms. Immunology 2020; 159.
86. Assoun S, Lemiale V, Azoulay E. Molecular targeted therapy‑related life‑threatening toxicity in patients with malignancies. A systematic review of published cases. Intensive Care Medicine 2019; 45.
87. Azoulay E, Mokart D, Kouatchet A, Demoule A, Lemiale V. Acute respiratory failure in immunocompromised adults. The Lancet Respiratory Medicine 2019; 7.
88. Munshi L, Darmon M, Soares M, Pickkers P, Bauer P, Meert A‑P, et al. Acute Respiratory Failure Outcomes in Patients with Hematologic Malignancies and Hematopoietic Cell Transplant: A Secondary Analysis of the EFRAIM Study. Biology of Blood and Marrow Transplantation 2020.
89. Azoulay E, Russell L, van de Louw A, Metaxa V, Bauer P, Povoa P, et al. Diagnosis of severe respiratory infections in immunocompromised patients. Intensive Care Medicine 2020; 46.
90. Messika J, Darmon M, Mal H, Pickkers P, Soares M, Canet E, et al. Etiologies and Outcomes of Acute Respiratory Failure in Solid Organ Transplant Recipients: Insight Into the EFRAIM Multicenter Cohort. Transplantation Proceedings 2020.
91. Bauer PR, Chevret S, Yadav H, Mehta S, Pickkers P, Bukan RB, et al. Diagnosis and outcome of acute respiratory failure in immunocompromised patients after bronchoscopy. European Respiratory Journal 2019; 54.
92. Frat JP, Coudroy R, Marjanovic N, Thille AW. High‑flow nasal oxygen therapy and noninvasive ventilation in the management of acute hypoxemic respiratory failure. Annals of Translational Medicine 2017; 5.
93. Coudroy R, Pham T, Boissier F, Robert R, Frat JP, Thille AW. Is immunosuppression status a risk factor for noninvasive ventilation failure in patients with acute hypoxemic respiratory failure? A post hoc matched analysis. Annals of Intensive Care 2019; 9.
94. Lemiale V, de Jong A, Dumas G, Demoule A, Mokart D, Pène F, et al. Oxygenation Strategy during Acute Respiratory Failure in Critically ‑ Ill Immunocompromised Patients. Critical Care Medicine 2020.
95. Demoule A, Antonelli M, Schellongowski P, Pickkers P, Soares M, Meyhoff T, et al. Respiratory Mechanics and Outcomes in Immunocompromised Patients With ARDS. Chest 2020.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2020 Issue 6-
All articles in this issue
- Rok 2020 v přehledu
- Year 2020 in review – Intensive care
- Year 2020 in review – Anaesthesia
- Year 2020 in review – Perioperative pain therapy
- Year 2020 in review – Emergency medicine
- Year 2020 in review – Paediatric anaesthesia
- Year 2020 in review – Regional Anesthesia
- Year 2020 in review – Anaesthesiology in obstetrics
- Year 2020 in review – Post‑acute intensive care
- Použití kortikosteroidů u COVID-19
- Nekardiochirurgické výkony s pooperační hypotenzí – jak ovlivní myokard?
- Celková anestetika – liší se rizikem onkologické progrese?
- Nutriční stav a jeho podpora – která fakta vstupují do klinické medicíny hraničních a náročných stavů?
- Čemu vhodnému se mohou intenzivisté naučit v geriatrii?
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Year 2020 in review – Post‑acute intensive care
- Year 2020 in review – Intensive care
- Použití kortikosteroidů u COVID-19
- Year 2020 in review – Perioperative pain therapy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

