-
Medical journals
- Career
Hypoxie a hyperkapnie – jak fungují chemoreceptory?
Authors: D. Astapenko 1,2; V.- Černý 1 6
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové 1; Lékařská fakulta v Hradci Králové, Univerzita Karlova 2; Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové 3; Klinika anesteziologie, perioperační a intenzivní medicíny, Univerzita J. E. Purkyně v Ústí nad Labem, Masarykova nemocnice v Ústí nad Labem 4; Department of Anesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, Nova Scotia, Canada 5; Technická univerzita Liberec 6
Published in: Anest. intenziv. Med., 31, 2020, č. 4, s. 195-197
Category: Clinical Physiology
Overview
Správná tenze kyslíku a oxidu uhličitého jsou jedním ze základních předpokladů udržení homeostázy. V kontextu makroor ganismu se vyvinuly mechanismy, které umožňují jak akutní, tak dlouhodobou reakci na vzniklou nerovnováhu dýchacích plynů. Akutní reakce jsou zprostředkovány chemoreceptory (glomus caroticum, receptorové zóny velkých cév a chemo recepční centra v mozku) a ovlivňují primárně dechový vzorec. Chemoreceptory fungují na bázi transdukce chemického signálu na elektrický. Jeho geneze probíhá několika cestami, které vedou k uzavření kaliového kanálu, otevření kalciového kanálu a následně k depolarizaci membrány. Dlouhodobá stimulace hypoxií nebo hyperkapnií vede k odpovědi na buněčné úrovni změnou transkripce a genové exprese. Dosud nejvíce probádaná je tzv. HIF dráha (hypoxia induced factor), jejíž modulace v experimentu vedla ke zmírnění dopadů ischemie ‑ reperfuze.
Klíčová slova:
hypoxie – hyperkapnie – chemoreceptory – hypoxia induced factor
Buněčná fyziologie dýchacích plynů
Kyslík (O2) a oxid uhličitý (CO2) jsou plyny, které sehrály v evoluci zásadní roli při vzniku maximálně efektivního typu buněčného metabolismu – oxidativní fosforylace, umožňující další vývoj mnohobuněčných organismů. Jedním z předpokladů pevného zakotvení reakce v evolučním vývoji bylo mj. i vytvoření účinných detekčních a obranných mechanismů před hypoxií a hyperkapnií, ohrožující homeostázu organismu.
V kontextu makroorganismu může výrazná změna koncentrací CO2 a O2 vést k energetickému selhání nebo oxidativnímu stresu a poruše acidobazické rovnováhy. Koncentrace zmíněných plynů je přitom v buňkách opačná, než je v atmosféře.
Chemoreceptory jsou zodpovědné za udržování relativně konstantní koncentrace kyslíku (pO2) a oxidu uhličitého (pCO2) v krvi jak v klidu (např. ve spánku), tak při fyzické zátěži (např. výkonnostní sport). Receptory pro pCO2 jsou citlivější než pro pO2 ve smyslu jejich odpovědi ve zvýšení minutové ventilace. Buněčné mechanismy vedou ke změnám v transkripci proteinů odpovědných za buněčnou adaptaci na nerovnováhu vzniklou akutně nebo dlouhodobě působícím mechanismem [1].
Chemoreceptory představují malé okrsky specializovaných buněk odlišných od svého okolí. Nachází se jak v cévním systému, tak v mozku, kde jsou v kontaktu s mozkomíšním mokem (CSF), jehož fyziologické vlastnosti se výrazně liší v porovnání s plazmou.
Akutní reakce na hypoxii
Akutní hypoxie (resp. nepoměr mezi dodávkou a spotřebou kyslíku na úrovni tkání) může být vyvolána řadou situací: fyzická zátěž, vysokohorská turistika, fetální vývoj (kdy tkáně rostou rychleji než krevní zásobení). Chemoreceptory zodpovědné za akutní zvýšení minutové ventilace jsou především karotická tělíska (glomus caroticum), ale podobné okrsky tkáně byly detekovány i v plicní cirkulaci, kůře nadledvin a Botalově dučeji [2]. Karotická tělíska mají charakter malého „orgánu“. Jsou hustě prokrvená (v poměru ke své váze je denzita jejich cévního zásobení nejvyšší ve srovnání s ostatními tkáněmi v lidském těle) a obsahují zcela jiný typ buněk než okolní cévní stěna karotického sinu: buňky připomínající neurony (typ I) a buňky připomínající glie (typ II). Tyto buňky mohou podlehnout nádorové transformaci [3]. Buňky typu I jsou hustě inervovány z IX. hlavového nervu (n. glossopharyngeus) a jsou zodpovědné za akutní respirační odpověď na hypoxii. Rychlost tohoto reflexu vylučuje nutnost syntézy nových proteinů, a tudíž bude závislá na jiných mechanismech [4] (obr. 1):
Image 1. Znázornění mechanismů v karotických tělískách působících aktivaci respirační odpovědi na hypoxii 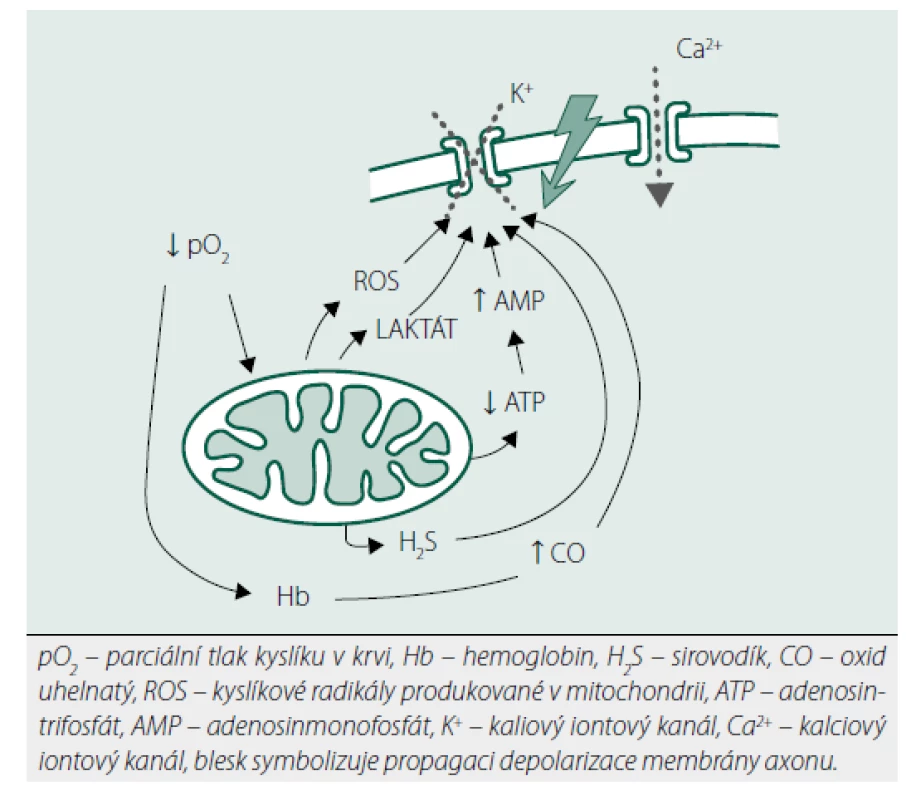
Membránová chemotransdukce – při hypoxii dojde k uzávěru draslíkových kanálů a depolarizaci membrány. Signál je poté na bázi neurotransmiterů (acetylcholin, dopamin) převeden až na IX. hlavový nerv, někteří autoři ale možnost zmíněné chemotransdukce popírají.
Metabolický senzor – při hypoxii se snižuje produkce ATP (adenosintrifosfát) a kumuluje se AMP (adenosinmonofosfát) laktát a draslík. Tyto změny v konečném důsledku vedou k uzavření draselných kanálů a depolarizaci membrány.
Redoxní teorie – při hypoxii dochází ke kumulaci kyslíkových radikálů, které způsobí uzavření draslíkových kanálů a depolarizaci membrány.
Teorie plynných transmiterů – oxid uhelnatý (CO) je ve zvýšené míře produkován enzymem hemoxygenázou při hypoxii, což vede k uzávěru draslíkových kanálů. Na reakci se podílí ještě další plyn s významnou biologickou signální funkcí – sirovodík (H2S). Dosud neobjasněnou roli v tomto reflexu hraje i oxid dusnatý (NO).
Akutní reakce na hyperkapnii
Oxid uhličitý v krvi má tendenci reagovat s vodou za vzniku bikarbonátu a vodíkového protonu (H+). Tuto reakci urychluje erytrocytární karboanhydráza. Vyšší koncentrace vodíkových protonů poté vede v CSF k acidóze (H+ v CSF není efektivně pufrován pro nízkou koncentraci proteinů a nepřítomnosti erytrocytů). Chemoreceptory v mozkovém kmeni, které jsou v kontaktu s CSF, poté reagují aktivací dýchacích center a zvýšení minutové ventilace pro eliminaci CO2. Bazální tonus respiračních center, a tedy bazální dechová aktivita, je na pCO2 za fyziologických okolností závislá. Centra v mozku a buněčné mechanismy jsou následující:
Nucleus amigdalae – část tohoto centra v limbickém systému je zodpovědná za afektivní zabarvení reakce na hyperkapnii – strach z udušení. Neurony zodpovědné za tento pocit jsou citlivé na změny pH [5].
Centra v prodloužené míše (nucleus tractus solitarii, nucleus raphae, nucleus retrotrapezoideum) [6] obsahují neurony, které mění svojí elektrickou aktivitu v závislosti na pH a jsou přímo spojena s respiračními centry.
Mozeček – u potkanů, kterým byla provedena ablace nucleus fastigii nedošlo k ventilační odpovědi na hyperkapnii [7].
Kalcium‑dependentní depolarizace [8] – opakovaná stimulace tohoto mechanismu vede k oslabení odpovědi (viz pacienti s chronickou obstrukční plicní nemocí).
Periferní chemoreceptory v karotických tělískách [9] – nejsou na změny pH tak citlivé, jelikož v krvi dojde rychleji k jeho normalizaci. S centry v mozku vyvolají synergistickou odpověď.
Dlouhodobý vliv hypoxie a hyperkapnie
Chronická stimulace buněk hypoxií a hyperkapnií vede ke změnám na úrovni genové exprese a transkripce. Buňky produkují transkripční faktory, které vedou k syntéze proteinů ochraňujících buňky samotné. Mezi tyto transkripční faktory patří: HIF (hypoxia induced factor), HSF (heat shock factor), transkripční faktor NFkB [1].
Buněčná odpověď je uniformní (tzv. HIF dráha) a nezohledňuje stimulaci fyziologickou od patologické: vývoj plodu, nadmořská výška, výkonnostní sport, hojení ran vs. ischemie, růst nádoru, zánět, fibróza.
Klinická implikace v oboru anesteziologie a intenzivní medicína
Modulace transkripce indukované hypoxií, resp. hyperkapnií, jsou potenciálně atraktivní terapeutický cíl, jak omezit negativní dopad některých mechanismů systémové zánětové odpovědi a využívat efekt jejich reparačních procesů.
Pozitivní výsledky modulace HIF dráhy naznačil výzkum na myším modelu ischemie‑reperfuze myokardu snížením rozsahu ischemie [10], snížením neoangiogeneze a zachováním funkce myokardu [11]. Na prasečím modelu mozkového iktu byla modulací dráhy HIF docílena vyšší odolnost neuronů vůči kyslíkovým radikálům a zlepšení glukózového metabolismu [12]. Vyšší odolnost vůči oxidačnímu stresu byla též dokumentována na modelu ischemie‑reperfuze jater u myší [13].
Body k zapamatování
Chemoreceptory tenze kyslíku jsou převážně v karotických tělíscích
Chemoreceptory tenze oxidu uhličitého a pH jsou především v mozku
Hlavním efektorem akutní reakce na hypoxii, resp. hyperkapnii, je zvýšení minutové ventilace
Hlavním mechanismem reakce organismu na chronické změny obou dýchacích plynů je změna transkripce z DNA a aktivace buněčné odpovědi (HIF dráha) na stres
Cílené ovlivnění některých receptorových reakcí (HIF dráha) představuje možný koncept modulace excesivní zánětové reakce
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Vladimír Černý, Ph.D., FCCM
Cit. zkr: Anest intenziv Med. 2020; 31(4): 195–197
Sources
1. Cummins EP, Strowitzki MJ, Taylor CT. Mechanisms and consequences of oxygen and carbon dioxide sensing in mammals. Physiol Rev American Physiological Society 2020; 100(1): 463–488.
2. Kumar P, Prabhakar NR. Peripheral chemoreceptors: Function and plasticity of the carotid body. Compr Physiol NIH Public Access 2012; 2(1): 141–219.
3. Ma D, Liu M, Yang H, Ma X, Zhang Ch. Diagnosis and surgical treatment of carotid body tumor: A report of 18 cases. J Cardiovasc Dis Res Medknow Publications 2010; 1(3): 122–124.
4. Prabhakar NR, Semenza GL. Oxygen Sensing and Homeostasis. Physiology (Bethesda). 2015; 30(5): 340–348.
5. Taugher RJ, Lu Y, Wang Y, Creple CJ, Ghobbeh A, Fan R, et al. The bed nucleus of the stria terminalis is critical for anxiety‑related behavior evoked by CO2 and acidosis. J Neurosci Society for Neuroscience 2014; 34(31): 10247–10255.
6. Mulkey DK, Stornetta RL, Weston MC, Simmons JR, Parker A, Bayliss DA, et al. Respiratory control by ventral surface chemoreceptor neurons in rats. Nat Neurosci Nature Publishing Group 2004; 7(12): 1360–1369.
7. Xu F, Frazier DT. Role of the cerebellar deep nuclei in respiratory modulation. Cerebellum. 2002; 1(1): 35–40.
8. Gourine AV, Kasymov V, Marina N, Tang F, Figueiredo MF, Lane S, et al. Astrocytes control breathing through pH‑dependent release of ATP. Science 2010; 329(5991): 571–575.
9. Blain GM, Smith CA, Henderson KS, Dempsey JA. Peripheral chemoreceptors determine the respiratory sensitivity of central chemoreceptors to CO2. J Physiol J Physiol 2010; 588(13): 2455–2471.
10. Adluri RS, Thirunavukkarasu M, Dunna NR, Zhan J, Oriowo B, Takeda K, et al. Disruption of hypoxia‑inducible transcription factor‑prolyl hydroxylase domain-1 (PHD-1 -/-) Attenuates ex vivo myocardial ischemia/reperfusion injury through hypoxia ‑ inducible factor - -1α transcription factor and its target genes in mice. Antioxidants Redox Signal Antioxid Redox Signal 2011; 15(7): 1789–1797.
11. Oriowo B, Thirunavukkarasu M, Selvaraju V, Adluri RS, Zhan L, Takeda K, et al. Targeted Gene Deletion of Prolyl Hydroxylase Domain Protein 3 Triggers Angiogenesis and Preserves Cardiac Function by Stabilizing Hypoxia Inducible Factor 1 Alpha Following Myocardial Infarction. Curr Pharm Des Bentham Science Publishers Ltd. 2014; 20(9): 1305–1310.
12. Quaegebeur A, Segura I, Schmieder R, Verdegem D, Decimo I, Bifari F, et al. Deletion or inhibition of the oxygen sensor PHD1 protects against ischemic stroke via reprogramming of neuronal metabolism. Cell Metab Cell Press 2016; 23(2): 280–291.
13. Schneider M, Van Geyte K, Fraisl P, Kiss J, Aragones J, Mazzone M, et al. Loss or Silencing of the PHD1 Prolyl Hydroxylase Protects Livers of Mice Against Ischemia/Reperfusion Injury. Gastroenterology W.B. Saunders 2010; 138(3).
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2020 Issue 4-
All articles in this issue
- Doporučené postupy anestezie u pacientů trpících vzácným onemocněním v češtině – „OrphanAnesthesia.cz“
- Efekt midazolamu a dexmedetomidinu na funkci srdečních komor s využitím MRI – pilotní randomizovaná studie
- Perioperační péče o transgender pacienty/pacientky
- Audit antibiotické profylaxe v chirurgii
- Sto šedesát let od izolace kokainu a 115 let od syntézy prokainu – historie lokálních anestetik a jejich objevitelů
- Renesance ketaminu v léčbě dospělých pacientů v akutním a v kritickém stavu
- Náš článek po 10 letech: The practice of therapeutic mild hypothermia in cardiac arrest survivors in the Czech Republic
- Hemadsorpční metody u kriticky nemocných – dvojitá sázka naslepo?
- Inzulinová rezistence, hyperglykemie a proteinový katabolismus u kriticky nemocných: hledání klíčů k uzamčeným dveřím
- Suspektní imunitní trombocytopenie při Morbus Crohn
- Diagnostika COVID-19 pneumonie pomocí výpočetní tomografie, naše zkušenosti
- Perioperační použití gabapentinoidů v léčbě akutní pooperační bolesti – systematický přehled a metaanalýza
- Infekce krevního řečiště u kriticky nemocných: expertní stanovisko
- Tranexamová kyselina
- Hypoxie a hyperkapnie – jak fungují chemoreceptory?
- Disrupce rytmicity melatoninu v kritickém stavu
- Zajímavosti, tipy a triky, informace z jiných oborů
- CO2 oproti vzduchu významně sníží riziko vzduchové embolie při intervenčních ERCP a GIT endoskopiích
-
MEZIOBOROVÉ STANOVISKO
(evidenční číslo ČSARIM: 11/2020)
ZÁSADY ÚČELNÉ INDIKACE REMDESIVIRU U PACIENTŮ S COVID-19
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Tranexamová kyselina
- Hypoxie a hyperkapnie – jak fungují chemoreceptory?
- Audit antibiotické profylaxe v chirurgii
- Sto šedesát let od izolace kokainu a 115 let od syntézy prokainu – historie lokálních anestetik a jejich objevitelů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

