-
Medical journals
- Career
Historický přehled tekutinové terapie
Authors: M. Kříž 1; J. Raděj 1,2; M. Nalos 1,2,3
Authors‘ workplace: I. interní klinika FN Plzeň a LF UK 1; Biomedicínské centrum LF UK, Plzeň 2; Dept. of Intensive Care Medicine, Nepean Hospital, University of Sydney, Australia 3
Published in: Anest. intenziv. Med., 31, 2020, č. 1-2, s. 23-29
Category: Review Articles
Overview
Management intravenózní tekutinové terapie je již více než 180 let součástí klinické praxe. Za tu dobu procházel vývoj složení tekutinových přípravků, postupů při jejich aplikaci a chápání příslušné fyziologie mnohými milníky. Přesto v dnešní době nelze stále říci, že je tato evoluce u konce. Cílem dalších bádání je proto doplnit chybějící znalosti v této problematice, ověřit dosavadní zjištění a pokusit se optimalizovat přístup v terapii specificky nemocných pacientů. Zásadní při tom bude nalezení optimálního složení, dávky a načasování tekutinové terapie u pacientů v intenzivní péči. V tomto přehledovém článku se zaměřujeme na klíčové předěly historie tekutinové léčby, abychom čtenářům přiblížili vývoj preskripce tekutinové léčby a vliv přibývajících poznatků na změny v uvažování o přístupu k terapii tekutinami v rámci péče o kriticky nemocné.
Klíčová slova:
historie – tekutinová terapie – infuzní roztoky – krystaloidy – koloidy
Byl to rok 1832, který se stal zlomovým obdobím v parenterálním podání náhrady cirkulujícího objemu u pacientů se zvýšenými ztrátami tekutin. Důležité souvislosti sahají zhruba do 20. let 19. století, kdy propukla v deltě řeky Gangy epidemie cholery, která se o několik let později jako druhá pandemie postupně šířila napříč euroasijským kontinentem. V říjnu 1831 v anglickém přístavním městě Sunderland zemřel první pacient na území Velké Británie postižený touto nemocí a během následujícího roku v celém království podlehlo nákaze přibližně 32 000 lidí [1]. V té době odborná veřejnost nedokázala určit, co bylo příčinou projevů nemoci, ani se shodnout na efektivním přístupu v péči o postižené. Specifický diagnostický test neexistoval a léčba se zakládala pouze na domněnkách. Černá, hustá a chladná krev, jak byla často popisována u pacientů postižených vodnatými průjmy provázejících choleru, vedla lékaře k myšlence, že je nutné nemocného takové krve oprostit. Venesekce se tak stala tehdy populární a ne jedinou exaktně nepodloženou metodou léčby cholery [2].
Nejasný původ a příčina obrazu onemocnění, vědecky neodůvodněné lékařské postupy a stálé špatné léčebné výsledky přiměly víceprezidenta Royal College of Surgeons of London vyslat tehdy 22letého britského doktora Williama Brooka O’Shaughnessyho v prosinci 1831 do ohniska nákazy – Sunderlandu, aby zde analyzoval chemickou povahu krve a stolice pacientů postižených cholerou. Vedle dokonalého popisu klinického stavu nemocných si O’Shaughnessy po provedení chemické analýzy krve pacientů dehydratovaných těžkými průjmy všiml výrazného úbytku vody, snížení množství rozpustných solí a vzestupu urey v séru [3, 4]. Ve stolici popisoval naopak zvýšenou přítomnost těchto chybějících látek a uvedl, že jejich doplnění „do krve v patřičném poměru by obnovilo její normální složení“ [5; original emphasis]. Zároveň spatřoval v chemickém složení krve a stolice u pacientů s cholerou významné vodítko při určování diagnózy tohoto onemocnění [4].
Na základě svých poznatků definoval cíle restaurace krve – obnovit její specifickou hmotnost a doplnit nedostatek solí. K jejich dosažení doporučil aplikaci vlažného roztoku soli prostřednictvím rektálního nebo intravenózního podání. Intestinální absorpce ale vzhledem k povaze onemocnění nemohla vykazovat uspokojivý efekt. Tak byla poprvé přesněji popsána racionální indikace k parenterální tekutinové terapii a přibližně definováno složení potřebného roztoku. Své výsledky publikoval O’Shaughnessy v lednu 1832 před Ústřední zdravotní radou [4].
Již za necelých pět měsíců aplikoval skotský lékař Thomas Aitchison Latta zřejmě jako vůbec první poznatky doktora O’Shaughnessyho v praxi a přistoupil tak k intravenózní aplikaci tekutin u svých pacientů, aby „obnovil krev do jejího přirozeného stavu“ [6]. Brzy si uvědomoval, že podání roztoku není specifickou modalitou v léčbě cholery, nýbrž nezbytným pomocným prostředkem při resuscitaci tekutin u kolabujícího pacienta. Lattovy roztoky obsahovaly chlorid sodný a hydrogenuhličitan sodný rozpuštěný ve vodě [6]. Původní koncentraci těchto látek modifikoval ještě třikrát. Koncentrace chloridu sodného ve druhém roztoku dosahovala zhruba třikrát menších hodnot (58 mmol/l Na+; 49 mmol/l Cl - ; 9 mmol/l HCO3-), než je přítomno v dnes užívaném fyziologickém roztoku. Čtvrté složení bylo koncentrací elektrolytů nejblíže hodnotám obsažených v séru (134 mmol/l Na+ ; 118 mmol/l Cl - ; 16 mmol/l HCO3-) [7]
Své roztoky aplikoval nemocným prostřednictvím injekčního aparátu v množstvích (až 330 oz, tj. asi 10 l, za 12 hodin) a intervalech, které určoval dle klinického obrazu a tepu pacienta. Teplotu podávané infuze udržoval Latta tak, aby se vyvaroval chladovému třesu při nižších teplotách roztoku a tachykardii a hyperemii při teplotách vyšších. Upozornil také na nutnost opakované aplikace roztoku pro udržení kýženého efektu léčby, který následoval poměrně krátce po podání prvních jednotek tekutiny. Dále varoval před příliš rychlým provedením infuze, neúmyslným injikováním vzduchu či možností rozvoje flebitidy [6]. Doktor Robert Lewins, jenž informoval odbornou veřejnost o krocích svého kolegy Latty, tehdy popsal okamžitý efekt injekce roztoku jako „téměř zázračný“ [8].
I přes okamžité zlepšení klinického stavu nemocných v úvodu infuzní léčby nedokázali Lewins a Latta pomoci všem pacientům. Ve svém sdělení přiznali úmrtí deseti z prvních patnácti léčených. Přítomná terapie u nich nezabránila relapsu nepříznivého stavu při pokračujících nadměrných ztrátách tekutin. Následně autoři popsali možné příčiny selhání postupu. V této souvislosti zmínili pozdní podání tekutin, jejich nedostatečný objem nebo předčasné přerušení terapie a především přítomnost komorbidit. K většině uvedených úmrtí pravděpodobně vedla, dle provedené sekce, právě přidružená onemocnění a čas promarněný jinými léčebnými metodami v úvodu terapie namísto včasného podání infuze [6, 9].
Navzdory těmto poměrně nadějným výsledkům a nově se vyskytujícím epidemiím cholery byla intravenózní terapie roztoky solí postupně opouštěna. Za výjimku lze považovat zřejmě jen Johna Mackintoshe, který v odkazu průkopníků intravenózní terapie pokračoval [10]. A zatímco zastánci parenterálního způsobu restaurace vnitřního prostředí nemocných ocenili Lattovu a Lewinsovu odvahu k provedení a publikování inovativního přístupu, který si pro do té doby nevídaný efekt zasloužil uznání, jiní ji považovali za příčinu či urychlující faktor úmrtí. Dalším důvodem nastávajícího úpadku popularity terapie byl sám nesterilní, chemicky nečistý a značně hypotonický roztok, který léčbu nezřídka komplikoval rozvojem bakteriemie, pyretické a hemolytické reakce. V neposlední řadě to pak bylo úmrtí Thomase Latty v říjnu 1833 a odchod O’Shaughnessyho do Indie, kde se věnoval spíše činnostem mimo oblast medicíny [5].
Myšlenka intravenózní terapie ukázala tehdy obrovský potenciál přesto, že nebyla řádně propracována ani doceněna. Předstihovala bohužel tehdejší chápání patofyziologie celého procesu, a tak v polovině 19. století došlo k obecnému přijetí názoru, že intravenózní terapie nemá v medicíně místo. Předešlá snaha ji prosadit však vytvořila základy pro další racionální přístup v bádání a inovování v této oblasti medicíny, které pokračovalo o několik desetiletí později.
Již ve druhé polovině 19. století vzbudil nový zájem o solné roztoky popis jejich účinku u krvácivých stavů [11]. V neposlední řadě to byly čtyři významné práce britského fyziologa, farmakologa a lékaře Sydney Ringera publikované v letech 1882 a 1883 v The Journal of Physiology, které přinesly nové poznatky o působení roztoků solí na fyziologii organismu.
Ringer zkoumal vliv jednotlivých anorganických složek krevního séra na kontraktilitu izolovaného myokardu žab. Jeho pomocník omylem zaměnil do té doby používanou vodu z kohoutku za vodu destilovanou. Z tohoto omylu Ringer vyvodil, že roztok musí obsahovat určité koncentrace iontů pro udržení normální kontraktility. Myokard pak vystavoval účinkům roztoků o různé koncentraci různých konstituentů a na základě svých pozorování popsal význam kvantitativních změn sodíkových, draslíkových a vápenatých iontů v rámci srdeční aktivity a negativní vliv kyselého prostředí na činnost myokardu. Pro udržení normální kontraktility a frekvence žabího myokardu po dobu několika hodin stanovil Ringer vhodný a relativně izotonický roztok (154 mmol/l Na+ ; 4 mmol/l K+ ; 2,7 mmol/l Ca2+; 163 mmol/l Cl - ), který je dodnes znám jako Ringerův roztok a stal se prekurzorem pro další solné roztoky [12]. Kromě Ringerova roztoku neměly do tehdejší doby používané solné roztoky tonicitu srovnatelnou s hodnotou lidského séra. Až práce nizozemského profesora Hartoga Jacoba Hamburgera zabývající se rezistencí erytrocytů v prostředí solných roztoků o rozdílné koncentraci pomohla definovat 0,9% NaCl jako tekutinu isotonickou s krevním sérem savců, respektive člověka. Během experimentů profesor Hamburger, známý spíše pro popis dějů spjatých s tzv. chloridovým posunem ve fyziologii erytrocytů, sledoval únik hemoglobinu, jakožto známku narušení celistvosti buněčné membrány červených krvinek vlivem extrémní tonicity. Inspirací mu byla práce botanika Huga de Vriese, který pozoroval vliv různě koncentrovaných roztoků na rostlinné buňky a podíl semipermeability jejich cytoplazmatické membrány při adaptaci buňky v hypertonickém a hypotonickém prostředí [13].
Přibývající počet předepisování solných roztoků řadě pacientů, ovšem bez jasných indikací a kontraindikací, přiměl na počátku 20. století doktora George H. Evanse vyjádřit své obavy z takového neuváženého jednání. V roce 1911 upozornil na možnost retence solí v organismu, přetížení velkým množstvím tekutin a nebezpečí plynoucí z vlastností nejen hypertonických, ale také hypotonických roztoků. Vyzval k omezení nedbalého užívání tekutinových přípravků a stanovení podmínek, za kterých jsou „kvantitativní nebo kvalitativní změny v krevní plazmě racionálními indikacemi k jejich aplikaci a dále jedině poté, co bylo dostatečně prokázáno, že u pacienta neexistují oběhové nebo renální kontraindikace“ [14]. Zdá se, že ani po téměř 110 letech není problematika bezpečnosti tekutinových přípravků zcela vyjasněna. Není tomu příliš dlouho, co klinické účinky přebytku soli, kumulace tekutin a negativního vlivu chloridů byly stále do určité míry opomíjeny. Pravděpodobně „neexistuje žádný historický nebo vědecký podklad, s výjimkou Hamburgerových in vitro studií lýzy erytrocytů, které by podporovaly pokračující užívání 0,9% NaCl v klinické praxi, kromě případů, kdy dochází k velkým ztrátám chloridů, např. v důsledku zvracení“ [7]. Přesto není pochyb, že tekutinová terapie roztoky soli za svou éru zachránila nespočet nemocných.
V roce 1932 americký pediatr Alexis Hartmann modifikoval Ringerův roztok přidáním laktátu sodného a mírnou úpravou iontových koncentrací s cílem snížit acidifikaci séra u dehydratovaných, oligurických pacientů s průjmovitým onemocněním.
Přítomnost laktátového aniontu působí jako fyziologický pufr při vlastní metabolizaci na oxid uhličitý a bikarbonát. Hartmann a Darrow sice vyzdvihli efektivitu bikarbonátu v léčbě těžké acidózy, současně ale uvedli několik námitek proti jeho podávání, které je vedly k upřednostnění směsi laktátu sodného a hypotonického Ringerova roztoku. Byla to dle jejich poznámek hlavně tendence bikarbonátu působit prudký posun z nekompenzované acidózy do nekompenzované alkalózy, zvyšovat množství oxidu uhličitého ve tkáních a narušovat iontovou rovnováhu mezi sodíkem, draslíkem, vápníkem a hořčíkem [15].
Klinické výsledky pozorované při léčbě kojenců Hartmannovým roztokem považoval sám autor za velice úspěšné. Nicméně stále pokračoval ve studiu odpovědi organismu na podání laktátu sodného. Obával se nežádoucích účinků u pacientů s jaterním postižením, renální insuficiencí, anémií a anoxemií [15]. Zařazením metabolizovatelného aniontu, jako je laktát, Hartmann ukázal nový směr v uvažování o složení roztoků pro infuzní terapii a učinil krok k vytvoření vyváženějšího krystaloidního roztoku bez acidifikujícího účinku, ačkoliv iontové složení roztoku zůstalo oproti plazmě stále významně rozdílné.
Problémy, jako je například neadekvátnost užití bikarbonátu při léčbě metabolické acidózy u některých pacientů nebo dobře známý acidifikující a diluční účinek fyziologického roztoku, který je celosvětově stále nejčastěji používaným roztokem pro tekutinovou resuscitaci, vedly k potřebě vyvinout vyvážený krystaloidní roztok. Tedy takový roztok, který by rozvoji negativních účinků předcházel. Asi nejznámější z nich – Plasmalyte roztok – byl poprvé uveden na trh v roce 1982. Jeho potenciální přínos byl a je spatřován v nižším obsahu chloridů, které mohly stát zejména za zvýšenou zánětlivou odpovědí, sníženou splanchnickou perfuzí, renální aferentní vazokonstrikcí nebo alterací kontraktility myokardu [16, 17]. Balancované roztoky navíc obsahují různé metabolizovatelné anionty, jejichž vlastností využíval již Hartmann, viz výše. Od nástupu éry balancovaných krystaloidních roztoků uplynulo tedy více než 35 let a stále se jedná o oblíbenou resuscitační a udržovací tekutinu, které je připisováno zejména menší riziko rozvoje infekce, akutního poškození ledvin a potřeby renální substituční terapie u pacientů v kritické péči [16, 18].
Se začátkem 1. světové války a narůstajícím počtem obětí s hemoragickým šokem vyžadovala válečná medicína efektivní přístup v resuscitaci oběhu na bitevním poli. Velký potenciál zlepšit přežití těchto raněných při transportu z bojiště na lékařskou jednotku zde ukázaly, na rozdíl od krystaloidů, koloidní přípravky. Aplikací přípravků ze želatiny v terapii hemoragického šoku se zabýval americký lékař James J. Hogan. Ačkoliv spatřoval v krevní transfuzi a podání lidské plazmy optimální řešení u krvácejících v šoku, považoval tyto metody za nevhodné v podmínkách boje vzhledem ke špatné dostupnosti plazmy a rizikům plynoucích z transfuze krve [19].
Počátek výzkumu použitelnosti lidského albuminu v resuscitaci oběhu v klinické praxi je zřejmě spojen s terapií několika raněných s popáleninami během útoku na Pearl Harbor v prosinci 1941 [20]. Vzhledem k nákladnosti frakcionace lidského albuminu směřoval další vývoj spíše k produkci syntetických přípravků.
V roce 1944 začala ve Švédsku experimentální produkce dextranů a ke konci války se i ony uplatňovaly vedle želatinových přípravků při hemodynamické stabilizaci. Inspirací k vývoji polysacharidových přípravků byla arabská guma, která se za 1. světové války stala oblíbeným plazmatickým substituentem při tekutinové resuscitaci raněných vojáků [21].
Zhruba ve stejném období, v jakém začala ve Švédsku první produkce dextranů, nutila lékaře narůstající míra akutních intoxikací barbituráty a omezená terapie následků této otravy hledat řešení, která by snížila vysokou úmrtnost pacientů v důsledku podání nadměrného množství těchto sedativně -hypnotických látek na operačních sálech nebo úmyslného užití při suicidálních pokusech [22].
V roce 1945 popsal dánský psychiatr Aage Kirkegaard na základě dostupných výsledků zvířecích experimentů nebezpečí rozvoje oběhového šoku při přetrvávajícím poklesu krevního tlaku způsobeného vysokými dávkami kyseliny barbiturové. Zvířecí modely přitom byly zajištěny umělou ventilací, která bránila jejich úhynu při trvajícím depresivním účinku sedativa na dechové centrum [23]. Zároveň dospěl k závěru, že „dominantní příčinou (barbiturátové) smrti před rokem 1945 bylo periferní oběhové selhání“ [22], resp. oběhový šok u pacientů s dechovou podporou. Proto navrhl vhodný způsob tekutinové terapie pro tyto stavy za využití dextranů a lidského séra.
Model tekutinové terapie dle Kirkegaarda brzy převzal do praxe švédský anesteziolog Eric Nilsson a zavedl tzv. skandinávskou metodu, která současně zahrnovala podporu vitálních funkcí (zejm. podpora oběhu a dechu, průběžná kontrola renálních funkcí a elektrolytové homeostázy) a prevenci infekce (pneumonie) u pacientů intoxikovaných barbituráty. Metoda snížila mortalitu takto nemocných a dala základ pro multisystémovou intenzivní péči [24]. Stejné principy intenzivní péče byly zanedlouho uplatněny během epidemie poliomyelitidy v Dánsku v letech 1952 až 1953 u postižených s akutním respiračním selháním. Dánský anesteziolog Bjørn Ibsen se v průběhu těchto let zasloužil o vybudování jednotky intenzivní péče, která byla prototypem JIP, jak je známe dnes [25].
První semisyntetický koloid připravený z amylopektinu škrobu voskové kukuřice byl na trh uveden v roce 1970 s cílem napodobit volumexpanzivní vlastnosti albuminových přípravků. Obliba koloidů v následujících desetiletích rostla. Klinická praxe totiž ukázala, že jsou relativně efektivnější alternativou krystaloidů při stabilizaci oběhových parametrů u hypovolemických pacientů [26]. Negativní účinky hydroxyethylškrobů však byly postupně odhalovány v kontrastu s přibývající popularitou. Vysoká koncentrace, velká molekulární hmotnost a stupeň molární substituce (10% HES 450/0,7) byly faktory, které stály za poruchami koagulace [27], poškozováním ledvinných funkcí [28] a nežádoucí kumulací látky v retikuloendoteliálním systému parenchymatózních orgánů, svalů a kůže [29]. U následujících generací HES byly implementovány formy s redukovanou molární hmotností a stupněm molární substituce ve snaze zlepšit bezpečnost a farmakologické vlastnosti při současném zachování objemové účinnosti předchozích generací. Následovaly ještě dvě další generace těchto přípravků. Poslední, třetí generací z roku 1999 je HES 130/0,4, získávaný z kukuřičného, respektive HES 130/0,42 z bramborového škrobu, přičemž určitý rozdíl ve farmakokinetice lze nalézt i zde [30]. V roce 2007 byl představen HES 130/0,4 v balancovaném roztoku.
V roce 1998 publikovali recenzenti z Cochrane Injuries Group systematický přehled randomizovaných kontrolovaných studií srovnávajících podávání albuminu a krystaloidů u kriticky nemocných pacientů s hypovolemií [31]. Přehled ukázal zvýšení mortality a morbidity u pacientů ze skupiny léčených albuminovými přípravky, což snížilo popularitu albuminu a vyvolalo kontroverzní diskuze na toto téma. Australian and New Zealand Intensive Care Society -Clinical Trials Group (ANZICS -CTG), proto navrhla studii SAFE (Saline versus Albumin Fluid Evaluation), která nepotvrdila u heterogenní skupiny 6997 pacientů přítomnost nepříznivých účinků, ani zvýšenou 28denní mortalitu po podání 4% albuminu a zhodnotila jeho bezpečnost jako srovnatelnou s fyziologickým roztokem. Současně však analýza podskupiny pacientů v sepsi naznačila poněkud snížené riziko úmrtí při podání albuminu [32]. Zároveň post - -hoc analýzy studie SAFE prokázaly zhoršení otoku mozku a nebezpečí podání 4% albuminu u pacientů s kraniocerebrálním traumatem [33].
Zatím posledním mezníkem, který se týká podávání albuminu, byla studie ALBIOS (Albumin Replacement in Severe Sepsis or Septic Shock) z roku 2014 srovnávající 20% albumin v kombinaci s krystaloidy se samotnými krystaloidními roztoky v rámci tekutinové terapie septického šoku. Významný rozdíl ve 28 a 90denní mortalitě mezi těmito přípravky nebyl zjištěn. Post-hoc analýza, podobně jako u studie SAFE, ale přeci jen ukázala potenciál albuminu snížit 90denní mortalitu u nemocných v septickém šoku [32, 34].
Po zveřejnění Cochrane review v roce 1998 se používání albuminu na čas významně snížilo. Obliba syntetických koloidů, především HES, ale nadále přetrvávala. Tento trend vedl k provedení několika studií.
Během studie VISEP z roku 2008 bylo 537 pacientů se sepsí randomizováno do skupiny intenzivní nebo konvenční inzulinové terapie a současně do skupin resuscitační infuzní terapie roztokem HES 200/0,5 nebo Ringer laktátem ve faktoriálním designu. Primárně byla sledována 28denní mortalita a orgánová dysfunkce. Vzhledem k přítomnosti častého výskytu závažných hypoglykemií u skupiny léčené intenzivní inzulinovou terapií byla studie z bezpečnostních důvodů předčasně ukončena. Výsledky neprokázaly signifikantní rozdíl v míře 28denní mortality nebo morbidity (dle SOFA skóre) u srovnávaných typů inzulinové nebo tekutinové terapie. Popsána byla pouze tendence k delší době hospitalizace na JIP ve skupině pacientů s intenzivní inzulinovou terapií a tendence skupiny s HES vykazovat vyšší 90denní mortalitu. Podstatným zjištěním této studie z hlediska objemové terapie byla spojitost HES se značně vyšším výskytem akutního renálního selhání a nutnosti kontinuální náhrady funkce ledvin [35].
Tato pozorování podpořila také studie 6S z roku 2012 zaměřená na rozdíl v efektu léčby sepse při podání roztoku HES 130/0,42 nebo Ringer acetátu [29]. Ve stejném roce vznikla studie CHEST, při které bylo randomizováno 7000 heterogenních pacientů v intenzivní péči do dvou skupin v poměru 1 : 1. Pacienti byli dle přiřazené skupiny léčeni buď fyziologickým roztokem nebo nízkomolekulárním HES 130/0,4. Přestože se 90denní mortalita v obou skupinách nelišila, zlepšení hemodynamických parametrů bylo dosaženo rychleji u jedinců, kteří dostávali HES. Na druhou stranu byly u těchto pacientů častěji sledovány poruchy ledvinných funkcí vyžadující dialýzu a další nežádoucí příhody, jako vyrážka a pruritus [36].
V následujícím roce byla uveřejněna studie CRISTAL zabývající se ovlivněním mortality volbou roztoku koloidu nebo krystaloidu při objemové resuscitaci u pacientů v hypovolemickém šoku [37]. Ačkoliv tato studie ukázala výsledky vypovídající ve prospěch koloidů, vybídli její autoři k provedení dalších studií a vyčkání s formulací definitivních závěrů. Zveřejnění předešlých velkých studií ovšem vedlo i přes mnohé výhrady vůči užitým metodologickým postupům k reakci regulačních orgánů po celém světě. Ty postupovaly od méně restriktivních opatření až po úplný zákaz HES. Mnohé hlasy volající po přehodnocení a zrušení těchto omezení odkazovaly na studie, které neprokázaly riziko nežádoucích účinků spojených s užíváním HES, a zároveň varovaly před chyběním HES tam, kde nejsou krystaloidy dostačující [38]. Přesto v současné době ve většině vyspělých zemí přetrvává úsilí nepodávat HES pacientům se sepsí nebo s poruchou funkce ledvin. Použití HES při léčbě hemodynamicky nestabilních pacientů se ztrátou cirkulujícího objemu v důsledku akutního krvácení, pokud krystaloidy nepostačují, je předmětem současných debat. Přehled jednotlivých krystaloidních a koloidních roztoků dostupných aktuálně na našem trhu a jejich složení shrnuje tabulka 1 a 2.
Table 1. Složení krystaloidních roztoků dostupných na našem trhu [51] ![Složení krystaloidních roztoků dostupných na našem trhu [51]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3f14257425814fff9e9f410322d84910.png)
Table 2. Složení koloidních roztoků dostupných na našem trhu [51] ![Složení koloidních roztoků dostupných na našem trhu [51]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/26a40923459fecb9211bfee71af4b567.png)
Historicky poučná, avšak z etického a vědeckého hlediska opovrženíhodná, je kauza spojená se jménem Joachim Boldt. Ten jako autor a spoluautor mnoha publikací hájících bezpečnost syntetických koloidů do jisté míry ovlivnil spor mezi zastánci a odpůrci HES. Vyšetřování, které bylo započato po zveřejnění autorovy podezřelé publikace v roce 2009, postupně odhalilo 98 autorových studií zejména z 90. let, které obsahovaly falzifikovaná klinická data a ignorovaly etická ustanovení. Data z těchto studií byla zahrnuta v mnoha metaanalýzách, které z toho důvodu neshledaly ve svých závěrech významnou spojitost mezi HES a vyšším rizikem úmrtí. Výsledky zpětných šetření, která u těchto metaanalýz nezahrnula podvodná data, nakonec podpořily tvrzení o škodlivosti HES. Ačkoliv byla Boldtova role v prosazování a přežívání HES v praxi spíše malá, jedná se o událost, která by měla podnítit k ostražitosti při výběru a interpretaci dat ovlivňujících konečná doporučení. Otázkou zůstává, kolik pacientů bylo v rámci této aféry skutečně postiženo.
Závěr
Je zřejmé, jaký obrovský posun lze do současnosti zaznamenat ve vývoji tekutinové terapie od dob, kdy Latta a Lewins provedli první intravenózní aplikaci tekutinového přípravku (obr. 1). Nové znalosti v oblasti fyziologie a patologie procesů týkajících se stavů vyžadujících podání infuzní léčby společně s přibývajícími zkušenostmi z klinické praxe a aplikace nových poznatků pomáhaly formovat tento typ terapie do podoby, jakou známe dnes. Základní myšlenka přetrvává a snaha o udržení stálosti vnitřního prostředí, resuscitaci krevního oběhu nebo náhradu deficitu tekutin je zásadním cílem.
Image 1. Historické milníky tekutinové terapie 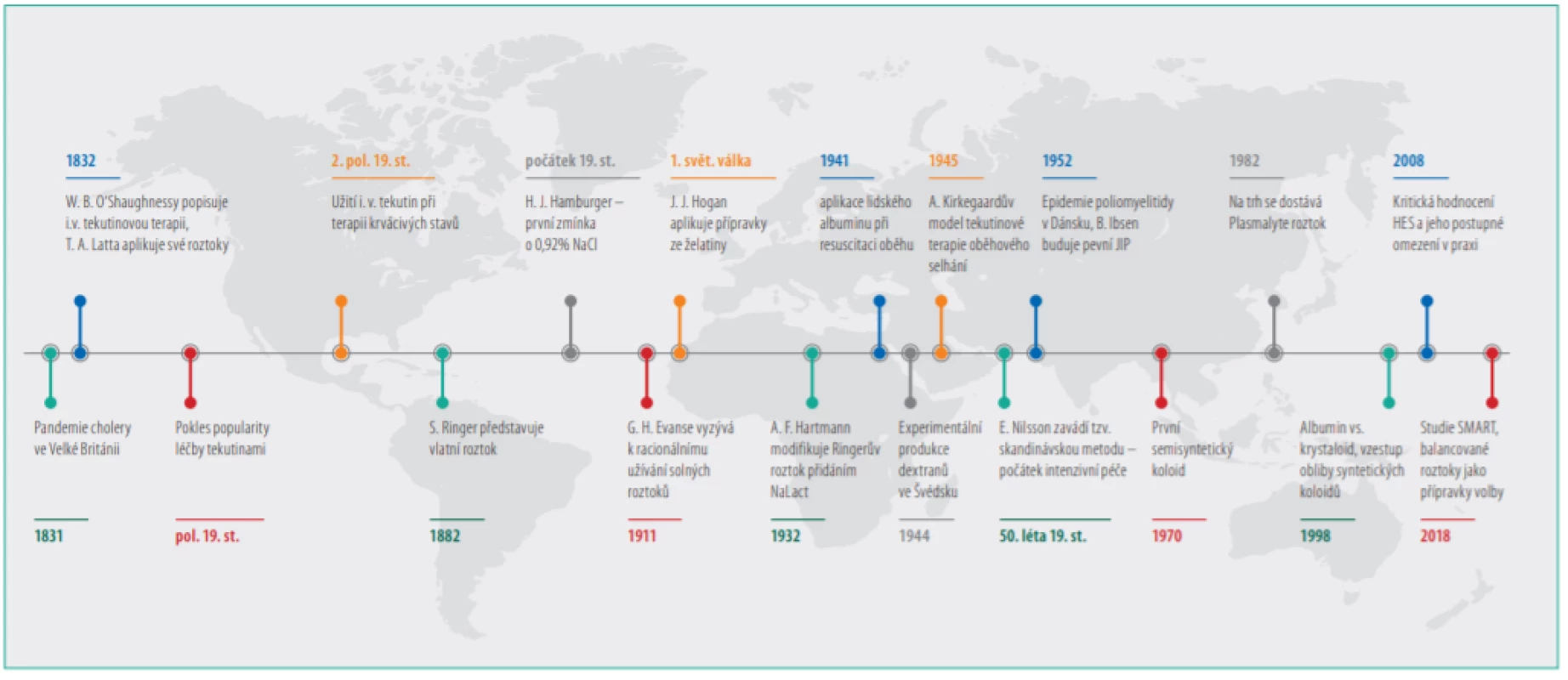
Již přes sto let uplynulo od Evansových výroků o možných rizicích provázejících aplikaci solných roztoků a stále platí, že podání tekutin je nutno vnímat jako jakýkoliv jiný léčebný postup, který musí respektovat známé indikace a kontraindikace. V moderní době, kdy jsou dostupná velká množství dat o účincích tekutinové terapie a nové poznatky rychle přibývají, se rozrůstá i spektrum aspektů, které je nutné neopomíjet, zejména při rozhodování jak rychle a dlouho léčbu tekutinovými přípravky vést, jakou formu a množství přípravku zvolit a u jakého pacienta bude zvolená individualizovaná strategie přínosná, aniž by došlo k rozvoji komplikací. Infuzní terapie tak neustále vybízí k hledání nových postupů nebo ke změnám dosavadních doporučení, jak dokazují následující příklady.
Lze zde zmínit provokativní výsledky dvou recentních randomizovaných studií provedených v Africe. Studie FEAST uskutečněná v Keni, Tanzanii a Ugandě zdokumentovala zvýšenou úmrtnost u dětí s infekcí a oběhovým selháním, které dostaly i. v. tekutiny ve srovnání s těmi, kterým nebyla podána žádná i. v. tekutina [39]. Andrews a spol. randomizoval 209 dospělých pacientů se sepsí v Zambii do skupiny protokolizované resuscitace, které byly podány vyšší objemy i. v. tekutin. To však paradoxně vedlo ke zhoršení šance na přežití [40]. Více pacientů ve skupině protokolizované péče mělo respirační selhání (36 % oproti 22%), nicméně pacientům nebyla k dispozici umělá plicní ventilace. Výše zmíněné výsledky mohou být zčásti vysvětleny evolučně danou tolerancí lidského organismu spíše k dehydrataci než hyperhydrataci.
Tyto studie a pilotní projekt skandinávského centra pro klinické studie (CRIC) jsou nyní spouštěčem změny v uvažování o způsobu vedení i. v. tekutinové terapie u pacientů v septickém šoku [41]. Restriktivní přístup při podávání tekutin by mohl vyřešit problém negativního vlivu pozitivní kumulativní bilance zejména na funkci plic, gastrointestinálního traktu a ledvin u pacientů se systémovou zánětlivou odpovědí [42]. Na tuto otázku se zaměřuje v současnosti probíhající mezinárodní studie CLASSIC, které se rovněž účastní pracoviště autorů tohoto přehledového článku [43].
Potenciální negativní důsledky intravenózního podávání tekutin může pomoci vysvětlit průkaz degradace endoteliálního glykokalyxu.
Glykokalyx je ochranný plášť povrchu buňky tvořený oligosacharidy, složený z glykoproteinů a jiných proteoglykanů. Přímé intravaskulární podávání tekutin může vést k poruše glykokalyxu, navození dysfunkce endotelu a ke změně vaskulární permeability v organismu kompromitovaném sepsí. V posledních letech je k faktorům narušujícím glykokalyx přiřazována paradoxně sama objemová terapie, která je základní součástí managementu tekutinové terapie. Recentním důkazem jsou v této problematice výsledky zveřejněné v roce 2019 v Critical Care. Byla sledována podskupina 56 pacientů v septickém šoku a podskupina 100 septických pacientů (kritéria Sepsis-2) časně léčených dle protokolizovaného postupu. Na základě získaných dat vypracovali autoři model, ve kterém hladina ukazatele míry poškození glykokalyxu (cirkulující heparan sulfát) významně korelovala s každým 1 litrem podaného krystaloidu během dané resuscitační periody nezávisle na závažnosti sepse (dle SOFA skóre), resp. septického šoku, a věku pacienta [44].
Významný podíl na možném vzniku komplikací je připisován také chlorid -liberální strategii tekutinové léčby. Serióznější přístup k Stewart-Fenclově konceptu analýzy poruch acido-bazické rovnováhy v 90. letech minulého století přispěl k respektování chloridového aniontu, jakožto nezávislé proměnné, která se významně podílí na míře acidity vnitřního prostředí [45]. Hyperchloremická acidóza a hyperchloremie obecně se tak pravděpodobně stávají nezávislými prediktory mortality a nepříznivých výsledků léčby na chloridy bohatými tekutinami u kritických pacientů. Svědčí pro to zjištění poukazující na zpětnovazebnou regulaci průtoku ledvinami iniciovanou reabsorpcí většího množství chloridů a chloridy indukovaným zvýšením senzitivity renální vaskulární reakce. To může způsobit renální aferentní vazokonstrikci a pokles glomerulární filtrace. Tento efekt byl pozorován například u pacientů po transplantaci jater s následnou péčí na JIP. Strategie s restrikcí chloridů zde snížila výskyt AKI a potřebu náhrady funkce ledvin, jak popisuje nedávná studie [46].
Jiné práce sledovaly spojitost iatrogenně navozené hyperchloremie s poruchami koagulace [47]. Studie na septických zvířecích modelech upozornily na stupeň systémové hypotenze a vzestup prozánětlivých cytokinů v závislosti na rostoucí koncentraci chloridů v plazmě [48]. Roztok potenciálně schopný vyhnout se komplikacím spojených s aplikací roztoků bohatých na chloridy se zdá být např. hypertonický roztok laktátu sodného [49].
Výše popsané nežádoucí účinky nebalancovaných roztoků s vysokou koncentrací chloridů, kam typicky řadíme fyziologický roztok, vycházejí z „nefyziologičnosti“ těchto roztoků. Tento fakt vedl v posledních letech u nás, ale i v jiných vyspělých zemích, k obecnému omezení podávání nebalancovaných roztoků u většiny pacientů v kritické péči. Velká studie SMART (nezaslepená studie s mnohonásobně překříženým uspořádáním) z roku 2018 primárně hodnotila u celkem 15802 pacientů kompozitní výstup zahrnující úmrtí z jakékoliv příčiny, novou náhradu funkce ledvin nebo přetrvávající renální dysfunkci při užití balancovaných roztoků oproti 0,9% NaCl. Výsledky definitivně potvrdily vhodnost upřednostnění vyvážených roztoků [50].
Ačkoliv je tedy tekutinová terapie neodmyslitelnou a efektivní součástí péče o kriticky nemocné pacienty, bude nutné i po téměř dvou stoletích vynaložit ještě mnoho úsilí, než budou zodpovězeny veškeré otázky týkající se problematiky této léčebné intervence a bude nalezen optimální přístup, který vyhoví individuálním potřebám jednotlivých pacientů.
PROHLÁŠENÍ AUTORŮ: Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Střet zájmů: Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Podíl autorů: Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Financování: Žádné.
Poděkování: Poděkování patří všem autorům, kteří se podíleli na vytvoření tohoto článku a dále MUDr. Bc. Janu Horákovi, Ph.D., za cenné komentáře a poskytnutí přehledných tabulek použitých v textu.
Článek přijat redakcí: 22. 11. 2019; Článek přijat k tisku: 5. 1. 2020; Cit. zkr: Anest intenziv Med. 2020; 31(1–2): 23–29
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Marek Nalos, Ph.D., EDIC, FCICM,
Sources
1. Underwood EA. The history of cholera in Great Britain. Proc R Soc Med. 1948; 41(3): 165–173.
2. Edited by Wakley T. History of the rise, progress, ravages, etc. of the blue cholera of India. The Lancet 1831–1832 in two volumes. The Lancet. 1831; 19 : 241–284.
3. O’Shaughnessy WB. Chemical pathology of cholera. The Lancet. 1832; 18(456): 225–232.
4. O’Shaughnessy WB. Report on the chemical pathology of the malignant cholera: containing analyses of the blood, dejections, &c. of patients labouring under that disease in Newcastle and London, &c. London: Highley; 1832.
5. Cosnett JE. The origins of intravenous fluid therapy. The Lancet. 1989; 1(8641): 768–771.
6. Latta T. Malignant cholera. Documents communicated by the Central Board of Health, London, relative to the treatment of cholera by the copious injection of aqueous and saline fluids into the veins. The Lancet. 1832; 18(457): 274–277.
7. Awad S, Allison SP, Lobo DN. The history of 0.9% saline. Clinical Nutrition. 2008; 27(2): 179–188.
8. Lewins R. Latest Communication from Dr. Lewins to the Secretary of the Central Board of Health. The Lancet. 1832; 18(457): 280.
9. Lewins R. Results of the injection practice in the Drummond Street hospital, Edinburgh. The Lancet. 1832; 18(457): 277.
10. Mackintosh J. Principles of pathology and practice of physic. 4th ed. London: Longman, Rees, Orme, Brown, & Green. 1836; 405–416.
11. Jennings CE. The intra -venous injection of fluid for severe haemorrhage. The Lancet. 1882; 120(3081): 436–437.
12. Ringer S. A further Contribution regarding the influence of the different Constituents of the Blood on the Contraction of the Heart. J Physiol. 1883; 4(1): 29–42. 3.
13. Hamburger HJ. A discourse on permeability in physiology and pathology. The Lancet. 1921; 198(5125): 1039–1045.
14. Evans GH. The abuse of normal salt solution. JAMA. 1911; LVII(27): 2126–2127.
15. Hartmann AF, Senn MJ. Studies in the metabolism of sodium r-lactate. I. Response of normal human subjects to the intravenous injection of sodium r-lactate. J Clin Invest. 1932; 11(2): 327–335.
16. Yunos NM, Bellomo R, Hegarty C, Story D, Ho L, Bailey M. Association between a chloride-liberal vs chloride-restrictive intravenous fluid administration strategy and kidney injury in critically ill adults. JAMA. 2012; 308(15): 1566–1572.
17. Handy JM, Soni N. Physiological effects of hyperchloraemia and acidosis. British journal of anaesthesia. 2008; 101(2): 141–150.
18. Neto AS, Loeches IM, Klanderman RB, Silva RF, Gama de Abreu M, Pelosi P, Schultz MJ. Balanced versus isotonic saline resuscitation – a systematic review and meta-analysis of randomized controlled trials in operation rooms and intensive care units. Annals of Translational Medicine. 2017; 5(16): 323–323.
19. Hogan JJ. The intravenous use of colloidal (gelatin) solutions in shock. JAMA. 1915; LXIV(9): 721–726.
20. Caironi P, Gattinoni L. The clinical use of albumin: the point of view of a specialist in intensive care. Blood Transfus. 2009; 7(4): 259–267.
21. Grönwall A, Ingelman B. The Introduction of Dextran as a Plasma Substitute. Vox Sanguinis. 1984; 47(1): 96–99.
22. Clemmesen C, Nilsson E. Therapeutic trends in the treatment of barbiturate poisoning. The Scandinavian method. Clin Pharmacol Ther. 1961; 2 : 220–229.
23. Kirkegaard A. Secondary Circulatory Shock in Rats with Severe Barbituric Acid Poisoning. Acta Pharmacologica et Toxicologica. 1952; 8(4): 315–328.
24. Nilsson E, Eyrich B. On Treatment of Barbiturate Poisoning. Acta Medica Scandinavica. 1950; 137(6): 381–389.
25. Ibsen B. From anaesthesia to anaesthesiology. Personal experiences in Copenhagen during the past 25 years. Chapter V The polio epidemic. Acta Anaesthesiol Scand Suppl. 1975; 61 : 21–28.
26. Shoemaker WC, Schluchter M, Hopkins JA, Appel PL, Schwartz S, Chang PC. Comparison of the relative effectiveness of colloids and crystalloids in emergency resuscitation. Am J Surg. 1981; 142(1): 73–84.
27. Alexander B, Odake K, Lawlor D, Swanger M. Coagulation, hemostasis, and plasma expanders: a quarter century enigma. Fed Proc. 1975; 34(6): 1429–1440.
28. Perner A, Haase N, Guttormsen AB, Tenhunen J, Klemenzson G, Åneman A, et al. Hydroxyethyl Starch 130/0.42 versus Ringer’s Acetate in Severe Sepsis. New England Journal of Medicine. 2012; 367(2): 124–134.
29. Bellmann R, Feistritzer C, Wiedermann CJ. Effect of molecular weight and substitution on tissue uptake of hydroxyethyl starch: a meta -analysis of clinical studies. Clin Pharmacokinet. 2012; 51(4): 225–236.
30. Westphal M, James MFM, Kozek -Langenecker S, Stocker R, Guidet, B, Van Aken H. Hydroxyethyl Starches. Anesthesiology. 2009; 111(1): 187–202.
31. Berger A. Cochrane Injuries Group Albumin Reviewers: Human albumin administration in critically ill patients: systematic review of randomised controlled trials. BMJ (Clinical Research Ed.). 1998; 317(7153): 235–240.
32. Finfer S, Bellomo R, Boyce N, French J, Myburgh J, Norton R. The SAFE Study Investigators: A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N Engl J Med 2004; 350(22): 2247–2256.
33. Caironi P, Tognoni G, Masson S, Fumagalli R, Pesenti A, Romero M, et al. Albumin Replacement in Patients with Severe Sepsis or Septic Shock. New England Journal of Medicine. 2014; 370(15): 1412–1421.
34. Myburgh J, Cooper DJ, Finfer S, Bellomo R, Norton R, Bishop N, et al. Saline or Albumin for Fluid Resuscitation in Patients with Traumatic Brain Injury. New England Journal of Medicine. 2007; 357(9): 874–884.
35. Brunkhorst F, Engel Ch, Bloos F, Meier -Hellmann A, Ragaller M, Weiler N, et al. Intensive Insulin Therapy and Pentastarch Resuscitation in Severe Sepsis. N Engl J Med. 2008; 358(2): 125–139.
36. Myburgh JA, Finfer S, Bellomo R, Billot L, Cass A, Gattas D… Webb SAR. Hydroxyethyl Starch or Saline for Fluid Resuscitation in Intensive Care. N Engl J Med. 2012; 367(20): 1901–1911.
37. Annane D. Effects of Fluid Resuscitation With Colloids vs Crystalloids on Mortality in Critically Ill Patients Presenting With Hypovolemic Shock. JAMA. 2013; 310(17): 1809.
38. Annane D, Fuchs -Buder T, Zoellner C, Kaukonen M, Scheeren TWL. EMA recommendation to suspend HES is hazardous. The Lancet. 2018; 391(10122): 736–738.
39. Maitland K, Kiguli S, Opoka RO, Engoru C, Olupot -Olupot P, Akech SO, Nyeko R, Mtove G, Reyburn H, Lang T, Brent B, Evans JA, Tibenderana JK, Crawley J, Russell EC, Levin M, Babiker AG, Gibb DM. Mortality after fluid bolus in African children with severe infection. N Engl J Med. 2011; 364 : 2483–2495.
40. Andrews B, Semler MW, Muchemwa L, Kelly P, Lakhi S, Heimburger DC, Mabula C, Bwalya M, Bernard GR. Effect of an Early Resuscitation Protocol on In -hospital Mortality Among Adults With Sepsis and Hypotension: A Randomized Clinical Trial. JAMA. 2017; 318 : 1233–1240.
41. Hjortrup PB, Haase N, Bundgaard H, Thomsen SL, Winding R, Pettila V, Aaen A, Lodahl D, Berthelsen RE, Christensen H, Madsen MB, Winkel P, Wetterslev J, Perner A. Restricting volumes of resuscitation fluid in adults with septic shock after initial management: the CLASSIC randomised, parallel -group, multicentre feasibility trial. Intensive Care Med. 2016; 42(11): 1695–1705.
42. Silversides JA, Major E, Ferguson AJ, Mann EE, McAuley DF, Marshall JC, et al. Conservative fluid management or deresuscitation for patients with sepsis or acute respiratory distress syndrome following the resuscitation phase of critical illness: a systematic review and meta -analysis. Intensive Care Medicine. 2017; 43(2): 155–170.
43. Meyhoff TS, Hjortrup PB, Møller MH, Wetterslev J, Lange T, Kjaer MN, et al. Conservative vs liberal fluid therapy in septic shock (CLASSIC) trial-Protocol and statistical analysis plan. Acta Anaesthesiol Scand. 2019; 63(9): 1262–1271.
44. Hippensteel JA, Uchimido R, Tyler PD, Burke RC, Han X, Zhang F, et al. Intravenous fluid resuscitation is associated with septic endothelial glycocalyx degradation. Crit Care. 2019; 23(1): 259.
45. Yunos NM, Bellomo R, Story D, Kellum J. Bench -to -bedside review: Chloride in critical illness. Crit Care. 2010; 14(4): 226.
46. Nadeem A, Salahuddin N, El Hazmi A, Joseph M, Bohlega B, Sallam H, et al. Chloride - -liberal fluids are associated with acute kidney injury after liver transplantation. Crit Care. 2014; 18(6): 625.
47. Martin G, Bennett -Guererro E, Wakeling H, Mythen MG, El -Moalem H, Robertson K, Kucmeroski D, Gan TJ. A prospective, randomized comparison of thromboelastographic coagulation profile in patients receiving lactated Ringer’s solution, 6% hetastarch in a balanced-saline vehicle, or 6% hetastarch in saline during major surgery. J Cardiothorac Vasc Anesth. 2002; 16(4): 441–446.
48. Kellum JA, Song M, Venkataraman R. Effects of hyperchloremic acidosis on arterial pressure and circulating inflammatory molecules in experimental sepsis. Chest. 2004; 125(1): 243–248.
49. Nalos M, Leverve X, Huang S, Weisbrodt L, Parkin R, Seppelt I, Ting I, Mclean A. Half-molar sodium lactate infusion improves cardiac performance in acute heart failure: a pilot randomised controlled clinical trial. Crit Care. 2014; 25; 18(2): R48.
50. Semler MW, Self WH, Wanderer JP, Ehrenfeld JM, Wang L, Byrne DW, et al. Balanced Crystalloids versus Saline in Critically Ill Adults. New England Journal of Medicine. 2018; 378(9): 829–839.
51. Matějovič M, Horák J, Harazim M, Karvunidis T, Raděj J, Novák I. Tekutinová léčba u akutních stavů pro neintenzivisty. Vnitř Lék. 2019; 65(3): 187–192.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2020 Issue 1-2-
All articles in this issue
- Pandemie COVID-19 – jenom rizika a negativní dopady nebo i příležitosti?
- Zajištění dýchacích cest v přednemocniční péči dospělých – to tube or not to tube?
- Náš článek po 10 letech: Intraoperative fluid optimization using stroke volume variation in high risk surgical patients: results of prospective randomized study
- Sedace v intenzivní péči – část I.
- Historický přehled tekutinové terapie
- Fasciální prostory trupu ve vztahu k regionální anestezii – část první: fasciální prostory hrudníku ve vztahu k regionální anestezii
- Plicní alveolární proteinóza: opakovaná oboustranná celoplicní laváž s podporou mimotělní membránové oxygenace
- Příjem a třídění pacientů se suspektním nebo potvrzeným COVID-19
- Obecné zásady péče o pacienta s COVID-19 na pracovišti intenzivní péče
- Perioperační péče o pacientky podstupující císařský řez
- Kardiopulmonální resuscitace pacientů se suspektním nebo potvrzeným COVID-19
- Protektivní ventilace u chirurgicky nemocných pacientů: doporučení mezinárodního expertního panelu
- Cílená regulace tělesné teploty: konsenzuální stanovisko mezioborové pracovní skupiny k použití metody „targeted temperature management“ u dospělých pacientů v intenzivní péči
- Mezinárodní konsenzuální stanovisko k použití uterotonik v průběhu císařského řezu
- Glykemie, mozkové neurotransmitery a možný vztah k pooperační kognitivní poruše?
- European Diploma in Regional Anaesthesia and Acute Pain Management – EDRA
- Prof. MUDr. Danuše Táborská, DrSc. 22. 12. 1928 – 6. 4. 2020
- Životní jubileum emeritního primáře MUDr. Jana Řezáče
- Zajímavosti, tipy a triky, informace z jiných oborů
- Elevace vysoce senzitivního troponinu u stavů mimo akutní koronární syndrom – výzva pro lékaře urgentního příjmu
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sedace v intenzivní péči – část I.
- Zajištění dýchacích cest v přednemocniční péči dospělých – to tube or not to tube?
- Perioperační péče o pacientky podstupující císařský řez
- Obecné zásady péče o pacienta s COVID-19 na pracovišti intenzivní péče
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

