-
Medical journals
- Career
Pooperační nauzea a zvracení u dětí
Authors: M. Frelich 1,2; J. Divák 1,2; R. Kula 1,2
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní medicíny FN Ostrava 1; Lékařská fakulta, Ostravská univerzita v Ostravě 2
Published in: Anest. intenziv. Med., 27, 2016, č. 4, s. 214-221
Category: Anesthesiology - Review Article
Overview
Prevence a léčba pooperační nauzey a zvracení (PONV) spolu s tišením pooperační bolesti patří mezi dva základní pilíře pooperační péče o dětského pacienta. Incidence PONV u dětí není přesně známa, ale odhaduje se na dvojnásobek ve srovnání s dospělou populací. Podle literatury je incidence PONV v dětské populaci 9–42%. Rizikové faktory a predispozice jsou odlišné od dospělé populace. Důsledky PONV jsou: vyšší perioperační morbidita (dehiscence operační rány, krvácení, dehydratace atd.), prodloužení pobytu pacienta na dospávacím pokoji a celkové doby hospitalizace. V současné době se uplatňuje multimodální přístup k prevenci a léčbě PONV, který je založen na racionální kombinaci farmakologických a nefarmakologických postupů. Skórovací systém podle Eberharta umožní stratifikovat dětské pacienty podle míry rizika vzniku PONV a zvolit adekvátní profylaxi, eventuáulně léčbu. Vedle vyhodnocení rizika PONV s nasazením patřičné farmakologické profylaxe (je-li indikována) může snížit výskyt PONV vhodná volba anesteziologických technik: totální intravenózní anestezie (TIVA, s využitím antiemetogenního účinku propofolu) nebo regionální anestezie (opiod-sparing efekt). K dispozici je celá řada preparátů působících přes různé receptorové systémy CNS: antagonisté 5-HT3 receptorů, receptorů D2, muskarinových receptorů atd. Cílem účinné prevence a léčby je snaha o co nejnižší výskyt této relativně nezávažné, o to však subjektivně špatně vnímané komplikace operačního výkonu.
Klíčová slova:
pooperační nauzea a zvracení – dětská anestezie – ondansetron – dexametazon – droperidol – multimodální přístupÚVOD
Pooperační nauzea a zvracení (PostOperative Nausea and Vomiting, PONV) je definována jako nauzea nebo zvracení, které se objeví během 24 hodin od výkonu v celkové anestezii. Jedná se o vedoucí příčinu morbidity pediatrických pacientů v časném pooperačním období [1]. I přes pokrok v anesteziologických technikách a přes použití moderních anesteziologických farmak je incidence PONV stále vysoká [2]. Zájem o tuto problematiku není příliš vysoký, důvodem je relativní „nezávažnost“ této pooperační komplikace.
PONV vede k prodloužení doby pobytu na PACU (PostAnesthesia Care Unit), celkové doby hospitalizace a konečně k opakovanému přijetí do zdravotnického zařízení [2, 3, 4]. Výsledkem je zvýšení nákladů na zdravotní péči [5]. Dalším následkem pooperačního zvracení je zvýšená perioperační morbidita spojená s možností dehiscence operační rány, pooperačního krvácení, dehydratace a vzácně také aspirace do plic [1, 6, 7]. V současné době existuje pouze velmi málo přehledových článků věnujících se problematice PONV pediatrických pacientů, a to i přesto, že v této skupině je PONV daleko častější komplikací celkové anestezie ve srovnání s dospělou populací. Předložená práce poskytuje přehled poznatků o problematice PONV u dětských pacientů.
INCIDENCE PONV u PEDIATRICKÝCH PACIENTŮ
Určit přesnou incidenci PONV u dětí je velmi obtížné. Nauzea, jako zcela subjektivní prožitek, je nejmladšími věkovými skupinami (v rámci vnímaného diskomfortu) velmi obtížně verbalizována a zachycena. Skutečná incidence PONV bude tedy patrně ještě daleko vyšší [1]. Z tohoto důvodu řada autorů pracuje pouze s termínem pooperační zvracení (PostOperative Vomiting – POV), který hodnotí přítomnost a počet epizod zvracení, které lze samozřejmě velmi snadno objektivizovat a kvantifikovat.
Podle literatury se incidence pooperačního zvracení pohybuje okolo 30 %, incidence pooperační nauzey bývá 50%, nicméně v podskupinách vysoce rizikových pacientů stoupá incidence PONV až k 80 % [5]. Obecně je v pediatrické populaci výskyt PONV dvojnásobný ve srovnání s dospělými pacienty. Potřeba profylaxe a případně rescue terapie je proto proti dospělým ještě naléhavější [8, 9, 10]. Další práce uvádějí incidenci PONV s velkou variabilitou, která se pohybuje mezi 8,9–42 % [1]. V případě chirurgické korekce strabismu a adenotonzilektomie (tedy u vysoce emetogenních operačních výkonů) dosahuje incidence POV až k 85 % [11].
PATOFYZIOLOGIE
Zvracení je ochranný reflex, jehož primárním účelem je eliminace toxinů z organismu prostřednictvím expulze žaludečního obsahu dutinou ústní. Mimo nauzey a zvracení jako součásti klinického obrazu určitého onemocnění (např. onemocnění GITu) je v moderní medicíně nauzea a zvracení komplikací onkologické terapie (Chemotherapy-Induced Nausea and Vomiting – CINV) a chirurgických výkonů v celkové anestezii (PONV). CINV i PONV spolu sdílejí celou řadu mechanismů patogeneze zvracení. Aktivace samotného zvracení probíhá zejména z mechano - a chemoreceptorů gastrointestinálního traktu a chemorecepční spouštěcí oblasti, která leží v area postrema na spodině IV. komory mozkové mimo hematoencefalickou bariéru (to má význam v citlivosti oblasti vůči případným toxinům v krvi). Vestibulární aparát, mozková kůra a thalamus jsou další místa možné aktivace. Samotná signální transdukce do centra pro zvracení, které je ústředním motorem emeze, je zprostředkována celou řadou neurotransmiterů (serotoninem, histaminem, acetylcholinem, substancí P atd.), které se vážou na své příslušné receptory. Farmaka působící antagonisticky na specifických receptorech jsou účinnou cestou k profylaxi a léčbě PONV.
Centrum pro zvracení řídí a integruje vlastní akt zvracení. Eferentace probíhá přes n. phrenicus (kontrakce bránice), nervi spinales ke svalovině břicha a mezižeberních svalů (kontrakce těchto svalů) a konečně k žaludku a jícnu (dilatace dolního jícnového svěrače, antiperistaltická vlna). Celý akt zvracení je vysoce koordinovaný a jednotlivé kroky na sebe místně a časově navazují.
V případě zmiňovaných vysoce emetogenních operačních výkonů, které jsou charakteristické právě pro dětskou populaci pacientů (tonzilektomie (adenotomie) a chirurgická korekce strabismu) se v obecné patofyziologii PONV uplatňuje spolykaná krev po tonzilektomiích a stimulace okohybných svalů při korekci strabismu s možností aktivace okulokardiálního reflexu (nervus vagus) [1].
Multifaktoriální etiologie PONV
Etiologie PONV je multifaktoriální a přesné příčiny nejsou doposud známé. Existují individuální, chirurgické a anesteziologické rizikové faktory, které se do velké míry podílejí na vzniku nauzey a zvracení v pooperačním období. Některé z nich byly identifikovány jako nezávislé prediktory výskytu PONV (viz dále):
- Individuální rizikové faktory: věk nad 3 roky, historie PONV v osobní anamnéze či u sourozenců, do puberty není rozdíl mezi mužským a ženským pohlavím [12].
- Anesteziologické rizikové faktory: použití inhalačních anestetik – jsou zodpovědná za časnou PONV v prvních 2 hodinách po operačním výkonu [13].
- Chirurgické rizikové faktory: délka výkonu nad 30 min, chirurgická korekce strabismu, tonzilektomie (adenotomie).
Stratifikace rizik a identifikace rizikových dětí z pohledu incidence PONV
Pro populaci dospělých chirurgických pacientů existuje několik skórovacích systémů k predikci incidence PONV. Jejich přímá aplikace na dětské pacienty je však problematická pro obtížnou vyšetřitelnost některých rizikových faktorů. Jiné nelze u dětí aplikovat vůbec [14]. Jedním z příkladů silných rizikových faktorů PONV je historie pooperační nauzey a zvracení v osobní anamnéze. U dětských pacientů, kteří často podstupují svůj první výkon v celkové anestezii, má tak automaticky negativní osobní anamnézu PONV. Nekuřáctví (zejména u žen) je rovněž významným rizikovým faktorem pro výskyt PONV, tento údaj rovněž u dětské populace nelze aplikovat. Rozsáhlou statistickou analýzou skórovacích systémů pro dospělou populaci se tedy zjistilo, že skórovací systémy pro dospělou populaci nejsou schopny dostatečně přesně predikovat a kvantifikovat míru rizika PONV u dětských pacientů [14].
Stěžejní práci ve stanovení rizikových faktorů a predispozic dětí k POV provedl Eberhart et al. v roce 2004. Jedná se o prospektivní studii, do které bylo zařazeno 1401 pacientů ve věku 0–14 let podstupujících elektivní operační výkony ve dvou univerzitních nemocnicích ve sledovaném období 22 měsíců. Finální analýza této práce stanovila 4 nezávislé rizikové faktory POV: délka chirurgického výkonu nad 30 min, věk nad 3 roky, operace strabismu a anamnéza POV v osobní či rodinné anamnéze. Na základě přítomnosti či naopak nepřítomnosti výše zmíněných rizikových faktorů se stanovuje POVOC skóre (PostOperative VOmiting in Children) (tab. 1, graf 1). Kranke et al provedl validizaci tohoto skóre, přičemž zjistil obdobnou incidenci POV. Pacienti v Krankeho studii byli bez jakékoliv PONV profylaxe a v této práci nebyli zařazeni pediatričtí pacienti podstupující chirurgickou korekci strabismu, čímž ubyl jeden rizikový faktor [5]. Výsledky obou prací jsou tedy ve vzájemné shodě, a Krankeho práce tak podporuje dřívější doporučení k užití Eberhartova POVOC skóre k stratifikaci rizika PONV u pediatrické populace [15].
Table 1. POVOC skóre a riziko vzniku POV 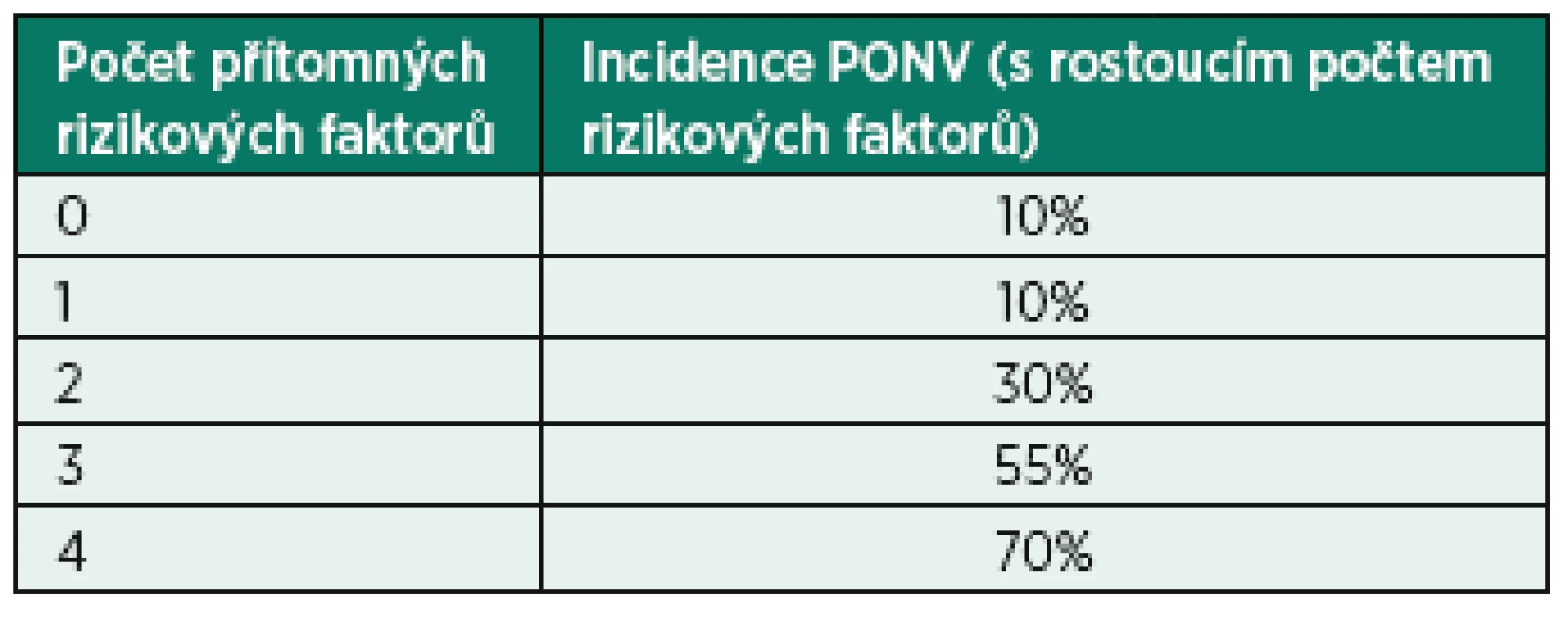
Graph 1. POVOC skóre a procento rizika vzniku POV 
POVOC – PostOperative VOmiting in Children (volně podle [14]) Skóre sleduje výskyt čtyř rizikových faktorů: věk nad tři roky, délka výkonu nad 30 minut, operace strabismu, výskyt POV v rodině.
FARMAKOLOGICKÁ PROFYLAXE PONV
Dexametazon
Dexametazon je vysoce účinný lék v prevenci PONV u dětských pacientů v monoterapii nebo v kombinaci se setrony [16]. Jeho efektivita byla prokázána v celé řadě prací, v případě tonzilektomií je užití dexametazonu spojeno s redukcí incidence PONV v prvních 24 hod po operačním výkonu o 50 % [17]. Další práce referují snížení incidence PONV z 71 % na 40 % při užití profylaktické dávky dexametazonu [18].
Otázkou zůstává stanovení nejnižší efektivní dávky dexametazonu z obav z možných nežádoucích účinků kortikoidů. Doporučené dávkování dexametazonu je 0,15 mg/kg (podle FDA maximálně jednotlivá dávka 5 mg) dítěte intravenózně, a to ihned po úvodu do celkové anestezie či po zajištění intravenózního vstupu [16, 17, 18].
Přesný mechanismus účinku dexametazonu v redukci PONV není znám. Recentní experimentální práce prokazují účinek prostřednictvím vazby dexametazonu na glukokortikoidní receptory v tractus solitarius v mozkovém kmeni. Dalším možným vysvětlením je centrální inhibice syntézy prostaglandinů, redukce centrální serotoninové aktivity a konečně změna permeability hematoencefalické bariéry. V úvahu přichází i silný protizánětlivý efekt dexametazonu, který tlumí zánětlivou reakci v operačním poli a celkový prozánětlivý vliv operačního výkonu na celý organismus. Dexametazon rovněž zvyšuje syntézu endorfinu a dalších endogenních substancí, čímž zlepšuje náladu a chuť do jídla [2].
Zvýšení glykemie, zpomalení hojení operační rány či krvácení jsou klasické příklady možných komplikací v souvislosti s léčbou kortikoidy, avšak po jednorázovém podání v nízké dávce nemají v literatuře dostatečnou podporu. Zdokumentovanou, naštěstí však velmi vzácnou, komplikací po podání dexametazonu je vznik tumor-lysis syndromu u dětí s malignitami (např. ALL). Tumor-lysis syndrom je charakterizován rozpadem velkého množství nádorových buněk po podání chemoterapie či dexametazonu. Je charakterizován hyperkalémií, těžkou laktátovou acidózou, hyperfostatémií a hyperurikémií. Je popsán smrtelný průběh tohoto syndromu u 3letého chlapce podstupujícího adenotonzilektomii pro syndrom spánkové apnoe a recidivující infekty HCD po podání dexametazonu v indikaci prevence PONV [19, 20, 21].
Setrony
Skupina potentních antiemetik původně určená pro léčbu nauzey a zvracení u pacientů v souvislosti s podáním chemoterapie – CINV. Chemoterapie stimuluje uvolnění serotoninu z enterochromafinních buněk, který přes stimulaci n. vagus a spinálních nervů cestou k tractus solitarius a area postrema má proemetogenní efekt. Setrony fungují v blokádě receptorů 5-HT3 jak na centrální (chemorecepční spouštěcí zóna, centrum pro zvracení), tak na periferní úrovni (GIT) [22, 23].
Ondansetron je bezpečné antiemetikum první volby pediatrických pacientů v prevenci a léčbě PONV [24, 25, 26, 27]. Ondansetron je jediný zástupce antagonistů 5-HT3 receptorů, který je schválený FDA k použití u dětí od 1 měsíce věku [28]. Dávkovacích schémat je celá řada, ale jako racionální a většinou autorů uznávané dávkování je 0,1–0,15 mg/kg dítěte intravenózně s maximální jednotlivou dávkou 4 mg [29]. Nejnovější data zabývající se farmakokinetikou ondansetronu ukázala jeho sníženou clearance u nejmladších věkových skupin dětí, a to o 76 %, 53 % a 31 % ve věku 1, 3 a 6 měsíců. Farmakokinetické simulace dále ukázaly, že dávka 0,1 mg/kg u dítěte mladšího 6 měsíců navodí stejnou hladinu léku v krvi jako dávka 0,15 mg/kg u starších dětí. Příčinou je zejména nevyzrálost jaterních cytochromů P450 CYP3A4 a CYP1A2, které jsou zodpovědné za jeho biotransformaci. Autoři práce doporučují při podání ondansetronu dětem mladším 4 měsíců podrobnější sledování, nicméně bez nějakých specifických doporučení či opatření [30]. Časování aplikace není podle současné úrovně poznatků podstatné. Není důkaz pro rozdílnou efektivitu ondansetronu v podání před úvodem do celkové anestezie, během operačního výkonu či po něm ve snížení incidence PONV [16].
Ondansetron je tedy vysoce účinný lék k prevenci a léčbě nauzey a zvracení u dospělých a dětských pacientů po chemoterapii [31], radioterapii [32] a v pooperačním období [33, 34, 35, 36]. V prevenci PONV je účinnější ve srovnání s droperidolem či metoklopramidem [16].
Běžnými nežádoucími účinky po podání ondansetronu jsou bolesti hlavy, nevýznamná elevace jaterních enzymů a zácpa [5]. Vzácnou komplikací je prodloužení QT intervalu s možností vzniku torsades de pointes (TdP). V literatuře je popsána ventrikulární tachykardie u 11letého pacienta podstupujícího operační výkon v celkové anestezii poté, co byl aplikován ondansetron a dimenhydrinát [5].
V současné době jsou k dispozici i další zástupci 5-HT3 antagonistů (tab. 2). Všechny jsou vysoce účinné k profylaxi i jako rescue terapie pooperační nauzey a zvracení. Určitou nevýhodou je nedostatek klinických studií na jejich účinnost a bezpečnost v dětské anesteziologii ve srovnání s ondansetronem. Dolasetron je kontraindikován u dětí do 18 let věku z důvodu možnosti prodloužení QTc intervalu se vznikem maligních arytmií, akutního infarktu myokardu či srdeční zástavy [16].
Table 2. Zástupci setronů [16] ![Zástupci setronů [16]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5d8d2e4df32ecd6c1bb6fd8aea3db4b6.png)
V souvislosti s rutinním používáním antiemetik, které prodlužují QT interval (setrony, droperidol, metoklopramid) se dostává do popředí otázka syndromu prodlouženého QT intervalu – LQT. Prodloužení QT intervalu je spojeno s vyšším rizikem vzniku torsade de pointes (TdP), polymorfních komorových tachykardií, které mohou způsobit náhlou smrt pacienta. Rozlišujeme dvě skupiny příčin prodloužení QT intervalu – vrozené a získané.
Vrozené prodloužení QT intervalu (congenital Long QT Syndrom – LQTS) je soubor genetických onemocnění s incidencí okolo 1 : 2 500 dětí. Jejich podstatou jsou geneticky podmíněné defekty draslíkových (LQTS 1, LQTS 2) či sodíkových kanálů (LQTS 3, LQTS 4) s abnormalitami repolarizace myokardu. Diagnóza je většinou náhodná při provedení EKG, či se syndrom manifestuje benigní synkopou či primo záchytem závažné arytmie. Setrony a droperidol jsou u pacientů s prodlouženým QT intervalem kontraindikované pro možnost dalšího prodloužení a vzniku TdP. Ze získaných stavů, které potenciálně vedou k prodloužení QT intervalu, jsou to iontové dysbalance a celá řada farmak spolu s jejich interakcemi. Přesný výčet a charakteristika interakcí je mimo hranice sdělení, je ovšem nutné na tyto možnosti v rámci podávání antiemetik pomýšlet a zvážit případná rizika.
Droperidol
Droperidol je lék ze skupiny butyrofenonů s vynikajícím antiemetickým účinkem. V anesteziologii zažívá svou renesanci po překonání obav z prodloužení QT intervalu a možnosti vzniku maligních arytmií, což je důsledek aplikace velkých dávek, které v rámci prevence a léčby PONV nemají opodstatnění. Hlavní mechanismus účinku droperidolu je blokáda D2-receptorů v chemorecepční spouštěcí zóně v area postrema. Druhým, daleko slabším účinkem je jeho α1-adrenolytická aktivita, která může být zodpovědná za přechodnou hypotenzi po jeho podání.
Odlišný mechanismus účinku droperidolu od setronů a dexametazonu, předurčuje jeho pozici jako rescue terapii protrahovaného pooperačního zvracení, které nereaguje na úvodní léčbu ondansetronem (s dexametazonem či bez něj). V doporučeném dávkování 10–20 µg/kg intravenózně (maximální dávka 1,25 mg i. v.) je zcela bezpečný a nevede k signifikantnímu prodloužení QT intervalu či extrapyramidovým projevům [37].
Antagonisté NK1-receptoru
Je to nová a velmi potentní skupina antiemetik s dlouhým účinkem a možností perorálního podání. NK1 receptory jsou široce zastoupeny v aferentních drahách n. vagus a v nucleus solitarius v mozkovém kmeni. Přirozeným ligandem těchto receptorů je substance P. Základním zástupcem této skupiny antagonistů NK1 receptorů je aprepitant. Aprepitant vykazuje obdobný účinek srovnatelný s ondansetronem v dosažení stavu bez žádné epizody zvracení prvních 24 hod po operačním výkonu, nicméně v období od 24 hod do 48 hod je aprepitant statisticky signifikantně účinnější ve srovnání s ondansetronem [38, 39]. Dosud však nebyla provedena žádná klinická studie k ověření účinnosti a bezpečnosti této skupiny antiemetik u pediatrické populace a z tohoto důvodu jejich použití v profylaxi a léčbě PONV nelze doporučit.
PRAKTICKÝ PŘÍSTUP K DĚTSKÉMU PACIENTOVI
Každý pediatrický pacient podstupující operační či diagnostický výkon v celkové anestezii by měl být posouzen anesteziologem k určení míry rizika PONV (skóre podle Eberharta). Na základě míry rizika pak lze užít farmakologické či nefarmakologické intervence k profylaxi vzniku PONV. Plošná PONV profylaxe není indikována, zejména u dětí s nízkým rizikem pooperační nauzey a zvracení, kdy mohou potenciální vedlejší účinky antiemetik převýšit jejich benefit pro pacienta. Určitou výjimkou je skupina pacientů v malém riziku PONV, nicméně se závažnými důsledky při jejím vzniku: intermaxilární fixace po stomatochirurgických výkonech, anastomózy střevní a u dětí s rizikem prudkého nárůstu intrakraniálního tlaku [12].
Recentní přístup k prevenci a léčbě PONV je kombinace antiemetik působících přes různé receptorové systémy a aplikace tzv. multimodálního přístupu [12]. Samozřejmou součástí praxe anesteziologa je minimalizovat základní rizika vzniku PONV. Nové práce prokázaly, že snížením baseline rizik dochází ke snížení skutečné incidence PONV u pediatrických pacientů [5]. To znamená, že anesteziolog je schopen reálně ovlivnit incidenci PONV způsobem vedení celkové anestezie navzdory celé řadě rizikových faktorů, které ovlivnit nelze (věk, typ chirurgického výkonu atd.). Jednou z velmi účinných cest jsou tzv. opiod-sparing techniky v podání celkové anestezie: zejména aplikace regionální anestezie, která sníží perioperační potřebu opioidů. To se projeví v poklesu incidence PONV [40, 41, 42].
Optimalizace tekutinového managementu je další slibnou, a nutno říci velmi jednoduchou, intervencí ke snížení incidence PONV. Goodarzi et al. prokázali u chirurgické korekce strabismu snížení počtu epizod zvracení u skupiny dětí, které byly hydratovány během operačního výkonu krystaloidním roztokem rychlostí 30 ml/kg/hod intravenózně ve srovnání se skupinou, která byla hydratována pouze rychlostí 10 ml/kg/hod při jinak identickém anesteziologickém protokolu. Ke stejným výsledkům došel i Elgueta et al., který se však zabýval snížením incidence PONV po tonzilektomiích, nicméně ve stejném designu studie jako Goodarzi [43, 44].
Jako zcela neúčinné techniky ke snížení PONV se jeví rutinní zavádění nazogastrické sondy s dekompresí žaludku či omezení příjmu tekutin v pooperačním období. Použití N2O není asociováno s vyšším rizikem POV u dětských pacientů. U větších dětí jej tedy s výhodou lze využít jako součást nosné směsi plynů ke snížení spotřeby volatilních anestetik, která jsou majoritně zodpovědná za časnou PONV v prvních dvou hodinách od operačního výkonu [5, 13].
U dětí se středním rizikem vzniku PONV je vhodná profylaxe s využitím 1–2 intervencí. Jako velmi výhodná se jeví kombinace dexametazon plus ondansetron, která je na našem pracovišti nejčastěji užívanou kombinací. Další možnosti včetně dávkování jsou shrnuty v tabulce 3. U dětí s vysokým rizikem použijeme stejnou profylaxi jako u rizika středního, ke které přidáme další intervence v rámci tzv. multimodálního přístupu: je nutné zvážit možnost regionální anestezie, infuze subhypnotické dávky propofolu či TIVA. Praktický přístup – graf 2.
Table 3. Dávkovací schémata doporučených kombinací antiemetik v profylaxi PONV [4] ![Dávkovací schémata doporučených kombinací antiemetik v profylaxi PONV [4]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/85833b32f72d599decc46de3a20d8113.png)
Graph 2. Algoritmus stratifikace rizik incidence PONV a možné terapeutické intervence 
(zpracováno volně podle Gan et al. [5]) Velmi zajímavou možností v prevenci PONV je nefarmakologická profylaxe. V literatuře dobře popsaná metoda stimulace akupunkturního bodu P6 (akupunkturou, akupresurou či elektrickou/laserovou stimulací) vede ke snížení pooperační nauzey a zvracení. Není bez zajímavosti, že účinnost stimulace P6 bodu je srovnatelná s farmakologickou antiemetickou terapií [6]. Možným důvodem, proč se výše zmíněné nefarmakologické přístupy neetablovaly v tuzemské dětské anesteziologii, je jistý skepticismus, který nad metodami alternativní medicíny panuje.
LÉČBA POV
V případě již rozvinutého pooperačního zvracení přistupujeme k aktivní léčbě – rescue terapii s využitím identických preparátů jako v případě profylaxe: ondansetron v dávce 0,15 mg/kg i. v. v případě, že nebyl podán jako profylaxe, droperidol v dávce 10–15 µg/kg i. v. do maximální dávky 1,25 mg jako lék druhé volby, či byl-li podán ondansetron jako profylaxe PONV – není doporučován u dětí do 2 let věku. Ondansetron či droperidol lze znovu podat po 6hodinovém intervalu. Účinná je též subhypnotická dávka propofolu 0,1–0,3 mg/kg.
ZÁVĚR
Pooperační nauzea a zvracení je stále významným problémem perioperační péče o dětské pacienty. Základním předpokladem k řešení této komplikace je stratifikace rizika vzniku PONV u konkrétního dětského pacienta již před začátkem celkové anestezie a na základě tohoto vyhodnocení přijmout patřičná preventivní opatření – v rozsahu „wait and see“ až k multimodálnímu přístupu využívajícímu kombinaci antiemetik několika skupin u vysoce rizikových pacientů. Na prvním místě v prevenci a léčbě PONV zůstává ondansetron v kombinaci s dexametazonem. Samozřejmou součástí je redukce základních rizik, které by měl implementovat do své praxe každý anesteziolog k zajištění spokojenosti a komfortu dětského pacienta po operačním výkonu.
Prohlašuji, že zaslaná práce nebyla sponzorována a není předmětem střetu zájmů.
Do redakce došlo dne 25. 4. 2016.
Do tisku přijato dne 14. 6. 2016.
Adresa pro korespondenci:
MUDr. Michal Frelich
Klinika anesteziologie, resuscitacea intenzivní medicíny
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: michalfrelich@seznam.cz
Sources
1. Kovac, A. L. Management of postoperative nausea and vomiting in children. Pediatric Drugs, 2007, 9, 1, p. 47ľ69.
2. Chiu-Ming, H., Hsin-Lun, W., Shung-Thi, H. Dexamethasone prevents postoperative nausea and vomiting: benefit versus risk. Acta Anasthesiologica Taiwanica, 2011, 49, p. 100–104.
3. Rose, J. D., Watcha, M. F. Postoperative nausea and vomiting in paediatric patients. Br. J. Anaesth., 1999, 83, p. 104–117.
4. Gan, T. J., Sloan, F., Dear, G. How much are patients willing to pay to avoid postoperative nausea and vomiting? Anesth. Analg., 2001, 92, p. 393–400.
5. Gan, T. J., Diemunsch, P., Habib A. S. Consensus guidelines for the managment of postoperative nausea and vomiting. Anesth. Analg., 2014, 118, p. 85–113.
6. McCracken, G., Houston, P., Lefebvre, G. Guideline for the managment of postoperative nausea and vomitiv. J. Obstet. Gynaecol. Can., 2008, 30, p. 600–607.
7. Palazzo, M. G., Strunin, L. Anesthesia and emesis: 1. etiology. Can. Anaest. Soc. J., 1984, 31, p. 178–187.
8. Apfel, C. C., Läärä, E., Koivuranta, M. A simplified risk score for predicting postoperative nausea and vomiting: conclusions form cross-validations between two centers. Anesthesiology, 1999, 91, p. 693–700.
9. Koivuranta, M., Läärä, E., Snåre, L. A survey of postoperative nausea and vomiting. Anesthesiology, 1997, 52, p. 443–449.
10. Sinclair, D. R., Chung, F., Mezei, G. Can postoperative nausea and vomiting be predicted? Anesthesiology, 1999, 91, p. 109–118.
11. Abramowitz, M. D., Epstein, B. S., Ruttiman U. E. The antiemetic effect of droperidol following outpatient strabismus surgery in children. Anesthesiology, 1983, 59, p. 579–583.
12. Chatterjee, S., Rudra, A., Sengupta, S. Current concepts in the management of postoperative nausea and vomiting. Anesthesiology Research and Practice, 2011, ID 748031.
13. Apfel, C. C., Kranke, P., Katz, M. H. Volatile anaesthetics may be the main cause of early but not delayed posoperative vomiting, a randomised controlled trial of factorial design. Brit. J. Anaesth., 2002, 85, p. 659–668.
14. Eberhart, L. H., Geldner, G., Kranke, P. The development & validation of a risk score to predict the probability of postoperative vomiting in pediatric patients. Anesth. Analg., 2004, p. 1630–1637.
15. Hill, R. P. et al. Cost-effectiveness of prophylactic antiemetic therapy with ondansetron, droperidol, or placebo. The Journal of the American Society of Anesthesiologists, 2000, 92, 4, p. 958–967.
16. Carr, A. S. et al. Guidelines on the prevention of postoperative vomiting in children. The Association of Paediatric Anaesthetists of Great Britain and Ireland Spring, 2009.
17. Steward, D. L., Grisel, J., Meinzen-Derr, J. Steroids for improving recovery following tonsillectomy in children. Cochrane Database Syst. Rev., 2011, 8.
18. Splinter, W. M., Robetrs, D. J. Dexamethasone decreases vomiting by children after tonsillectomy. Anesthesia & Analgesia, 1996, 83, 5, p. 913–916.
19. Dhingra, K., Newcom, S. R. Acute tumor lysis syndrome in non-Hodgkin lymphoma induced by dexamethasone. American Journal of Hematology, 1988, 29, 2, p. 115–116.
20. Osthaus, W. A. et al. Tumor lysis associated with dexamethasone use in a child with leukemia. Pediatric Anesthesia, 2008, 18, 3, p. 268–270.
21. McDonell, C. et al. Fatal peri-operative acute tumour lysis syndrome precipitated by dexamethasone. Anaesthesia, 2008, 63, 6, p. 652–655.
22. Gregory, R. E., Ettinger, D. S. 5-HT3 receptor antagonists for the prevention of chemotherapy-induced nausea and vomiting. Drugs, 1998, 55, 2, p. 173–189.
23. Hesketh, P. J. Chemotherapy-induced nausea and vomiting. New England Journal of Medicine, 2008, 358, 23, p. 482–494.
24. Culy, Ch. R., Bhana, N., Plosker, G. L. Ondansetron. Paediatric drugs, 2001, 3, 6, p. 441–479.
25. Splinter, W. M., Rhine, E. J. Low-dose ondansetron with dexamethasone more effectively decreases vomiting after strabismus surgery in children than does high-dose ondansetron. The Journal of the American Society of Anesthesiologists, 1998, 88,1, p. 72–75.
26. Splinter, W. M. Prevention of vomiting after strabismus surgery in children: Dexamethasone alone versus dexamethasone plus low-dose ondansetron. Pediatric Anesthesia, 2001, 11, 5, p. 591–595.
27. Furst, S. R., Rodarte, A. Prophylactic antiemetic treatment with ondansetron in children undergoing tonsillectomy. Anesthesiology, 1994, 81, 4, p. 799–803.
28. Khalil, S. N. et al. A double-blind comparison of intravenous ondansetron and placebo for preventing postoperative emesis in 1-to 24-month-old pediatric patients after surgery under general anesthesia. Anesthesia & Analgesia, 2005, 101, 2, p. 356–361.
29. Figueredo, E. D., Canosa, L. G. Ondansetron in the prophylaxis of postoperative vomiting: a meta-analysis. Journal of Clinical Anesthesia, 1998, 10, 3, p. 211–221.
30. Mondick, J. T. et al. Population pharmacokinetics of intravenous ondansetron in oncology and surgical patients aged 1−48 months. European journal of Clinical Pharmacology, 2010, 66, 1, p. 77–86.
31. Schmoll, H. J. The role of ondansetron in the treatment of emesis induced by non-cisplatin-containing chemotherapy regimes. European journal of cancer & clinical oncology, 1988, 25, S35–39.
32. Priestman, T. J. Clinical studies with ondansetron in the control of radiation-induced emesis. European Journal of Cancer & Clinical Oncology, 1988, 25, S29–33.
33. Claybon, L. Single dose intravenous ondansetron for the 24-hour treatment of postoperative nausea and vomiting. Anaesthesia, 1994, 49, 1, p. 24–29.
34. Furst, S. R., Rodarte, A. Prophylactic antiemetic treatment with ondansetron in children undergoing tonsillectomy. Anesthesiology, 1994, 81, 4, p. 799–803.
35. Lawhorn, C. D. et al. A comparative-evaluation of ondansetron, droperidol and placebo in prevention of postoperative vomiting following tonsillectomy and adenoidectomy in the pediatric-patient. Anesthesiology, 227 East Washington SQ, Philadelfia, PA 19106: LIPPINCOTT-RAVEN PUBL, 1993. p. A1195-A1195.
36. Litman, R. S., WU, Ch. L., Cataranzo, F. A. Ondansetron decreases emesis after tonsillectomy in children. Anesthesia & Analgesia, 1994, 78, 3, p. 478–481.
37. Schoeter, E. et al. „Low-dose“ Droperidol-Gabe bei Kindern. Der Anaesthesist, 2012, 61,1, p. 30–34.
38. Diemunsch, P. et al. Single-dose aprepitant vs ondansetron for the prevention of postoperative nausea and vomiting: a randomized, double-blind phase III trial in patients undergoing open abdominal surgery. British Journal of Anaesthesia, 2007, 99, 2, p. 202–211.
39. Gan, Tong J. et al. A randomized, double-blind comparison of the NK1 antagonist, aprepitant, versus ondansetron for the prevention of postoperative nausea and vomiting. Anesthesia & Analgesia, 2007, 104,5, p. 1082–1089.
40. De Windt, A. C. et al. An opioid-free anaesthetic using nerve blocks enhances rapid recovery after minor hand surgery inchildren. European Journal of Anaesthesiology (EJA), 2010, 27, 6, p. 521–525.
41. Gupta, N. et al. A prospective randomised double blind study to evaluate the effect of peribulbar block or topical application of local anaesthesia combined with general anaesthesia on intra-operative and postoperative complications during paediatric strabismus surgery. Anaesthesia, 2007, 62, 11, p. 1110–1113.
42. Steib, A. et al. Effects of subtenon anesthesia combined with general anesthesia on perioperative analgesic requirements in pediatric strabismus surgery. Regional Anesthesia and Pain Medicine, 2005, 30, 5, p. 478–483.
43. Goodarzi, M. et al. A prospective randomized blinded study of the effect of intravenous fluid therapy on postoperative nausea and vomiting in children undergoing strabismus surgery. Pediatric Anesthesia, 2006, 16, 1, p. 49–53.
44. Elgueta, M. F. et al. Effect of intravenous fluid therapy on postoperative vomiting in children undergoing tonsillectomy. British Journal of Anaesthesia, 2013, 110, 4, p. 607–614.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2016 Issue 4-
All articles in this issue
- Několik poznámek klinických biochemiků k akutnímu poškození ledvin
- Je morfin stále indikován v léčbě kardiogenního plicního edému?
- Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
- Neopioidní analgetika v léčbě akutní pooperační bolesti
- Význam rotačnej tromboelastometrie (ROTEM) v manažmente perioperačného krvácania
- Specifika intervenční bronchologie z pohledu anesteziologa
- Pooperační nauzea a zvracení u dětí
- Novinky v kardiopulmonální resuscitaci v porodnictví
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Význam rotačnej tromboelastometrie (ROTEM) v manažmente perioperačného krvácania
- Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
- Pooperační nauzea a zvracení u dětí
- Novinky v kardiopulmonální resuscitaci v porodnictví
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

