-
Medical journals
- Career
Neopioidní analgetika v léčbě akutní pooperační bolesti
Authors: T. Gabrhelík 1,2; M. Pieran 2; J. Lejčko 3
Authors‘ workplace: Anesteziologicko-resuscitační oddělení Krajské nemocnice Tomáše Bati Zlín, a. s., Zlín 1; Klinika anesteziologie, resuscitace a intenzivní medicíny FN a LF UP v Olomouci 2; Klinika anesteziologie, resuscitace a intenzivní medicíny FN Plzeň 3
Published in: Anest. intenziv. Med., 27, 2016, č. 4, s. 252-258
Category:
Overview
Akutní bolest provází každý operační či diagnostický výkon a její léčba je samozřejmou součástí perioperační péče o pacienty. V současné době máme k dispozici dostatek léků a analgetických postupů, aby byl tento požadavek splněn. Moderní trendy v léčbě pooperační bolesti využívají postupy multimodální analgezie, které jsou specifické podle typu operačního výkonu. Cílem těchto postupů je adekvátní léčba pooperační bolesti s minimem nežádoucích účinků. Neopioidní analgetika jsou základním pilířem léčby akutní bolesti. Jejich správné používání zvyšuje kvalitu i bezpečnost analgetických postupů v naší praxi.
Klíčová slova:
akutní bolest – multimodální analgezie – analgezie podle typu výkonů – neopioidní analgetika1 ÚVOD
Bolest provází většinu chorob a je jedním z nejčastějších příznaků, pro které jsou lékaři konzultováni. Akutní bolest je symptomem, který naléhavě informuje organismus o hrozícím tkáňovém inzultu. Jedná se o nepříjemný senzorický, emoční a mentální prožitek spojený se strachem, úzkostí a fylogeneticky starou obrannou nebo únikovou vegetativní reakcí. Cíle léčby akutní bolesti jsou jednoduché – odstranění příčiny bolesti, léčba bolesti samotné a včasná mobilizace a rehabilitace pacienta. Neadekvátně léčená akutní bolest může vést na podkladě periferní a centrální senzitizace nervového systému k chronifikaci bolesti (neuroplasticita).
Pooperační bolest je typickým příkladem akutní bolesti. V posledních letech se v České republice podá více než 800 tisíc celkových a regionálních anestezií ročně. Každý z operačních či diagnostických výkonů je spojen s větší či menší pooperační bolestí. Strach z pooperačních bolestí patří oprávněně mezi nejvýznamnější obavy pacientů chystajících se k operaci. Z řady studií ze zemí s vysoce rozvinutým zdravotnictvím je zřejmé, že ani v první dekádě 21. století není u 20–36 % pacientů pooperační bolest dobře tlumena [Ševčík, 2014].
Základním pilířem léčby akutní pooperační bolesti je široký, chemicky nesourodý soubor neopioidních analgetik. Řada léčiv z této skupiny má poměrně silnou analgetickou potenci. Všechna neopioidní analgetika však mají tzv. stropový efekt, kdy zvyšování dávky nad doporučené dávkování nevede ke zlepšení analgezie. Jejich účinek však lze u silných bolestí značně posílit jejich vzájemnými kombinacemi nebo souběžným používáním s analgetiky jiných lékových skupin (opioidy, antiepileptika a další). Mezi neopioidní analgetika používaná v léčbě akutní pooperační bolesti patří především paracetamol, metamizol a nesteroidní antiflogistika (NSA).
2 MECHANISMUS ÚČINKU
Paracetamol je velmi slabým inhibitorem COX a prakticky nemá periferní analgetický účinek. Přesný mechanismus účinku paracetamolu není znám, zkoumáno je jeho působení na serotoninergní a kanabinoidní systémy nebo na ovlivnění produkce oxidu dusnatého na úrovni zadních rohů míšních nebo na supraspinální úrovni. Jeho účinnost je u zánětlivé bolesti nižší než v případě NSA, jeho bezpečnostní profil jej však činí metodou volby při zahájení analgetické terapie.
Protizánětlivý, analgetický a antipyretický účinek NSA spočívá v inhibici cyklooxygenázy a tím i tvorby prostaglandinů. Poprvé byl tento mechanismus popsán Johnem Vanem v 70. letech minulého století u kyseliny acetylsalicylové [Vane et al., 1998]. Prostaglandiny, které vznikají za účasti cyklooxygenázy, mají v tkáních řadu biologických účinků. Mají mimo jiné úlohu v ochraně žaludeční sliznice (zvyšují tvorbu hlenu a snižují sekreci HCl), u zánětu působí vazodilataci, zvyšují permeabilitu kapilár a nastavení termoregulačního centra, ale především zvyšují citlivost receptorů pro bolest.
Popsány jsou dvě izoformy cyklooxygenázy. Cyklooxygenáza-1 (COX-1) je produkována v tkáních konstitutivně (především trombocyty, játra, ledviny a buňky žaludeční sliznice). Inhibice COX-1 působí proti její roli v agregaci trombocytů, při použití NSA reverzibilně, v případě acetylsalicylové kyseliny ireverzibilně. Cyklooxygenáza-2 (COX-2) je indukovatelný enzym, jehož produkce vzrůstá při poškození organismu (zánět, bolest). V menší míře je COX-2 trvale produkována např. v ledvinách, kardiovaskulárním systému nebo oku jako konstitutivní forma. COX-2 se podílí na inhibici agregace trombocytů a vazodilataci, její blokáda zvyšuje riziko náhlých trombembolických příhod. Působením NSA dochází k inhibici cyklooxygenázy na periferii (periferní analgetický účinek), ale také v zadních rozích míšních, kde NSA blokují účinek prostaglandinů na descendentní antinociceptivní dráhy.
3 ANALGETIKA-ANTIPYRETIKA
3. 1 Paracetamol
Anilinový derivát paracetamol je centrálně působící analgetikum – antipyretikum s minimem vedlejších účinků. Postrádá antiflogistickou aktivitu, neovlivňuje významně krevní srážlivost ani u pacientů užívajících perorální antikoagulancia a má dobrou gastrointestinální snášenlivost. Jeho použití je doporučeno pro všechny věkové kategorie včetně novorozenců, na rozdíl od NSA není kontraindikován v graviditě a během laktace.
Analgetický efekt paracetamolu je vhodný k tlumení mírné až středně silné bolesti. S výjimkou bolesti se zánětlivou složkou je jeho potence v dostatečném dávkování srovnatelná s NSA. Jeho efekt významně roste v kombinaci s dalšími látkami, potencuje účinky NSA, kofeinu, slabých a silných opioidů (viz kapitola Multimodální analgezie).
Paracetamol je dostupný v celé řadě forem (perorální, rektální, intravenózní). Výhodou intravenózní 15minutové infuze je rychlý nástup účinku, analgezie je rozvinuta již po ukončení infuze. Analgetická dávka pro dospělé a dospívající s hmotností nad 50 kg je 750–1000 mg paracetamolu, doporučovaný odstup mezi dávkami je nejméně 4 hodiny. Maximální denní dávka je 4 g, při dlouhodobé terapii klesá denní dávka pod 3 g. U dětí od hmotnosti 10 kg (přibližně od 1 roku) nemá denní dávka překročit 60 mg . kg-1, pro jednorázové podání je dávka 10–15 mg . kg-1 hmotnosti. U novorozenců a dětí do 10 kg je jednotlivá dávka 7,5 mg . kg-1, maximální denní dávka je 30 mg . kg-1 tělesné hmotnosti.
Paracetamol je kontraindikován u těžké kachexie pro nedostatek zásob glutathionu, relativně kontraindikován při užívání karbamazepinu, fenytoinu, barbiturátů nebo alkoholu. Při předávkování hrozí závažné riziko poškození jater provázené příznaky zvracení, somnolence, bolestmi břicha. Jaterní selhání s encefalopatií může vyústit v kóma a smrt. Toxická dávka paracetamolu je 8–15 g, antidotem je acetylcystein v dávce l50 mg . kg-1 následované kontinuální infuzí. U velmi těžkých otrav je možná hemodialýza či hemoperfuze. Do dávky 4 g/den je však paracetamol bezpečný, což prokázala analýza 800 publikací zahrnující 30 tisíc pacientů, u kterých nikdy nedošlo k selhání jater [Dart a Bailey, 2007]. Kazuisticky byla při předávkování paracetamolem popsána i akutní tubulární nekróza a pankreatitida. V posledních letech však řada studií upozorňuje na narůstající incidenci alergií a astmatu v souvislosti užíváním paracetamolu. Ve studii ISAAC III bylo sledováno 300 000 dětí ze 113 center a 50 zemí světa. Riziko astmatu u uživatelů paracetamolu minimálně 1krát za měsíc bylo ve srovnání s kontrolní skupinou 2,51krát větší [Asher et al., 2006]. Multicentrická studie GA2LEN zjistila u dospělých 2,9krát větší riziko astmatu u skupiny s nejméně 1krát za týden častou aplikací paracetamolu oproti skupině užívající paracetamol méně často než 1krát týdně [Burbach et al., 2009].
3. 2 Metamizol
Pyrazolonový derivát metamizol je účinné spasmolytické analgetikum-antipyretikum. Je dostupný v perorální nebo injekční formě pro intravenózní infuzi. Jednotlivá dávka pro dospělého je 500–1000 mg (6–16 mg . kg-1 tělesné hmotnosti), u první pooperační analgetické infuze však není výjimkou dávka 2,5 g v 500 ml infuzi. Maximální denní dávka je 4–6 g. U dětí je doporučena dávka 10–15 mg . kg-1 maximálně 4krát denně, u dětí ve věku 3–11 měsíců smí být injekce podána pouze intramuskulárně. Během 3. trimestru těhotenství a při kojení je kontraindikován.
Metamizol je oproti paracetamolu poměrně bezpečný i při předávkování. Jeho používání nemá závažná gastrointestinální rizika a neovlivňuje agregaci trombocytů. Je spojován s rizikem leukopenie a agranulocytózy, ale toto riziko je reverzibilní a s nízkou četností (jeden případ na milion léčených pacientů). Kontraindikací je kromě alergie (těžké anafylaktoidní reakce) i porucha krvetvorby, alergické astma, porfyrie a vrozený defekt glukózo-6-fosfát dehydrogenázy. Opatrnosti je třeba u osob starých a při hypotenzi a hypovolémii. Riziko úmrtí pro závažné nežádoucí účinky je u metamizolu podobně nízké jako u paracetamolu (20–25 úmrtí na 100 milionů exponovaných osob) a je asi 20krát menší než u diklofenaku [Kršiak et al., 2012].
Do skupiny pyrazolonových derivátů patří také fenazon (v ČR se již nepoužívá) a propyfenazon a aminofenazon, které jsou součástí některých stále používaných kompozitních perorálních preparátů (v léčbě akutní pooperační bolesti nejsou využívány).
4 NESTEROIDNÍ ANTIFLOGISTIKA
NSA jsou účinná analgetika se silným protizánětlivým účinkem. Většina analgetik ze skupiny NSA má lepší analgetický efekt v léčbě akutní pooperační bolesti se zánětlivou složkou než paracetamol, tramadol, kodein a dokonce než 10 mg morfinu intramuskulárně. Jejich účinek dále posilují vhodné kombinace s paracetamolem, metamizolem, opioidy a dalšími adjuvantními analgetiky. U neuropatické bolesti je jejich efekt na úrovni placeba, při kombinaci s antiepileptiky však účinek výrazně vzrůstá. NSA mají jako všechna neopioidní analgetika stropový efekt, kdy zvyšování dávky nad doporučenou úroveň nevede ke zlepšení analgezie, ale může prohloubit vedlejší efekty léčby. Užití jednoho NSA v maximální denní dávce atakuje stropový efekt, užití dalšího NSA tuto hranici již překračuje. Kombinace NSA jsou proto mezi sebou kontraindikovány. Právě vedlejší účinky NSA jsou velmi často podceňovány a jejich nesprávné používání a nerespektování kontraindikací často znehodnocují dobrou analgetickou potenci NSA.
Mezi nejčastější a nejzávažnější nežádoucí účinky NSA patři gastrotoxicita (snížení tvorby hlenu a zvýšení sekrece HCl), nefrotoxicita a riziko trombembolických příhod (tab. 1). Paradigmatem do nedávné doby byl fakt, že u jednotlivých skupin NSA byla rizika nežádoucích účinků různá podle jejich působení na izoformy COX-1 a COX-2,žádná skupina však nebyla zcela prosta všech nežádoucích účinků. Řada studií v posledních letech prokázala, že rizika kardio - a nefrotoxicity se u neselektivních a selektivních NSA neliší [Katz, 2013]. Také Singh dospěl ke stejnému závěru, že koxiby i NSA mají podobné riziko kardiotoxicity a nefrotoxicity (rofecoxib OR = 2,12, ibuprofen OR = 3,36, etoricoxib OR = 4,07). Výskyt těchto vedlejších účinků léčby nezávisí na cestě aplikace a roste s dávkou a délkou podávání [Singh et al., 2014]. Podle metaanalýzy z roku 2013, do níž bylo zahrnuto 280 studií s více než 124 tisíci probandy, jsou vaskulární a gastrointestinální rizika diklofenaku, ibuprofenu a koxibů srovnatelná [CNT Collaboration et al., 2013].
Table 1. Nežádoucí účinky NSA 
SSRI – selective serotonin reuptake inhibitors Na druhou stranu nedávná metanalýza 9 studií prokázala, že dlouhodobé užívání kyseliny acetylsalicylové (OR 0,73) nebo NSA (OR 0,74) redukovalo riziko vzniku karcinomu žaludku a riziko vzniku kolorektální rakoviny až o 50 % [Rothwell et al., 2011]. NSA jsou dlouhodobě sledována jako látky s možnou potencí na snížení rizika vzniku recidivy rakoviny prsu, tento efekt byl naposledy prokázán u sulindacu [Yin et al., 2016]. Kyselina acetylsalicylová a celecoxib mohou být také vhodnou chemoprevencí před rekurencí adenomatózy střeva. Recentní retrospektivní studie provedená na 2 605 pacientech neprokázala zvýšené riziko úniku z anastomózy po resekci střeva pro rakovinu rekta, a vyvrátila tak úvahy o možném zvýšení rizika dehiscence anastomóz v kolorektální chirurgii způsobené podáváním nesteroidních antiflogistik [Rutegard et al., 2016].
Na základě nových informací o účincích NSA pověřila agentura CORDIS řízená Evropskou komisí ERASMUS Univerzitu v Rotterdamu výzkumem bezpečnosti užívání NSA. Na základě závěrů jejich SOS project (Safety of non-steroidal anti-inflammatory drugs) přijala Evropská léková agentura EMA a později i Státní ústav pro kontrolu léčiv (SÚKL) následující doporučení:
- Hodnocení bezpečnosti NSA nedoporučilo zatím změny ve způsobu jejich používání.
- Kardiovaskulární riziko diklofenaku a ibuprofenu se blíží coxibům.
- Naproxen má nižší kardiovaskulární rizika, GIT toxicita je u všech NSA stejná.
- Všechna NSA mají být používána nejkratší nutnou dobu a v co nejnižší účinné dávce.
- Maximální podpora výzkumu nových NSA.
Obecně tak lze konstatovat, že NSA jsou jako analgetika „dobrý sluha, ale špatný pán“. Ve správné indikaci a pro léčbu akutní bolesti jsou velmi účinná. Pokud nejsou respektovány kontraindikace a rizikové faktory medikace NSA, mohou mít následky léčby dopad na morbiditu i mortalitu (tab. 2). Vhodnou alternativou jejich podání jsou paracetamol nebo metamizol. Se sporným efektem lze využít kombinace NSA s inhibitory protonové pumpy či misoprostolu, jejichž protektivní efekt však některé studie vyvracejí [Chan et al., 2010]. Vzhledem k antiagregačnímu efektu je doporučeno NSA vysadit 3 dny před operací, u kyseliny acetylsalicylové je tento interval 1 týden. NSA mohou zvýšit toxicitu souběžně podávaných lithia a metotrexátu.
Table 2. Kontraindikace a rizikové faktory podávání NSA 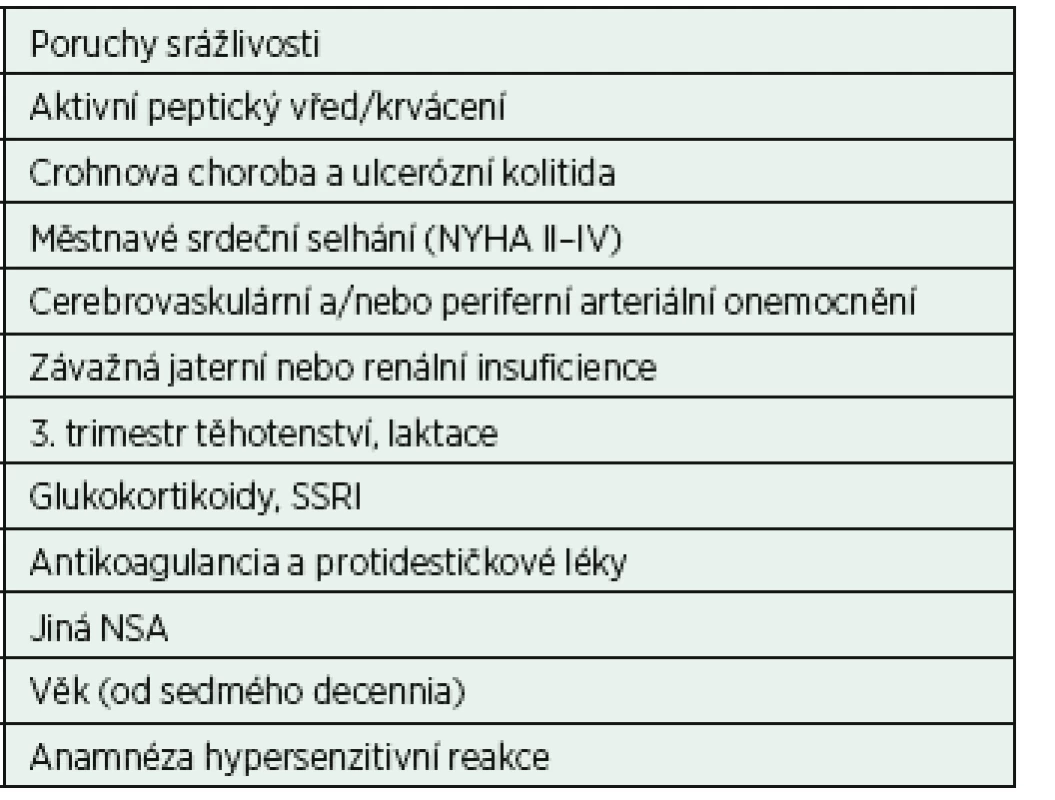
SSRI – selective serotonin reuptake inhibitors 4. 1 Neselektivní NSA
Neselektivní COX-2 inhibitory jsou nejpoužívanější skupinou NSA. Patří mezi ně především deriváty kyseliny octové (např. diklofenak, indometacin) a kyseliny propionové (např. ibuprofen, naproxen a další). Další skupinou NSA jsou oxikamy (např. piroxikam) s dlouhým biologickým poločasem a také fenamáty. Pokud nemá pacient anamnestické gastrointestinální riziko (vřed gastroduodena, terapie kortikoidy či warfarinem, věk nad 65 let, kouření, alkoholismus), patří neselektivní NSA mezi středně silná analgetika s protizánětlivým účinkem. Při léčbě NSA trpí dyspepsií 10–20 % pacientů. V Evropské unii je denně hospitalizováno pro komplikace NSA gastropatie 400 osob, z nichž 10 % umírá. Extrapolace dat pro Českou republiku znamená 5 000 hospitalizací a 800 úmrtí ročně [Kršiak et al., 2012]. Relativní riziko gastrointestinálního krvácení klesá v pořadí: indometacin, piroxikam, naproxen, diklofenak, ibuprofen.
Ibuprofen
Ibuprofen patří mezi nejrozšířenější NSA. Pro léčbu bolesti je dostupný pouze v perorální, rektální či lokální formě. Je určen pro léčbu bolesti od 6 měsíců věku. Denní dávka u dětí do 12 let věku je 20–35 mg . kg-1 hmotnosti. U dospělých se jednotlivé dávky pohybují od 400 do 800 mg každých 6 hodin, maximální denní dávka je 2400 mg. Injekční forma ibuprofenu není určena pro léčbu bolesti, používá se v neonatologii k uzavření ductus arteriosus.
Diklofenak
Patří mezi nejúčinnější NSA na bolest se zánětlivou složkou. V léčbě akutní pooperační bolesti se nejčastěji využívá infuzní podání 75 mg po dobu 30 minut. Diklofenak je nutno ředit ve fyziologickém roztoku nebo 5% glukóze, při smíchání s ostatními krystaloidy precipituje! Maximální denní dávka je 150 mg. U dětí a mladistvých se nedoporučuje injekční přípravek používat, výjimkou je indikace juvenilní chronické artritidy. Po 1–2 dnech se přechází na perorální formu za respektování maximální denní dávky. U dětí nad 12 let obvykle postačuje 75–100 mg denně. Možné je i podání hluboko intramuskulárně. Nežádoucí účinky a kontraindikace jsou společné pro tuto skupinu, má mírně vyšší riziko hepatotoxicity.
V kombinaci s centrálním svalovým relaxans orfenadrinem se využívá v infuzi k analgetickému a spasmolytickému účinku na kosterní svalstvo.
Indometacin
Má silný analgetický a protizánětlivý efekt. Pro celkově vyšší podíl nežádoucích účinků není vhodný pro dlouhodobou léčbu a v dětském věku.
Piroxikam
Je dostupný v perorální a injekční formě pro intramuskulární podání. Dlouhý biologický poločas umožňuje podávání jedenkrát denně 20–40 mg piroxikamu. Má mírně vyšší výskyt nežádoucích účinků na gastrointestinální trakt. Lze použít na léčbu akutní pooperační bolesti u pacientů starších 14 let.
Naproxen
Indikace a kontraindikace jsou shodné s dalšími NSA. Výhodou naproxenu je velmi rychlý nástup účinku a délka trvání až 12 hodin.
Ketoprofen
Analgeticky efektivní NSA s protizánětlivým účinkem, má krátký eliminační poločas, jeho nevýhodou je vyšší výskyt gastrotoxicity. Nejnovější údaje z metaanalýz ale prokazují srovnatelný bezpečnostní profil a lepší risk vs. benefit ratio ve srovnání s diklofenakem a ibuprofenem u bolesti se zánětlivou etiologií [Sarzi-Puttini et al., 2015]. Je dostupný v injekční formě, v dávce 2krát 100 mg intravenózně v krátkodobé infuzi 5% glukózy je využitelný pro perioperační léčbu bolesti.
4. 2 Preferenční COX-2 inhibitory
Tato skupina NSA inhibuje aktivitu COX-1 pouze ve vyšších dávkách. Preferenční účinek na COX-2 vede u léčiv této skupiny k lepší gastrointestinální snášenlivosti a menšímu ovlivnění funkce trombocytů s rizikem krvácení. Nežádoucí dopad na renální funkce je však stejný jako u neselektivních NSA a narůstá nepříznivý účinek na kardiovaskulární systém, který je závislý na dávce a délce podávání. Jako u ostatních NSA je kontraindikováno jejich použití v těhotenství i během laktace.
Nimesulid
Jeho výhodou je rychlý nástup účinku do 30 minut v perorální formě, v injekční formě není k dispozici. Pro pacienty starší 12 let je dávka 100 mg dvakrát denně. Nežádoucí účinky a kontraindikace jsou shodné s ostatními NSA.
Meloxikam
Meloxikam není schválen k léčbě akutní pooperační bolesti. Rozdíl proti nimesulidu je především v nástupu (90 minut) a délce účinku (15 mg 1krát denně). Nežádoucí účinky a kontraindikace jsou shodné s ostatními NSA.
4. 3 Selektivní COX-2 inhibitory (koxiby)
Analgetická účinnost koxibů je srovnatelná s neselektivními NSA. Selektivní inhibice COX-2 přináší teoreticky nižší riziko gastrotoxicity (v posledních letech zpochybněno), na druhou stranu výrazně narůstá riziko náhlých trombembolických příhod (především infarkty myokardu nebo mozku). Některé koxiby proto byly staženy z trhu (rofekoxib, valdekoxib). Bohužel v posledních letech prokázala řada metaanalýz zvýšené trombogenní riziko a vyšší výskyt městnavého srdečního selhání nejen u koxibů, ale také u ostatních NSA [Trelle et al., 2011; Patrono, 2016]. Riziko se zvyšuje s dávkou, délkou podávání a u pacientů s kardiovaskulární anamnézou. Relativně nižší trombogenní riziko ze všech NSA vykazuje pouze naproxen a ibuprofen. Nefrotoxický účinek koxibů je podobný jako u ostatních NSA. Koxiby jsou kontraindikovány k léčbě bolesti po koronárním bypassu, v posledním trimestru těhotenství a během kojení.
Parekoxib
Parekoxib je jediným injekčním koxibem, který je přímo indikován pro krátkodobou pooperační analgezii u osob starších 18 let. Nežádoucí účinky a kontraindikace jsou shodné s ostatními NSA. Intravenózní či intramuskulární injekce se aplikuje v dávce 40 mg, maximální denní dávka je 80 mg.
Celekoxib
Má dlouhý biologický poločas, dávka 200 mg se podává perorálně jedenkrát denně. Není registrován pro léčbu pooperační bolesti, přesto se používá především jako preemptivní analgetikum a v pooperačním průběhu, protože méně ovlivňuje krvácení (například po endoskopických urologických operacích).
Etorikoxib
Není registrován pro léčbu akutní pooperační bolesti. Dosud bylo publikováno omezené množství prací o synergickém působení etorikoxibu a opioidů, což vedlo ke snížení jejich nežádoucích účinků. Ze všech NSA má nejvyšší kardiovaskulární riziko.
4. 4 Další NSA
V klinické praxi nebo ve fázi výzkumu je řada dalších NSA. Pro léčbu akutní pooperační bolesti v ČR zatím však nemají význam. Patří mezi ně inhibitory COX flurbiprofen, aceklofenak nebo nepafenak (neselektivní), nalbumeton (preferenční). Některé z nich mají svůj klinický účinek postavený na jiném mechanismu než interakci s enzymy COX (sulindac). Léky ze skupin HS-NSAID, TEMPO-NSAID, phospho-NSAID (phospho-aspirin, phospho-ibuprofen a phospho-sulindac) jsou nové látky zkoumané pro jejich pravděpodobně menší nežádoucí účinky než jejich starší formy.
5 DALŠÍ NEOPIOIDNÍ ANALGETIKA
Do této skupiny patří především flupirtin a nefopam. V ČR nejsou registrovány. Jejich účinek je zprostředkován interakcí s histaminovými receptory a zpětným vychytáváním serotoninu, noradrenalinu a dopaminu. Výjimkou je orfenadrin, jehož centrálně myorelaxační a lokálně anestetické účinky jsou využity v kompozitním infuzním přípravku společně s diklofenakem.
V jistém slova smyslu nepatří mezi opioidní analgetika i ketamin a celá skupina tzv. adjuvantních analgetik (antiepileptika, lokální anestetika, kortikoidy, alfa-2-mimetika a další). Tvoří však samostatnou heterogenní skupinu látek s analgetickými účinky, a proto nejsou obsahem tohoto sdělení.
6 MULTIMODÁLNÍ ANALGEZIE
Periferní analgetika mají stropový efekt a další zvyšování jejich dávky nevede ke zlepšení analgezie, proto se u silných bolestí kombinují s opioidy. V rámci této kombinace mohou redukovat celkovou dávku opioidů až o 30–40 % [Maund et al., 2011]. Podle tzv. Oxfordské ligy analgetik je paracetamol v kombinaci s tramadolem nebo kodeinem účinnější než petidin nebo morfin v klinických dávkách. Je třeba ale poznamenat, že toto hodnocení bylo pro řadu metodických nedostatků a manipulaci s výsledky opuštěno. V posledních letech se v klinické praxi uplatňuje metoda analgezie podle typu operace (procedure specific analgesia), která klasifikuje bolest do tří stupňů podle intenzity pooperační bolesti a tomu přizpůsobuje analgetický protokol [(Málek, 2014]. Tento přístup je respektován i v Doporučeném postupu ČSARIM Léčba akutní pooperační bolesti [ČSARIM, 2008].
Také kombinace neopioidních analgetik mezi sebou mají aditivní efekt. Podle posledních systematických review má kombinace NSA s paracetamolem až o 30 % lepší efekt než samotná NSA nebo paracetamol, a to jak u dospělých, tak i u dětí [Ong et al., 2010; Wong et al., 2013]. Derry v jedné ze svých mnoha systematických review na téma neopioidních analgetik z roku 2013 prokázal, že ibuprofen s paracetamolem mají NNT 1,5 (NNT – Number Needed to Treat) proti samotnému ibuprofenu s NNT 5,4 [Derry et al., 2013]. Pozitivní adjuvantní efekt na neopioidní analgetika mají i kofein nebo guaifenesin, které jsou složkami řady kompozitních léků s analgetickým, protizánětlivým nebo spasmolytickým efektem. Tyto kompozitní preparáty na léčbu slabé bolesti se však v léčbě akutní pooperační bolesti většinou neuplatňují.
Samotná NSA nemají téměř žádný efekt v léčbě neuropatické bolesti. Již od 90. let minulého století je však známa role prostaglandinů a cyklooxygenázy v zesilování přenosu neuropatické bolesti. Inhibice COX-2 vede ke snížené tvorbě prostaglandinů a má analgetický efekt v oblasti zadních rohů míšních. Podle řady studií má kombinace koxibů s pregabalinem nebo gabapentinem pozitivní efekt na neuropatickou bolest a vedla až k 52% snížení neuropatických bolestí nebo zmírnění allodynie proti monoterapii antiepileptiky [Romanò et al., 2009; Gilron et al, 2005]. Recentní studie o perioperačním podávání pregabalinu s NSA a opioidními analgetiky (kontrolní skupina místo pregabalinu placebo) prokázala signifikantní snížení nejen bolesti, ale i anxiety a PONV [Shimony et al., 2016].
7 ZÁVĚR
Adekvátní analgezie je základním právem každého pacienta podstupujícího operační nebo diagnostický výkon. V dnešní době máme dostatek prostředků a znalostí, aby byl tento fakt naplněn. Stejně tak máme dost informací o výhodách i rizicích používání neopioidních analgetik. Jsou to relativně účinná analgetika, jejichž efekt narůstá v kombinacích s jinými lékovými skupinami. Principy multimodální analgezie a analgezie podle typu operačního výkonu by měly být obsaženy v každém moderním postupu léčby akutní pooperační bolesti.
Doporučení používání neopioidních analgetik v léčbě akutní pooperační bolesti:
- multimodální farmakoterapie a analgezie podle typu operace jsou základními principy léčby akutní bolesti,
- neopioidní analgetika by měla být součástí každého algoritmu léčby akutní bolesti,
- monoterapie neopioidními analgetiky je určena pro léčbu mírné a středně silné bolesti,
- kombinace s jinými lékovými skupinami vede k zesílení analgetického účinku,
- neopioidní analgetika mají stropový efekt,
- paracetamol je lékem první volby mezi neopioidními analgetiky,
- NSA používáme nejkratší možnou dobu v nejnižší možné dávce,
- není racionální kombinovat NSA vzájemně,
- pacientův údaj o bolesti je rozhodující!,
- důraz je kladen na cyklické vzdělávání lékařů i středního zdravotnického personálu v problematice léčby bolesti.
Kolektiv autorů prohlašuje, že práce nebyla publikována v jiném časopise.
Tato práce nebyla finančně podpořena třetí stranou, není s ní spojen žádný konflikt zájmů.
Do redakce došlo dne 25. 4. 2016.
Do tisku přijato dne 26. 5. 2016.
Adresa pro korespondenci:
doc. MUDr. Tomáš Gabrhelík, Ph.D.
ARO KNTB Zlín, a. s.
Havlíčkovo nábřeží 600
760 01 Zlín
e-mail: tomas.gabrhelik@bnzlin.cz
Sources
1. Ševčík, P. Úvod. In Málek, J., Ševčík, P. a kol. Léčba pooperační bolesti. 3. vydání. Praha: Mladá fronta, 2014, s. 13–14, ISBN 978-80-204-3522-4.
2. Vane, J. R., Bakhle, Y. S., Botting, R. M. Cyclooxygenases 1 and 2. Annu. Rev. Pharmacol. Toxicol., 1998; 38, p. 97–120.
3. Dart, R. C., Bailey, E. Does therapeutic use of acetaminophen cause acute liver failure? Pharmacotherapy, 27, 2007, 9, p. 1219–1230.
4. Asher, M. I., Montefort, S., Björkstén, B., Lai, C. K. W., Strachan, D. P., Weiland, S. K. and the ISAAC Phase Three Study Group. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC Phases One and Three repeat multicountry cross-sectional surveys. Lancet, 368, 2006, 9537, p. 733–743.
5. Burbach, G. J., Heinzerling, L. M., Edenharter, G., Bachert, C., Bindsley-Jensen, C., Bonini, S. et al. GA(2)LEN skin test study II: clinical relevance of inhalant allergen sensitizations in Europe. Allergy, 64, 2009, 10, p. 1507–1515.
6. Kršiak, M., Doležal, T., Lejčko, J. Neopioidní analgetika. In Rokyta, R., Kršiak, M., Kozák, J. Bolest. 2. vydání. Praha: Tigis, 2012, s. 116–126. ISBN 978-80-87323-02-1.
7. Katz, J. A. COX-2 inhibition: what we learned – a controversial update on safety data. Pain Med., 14, 2013, Suppl 1, p. 29–34.
8. Singh, B. K., Haque, S. E., Pillai, K. K. Assessment of nonsteroidal anti-inflammatory drug-induced cardiotoxicity. Exp. Opin. Drug Metab. Toxicol., 10, 2014, 2, p. 143–156.
9. Coxib and traditional NSAID Trialists’ (CNT) Collaboration, Bhala, N., Emberson, J., Merhi, A., Abramson, S., Arber, N. et al. Vascular and upper gastrointestinal effects of non-steroidal antiinflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet, 382, 2013, 9894, ps. 769–779.
10. Rothwell, P. M., Fowkes, F. G., Belch, J. F., Ogawa, H., Warlow, C. P., Meade, T. W. Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials. Lancet, 377, 2011, 9759, p. 31–41.
11. Yin, T., Wang, G., Ye, T., Wang, Y. Sulindac, a non-steroidal anti-inflammatory drug, mediates breast cancer inhibition as an immune modulator. Scientific reports, 2016, 6, p. 1–8.
12. Rutegård, M., Westermark, S., Kverneng, H. D., Haapamäki, M., Matthiessen, P., Rutegård, J. Non-Steroidal Anti-Inflammatory Drug Use and Risk of Anastomotic Leakage after Anterior Resection: A Protocol-Based Study. Dig. Surg., 33, 2016, 2, p. 129–135.
13. Chan, F., Lanas, A., Scheiman, J., Berger, M. F., Nguyen, H., Goldstein, J. L. Celecoxib versus omeprazole and diclofenac in patients with osteoarthritis and rheumatoid arthritis (CONDOR): a randomised trial. Lancet, 376, 2010, 9736, p. 173–179.
14. Sarzi-Puttini, P., Bagnasco, M., Lanata, L., Atzeni, F. Risk and Benefit Profile of Nsaids: A New Overall Analysis on Efficacy and Safety of Ketoprofen vs Ibuprofen and Diclofenac. Annals of the Rheumatic Diseases, 74, 2015, Suppl 2, p. 1067–1068.
15. Trelle, S., Reichenbach, S., Wandel, S., Hildebrand, P., Tschannen, B., Villiger, P. M. et al. Cardiovascular safety on non-steroidal anti-inflamatory drugs: network meta-analysis. BMJ, 11, 2011, 342, p. 7086. Review.
16. Patrono, C. Cardiovascular Effects of Nonsteroidal Anti-inflammatory Drugs. Current cardiology reports, 18, 2016, 3, p. 1–8.
17. Maund, E., McDaid, C., Rice, S., Wright, K., Jenkins, B., Woolacott, N. et al. Paracetamol and selective and non-selective non-steroidal anti-inflammatory drugs for the reduction in morphine-related side-effects after major surgery: a systematic review. Br. J. Anaesth., 106, 2011, 3, p. 292–297.
18. Málek, J. Multimodální analgezie. In Málek, J., Ševčík, P. a kol. Léčba pooperační bolesti. 3. Vydání. Praha: Mladá fronta, 2014, s. 80–83, ISBN 978-80-204-3522-4.
19. Pracovní skupina pro léčbu pooperační bolesti ČSARIM: Doporučené postupy léčby akutní pooperační bolesti. Anest. intenziv. Med., 2008, 19, s. 162–169. www.csarim.cz/Text/metodicke-pokyny-a-stanoviska-csarim-1?MenuItemId=38
20. Ong, C. K., Seymour, R. A., Lirk, P., Merry, A. F. Combining paracetamol (acetaminophen) with nonsteroidal antiinflammatory drugs: a qualitative systematic review of analgesic efficacy for acute postoperative pain. Anesth. Analg., 110, 2010, 4, p. 1170–1179.
21. Wong, I., St. John-Green, C., Walker, S. M. Opioid-sparing effects of perioperative paracetamol and nonsteroidal anti-inflammatory drugs (NSAIDs) in children. Paediatr Anaesth., 23, 2013, 6, p. 475–495.
22. Derry, C. J., Derry, S., Moore, R. A. Single dose oral ibuprofen plus paracetamol (acetaminophen) for acute postoperative pain. Cochrane Database Syst Rev., 2013, 6, CD010210.
23. Romanò, C. L., Romanò, D., Bonora, C., Mineo, G. Pregabalin, celecoxib, and their combination for treatment of chronic low-back pain. J. Orthop. Traumatol., 10, 2009, 4, p. 185–191.
24. Gilron, I., Orr, E., Tu, D., O’Neill, J. P., Zamora, J. E., Bell, A. C. A placebo-controlled randomized clinical trial of perioperative administration of gabapentin, rofecoxib and their combination for spontaneous and movement-evoked pain after abdominal hysterectomy. Pain, 113, 2005, 1–2, p. 191–200.
25. Shimony, N., Amit, U., Minz, B., Grossman, R., Dany, M. A., Gonen, L. et al. Perioperative pregabalin for reducing pain, analgesic consumption, and anxiety and enhancing sleep quality in elective neurosurgical patients: a prospective, randomized, double-blind, and controlled clinical study. J. Neurosurg., 2016, p. 1–10. Epub ahead.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2016 Issue 4-
All articles in this issue
- Několik poznámek klinických biochemiků k akutnímu poškození ledvin
- Je morfin stále indikován v léčbě kardiogenního plicního edému?
- Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
- Neopioidní analgetika v léčbě akutní pooperační bolesti
- Význam rotačnej tromboelastometrie (ROTEM) v manažmente perioperačného krvácania
- Specifika intervenční bronchologie z pohledu anesteziologa
- Pooperační nauzea a zvracení u dětí
- Novinky v kardiopulmonální resuscitaci v porodnictví
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Význam rotačnej tromboelastometrie (ROTEM) v manažmente perioperačného krvácania
- Laktátová acidóza asociovaná s metforminem – minireview na podkladě kazuistik
- Pooperační nauzea a zvracení u dětí
- Novinky v kardiopulmonální resuscitaci v porodnictví
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

