-
Medical journals
- Career
Postpunkční cefalea v porodnictví
Authors: Nosková Pavlína 1,2; Bláha Jan 1,2; Klozová Radka 1,3; Seidlová Dagmar 1,4; Štourač Petr 1,5; Pařízek Antonín 6
Authors‘ workplace: Expertní skupina porodnické anestezie a analgezie ČSARIM 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. lékařská fakulta Univerzity Karlovy v Prazea Všeobecná fakultní nemocnice v Praze 2; Klinika anesteziologie a resuscitace, 2. lékařská fakulta Univerzity Karlovy v Praze a Fakultní nemocnicev Motole 3; II. anesteziologicko-resuscitační oddělení Fakultní nemocnice Brno 4; Klinika anesteziologie, resuscitace a intenzivní medicíny, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno 5; Gynekologicko-porodnická klinika, 1. lékařská fakulta Univerzity Karlovy v Praze a Všeobecná fakultní nemocnice v Praze 6
Published in: Anest. intenziv. Med., 25, 2014, č. 3, s. 194-202
Category: Anesthesiology - Review Article
Overview
Postpunkční cefalea (PDPH – postdural puncture headache) je v porodnictví poměrně častá (okolo 1 % všech neuro-axiálních punkcí) iatrogenní komplikace. Důvodem jejího častějšího výskytu u rodiček oproti běžné pacientské populaci jsou především fyziologicko-patofyziologické rozdíly těhotných žen, ale i stoupající počet aplikovaných neuroaxiálních blokád. Protože neléčený postpunkční syndrom může vyústit až ve fatální komplikace, je hlavní zásadou léčby komplexní a multimodální přístup skládající se nejen z využití všech prostředků konzervativní i invazivní terapie, ale též odpovídající komunikace a psychické podpory pacientky. Cílem tohoto článku je podat přehled a současný pohled na patofyziologii a léčbu této komplikace.
Klíčová slova:
postpunkční cefalea – porodnictví – císařský řez – porodnická analgezieÚVOD
Postpunkční cefalea (PDPH – postdural puncture headache) v rámci postpunkčního syndromu je iatrogenní komplikace, se kterou se v porodnictví, na rozdíl od ostatních pooperačních stavů, setkáváme relativně často. Uvádí se, že až 79 % nechtěných punkcí tvrdé pleny během epidurální blokády je právě z oblasti porodnické anestezie a analgezie [1].Důvodem je jak stoupající počet neuroaxiálních blokád, tak i fyziologicko-patofyziologické rozdíly těhotných žen oproti běžné populaci. Incidence nechtěné punkce dury mater během epidurální blokády zkušenými anesteziology se v literatuře pohybuje mezi 0,16–1,3 % [2, 3]. K rozvoji PDPH potom dochází v 16–86 % [4].
Podle IHS (International Headache Society) [5] je PDPH definována jako bolest hlavy, která se rozvine do 7 dnů po spinální punkci, kdy se klinické projevy zhoršují po 15 minutách ve vertikální poloze a po opětovném uložení do horizontální polohy dochází do 30 minut k odeznění symptomů. K doprovodným příznakům patří diplopie, nauzea, zvracení, tinnitus a spasmus šíjového svalstva. V naprosté většině případů dochází k rozvoji klinických projevů již během 24–48 hodin od perforace dura mater. Potíže vyšší intenzity trvají průměrně 2 týdny, a pokud přetrvávají i nadále, označujeme stav jako CSF (cerebrospinal fluid) fistula headache [6]. Asi 70 % bolestí hlavy vymizí zcela během 7 týdnů, v 90 % dojde k úpravě stavu do 6 měsíců [7, 8].
PATOFYZIOLOGIE
Klinické projevy postpunkčního syndromu mají hlavní patofyziologický korelát v úniku mozkomíšního moku a následných tlakových změnách sub-arachnoidálního prostoru. Produkce mozkomíšního moku nestačí vyrovnat jeho únik defektem v tvrdé pleně, a to ani přesto, že jeho denní produkce činí až 500 ml. Celkové množství moku v subarachnoidálním prostoru centrální nervové soustavy (CNS) je pouze 150 ml. Tlak moku v lumbální oblasti je v horizontální poloze asi 5–15 cm H2O, při perforaci je snížen pod 4 cm H2O, ve vertikální poloze je za normálních podmínek 40 cm H2O [9, 10]. To je důvod, proč je ve vertikální poloze při perforaci únik moku větší. Tlakové změny způsobují trakci senzitivních anatomických struktur CNS (tentorium, intrakraniální siny) a iritaci hlavových nervů IV, VI (oční příznaky), V (bolest ve frontální krajině), IX, X (okcipitální krajina) a krčních nervů C1–3. Druhým významným mechanismem, zodpovědným za klinické projevy, je reflexní kompenzatorní adenosinem zprostředkovaná mozková venodilatace za účelem zachování Monro-Kellieho hypotézy. Tato doktrína předpokládá, že součet objemu mozkomíšního moku a krve v mozku zůstává konstantní [5, 6, 11].
KLINIKA A DIFERENCIÁLNÍ DIAGNOSTIKA
Až 39 % žen si v poporodním období stěžuje na bolest hlavy. Nejčastější příčinou jsou migrény, tenzní bolesti hlavy a pouze v 18 % je příčinou PDPH [12–15]. Důvodem exacerbace primárních bolestí hlavy bývá v poporodním období nedostatek spánku, únava, poporodní psychické a hormonální změny, emoční labilita, změna stravy nebo blokáda krční páteře z nevyhovujícího lůžka. Nicméně stížnosti na cefaleu nelze podceňovat a je třeba odlišit hlavní závažné klinické stavy, ke kterým bolest hlavy patří: meningitis, hematom a tumor CNS, pneumocefalus a cerebrální venózní trombózu. Specifikou šestinedělí je také bolest hlavy spojená s možnou poporodně vzniklou preeklampsií a hypertenzí.
V rámci postpunkčního syndromu se setkáváme s dalšími příznaky, jako jsou nauzea, zvracení, poruchy zraku – diplopie, hypacusis, tinnitus a pseudomeningismus na podkladě iritace krčních nervových kořenů (C1–C3). Bolest hlavy je silná, tupá nebo pulsující. Nejčastěji vychází z oblasti zátylku a propaguje se do frontální krajiny a za oči. Ve většině případů má typický migrenózní charakter. Hlavním diagnostickým kritériem, svědčícím pro PDPH, je akcentace symptomů vertikalizací, což je i obsahem definice postpunkční cefaley. Nejčastěji příznaky vznikají za 24–48 hodin po regionální blokádě. Při pochybnostech je nutno doplnit vždy neurologické vyšetření, případně zobrazovací metodu – magnetickou rezonanci nebo při její nedostupnosti CT. Doprovodná cílená laboratorní vyšetření (krevní obraz, krevní srážlivost, zánětové markery) ke kompletizaci diferenciální diagnostiky jsou samozřejmou nutností.
SPECIFIKA PDPH V PORODNICTVÍ
Častý výskyt PDPH v porodnictví souvisí s několika faktory. Věk pacientek je standardně mezi 18–45 lety, kdy je dispozice ke vzniku postpunkčního syndromu nejvyšší [16]. Důvodem je vyšší elasticita intrakraniálních struktur. U starších lidí se elasticita snižuje a dochází také k redukci senzitivních vláken [17]. Předpokládá se i vyšší incidence výskytu PDPH u ženského pohlaví oproti mužskému (12 % vs. 7 %) [18]. Některé práce uvádějí i význam změn intraabdominálního tlaku po porodu a tím i větší tlakový rozdíl v lumbálním subarachnoidálním prostoru [18], jiné zdroje tyto souvislosti vylučují [19]. Pokud se setkáme s perforací dura mater v jiných chirurgických oborech, nebývají klinické projevy tak výrazné. Pacient dostává analgetika v rámci pooperační analgezie a většinou má klidový režim na lůžku s postupnou vertikalizací. Pacientka po porodu je ale nucena velmi brzy vstávat a pohybovat se v souvislosti s péčí o novorozence. Také správná poloha hlavy při kojení vyžaduje její volný pohyb. Pokud pro bolesti hlavy není možná plná mobilizace matky, a je tak snížena její schopnost péče o dítě, rozvíjí se začarovaný kruh. Cefalea vytváří psychickou nerovnováhu, která je potencována hormonálními změnami v šestinedělí, a to zpětně zhoršuje bolesti hlavy. Proto psychologická podpora, vysvětlující pohovor a zvýšená péče o takto postiženou pacientku je na prvním místě v léčbě PDPH v porodnictví. Výhodu představuje u pacientů s PDPH také přiměřené zatemnění a dodržování tichého režimu v okolí. Je třeba poznamenat, že tato podmínka bývá v prostředí standardních pokojů šestinedělí obtížně splnitelná.
PDPH A SUBARACHNOIDÁLNÍ BLOKÁDA
V souvislosti s výskytem PDPH a subarachnoidální (spinální) blokádou bývá především široce diskutován nejen tvar a tloušťka jehly, ale i technika provedení blokády.
V současnosti jsou nejužívanějšími spinálními jehlami typ „cutting needle“ (Quincke) a „noncutting needle“ – pencil point (Whitacre, Sprotte). Určitou modifikaci obou jehel představuje typ Atraucan. V literatuře je popisován menší výskyt PDPH ve prospěch typu pencil point [20–22], podle našich praktických zkušeností (VFN Praha, FN Brno) není významný rozdíl mezi zmiňovanými typy, naopak jsme zaznamenali s typem pencilpoint případy nekvalitní subarachnoidální blokády. To může souviset s polohou otvoru a jeho vztahem k dura mater. Některé práce popisují také možné parestezie při provádění blokády jehlou pencil point, což může souviset se vzdáleností otvoru a konce jehly [23]. Volba typu jehly a orientace hrotu je také závislá na předpokládaném uspořádání vláken dury mater a na defektu, který po subarachnoidální punkci vznikne. Předpokládalo se, že vlákna tvrdé pleny jsou uspořádána longitudinálně [24], avšak s rozvojem elektronové mikroskopie a epiduroskopie byla tato domněnka vyvrácena [25]. Tato sledování naopak dokazují, že existuje i uspořádání koncentrické a různá síla dury mater a tím se mění pohled na možné vytvořené defekty jednotlivými typy jehel a únik moku [26, 27]. Jednoznačné závěry však zatím nelze vyvodit. Například jedním z možných vysvětlení častějšího výskytu PDPH při použití Quinckeho hrotu může být fakt, že špička tohoto typu hrotu je výrazně náchylnější k deformacím při kontaktu s kostí. Následně pak takto deformovaný hrot způsobí výraznější poškození dury než původní tvar hrotu [28].
Rozhodujícím faktorem pro vznik postpunkčního syndromu, který může anesteziolog ovlivnit, je ale jednoznačně velikost jehly. Pro pacientky v peripartálním období platí jasná preference tenkých jehel G 25 a tenčích [21]. Tenké jehly G 27 již vyžadují technickou zkušenost a zručnost anesteziologa. Je však třeba vyvarovat se opakovaným punkcím při nerozpoznaném průniku hrotu [29], které jsou právě tím rizikovým faktorem pro vznik PDPH při použití tenkých jehel. Častou příčinou opakované punkce může být netrpělivost či spěch provádějícího, kdy se v případě pomalu tekoucího moku tenkou jehlou dopouští opakované nerozpoznané punkce subarachnoidálního prostoru. Při nedostatečné zkušenosti anesteziologa může být proto výhodou v časové tísni (akutní císařský řez nebo emergentní výkon u nelačné rodičky) i volba velikosti G 26 nebo G 25. Velmi tenké jehly G 29 a menší přinášejí výrazné technické problémy a nepřinášejí profit z hlediska snížení incidence PDPH oproti G 27 [30, 31].
Nejpodstatnější prevencí PDPH při spinální ane-stezii je volba velikosti jehly G25 a menší, ideálně G26 nebo G27 a minimalizace opakovaných pokusů!
PDPH A EPIDURÁLNÍ BLOKÁDA
Nejčastěji se s PDPH v porodnictví setkáváme jako důsledek nechtěné perforace dura mater při provádění epidurální analgezie během porodu nebo při epidurální anestezii k císařskému řezu. Příčinou bývá nespolupráce a pohyb pacientky, nezkušený anesteziolog nebo obtížná identifikace epidurálního prostoru v graviditě (přírůstek hmotnosti, obtížné polohování, prosáknutí tkání, otoky při preeklampsii). Metodou první volby z hlediska bezpečnosti při epidurální blokádě v porodnictví je použití bezodporové stříkačky naplněné fyziologickým roztokem. Použití vzduchu není doporučováno z důvodu možných akcentací bolestí hlavy a rizika vzniku pneumocefalu [32–35].
MANAGEMENT NECHTĚNÉ PUNKCE DURA MATER U EPIDURÁLNÍ ANESTEZIE K SC A BĚHEM PORODNICKÉ ANALGEZIE
Stále diskutovanou otázkou zůstává, jak postupovat při perforaci tvrdé pleny během epidurální blokády. Pokud se jedná o perforaci během podávání epidurální anestezie k císařskému řezu, lze přejít na subarachnoidální anestezii aplikací bupivakainu určeného pro subarachnoidální podání do epidurální jehly v té chvíli subarachnoidálně zavedené. Jelikož je místo vpichu o 2–3 etáže (primárně epidurální blokáda) výše než u standardně prováděné subarachnoidální blokády, je bezpečnější aplikovat hyperbarický bupivakain a pa-cientku polohovat do mírné anti-Trendelenburgovy polohy. Tím je anestezie řiditelná. Polohování zabrání také postupu lokálního anestetika směrem kraniálním a nástupu nechtěné vyšší blokády. Pokusy o novou epidurální punkci mohou přinést riziko opětovné perforace, navíc následné podání plné epidurální dávky může způsobit vysokou, či dokonce totální spinální anestezii. Důvodem je možné prosáknutí lokálního anestetika otvorem v tvrdé pleně do moku. Pokud se nebude pokračovat v regionální blokádě a pokračuje se v celkové anestezii, je možné podat do moku alespoň purifikovaný morfin k zajištění pooperační analgezie. Subarachnoidálně podaný morfin má nástup analgetického účinku přibližně do hodiny a tento efekt vydrží 12–24 hodin. Vzhledem k hydrofilním vlastnostem morfinu a jeho rostrálního posunu je však nutné pacientku v pooperačním období monitorovat 24 hod. pulzní oxymetrií kvůli riziku pozdního dechového útlumu. Navíc, podle některých studií může i intratekální aplikace morfinu snižovat výskyt PDPH [36].
Při nechtěné punkci dury mater během epidurální analgezie k porodu (PDA) je možno zvolit také více postupů řešení (tab. 1). Pokud je přistoupeno k opakované punkci, je vhodnější volit prostor kraniálně nad místem perforace a analgetickou dávku podávat vždy pod dohledem anesteziologa. Takto zavedený epidurální katétr lze následně využít k profylaktické aplikaci běžných krystaloidů, ale efekt bývá pouze přechodný a krátkodobý [37–39]. Katétr lze využít i k aplikaci krevní zátky, i když podání tímto způsobem může být technicky obtížné a není příliš rozšířené.
Table 1. Management arteficiální punkce dury mater při epidurální analgezii (PDA) 
PDA = peridurální analgezie Přínosná by v případě perforace u PDA mohla být aplikace opioidu subarachnoidálně pro jeho analgetický efekt. Purifikovaný morfin se ale jeví v této indikaci nepraktický pro svůj pomalý nástup účinku a nutnost prodlouženého monitorování rodičky v poporodním období po spontánním porodu. Sufentanil má sice rychlý nástup účinku, ale podle SPC (Souhrn údajů o přípravku) není díky aditivům určen pro podávání do subarachnoidálního prostoru, stejně tak i fentanyl patří mezi off-label indikace s potenciálními komplikacemi.
V poslední době asi největší diskusi v managementu arteficiální punkce dury mater vyvolává tzv. teorie reaktivního zánětu v prevenci výskytu PDPH [40–44]. Prakticky to znamená zavedení epidurálního katétru intratekálně na 24 hodin a vytvoření aseptického zánětu v oblasti perforace kolem katétru. Předpokládá se, že po extrakci katétru se defekt vlivem nakupených zánětových buněk snadněji uzavře. Takto zavedený katétr (maximálně 3 cm v subarachnoidálním prostoru) je nutné vždy pečlivě označit a poučit o místu zavedení ošetřující zdravotnický personál, aby nedošlo k nechtěné aplikaci epidurálních dávek sub-arachnoidálně. Několik recentních studií dokazuje použití tohoto postupu asi v 25–36 % nechtěných perforací dury mater [40, 45, 46]. Samozřejmostí je minimalizace rizika infekce a vzniku meningitidy [47], proto je z této metody nutno vyloučit rodičky s možnými infekčními komplikacemi (např. kolostomie).
TERAPIE
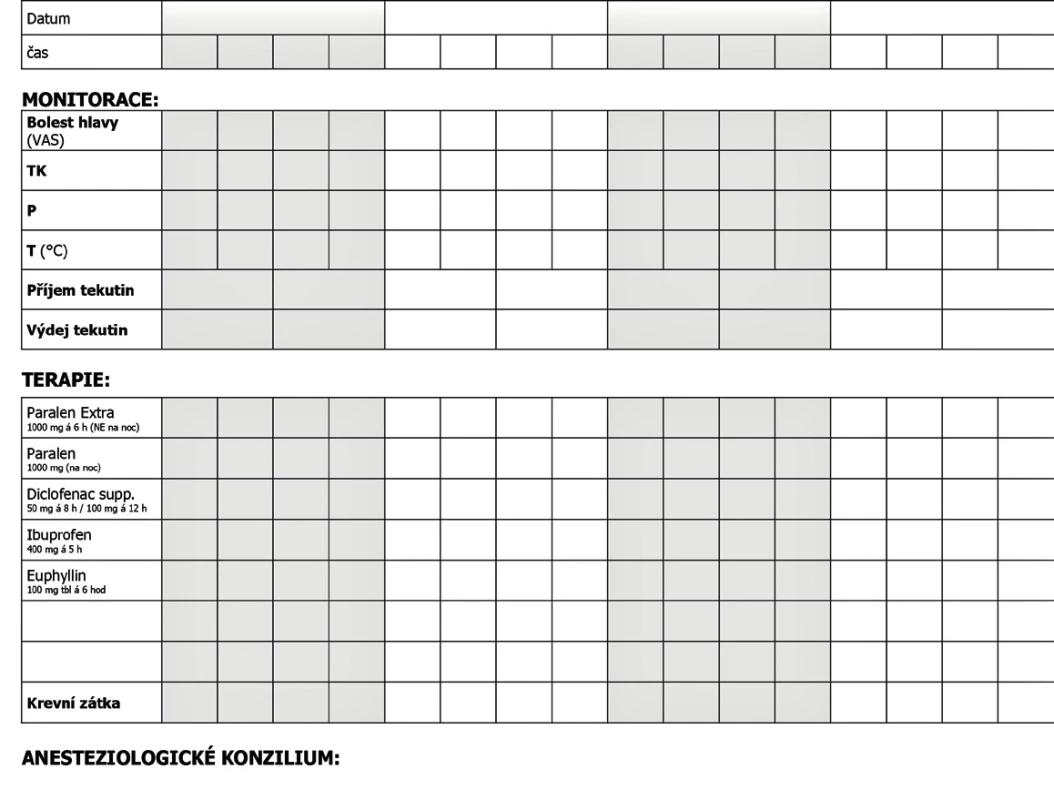
Hlavní zásadou je pečlivá dokumentace a pravidelné monitorování pacientky s postpunkčním syndromem anesteziologem. V praxi je velmi přínosné i vytvoření lokálního protokolu PDPH, které odpovídá potřebám daného pracoviště [48]. Příkladem může být protokol používaný ve VFN Praha (obr. 1). Při nechtěné perforaci dura mater, kdy je vznik PDPH vysoce pravděpodobný, rodičku o vzniklé komplikaci informujeme a zejména zdůrazníme, že je to situace řešitelná a pacientka bude stále pod naší kontrolou. V případě podezření na možný vznik postpunkčního syndromu vždy informujeme ošetřující personál a při prvních klinických projevech zahajujeme léčbu. Je třeba mít na paměti, že některé případy se mohou vyvinout i v právní spory. V žádném případě bychom neměli PDPH podceňovat, jelikož v souvislosti s postpunkčním syndromem mohou vzniknout i velmi závažné komplikace. Mezi ně patří obrny hlavových nervů a subdurální hematom, jako následek přetržení přemosťujících vén při likvorové hypotenzi [42, 49]. V literatuře se často diskutuje o existenci a významu případných preventivních opatření, která by mohla zabránit postpunkčnímu syndromu při nechtěné perforaci tvrdé pleny. Praxe však potvrzuje, že preventivní klid na lůžku, hyperhydratace infuzní terapií [50, 51], preventivní podávání paracetamolu s kofeinem [52], profylaktická krevní zátka [53] ani abdominální bandáž nezabrání vzniku symptomů [10, 42].Abdominální bandáž je navíc v poporodním období nekomfortní a může zvyšovat riziko trombembolické choroby. Přirozeně pacientky preferují klidový režim v horizontální poloze, který zmírňuje klinické projevy PDPH. Z léčebných opatření je nutno zabránit dehydrataci. Základem terapie PDPH je zpočátku konzervativní analgetická terapie a po 24 hodinách neúspěšného konzervativního postupu se přistupuje k aplikaci krevní zátky. Po celou dobu je nutná podpora psychiky pacientek. Doporučené postupy jednotlivých anesteziologických společností neexistují. Terapeutický postup při léčbě PDPH se opírá o literární zdroje a doporučené postupy různých porodnických pracovišť. Ty především definují časování a možnosti konzervativní a invazivní terapie.
KONZERVATIVNÍ TERAPIE
Základem konzervativní terapie PDPH je klidový režim, dostatečná hydratace a farmakoterapie (tab. 2). Výběr analgetik je nutno podřídit již nastupující laktaci, a tak lékem první volby zůstává paracetamol a nesteroidní antiflogistika s krátkým poločasem – ibuprofen a diklofenak. K potenciaci analgetického účinku lze tato analgetika kombinovat. Díky vazodilataci mozkových cév má postpunkční cefalea migrenózní charakter, a proto v její léčbě mají své místo i methylxantiny (kofein, theophyllin). Methylxantiny blokují adenosinové receptory v mozku a tím vedou k vazokonstrikci, ale jejich efekt je spíše dočasný [6] a mají význam zejména na počátku léčby [54]. Intravenózně aplikovaný aminophyllin však může výskyt PDPH i přímo snižovat [55]. Některé literární zdroje užívání metylxantinů zpochybňují [56], ale přesto zůstávají součástí managementu terapie PDPH většiny pracovišť [10]. Doporučené dávkování kofeinu je 300–500 mg/den (1 šálek silné kávy obsahuje 50–100 mg kofeinu) [10]. V zahraničí je kofein dostupný i v intravenózní formě, u nás ho používáme v kombinovaném přípravku s paracetamolem (1 tbl obsahuje paracetamol 500 mg a kofein 65 mg). Analgetika podáváme v pravidelných časových intervalech. Na noc je racionální, z důvodu možné excitace a narušení spánku novorozence, užít samotný paracetamol bez přídavku kofeinu.
Table 2. Farmakoterapie PDPH v porodnictví 
Methylxantiny V léčbě PDPH se uplatňují také antimigrenika – triptany. Nejvíce zkušeností v této indikaci je se sumatriptanem [57, 58]. Nevýhodou je však jeho cena a zejména nutnost přerušení kojení až na 24 hodin z důvodu přestupu do mléka.
Předmětem zkoumání jsou ACTH (adrenokortikotropní hormon) a hydrocortizon, u kterých se uvažuje přímý stimulační vliv na tvorbu mozkomíšního moku a tím zmírnění intenzity PDPH [59–60].
Jestliže jsou bolesti hlavy snesitelné a klinické projevy postpunkčního syndromu mírné, lze pokračovat v konzervativní terapii i doma s postupným snižováním dávek analgetik v průběhu 2 týdnů.
Pokud jsou projevy PDPH i přes 24hodinovou konzervativní terapii intenzivní, nebo dojde-li ke zhoršení symptomů i po propuštění domů, je nutné zvážit invazivní postup – aplikaci krevní zátky.
INVAZIVNÍ TERAPIE – KREVNÍ ZÁTKA
Krevní zátka (blood patch – BP) představuje celosvětově zlatý standard v léčbě PDPH a je na podkladě metaanalýz [62] jednoznačně účinnější oproti konzervativní terapii. To ale neznamená, že se za každé situace jedná o nejlepší možný postup – vzhledem k invazivitě BP je vždy nutno aplikaci zátky individuálně zvážit [63]. Spočívá v aplikaci autologní krve do epidurálního prostoru v oblasti perforace tvrdé pleny. Kontraindikací provedení jsou septikémie, poruchy koagulace a odmítnutí pacientkou. Antibiotická profylaxe k výkonu se standardně neprovádí. Princip účinku BP zahrnuje dva mechanismy [10, 42]:
- Rychlý vzestup epidurálního, lumbálního a intrakraniálního subarachnoidálního tlaku a tím dochází k reverzi adenosinem zprostředkované cerebrální venodilatace.
- Adherence krve k dura mater, vytvoření fibrinové zátky a zabránění dalšímu úniku mozkomíšního moku.
V literatuře se rozlišuje pojem profylaktická krevní zátka a terapeutická krevní zátka (tab. 3). Profylaktická BP je provedena bezprostředně po perforaci, zatímco terapeutická BP je aplikována až při projevech postpunkčního syndromu. Profylaktická krevní zátka není všeobecně doporučována, a to ani v porodnictví, protože četnost aplikace terapeutické BP, a to i přesto, že může zkracovat délku trvání symptomů PDPH. V časné fázi, kdy je únik moku největší, může být navíc narušena adherence krve k tvrdé pleně, přičemž lokální anestetika (bupivakain, lidokain) interferují s tvorbou krevního koagula [53, 64].
Table 3. Management krevní zátky (BP) 
BP = blood patch, PDPH = postdural puncture headache Nejčastěji diskutovanými otázkami v případě krevní zátky jsou načasování a velikost objemu krve. Většina literárních zdrojů a doporučení jednotlivých nemocnic se shodují na časovém odstupu minimálně 24–48 hodin od perforace nebo po 24 hodinách trvající neúspěšné konzervativní terapii. Aplikace s delším časovým odstupem zvyšuje účinnost BP až na 70–98 % [10, 65]. V praxi se setkáváme s velikostí objemu krve 5–30 ml, za optimum považuje většina autorů objem 20 ml [10, 66, 67]. V případě, že se při aplikaci objeví kořenové dráždění je doporučeno dále nepokračovat a výkon ukončit na daném objemu krve. Zvláště v porodnictví není neobvyklé, že i po BP nedojde k úlevě nebo se intenzita symptomů opět zhorší a je nutno provést opakovanou BP s odstupem minimálně 24 hodin. U pacientek, které odmítají krevní deriváty, je možné krev nahradit dextranem [10]. To však vyžaduje zvýšenou opatrnost z důvodu možného vzniku alergické až anafylaktické reakce.
Nezbytnou součástí tohoto výkonu je sepsání informovaného souhlasu. Po výkonu se doporučuje 1–2 hodiny horizontální poloha na lůžku. Nejčastějšími komplikacemi BP jsou: bolesti zad (35 %), bolesti v oblasti krční páteře (0,9 %) a přechodné zvýšení teploty trvající 24–48 hodin (5 %) [6]. Při nejasných potíží je vždy nutné neurologické vyšetření, případně zobrazovací metoda (CT, NMR).
ZÁVĚR
Postpunkční cefalea v porodnictví je vždy komplikací, kterou nelze podceňovat. Hlavní zásadou je komunikace, podpora psychiky pacientky a využití všech prostředků konzervativní i invazivní terapie. Neléčený postpunkční syndrom může vyústit až ve fatální komplikace. Při sebemenších pochybnostech v diagnostice neváháme s neurologickým vyšetřením a zobrazovacími metodami. Pečlivá dokumentace musí být vždy nezbytnou součástí našeho léčebného úsilí.
Do redakce došlo dne 3. 1. 2014.
Do tisku přijato dne 1. 3. 2014.
Adresa pro korespondenci:
MUDr. Jan Bláha, Ph.D.
KARIM 1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: jan.blaha@lf1.cuni.cz
Sources
1. Chan, T. M., Ahmed, E., Yentis, S., M., Holdcroft, A. Obstetric Anaesthetists A, Group NS: Postpartum headaches: summary report of the National Obstetric Anaesthetic Database (NOAD) 1999. International journal of obstetric anesthesia, 2003, 12 (2), p. 107–112.
2. Reynolds, F. Epidural analgesia during childbirth. Minimising headache after dural puncture. BMJ, 1993, 307 (6895), p. 63–64.
3. Ramaswamy, K. K., Burumdayal, A., Bhardwaj, M., Russell, R.A UK survey of the management of intrathecal catheters. International journal of obstetric anesthesia, 2013, 22 (3), p. 257–259.
4. Liu, S., Carpenter, R. L., Neal, J. M. Epidural anesthesia and analgesia. Their role in postoperative outcome. Anesthesiology, 1995, 82 (6), p. 1474–1506.
5. Evans, R. W. Complications of lumbar puncture. Neurol. Clin. 1998, 16 (1), p. 83–105.
6. Ghaleb, A. Postdural puncture headache. Anesthesiol. Res. Pract., 2010.
7. Costigan, S. N., Sprigge, J. S. Dural puncture: the patients‘ perspective. A patient survey of cases at a DGH maternity unit 1983-1993. Acta Anaesthesiologica Scandinavica, 1996, 40 (6), p. 710–714.
8. Vandam, L. D., Dripps, R. D. Long-term follow-up of patients who received 10,098 spinal anesthetics; syndrome of decreased intracranial pressure (headache and ocular and auditory difficulties). J. Am. Med. Assoc., 1956, 161 (7), p. 586–591.
9. Rando, T. A., Fishman, R. A. Spontaneous intracranial hypotension: report of two cases and review of the literature. Neurology, 1992, 42 (3 Pt 1), p. 481–487.
10. Turnbull, D. K., Shepherd, D. B. Post-dural puncture head-ache: pathogenesis, prevention and treatment. British Journal of anaesthesia, 2003, 91 (5), p. 718–729.
11. Grant, R., Condon, B., Hart, I., Teasdale, G. M. Changes in intracranial CSF volume after lumbar puncture and their relationship to post-LP headache. Journal of Neurology, Neurosurgery, and Psychiatry, 1991, 54 (5), p. 440–442.
12. Goldszmidt, E., Kern, R., Chaput, A., Macarthur, A. The incidence and etiology of postpartum headaches: a prospective cohort study. Can. J. Anaesth., 2005, 52 (9), p. 971–977.
13. Sances, G., Granella, F., Nappi, R. E., Fignon, A., Ghiotto, N.,Polatti, F., Nappi, G. Course of migraine during pregnancy and postpartum: a prospective study. Cephalalgia, 2003, 23 (3), p. 197–205.
14. Stella, C. L., Jodicke, C. D., How, H. Y., Harkness, U. F.,Sibai, B. M. Postpartum headache: is your work-up complete? Am. J. Obstet. Gynecol., 2007, 196 (4), p. 318 e311–317.
15. Macgregor, E. A. Headache in pregnancy. Continuum (MinneapMinn), 2014, 20 (1 Neurology of Pregnancy), p. 128–147.
16. Lynch, J., Krings-Ernst, I., Strick, K., Topalidis, K., Schaaf, H.,Fiebig, M. Use of a 25-gauge Whitacre needle to reduce the incidence of postdural puncture headache. British Journal of Anaesthesia, 1991, 67 (6), p. 690–693.
17. Chohan, U., Hamdani, G. A. Post dural puncture headache.J. Pak. Med. Assoc., 2003, 53 (8), p. 359–367.
18. Spencer, H. C. Postdural puncture headache: what matters in technique. Reg. Anesth. Pain. Med., 1998, 23 (4), p. 374–379, discussion 384–377.
19. Ravindran, R. S., Viegas, O. J., Tasch, M. D., Cline, P. J., Deaton, R. L., Brown, T. R. Bearing down at the time of delivery and the incidence of spinal headache in parturients. Anesthesia and analgesia, 1981, 60 (7), p. 524–526.
20. Flaatten, H., Felthaus, J., Kuwelker, M., Wisborg, T. Postural post-dural puncture headache. A prospective randomised study and a meta-analysis comparing two different 0.40 mm O.D. (27 g) spinal needles. Acta anaesthesiologica Scandinavica, 2000, 44 (6), p. 643–647.
21. Halpern, S., Preston, R. Postdural puncture headache and spinal needle design. Metaanalyses. Anesthesiology, 1994, 81 (6), p. 1376–1383.
22. Lambert, D. H., Hurley, R. J., Hertwig, L., Datta, S. Role of needle gauge and tip configuration in the production of lumbar puncture headache. Reg. Anesth., 1997, 22 (1), p. 66–72.
23. Sibai, B. M., Stella, C. L. Diagnosis and management of atypical preeclampsia-eclampsia. American Journal of Obstetrics and Gynekology, 2009, 200 (5), p. 481 e481–487.
24. Norris, M. C., Leighton, B. L., DeSimone, C. A. Needle bevel direction and headache after inadvertent dural puncture. Anesthesiology, 1989, 70 (5), p. 729–731.
25. Reina, M. A., Dittmann, M., Lopez Garcia, A., van Zundert, A.New perspectives in the microscopic structure of human dura mater in the dorsolumbar region. Reg. Anesth., 1997, 22(2), p. 161-166.
26. Ready, L. B., Cuplin, S., Haschke, R. H., Nessly, M. Spinal needle determinants of rate of transdural fluid leak. Anesthesia and analgesia, 1989, 69(4), p. 457-460.
27. Reina, M. A., Lopez-Garcia, A., de Andres-Ibanez, J. A., Dittmann, M., Cascales, M. R., del Cano, M. C., Daneri, J., Zambrano, O. Electron microscopy of the lesions produced in the human dura mater by Quincke beveled and Whitacre needles. Revista espanola de anestesiologia y reanimacion, 1997, 44 (2), p. 56–61.
28. Reina, M. A., Lee, R. A.: Prevention of post-dural puncture headache (PDPH) in parturients. Contributions from experimental research. Acta anaesthesiologica Scandinavica, 2013, 57 (7), p. 947–949.
29. Seeberger, M. D, Kaufmann, M., Staender, S., Schneider, M., Scheidegger, D. Repeated dural punctures increase the incidence of postdural puncture headache. Anesthesia and analgesia, 1996, 82 (2), p. 302–305.
30. Flaatten, H., Rodt, S. A., Vamnes, J., Rosland, J., Wisborg, T.,Koller, M. E. Postdural puncture headache. A comparison between 26 - and 29-gauge needles in young patients. Anaesthesia, 1989, 44 (2), p. 147–149.
31. Hoskin, M. F. Spinal anaesthesia – the current trend towards narrow gauge atraumatic (pencil point) needles. Case reports and review. Anaesth. Intensive Care, 1998, 26 (1), p. 96–106.
32. Aida, S., Taga, K., Yamakura, T., Endoh, H., Shimoji, K. Headache after attempted epidural block: the role of intrathecal air. Anesthesiology, 1998, 88 (1), p. 76–81.
33. Kuczkowski, K. M. Post-dural puncture headache, intracranial air and obstetric anesthesia. Anaesthesist, 2003, 52 (9), p. 798–800.
34. Nafiu, O. O., Urquhart, J. C. Pneumocephalus with headache complicating labour epidural analgesia: should we still be using air? International journal of obstetric anesthesia, 2006, 15 (3), p. 237–239.
35. Velickovic, I. A., Pavlik, R. Pneumocephalus complicated by postdural puncture headache after unintentional dural puncture. Anesthesia and analgesia, 2007, 104 (3), p. 747–748.
36. Bradbury, C. L., Singh, S. I., Badder, S. R., Wakely, L. J., Jones, P. M. Prevention of post-dural puncture headache in parturients: a systematic review and meta-analysis. Acta anaesthesiologica Scandinavica, 2013, 57 (4), p. 417–430.
37. Bart, A. J., Wheeler, A. S. Comparison of epidural saline placement and epidural blood placement in the treatment of post-lumbar-puncture headache. Anesthesiology, 1978, 48 (3), p. 221–223.
38. Crawford, J. S. The prevention of headache consequent upon dural puncture. British Journal of Anaesthesia, 1972, 44 (6), p. 598–600.
39. Charsley, M. M., Abram, S. E. The injection of intrathecal normal saline reduces the severity of postdural puncture headache. Reg Anesth Pain Med, 2001, 26 (4), p. 301–305.
40. Baysinger, C. L., Pope, J. E., Lockhart, E. M., Mercaldo, N. D.The management of accidental dural puncture and postdural puncture headache: a North American survey. Journal of Clinical Anesthesia, 2011, 23 (5), p. 349–360.
41. Gunaydin, B., Karaca, G. Prevention strategy for post dural puncture headache. Acta Anaesthesiol. Belg., 2006, 57 (2), p. 163–165.
42. Nath, G. S. M. Headache in parturient: Pathophysiology and management of post-dural puncture headache. Journal of Obstetric Anaesthesia and Critical Care, 2011, 1 (2), p. 57–66.
43. Kaddoum, R., Motlani, F., Kaddoum, R. N., Srirajakalidindi, A.,Gupta, D., Soskin, V. Accidental dural puncture, postdural puncture headache, intrathecal catheters, and epidural blood patch: revisiting the old nemesis. Journal of Anesthesia, 2013.
44. Heesen, M., Klohr, S., Rossaint, R., Walters, M., Straube, S., van de Velde, M. Insertion of an intrathecal catheter following accidental dural puncture: a meta-analysis. International journal of obstetric anesthesia, 2013, 22 (1), p. 26–30.
45. Gunaydin, B., Camgoz, N., Karaca, G., Gungor, I., Celebi, H. Survey of Turkish practice evaluating the management of post-dural puncture headache in the obstetric population (1). Acta Anaesthesiol. Belg., 2008, 59 (1), p. 7–12; quiz 13–14.
46. Newman, M. J., Cyna, A. M. Immediate management of inadvertent dural puncture during insertion of a labour epidural: a survey of Australian obstetric anaesthetists. Anaesth. Intensive Care, 2008, 36 (1), p. 96–101.
47. Cohen, S., Hunter, C. W., Sakr, A., Hijazi, R. H. Meningitis following intrathecal catheter placement after accidental dural puncture. International Journal of Obstetric Anesthesia, 2006, 15 (2), p. 172.
48. Gaiser, R. R. Postdural puncture headache: a headache for the patient and a headache for the anesthesiologist. Current opinion in anaesthesiology, 2013, 26 (3), p. 296–303.
49. Zeidan, A., Farhat, O., Maaliki, H., Baraka, A. Does postdural puncture headache left untreated lead to subdural hematoma? Case report and review of the literature. International journal of obstetric anesthesia, 2006, 15 (1), p. 50–58.
50. Cochrane Database Syst Rev 2013 Jul 12;7:CD009199 doi: 101002/14651858CD009199pub2.
51. Arevalo-Rodriguez, I., Ciapponi, A., Munoz, L., Roque i Figuls, M., Bonfill Cosp, X. Posture and fluids for preventing post-dural puncture headache. The Cochrane database of systematic reviews 2013, 7:CD009199.
52. Esmaoglu, A., Akpinar, H., Ugur, F. Oral multidose caffeine-paracetamol combination is not effective for the prophylaxis of postdural puncture headache. Journal of Clinical Anesthesia, 2005, 17 (1), p. 58–61.
53. Scavone, B. M., Wong, C. A., Sullivan, J. T., Yaghmour, E., Sherwani, S. S., McCarthy, R. J. Efficacy of a prophylactic epidural blood patch in preventing post dural puncture headache in parturients after inadvertent dural puncture. Anesthesiology, 2004, 101 (6), p. 1422–1427.
54. Camann, W. R., Murray, R. S., Mushlin, P. S., Lambert, D. H. Effects of oral caffeine on postdural puncture headache. A double-blind, placebo-controlled trial. Anesthesia and Analgesia, 1990, 70 (2), p. 181–184.
55. Basurto Ona, X., Uriona, Tuma, S. M., Martinez Garcia, L., Sola, I., Bonfill Cosp, X. Drug therapy for preventing post-dural puncture headache. The Cochrane database of systematic reviews, 2013, 2:CD001792.
56. Halker, R. B., Demaerschalk, B. M., Wellik, K. E., Wingerchuk, D. M., Rubin, D. I., Crum, B. A., Dodick, D. W. Caffeine for the prevention and treatment of postdural puncture headache: debunking the myth. Neurologist, 2007, 13 (5), p. 323–327.
57. Carp, H., Singh, P. J., Vadhera, R., Jayaram, A. Effects of the serotonin-receptor agonist sumatriptan on postdural puncture headache: report of six cases. Anesthesia and Analgesia, 1994, 79 (1), p. 180–182.
58. Hodgson, C., Roitberg-Henry, A. The use of sumatriptan in the treatment of postdural puncture headache. Anaesthesia, 1997, 52 (8), p. 808.
59. Carter, B. L., Pasupuleti, R. Use of intravenous cosyntropin in the treatment of postdural puncture headache. Anesthesiology, 2000, 92 (1), p. 272–274.
60. Neves, J. F., Vieira, V. L., Saldanha, R. M., Vieira Fde. A., Coutinho Neto, M., Magalhaes, M. G., Neves, M. M., Araujo, F. P.Hydrocortisone treatment and prevent post-dural puncture head-ache: case reports. Rev. Bras. Anestesiol., 2005, 55 (3), p. 343–349.
61. Noyan Ashraf, M. A., Sadeghi, A., Azarbakht, Z., Salehi, S., Hamediseresht, E. Evaluation of intravenous hydrocortisone in reducing headache after spinal anesthesia: a double blind controlled clinical study [corrected]. Middle East J. Anesthesiol., 2007, 19 (2), p. 415–422.
62. Boonmark, P., Boonmark, S. Epidural blood patching for preventing and treating post-dural puncture headache. The Cochrane database of systematic reviews, 2010, CD001791.
63. Rucklidge, O. M. All patients with a postdural puncture headache should receive an epidural blood patch. International Journal of Obstetric Anesthesia, 2014.
64. Agerson, A. N., Scavone, B. M. Prophylactic epidural bloodpatch after unintentional dural puncture for the prevention of postdural puncture headache in parturients. Anesthesia and Analgesia, 2012, 115 (1), p. 133–136.
65. Kokki, M., Sjovall, S., Keinanen, M., Kokki, H. The influence of timing on the effectiveness of epidural blood patches in parturients. International Journal of Obstetric Anesthesia, 2013, 22 (4), p. 303–309.
66. Paech, M. J., Doherty, D. A., Christmas, T., Wong, C. A. Epidural Blood Patch Trial G: The volume of blood for epidural blood patch in obstetrics: a randomized, blinded clinical trial. Anesthesia and Analgesia, 2011, 113 (1), p. 126–133.
67. Safa-Tisseront, V., Thormann, F., Malassine, P., Henry, M., Riou, B., Coriat, P., Seebacher, J. Effectiveness of epiduralblood patch in the management of post-dural puncture headache. Anesthesiology, 2001, 95 (2), p. 334–339.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2014 Issue 3-
All articles in this issue
- Bužií asistovaná koniotomie (BACT) na prasečím modelu – pilotní studie
- Kontinuální kaudální epidurální analgezie extrémně nedonošeného dítěte – kazuistika
- Postpunkční cefalea v porodnictví
- Úloha krátkodobých betablokátorů v anestezii a intenzivní péči
- Kandidová sepse jako komplikace u pacienta s polytraumatem
- Význam tromboelastografie (TEG) a tromboelastometrie (ROTEM) na jednotke intenzívnej starostlivosti
- Současné možnosti kontinuálního neinvazivního monitorování arteriálního tlaku
- Vladimír Lemon a hudba v korespondenci z let 2009–2010
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Postpunkční cefalea v porodnictví
- Význam tromboelastografie (TEG) a tromboelastometrie (ROTEM) na jednotke intenzívnej starostlivosti
- Bužií asistovaná koniotomie (BACT) na prasečím modelu – pilotní studie
- Kandidová sepse jako komplikace u pacienta s polytraumatem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career