-
Medical journals
- Career
Aplikace ultrazvuku u příjmu traumata nejasných šokových stavů (FAST)
Authors: Waldauf Petr
Authors‘ workplace: Klinika anesteziologie a resuscitace, Fakultní nemocnice Královské Vinohrady, Praha
Published in: Anest. intenziv. Med., 24, 2013, č. 5, s. 332-338
Category: Postgraduate education - ECHO didactics
FAST (Focused Assessment with Sonography for Trauma) je rychlé orientační sonografické vyšetření dutiny břišní a perikardu ve své rozšířené podobě (EFAST = extended FAST) zahrnuje i vyšetření hrudníku. FAST je dnes již rutinně používané vyšetření polytraumatizovaného pacienta. Fyzikální vyšetření u těchto pacientů s rizikem akutního život ohrožujícího krvácení naráží na stejná omezení jako u všech kriticky nemocných (hluboká analgosedace, eventuálně doplněná myorelaxací, umělá plicní ventilace atd.). Definitivní vyšetření především v podobě CT může vést ke zbytečné ztrátě času potřebného k akutnímu chirurgickému ošetření krvácení a tedy ohrozit pacienta na životě. FAST si neklade za cíl nahradit CT vyšetření, ale rozšířit možnosti fyzikálního vyšetření, a to velmi rychlým, okamžitě dostupným (bedside) a jednoduchým způsobem.
Primárním cílem FAST je detekce volné tekutiny v dutině břišní, pleurální a perikardiální. U polytraumatizovaného pacienta se předpokládá, že volnou tekutinou je krev (hemoperitoneum, hemotorax a hemoperikard). V případě pozitivity FAST může následovat rychlá změna managementu pacienta (urgentní operační výkon místo CT), a to zvláště tehdy, pokud je přítomna oběhová nestabilita. K tomu podle práce Ollertona [1] dochází až ve 33 % případů a podle Wherretta stačí k identifikaci volné tekutiny pouze 19 sekund [2].
Sekundární cíl je poněkud kontroverznější, a ne zcela akceptovaný. U hemodynamicky stabilního pacienta se provede pouze FAST, a pokud je negativní, CT se již dále neprovádí (samozřejmě za podmínek, že není podezření na další poranění, jako je kraniotrauma, spinální trauma apod.). Pacient je dále monitorován a FAST se případně opakuje podle potřeby. Pacient tak není zbytečně ozařován a ušetří se finanční prostředky za CT vyšetření [3, 4, 5] – tabulka 1.
Table 1. Primární a sekundární cíl FAST 
U základního FAST jsou vyšetřovány 4 torzo regiony (4P):
- Perihepatický (Morisonův) prostor: mezi játry a pravou ledvinou – obrázky 1 a 2.
- Perisplenický prostor: mezi slezinou a levou ledvinou – obrázky 3 a 4.
- Pánevní (Douglasův) prostor: optimálně při naplněném močovém měchýři – obrázky 5 a 6.
- Perikardiální prostor – obrázky 7 a 8.
Image 1. Umístění sondy pro zobrazení Morisonova perihepatického prostoru 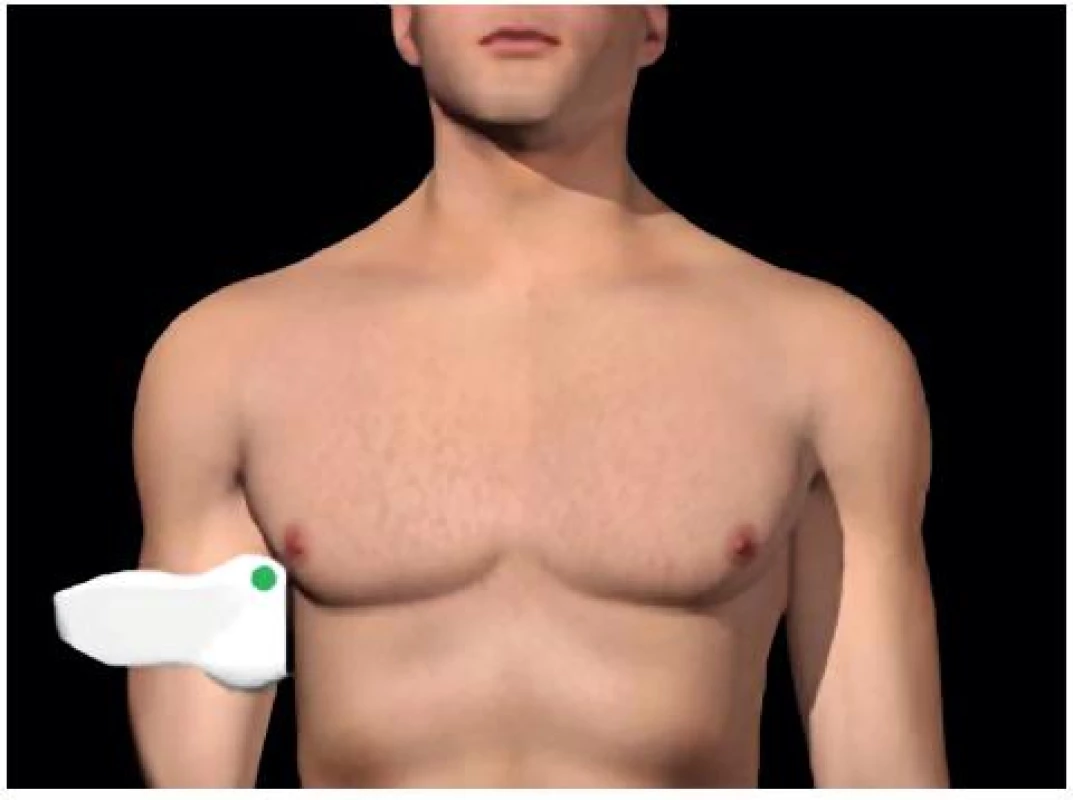
Image 2. Sonografický obraz Morisonova perihepatického prostoru 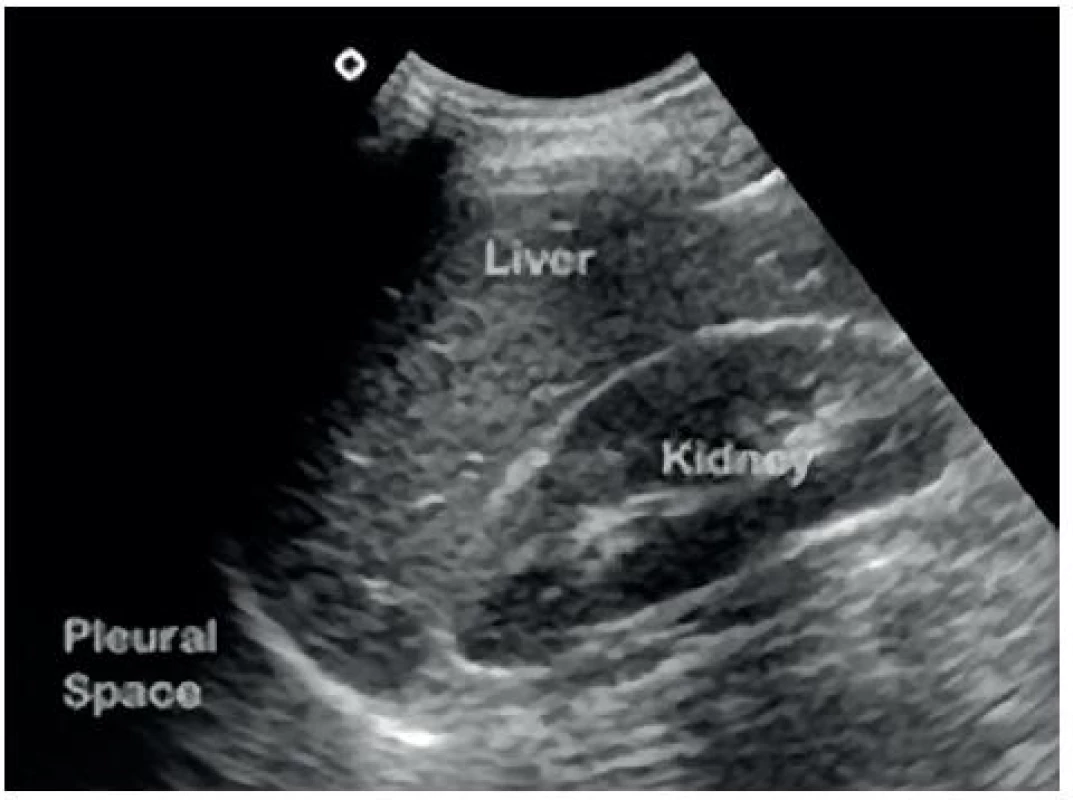
Image 3. Umístění sondy pro zobrazení perisplenického prostoru 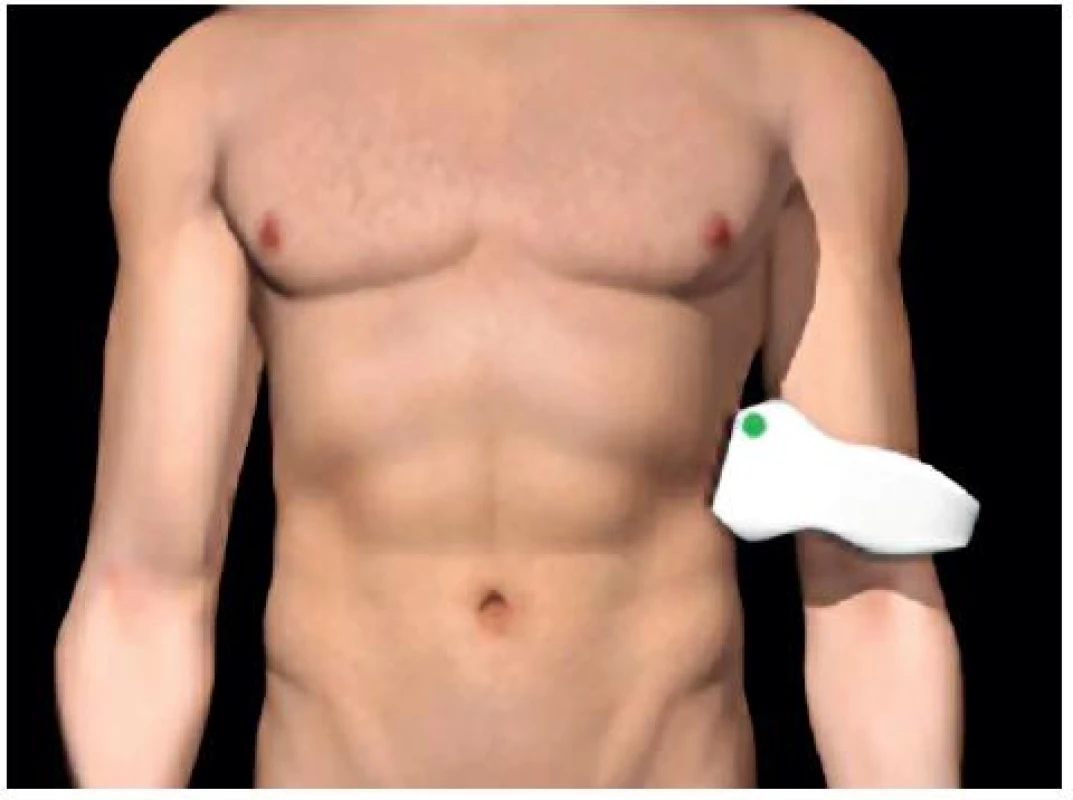
Image 4. Sonografický obraz perisplenického prostoru 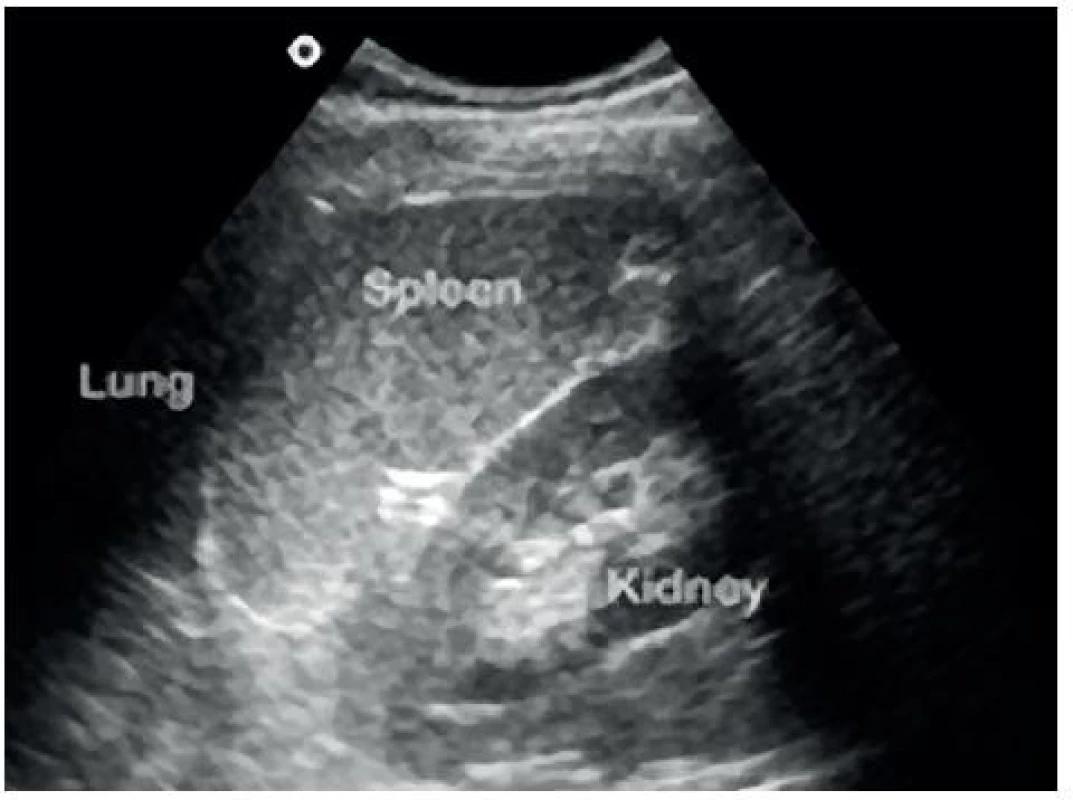
Image 5. Umístění sondy pro zobrazení Douglasova pánevního prostoru 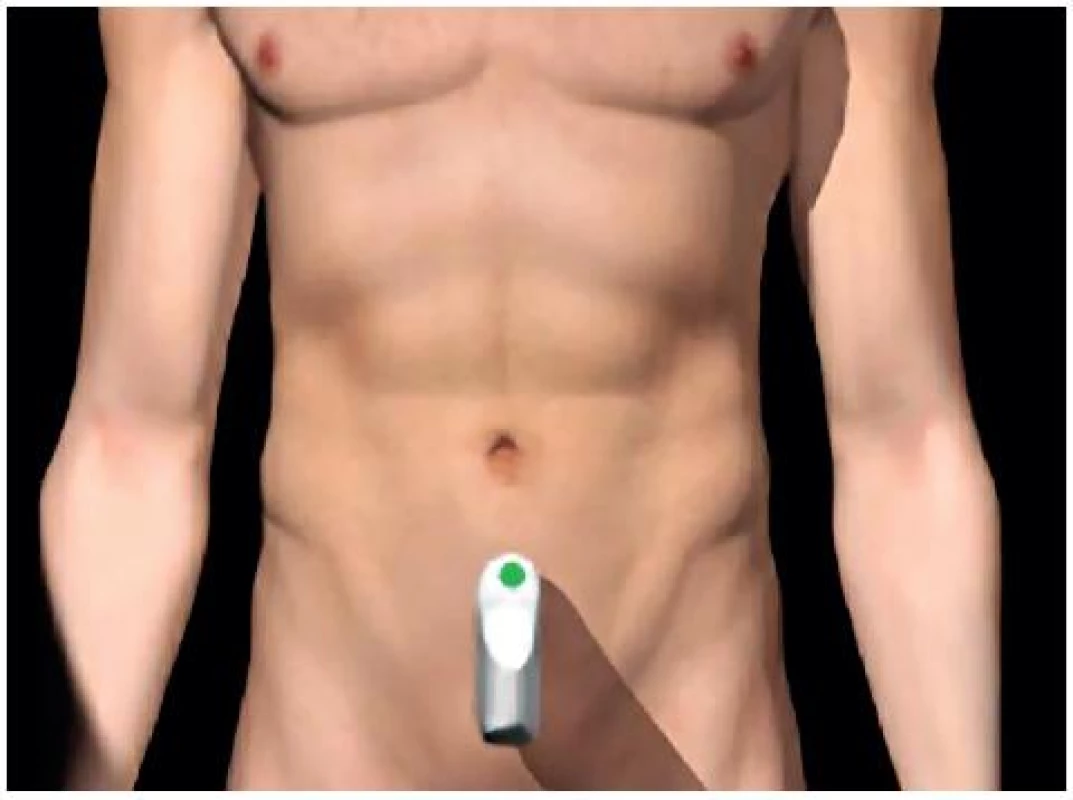
Image 6. Sonografický obraz Douglasova pánevního prostoru 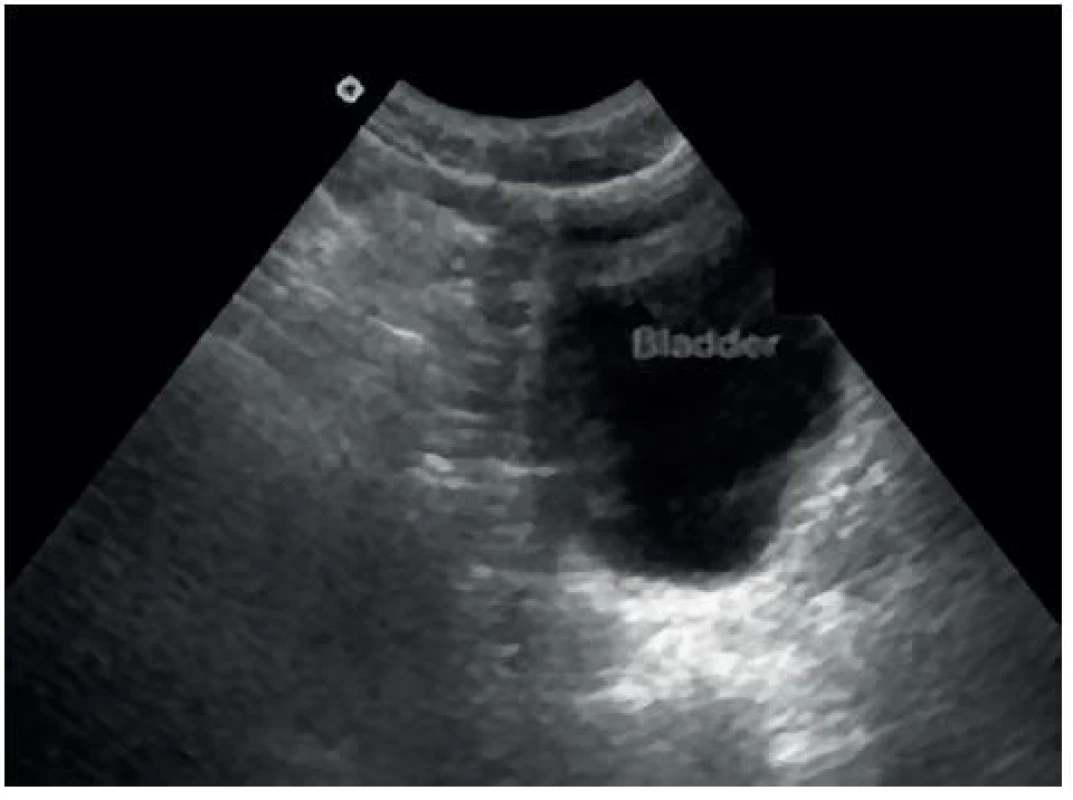
Image 7. Umístění sondy pro zobrazení perikardiálního prostoru 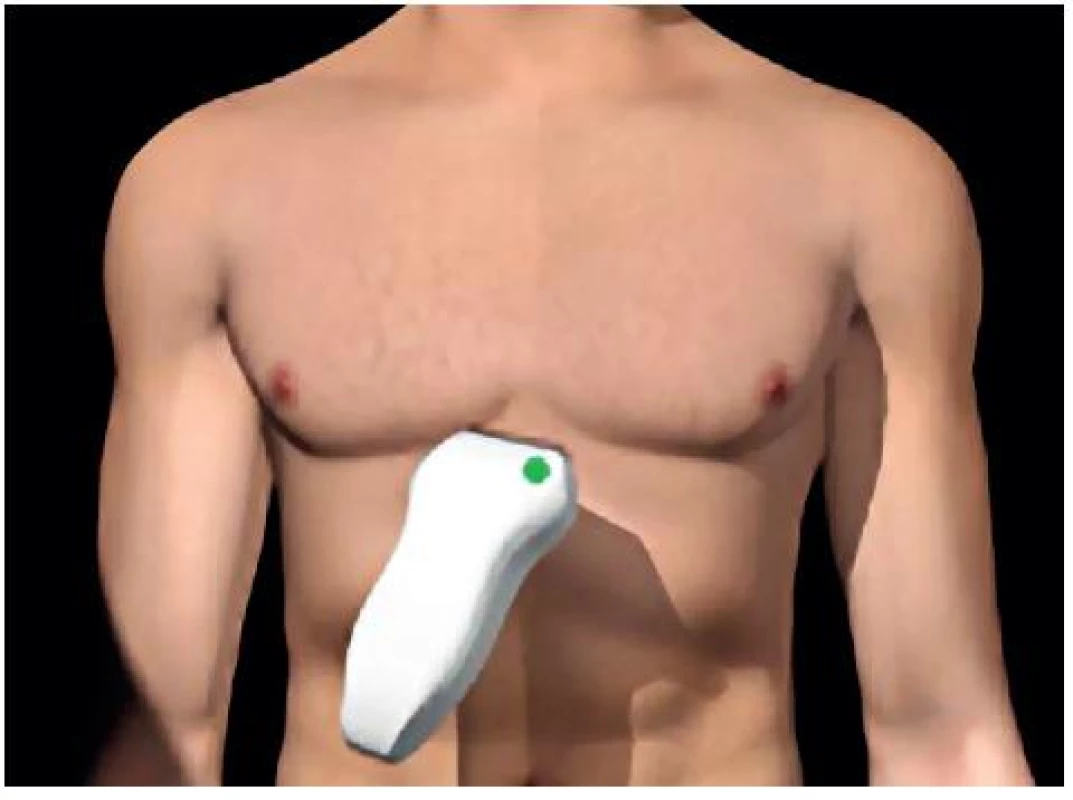
Image 8. Sonografický obraz perikardiálního prostoru 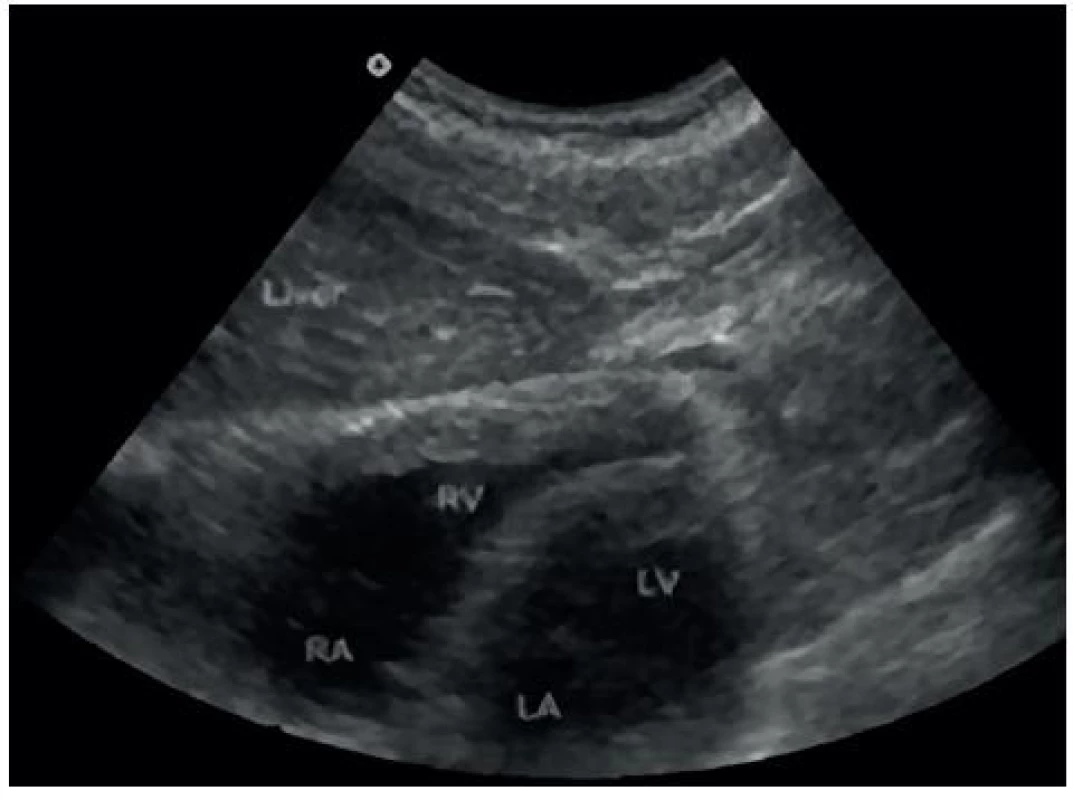
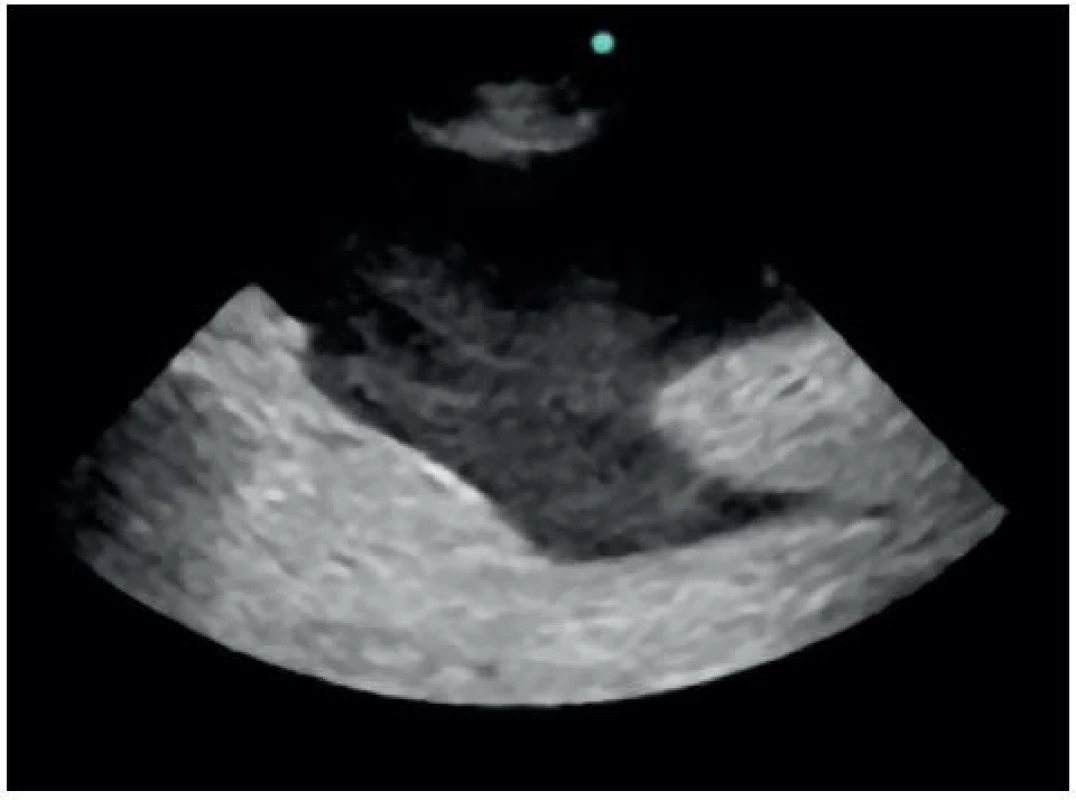
Volná tekutina v dutině břišní je nejčastěji detekována v Morisonově prostoru (86 %), méně často v perisplenickém (55 %) a pánevním (43 %) [6]. Nález při negativním a pozitivním FAST v Morisonově prostoru je znázorněn na obrázku 9, respektive 10. Velká metaanalýza, která zahrnovala více než 18 tisíc pacientů, prezentovala senzitivitu FAST 79% (95 % CI: 75 %, 83 %) a specificitu 99,2% (95% CI: 99,0 %, 99,4 %) [7]. Senzitivita a specificita FAST v detekci volné tekutiny v dutině břišní byla porovnávána nejčastěji proti CT, peritoneální laváži a laparatomii. Relativně nízká senzitivita je dána především schopností FAST detekovat tekutinu až od určitého objemu. Branney ve své práci zjistil, že nejmenší objem volné tekutiny v dutině břišní, který je možné v Morisonově prostoru detekovat, odpovídá přibližně 250 ml [8]. Objem 1000 ml by měl být detekovatelný již téměř ve 100 % případů. Na nízkou senzitivitu však není nutno nahlížet zcela negativně. V 80–90. letech FAST postupně zcela nahradil jinou, do té doby rutinně používanou metodu pro detekci krve v dutině břišní, a to diagnostickou peritoneální laváž. Její extrémní senzitivita (≥ 100,000 RBCs/mm3, což je cca 20 ml krve v 1000 ml lavážní tekutiny) vedla k častým neterapeutickým laparotomiím (6–26 %) [9].
Image 9. Negativní FAST v Morisonově prostoru 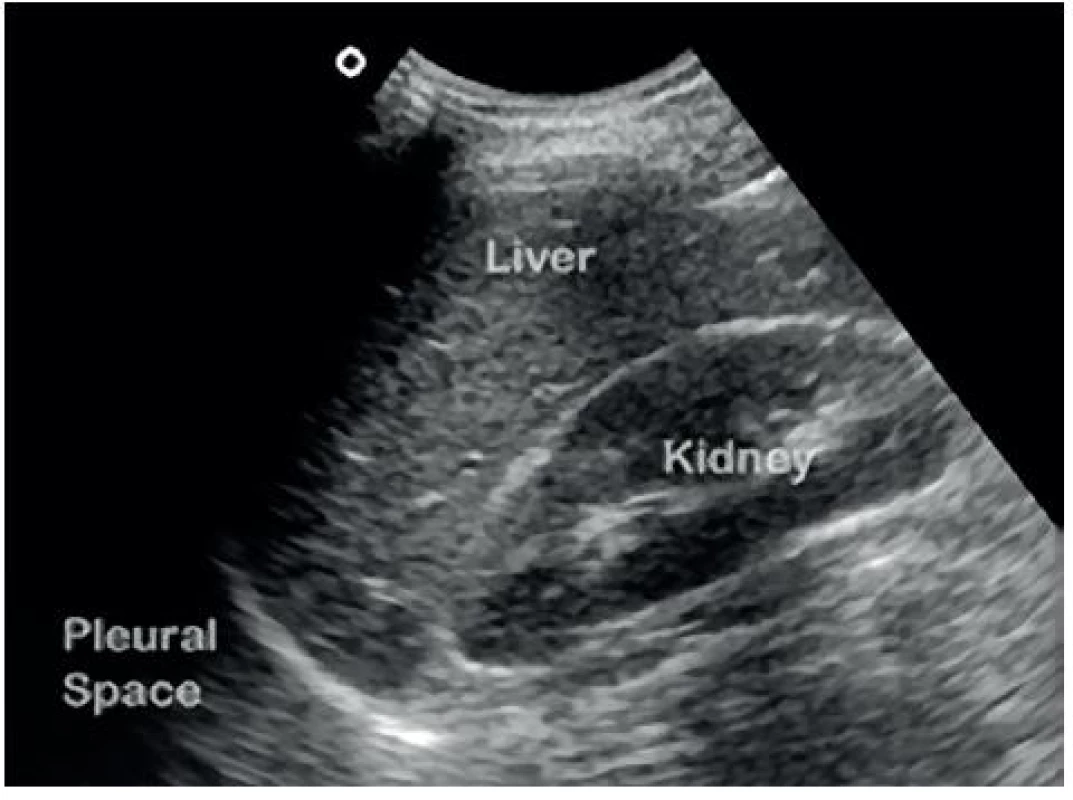
Image 10. Pozitivní FAST v Morisonově prostoru 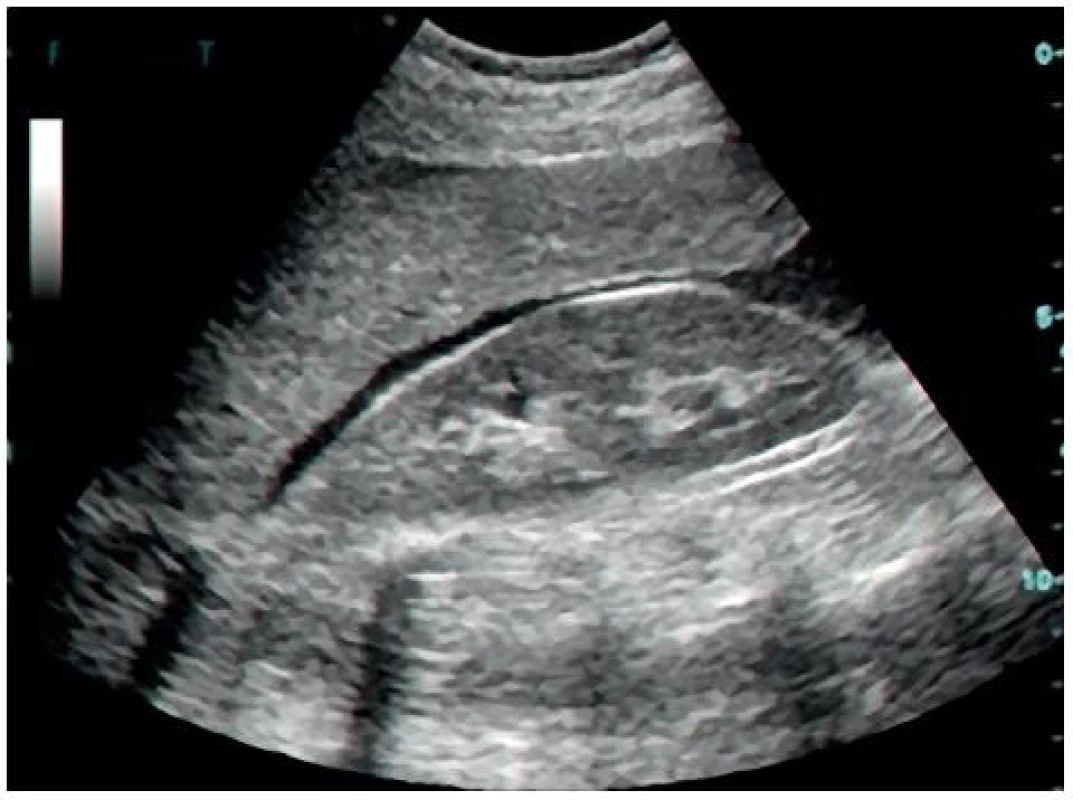
Zvýšení senzitivity lze o pár procent dosáhnout několika opatřeními:
- přidáním zobrazovaných oblastí na pravý a levý subdiafragmatický a parakolický prostor,
- Trendelenburgovou pozicí (zvýší se pravděpodobnost detekce tekutiny v Morisonově prostoru),
- opakováním FAST v čase. Pokud FAST neprokazuje volnou tekutinu ani po 6 hodinách je možno FAST označit za definitivně negativní [7].
Falešnou pozitivitu (a tedy sníženou specificitu) může zapříčinit detekce volné tekutiny, kterou však není krev. Často se jedná o pacienty s ascitem. Malé množství tekutiny v malé pánvi je přítomno také u žen v gestačním věku. Vzhledem k výše uvedené senzitivitě 99 % [8] není tento problém příliš klinicky významný. V individuálních případech je však potřeba na ascites pomýšlet.
FAST má do určité míry schopnost lokalizovat zdroj krvácení. Vlastní identifikace poraněného orgánu je však velmi omezená a FAST si tento cíl ani neklade. Identifikovat např. laceraci sleziny je možné zpravidla až po podání sono-kontrasní látky (mikrobubliny). Omezená možnost určit lokalitu krvácení spočívá v identifikaci místa s největším množstvím volné tekutiny (největší separace). Krvácení se dále šíří tradičními cestami, jak je pro případ lacerované sleziny zobrazeno na obrázku 11. V tomto případě se krev šíří z levého subdiafragmatického a splenorenálního prostoru do pravého subdiafragmatického a Morisonova prostoru. Z obou subdiafragmatických oblastí pak stéká do malé pánve parakolickými prostory (obr. 11).
Image 11. Šíření krvácení tradičními cestami v případě lacerované sleziny 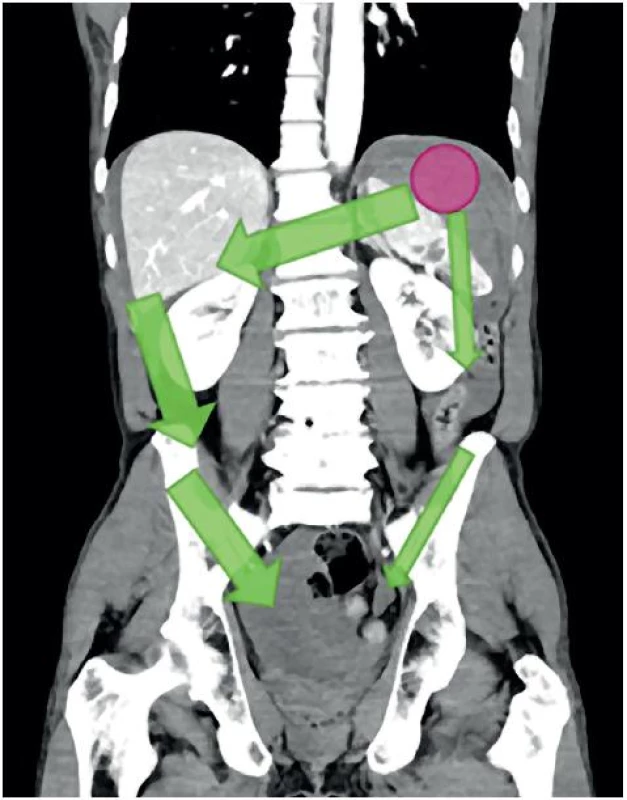
Krev dále po určité době sedimentuje, což je opět možné zachytit na ultrazvuku (obr. 12). K sedimentačnímu efektu pak zpravidla dochází nejdříve v blízkosti zdroje krvácení.
Limitace FAST jsou stejné jako u jiných sonografických vyšetření. Jedná se především o vyšetření u výrazně obézních pacientů nebo pacientů se subkutánním emfyzémem. Sražená krev může nezkušenému sonografistovi imponovat jako pa-renchymatozní orgán. FAST může být také falešně negativní, jak již bylo uvedeno výše, u pacientů se subkapsulární lacerací jater a sleziny bez přítomnosti volné krve v peritoneální dutině. Tekutinou naplněné kličky střev mohou imponovat jako volná tekutina, ale zpravidla mají na řezu oválný tvar na rozdíl od volné tekutiny, která se většinou zobrazuje jako troj - nebo mnohoúhelník.
EFAST (extended FAST)
Jedná se o rozšířenou podobu FAST o vyšetření hrudníku s cílem detekovat hemotoraxa pneumotorax. Rychlá detekce krve či vzduchu v pleurální dutině opět vede k bezprostřední změně našeho postupu – hrudní drenáži.
Hemotorax hodnotíme přiložením sondy přibližně v zadní axilární čáře nad úrovní bránice. Je možné i orientačně odhadnout objem volné tekutiny v pleurální dutině, a to změřením pleurální separace. Objem v mililitrech pak získáme vynásobením maximální separace parietální a viscerální pleury (nikoliv parietální pleury a bránice nad játry či slezinou) v milimetrech hodnotou 20 [11].
Abychom byli schopni identifikovat pneumotorax pomocí ultrazvuku, je nutné nejdříve se seznámit se základními sonografickými nálezy.
1. Pleurální sliding
Provzdušněnou plíci samozřejmě není možné prostřednictvím ultrazvuku vyšetřit. Můžeme ale detekovat pohyb viscerální pleury během nádechu a výdechu po přiložení sondy do mezižeberního prostoru. Sliding je možné zvýraznit v B-modu přidáním barevného dopplerovského mapování (obr. 13). Analogií pleurálního slidingu je lung pulse, což je pleurální sliding daný přenosem kardiálních kontrakcí, nikoli ventilací. Je samozřejmě patrný převážně v oblastech plic přilehlých k srdci.
Image 13. Pleurální sliding v B-modu a jeho zvýraznění přidáním barevného dopplerovského mapování 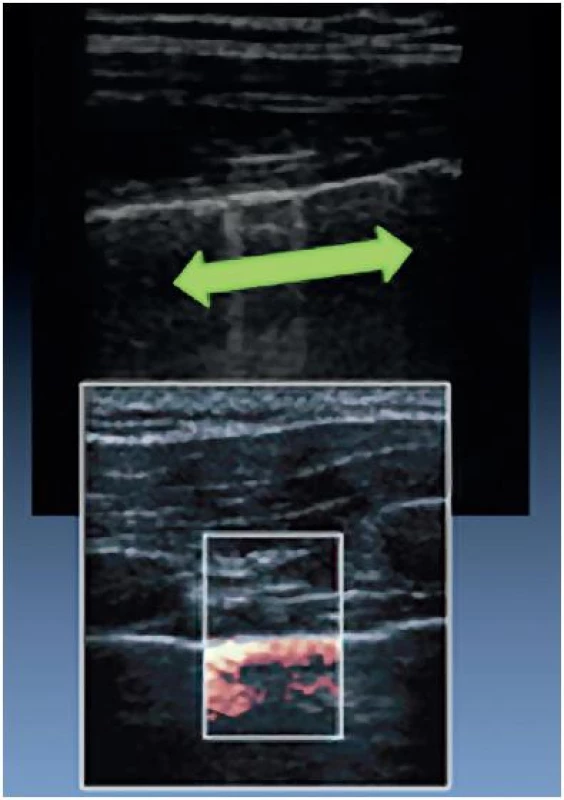
2. Seashore a atmosphere sign
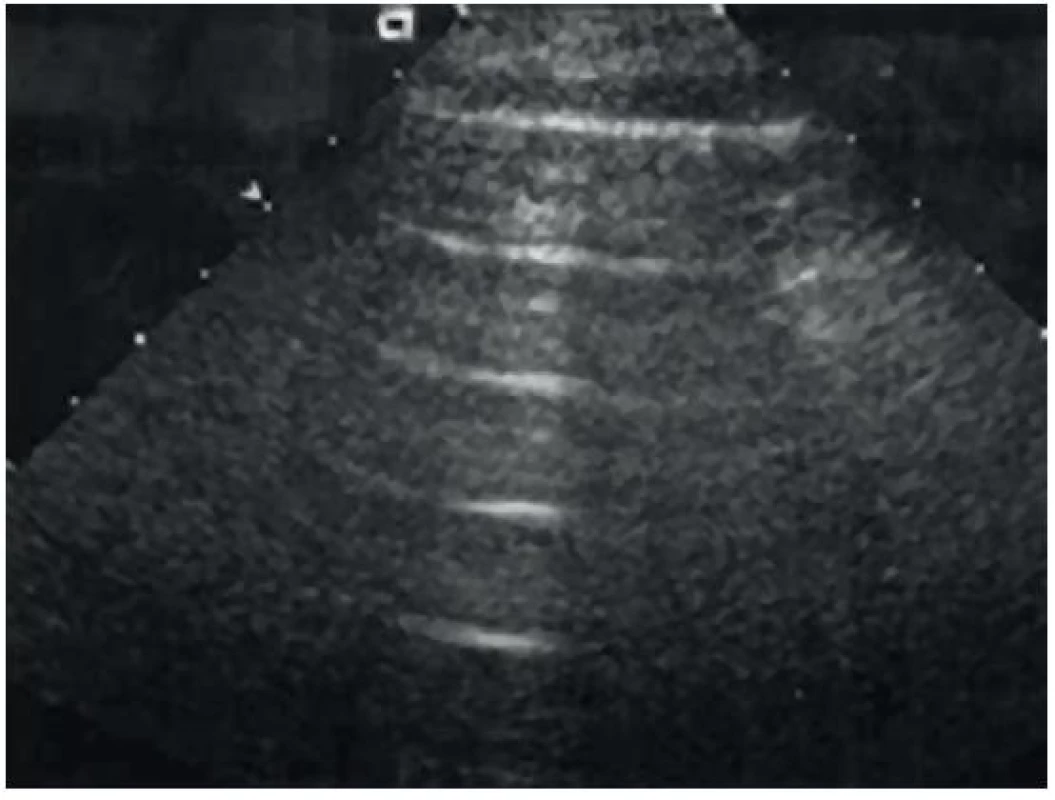
Je analogií přítomnosti či nepřítomnosti slidingu v M-modu. V případě nepřítomnosti pneumotoraxu, a tedy přítomnosti slidingu, můžeme sledovat linearní artefakty (připomínající moře) proximálně od pleury a zrnité artefakty (připomínající písek) distálně od pleury (obr. 14). V případě nepřítomnosti pleurálního slidingu, plicního pulzu a komet (B linií, viz níže) u pneumotoraxu vidíme pouze lineární artefakty (atmosphere/barcode sign, obr. 15).
Image 15. Atmosphere sign/Barcode sign 
3. Lung point
V případě přítomnosti pneumotoraxu je místo, kde se viscerální pleura odděluje od parietální označováno jako lung point (obr. 16). Tento bod je charakterizován střídající se přítomností a nepřítomností slidingu, respektive střídajícím se seashore a atmosphere sign s dechovým cyklem pacienta tak, jak se lehce mění pozice lung pointu (obr. 17).
Image 17. Střídající se seashore a atmosphere sign v oblasti lung pointu 
4. A-linie
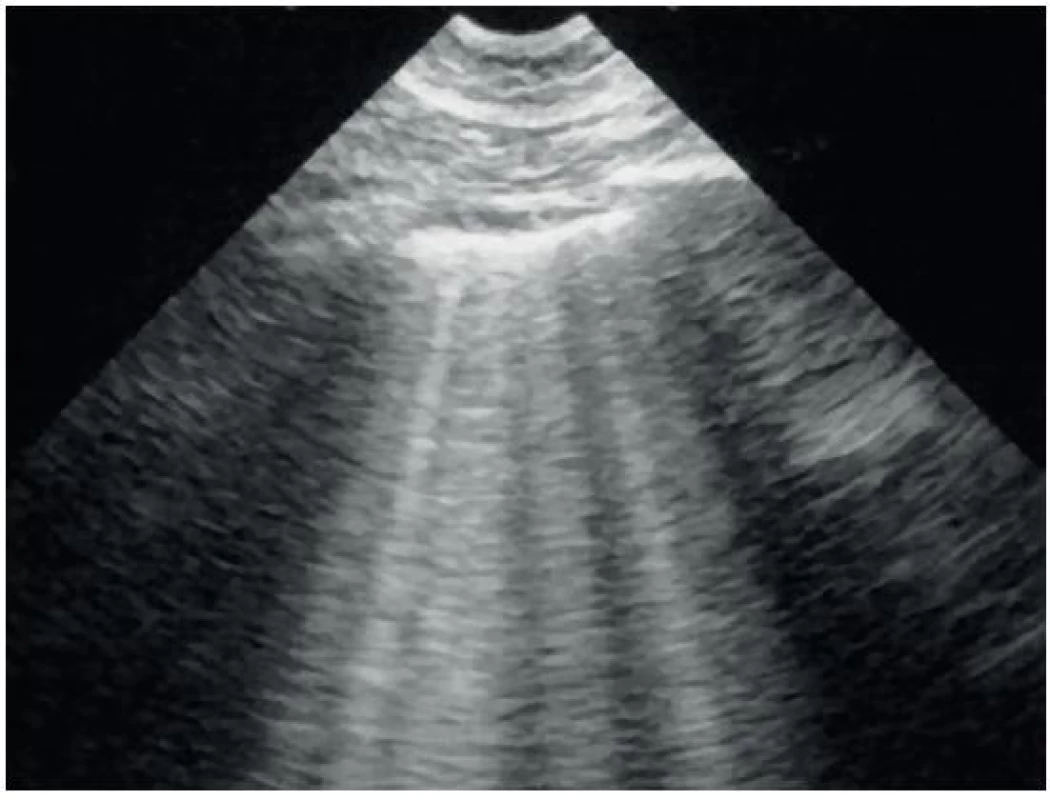
A-linie jsou horizontální artefakty dané reverberací pleurálního rozhraní. Vzdálenost mezi jednotlivými A-liniemi je tedy přibližně stejná (obr. 18).
5. B-linie
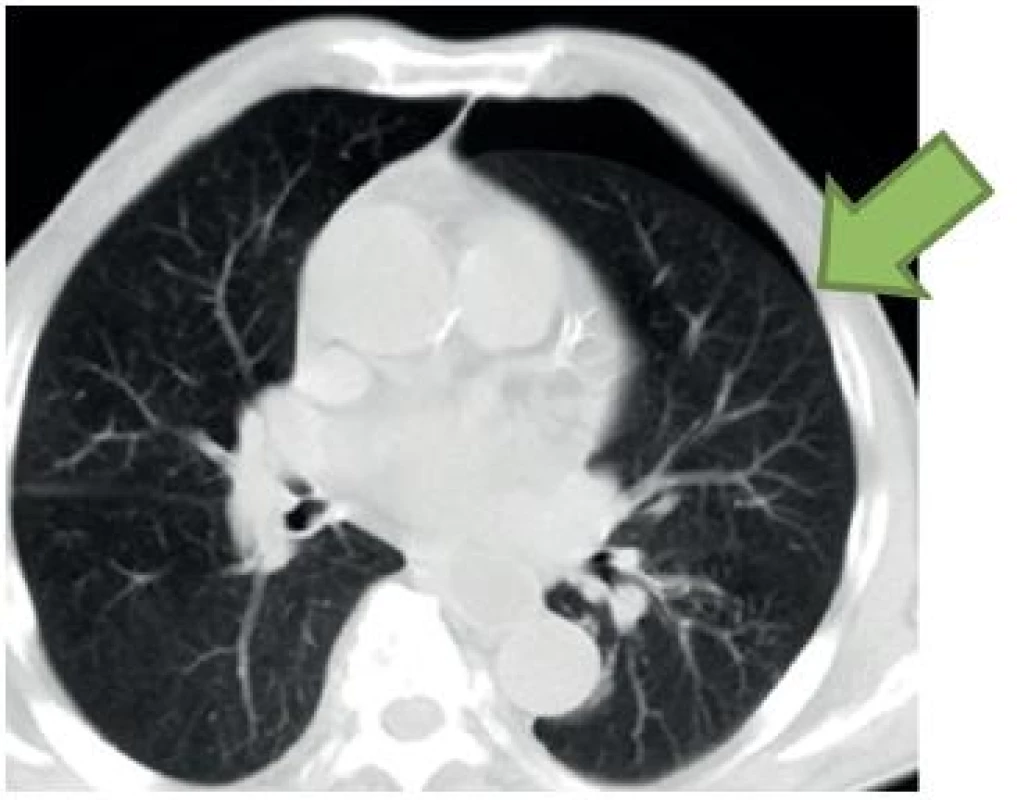
B-linie jsou naopak horizontální artefakty šířící se od pleurálního rozhraní do periferie (obr. 19). Jsou také označované jako comet tails nebo lung rockets. Zajímá nás nejenom jejich přítomnost či nepřítomnost, ale také jejich četnost. B-linie vznikají odrazy ultrazvuku pod viscerální pleurou v plicním parenchymu a jejich četnost narůstá zcela nespecificky u plicních patologií (např. plicního edému). Fyziologicky můžeme zobrazit B-linie v dependentních oblastech plic, kde je plicní parenchym lehce „kondenzovanější“. V případě plicního edému se pak rozšiřují i do ventrálních oblastí. Pro nás je však nejdůležitější, že vylučují přítomnost pneumotoraxu, neboť základní podmínkou vzniku B-linie je naléhání plicního pa-renchymu, respektive viscerální pleury, na pleuru parietální.
Diagnostický postup identifikace přítomnosti či nepřítomnosti pneumotoraxu podle sonografie je možné shrnout do rozhodovacího diagramu z publikace Daniela Lichtensteina [12] – obrázek 20.
Image 20. Schéma pro diagnostiku pneumotoraxu [12] ![Schéma pro diagnostiku pneumotoraxu [12]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/027121dab889fdd4bc20dae9c0affca7.jpg)
Prvním krokem je snaha o identifikaci plicního slidingu. Hledáme jej nejdříve v jednotlivých ventrálních mezižebřích a postupujeme laterálně až do zadní axilární čáry. Pokud se nám v jednotlivých lokalitách sliding zobrazuje, můžeme pneumotorax v těchto oblastech vyloučit. Pokud sliding přítomen není, hledáme plicní pulz a vertikální B-linie. Jejich přítomnost opět vylučuje pneumotorax ve vyšetřované lokalitě. Horizontální A-linie jsou často dobře vyjádřeny u pacientů s pnemotoraxem, ale bohužel se mohou vyskytovat i u pacientů bez pneumotoraxu, např. pokud visceralní pleura adheruje k parietální. V tomto případě nezachytíme ani sliding. Posledním krokem je snaha o identifikaci lung pointu. Pokud jej zachytíme, znamená to přítomnost pneumotoraxu. Podle jeho lokality můžeme odhadovat i velikost pneumotoraxu. Je nutné podotknout, že při rozsáhlém pneumotoraxu, kdy je kolabovaná celá plíce, lung point samozřejmě nezobrazíme a právě toto snižuje senzitivitu uvedeného postupu. Lichtenstein byl ve své práci schopen vyloučit pneumotorax u 94 % pacientů, kteří ho neměli (100 % –4 %/63 %) a potvrdit u 68 % pacientů, kteří ho měli (15 %/22 %). U 32 % pacientů zůstal pneumotorax nediagnostikován. Přestože je toto číslo relativně vysoké, je nutné si uvědomit, že řada studií prokazuje vyšší senzitivitu a stejnou specificitu diagnostiky pneumotoraxu proti RTG, a to zvlášť, pokud je okultní [13].
Adresa pro korespondenci:
MUDr. Petr Waldauf
Klinika anesteziologie a resuscitace
Fakultní nemocnice Královské Vinohrady
Šrobárova 50
100 34 Praha 10
e-mail: petrwaldauf@seznam.cz
Sources
1. Ollerton, J. E., Sugrue, M., Balogh, Z. et al. Prospective study to evaluate the influence of FAST on trauma patient management. J. Trauma, 2006, 60, p. 785–791.
2. Wherrett, L. J., Boulanger, B. R., McLellan, B. A. et al. Hypotension after blunt abdominal trauma: The role of emergent abdominal sonography in surgical triage. J. Trauma, 1996, 41, p. 815–820.
3. Rose, J. S., Levitt, M. A., Porter, J. et al. Does the presence of ultrasound really affect computed tomographic scan use? A prospective randomized trial of ultrasound in trauma. J. Trauma, 2001, 51, p. 545–550.
4. Arrillaga, A., Graham, R., York, J. W. et al. Increased efficiency and cost-effectiveness in the evaluation of the blunt trauma pa-tient with the use of ultrasound. Am. Surg., 1999, 65, p. 31–35.
5. Branney, S. W., Moore, E. E., Cantrill, S. V. et al. Ultrasound based key clinical pathway reduces the use of hospital resources for the evaluation of blunt abdominal trauma. J. Trauma, 1997, 42, p. 1086–1090.
6. Rozycki, G. S., Ochsner, M. G., Feliciano, D. V. et al. Early detection of hemoperitoneum by ultrasound examination of the right upper quadrant: A multicenter study. J. Trauma, 1998, 45, p. 878–883.
7. Scalea, T. M., Rodriguez, A., Chiu, W. C. et al. Focused assessment with sonography for trauma (FAST): Results from an international consensus conference. J. Trauma, 1999, 46, p. 466–472.
8. Stengel, D., Bauwens, K., Rademacher, G. et al. Association between compliance with methodological standards of diagnostic research and reported test accuracy: Meta-analysis of focused assessment of US for trauma. Radiology, 2005, 236, p. 102–111.
9. Branney, S. W., Wolfe, R. E., Moore, E. E. et al. Quantitative sensitivity of ultrasound in detecting free intraperitoneal fluid.J. Trauma, 1995, 39, 2, p. 375–380.
10. Henneman, P. L., Marx, J. A., Moore, E. E. et al. Accuracy in predicting necessary laparotomy following blunt and penetrating trauma. J. Trauma, 1990, 30, p. 1345–1355.
11. Balik, M., Plasil, P., Waldauf, P., Pazout, J., Fric, M., Otahal, M., Pachl Ultrasound estimation of volume of pleural fluid in mechanically ventilated patients. J. Intensive Care Med., 2006, 32, 2, p. 318–321. Epub 2006 Jan 24.
12. Lichtenstein, D., Meziere, G., Biderman, P. et al. The “lung point”: An ultrasound sign specific to pneumothorax. Intensive Care Med., 2000, 26, p. 1434–1440.
13. Kirkpatrick, A. W., Sirois, M., Laupland, K. B., Liu, D., Rowan, K., Ball, C. G. et al. Hand-held thoracic sonography for detecting post-traumatic pneumothoraces: The extended focused assessment with sonography for trauma (EFAST). J. Trauma, 2004, 57, p. 288–295.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2013 Issue 5-
All articles in this issue
- Programové prohlášení výboru České společnosti intenzivní medicíny na období 2013–2016
- Způsoby celkové anestezie a svalové relaxace v oblastní a fakultní nemocnici – tříměsíční bicentrická observační studie
- Alternativní mininvazivní přístupy při náhradě kalcifikované aortální chlopně
- Komentář k Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association
- Preeklampsie, eklampsie, HELLP syndrom z pohledu anesteziologa
-
Skórovací schémata hodnocení sedace a výskytu deliria
I. Přehled skórovacích systémů hloubky sedace na JIP -
Skórovací schémata hodnocení sedace a výskytu deliria
II. Skórovací systémy pro hodnocení výskytu deliria na JIP - Využití kapilární elektroforézy pro stanovení kyseliny mravenčí v séru po intoxikaci metanolem – kazuistika
- Aplikace ultrazvuku u příjmu traumata nejasných šokových stavů (FAST)
- Syndrom multiorgánové dysfunkce
- Co to je chladová diuréza a proč nelze u hypotermických pacientů považovat „dostatečnou“ diurézu jako klinický ukazatel vylučující případnou hypovolémii/renální hypoperfuzi
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Skórovací schémata hodnocení sedace a výskytu deliria
I. Přehled skórovacích systémů hloubky sedace na JIP - Syndrom multiorgánové dysfunkce
- Preeklampsie, eklampsie, HELLP syndrom z pohledu anesteziologa
- Aplikace ultrazvuku u příjmu traumata nejasných šokových stavů (FAST)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career