-
Medical journals
- Career
Syndrom arteria spinalis anterior jako komplikace neuroaxiální blokády – úspěšná léčba pomocí prostacyklinu
: Stibor Bronislav 1; Schwameis Franz 1; Fellner Hermann 2
: Abteilung für Anästhesie und Intensivmedizin, Landesklinikum Baden, Baden bei Wien, Rakousko 1; Röntgeninstitut, Landesklinikum Baden, Baden bei Wien, Rakousko 2
: Anest. intenziv. Med., 20, 2009, č. 2, s. 78-83
: Anaesthesiology - Case Report
Autoři referují o syndromu arteria spinalis anterior, který vznikl jako komplikace neuroaxiální blokády. Popisují příčinu vzniku syndromu, klinické příznaky, průběh onemocnění a úspěšnou léčbu. U 66letého pacienta byla z důvodu kolonoskopicky diagnostikovaného karcinomu provedena resekce tlustého střeva. Operace byla provedena v celkové anestezii. Pro peri - a pooperační analgezii byl předoperačně zaveden epidurální katétr v oblasti L2–3. Asi 8 hodin po zavedení katétru byl pacient extubován. Následně byla zjištěna kompletní míšní paraplegie odpovídající výšce zavedeného katétru. CT vyšetření v 3D zobrazení vyloučilo expanzivní proces v oblasti míšního kanálu. K léčbě byl použit kontinuálně aplikovaný prostacyklin epoprostenol, který vykazuje výrazné antiagregační a vazodilatační účinky. K úplnému vymizení neurologických příznaků a úpravě ad integrum došlo do 9 hodin od začátku jeho podávání.
Klíčová slova:
syndrom arteria spinalis anterior – neuroaxiální blokáda – epidurální katétr – prostacyklinÚvod
Syndrom arteria spinalis anterior je velmi závažným akutně vzniklým neurologickým onemocněním, které ohrožuje pacienta zejména trvalými neurologickými následky až do rozsahu plegie. Neurologické příznaky jsou dány ischémií v povodí arteria spinalis anterior. Jedná se především o radikulární bolesti, poruchy senzitivity i motoriky, později i trofické změny a poruchy funkce střeva a močového traktu. Obecně může být příčinou ischémie systémová hypotenze, arterioloskleróza, mikrotrombotizace, mikroembolizace, expanze v míšním prostoru, operační výkony, systémové vaskulitidy, aktinoterapie, luxace meziobratlových plotének, popř. kombinace několika příčin. Bývá také velmi vzácnou, ale obávanou komplikací neuroaxiálních blokád, jeho přesná incidence není známa.
Arteria spinalis anterior
Tato poměrně malá tepénka zajišťuje perfuzi míchy přibližně ze dvou třetin, zbylá třetina míchy je zásobena z aa. spinales posterior. A. spinalis anterior vzniká u baze lební spojením rami spinales anteriores obou vertebrálních arterií. Dále jde směrem kaudálním, uložena v sulcus ventralis míchy. Tvar a průběh a. spinalis anterior vykazuje poměrně velkou interindividuální variabilitu [1]. Na 80 kadaverech bylo zjištěno, že asi u 75 % jedinců vzniká spojením oboustranných přítoků (typ I). Podle průměru obou přívodných větví lze tento typ dále rozlišit na několik podtypů, a sice typ Ia (obě větve rovnocenné, 42,5 %), typ Ib („right-dominated”, 17,5 %) a typ Ic („left-dominated”, 15 %). Unilaterální vznik, tedy vznik z jedné větve, se udává asi u 11,3 % jedinců a jedná se o typ II. Asi u 13,8 % případů vzniká arteria spinalis anterior z intervertebrálních příčných anastomóz, typ III [2]. Ve všech případech má arteria spinalis anterior průměr přibližně 1,145 ± 0,12 mm.
Jiná studie zjišťovala vnitřní průměry arterií zajišťujících míšní perfuzi v oblasti hrudní a bederní páteře, tedy v oblasti nejčastěji aplikovaných neuroaxiálních blokád. Bylo zjištěno, že i nejsilnější arterie, a sice arteria spinalis magna (Adamkiewiczova arterie) má vnitřní průměr jen asi 0,7 mm [3].
Z uvedeného vyplývá, ze míšní perfuze je zajišťována arteriemi o velmi malém průměru, které jsou náchylné k poškození. Hypoperfuze jakékoliv etiologie vede k okamžitým neurologickým výpadkům odpovídajícím lokalizaci arteriální ischémie. Navíc je známo, že mezi předními a zadními míšními arteriemi existují přímé anastomózy bez vložené kapilární oblasti. Během diastoly může proto docházet k prudkým poklesům krevního tlaku [4].
Syndrom a. spinalis anterior
Etiopatogeneze
Syndrom označuje ischemické poškození míchy v povodí a. spinalis anterior. Etiologie je různorodá. Spinální arterie jsou i u pokročilé systémové aterosklerózy poměrně málo postiženy. Ateroskleróza sama o sobě tedy nebývá většinou příčinou uvedeného syndromu, je však predisponujícím faktorem, na jehož podkladě syndrom snáze vzniká, nebo který zhoršuje jeho průběh. V literatuře jsou popisovány případy míšní ischémie častěji při systémových chorobách typu vaskulitidy, panarteitidy, systémového lupus erythematodes apod. Bývá komplikací i angiochirurgických výkonů nebo hrudních operací, jako např. výkonech na hrudní aortě či jícnu [5]. Popsány jsou i případy, jež vznikly po naprosto minimálních traumatech, které ihned nebyly dány s tímto traumatem do souvislosti [6]. Další příčinou může být tumor, protruze meziobratlové ploténky apod. [7].
Jako vzácná komplikace je popisována i u neuroaxiálních blokád, zejména u katétrových technik. Snadno identifikovatelný je expanzivní proces – epidurální hematom nebo s odstupem několika dnů vznikající absces. Ostatní možné příčiny vznikající v příčinné souvislosti se zavedeným katétrem jsou hypotetické a v klinické praxi v podstatě nezjistitelné – mechanická komprese, vazospasmus, intersticiální edém či lokální zánětlivá reakce z podráždění. Příznaky míšní ischémie mohou být navíc zastřeny účinky lokálního anestetika a patologický stav je diagnostikován se zpozděním několika hodin, až účinek anestetika odezní. Bohužel právě v tomto „bezpříznakovém” intervalu je při rychlé diagnóze a následné terapii šance na úpravu největší.
Klinické příznaky
Jejich lokalizace, rozsah a závažnost závisí na místě míšní hypoperfuze. Nejčastěji se objevuje bolest v končetinách, výpadky citivosti, zpočátku chabá, později spastická paraparéza, často se manifestuje náhle vzniklou paraplegií pod obrazem transverzální míšní léze. V akutní fázi je někdy popisována motorická paréza při zachované citivosti. Typickým obrazem, který ale zdaleka není vždy vyjádřen, je disociovaná porucha citlivosti, tzn. porucha citivosti tepla a bolesti při zachování ostatních kvalit. Později se přidávají i poruchy střevní motility a poruchy mikce.
Diagnostika
Základem je podrobné neurologické vyšetření následované zobrazovacími metodami, jež mají zachytit především ty stavy, které jsou řešitelné neurochirurgicky. V našich podmínkách se jako první indikuje naléhavé CT vyšetření, které je suverénní v potvrzení nebo vyloučení míšního hematomu či abscesu. Časné změny způsobené míšní ischémií mnohem lépe zachytí magnetická rezonance [8]. Přínosné může být i vyšetření pomocí evokovaných potenciálů.
Léčba
V případě míšní expanze (epidurální hematom apod.) je indikována okamžitá neurochirurgická revize. Odstranění epidurálního katétru je samozřejmostí. Podpůrná léčba spočívá v zajištění hemodynamické stability, normotermie, aplikaci LMWH, vitaminů skupiny B. Někdy jsou doporučovány i farmakologické dávky kortikoidů. Vzhledem k naprosto raritnímu výskytu nejsou terapeutické postupy podloženy řadou studií. Kauzální účinná léčba není z literatury známa.
Prognóza
Obecně je velmi nepříznivá. Trvalé následky v podobě spastické parézy či plegie bývají spíše pravidlem. Úplné vyléčení je vzácností. Opakovaně byly popsány případy přechodného zlepšení s následným opětovným zhoršením, většinou již trvalým.
Epoprostenol
Charakteristika
Epoprostenol je přirozeně se vyskytující prostaglandin, který je tvořen intimou, vnitřní vrstvou cévní stěny. Vykazuje dva podstatné farmakologické účinky. Je potentním inhibitorem agregace krevních destiček, udává se, že je vůbec nejsilnějším inhibitorem dostupným v klinické praxi. Dále má výrazný vazodilatační efekt. Kromě výše uvedeného má také cytoprotektivni efekt, snižuje adhezi leukocytů k cévní stěně, snižuje tvorbu a sekreci endotelinu a vede k inhibici migrace a agregace buněk.
Farmakokinetika
Epoprostenol podávaný ve formě sodné soli má velmi krátký biologický poločas, přibližně 3–5 minut. Velmi rychle se distribuuje z krve do tkání, u králíků je jeho distribuční objem 1015 ml . kg-1 a clearance 4,27 ml . kg-1 . s-1. Za normálního pH a při teplotě 37 °C se spontánně štěpí na 6-oxo-prostaglandin F1a; enzymatická degradace je pravděpodobně pomalejší cestou jeho metabolizování [9]. Nejvyšší koncentrace dosahuje v játrech, ledvinách a tenkém střevě. Ustáleného stavu se dosahuje již po 15 minutách od začátku intravenózní aplikace, což prokázaly studie s epoprostenolem značeným radioaktivním tritiem. Neexistují důkazy o hromadění nebo dlouhodobé retenci některého z metabolitů. Na rozdíl od celé řady dalších prostaglandinů se epoprostenol nemetabolizuje během průchodu plicní cirkulací.
Nežádoucí účinky
Nejčastěji se jedná o pokles středního arteriálního tlaku, jenž je přímo úměrný aplikované dávce či rychlosti infuze. Po vysazení či snížení dávky dochází k promptní úpravě. Dále se jedná o bolesti hlavy, nauzeu, průjmy, flushing. Z kardiálních potíží se objevuje bradykardie i tachykardie, v závislosti na dávce. Souhrnně se dá říci, že nežádoucí účinky jsou většinou akceptovatelné ve srovnání s přínosem, který léčba epoprostenolem přináší.
Indikace k podání epoprostenolu:
a) antikoagulační léčba u mimotělních eliminačních technik
Epoprostenol působí stimulaci adenylátcyklázy, což zvyšuje hladiny cyklického adenosin-3´5´-monofosfátu (cAMP). V lidských trombocytech byla prokázána následná aktivace fosfodiesterázy. Intracelulární hladina cAMP reguluje koncentraci vápníku uvnitř buňky. Zvýšení hladiny cAMP způsobuje přestup vápníku z buňky, následovaném inhibicí agregace krevních destiček snížením koncentrace cytoplasmatického kalcia. To má vliv na změnu tvaru trombocytů a jejich shlukování.
Inhibiční efekt na agregaci je v rozmezí dávkování 2–5 ng . kg-1 . min-1 lineární. Při vyšším dávkování (20 ng . kg-1 . min-1 a více) dochází i k rozpuštění cirkulujících trombocytárních agregátů a doba krvácivosti je prodloužena až na dvojnásobek. Antikoagulace je u kontinuálních eliminačních technik někdy doplňována podstatně redukovanými dávkami heparinu. Epoprostenol navíc zesiluje jeho antikoagulační aktivitu. Vzhledem ke krátkému biologickému poločasu je nutné kontinuální podávání. Účinek odeznívá asi do 60 minut od ukončení aplikace.
b) vazodilatační terapie
Okamžitý a výrazný vazodilatační efekt je využíván zejména v léčbě plicní hypertenze. Mnoha studiemi byl prokázán příznivý vliv kontinuální aplikace na zvýšení srdečního indexu, poklesu plicní vaskulární rezistence, poklesu celkového plicního odporu i středního arteriálního tlaku. Klinicky se jeho účinek projeví celkovým zlepšením hemodynamiky, lepší tolerancí zátěže i sníženou mortalitou, především u pacientů s plicní hypertenzí ve stadiu NYHA III–IV. Dlouhodobé sledování ukázalo 5leté přežívání přibližně 65%, což dokonce převyšuje 5leté přežívání po transplantaci plic, které se pohybuje okolo 50 %.
Kazuistika
Pacient (66 let) byl určen k resekci tlustého střeva pro karcinom ve stadiu T4 Nx M1 R0. V anamnéze byla přítomna arteriální hypertenze, diabetes mellitus II. typu, jaterní cirhóza toxonutričního původu a diabetická polyneuropatie. V játrech byly již přítomny metastázy v segmentech III, V, VI a VIII. Tělesná výška 172 cm, hmotnost 72 kg, předoperační laboratorní výsledky bez pozoruhodností. Po poučení pacienta a podepsání informovaného souhlasu byla operace provedena v celkové anestezii kombinované s perioperační kontinuální analgezií epidurálním katétrem. Perorální premedikace benzodiazepinem 60 minut před výkonem.
Byl použit epidurální katétr FlexTip Plus® 19G (Arrow), zaveden Tuohyo jehlou 17G v lokální anestezii 2% lidokainem ve výši L2–3, detekce epidurálního prostoru metodou ztráty odporu., hloubka v epidurálním prostoru 7 cm. Samotné zavedení zcela bezproblémové, na první pokus. Testovací dávka 5 ml 0,75% ropivacainu vyloučila intratekální umístění. Poté byl pacient uveden do celkové anestezie indukční dávkou propofolu, anestezie dále vedena sevofluranem MAC 1,1. Pacient byl zajištěn centrálním žilním a arteriálním katétrem, dále byla zavedena nazogastrická sonda a močový katétr. Relaxace – bolusovými dávkami cisatrakuria, intravenózní analgezie minimálními dávkami fentanylu. Samotná operace i anestezie proběhly bez pozoruhodností, krevní ztráta 600 ml, pacient byl po celou dobu oběhově stabilní. Perioperační analgezie doplněna kontinuální aplikací 0,375% ropivakainu (Naropin®, AstraZeneca) v dávce 5 ml . h-1. Aplikace ropivakainu byla ukončena zároveň s operačním výkonem, tedy po 3 hod. 40 min.
Poté byl intubovaný a řízeně ventilovaný pacient přeložen na JIP, kde byl ještě krátce sedován remifentanilem a propofolem. Po zahřátí byl pacient vyveden z celkové anestezie a asi 8 hodin od zavedení epidurálního katétru a 3 hod. 45 min. od ukončení aplikace lokálního anestetika bez problémů extubován. Ihned po extubaci uvádí, že necítí žádnou bolest v operační oblasti, ale zároveň nemůže hýbat dolními končetinami. Pokusná aspirace moku z epidurálního katétru byla negativní. Klinické vyšetření zjišťuje paraplegii, která odpovídá transverzální míšní lézi v oblasti L 2–3.
Akutně provedené CT vyšetření lumbální páteře vyloučilo krvácení či jiný expanzivní proces. Zobrazilo však epidurální katétr, který se v oblasti L 2–3 nacházel mezi ligamentum flavum a durálním vakem, navíc ve stejné výši tvořil několik smyček (obr. 1–5). Zamýšlené vyšetření magnetickou rezonancí, jež podrobněji zobrazí příčiny či následky míšní ischémie, by znamenalo transport do jiného zdravotnického zařízení s časovou prodlevou minimálně 2–3 hodiny.
1. 3D zobrazení polohy epidurálního katétru mezi L2–3, pohled z levé strany 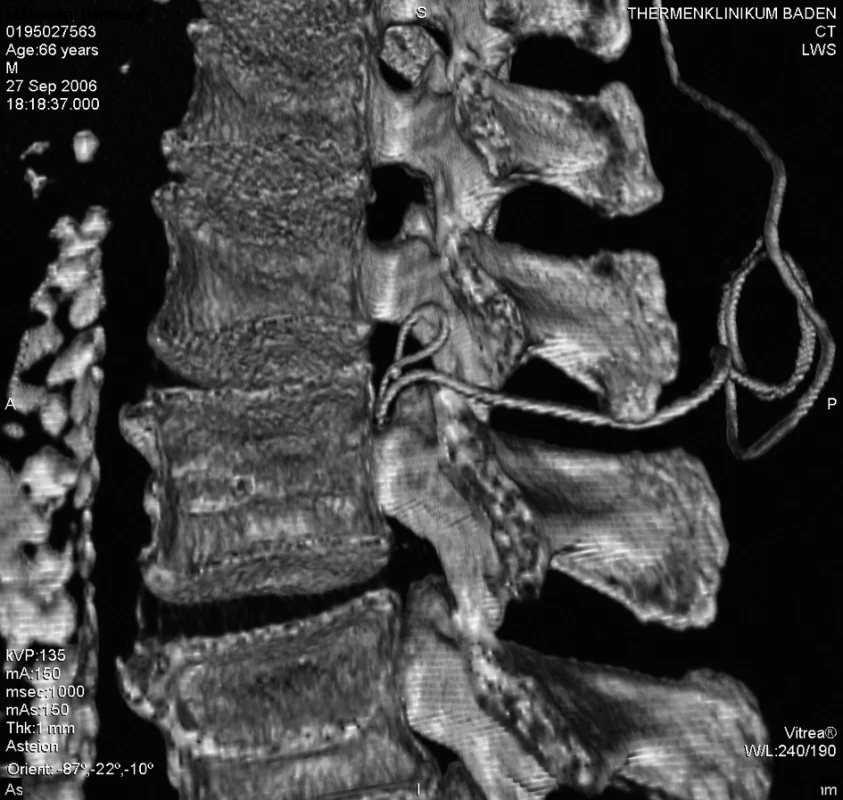
2. 3D zobrazení polohy epidurálního katétru mezi L2–3, pohled z levé strany 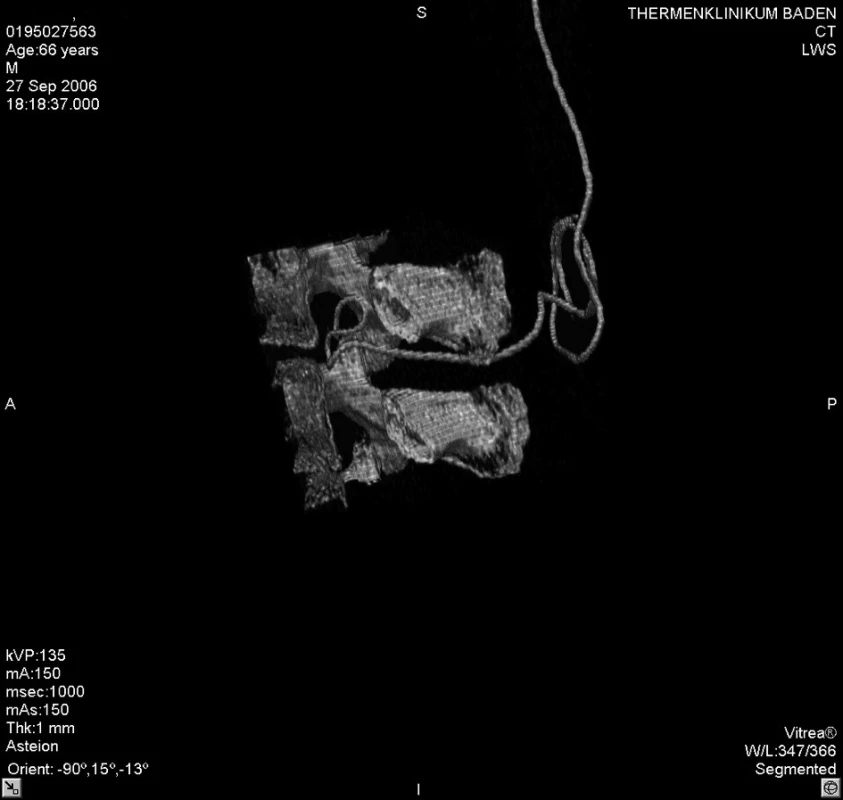
3. 3D zobrazení tvaru epidurálního katétru po počítačovém odstranění struktur bederní páteře 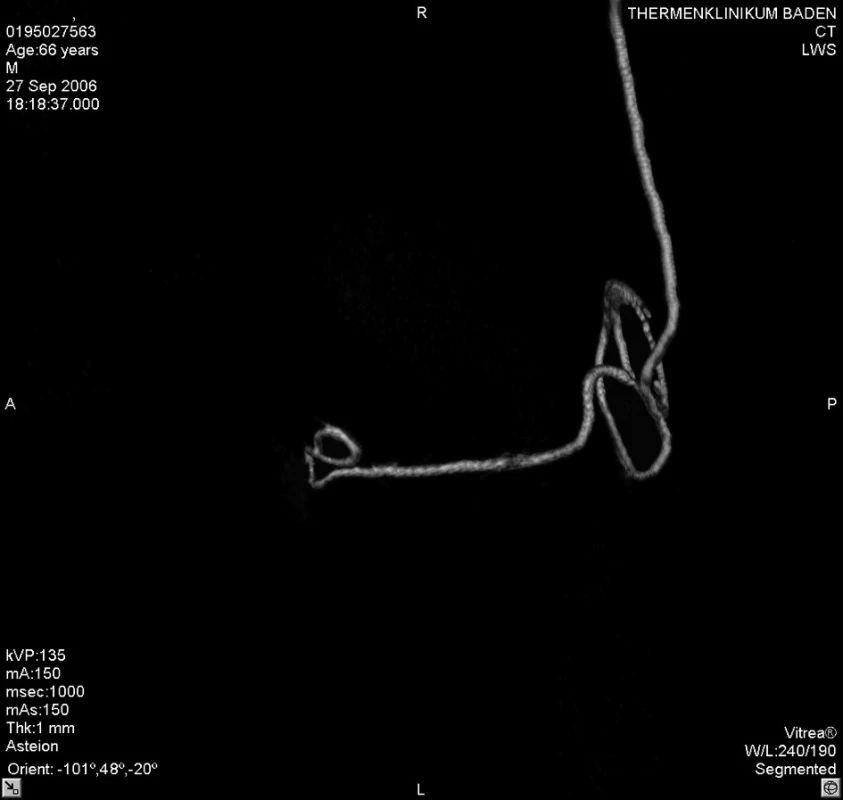
4. Umístění katétru v oblasti páteřního kanálu L2–3, pohled z pravé strany 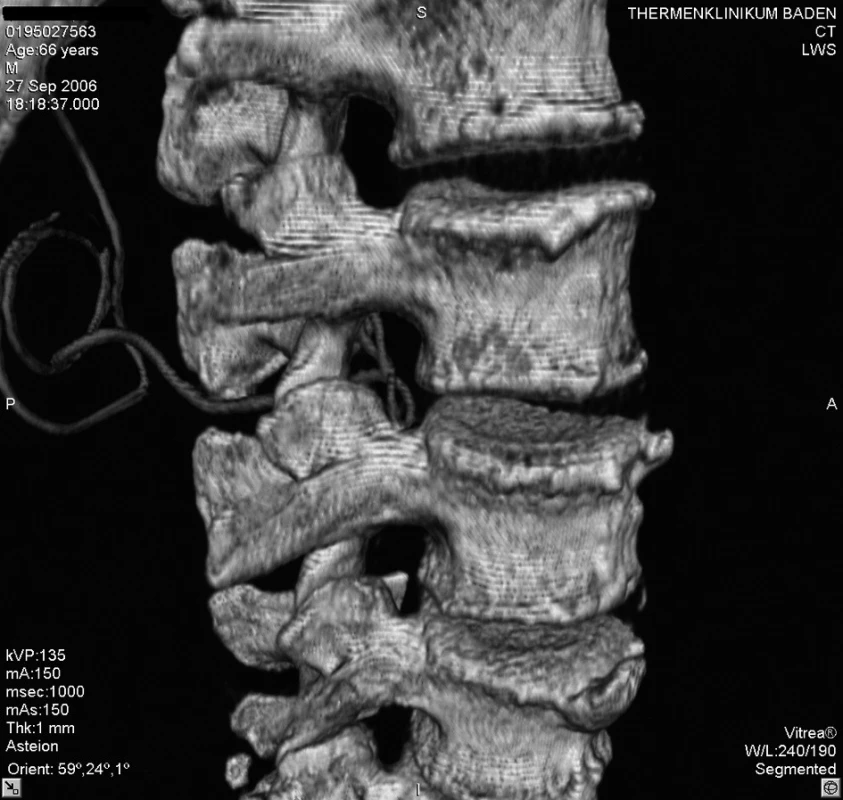
5. Umístění katétru v oblasti páteřního kanálu L2–3, pohled z pravé strany 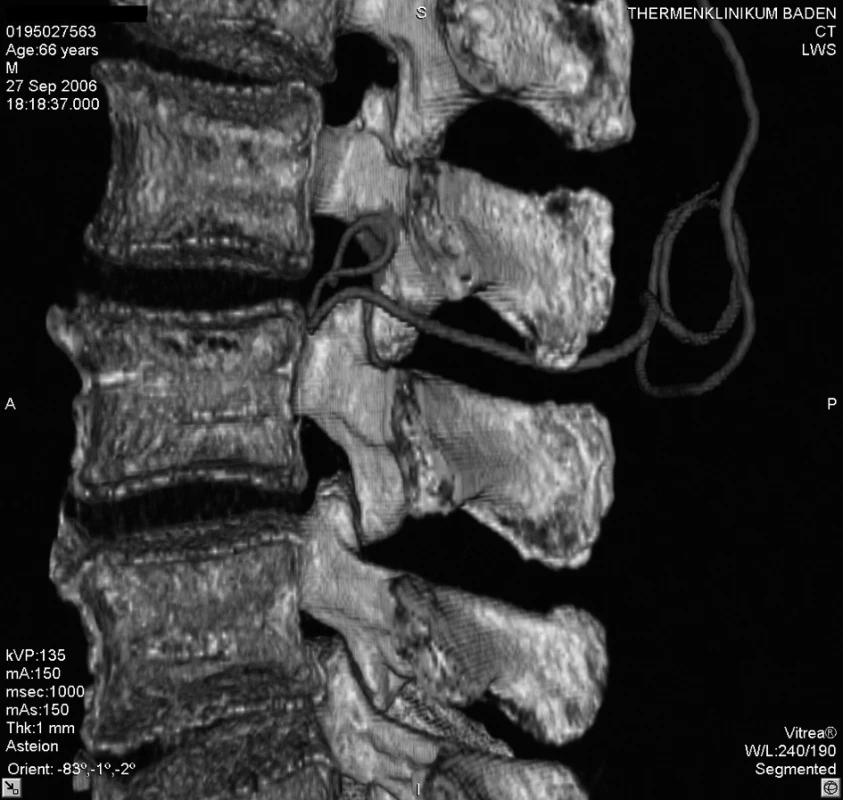
Pooperační laboratorní odběry vykazovaly mírnou anémii (hemoglobin 121 g . l-1, hematokrit 0,36) a lehkou hypomagnezémii 0,6 mmol . l-1. Ostatní výsledky byly v normě.
Po vyloučení expanze jako příčiny paraplegie – na základě provedení neuroaxiální blokády, následně vzniklých klinických příznaků a CT nálezu – bylo vysloveno podezření na syndrom přední míšní arterie. Epidurální katétr byl okamžitě odstraněn (cca 10 hodin od jeho zavedení a 5 hod. 45 min. od ukončení aplikace lokálního anestetika), avšak i 20 minut po jeho odstranění zůstával neurologický stav nezměněn. Příčina přetrvávání plegie byla nejasná, jako nejpravděpodobnější se jevila trombóza, spazmus či embolie v povodí a. spinalis anterior jako následek zavedeného epidurálního katétru. Pacient byl oběhově stabilní s krevním tlakem 140/85, normotermický, hladina laktátu byla v normě. Dalo se tedy předpokládat, že není přítomna systémová hypoperfuze.
S vědomím, že hypoperfuze mohla trvat již více než 10 hodin a perfuze míchy se mohla stávat kritickou, přistoupili autoři k léčbě kontinuální aplikací epoprostenolu (Flolan®, GlaxoSmithKline), prostaglandinu s potentním vazodilatačním a antiagregačním účinkem, byť jim nebyl z literatury znám případ použití epoprostenolu v této indikaci.
Kontinuální aplikace byla zahájena dávkou 7,0 ng . kg-1 . min-1. Asi po 20 minutách dochází k postupnému zlepšování neurologického nálezu, přechodně se objevují parestezie dolních končetin, následně se postupně obnovuje i motorika. Pokles systolického tlaku o 20 mm Hg dobře reaguje na infuzní terapii. Asi po 180 minutách dokáže pacient nadzvednout obě dolní končetiny nad podložku, ale hypostezie a parestezie přetrvávají ještě následujících 6 hodin. Asi po 9 hodinách od začátku aplikace epoprostenolu dochází k úpravě neurologických funkcí ad integrum. Dávka epoprostenolu byla poté postupně redukována na 4,6 ng . kg-1 . min-1, posléze na 2,3 ng . kg-1 . min-1. Po 18 hodinách byla aplikace ukončena. Pacient byl 4. pooperační den přeložen na standardní oddělení.
V důsledku dehiscence anastomózy u něj po 5 dnech dochází k těžké peritonitidě a septickému stavu. Umírá za 8 týdnů od první operace pod obrazem multiorgánového selhání na jaterní selhání, způsobené septickým stavem, jaterními metastázemi a alkoholickou cirhózou. Vzhledem k přítomné malignitě nebyla zahájena léčba jaterního selhání pomocí systému M.A.R.S. Příznaky syndromu a. spinalis anterior se však ani během druhé hospitalizace na JIP již neobjevily.
Diskuse
Náhle vzniklá úplná paraplegie – do té doby u neurologicky zcela zdravého pacienta – byla alarmující. Neznámá byla příčina i délka trvání míšní ischémie. Na jejím vzniku se kromě katétru mohlo spolupodílet více faktorů: operační poloha, přechodná systémová hypotenze, pokles tělesné teploty, mírný perioperační posun koagulační rovnováhy ve prospěch hyperkoagulace apod. Kombinace s celkovou anestezií znemožnila určit přesný čas vzniku míšní léze. Délka ischémie má však rozhodující vliv na vznik trvalých následků. Čím déle hypoperfuze trvá, tím se jejich pravděpodobnost rapidně zvyšuje.
Přítomnost kožního névu velikosti cca 5 x 10 cm v bederní oblasti znemožnil punkci a zavedení katétru ve výšce obvyklé pro resekci tlustého střeva. Lékař provádějící anestezii proto zvolil nejbližší nižší prostor a ve snaze zasáhnout i výše inervované oblasti zavedl epidurální katétr do hloubky cca 7 cm, což překračuje doporučenou hloubku zavedení, která je pouze 3–4 cm.
Zvažována byla i možnost nechtěného umístění katétru subarachnoidálně. Proti však hovořila negativní testovací dávka po zavedení, nemožnost aspirace likvoru i přetrvávání příznaků několik hodin po skončení aplikace lokálního anestetika. Definitivně toto podezření vyvrátila počítačová tomografie.
CT vyšetření v 3D zobrazení vyloučilo epidurální hematom či jiný expanzivní proces v oblasti míšního kanálu, naopak prokázalo dislokaci až zauzlení katétru v epidurálním prostoru. Epidurální katétr byl poté ihned odstraněn, asi 20 hodin od poslední aplikace LMWH. I po jeho odstranění však zůstával neurologický nález beze změny. Akutní vyšetření magnetickou rezonancí by znamenalo minimálně dvouhodinové zdržení.
Diagnóza syndromu přední míšní arterie byla stanovena per exclusionem a byla zvažována následná léčba. Rozsáhlý operační výkon znemožňoval systémovou trombolýzu. Aplikace farmakologických dávek kortikoidů by neřešila příčinu míšní ischémie, navíc by mohla nepříznivě ovlivnit hojení po provedené intraabdominální operaci. V jedné studii bylo pomocí laserové dopplerovské flowmetrie prokázáno, že lokální aplikace směsi kortikoidů a lokálního anestetika k míšním kořenům nevede ke zvýšení krevního průtoku [10]. V další randomizované studii téhož autora bylo prokázáno, že ani systémová aplikace fyziologického roztoku spolu s kortikoidem neovlivní prokrvení míšních kořenů. Avšak aplikace 20 mg prostaglandinu E1 vedla ke zvýšení krevního průtoku na 125 % výchozích hodnot [11].
Po výborných zkušenostech s prostacyklinem epoprostenolem, jenž se na pracovišti autorů rutinně používá k antikoagulační léčbě u kontinuálních eliminačních technik, bylo rozhodnuto o jeho aplikaci. Hlavní kauzální příčina (epidurální katétr) byla již odstraněna, ostatní faktory nebyly v časové tísni verifikovatelné. Přetrvávající míšní hypoperfuze mohla být způsobena mikrotrombotizací, mikroembolizací nebo vazospasmem a. spinalis anterior – všechny tyto příčiny jsou potenciálně příznivě ovlivnitelné aplikací prostacyklinu.
Pokles systémového krevního tlaku byl nepatrný a snadno upravitelný infuzní terapií. Uvedená dávka také nezpůsobila zvýšené pooperační krvácení, byť první pooperační den došlo k prodloužení aPTT na 47,6 s a protrombinového času na 64 %. Mírně prodloužené hodnoty přetrvávaly do třetího pooperačního dne s možným podílem hepatopatie.
Trojrozměrné zobrazení umístění epidurálního katétru po jeho naprosto bezproblémovém zavedení naznačuje, že ne vždy se katétr nachází tam, kde předpokládáme. Rozhodně by se neměla překračovat obecně doporučovaná hloubka jeho zavedení [12]. Použitý katétr je podle mínění autorů poměrně měkký, což možná snižuje riziko perforace tvrdé míšní pleny, zároveň však může usnadňovat jeho „zamotání” v epidurálním prostoru.
Závěr
V literatuře je zdokumentováno poměrně málo případů syndromu a. spinalis anterior způsobených neuroaxiální blokádou. Zatímco okamžitý diagnostický algoritmus je zřejmý, léčebné možnosti po vyloučení expanzivního procesu jsou naopak poměrně omezené. Léčba pomocí kontinuálně aplikovaného prostaglandinu epoprostenolu se alespoň v tomto případě ukázala jako velmi účinná.
Došlo 9. 10. 2008.
Přijato 20. 1. 2009.
Adresa pro korespondenci:
MUDr. Bronislav Stibor
Modřická 25
664 48 Moravany u Brna
e-mail: stiborovi@volny.cz
Sources
1. Er, U., Fraser, K., Lanzino, G. The anterior spinal artery origin: a microanatomical study. Spinal cord., 2008, 46, 1, p. 45–49.
2. Gövsa, F., Aktan, Z. A., Arisoy, Y., Varol, T. et al. Origin of the anterior spinal artery. Surg. Radiol. Anat., 1996, 18, 3, p. 189–193.
3. Schalow, G. Feeder arteries, longitudinal arterial trunks and arterial anastomoses of the lower human spinal cord. Zentralbl Neurochir., 1990, 51, 4, p. 181–184.
4. Thron, A. K., Mull, M. Blood Vessels of the Spinal Cord: Anatomical and MR-Imaging Correlation. Rivista di Neuroradiologia, 2004, 17, p. 277–281.
5. Černák, V., Ondrejovič, S., Andrejčáková, R. Syndróm arteria spinalis anterior po operácii na brušnej aorte – kazuistika. Anest. neodkl. Péče, 2002, 13, 6, p. 269–270.
6. Soukop, W. Forensischer Fall: Spinalis Anterior Syndrom nach minimalen Wirbelsäulentraumen. J. Neurol. Neurochir. Psychiatr., 2005, 6, 2, p. 37–39.
7. Shamji, M. F., Maziak, D. E., Shamji, F. M., Gingsberg, R. J. Circulation of the spinal cord: an importnant consideration for thoracic surgeons. Am. Thorac. Surg., 2003, 76, p. 315–321.
8. Yuh, W. T. C., March, E. E., Wang, A. K. et al. MR imaging of spinal cord, and vertebral body infarction. Am. J. Neuroradiol., 1992, 13, p. 145–154.
9. http://www.gsk.com/products/index.htm
10. Fukusaki, M. et al. Perineural injection to nerve root and radicular blood flow: a clinical study during spinal surgery. Eur. J. Anaesthesiol., 2001, 18, 2, p. 70–74.
11. Fukusaki, M. et al. Prostaglandin E1 But Not Corticosteroid Increases Nerve Root Blood Flow Velocity After Lumbar Diskectomy in Surgical Patients. J. Neurosurg. Anesthesiol., 2003, 15, 2, p. 76–81.
12. Beilin, Y. et al. The optimal distance that the multiorifice epidural catheter should be threaded into the epidural space. Anesth. Analg., 1995, 81, 2, p. 301–304.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2009 Issue 2-
All articles in this issue
- Anaphylaxis after induction to general anaesthesia: Four case reports
- Anterior spinal artery syndrome as a complication of neuroaxial blocade – successful treatment with prostacyclin (case report)
- Erythropoietin and other erythropoiesis-stimulating drugs and bloodless medicine – a new era in the management of anaemia?
- The influence of continuous positive pressure ventilation on the degree of inflammatory reaction and organ function – experimental study
- Hypocholesterolaemia on the medical intensive care unit: The process of cholesterol synthesis and absorption is altered in the acute phase of disease
- Evaluation of changes in brain tissue oxygen levels (PbtO2) for detection of vasospasm in patients after subarachnoid haemorrhage
- A fatal complication of tracheostomy in a 13-year-old patient with Duchenne Muscular Dystrophy – case report
- Assoc. Prof. MUDr. Josef Hoder, CSc., in the memories of his colleagues and friends
- Assoc. Prof. MUDr Josef Hoder, CSc. (1912–1987)
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Anaphylaxis after induction to general anaesthesia: Four case reports
- Erythropoietin and other erythropoiesis-stimulating drugs and bloodless medicine – a new era in the management of anaemia?
- Anterior spinal artery syndrome as a complication of neuroaxial blocade – successful treatment with prostacyclin (case report)
- A fatal complication of tracheostomy in a 13-year-old patient with Duchenne Muscular Dystrophy – case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

