-
Medical journals
- Career
Úskalia uplatňovania odporúčaní pre diagnostiku a liečbu ťažkej sepsy
Authors: Firment Jozef; Hudák Vladimír; Grendel Tomáš
Authors‘ workplace: Oddelenie anesteziológie a intenzívnej medicíny, FN LP a LF UPJŠ Košice, Slovenská republika
Published in: Anest. intenziv. Med., 19, 2008, č. 5, s. 252-259
Category: Intensive Care Medicine - Original Paper
Overview
Cieľ prace:
Ťažká sepsa a septický šok sú v súčasnosti považované za jedny z najzávažnejších príčin vysokej morbidity a mortality u kriticky chorých. Cieľom našej práce bolo zistiť implementáciu odporúčaní pre diagnostiku a liečbu ťažkej sepsy a septického šoku na našom pracovisku podľa postupov celosvetovej kampane za prežitie pacientov s ťažkou sepsou alebo septickým šokom.Názov a miesto pracoviska:
Oddelenie anesteziológie a intenzívnej medicíny, Fakultná nemocnica.Materiál a metódy:
Pacienti z roku 2004 boli zaradení do sledovania retrospektívne, bolo to v čase postupnej implementácie odporúčaní. Od roku 2005 boli zaraďovaní pacienti do databázy priebežne a bolo to v čase úplnej implementácie postupov.Výsledky:
Za roky 2004–2006 bolo na našej klinike hospitalizovaných 103 pacientov s diagnostikovanou ťažkou sepsou/septickým šokom z celkového počtu 1293 prijatých pacientov, čo predstavuje 8 %. Percento mortality v jednotlivých rokoch bolo: 72 % (2004), 63 % (2005) a 61 % (2006). Všetky resuscitačné kritériá boli splnené v roku 2004 u 7 %, v roku 2005 u 16 % a v roku 2006 u 11 % pacientov. Kritériá 24-hodinového manažmentu neboli v rokoch 2004 a 2005 naplnené ani u jedného pacienta s ťažkou sepsou/septickým šokom; v roku 2006 to bolo u 56 % pacientov. Pri hodnotení splnenia všetkých kritérií na 100 %, čo je aj cieľom realizovania postupov, sme zistili, že v rokoch 2004 a 2005 neboli naplnené ani u jedného z pacientov a v roku 2006 u 8 % pacientov.Záver:
Implementácia postupov do praxe je dlhodobý proces. Vysokú mortalitu septických pacientov vysvetľujeme závažným stavom pri rozvinutom septickom šoku pri začatí liečby štandardnými metódami.Kľúčové slová:
ťažká sepsa – septický šok – kriticky chorý pacientÚvod
Ťažká sepsa je v súčasnosti považovaná za významnú príčinu morbidity a mortality u kriticky chorých. Z toho dôvodu sa v roku 2002 spustila kampaň za prežitie sepsy formou Barcelonskej výzvy.
Do kampane sa prihlásilo aj Česko-Slovenské fórum pre sepsu (www.csfps.cz) [1]. V roku 2004 boli publikované Odporúčania pre diagnostiku a liečbu ťažkej sepsy [2] a v januári roku 2008 boli vydané upravené a bližšie špecifikované postupy [3].
Metodika
Podobne ako na mnohých pracoviskách, aj na klinike anestéziológie a intenzívnej medicíny (KAIM), boli vytvorené podmienky pre implementáciu Odporúčaní do diagnostických a liečebných postupov. Personálu kliniky boli sprístupnené písomné materiály vo forme posterov a príručných letákov. Medzinárodné odporúčania boli často opakované pri diferenciálne diagnostických rozvahách a terapeutických postupoch kriticky chorých. Určení boli členovia pracovného tímu, ktorí ako tzv. „Sepsis Champions“ mali za úlohu propagovať myšlienky kampane a evidovať pacientov s ťažkou sepsou do databázy Sepsis bundles vytvorenej americkou Spoločnosťou kriticky chorých (SCCM) (www.survivingsepsis.org). Košické pracovisko v spolupráci s Dr. S. Townsendom z tímu prof. M. M. Levyho vypracovalo slovenskú jazykovú mutáciu tohto celosvetovo používaného programu.
Za roky 2004–2006 sme zaevidovali 103 pacientov s ťažkou sepsou a septickým šokom.
Počiatočné výsledky z roku 2004 naznačili, ako boli na našom pracovisku uplatňované kritéria manažovania ťažkej sepsy a septického šoku. Bolo to v čase, kedy sa odporúčania pre liečbu ťažkej sepsy a septického šoku postupne dostávali do praxe.
V nasledujúcom texte sú údaje z roku 2004, ktoré boli evidované retrospektívne a pacienti počas rokov 2005 a 2006 boli zaradzovaní do databázy priebežne podľa prijatia.
Výsledky
V období od 1. 1. 2004 do 31. 12. 2006 sme na KAIM lôžkovej časti hospitalizovali 1 293 pacientov (2004 : 377, 2005 : 488, 2006 : 428) – tabuľka 1. Z uvedeného počtu boli do štúdie zaradení pacienti, u ktorých bola podľa kritérií SSC zistená ťažká sepsa alebo septický šok. Takýchto pacientov bolo v trojročnom období spolu 103 (29 + 38 + 36), v percentuálnom vyjadrení po jednotlivých rokoch to predstavuje 7,7 %, 7,8 % a 8,4 %, t. j. za celé sledované obdobie pacienti s ťažkou sepsou a septickým šokom predstavujú priemerný počet 8 % hospitalizovaných na KAIM.
Table 1. Výskyt ťažkej sepsy a septického šoku 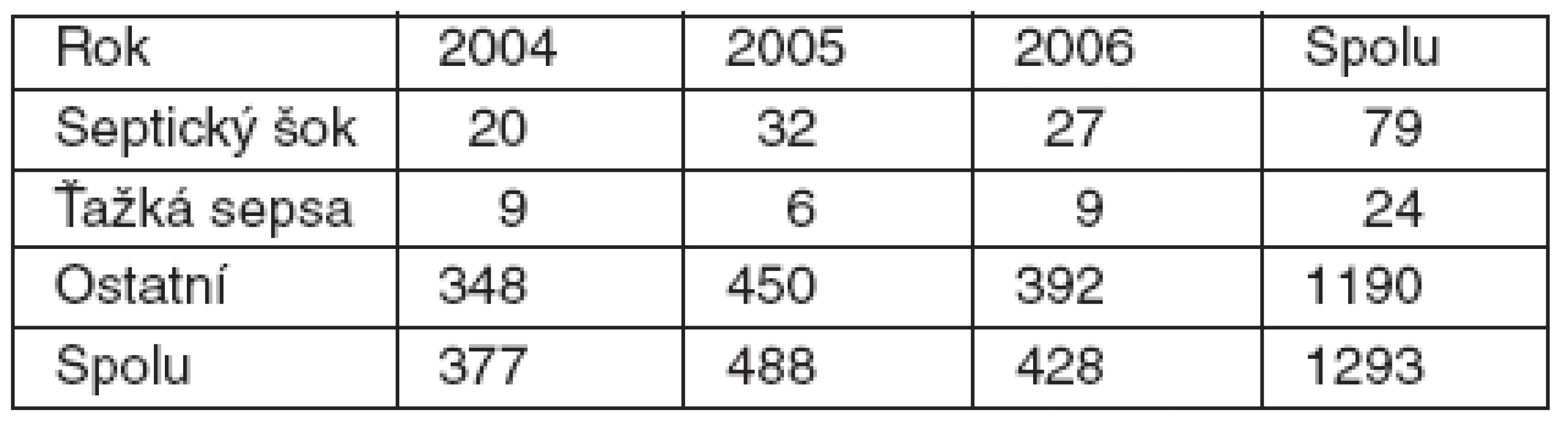
Zisťovali sme, na ktorom pracovisku v nemocnici bola identifikovaná sepsa. V roku 2004 na Oddelení centrálneho príjmu (CPO) bol identifikovaný jeden pacient, 20 pacientov na KAIM a 8 pacienti na iných oddeleniach nemocnice. V roku 2005 boli na CPO identifikovaní 3 pacienti, na iných oddeleniach 22 a na KAIM 13 pacientov. V roku 2006 na CPO nebol identifikovaný žiadny pacient, na iných oddeleniach nemocnice 28 a na KAIM 8 pacientov (graf 1). Najčastejším dňom identifikácie sepsy bol deň prijatia – u 82 pacientov, čo predstavuje 80 %. Bol to aj dôvod prijatia pacientov na I. KAIM. Iné prípady identifikácie ťažkej sepsy v neskorších dňoch po prijatí predstavujú situácie, kedy sa ťažká sepsa rozvinula na KAIM.
Graph 1. Miesto identifikácie sepsy po rokoch podľa pracovísk 
Z celého súboru 103 pacientov zomrelo 62 pacientov (60 %) na KAIM a na iných oddeleniach nemocnice 5 pacientov (5 %). Súhrnná absolútna nemocničná mortalita analyzovaných 103 pacientov za celé obdobie predstavuje 65 %. Súhrnná absolútna mortalita týchto pacientov na KAIM bola 60,2%. Absolútne percento mortality bolo: v roku 2004 – 72 %, v roku 2005 – 63 % a v roku 2006 – 61 % (graf 2).
Priemerné SOFA skóre v súbore 103 pacientov bolo 10,1 ± 3,7. Priemerné APACHE II skóre bolo 34 ± 8,5. Priemerný vek pacientov hospitalizovaných s ťažkou sepsou alebo septickým šokom bol 56,2 ± 7,2 rokov. Vekové rozpätie bolo od 16 do 88 rokov.
Priemerné trvanie hospitalizácie bolo 11,3 ± 10,5 dní. Pri vyhodnocovaní najvyššej hodnoty TISS, dosiahnutej u jednotlivých pacientov počas celej liečby na KAIM, sme došli k výsledkom uvedeným v grafe 3.
Graph 3. Rozdelenie súboru 103 pacientov podľa najvyššieho dosiahnutého TISS skóre 
Rozdelenie pacientov podľa ložiska infekcie, z ktorého vznikla sepsa, je na grafe 4. Súčty sú väčšie ako 103, lebo u niektorých pacientov bolo identifikovaných viac zdrojov sepsy ako jeden.
Graph 4. Ložisko infekcie ako zdroja sepsy v celom súbore pacientov 
SIRS sa najčastejšie prejavoval tachykardiou (99 %), následne v zostupnom poradí zmenou psychického stavu (78 %), leukocytózou (73 %), horúčkou (59 %), tachypnoe (50 %) a hyperglykémiou (32 %). Leukopénia sa vyskytovala v 14 %, hypotermia v 5 % a zimnica v 1 % prípadov.
Medián trvania umelej ventilácie je 2 dni (16 pacientov). Trvanie hospitalizácie preživších pacientov bolo 13,2 dňa.
Graf 5 zobrazuje plnenie jednotlivých kritérií postupných krokov resuscitácie a ďalšieho manažovania pacientov s ťažkou sepsou a septickým šokom podľa jednotlivých rokov.
Cieľom realizovania postupov pre liečbu ťažkej sepsy a septického šoku je plnenie všetkých kritérií na 100 %. Medziročným porovnaním jednotlivých kritérií v grafe 5 je možné pozorovať priebežný trend vývoja kvality diagnostiky a liečby v celom súbore 103 pacientov.
Graph 5. Plnenie odporúčaných kritérií v celom súbore pacientov po rokoch 
V roku 2004 boli všetky resuscitačné kritériá do 6 hodín splnené u 7 % pacientov, v roku 2005 u 16 % pacientov a v roku 2006 u 11 % pacientov. Kritériá 24-hodinového manažmentu sa v rokoch 2004 a 2005 nepodarilo naplniť ani v jednom prípade. V roku 2006 to bolo u 56 % pacientov. Pri hodnotení plnenia všetkých kritérií, resuscitačných (do 6 hod) a zároveň aj kritérií ďalšieho manažovania (do 24 hod) v rokoch 2004 a 2005 neboli naplnené ani v jedinom prípade, v roku 2006 to bolo u 8 % pacientov.
Diskusia
Výskyt ťažkej sepsy a septického šoku v našej štúdii je prakticky totožný so štúdiou vykonávanou na vybraných anestéziologických pracoviskách na Slovensku v roku 2002 [4], ktorá uvádza 7,9-% výskyt z prijatých pacientov na OAIM. Výskyt ťažkej sepsy a septického šoku vo francúzskej štúdii EPISEPSIS bol 8,4-% [5]. French vo svojej práci uvádza (tab. 5) výskyt pacientov s ťažkou sepsou pri prijatí na JIS v rozmedzí 11,6–28,7 % [6].
Table 2. Incidencia ťažkej sepsy na 100 prijatí na JIS* 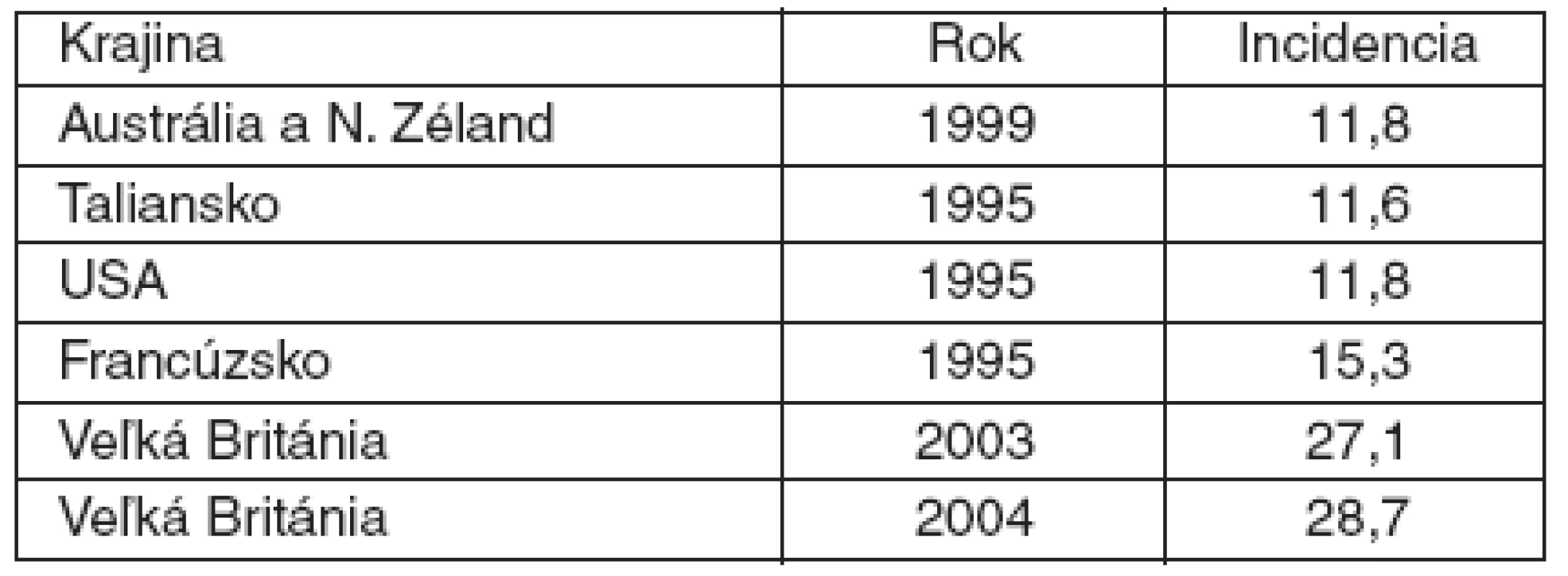
Spracované podľa [6] *vo vybraných krajinách [6] U prijatých pacientov je pozoruhodné vysoké percento septického šoku. Pacienti boli prijatí z iných pracovísk nemocnice a iba 4 pacienti (3,9 %) boli prijatí z vonku (cez oddelenie centrálneho príjmu).
APACHE II skóre bolo vo všetkých prípadoch vyššie v skupinách pacientov, ktorí zomreli, v porovnaní s tými, čo prežili. SOFA skóre nekoreluje vo všetkých skupinách ťažkej sepsy a septického šoku s mortalitou. Môže to súvisieť s malým počtom pacientov v jednotlivých podskupinách (viď tab. 4).
Table 3. Mortalita pri ťažkej sepse a pri septickom šoku* 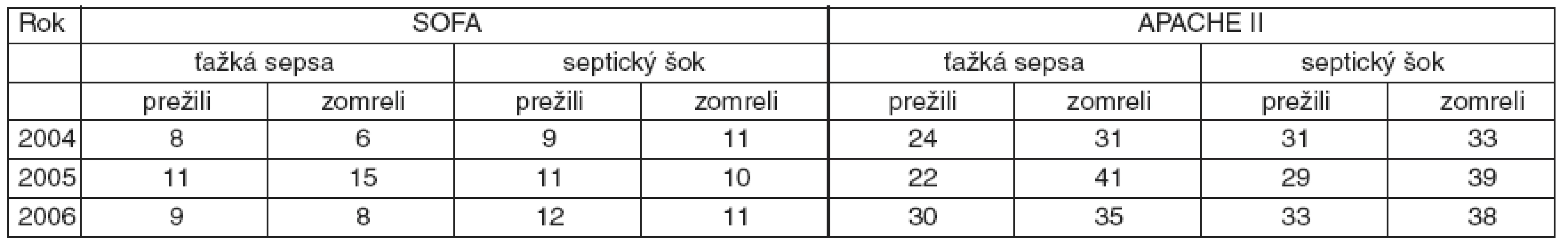
*v závislosti od SOFA, respektíve APACHE II Podobne ako v iných epidemiologických štúdiách, aj v našej bol najčastejším zdrojom sepsy respiračný trakt v 74 prípadoch u 103 pacientov a brušné infekcie v 59 prípadoch (viď graf 4). Podobné nálezy zaznamenala aj španielska štúdia EDUSEPSIS [7].
Najčastejšie sa pri ťažkej sepse z príznakov SIRS vyskytovali v klesajúcom poradí: tachykardia, mentálne zmeny, leukocytóza atď. Až na štvrtom mieste – čo do počtu výskytu – bola horúčka. Z toho vyplýva, že pacienta s ťažkou sepsou je potrebné analyzovať zo zreteľom na všetky klinické a laboratórne ukazovatele SIRS. Horúčka, ktorá sa v bežnej praxi hodnotí ako významný faktor, v našom súbore nevystupuje ako primárny ukazovateľ ťažkej sepsy.
V našom materiáli je najpočetnejšia skupina pacientov (24 %) s trvaním umelej ventilácie 2 dní, avšak súbor obsahuje aj pacientov s umelou ventiláciou trvajúcou dlhšie ako jeden mesiac. Priemerne trvanie hospitalizácie 11,3 ± 10,5 dní zahŕňa aj pacientov, ktorí zomreli. Ak vyberieme preživších, priemerne trvanie hospitalizácie je u nich 13,2 dní.
Pri porovnaní pacientov preživších a zomrelých možno pozorovať, že včasné vyšetrenie laktátu bolo vykonané častejšie u pacientov, ktorí zomreli. Ostatné kroky, ako odobratie kultivácie z krvného prúdu, podanie antibiotika, noradrenalínu a objemovej resuscitácie, dosiahnutie predpísaných parametrov CVT a SvcO2, boli dosiahnuté skôr u pacientov, ktorí prežili. Súhrnné vyhodnotenie krokov 1–6 resuscitačných postupov vychádza priaznivejšie u pacientov, ktorí prežili (graf 6).
Graph 6. Plnenie kritérií menežovania ťažkej sepsy a septického šoku a mortalita 
Table 4. Výskyt septického šoku a mortalita 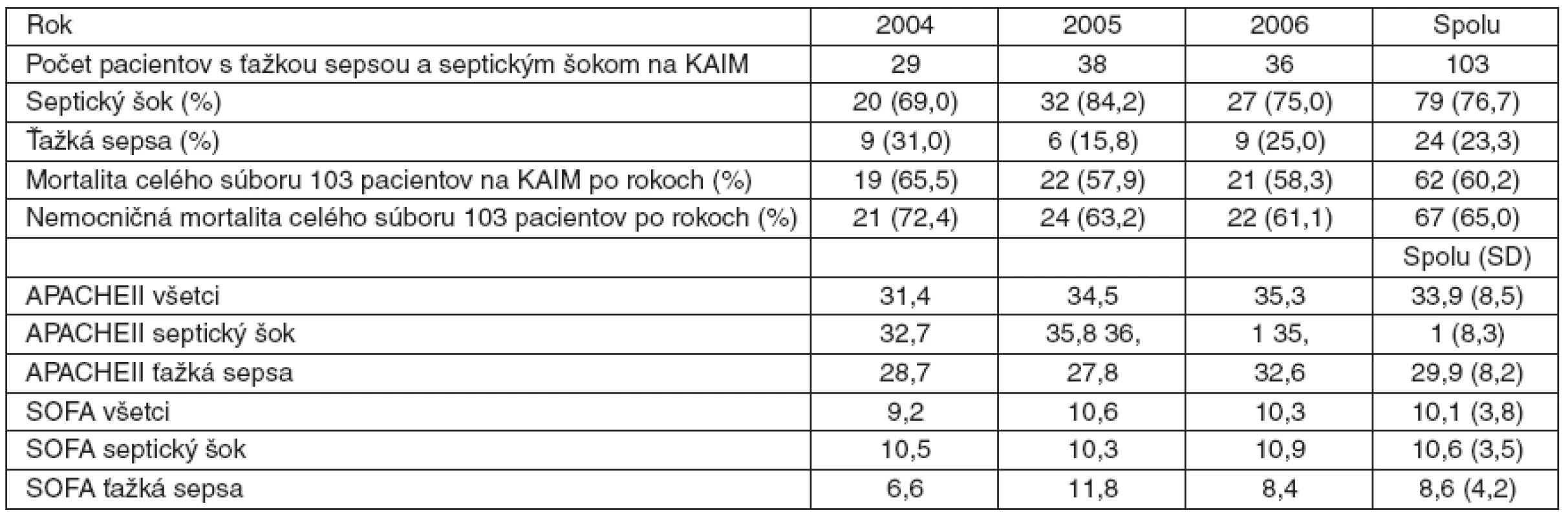
V krokoch 8–11 manažovania pacientov do 24 hodín od diagnostikovania ťažkej sepsy sú výsledky priaznivejšie pri ich dosiahnutí u pacientov, ktorí prežili. Trendu sa vymyká iba podanie steroidov (viď graf 6).
Včasné podanie kortikosteroidov, ak bolo indikované, bolo spojené s vyššou mortalitou. Dá sa to vysvetliť tým, že pacienti mali indikované podanie kortikosteroidov v prípade, ak nebola úspešná resuscitácia prívodom objemu a podaním noradrenalínu. Títo pacienti boli v ťažšom stave, spĺňali kritérium septického šoku. Pacienti, ktorí v septickom šoku neboli, nemali podávané kortikoidy. Podávanie kortikosteroidov bolo jedno z diagnostických kritérií, podľa ktorého sme pacienta zaradili do skupiny septického šoku alebo ťažkej sepsy [8].
Pozoruhodné je, že pri analýze pacientov v septickom šoku, naplnenie kritérií objemovej resuscitácie a podanie noradrenalínu bolo spojené s vyššou mortalitou. Jednou z možných príčin je podávanie noradrenalínu až následne, po neúspešnosti objemovej nálože. Ukazuje sa, že správnejší postup je súčasné podávanie objemovej nálože a vazopresorov, a pri pozitívnej odpovedi znižovať dávku oboch [9]. Stále sa hľadá rovnováha, kedy je možné považovať za dostatočné podanie objemovej nálože na jednej strane a dostatočnej dávky noradrenalínu na strane druhej. Z pohľadu splanchnickej mikrocirkulácie v prvom prípade hrozí pri vysokom príjme tekutín edematózne presiaknutie tkanív so zvýšením intraabdominálneho tlaku a pri poddávkovaní tekutinami a zvyšovaní dávok noradrenalínu ischemické neokluzívne poškodenie čreva. V tejto súvislosti je Cheatham toho názoru, že už od počiatočnej fázy liečby ťažkej sepsy je vhodné podávať objemovú nálož a noradrenalín súčasne v rámci tzv. vyvažovanej resuscitácie („balanced resuscitation“) [9]. Potrebné je preto hovoriť nie o resuscitácii objemom alebo vazopresormi, ale o resuscitácii objemom a vazopresormi.
Plnenie jednotlivých kritérií postupných krokov resuscitácie a ďalšieho manažovania pacientov s ťažkou sepsou a septickým šokom podľa jednotlivých rokov považujeme za ťažiskový výsledok našej štúdie (viď graf 5). V grafe porovnávame jednotlivé kritériá podľa rokov. Cieľom je zlepšovanie plnenia kritérií z roka na rok, čo sa podarilo v kritériách: vyšetrenie laktátu, podaní antibiotík, dosiahnutie SvcO2, podanie kortikosteroidov a prežitie pacientov. V ostatných kritériách sme nedosiahli očakávaný stúpajúci trend. V parametri dosahovania glykémie do 8,3 mmol . l-1 sa trend zhoršoval.
Výskyt počtu orgánových zlyhaní pri ťažkej sepse a septickom šoku v USA má v rokoch 1993–2003 postupný medziročný nárast výskytu počtu 1–3 zlyhaných orgánov. Počet štyroch orgánových zlyhaní v priebehu rokov klesá [10]. SOAP štúdia uvádza európsky výskyt zlyhania jedného orgánu na JIS do 30 %, dvoch do 20 %, troch 5 % a štyroch a viac orgánových systémov 2 %. Nepriamo úmerná je k tomu mortalita – 20% pri zlyhaní jedného orgánového systému, 32% pri dvoch, 50% pri troch a viacerých systémoch; 60% mortalita sa uvádza pri zlyhaní 4 a viacerých orgánových systémov [11]. V našom súbore počet orgánových zlyhaní neudávame.
Celková nemocničná mortalita zistená v sledovanom súbore (65%) je vysoká, podobne ako v celoslovenskej Záhorcovej štúdii z roku 2002, ktorá uvádza mortalitu 51,2%. Brun-Buisson uvádza mortalitu na francúzskych JIS 56% [5]. Nemecká štúdia prevalencie z roku 2003 uvádza mortalitu pri ťažkej sepse 40% na JIS a mortalitu nemocničnú 47%, pri septickom šoku mortalitu na JIS 55% a nemocničnú 62%. French uvádza mortalitu v rôznych krajinách s priemerom 36,2 % [6]. V našej štúdii je vysoký výskyt septického šoku – až 77%, čo môže vysvetľovať aj vysokú nemocničnú mortalitu. Svedčia o tom vysoké SOFA skóre 10,1 ± 3,7 a APACHE II skóre 34 ± 8,5. K vyššiemu výskytu úmrtia prispel aj vysoký priemerný vek pacientov 56,2 ± 7,2 rokov. Moreno pri analýze 2628 pacientov prijatých na JIS s infekciou alebo sepsou (15,6 %) zistil nemocničnú mortalitu 40,6%, z toho pacienti, ktorí mali septický šok, mali mortalitu až 52,5% [12].
Levy, jeden z protagonistov SSC, pri prezentácii na kongrese ESICM v Berlíne v roku 2007 uvádzal vyšší výskyt prijatých pacientov v septickom šoku (650, tj. 74 %) v porovnaní s počtom pacientov s ťažkou sepsou (230). Mortalitu pacientov prijatých v septickom šoku uvádza 25,5% a u pacientov s ťažkou sepsou mortalitu iba 13,7%. Španielski autori [7], v štúdii EDUSEPSIS prezentovali pokles úmrtnosti na JIS z 36,7 % na 32,3 % a nemocničnú mortalitu zo 44,0 na 39,7 % od začiatku uplatňovania smerníc SSC pre liečbu ťažkej sepsy. V našej štúdii máme pokles nemocničnej mortality zo 72% v roku 2004 na 61% v roku 2006, t. j. pokles mortality o 11 % (viď graf 2).
Incidencia sepsy so stúpajúcim vekom stúpa výraznejšie po 50. roku života u oboch pohlaví. Podobne sa chová aj mortalita, ktorá po 50. roku veku sa dostáva nad 25 % [13].
Table 5. Hodnotené kritériá v programe Sepsis bundles 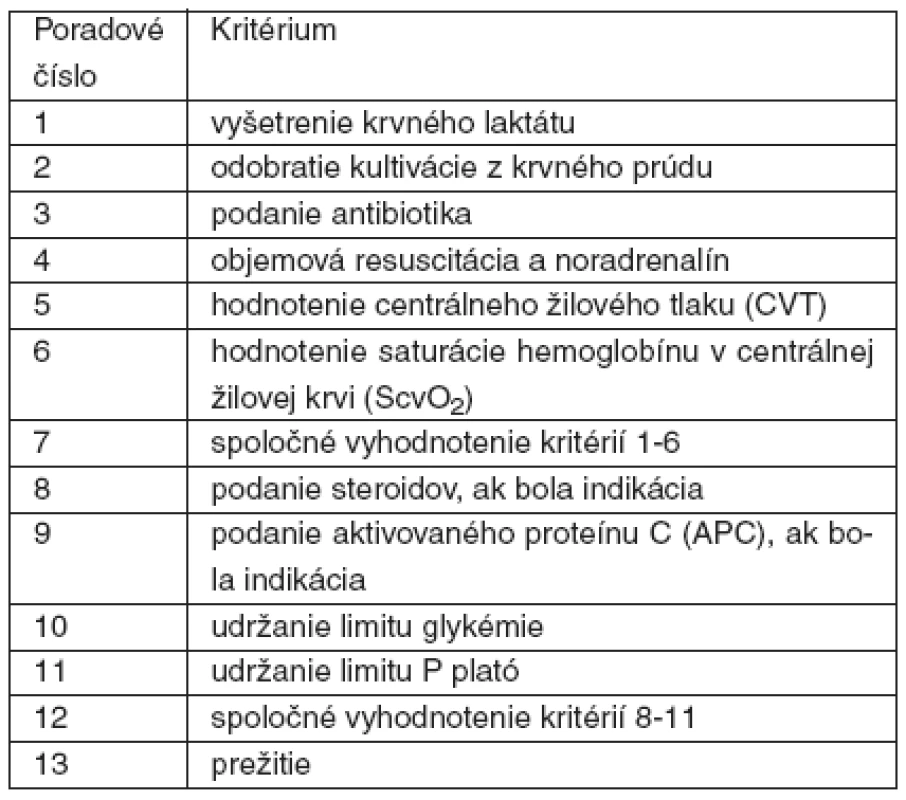
V našej štúdii je pri porovnaní s inými autormi pozoruhodná vysoká mortalita. Pacienti, ktorých sme analyzovali, boli postihnutí predovšetkým nozokomiálnymi infekciami, keďže počet prijatých pacientov z komunitného prostredia, teda z oddelenia centrálneho príjmu, bol v našom súbore pacientov minimálny (v roku 2004 : 1 pacient, 2005 : 3 pacienti, 2006 : 0). Väčšina prác, pochádzajúcich najmä zo zámoria, analyzuje pacientov, ktorí boli do nemocnice prijatí z komunitných podmienok a neliečila sa sepsa nozokomiálneho pôvodu. Základné princípy liečby ťažkej sepsy pri komunitných a nozokomiálnych infekciách sú rovnaké. Pacienti s rozvinutou nozokomiálnou sepsou však majú orgánové zlyhania v pokročilom štádiu rozvoja a ich stav je významne modifikovaný predchádzajúcou hospitalizáciou. Možno predpokladať, že to nepriaznivo ovplyvňuje reaktivitu pacientov na uskutočňovanú liečbu na JIS. Takými zmenami sú imunosupresia, malnutrícia, nesprávna liečba antibiotikami, katabolizmus, renálna insuficiencia, inzulínová rezistencia, anasarka, dlhší čas používané podporné procedúry (CVVH) a imobilizácia.
Pri kritickom pohľade na zdrojové články, na ktorých je postavená SSC, možno nájsť určité vysvetlenie v nie jednoznačne pozitívnych výsledkoch pri uplatňovaní súboru opatrení SSC. Väčšina citovaných štúdií je na úrovni dôkazov E (27 štúdií). Patria sem napríklad odporúčania objemovej nálože, používanie vazopresorov alebo včasné podanie antibiotík. Najvyššiu úroveň dôkazov A má iba 5 štúdií. Ostatné úrovne predstavujú štúdie úrovne B 11, úroveň C 5 štúdií a D 4 štúdie [14].
Zaujímavý je pohľad na podávanie rekombinantného humánneho aktivovaného proteínu C (rhAPC). V nasledujúcich štúdiách (ENHANCE, ADDRESS, Pediatric trial, národné registre) neboli výsledky také priaznivé ako v štúdii PROWESS. Z toho dôvodu sa odporúča podávať APC iba u pacientov s vysokým rizikom úmrtia so sepsou, ktorá je v priebehu prvých 24 hodín. Jeho podanie sa v súčasnosti považuje za relatívne bezpečné pri zvážení relatívnych kontraindikácií.
Annane et al. nenašli signifikantný rozdiel v 28-dňovej mortalite po resuscitácii septického šoku podávaním kombinácie noradrenalínu s dobutamínom (mortalita 34%) a v druhej skupine podávanom adrenalíne (mortalita 40%), aj keď výsledky pri podávaní adrenalínu sa ukazujú menej priaznivé [15].
V našom súbore pacientov sme postupovali podľa odporúčaní SSC, teda u pacienta s ťažkou sepsou, ktorý po podaní objemovej nálože na dosiahnutie CVT 8–12 mm Hg (10–15 cm H2O) nereagoval upravením stredného artériového tlaku nad 65 mm Hg, sme podali ako vazopresor prvej voľby noradrenalín. Ak u tohto pacienta nešlo o anémiu, a aj napriek tomu mal saturáciu Hb kyslíkom v hornej dutej žile menej ako 70 %, mal pridaný dobutamín. Vplyv na renálnu cirkuláciu sme pozorovali podobný ako Albanese, ktorý zistil, že u pacientov, ktorí mali septickú vazodilatáciu, podanie noradrenalínu zlepšilo perfúziu obličkami a vylučovanie kreatinínu. U pacientov s kraniotraumou zvyšovanie noradrenalínu funkcie obličiek zhoršovalo [16].
Veľa štúdií sa zameriava na liečbu hyperglykémie [17]. Všetky sa zhodujú na tom, že po stabilizácii obehu je potrebné liečiť hyperglykémiu, ktorá má veľa nepriaznivých dôsledkov u septického pacienta. Stále sa avšak diskutuje o otázke, na aké hladiny sa má hyperglykémia znižovať. Septickí pacienti sú veľmi labilní a majú sklon k náhlemu poklesu glykémie. Situácia je potencovaná vekom, lebo vyšší vek má väčšiu predispozíciu ku vzniku hypoglykémie [18]. Aj z toho dôvodu odporúčania SSC stanovili kompromisný limit glykémie 8,3 mmol . l-1 namiesto limitu 6,1 mmol . l-1, ktorý odporúčajú pôvodné práce Van den Bergovej [17]. V našej štúdii sme sa zameriavali na odporúčaný limit 8,3 mmol . l-1. Plnenie tohto kritéria na 62 % v prvom roku trvania štúdie 2004 sa nám nepodarilo udržať a v nasledujúcich rokoch percento plnenia pokleslo na 56 %. Môže to súvisieť s postupným presúvaním kompetencií za reguláciu glykémie na sestry a nedôslednosťou lekárskeho personálu pri dodržiavaní protokolu, keďže v pilotnej štúdii, ktorú sme vykonali pred začiatkom štúdie, sme mali plnenie kritéria dosiahnutia glykémie pod 8,3 mmol . l-1 do 24 hodín od diagnostikovania ťažkej sepsy až 75%.
Ako uvádza Goldhill, neskoršie prijatie pacientov z iného oddelenia na JIS má nepriaznivý vplyv na ich mortalitu [19]. Čím dlhšie boli pacienti hospitalizovaní na inom oddelení nemocnice pred prijatím na JIS, tým ich úmrtnosť na JIS, respektíve aj nemocničná mortalita, boli vyššie. Je možno predpokladať, že aj takáto skutočnosť mala vplyv na mortalitu pacientov v našej štúdii. Pacienti boli z iných oddelení alebo JIS prekladaní v pokročilom štádiu ťažkej sepsy, respektíve v septickom šoku, ktorý predstavuje v našom súbore až 77 % pacientov.
Ramsay prezentuje časť dotazníkovej akcie štúdie Prevalence vykonanej medzi nemeckými intenzivistami v roku 2003, v ktorej sa zisťovalo, čo si myslia o realizovaní postupov manažmentu ťažkej sepsy na ich pracoviskách a aké výsledky na týchto pracoviskách zistil v skutočnosti audit. Vo všetkých hodnotených kritériách sa našli podstatné rozdiely. Najväčšie rozdiely medzi dotazníkovými údajmi a skutočnosťou zistenou auditom boli pri netraumatizujúcej ventilácii (92 % vs 4 %). Pri plnení kritéria dodržiavanie glykémie to bolo 67 % vs 9 %, ScvO2 46 % vs 18 % a pri podávaní hydrokortizónu pri jeho indikácii 79 % vs 31 %. Opačne, teda horšiu mienku aká bola skutočnosť, mali o nepodávaní renoprotektívnych dávok dopamínu (67 % vs 92 %) [20].
Aj napriek vypracovaným odporúčaniam pre zvyšovanie úspešnosti liečby septických pacientov, v praxi pretrváva pomerne nízke využívanie týchto postupov. Mienka respondentov v štúdii Prevalence ukazuje, aká je diskrepancia medzi predstavami personálu o plnení kritérií na svojom pracovisku a aká je skutočnosť [20]. Podobné zistenia prezentoval Levy na kongrese ESICM v Berlíne 10. 10. 2007, kde predpokladané a uskutočnené výkony boli pri dosahovaní CVP 68 % vs 30 % a v resuscitácii tekutinami a vazopresormi uvádzal rozdiel 82 % vs 40 %.
Algoritmické postupy z odporúčaní SSC je možné z pohľadu liečby rozdeliť do dvoch skupín. Sú to základné kauzálne terapeutické postupy, akými je podanie antibiotika, drenáž abscesu, respektíve odstránenie cudzieho materiálu. Ďalšími sú suportívne kroky, ktoré majú za úlohu vytvoriť podmienky pre prežitie ťažkej sepsy/šoku, akými sú podanie objemovej nálože, noradrenalínu, dosiahnutie cieľovej hodnoty CVT a ScvO2, diurézy. Patrí sem aj podanie steroidov a zabezpečenie umelej ventilačnej podpory.
Na stratifikáciu pacientov pre identifikáciu rizika úmrtia a prispôsobovanie liečby odporúča Moreno používať trojstupňovú klasifikáciu:
- stupeň – vyjadruje predispozíciu pacienta v súvislosti s jeho stavom pred prijatím na JIS.
- stupeň – úroveň rozvinutia infekcie pri prijatí na JIS.
- stupeň – odpoveď orgánových funkcií na priebeh infekcie.
Vychádza to z klasickej koncepcie PIRO [12].
Záver
Za hlavné úskalia, ktoré v súčasnosti zhoršujú výsledky v liečbe pacientov s ťažkou sepsou, považujeme:
- Pacienti s ťažkou sepsou, ktorá sa rozvinie v nemocničných podmienkach, sú zaťažení vysokou mortalitou. Je to spôsobené častým výskytom septického šoku pri začínaní liečby na JIS. Pacientov s ťažkou sepsou je preto potrebné na základných oddeleniach skôr identifikovať, zahájiť liečbu a zavčasu prekladať na JIS.
- Pacienti s ťažkou sepsou predstavujú veľmi heterogénnu skupinu, preto je potrebné deliť ich do podskupín podľa príčiny a priebehu ochorenia. Podľa toho je potrebné orientovať výskum a prispôsobovať liečbu.
Došlo 1. 7. 2008.
Přijato 13. 8. 2008.
Adresa pro korespúondenci:
MUDr. Jozef Firment, PhD.
UPJŠ a FNLPKošice
I. klinika anesteziológie a intenzívnej medicíny
Rastislavova 43
040 66 Košice
Slovenská republika
e-mail: jozef.firment@upjs.sk
Sources
1. Firment, J. Výzva Č-S fóra pre sepsu adresovaná ČLS JEP a SLS. Medicínsky monitor, 2005, roč. 1, s. 29.
2. Firment, J., Záhorec, R. Odporúčania pre liečbu ťažkej sepsy dospelých. Medicínsky monitor, 2004, roč. 3, s. 30–35.
3. Dellinger, R. P., Levy, M. M., Carlet, J. M. et al. Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septic shock. Inten. Care Med., 2008, 34, p. 17–60.
4. Záhorec, R., Firment, J., Straková, J., Mikula, J., Malík, P. et al. Epidemiology of Severe Sepsis in Intensive Care Units in Slovak republic. Infection, 2005, 33, p. 93.
5. Brun-Buisson, C., Meshaka, P., Pinton, P. et al. EPISEPSIS: a reappraisal of the epidemiology and outcome of severe sepsis in French intensive care units. Inten, Care Med,, 2004, 30, p. 580–588.
6. French, C. J. The epidemiology of sepsis – is Australasia different? Crit. Care Res., 2006, 8, p. 219–222.
7. Ferrer, R., Edusepsis investigators: Sepsis mortality can be reduced by an educational program based on guidelines. Inten. Care Med., Supplement, 2007, S5.
8. Grendel, T., Hudák, V., Firment, J. Nízke dávky kortikoidov a septický šok. Rozhl. Chir., 2008, 87, 3, p. 158–164.
9. Cheatham, M. L. Resuscitation end points in severe sepsis: Central venous pressure, mean arterial pressure, mixed venous oxygen saturation, and intra-abdominal pressure. Crit. Care Med., 2008, 36, p. 1012–1013.
10. Dombrovskiy, V. Y., Martin, A. A., Sunderram, J., Paz, H. Rapid increase in hospitalization and mortality rates for severe sepsis in the United States: A trend analysis from 1993 to 2003. Crit. Care Med., 2007, 35, p. 1244–1250.
11. Vincent, J. L., Sakr, Y., Sprung, C. L., Ranieri, V. M., Reinhart, K. et al. Results of the SOAP study. Crit. Care Med., 2006, 34, p. 344–353.
12. Moreno, R. P., Metnitz, B., Adler, L., Hoechtl, A., Bauer, P., Metnitz, P. G. H., SAPS 3 Investigators: Sepsis mortality prediction based on predisposition, infection and response. Inten. Care Med., 2008, 34, p. 496–504.
13. Haas, L. E. M., Tjan, D. H. T., van Zanten, A. R. H. An introduction to sepsis. Lifelines in Critical Care and Anaesthesia, 2006, 10, p. 2–5.
14. Vincent, J. L. PLoS Medicine. Dostupné na:
www.plosmedicine.org, 2006, Vol. 3, 9, e346, p. 1488–1491.
15. Annane, D., Vignon, P., Renault, A., Bollaert, P. E., Charpentier, C., Martin, C., Troché, G., Ricard, J-D., Nitenberg, G., Papazian, L., Azoulay, E., Bellissant, E., CATS Study Group: Norepinephrine plus dobutamine versus epinephrine alone for management of septic shock: a randomised trial. Lancet, 2007, 370, p. 676–84.
16. Albanese, J., Leone, M., Garnier, F., Bourgoin, A., Antonini, F., Martin, C. Renal effects of norepinephrine in septic and nonseptic patients. Chest, 2004, 126, p. 534–539.
17. Van den Berghe, G., Wilmer, A., Hermans, G., Meersseman, W., Wouters, P.J. et al. Intensive Insulin Therapy in the Medical ICU. NEJM, 2006, 354, p. 449–461.
18. Brunkhorst, F. M., Reinhart, K. Intensive insulin therapy in the ICU: benefit versus harm? Inten. Care Med., 2007, 33, p. 1302.
19. Goldhill, D. R. et al. The longer patients are in hospital before Intensive Care admission the higher their mortality. Inten. Care Med., 2004, 30, p. 1908–1913.
20. Ramsay, G. Update on Surviving sepsis campaign. CD1, 8. PG Kurz Sepse a MODS. Ostrava 2006.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2008 Issue 5
Most read in this issue- Celková anestezie s bdělou fází u neurochirurgických výkonů
- Úskalia uplatňovania odporúčaní pre diagnostiku a liečbu ťažkej sepsy
- Imunopatogeneze sepse
- Čtvrtstoletí selektivní dekontaminace trávicího traktu – řada otázek zůstává nezodpovězena
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


