-
Medical journals
- Career
Celková anestezie s bdělou fází u neurochirurgických výkonů
: Duba Jaroslav 1; Gál Roman 1; Svoboda Tomáš 2
: Klinika anesteziologie, resuscitace a intenzivní medicíny FN Brno-Bohunice 1; Neurochirurgická klinika FN Brno-Bohunice 2
: Anest. intenziv. Med., 19, 2008, č. 5, s. 248-251
: Anaesthesiology - Original Paper
Cíl studie:
Zavést anesteziologický postup umožňující u pacienta s kraniotomií bdělou fázi s peroperační elektrickou kortikální stimulací při resekcích tumorů postihujících funkční korová centra. Ověřit možnost vedení přerušované celkové anestezie se spontánní ventilací bez invazivního zajištění dýchacích cest v celkové délce trvání několika hodin.Typ studie:
Klinická, prospektivní studie.Název a sídlo pracoviště:
Klinika anesteziologie, resuscitace a intenzivní medicíny a Neurochirurgická klinika.Materiál a metoda:
Do studie bylo zařazeno 5 pacientů s mozkovým nádorem postihujícím funkční mozkovou kůru. Jako anesteziologická technika byla použita TIVA s kombinací propofolu a remifentanilu bez invazivního zajištění dýchacích cest.Výsledky:
Průměrný čas výkonu byl 420 minut, průměrná doba peroperační bdělosti pacienta 73 minut. Použité dávky kontinuálně podávaných anestetik se pohybovaly v rozmezí 5–8 mg . kg⁻¹ . h⁻¹ propofolu a 1 až 5 mcg . kg⁻¹ . h⁻¹ remifentanilu. Komplikace byly zastoupeny 1krát výrazným nepohodlím spojeným s neklidem, 1krát epileptickou aktivitou a 1krát edémem, respektive expanzivním chováním léze.Závěr:
Celková anestezie s vědomou fází umožňuje využití elektrické kortikální stimulace, která v návaznosti na fMRI a neuronavigaci představuje současný „zlatý standard“ pro resekci mozkových nádorů postihujících funkční korová centra.Klíčová slova:
mozkový nádor – funkční kůra – intravenózní anestezie – bdělá fáze – kortikální stimulaceÚvod
Řada operačních výkonů v blízkosti CNS nebo přímo na CNS s sebou nese riziko pooperačního neurologického deficitu. Trvalou snahou je toto riziko minimalizovat, což usnadňují nové a stále dokonalejší monitorovací a zobrazovací technologie (monitorování SEP a MEP, NIRS, fMRI, neuronavigace), ale také rozvoj možností peroperačního funkčního vyšetřování.
Nejstarší osvědčenou metodou funkčního vyšetření, používanou ve spondylochirurgii deformit páteře, je test probuzení, tzv. wake-up test, jenž je nahrazován přesnější metodou somatosenzorických a motorických evokovaných potenciálů. Rovněž v neurochirurgii při resekcích tumorů postihujících funkční korová centra či v epileptochirurgii je v současné době za „zlatý standard“ považováno funkční mapování v podobě kortikální elektrické stimulace [1]. V případě lokalizace patologické léze v dominantní hemisféře v oblasti řečových a kognitivních funkcí je nutné provádět tuto stimulaci v průběhu bdělé fáze operace, tzv. awake surgery [2]. Cílem je maximální radikalita výkonu při zachování důležitých mozkových funkcí.
V článku popisujeme metodiku vedení anestezie [3, 4, 5, 6 ] a hodnotíme výsledky našeho malého souboru 5 pacientů operovaných pro tumor elokventního kortexu na Neurochirurgické klinice FN Brno v letech 2006 a 2007.
Soubor pacientů a metoda
V období od listopadu 2006 do července 2007 bylo ve FN Brno-Bohunice provedeno 5 operací mozkových nádorů, u nichž jsme na žádost neurochirurgické kliniky použili techniku „awake“ anestezie. Všichni pacienti byli před operací podrobně informováni včetně anonymního zpracování dat k výukovým a vědeckým účelům vzhledem k doposud malé četnosti provádění takových výkonů. Etickou komisi jsme neinformovali, neboť obdobná metoda je na jiných pracovištích již zavedena a celosvětově uznávána jako jeden z možných klinických postupů.
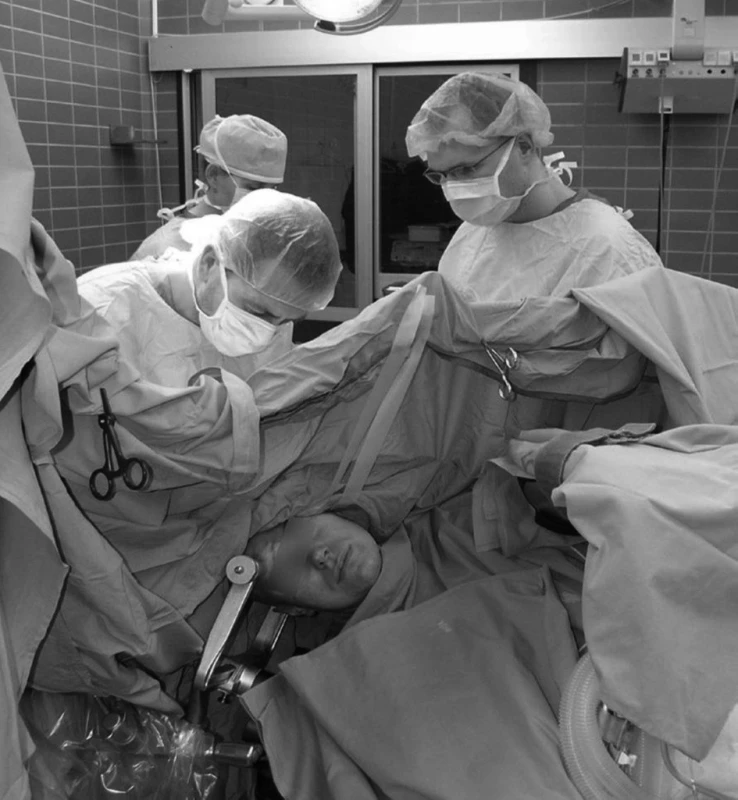
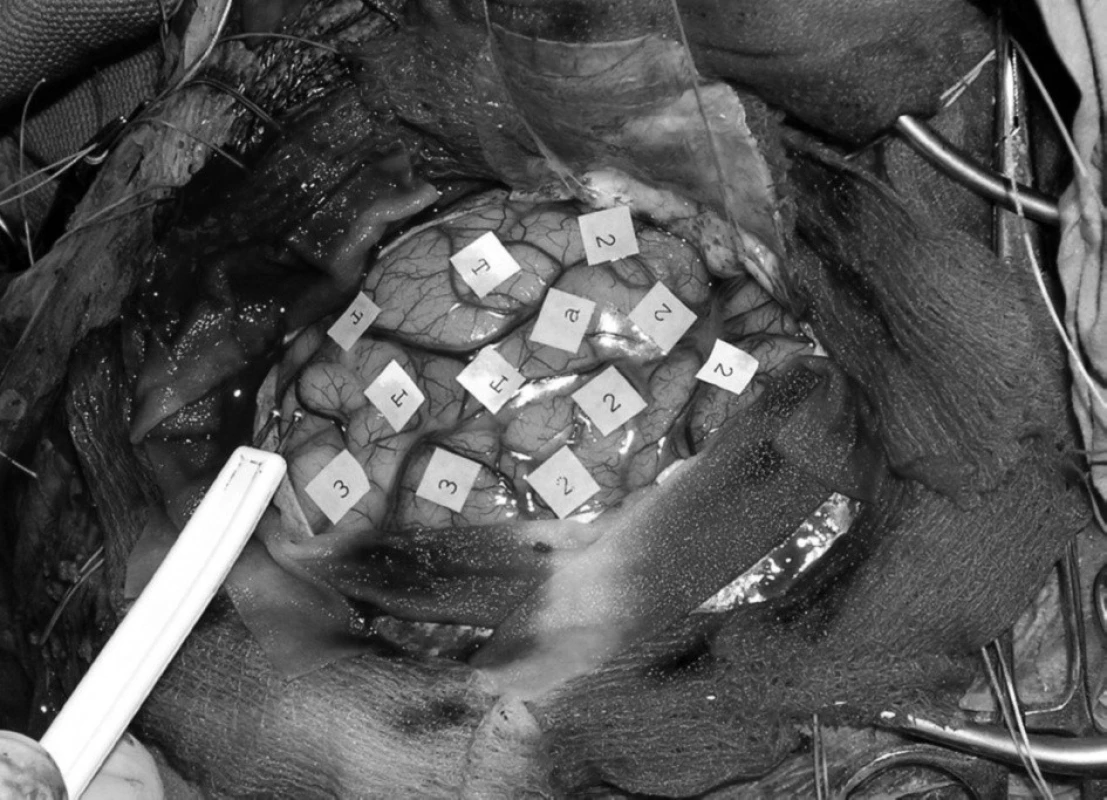
Jako premedikaci v předvečer operace jsme podali metoclopramid 10 mg a omeprazol 20 mg p. o. Ráno po příjezdu pacienta na operační sál a po kontrolním vyšetření anesteziologem jsme zajistili periferní žilní přístup a neinvazivní monitorování (EKG, SpO2, NIBP). Před úvodem do celkové anestezie jsme intravenózně aplikovali metoclopramid 10 mg, famotidin 20 mg a thiethylperazin 6,5 mg. Námi zvolená anesteziologická technika byla TIVA se spontánní ventilací s O2 maskou. Úvod do celkové anestezie jsme zahajovali bolusovou dávkou 1 mg . kg-1 t. hm. propofolu, následovanou spuštěním kontinuální aplikace propofolu a remifentanilu, které jsme postupně a šetrně navyšovali až do dosažení úvodní fáze spánku, v níž jsme dokončili invazivní zajištění (arteriální kanyla, močový katétr, další periferní žilní linka) a polohování včetně trojbodové fixace hlavy Mayfieldovým fixatérem. Použité dávky kontinuálně podávaných anestetik se pohybovaly v rozmezí 5–8 mg . kg-1 . hod-1 propofolu a 1–5 mcg . kg-1 . hod-1 remifentanilu. Spící, ale dostatečně spontánně ventilující pacient vdechoval směs vzduchu s 50% frakcí O2 volně přichycenou obličejovou maskou. Nezbytnou analgetickou složkou techniky je neurochirurgem provedená infiltrační anestezie měkkých tkání hlavy (operační rány, báze muskulokutánního laloku a bodů upnutí hlavy) 20–30 ml anestetické směsi (0,5% bupivakain a 1% mesokain v poměru 1 : 1 s adrenalinem 1 : 200 000). Stejná anestetická směs bez adrenalinu byla použita k infiltraci tvrdé pleny (1–3 ml). S využitím neuronavigace a fMRI po potřebném prohloubení anestezie provedl neurochirurg operační přístup – kraniotomii. Během kraniotomie jsme nemocného postupně saturovali fenytoinem (2 mg . kg-1 t. hm.) pro snížení prahu epileptické aktivity při elektrické stimulaci kůry mozku, dále jsme podali dexametazon (bolusově 4 mg po 4 hodinách) a manitol (1–1,5 g . kg-1 t. hm). Po dokončení kraniotomie jsme zastavili kontinuální injekci anestetik a pacient se během několika minut probudil k plnému vědomí. Během bdělé fáze (obr. 1) neurochirurg prováděl kortikální mapování (obr. 2) a lokalizaci korových center ohrožovaných tumorem metodou elektrické bipolární stimulace, za současného funkčního (v případě postižení řečového centra logopedického) vyšetřování (obr. 3). Následovala resekce tumoru, která byla podle tolerance pacientem a rozhodnutí operatéra uskutečňována buď při trvání vědomé fáze, nebo po opětovném navození celkové anestezie. V případě potřeby další stimulační fáze – subkortikální stimulace – lze tento postup „asleep-awake-asleep“ opakovat [3, 4]. Uzávěr kraniotomie jsme pak vždy prováděli opět v TIVA při spontánní ventilaci.
3. Peroperační logopedické vyšetření 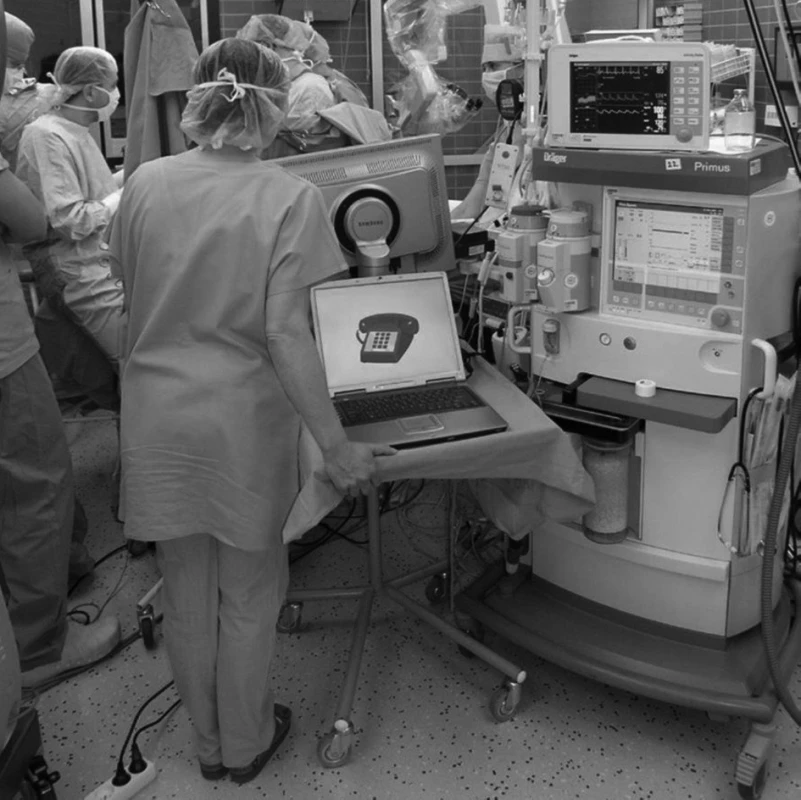
Výsledky
Všech 5 indikovaných pacientů úspěšně podstoupilo neurochirurgický resekční výkon s bdělou fází s využitím kombinace fMRI, neuronavigace a bipolární korové stimulace k ozřejmění hranice ještě bezpečné resekce tumoru elokventního kortexu. Pohlaví, věk, histologii, tumorem postižené centrum, čas bdělé fáze, celkový operační čas a perioperační komplikace ukazuje tabulka 1. Potřebná délka bdělé fáze se byla 18–120 min (průměr 73 min), celková doba pobytu na operačním sále byla 5–9,33 hod (průměr 7 hod). Peroperační komplikace byly zastoupeny 1krát výrazným nepohodlím spojeným s neklidem pacienta po 60 minutách bdělé fáze, 1krát epileptickou tonicko-klonickou aktivitou vyvolanou elektrickou kortikální stimulací, která ovšem rychle reagovala na ochlazení místa poslední stimulace připraveným chlazeným fyziologickým roztokem, a 1krát edémem, respektive expanzivním chováním léze reagujícím na bolus dexametazonu a manitolu. Ani jednou nebylo nutné invazivní zajištění dýchacích cest. Pooperačně se u jedné pacientky 2krát zopakovala epileptická aktivita, 1krát se vyskytla lehká paréza pravé horní končetiny, jež se pomalu zlepšovala, 1krát se objevila dočasná expresivní afázie a 1 pacient byl po kontrolním MR mozku reoperován ve standardní celkové anestezii pro reziduum tumoru.
1. Charakteristika souboru a výsledky 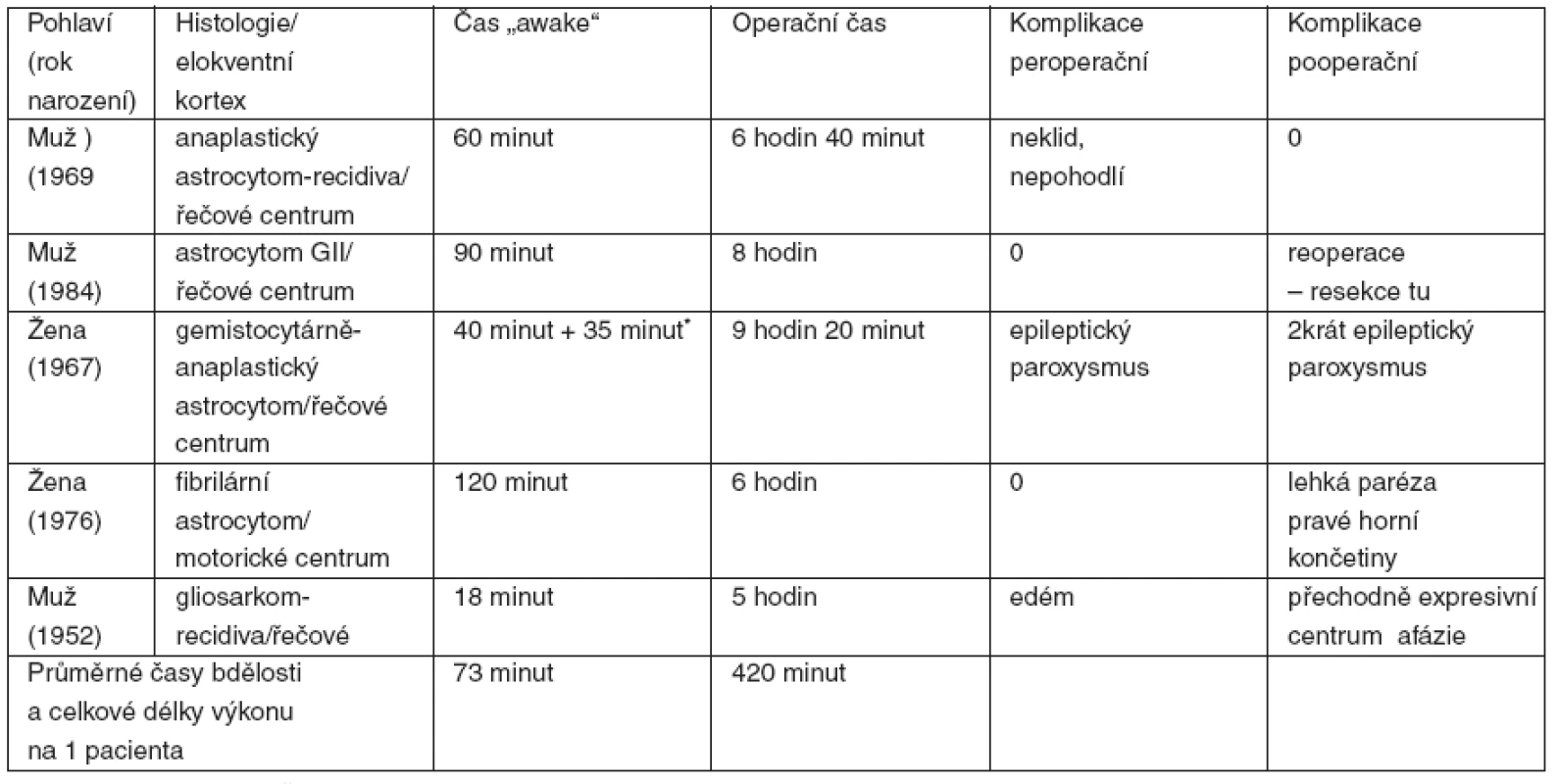
*opakování bdělé fáze při subkortikální stimulaci Diskuse
Rozhodujícím selekčním prvkem při výběru pacientů s odpovídajícím intrakraniálním nálezem při indikaci „awake“ resekce je osobnost pacienta. Je nezbytné, aby pacient zcela pochopil metodu a její přednosti a nebyl příliš úzkostlivý. Kromě standardního předoperačního vyšetření (fyzikální, laboratorní, EKG, RTG) věnujeme značnou pozornost psychologické přípravě se zaměřením na část operace při vědomí. K získání důvěry pacienta je třeba mu poskytnout společně s neurochirurgem a logopedem detailní vysvětlení celého průběhu operace. K navázání kontaktu s anesteziologem, případné úpravě zavedené léčby a ordinaci premedikace slouží anesteziologická vizita, která probíhá zpravidla den před operačním výkonem. Nezbytnou částí předoperační přípravy je logopedické vyšetření, při kterém se pacient seznámí s testy, které jsou pak používány při peroperačním vyšetřování (modifikovaný bostonský test). U všech pacientů v našem souboru byla předoperačně provedena fMRI na přístroji Magnetom Symphony 1,5T Siemens na pracovišti RDK Fakultní nemocnice u sv. Anny v Brně, respektive na přístroji Achieva 1,5T Philips na pracovišti ve FN Brno-Bohunice. Peroperačně byla využita neuronavigace StealthStation TREON firmy Medtronic a bipolární kortikální stimulace přístrojem Ojemann Stimulator firmy Integra.
Při farmakologické premedikaci se vyhýbáme tradičním preparátům, jež ovlivňují bdělost, kognitivní funkce a případně dechové centrum, a naopak upřednostňujeme prokinetika, antiemetika a gastroprotektiva k minimalizaci hrozících komplikací. Anestezie typu „asleep-awake-asleep“ [3] realizujeme ultrakrátce působícími kontinuálně podávanými anestetiky. Používáme propofol a remifentanil [4], ale primárně bez invazivního zajištění dýchacích cest. Náš přístup k managementu dýchacích cest lze charakterizovat jako citlivé vedení TIVA s primární snahou o volná ústa pacienta a zároveň neustálou připravenost k nutnému zajištění podle charakteru případné komplikace v souladu s doporučeními charakteru „difficult airways“. Připravené vybavení zahrnuje odpovídající velikosti vzduchovodů, laryngeálních masek, vybavení ke klasické intubaci, ale také flexibilní bronchoskop. Výhodu oproti obdobným výkonům s intubací či laryngeální maskou [5] spatřujeme především ve snazších přechodech mezi spánkem a bděním při peroperační fixaci hlavy Mayfieldovým fixatérem. Nedílnou součástí anesteziologické péče je zajištění dostatečného komfortu pro operovaného pacienta (pohodlí, teplota, ticho, minimalizace počtu osob), což spolu s důslednou předoperační selekcí podle neurologického nálezu a osobnostních charakteristik považujeme za hlavní prevenci nespolupráce v bdělé fázi. Jedenkrát se vyskytnuvší zhoršená spolupráce pacienta v našem malém souboru byla spojena s diskomfortem z operační polohy po 60 minutách stimulace, což byl dostatečný čas pro práci neurochirurga. Komunikace s pacientem a klinický odhad většinou rychle odhalí příčinu neklidu-diskomfortu operovaného. V případě, že příčinu nelze primárně eliminovat, je nutné ve spolupráci s neurochirurgem zkrátit čas stimulace, nebo zvolit přerušení bdělé periody stejně jako při subkortikální stimulaci. V popisovaném anesteziologickém postupu je vedle monitorování vitálních funkcí pacienta a vlastní anesteziologické techniky dále nutno znovu zdůraznit připravenost k řešení komplikací.
Malá velikost našeho souboru je dána přísnými indikačními kritérii. Metoda „awake“ resekce byla již v různých modifikacích několikrát popsána a publikována. Určitou změnu v anesteziologické technice spatřujeme především v primární neinvazivitě k dýchacím cestám. K hlavním rizikům popisovaných výkonů patří hypoventilace, vyvolaná epileptická aktivita, diskomfort pacienta spojený s neklidem, expanzivní chování léze, dále nauzea, vomitus s hrozící aspirací.
Závěr
Elektrická kortikální stimulace s využitím vědomé fáze operace v návaznosti na fMRI a neuronavigaci, představuje současný „zlatý standard“ pro resekci mozkových nádorů postihujících funkční korová centra. Podařilo se nám výše popsaný anesteziologický postup zavést do klinické praxe na našem pracovišti a zároveň jsme ověřili, že lze vést několikahodinovou přerušovanou TIVA bez invazivního zajištění dýchacích cest. Tyto „awake“ resekce lze provádět pouze se zkušeným anesteziologem, připraveným řešit hrozící komplikace, např. peroperační epileptický záchvat či nutnost invazivního zajištění dýchacích cest za nestandardních podmínek.
Cílem našeho článku je podat přehled o těchto nepříliš častých výkonech v neuroanestezii. Za hlavní předpoklady úspěchu považujeme výběr pacienta, získání důvěry, pochopení postupu, pečlivou přípravu přístrojů a vybavení, bezchybnou komunikaci v týmu a připravenost k řešení komplikací.
Použité zkratky:
TIVA – totální intravenózní anestezie
SEP – somatosenzorický evokovaný potenciál
MEP – motorický evokovaný potenciál
NIRS – blízká infračervená spektroskopie
fMRI – funkční magnetická rezonance
NIBP – neinvazivní krevní tlak
RDK – radiodiagnostická klinika
Došlo 29. 4. 2008.
Přijato 16. 8. 2008.
Adresa pro korespondenci:
MUDr. Jaroslav Duba
Svážná 2
634 00 Brno
e-mail: jarda.duba@atlas.cz
Sources
1. Stejskal, L. et al. Intraoperační stimulační monitorace v neurochirurgii. 1.vyd. Praha: Grada Publishing 2006, 104 s., ISBN 80-247-0964-3.
2. Taylor, M., Bernstein, M. Awake craniotomy with brain mapping as the routine surgical approach to treating patients with supratentorial intraaxial tumours: a prospective trial of 200 cases. J. Neurosurg, 1999, 90, s. 35–41.
3. Huncke, K., van de Wiele, B., Rubinstein, E. H. The asleep-awake-asleep anesthetic technique for intraoperative language mapping. Neurosurgery, 1998, 42, s. 1312–1317.
4. Conte, V., Baratta, P., Songa, V., Fava, E., Bello, L., Stocchetti, N. Propofol-remifentanil anesthesia for tumor surgery with cortical and subcortical mapping: a retrospective study on 37 patients. Riviera Medica, 2006, 12, s. 11–14.
5. Rajciová, J., Schroederová, I., Bartošík, T., Hřib, R., Kraus, R. Anestezie umožňující peroperační kontakt s pacientem v neurochirurgii. Anest. neodkl. Péče, 2001, 12, s. 171–172.
6. Frost, E, Booij, L. Anesthesia in the patient for awake craniotomy. Cur. Opin. Anaesth., 2007, 20, s. 331–335.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2008 Issue 5-
All articles in this issue
- The Žalud Days: Dr Pavel Žalud
- General anaesthesia with an awake period for brain surgery
- Difficulties in implementation of the recommendations for the diagnosis and treatment of severe sepsis and septic shock
- Twenty five years of selective digestion decontamination – the questions remain unanswered
- Immunopathogenenis of sepsis
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- General anaesthesia with an awake period for brain surgery
- Difficulties in implementation of the recommendations for the diagnosis and treatment of severe sepsis and septic shock
- Immunopathogenenis of sepsis
- Twenty five years of selective digestion decontamination – the questions remain unanswered
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career