-
Medical journals
- Career
Hemoragicko-traumatický šok po teroristickém útoku – léčba v Polní nemocnici Armády České republiky ROLE II+, Kábul
Authors: Jurenka Božetěch 1; Ryska Miroslav 2; Kalas Ladislav 3; Oberreiter Martin 4
Authors‘ workplace: Anesteziologicko-resuscitační oddělení, Ústřední vojenská nemocnice Praha 1; Chirurgická klinika, 2. LF UK a Ústřední vojenská nemocnice, Praha 2; Radiologické oddělení, Vojenská nemocnice Brno 3; 6. Polní nemocnice Armády České republiky, Kábul 4
Published in: Anest. intenziv. Med., 19, 2008, č. 3, s. 143-148
Category: Anaesthesiology - Case Report
Overview
Pacient (39 let) s těžkým hemoragicko-traumatickým šokem po střelném poranění s levostranným hemothoraxem a pneumothoraxem s masivní krevní ztrátou byl léčen v Polní nemocnici Armády České republiky ROLE II+ po teroristickém útoku v Kábulu. Iniciální SOFA skóre13 bodů bylo po „damage control surgery“ a anesteziologicko-resuscitrační péči sníženo na 5 bodů. Pacient byl 3. pooperační den transportován do Evropy, kde se uzdravil.
Autoři upozorňují, že standardní léčebné postupy mohou být realizovány i v mimořádných podmínkách v Polní nemocnici ROLE II+ v Afgánistánu. Týmová spolupráce a optimální načasování transportu do zdravotnického zařízení vyššího typu jsou nedílnou součástí léčebného postupu v mimořádných podmínkách ve vysoce rizikové oblasti.Klíčová slova:
teroristický útok – hemoragicko-traumatický šok – poranění plic – SOFA skóreÚvod
Mortalita hemoragicko-traumatického šoku v mimořádných podmínkách je stále vysoká. „Damage control surgery“ a adekvátní perioperační anesteziologicko-resuscitační péče může zvýšit šance pacienta na přežití.
Kazuistika
39letý Evropan, s tělesnou hmotností 80 kg, byl přijat do Polní nemocnice Armády České republiky v Kábulu v kritickém stavu po střelném poranění hrudníku vlevo a tváře vpravo, s těžkým hemoragicko-traumatickým šokem po teroristickém útoku v lednu 2008 v Kábulu.
Přijetí do Polní nemocnice
Pacient při přijetí spontánně ventiloval s dechovou frekvencí 35/min, byl hypoxický s Glasgow Coma Scale 8 bodů. Systolický tlak byl 60 mm Hg, diastolický tlak byl neměřitelný, TF 130/min, SpO2 pomocí pulzní oxymetrie byla neměřitelná, axilární tělesná teplota byla 33,3 °C. Byla provedena okamžitě endotracheální intubace a zahájena umělá plicní ventilace Oxylogem Dräger 1000 s FiO2 1,0, dechovým objemem 600 ml , PEEP 5 cm H2O, dechovou frekvencí 12/min. Analgosedace byla vedena titračně midazolamem 10 mg (Dormicum, Roche), fentanylem 0,25 mg–5 ml (Fentanyl, Janssen), myorelaxace pipekuriem 8 mg (Arduan, Gedeon Richter). Neodkladně byl zaveden centrální venózní katétr „high-flow“ cestou pravé jugulární žíly a permanentní močový katétr. Pacient splňující kritéria třídy IV hypovolemického šoku byl polohován do „autotransfuzní“ Trendelenburgovy polohy s aplikací přetlakové volumoterapie 500 ml koloidů (10% HAES 200/0.5, Fresenius Kabi) a krystaloidů 1000 ml (Plasmalyte, Baxter). Perfuzní tlak byl udržován infuzí noradrenalinu v dávce 0,9 μg . kg-1 . min-1. Pacient byl urgentně transportován na operační sál.
Operace a anesteziologická péče
Operační výkon byl zahájen 20 minut po přijetí do polní nemocnice. Bylo prokázáno, že se jedná o střelné poranění levého hemithoraxu s rupturou dolního segmentu plíce s hemothoraxem. Odhad krevní ztráty při zahájením výkonu byl 3000 ml. Dále byla patrna kontuze levé plíce s rozsáhlým defektem hrudní stěny o průměru 8 x 8 cm (obr. 1). Penetrující rána v oblasti pravé čelisti zasahovala pouze měkké tkáně (obr. 2). Byla provedena revize levé dutiny hrudní se suturou poraněného levého dolního plicního laloku s drenáží levé hrudní dutiny. Po testu hermetického uzávěru plíce byla přední hrudní stěna uzavřena (obr. 3). Střelné poranění měkkých tkání oblasti pravé čelisti bylo ošetřeno debridementem a drenáží. Celková peroperační krevní ztráta byla 1200 ml.
Image 1. Defekt hrudní stěny v místě výstřelu 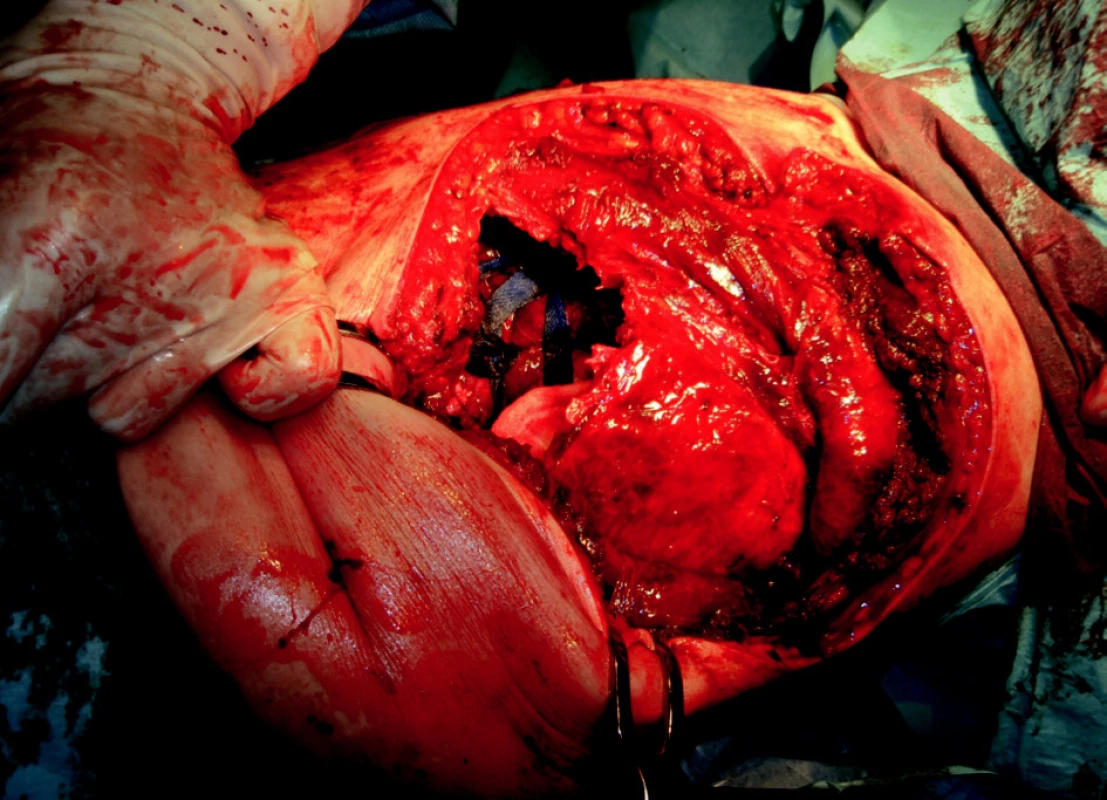
Image 2. Penetrující rána v oblasti pravé čelisti 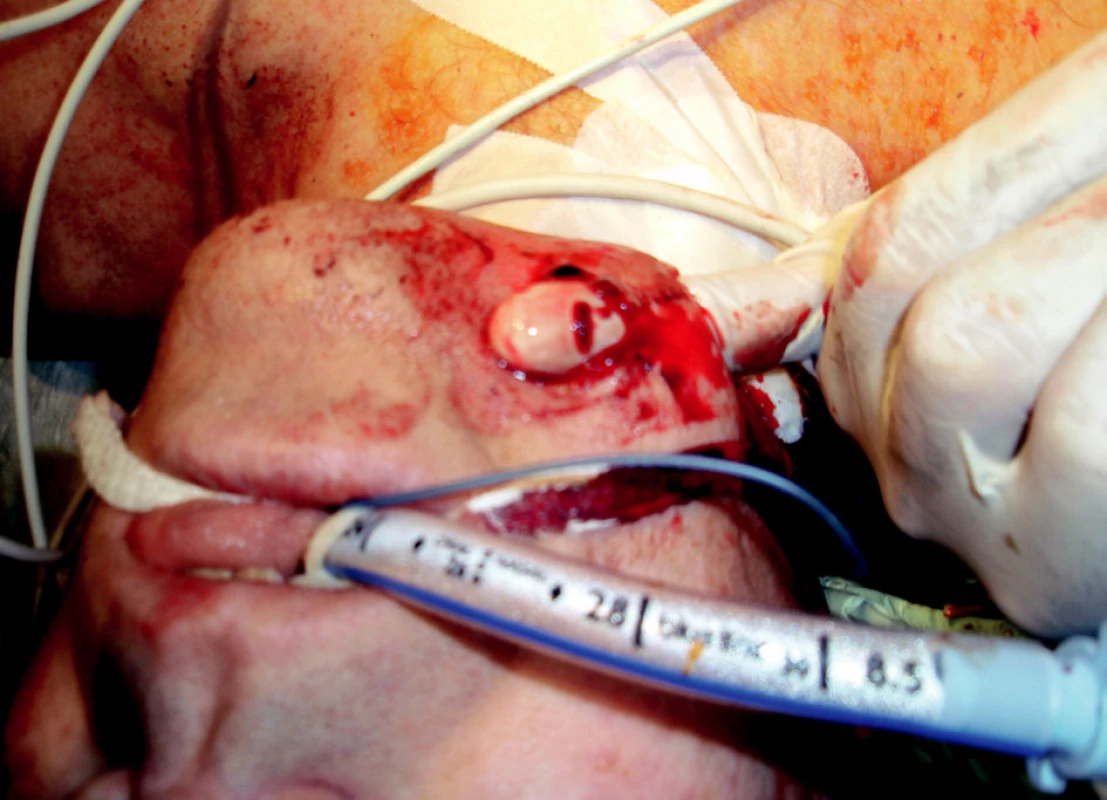
Image 3. Stav po uzavření thorakotomie 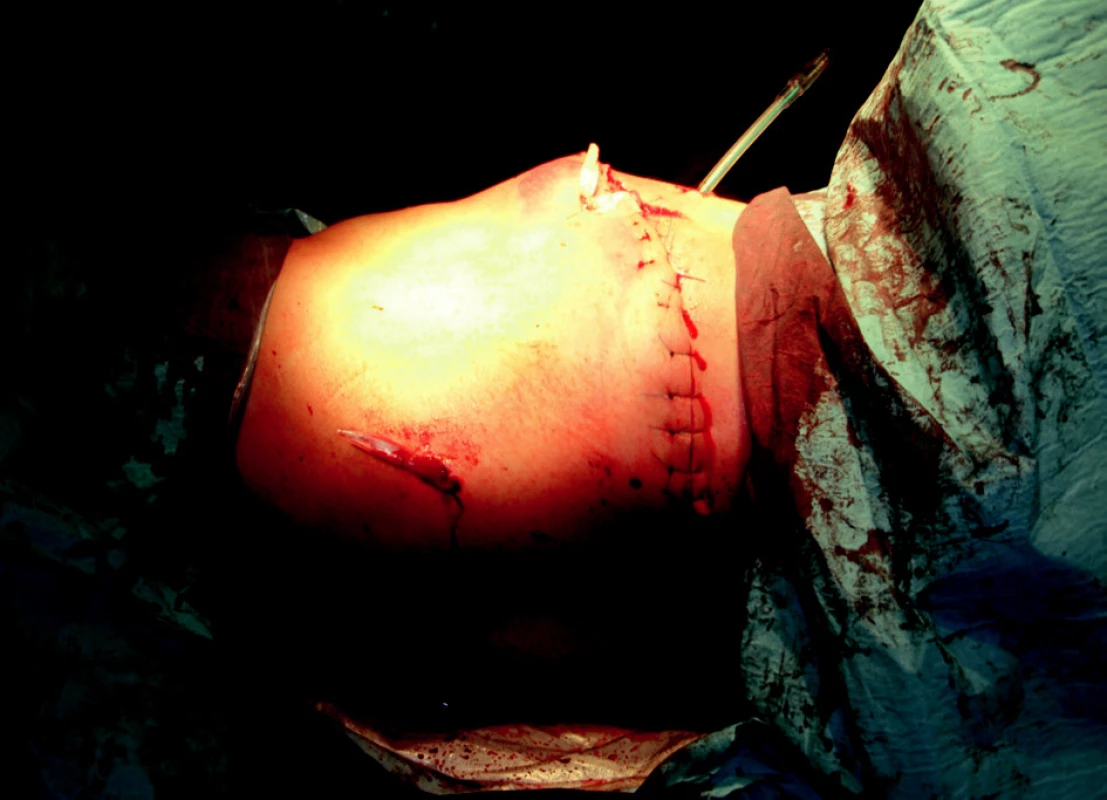
Operace byla vedena v celkové endotracheální anestezii přístrojem Fabius Dräger s objemovou řízenou ventilací s FiO2 1,0, dechovým objemem 600 ml, PEEP 5 cm H2O, dechovou frekvencí 12/min, poměrem I : E rovným 1 : 2. K celkové anestezii bylo podáno celkem: fentanyl 0,5 mg – 10 ml, pipekurium 8 mg, sevoflurane (Abbott) 1,5 %. K chirurgickému ošetření levé plíce byla použita krátkodobá selektivní intubace naslepo pravého hlavního bronchu s ventilací pravé plíce po dobu 7 minut. Bylo pokračováno v objemové resuscitaci s cílovým CVP 6 mm Hg s podáním 2000 ml krystaloidů, 1000 ml koloidů (10% HAES), 4 T.U. erytrocytární stejnoskupinové masy, 4 T.U. čerstvé mražené plasmy. Dávku noradrenalinu bylo možno postupně snižovat až na 0,07 μg . kg-1 . min-1. Na konci operačního výkonu byla zavedena kanyla do levé arteria radialis k invazivnímu měření krevního tlaku. K antibiotické a antitetanické profylaxi byly podány piperacillin 4,0 g s tazobactamem 500 mg i. v. (Tazocin, Wyeth) a Anatoxinum tetanicum purificatum 0,5 ml i. m. (Alteana, Sevapharma). Pacient byl během operace i po ní intenzivně zahříván pomocí ohřívací matrace (Equator warm-touch) a ohřevem podávaných infuzí (teplá vodní lázeň 38 °C + Asthoterm).
Pooperační resuscitační péče
Po operaci byl pacient přeložen na jednotku resuscitační péče, pokračovala analgosedace a umělá plicní ventilace. Příjmové SOFA skóre bylo 13 bodů (tab. 1).
Table 1. SOFA skóre při přijetí na ARO PN 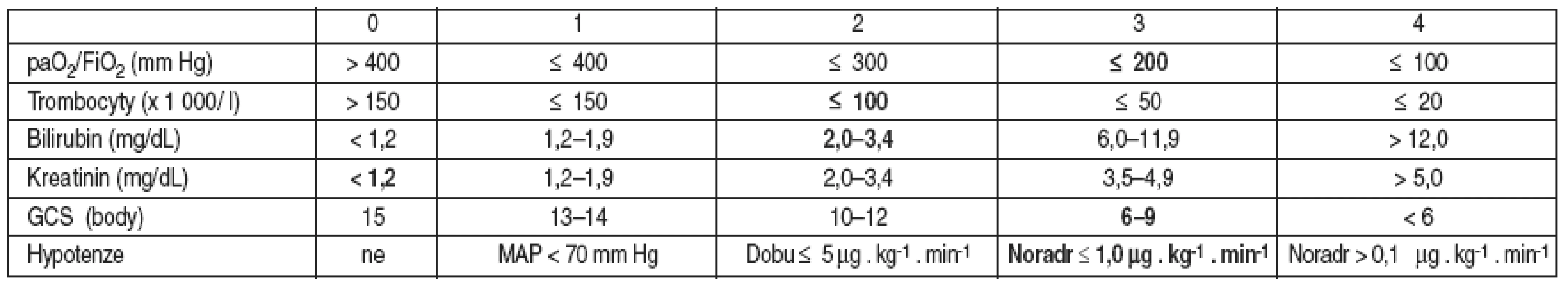
Vysvětlivky: dL – decilitr, Dobu – dobutamin, Noradr – noradrenalin Pacient byl hemodynamicky stabilní s CVP 6 mm Hg s podporou noradrenalinu 0,07–0,05 μg . kg-1 . min-1 se snahou o udržení cílového CVP 6–12 mm Hg pomocí čerstvé mražené plasmy 3 T. U. a 10% HAES. Diuréza byla obnovena nad 1 ml . kg-1 . h-1. Axilární tělesná teplota byla udržována na 37 °C.
Kontrolní předozadní snímek plic vleže bezprostředně po výkonu prokazuje mnohočetné plicní infiltráty s hemothoraxem a pneumothoraxem vlevo s podezřením na plicní laceraci. Vpravo je patrná malá atelektáza s apikálním pneumothoraxem a suspekcí na kontuzi plíce parakardiálně. Je přítomna dislokace centrálních struktur doprava a ztrátové poranění levostranných dolních žeber (obr. 4). Dislokovaná poloha centrálního venózního katétru byla upravena mírným povytažením do oblasti horní duté žíly. Byla provedena časná perkutánní dilatační punkční tracheotomie (Portex č. 8) s pokračující tlakem řízenou umělou plicní ventilací (BiPAP, Savina Dräger) v hluboké analgosedaci na cílové Glasgow Coma Scale 3 body kombinací sufentanil 50 μg . h-1 s midazolamem 5 mg . h-1. Odpad z hrudního drénu byl během prvních dvou dní minimální, avšak z drénu umístěného do oblasti střelného kanálu bylo patrné krvácení 600 ml prvních 9 hodin a 700 ml za 12 hodin po operaci. Bylo podáno 7 T. U. stejnoskupinové erytrocytární masy a NovoSeven (Novo Nordisk, Dánsko) v dávce 200 μg . kg-1, po 4 hodinách bylo podáno 100 μg . kg-1. Cílová normoglykémie 4,1–6,9 mmol . l-1 byla udržována kontinuálním podáváním inzulinu (Insulinum Humanum, Eli Lilly). Bylo pokračováno v antibiotické profylaxi Tazocinem 4,5 g každých 8 hodin i. v.
Image 4. RTG hrudníku bezprostředně po operaci 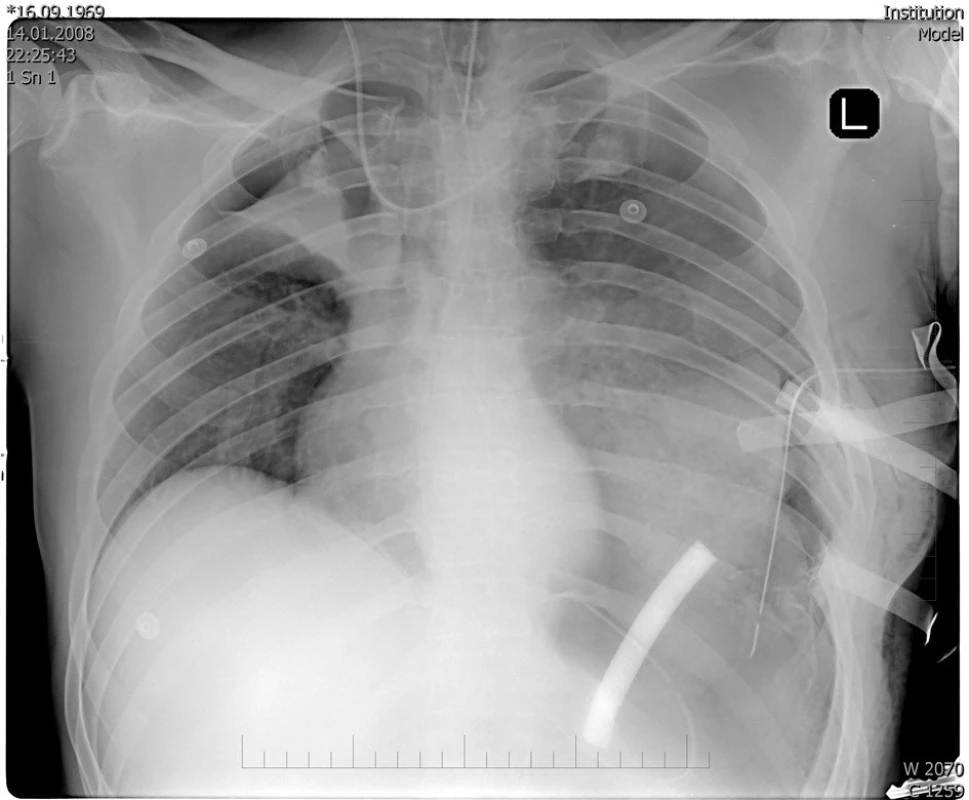
Kontrolní RTG plic provedený druhý a třetí pooperační den prokazuje reaktivní infiltráty parakardiálně vpravo. Centrální struktury jsou již bez dislokace. Na levé straně perzistuje reziduální fluidohemothorax a změny po kontuzi levé plíce. Pneumothorax není přítomen (obr. 5).
Image 5. RTG hrudníku před překladem 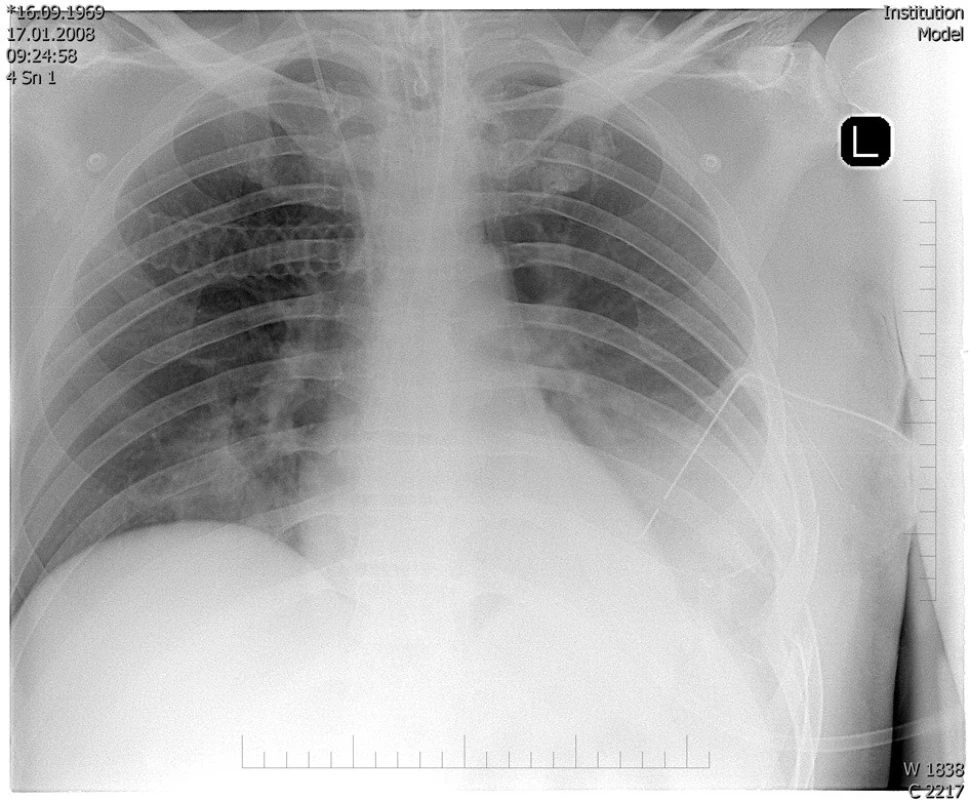
Třetí pooperační den SOFA skóre kleslo na 5 bodů a pacient byl transportován letecky do vlasti do univerzitní nemocnice v podmínkách umělé plicní ventilace s tlakovou podporou, mírně analgosedován, hemodynamicky stabilní, bez farmakologické podpory oběhu a bez známek orgánového selhávání. Na základě kontrolního CT vyšetření plic provedeného ve vlasti byl vytažen druhý den po příletu hrudní drén. Za 3 týdny po poranění byl pacient propuštěn z nemocnice do domácí péče v dobrém stavu.
Diskuse
Přijetí do polní nemocnice, neodkladná péče a predikce mortality
Mortalita hemoragicko-traumatického šoku v polních podmínkách je stále velmi vysoká. V našem případě jsme ke stratifikaci pacienta použili SOFA skóre, které hodnotí funkci šesti velkých orgánových systémů: respiračního, koagulačního, jaterního, renálního, CNS a kardiovaskulárního [1]. SOFA skóre našeho pacienta s 13 body predikuje mortalitu v době přijetí na jednotku resuscitační péče polní nemocnice na 95 %.
Zdravotnický tým Polní nemocnice Armády České republiky prováděl urgentní příjem kriticky nemocných pacientů s těžkými zraněními po tomto teroristickém útoku se zcela nedostatečně poskytnutou zdravotnickou první pomocí v místě útoku a během transportu raněných do polní nemocnice. Systém rychlé zdravotnické služby v Kábulu neexistuje a technické vybavení místních ambulancí k poskytování neodkladné péče na místě a během transportu je suboptimální. SOFA skóre těchto pacientů je tedy při příjmu extrémně vysoké ve srovnání s podmínkami v České republice. V našem případě vysoké SOFA skóre bylo ovlivněno těmito faktory: dlouhým intervalem (80 minut) mezi dobou vzniku poranění a dobu přijetí pacienta s masivním krvácením do polní nemocnice. Tento interval byl ovlivněn velmi nebezpečnou situací v místě konfliktu (záchranáři pod přímou palbou teroristů). Další nepříznivé faktory – hypotermie (venkovní teplota minus 20 °C), neléčená hypovolémie a hypoventilace – byly důkazem nedostatečného poskytnutí první pomoci v mimořádně složité bezpečnostní situaci v místě teroristického útoku.
K nepříznivým faktorům patří dále totální absence rychlé zdravotnické pomoci v Kábulu, dlouhý čas mezi vznikem poranění a zahájením adekvátní neodkladné péče s obtížnou prvotní triage v místě teroristického útoku (neosvětlená hotelová hala), nutnost obrněného odsunového prostředku vybaveného k poskytování neodkladné resuscitační péče při transportu Kábulem do polní nemocnice, absence zkušeného záchranářského týmu s poskytováním neodkladné péče.
Na druhou stranu je třeba konstatovat, že realizace kvalitně poskytované neodkladné péče v místě teroristického útoku je velmi riskantní pro celý tým a vyžaduje velkou osobní statečnost.
Neodkladná péče v naší polní nemocnici před zahájením operačního výkonu trvala 15 minut: intravenózní periferní linka, orotracheální intubace se zahájením umělé plicní ventilace, zavedení centrálního žilního katétru, zahájení volumoresuscitace, zavedení permanentního močového katétru. Thorakotomie byla zahájena za 20 minut po příjezdu pacienta. „Damage control surgery“ s finální suturou levé plíce a zástavou krvácení trvala 20 minut. Byla provedena těsnost sutury levé plíce a uzavření levého hemithoraxu se založením odsavné drenáže.
Třída IV akutního hypovolemického šoku [2] je definována těmito kritérii: náhlou krevní ztrátou nad 2000 ml, velmi nízkým systolickým a neměřitelným diastolickým tlakem, tepovou frekvencí nad 120/min, nedetekovatelným kapilárním návratem, dechovou frekvencí nad 20/min, diurézou 0–10 ml . h-1, opocenými chladnými končetinami, poruchou vědomí.
Operační výkon a vedení anestezie
Jako „damage control surgery“ jsme indikovali laterální levostrannou thorakotomii.
Stanovili jsme tyto léčebné cíle:
- zástavu masivního krvácení z levé plíce a hrudní stěny;
- zajištění dodávky kyslíku úpravou plnicího tlaku s cílovým CVP 6 mm Hg při umělé plicní ventilaci s FiO2 1,0;
- zahájení léčby koagulopatie podáváním čerstvé mražené plasmy s hemoterapií, poměr podání – erytrocytární masa : čerstvá mražená plasma = 1 : 1;
- intenzivní ohřev pacientova těla pomocí systému „warm-touch“ (Equator warm-touch), ohřevem podávaných infuzí a transfuzí v teplé vodní lázni 38 °C a ohřívacím zařízením infuzních setů a ohřevem podávaných infuzí (Asthoterm);
- kontrola systolického krevního tlaku na hodnoty 90–100 mm Hg.
Po obnově perfuzního tlaku jsme podali 20% Manitol jako protekci renálního poškození.
Při zahájení léčby koagulopatie u hemoragického šoku v polní medicíně jsme realizovali nový koncept strategie hemoterapie: poměr krev : plasma = 1 : 1, který může zlepšit outcome pacienta [4].
V době operace jsme zvažovali podání aktivovaného rekombinantního faktoru VII (NovoSeven). Avšak stav pacienta po operaci – hypotermie 34,1 °C, hladina Hb 58 g . l-1, arteriální pH 7,1 a hypokalcémie 1,68 mmol . l-1 – nezaručoval maximální léčebný efekt preparátu [5], proto jsme ho nepodali.
Sutura a ošetření levé plíce proběhlo v podmínkách selektivní intubace. Do pravého hlavního bronchu jsme „naslepo“ zavedli endotracheální rourku s využitím znalostí anatomických poměrů úhlu odstupu pravého hlavního bronchu. Ventilace pravé plíce trvala pouze 7 minut. Bronchofibroskop k verifikaci pozice endotracheální rourky nebyl v polní nemocnici k dispozici.
Pooperační komplikace
Vzhledem k rozsahu traumatu a krevní ztrátě jsme předpokládali rozvoj ARDS, koagulopatie a multiorgánové dysfunkce.
ARDS
ARDS (tab. 2) dominoval v klinickém obraze pooperačního období. Na jeho vzniku se podílelo současně několik faktorů: prolongovaná hypotenze a hypoxémie s následným šokovým stavem, nutnost opakovaného podání krevních transfuzí.
Table 2. Diagnostická kritéria ARDS [6] ![Diagnostická kritéria ARDS [6]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b4fc300d2933dd2e4c2e4dda4dad506d.png)
K rozhodnutí provést časnou perkutánní dilatační tracheotomie (Portex č. 8,0) po příjmu na oddělení resuscitační péče polní nemocnice vedl klinický stav pacienta s nutností agresivní plicní ventilace v nadmořské výšce téměř 2000 m n. m., předpoklad dlouhodobé umělé plicní ventilace s možnou prodlevou leteckého transportu vzhledem k bezpečnostní situaci, nedostupnost flexibilního bronchofibroskopu a předpokládaný rozvoj koagulopatie.
Při ventilaci jsme zvolili strategii „open lung concept“ s protektivní, tlakem řízenou ventilací s terapeutickými cíli: dechový objem 7 ml . kg-1 predikované ideální tělesné hmotnosti, plateau pressure pod 30 cm H2O, arteriální pH 7,3–7,45, paO2 nad 88 mm Hg. Titrace hodnoty PEEP byla prováděna v polních podmínkách podle SaO2 a oběhové odezvy. Použitím PEEP jsme se snažili minimalizovat vznik ventilátorem indukovaného poškození plic (VILI). Recruitment manévry s peak pressure 35 cm H2O a PEEP 15 cm H2O byly prováděny po dvou hodinách s cílem provzdušnit atelektatické okrsky plic s následnou korekcí nastavení peak pressure na cílový dechový objem 7 ml . kg-1. Tato opatření měla za následek zlepšení oxygenačního indexu PaO2/FiO2 ze 150 mm Hg na 236 mm Hg, zlepšení compliance plic. Předpokládali jsme též snížení hladiny cytokinů [12]. Udržovali jsme negativní tekutinovou bilanci.
Koagulopatie
Rozvoj koagulopatie podporovalo prolongované krvácení z rozsáhlého devastujícího poranění svalů, velká krevní ztráta, hypotermie a perioperační hemodiluce. Nejdůležitějším krokem v prevenci dalšího jejího rozvoje a závažnosti byla „damage control surgery“. Podání čerstvé mražené plasmy jako objemové náhrady vedlo k prevenci overloadu krystaloidů, vzniku „capillary leak“ syndromu s únikem tekutiny do třetího prostoru s následným rozvojem tkáňového edému. Výhodná přitom byla i substituce koagulačních faktorů. Transfuze trombocytů není v polní nemocnici ROLE II+ dostupná. Ačkoli je časné podání aktivovaného rekombinantního faktoru VII (NovoSeven) doporučováno co možná nejdříve, jeho maximální efekt se dá předpokládat za těchto podmínek: absence hypotermie a acidózy, extrémní anémie (Hb pod 60 g . l-1) a trombocytopenie (pod 50 tis.). V našem případě jsme podání NovoSeven indikovali až po úpravě výše uvedeného s vynikajícím léčebným efektem (první dávka za 8 hodin po operaci – 200 μg . kg-1 a druhá za 12 hodin po operaci – 100 μg . kg-1).
Během prvních 24 hodin po operaci jsme dodržovali kontrolu systolického krevního tlaku 90–100 mm Hg a tělesné teploty na 37,0–37,5 °C v nazofaryngu.
Multiorgánová dysfunkce
Vzhledem k anamnéze a klinickému stavu pacienta bezprostředně po přijetí na jednotku resuscitační péče byl reálný předpoklad progrese multiorgánové dysfunkce. V časném pooperačním období byla snaha o obnovu orgánové perfuze: cílové CVP 6–12 mm Hg s MAP nad 65 mm Hg, diuréza nad 0,5 ml . kg-1 . h-1, saturace z centrální venózní krve (SvO2) nad 70 %, jako transfuzní trigger jsme užili rozdíl SaO2 – SvO2, při jehož hodnotě nad 50 % jsme podali 1 T.U. stejnoskupinové erytrocytární masy [6]. Glykémii, jejíž striktní kontrola snižuje mortalitu kriticky nemocných pacientů, jsme udržovali v hodnotách 4,1–6,9 mmol . l-1 [8]. V prevenci bakteriální translokace jsme zahájili časnou enterální nutrici (Nutrison Nutricia) první pooperační den. Nemá pouze význam nutriční podpory, ale snižuje pravděpodobnost vzniku infekčních komplikací [9, 10].
Překlad do vyššího zdravotnického zařízení
SOFA skóre mělo třetí pooperační den hodnotu 5 bodů (tab. 3). Pacient nekrvácel, hemodynamicky byl stabilní bez nutnosti farmakologické podpory, bez klinických známek ARDS s normálními renálními funkcemi. Predikující mortalita klesla z příjmových 95 % na 20 % při zlepšených orgánových funkcích. Pacient byl v této době indikován k transportu do vlasti v podmínkách umělé plicní ventilace v režimu CPAP s FiO2 0,5, tlakovou podporou 15 cm H2O a PEEP 5 cm H2O, mírně analgosedován. Naše ošetření bylo definitivní a pacient byl připraven k zahájení weaningu.
Table 3. SOFA skóre v době překladu 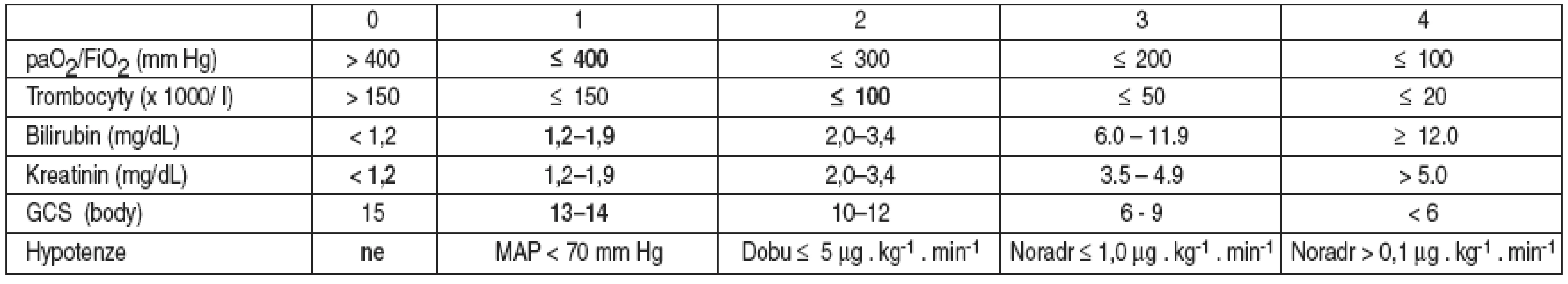
Vysvětlivky: dL – decilitr, Dobu – dobutamin, Noradr – noradrenalin Rozsah léčebné péče polní nemocnice úrovně ROLE II+ předpokládá provést neodkladnou „damage control surgery” s adekvátní perioperační anesteziologicko-resuscitační péčí s cílem stabilizovat vitální funkce pacienta a připravit ho k časnému bezpečnému transportu na vyšší zdravotnickou etapu [3].
Závěr
Polní nemocnice Armády České republiky ROLE II+ umožňuje provést „damage control surgery”, perioperačně stabilizovat pacienta s těžkým hemoragicko-traumatickým šokem a zajistit pooperační anesteziologicko-resuscitační péči.
Uplatnění zásad „damage control surgery”, nový koncept hemoterapie a „open lung concept” v pooperační péči mohou významnou měrou zlepšit nepříznivá vstupní kritéria pacienta v kritickém stavu. Důležitou součástí léčby pacienta ve vysoce rizikových oblastech je spolupráce s místní správou, zastupitelskými civilními i vojenskými složkami při organizaci první pomoci a transportu do zdravotnických zařízení vyššího typu. Podle našich zkušeností z Afgánistánu je tato spolupráce velmi obtížná.
Došlo 27. 3. 2008.
Přijato 1. 4. 2008.
Adresa pro korespondenci:
Prim. MUDr. Božetěch Jurenka
Branická 1319/86
147 00 Praha 4
e-mail: Bozetech.jurenka@uvn.cz
Sources
1. Ferreira, F. L. et al. Serial evaluation of the SOFA score to predict outcome in critically ill patients. JAMA, 2001, 286, p. 1754–1758.
2. Allman, K. G., Wilson, I. H. Oxford handbook of anaesthesia. Oxford University Press : Oxford 2007.
3. American College of Surgeons, Committee on Trauma. Advanced Trauma Life Support for Doctors. 6th Impression 2003.
4. Holcomb, J. B., Jenkins, D., Rhee, P. et al Damage control resuscitation: directly addressing the early coagulopathy of trauma. J. Trauma, 2007, 62, p. 307–310.
5. Spahn, D. R., Cerny, V., Coarts, T. J. et al. Management of bleeding following major trauma. European guideline. Crit. Care, 2007, 11, p. R17.
6. ARDS clinical network, dostupné na: www.ardsnet.org.
7. Marino, P. L. The ICU book. Third edition. Lippincott Williams & Wilkins, 2007.
8. Van der Berghe, G., Wouters, P., Weekers, F. et al. Intensive insulin therapy in critically ill patients. NEJM, 2001, 345, p. 1359–1367.
9. De-Souza, D. A., Greene, L. J. Intestinal permeability and systemic infections in critically ill patients: effect of glutamine. Crit. Care Med., 2005, 33, p. 1125–1135.
10. Bistrian, B. R., McCowen, K. C. Nutritional and metabolic support in the adult intensive care unit: key contraversies. Crit. Care Med., 2006, 34, p. 1525–1531.
11. Baert, A. L., Gourtsoyiannis, N. Emergency Radiology. Reprints from European Radiology, 2003, 12, p. 101–122.
12. Gattinoni, L., Cairon, M., Cressoni, M. et al. Lung recruitment in patients with acute respiratory distress syndrome. NEJM, 2006, 354, p. 1775–1786.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2008 Issue 3-
All articles in this issue
- Selektivní intubace dětí tracheální rourkou UniventR
- Distraction osteogenesis in the head and neck region
- Hemoragicko-traumatický šok po teroristickém útoku – léčba v Polní nemocnici Armády České republiky ROLE II+, Kábul
- Možnosti prevence nozokomiální pneumonie ventilovaných nemocných – aktuální stav
- Možnosti antikoagulačního zajištění metod mimotělní náhrady funkce ledvin u kriticky nemocných
- O výzkumné činnosti v oboru anesteziologie a resuscitace v druhé polovině dvacátého století
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hemoragicko-traumatický šok po teroristickém útoku – léčba v Polní nemocnici Armády České republiky ROLE II+, Kábul
- Selektivní intubace dětí tracheální rourkou UniventR
- Možnosti prevence nozokomiální pneumonie ventilovaných nemocných – aktuální stav
- O výzkumné činnosti v oboru anesteziologie a resuscitace v druhé polovině dvacátého století
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

