-
Medical journals
- Career
Možnosti prevence nozokomiální pneumonie ventilovaných nemocných – aktuální stav
: Stoszek Dalibor 1; Dostál Pavel 2; Vlková Andrea 2
: Neurochirurgická klinika, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové Fakultní nemocnice Hradec Králové 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové 2
: Anest. intenziv. Med., 19, 2008, č. 3, s. 149-153
: Intesive Care Medicine - Review Article
Pneumonie ventilovaných nemocných (ventilator-associated pneumonia, VAP) je nejčastější nozokomiální infekce u pacientů vyžadujících umělou plicní ventilaci (UPV). VAP je hlavní příčinou morbidity a mortality ventilovaných pacientů a je spojena s delším pobytem na JIP a v nemocnici, větší délkou UPV a zvýšenými náklady. Cílem článku je poskytnout systematický náhled na možnosti prevence VAP v souladu s medicínou založenou na důkazech, se zaměřením na poznatky publikované po roce 2006.
Klíčová slova:
pneumonie ventilovaných nemocných – VAP – prevence VAP1 Úvod
Nozokomiální pneumonie ventilovaných nemocných (ventilator–associated pneumonia, VAP) je aktuálním problémem i přes stále se zdokonalující metody diagnostiky, terapie a v neposlední řadě i prevence této komplikace.
VAP je definována jako nozokomiální pneumonie vzniklá nebo zjištěná v průběhu umělé plicní ventilace (UPV), podle časového kritéria (American Thoracic Society) jako pneumonie vzniklá za více než 48 až 72 hodin od tracheální intubace a zahájení UPV [3]. Exaktní určení incidence VAP je obtížné z několika důvodů. Jedním z nejvýznamnějších je absence jednotných diagnostických kritérií, což vede k velké variabilitě uváděné incidence v závislosti na definici a sledované populaci [4]. Američtí autoři uvádějí incidenci VAP mezi 9–27 % všech intubovaných pacientů [3]. Ventilátorová pneumonie je závislá na délce UPV. Nejvyšší riziko vzniku ventilátorové pneumonie je v prvních 5 dnech ventilace (3 % za den), během 5.–10. dne UPV je 2 % za den a v dalších dnech UPV stoupá o 1 % denně [21].
Doba vzniku pneumonie je významná z epidemiologického a prognostického hlediska. Časná VAP (vzniklá do 4. dne včetně od intubace a zahájení UPV) bývá způsobena patogeny citlivými na antibiotika (Streptococcus pneumoniae, Moraxella catarhalis, Hemophilus influenzae...). Jedná se často o patogeny přítomné v dýchacích cestách již v době intubace; vzniku časné VAP nepředchází kolonizace žaludku a bariérová opatření tedy bývají málo účinná [3, 12]. VAP pozdní (vzniklá od 5. dne včetně od zahájení UPV) bývá naopak častěji způsobena multirezistentními patogeny (Pseudomonas aeruginosa, Acinetobacter spp., Klebsiella pneumoniae, methicillin-rezistentní Staphylococcus aureus, Stenotrophomonas maltophilia) a je spojena s vyšší morbiditou a mortalitou.
Článek je zaměřen na prevenci vzniku VAP a jeho cílem je seznámit čtenáře s aktuálními znalostmi prevence vzniku VAP a s novými poznatky publikovanými v letech 2006–2007. K vyhledávání těchto publikací jsme pracovali s databází MEDLINE, jako vyhledávací kritérium jsme použili tyto dva pojmy: „prevention“ a „ventilator-associated pneumonia“. Výběr byl vymezen datem publikování od ledna 2006 do prosince 2007. Výsledkem hledání bylo 198 článků.
Opatření zaměřená na prevenci vzniku VAP lze rozdělit do několika skupin (tab. 1).
1. Preventivní opatření dostupná na JIP 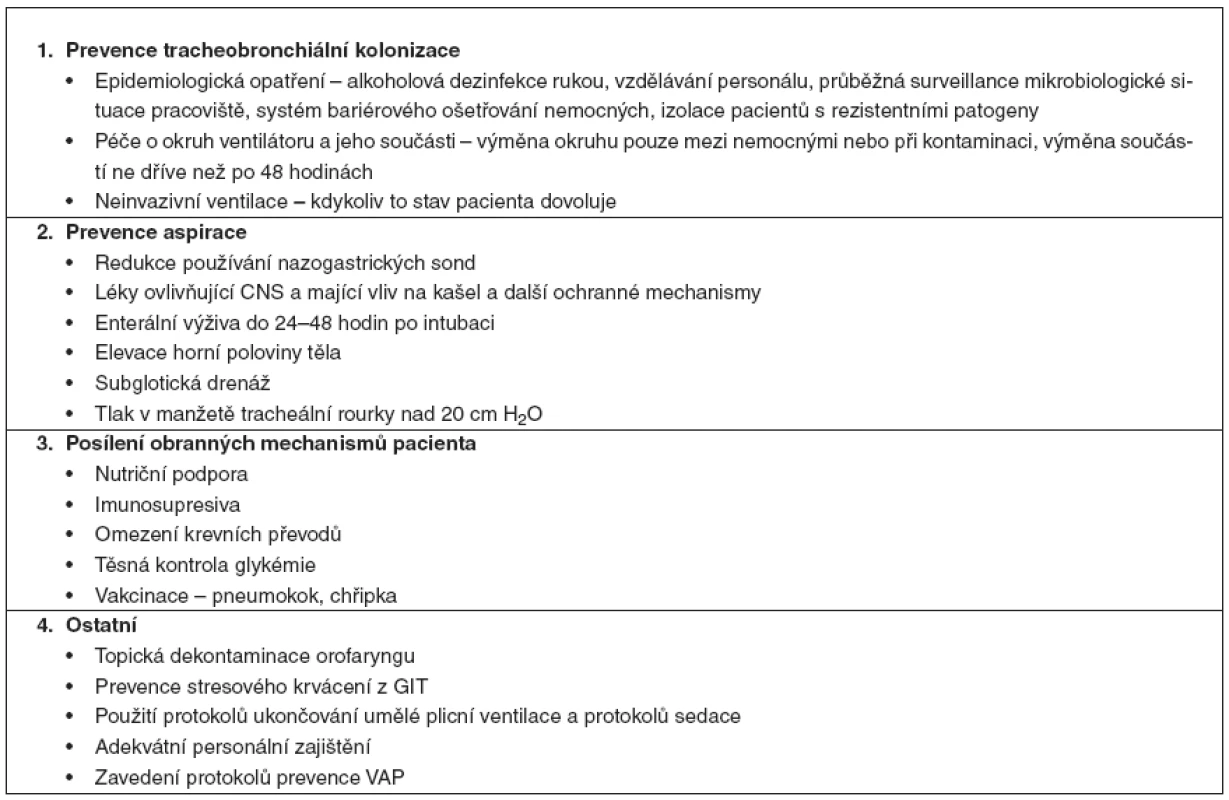
2 Prevence tracheobronchiální kolonizace
2. 1 Epidemiologická opatření
Na každém pracovišti, kde je prováděna umělá plicní ventilace, musí být zaveden účinný systém protiepidemických opatření zahrnující alkoholovou dezinfekci rukou, důkladnou dezinfekci zařízení pro nebulizaci, funkční systém bariérového ošetřování nemocných s cílem omezit riziko zkřížené kolonizace a infekce nemocných, izolace nemocných s multirezistentními nozokomiálními kmeny, průběžná surveillance mikrobiologické situace pracoviště [2, 12].
2. 2 Péče o okruh ventilátoru a jeho součásti
Výměna okruhu ventilátoru se doporučuje provádět jen se změnou ventilovaného pacienta nebo pokud došlo k jeho kontaminaci [1, 2, 13]. Důkladnou dezinfekci zařízení k nebulizaci je potřeba provádět po každém použití. Kontaminovaný kondenzát z okruhu ventilátoru by měl být odstraňován opatrně a mělo by být zabráněno vniknutí kondenzátu do endotracheální rourky nebo nebulizátorů napojených na okruh [3]. Pasivní výměníky tepla a vlhkosti snižují kolonizaci okruhu ventilátoru, nicméně nesnižují incidenci VAP, a proto nejsou doporučovány jako prevence VAP [3].
V současné době nejsou důkazy preferující uzavřený odsávací systém před systémem otevřeným [2]. Efektivitou, vlivem na prognózu pacienta, bakteriální kontaminací a náklady spojenými s odsávacími systémy se zabývala metaanalýza 15 randomizovaných kontrolovaných studií na 1334 pacientech, která srovnávala otevřené a uzavřené odsávací systémy [15]. Nebyl zjištěn signifikantní rozdíl v incidenci VAP (8 studií, 1272 pacientů), ani v mortalitě (4 studie, 1062 pacientů). Endotracheální odsávání uzavřeným systémem mělo signifikantně nižší vliv na tepovou frekvenci a změny středního arteriálního tlaku. Uzavřený systém se jevil jako nákladnější než systém otevřený. Vliv na redukci vzniku VAP používáním jednoho ze systémů nebyl potvrzen ani v metaanalýze studií publikovaných po roce 2004 [4].
2. 3 Intubace, neinvazivní ventilace
Intubace a reintubace zvyšují riziko VAP [3]. Pokud musí být intubace provedena, je preferována orotracheální před nazotracheální [1]. Neinvazivní ventilace místo konvenční mechanické ventilace vede u pacientů s akutním respiračním selháním v důsledku CHOPN nebo akutního kardiogenního plicního edému k signifikantně nižšímu riziku nozokomiální pneumonie, menší spotřebě antibiotik, kratšímu pobytu na JIP a nižší mortalitě [13].
3 Prevence aspirace
3. 1 Výživa
Časná enterální výživa (do 24–48 hodin po intubaci) se doporučuje, přestože je považována za rizikový faktor, hlavně pro riziko aspirace žaludečního obsahu [13, 25, 26]. Podle studie zabývající se redukcí rizika aspirace se tato komplikace vyskytuje až u 50–70 % pacientů vyžadujících umělou plicní ventilaci (jako detekce aspirace byla sledována hladina glukózy ve sputu) [24].
Enterální výživa je preferována před parenterální z důvodu nižšího rizika komplikací spojených s centrálním žilním katétrem a zároveň jako prevence atrofie střevní sliznice, která zvyšuje riziko bakteriální translokace [3].
Zdá se, že postpylorické umístění enterální sondy ve srovnání s gastrickým umístěním je spojeno s redukcí nozokomiální pneumonie. Při gastrickém i postpylorickém způsobu podávání enterální výživy se doporučuje sledování objemu gastrického rezidua postupem upraveným standardem příslušného pracoviště [1, 25].
Nazogastrická sonda je spojena se zvýšeným rizikem nozokomiální sinusitidy [1]. Zrušení enterální sondy je žádoucí ihned, jakmile to stav pacienta dovolí [1].
3. 2 Poloha pacienta
Pacient má být uložen se zvýšenou horní polovinou těla (v úhlu 30–45°). Zvýšená poloha horní poloviny těla by měla být udržována i v průběhu úkonů ošetřovatelské péče včetně polohování nemocného do polohy na bocích [1, 2, 12].
3. 3 Subglotická drenáž
Intermitentní subglotická drenáž je jednou z cest vedoucích ke snížení množství orofaryngeálního sekretu zatékajícího do dolních dýchacích cest. Ve studii, zaměřené na srovnání konvenčních endotracheálních kanyl s polyvinylovou manžetou (tloušťka ≥ 50 mikronů) bez subglotické drenáže a kanyl s polyuretanovou manžetou (tloušťka 7 mikronů) se subglotickým drenážním systémem (ETT-PUC-SSD – endotracheal tube, polyurethane cuff, subglotic secretion drainage), bylo celkem 280 pacientů rozděleno do dvou skupin podle typu kanyly. Ve skupině se standardní kanylou byl výskyt VAP 22,1 % (31 ze 140 pacientů), ve skupině s ETT-PUC-SSD pouze 7,9 % (11 ze 140 pacientů, p = 0,001). Regresní analýzou dat došli autoři k závěru, že použití konvenční kanyly se jeví jako rizikový faktor VAP celkově: Hazard Ratio (HR) = 3,3, 95% confidence interval (CI) = 1,66–6,67, p = 0,001; časné VAP: HR = 3,3, 95% CI = 1,19–9,09, p = 0,02; pozdní VAP: HR = 3,5, 95% CI = 1,34–9,01, p = 0,01. Mortalita však vyšla podobná jak u skupiny s drenáží, tak u kontrolní skupiny [5].
Před deflací manžety u plánované extubace je nutno řádně odsát sekrety přítomné nad manžetou [1].
3. 4 Tlak v manžetě tracheální rourky
Tlak v manžetě tracheální rourky nebo tracheostomické kanyly by měl být v pravidelných intervalech měřen a dokumentován a jeho hodnota by měla být udržována nad úrovní 20 cm H2O [1]. Správný tlak v manžetě je lépe kontrolován automatickým zařízením na kontrolu tlaku než rutinní kontrolou personálem [16]. Jak dále zjistila studie provedená na 142 pacientech se zvýšenou horní polovinou těla, lepší kontrola tlaku v obturační manžetě tracheální rourky neměla ke zvýšené poloze pacienta přídatný vliv na další sledované parametry (výskyt VAP, poměr časné a pozdní VAP, druh mikroorganismů způsobujících VAP, mortalitu na JIP a nemocniční mortalitu) [17].
4 Posílení pacientových obranných mechanismů
4. 1 Nutrice
Adekvátní nutrice kriticky nemocného pacienta je spojena se signifikantní redukcí morbidity, mortality, množství podaných antibiotik a délky pobytu na JIP [13, 26].
Enterální forma podání výživy je preferována před parenterální [13, 26].
4. 2 Krevní převody
Expozice alogenním krevním přípravkům je považována za rizikový faktor pooperační infekce a pooperační pneumonie. Nedeleukotizované erytrocytární přípravky mají pravděpodobně imunosupresivní účinky. Používání deleukotizovaných transfuzí vede k redukci pooperačních infekcí, zvláště redukuje incidenci pooperační pneumonie u pacientů po kolorektálních operacích [13].
5 Ostatní opatření
5. 1 Modulace orofaryngeální kolonizace
Topická aplikace chlorhexidinu nebo povidon-jodidu se pravděpodobně objeví v nových doporučených postupech v prevenci VAP. Napovídá to metaanalýza studií na téma prevence VAP publikovaných po roce 2004 [4]. Cílem bylo zjistit, zda by závěry těchto prací přinesly významné změny do stále platných guidelines pro prevenci VAP [1]. Analýze bylo podrobeno 15 randomizovaných studií a 7 metaanalýz nebo přehledných článků z období od ledna 2004 do ledna 2007. Významná je rovněž metaanalýza celkem 7 randomizovaných studií zaměřených na použití topického chlorhexidinu z roku 2007 [7]. Topický chlorhexidin se v prevenci VAP jeví jako prospěšný [7, 20]. Nejvíce z něj profitovali pacienti po kardiochirurgických operacích. Zároveň však autoři doporučují provést rozsáhlou randomizovanou studii zaměřenou na vztah chlorhexidinu k mortalitě, neboť tento vztah není dosud jasně vyjádřen. Jiná metaanalýza porovnávala výsledky 11 studií provedených celkem na 3242 pacientech [8]. Analýza 1. části (4 studie, 1098 pacientů), zaměřená na dekontaminaci dutiny ústní antibiotiky, neprokázala statisticky významnou redukci incidence VAP (RR 0,69, 0,41–1,18; p = 0,18; I2= 59,4 %). Analýza zbylých 7 studií (2144 pacientů) testujících dekontaminaci antiseptiky prokázala signifikantní redukci VAP (RR 0,56, 0,39–0,81; p = 0,002; I2= 48,2 %). Lokální aplikace antiseptik ani antibiotik nevedla k redukci mortality, délky umělé plicní ventilace ani délky pobytu na JIP. Optimální frekvence a způsob provedení orofaryngeální dekontaminace nejsou dosud určeny. Například v guidelines pro traumatizované pacienty z roku 2006 se doporučuje vypláchnutí dutiny ústní 0,12 % roztokem chlorhexidinu alespoň 2krát denně [3, 10]. Účinnou alternativou chlorhexidinu může být povidon-jodid, jaknaznačuje studie provedená na souboru 110 pacientů s kraniotraumatem a umělou plicní ventilací delší než 48 hodin [11]. Testované skupině byl vyplachován nazofarynx a orofarynx 20 ml 10% roztoku povidon-jodidu následované aspirací sekretů. Ve srovnání s kontrolní skupinou bylo užívání povidon-jodidu spojeno se signifikantní redukcí VAP, ovšem bez vlivu na mortalitu na JIP, délku pobytu na JIP a délku mechanické ventilace. Jiná studie se zabývala in vitro antibakteriální účinností 3 produktů používaných k orofaryngeální hygieně – 0,2% chlorhexidin glukonátu, peroxidu vodíku a komerčního přípravku obsahujícího glukózooxidázu, laktoperoxidázu, lysozym a laktoferin [9]. Chlorhexidin i peroxid vodíku vykazovali větší in vitro účinnost na izolované patogeny než posledně jmenovaný komerční přípravek.
Dentální plak může být významným rezervoárem respiračních patogenů u kriticky nemocných pacientů [14]. Plak má totiž vlastnosti „biofilmu“, proto může způsobovat nižší citlivost bakterií na lokální farmaka. Předpokládá se zvýšení účinnosti topických dezinficencií mechanickým odstraněním dentálního plaku, ale ověření této teorie musí přinést až studie zaměřená na možnost posílení efektu chlorhexidinu mechanickým odstraněním plaku.
5. 2 Profylaxe stresového krvácení
H2-antagonisté a antacida jsou považovány za nezávislé rizikové faktory VAP [22]. Sukralfát je v prevenci gastrického krvácení využíván jako látka, která nesnižuje gastrickou aciditu. Řada randomizovaných studií užívajících různé dávky léku a skupiny pacientů, poskytla kontroverzní výsledky vzhledem ke vztahu mezi profylaxí stresového krvácení a výskytem VAP. Velká randomizovaná studie na 244 pacientech nezjistila signifikantní rozdíl mezi antacidy, ranitidinem a sukralfátem ve vztahu k časné VAP, avšak ve skupině sukralfátu byl shledán signifikantně nižší výskyt pozdní VAP, ovšem bez vlivu na mortalitu [23]. V jiné, dvojitě slepé randomizované studii na 1200 pacientech srovnávající sukralfát (1 g každých 6 hodin nazogastrickou sondou) a ranitidin (50 mg intravenózně každých 8 hodin) bylo zjištěno signifikantně nižší riziko gastrointestinálního krvácení ve skupině s ranitidinem (1,7 % vs 3,8 %, relative risk (RR), 0,44, 95% confidence interval (CI), 0,21–0,92; p = 0,02), nicméně bez vlivu na výskyt VAP (19,1 % VAP ve skupině s ranitidinem, 16,2 % ve skupině se sukralfátem (RR 1,18; 95% CI, 0,92–1,51; p = 0,19), délku pobytu na JIP (medián 9 dnů v obou skupinách) a mortalitu (23,5 % ve skupině s ranitidinem a 22, 8 % ve skupině sukralfátu) [22]. V současné době je akceptovatelná jak prevence H2-antagonisty, tak sukralfátem. Acidifikace gastrické výživy není doporučována [1].
5. 3 Probiotika
Aplikace probiotik je dalším z dlouhodobě diskutovaných témat. Z rozsáhlé recenze článků od roku 1996 do roku 2006 zabývající se klinickou aplikací probiotik, mimo jiné právě i v prevenci nozokomiálních pneumonií vyplývá, že v současné době nejsou klinické důkazy o snížení incidence nozokomiálních pneumonií včetně VAP používáním probiotik [6].
5. 4 Personální zajištění
Adekvátní personální zajištění vede ke zvýšení účinnosti protiinfekčních a protiepidemických opatření a ke snížení délky umělé plicní ventilace [3, 12]. Nižší počet zdravotnického personálu na oddělení (understaffing) může být rizikovým faktorem vzniku nozokomiálních infekcí včetně VAP. Potvrzuje to i prospektivní kohortová studie studující poměr sestra/pacient, jejíž autoři došli k závěru, že vyšší počet sester vede k signifikantnímu snížení rizika nozokomiální infekce (katétrové infekce, ventilátorové pneumonie a infekce ze zavedených permanentních močových katétrů) [16]. Rovněž úroveň znalostí preventivních opatření může sehrát významnou roli v redukci rizika vzniku VAP. Studie provedená na vzorku 638 sester pracujících v Belgii na lůžkách intenzivní péče se zabývala mírou znalostí preventivních opatření VAP [18]. Úroveň znalostí doporučených postupů byla nedostatečná. Elevace trupu byla označena za doporučenou v 90 %, na druhé straně orotracheální způsob intubace označilo za preferovaný pouze 19 % respondentů. Míra znalostí pozitivně korelovala s dosaženým vzděláním a délkou praxe.
5. 5 Implementace multimodálních programů prevence VAP
Preventivní programy založené na evidence-based medicine mohou snížit incidenci VAP, jak ukazuje práce porovnávající skupinu 349 pacientů léčených podle protokolu se skupinou 360 pacientů léčených před jeho implementací [19]. Pacienti léčeni podle preventivního protokolu měli signifikantně nižší výskyt jak časné (redukce z 31,0 na 18,5 VAP/1000 ventilovaných dnů, p < 0,001), tak i pozdní VAP. Podle metaanalýzy studií publikovaných po roce 2004 vedla aplikace multimodálních programů k redukci incidence VAP o 31–57 % [4].
5. 6 Profylaktické podávání systémových antibiotik
Profylaktické podávání antibiotik po urgentní intubaci a zahájení umělé plicní ventilace není pro rutinní podávání doporučováno [1]. Může být zváženo u pacientů s těžkým kranicerebrálním poraněním nebo iktem vyžadujícím urgentní intubaci a umělou plicní ventilaci [24]. Toto doporučení se opírá o práci, která ukázala, že podání dvou dávek 1,5 g cefuroximu po intubaci má profylaktický efekt na vznik VAP a snižuje délu pobytu na JIP a délku hospitalizace v nemocnici. Vliv na mortalitu však prokázán nebyl [24].
5. 7 Těsná kontrola glykémie
U kriticky nemocných pacientů je doporučován intenzivní inzulinový režim s cílem udržet glykémii v rozmezí 4,4–6,1 mmol . l-1 jako metoda redukující nozokomiální infekční komplikace, délku trvání umělé plicní ventilace, délku pobytu na JIP, morbiditu a mortalitu [27]. Rutinní zavádění tohoto doporučení pro všechny kriticky nemocné pacienty je v poslední době zpochybňováno, se zdůrazněním nutnosti provedení dalších studií [28].
6 Závěr
Provedené studie dokazují, že výskyt VAP lze významně ovlivnit použitím mnoha preventivních opatření. Jedná se často o opatření jednoduchá a největší účinnost je pozorována po zavedení multimodálních preventivních programů.
Došlo 25. 3. 2008.
Přijato 31. 3. 2008.
Adresa pro korespondenci:
MUDr. Dalibor Stoszek
Neurochirurgická klinika FN
Sokolská 581
500 05 Hradec Králové
e-mail: d.stoszek@seznam.cz
Sources
1. Tablan, O., Anderson, L., Besser, R. et al. Guidelines for preventing health-care-associated pneumonia, 2003. Recommendations of CDC and the Healthcare Infection Control Practises Advisory Committee. MMWR Recomm. Rep., 2004, 53, (RR-3), p. 1–36.
2. Iregui, M., Kollef, M. et al. Prevention of Ventilator – Associated Pneumonia. Chest, 2002, 121, p. 679–681.
3. Niederman, M. S., Craven, S. E. et al. American Thoracic Society documents. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and health care associated pneumonia. Am. J. Resp. Crit. Care Med., 2005,171, p. 388–416. Dostupné na www:
http//www.thoracic.org/adobe/statements/guide1–29.pdf.
4. Gastmeier, P., Geffers, C. Prevention of ventilator-associated pneumonia: analysis of studies published since 2004. Journal of Hospital Infection, 2007. Dostupné na WWW: www.elsevierhealth.com/journals/jhin.
5. Lorente, L., Lecuona, M., Alejandro, J. et al. Influence of an Endotracheal Tube with Polyurethane Cuff and Subglottic Drainage on Pnemonia. Am. J. Respir. Crit. Care Med., 2007, Sep. 13.
6. Isakow, W., Morrow, L., Kollef, M. Probiotics for Preventing and Treating Nosocomial Infections, Review of Current Evidence and Recommendations. Chest, 2007, 132, p. 286 to 294.
7. Chlebicki, M. P., Safdar, N. Topical chlorhexidine for prevention of ventilator-associated pneumonia: a metaanalysis, Crit. Care Med., 2007, 35, 2, p. 668–669.
8. Chan, E. Y., Ruest, A., Meade, M., Cook, D. Oral decontamination for prevention of pneumonia in mechanically ventilated adults: systematic review and meta-analysis. BMJ, 2007, 334, p. 889.
9. Senol, G., Kirakli, C. et al. In vitro antibacterial activities of oral care products against ventilator-associated pneumonia pathogens. Am. J. Infect. Control., 2007, 35, 8, p. 531–535.
10. Minei, J., Nathens, A., West, M., Harbrecht, B. et al. II. Guidelines for Prevention, Diagnosis and Treatment of Ventilator-Associated Pneumonia (VAP) in the Trauma Pacient. J. Trauma, 2006, 60, p. 1106–1113.
11. Seguin, P., Tanguy, M. et al. Effect of oropharyngeal decontamination by povidone-iodine on ventilator-associated pneumonia in patients with head trauma. Crit. Care Med., 2006, 34, p. 1514–1519.
12. Dostál, P. et al. Základy umělé plicní ventilace. 2. rozšířené vydání, Praha: Maxdorf Jessenius 2005, s. 258–266.
13. Irwin, R. S., Rippe, J. M. Irwin and Rippe’s Intensive Care Mediciine, 6th edition, Lippincott Williams&Wilkins 2008, p. 822–847.
14. Kishimoto, H., Urade, M. Mechanical Tooth Cleaning before Chlorhexidine Application. Am. J. Respir. Crit. Care Med., 2007.
15. Jondergen, I., Rovers, M. et al. Open and closed endotracheal suction systems in mechanically ventilated intensive care patients: a systematic review and meta-analysis. Crit. Care Med., 2007, 35, p. 260–270.
16. Valencia, M., Ferrer, M., Farre, R., Navajas, D., Badia, J. R., Nicolas, J. M., Torres, A. Automatic control of tracheal tube cuff pressure in ventilated patients in semicurbent position: a randomized trial. Crit. Care Med., 2007, 35, 6, p. 1543–1549.
17. Hugonnet, S., Chevrolet, J.-C. The effect of workload on infection risk in critically ill patients. Crit. Care Med., 2007, 35, p. 76–81.
18. Blot, S., Labeau, S. et al. Evidence-based guidelines for the prevention of ventilator-associated pneumonia: results of a knowledge test among intensive care nurses. Intensive Care Med, 2007, 33, p. 1463–1467.
19. Omrane, R., Eid, J., Perreault, M. M. et al. Impact of a protocol for prevention of ventilator-associated pneumonia. Ann. Pharmacother., 2007, 41, 9, p. 1390–1396. (Roub. 2007 Aug 14)
20. Koeman, M., van der Ven, A., Hak, E. et al. Oral decontamination with chlorhexidine reduces incidence of ventilátor ssociated pneumonia. Am. J. Respir. Crit. Care Med., 2006, 173, p. 1348–1355.
21. Cook, D. J., Walter, S. D., Cook, R. J. Incidence of and risk factors for ventilator-associated pneumonia in critically ill patients. Ann. Intern. Med., 1998, 129, 6, p. 433.
22. Cook, D., Guyatt, G., Marshall, J. et al. A Comparison of Sucralfate and Ranitidine fot the Prevention of Upper Gastrointestinal Bleeding in Patients Requiring Mechanical Ventilation. NEJM, 1998, 338, p. 791–797.
23. Prod’hom, G., Leuenberger, P., Koerfer, J. et al. Nosocomial Pneumonia in Mechanically Ventilated Patients Receiving Antacid, Ranitidine, or Sucralfate as Prophylaxis for Stress Ulcer. A randomized controlled trial. Ann. Intern. Med., 1994, 120, p. 653–662.
24. Sirvent, J. M., Torres, A. et al. Protective effect of intravenously administered cefuroxime against nosocomial pneumonia in pacients with structural coma. Am. J. Respir. Crit. Care Med., 1997, 155, p. 1729–1734.
25. McClave, S. A., Lukan, J. K., Stefater, J. A.et al. Poor validity of residual volumes as a marker for risk of aspiration in critically ill patiens. Crit. Care Med., 2005, 33, p. 324–330.
26. Sobotka, L., Allison, S. P., Meier, R. et al. Basics in clinical nutrition. Third Edition, Praha : Galén 2004.
27. Van den Berghe, G., Wouters, P. J., Weekers, F. et al. Intensive insulin therapy in critically ill patiens. N. Engl. J. Med., 2001, 345, p. 1359–1367.
28. Treggiari, M. M., Karir, V., Yanez, N. D. et al. Intensive insulin therapy and mortality in critically ill patiens. Crit. Care, 2008, 12, p. R29.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2008 Issue 3-
All articles in this issue
- Selective bronchial intubation with the UniventR tracheal tube in children
- Distraction osteogenesis in the head and neck region
- A 39-year patient with a severe haemorrhagic-traumatic shock due to a gunshot, with a left-sided penetrating chest wound resulting in haemothorax, pneumothorax and massive blood loss was treated in the Czech Field Hospital ROLE 2 plus after a terrorist attack in Kabul. The initial Sequential Organ Failure Assessment (SOFA) of 13 points improved thanks to damage control surgery and adequate perioperative care to 5 points, increasing the chance of survival from 5% to 80%. The patient was transported to his homeland on the 3rd postoperative day where he recovered.
- Preventive measures of nosocomial infection in ventilated patients – current status
- Anticoagulation for extracorporeal renal replacement therapy in the critically ill
- Research in Anaesthesiology and Resuscitation in the second half of 20th Century
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- A 39-year patient with a severe haemorrhagic-traumatic shock due to a gunshot, with a left-sided penetrating chest wound resulting in haemothorax, pneumothorax and massive blood loss was treated in the Czech Field Hospital ROLE 2 plus after a terrorist attack in Kabul. The initial Sequential Organ Failure Assessment (SOFA) of 13 points improved thanks to damage control surgery and adequate perioperative care to 5 points, increasing the chance of survival from 5% to 80%. The patient was transported to his homeland on the 3rd postoperative day where he recovered.
- Selective bronchial intubation with the UniventR tracheal tube in children
- Preventive measures of nosocomial infection in ventilated patients – current status
- Research in Anaesthesiology and Resuscitation in the second half of 20th Century
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

