-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Obrovský gastrointestinální stromální tumor – kazuistika
A giant gastrointestinal stromal tumour – a case report
Gastrointestinal stromal tumours represent a group of non-epithelial gastrointestinal tumours that have both benign and malignant character. Most frequently, they occur in the stomach and the intestine; however, as regards their overall incidence, they are rather infrequent tumour lesions. The present case report describes a rare bulky extragastrointestinal stromal tumour originating from the mesenterium in a young patient. Its anatomical and histological picture, diagnosis and treatment are described. Our work points to the necessity for physicians to also bear in mind the less likely options and highlights the role of surgery in the treatment of such voluminous findings.
Key words:
stromal tumour – R0 resection – immunohistochemistry
Autoři: L. Tulinský 1
; J. Dostalík 1; J. Dvořáčková 2; R. Tomanová 2
Působiště autorů: Chirurgická klinika LF OU a FN v Ostravě, přednosta: Doc. MUDr. J. Dostalík, CSc. 1; Ústav patologie FN Ostrava, přednosta: MUDr. J. Dvořáčková, Ph. D. 2
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 9, s. 486-489.
Kategorie: Kazuistika
Souhrn
Gastrointestinální stromální nádory představují skupinu neepitelových nádorů GIT majících benigní i maligní charakter. Nejčastěji se vyskytují v žaludku a střevě a svou incidencí patří mezi málo časté nádorové afekce. Předkládaná kazuistika popisuje u mladého pacienta raritní objemný extragastrointestinální stromální nádor vycházející z mesenteria. Ukazuje jeho histologický i anatomický obraz, diagnostiku a léčbu. Poukazuje na nutnost lékaře myslet i na méně pravděpodobné možnosti a vyzdvihuje vliv chirurgie při léčbě takto objemných nálezů.
Klíčová slova:
stromální nádor – R0 resekce – imunohistochemieÚVOD
Gastrointestinální stromální tumory (GIST) představují skupinu neepitelových nádorů gastrointestinálního traktu vycházejících z Cajalových buněk. Mají benigní i maligní variantu. Nejčastěji se vyskytují v žaludku (60–70 %), tenkém střevě (20–25 %), tlustém střevě (5–10 %) a jícnu (3–5 %) [1]. Méně často se mohou objevit v omentu, mesenteriu nebo v retroperitoneu. Dosahují různých velikostí, což je i jeden z prediktivních faktorů rizika jejich chování a další prognózy pacienta. Určitý marker stupně malignity je i riziko jeho agresivního chování. Závisí to na kombinaci velikosti, umístění a mitotického indexu nádorové tkáně, které potvrdil Miettinen v několika rozsáhlých studiích [2, 3]. Neexistuje však kritérium, které by maligní potenciál s určitostí vyloučilo. Imunohistochemicky je GIST prokázán CD34 a CD117 (KIT) pozitivitou, které exprimují Cajalové buňky. Dle dalších genomových mutací na KIT genu je možno určit i pravděpodobnou anatomickou distribuci nebo rezistenci a citlivost na Imatinib [4].
Původně byly GISTomy řazeny mezi leiomyocelulární nádory (leiomyomy, leiomyosarkomy nebo leiomyoblastomy). Jako samostatnou skupinu stromálních nádorů ji vyčlenili až Mazur a Clark v roce 1983 [5], obsahovala mezenchymové nádory gastrointestinálního traktu bez neurogenního nebo svalového původu. Jejich původ v Cajalových buňkách ukázala až imunohistochemická pozitivita proteinu KIT (CD117) v roce 1998 (6). Incidence GIST v Evropě je na průměrné úrovni 15 na 1 milion za 1 rok. Avšak tento údaj je výrazně podhodnocen, hlavně pro neúplnou diagnostiku a zařazení nálezů.
KAZUISTIKA
Pacient, 44 let, původem z africké země, opakovaně interně došetřován pro nejasné intermitentní bolesti břicha. Dle ultrazvuku a CT zjištěna suspektní pseudocysta pankreatu velikosti 14x10x9 cm. Vzhledem k nejasnému nálezu doporučena observace s kontrolou za 3 měsíce. Na pacientovu žádost ale další kontrola proběhla až za 6 měsíců. V dalším kroku byla provedena endosonografická ultrasonografie (EUS) s potvrzením nálezu rozsáhlého ložiska v dutině břišní o průměru nejméně 20 cm obsahující složku tekutou a složku solidní ve formě silných sept. V jedné době byla provedena i aspirace pod EUS navigací. V diferenciální diagnóze se uvažovalo i o parazitární cystě, pro kterou byl preventivně přeléčen. Cytologický výsledek punkce neprokázal přítomnost maligních buněk. Kontrolní CT ale potvrdilo expanzivní růst, kdy útvar měl po půl roce sledování velikost 27x22x15 cm bez infiltrace okolí. Pacientovi byla nabídnuta brzká chirurgická exstirpace, na jeho přání ale objednán až za 2 měsíce. Při příjmu u pacienta klinicky dominovala výrazná klenoucí se rezistence břicha, anemie a hubnutí. Kontrolní předoperační CT ukazovalo tumorózní cystický, septovaný útvar, pravděpodobně v oblasti těla pankreatu velikosti 33x33x23 cm, tedy jasnou progresi (Obr. 1 – a, b, c,).
Obr. 1. CT vyšetření před operací zobrazuje obrovský cystický tumor vyplňující celou břišní dutinu (A - transverzální řez, B - frontální řez, C - sagitální řez) Fig. 1: CT scan before surgery shows a huge cystic tumour filling the entire abdominal cavity (a – transversal section , b – frontal section, c – sagittal section) 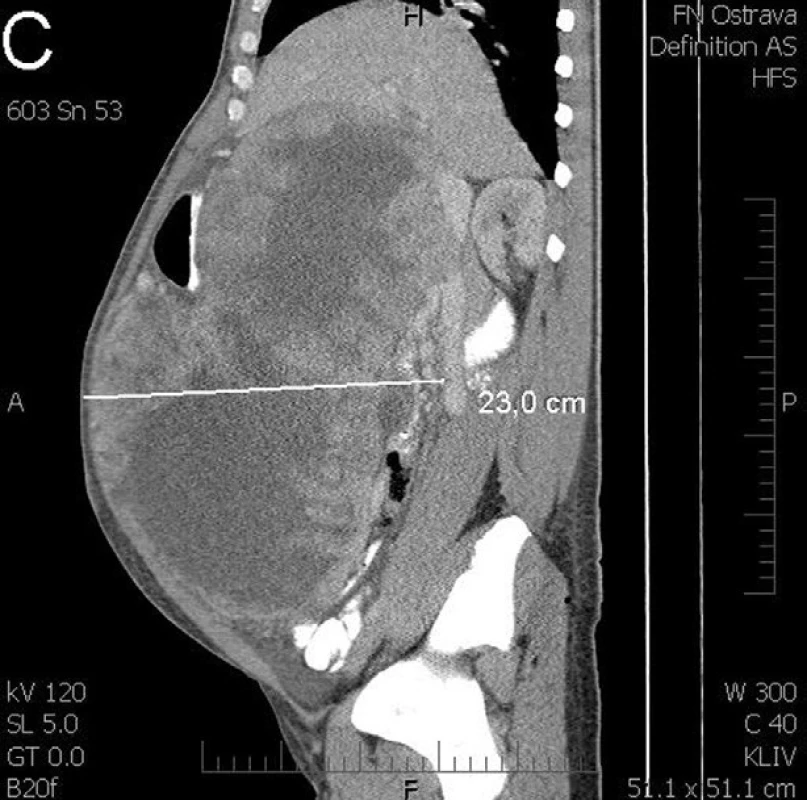
Operační výkon proveden z oboustranného subkostálního řezu. Břišní dutina byla zcela vyplněná obrovským tumorem, který se zčásti luxoval do rány. Dominovalo jeho bohaté cévní zásobení a laločnatý tvar (Obr. 2a). Po preparaci bylo zřejmé, že tumor nevyrůstá z pankreatu, ani s ním nijak nesouvisí, ale vychází z radixu mesenteria. Peroperační histologie potvrdila malignitu, dbali jsme tedy na R0 resekci. Exstirpovaný útvar měl patologem potvrzenou velikost 65x25x20 cm s hmotností 9120 g (Obr. 2b).
Obr. 2a: Peroperační snímek ukazuje část tumoru vyhřezlou po provedení laparotomie Fig. 2a: Intraoperative image shows a prolapse of the tumour after laparotomy 
Obr. 2b: Resekovaný tumor Fig. 2b: Resected tumor 
Po výkonu pacient observován na ARK JIP a 5. pooperační den byl v dobrém stavu přeložen na standardní chirurgické oddělení a po dalším týdnu byla možná dimise do ambulantní péče. Pacient zhojen per primam intentionem. Definitivní histologie potvrzená druhým čtením ukázala morfologický a imunohistochemický obraz epitheloidního extragastrointestinálního stromálního tumoru (EGIST). Nádor byl složený z dvou typů buněk. Z populace středně velkých nádorových buněk s kulatými jádry bez výraznější anizomorfie a z populace velkých buněk s většími vezikulárními jádry a eozinofilní, místy vodojasnou cytoplazmou. Stroma nádoru myxoidně prosáklé (Obr. 3). Imunohistochemicky s fokální expresí CD117 a CD 34 (Obr. 4). Dle doplňkového nukleárně genetického vyšetření – mutační analýzy – byla zjištěna mutace exonu 18 genu PDGFRA, pD842V, která je spojena s rezistencí na léčbu Imatinibem. Pacient tedy nebyl indikován k adjuvantní onkologické léčbě. V rámci dispenzarizace bylo doplněno PET CT 3 měsíce od exstirpace bez verifikace viabilní nádorové tkáně a pacient je bez klinických potíží.
Obr. 2. EGIST s oběma populacemi nádorových buněk oddělených poměrně ostrou hranicí. Barvení hematoxylin-eozin Fig. 3: EGIST with both tumour cell populations separated by a relatively sharp border. Hematoxylin-eosin stain 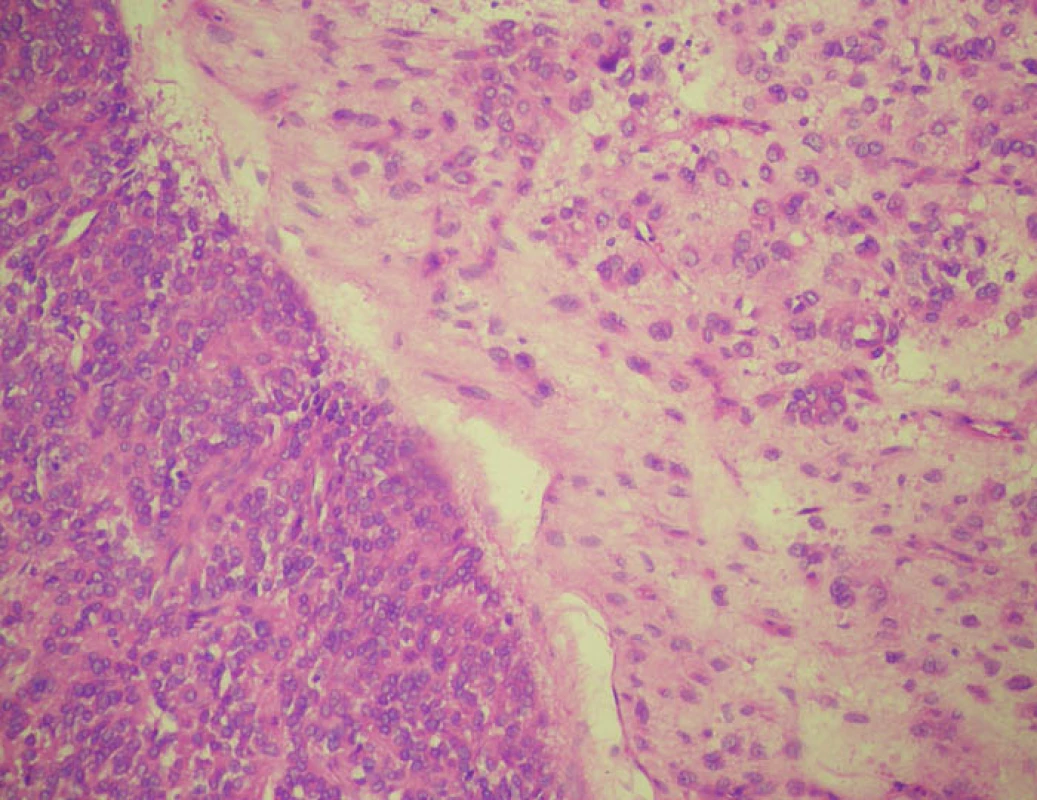
Obr. 4a, b: EGIST s fokální expresí CD117 a CD 34 (Imunohistochemické vyšetření k průkazu 4a) CD117 (c-kit) a 4b) CD 34) Fig. 4a, b: EGIST with focal expression of CD 117 and CD34 (Immunohistochemical examination for the detection of CD117 (c-kit) and CD34) 
DISKUZE
Primární léčbou pro resekabilní GISTom je zcela jistě chirurgická exstirpace, hlavně u pacientů s nízkým nebo středním rizikem agresivního růstu. Jak popisuje i Heinrich [4], léze by měla být odstraněna neporušená a s jasnými okraji. Bezpečnostní lem nemusí být široký a lymfadenektomie je kromě dětských variant zbytečná. Zavedením Imatinibu (derivát 2-fenylpyrimidinu) do adjuvantních onkologických protokolů stouplo průměrné přežívání pokročilých forem z 18 měsíců na 6 let [7]. Gold tuto skutečnost potvrzuje ve své studii skupin ve Španělsku i v USA na Mayo Clinic [9]. Ovšem naše kazuistika popisuje pacienta s rezistencí na terapii Imatinibem, i vzhledem k lokální pokročilosti a agresivnímu růstu byla tedy důsledná chirurgická léčba bez resekčních okrajů pro jeho prognózu rozhodující. DeMatteo [8] popisuje ve své retrospektivní studii na 200 pacientech rekurenci onemocnění 40 %, nejčastěji ve formě jaterních (60 %) nebo peritoneálních (20 %) metastáz. Méně častá je lokální recidiva (7 %). Je tedy velice důležitá frekventní dispenzarizace pacienta po výkonu a zjišťování tak nové viabilní nádorové tkáně. Nejvhodnější metodou je PET/CT sken, který byl v rámci dispenzarizace použit i v našem případě. Samozřejmostí je případná následná chirurgická intervence, hlavně v případě rezistentních forem. Samostatnou kategorií je výrazné poddiagnostikování pacientů s GISTomy, které jsou dlouhou dobu klinicky němé nebo jsou považovány za benigní afekce. Při potvrzené progresi v růstu by chirurgická léčba měla mít přednost před další dispenzarizací.
Závěr
Gastrointestinální stromální tumory jsou méně časté tumorózní afekce gastrointestinálního traktu. Ke stanovení definitivní diagnózy užíváme morfologické a imunohistochemické metody, které zároveň určují další prognózu pacientů. Léčebnou modalitou prvního kroku je chirurgické odstranění nádoru beze zbytků viabilní nádorové tkáně. K následné neoadjuvantní léčbě jsou indikováni pacienti s citlivostí na Imatinib prokázanou imunohistochemicky. Kombinovaná léčba významně prodlužuje přežití. Popsaná kazuistika prezentuje pacienta s lokálně výrazným pokročilým GISTomem mesenteria, který je v tomto rozsahu a umístění raritní. U pacienta byla provedena úplná exstirpace nádorové tkáně bez komplikací a bez prokázané viabilní tkáně při dispenzarizaci, což vzhledem k později zjištěné rezistenci k terapii Imatinibem bylo pro prognózu rozhodující.
MUDr. Lubomír Tulinský
Staříčská 495
739 25 Sviadnov
e-mail: tulinsky@email.cz
Zdroje
1. Miettinen M, Sarlomo-Rikala M, Lasota J. Gastrointestinal stromal tumors: recent advances in understanding of their biology. Hum Pathol 1999;30(10):1213–1220.
2. Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 2005;29(1):52–68.
3. Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol 2006;23(2):70–83.
4. Corless ChL, Heinrich MC. Molecular Pathobiology of Gastrointestinal Stromal Sarcomas. Annu Rev Pathol Mech Dis 2008;3 : 557–586. Downloaded from arjournals.annualreviews. org.
5. Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol 1983;7(6):507–519.
6. Sircar K, Hewlett BR, Huizinga JD et al. Interstitial cells of Cajal as precursors of gastrointestinal stromal tumors. Am J Surg Pathol 1999;23(4):377–389.
7. Heinrich MC, Griffith DJ, Druker BJ, Wait CL, Ott KA, Zigler AJ. 2000. Inhibition of c-kit receptor tyrosine kinase activity by STI 571, a selective tyrosine kinase inhibitor. Blood 96 : 925–32.
8. DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred Gastrointestinal Stromal Tumors recurrence patterns and prognostic factors for survival. Ann Surg 2000;231(1):51.
9. Gold JS, Gonen M, Gutierrez A et al. Development and validation of a prognostic nomogram for recurrence-free survival after complete surgical resection of localised primary gastrointestinal stromal tumour: a retrospective analysis. Lancet Oncol 2009; 10(11):1045–1052.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Významné anatomické dieloČlánek Luxační zlomeniny hlezna
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Ultrasonografická palpace i peroperační a endoluminální metody – chirurgické pojetí zobrazovací technologie
- Abdominální komplikace u pacientů po implantaci mechanické srdeční podpory
- Vývoj operativy onemocnění jater a žlučových cest
- SILS apendektómia pre akútnu apendicitídu – dvojročné skúsenosti
- Farmakologické ovlivnění modelového aneuryzmatu břišní aorty – experiment na zvířeti, prvotní výsledky
- Významné anatomické dielo
- Divertikul veľkej kurvatúry žalúdka ako príčina anemizácie
- Zemřel profesor Bohumil Potrusil
- Obrovský gastrointestinální stromální tumor – kazuistika
- Luxační zlomeniny hlezna
- Luxační zlomeniny hlezna – nové pohledy na staré problémy
- Klasifikace luxačních zlomenin hlezna
- Poranění mediálních struktur hlezna
- Zlomeniny zadní hrany tibie u zlomenin hlezna
- Suprasyndesmální šroub u luxačních zlomenin hlezna
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Suprasyndesmální šroub u luxačních zlomenin hlezna
- Klasifikace luxačních zlomenin hlezna
- Poranění mediálních struktur hlezna
- Zlomeniny zadní hrany tibie u zlomenin hlezna
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání






