-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam a interpretace poruch acidobazické rovnováhy
Interpretation of acid-base disorders
Parameters of acid-base balance should not be neglected when evaluating the homeostasis, especially in acute conditions. However, their interpretation may be difficult in some cases. The article presents a possible view of acidbase disorders. It is based on pathophysiological mechanisms, as their understanding is essential for proper evaluation and subsequent diagnosis and treatment.
Keywords:
Homeostasis – Acidosis – alkalosis – children
Autoři: Pešková Šárka 1; Bernášková Klára 2; Heinige Pavel 3; David Jan 3,4
Působiště autorů: Pediatrická klinika, 2. lékařská fakulta Univerzity, Karlovy a Fakultní nemocnice, v Motole, Praha 1; Ústav patofyziologie, 3. lékařská fakulta Univerzity, Karlovy, Praha 2; Oddělení dětské intenzivní, medicíny, Fakultní, Thomayerova nemocnice, Praha 3; Soukromá pediatrická, a nutriční ambulance, Praha 4
Vyšlo v časopise: Čes-slov Pediat 2023; 78 (1): 15-19.
Kategorie: Patofyziologie v pediatrii
doi: https://doi.org/10.55095/CSPediatrie2023/002Souhrn
Při hodnocení vnitřního prostředí by neměly být opomíjeny parametry acidobazické rovnováhy, a to zejména u akutních stavů. Jejich interpretace však může být v některých případech obtížná. Předkládaný článek přináší možný pohled na problematiku poruch acidobáze. Staví přitom na patofyziologických mechanismech, neboť jejich pochopení je zásadním předpokladem správného zhodnocení a následně diagnostiky i léčby.
Klíčová slova:
deti – vnitřní prostředí – alkalóza – acidóza
Úvod
Při hodnocení vnitřního prostředí by neměly být parametry acidobazické rovnováhy (ABR) opomíjeny. Jejich interpretace však může být v některých případech obtížná, zvlášť pokud se jedná o kombinované poruchy. V textu bude uveden rozbor ABR jak pro akutní, tak pro chronické stavy. Pojďme se tedy na tuto problematiku podívat z patofyziologického hlediska.
Vnitřní prostředí a ABR
Stálost vnitřního prostředí označujeme za homeostázu. Vnitřní prostředí organismu tvoří intracelulární a extracelulární tekutina a látky v nich rozpuštěné. Mezi laboratorní parametry, které o vnitřním prostředí vypovídají, nepatří jen Korespondenční adresa: MUDr. Jan David, Ph.D. Soukromá pediatrická a nutriční ambulance Podolská 1485/10a 147 00 Praha jan.david@centrum.cz sérová osmolarita či mineralogram, ale také hodnoty ABR. Změny koncentrace vodíkových iontů (měřené jako změna pH) mohou být příčinou změn koncentrace jiných iontů (např. vyvolávají přestup draslíku přes buněčnou membránu), mění metabolismus a aktivitu iontů vápníku a některých enzymů, ovlivňují sekreci hormonů (růstový hormon, aldosteron, inzulin, antidiuretický hormon) a funkci orgánů (plíce, ledviny, játra, kosti, srdce). Kromě toho změny ABR ovlivňují dráždivost tkání (centrálního i periferního nervového systému) a svalů. Hodnocení ABR je významné k odhalení akutních poruch bezprostředně ohrožujících život pacienta i poruch chronických.(1)
Fyziologická koncentrace vodíkových iontů v krvi je velmi nízká (asi 40 nmol/l), avšak může mít značné výchylky. Proto se k jejímu vyjadřování užívá pH (jako záporný dekadický logaritmus). Vzhledem k tomu, že se jedná o logaritmický vztah, odpovídá malá změna pH velké změně v koncentraci iontů.(2) Výchylku pH krve pod dolní hranici normy označujeme jako acidemii, nad horní hranici normy jako alkalemii. Procesy, které k těmto změnám vedou, nazýváme acidóza nebo alkalóza. Na změněné pH reaguje tělo kompenzací ve snaze pH normalizovat. Metabolické poruchy, u kterých je primární změna v koncentraci bikarbonátu, se kompenzují v řádu minut respiračně změnou minutové ventilace a tím parciálního tlaku oxidu uhličitého (paCO2). Naopak respirační poruchy s primární změnou v paCO2 se kompenzují v řádu hodin až dní metabolicky (ledvinami a játry). Na udržování extracelulárního pH se podílejí také buňky (korekce). Při zvýšené koncentraci vodíkových iontů extracelulárně vstupuje vodík do buněk a pro zachování elektrochemické rovnováhy (zastoupení pozitivních a negativních nábojů) vystupují z buňky malé ionty s pozitivním nábojem – draslík. Tento děj je typický pro acidózu a vede k extracelulární změně koncentrace draslíku ve smyslu hyperkalemie. Při alkalóze naopak vystupuje z buňky iont vodíku (po koncentračním gradientu) a draselné ionty vstupují po elektrochemickém gradientu do buňky. Výsledkem je mírná alkalemie, ale také hypokalemie. Platí to však i naopak, při hyperkalemii vzniká acidóza a při hypokalemii alkalóza. Metabolické změny ABR je proto nutné vždy hodnotit v souvislosti s kalemií.
Na korekci ABR se podílejí také játra a kosti. Játra obsahují enzymy závislé na pH a při alkalóze zvyšují koncentraci vodíkových iontů, při acidóze napomáhají vylučování protonů ledvinami. Při chronické acidóze vstupuje iont vodíku do kostí výměnou za sodíkové a vápenaté ionty. Mění se tím metabolismus kostí a rozvíjí se jejich poškození (to je příčina poruchy růstu u dětí(1) a jeden z mechanismů rozvoje renální osteopatie při chronickém onemocnění ledvin).
Fyziologické reakce na změny ABR jsou u dětí obdobné jako u dospělých. Přesto se najdou rozdíly, a to především u novorozenců a kojenců. Obecně se ABR kojenců odlišuje od ABR dospělých hlavně tím, že mají menší schopnost reabsorbovat bikarbonát ledvinami. I z tohoto důvodu je koncentrace bikarbonátu v jejich krvi fyziologicky nižší a závisí na zralosti dítěte. Děti s nízkou porodní hmotností mají normální koncentraci bikarbonátu 12–16 mmol/l, ostatní 20–22 mmol/l.(1,3) I u dětí narozených v termínu je schopnost ledvin vylučovat kyseliny téměř na maximu, nemají tedy rezervu na kompenzaci acidózy. Schopnost vylučovat kyseliny se zvyšuje až v prvních měsících života. Navíc se během růstu ukládají baze do novotvořených kostí (vápenaté soli v kostech jsou alkalické povahy) a metabolismus bílkovin způsobuje vyšší produkci kyselin než u dospělých,(3) což opět podporuje tendenci k acidemii.
Poruchy ABR
Acidemie je porucha homeostázy, jejíž podstatou je snížení pH pod dolní hranici normy. Může se jednat o metabolickou acidózu (MAc), která se vyvíjí tehdy, jestliže se v organismu hromadí větší množství exogenních nebo endogenních kyselin či se změní koncentrace silných iontů (sodíku, draslíku, chloridů, laktátu). Podle mechanismu vzniku (a pro usnadnění diagnózy) se dělí MAc na variantu se zvýšeným anion gapem (aniontovou mezerou) a MAc s normálním anion gapem. Při MAc se zvýšeným anion gapem vzniká v organismu větší množství kyselin, např. keto-kyseliny při hladovění nebo u diabetiků 1. typu či laktát při anaerobním metabolismu, nebo mohou být kyseliny do organismu přiváděny ze zevního prostředí, jako tomu bývá u intoxikací (např. metanolem, etylenglykolem, kyselinou acetylsalicylovou či paracetamolem). Anion gap stoupá také při zvýšení koncentrace albuminu. Pro příčiny MAc se zvýšeným anion gapem lze využít mnemotechnikou pomůcku „GOLD MARK“, která je blíže vysvětlena v tabulce 1.(3,4,14) MAc s normálním anion gapem vzniká při změně koncentrace iontů, např. snížením vylučování vodíku nebo naopak zvýšením vylučování bikarbonátů ledvinami (renální tubulární acidóza). K tomuto typu MAc může také přispět iontová dysbalance (např. nadbytek chloridových iontů při terapii s fyziologickým roztokem). MAc je kompenzována respiračním systémem cestou hyperventilace (Kussmaulovo dýchání), která vede k hypokapnii.
Tab. 1. Příčiny metabolické acidózy se zvýšeným anion gapem „GOLD MARK“(3,4,14) 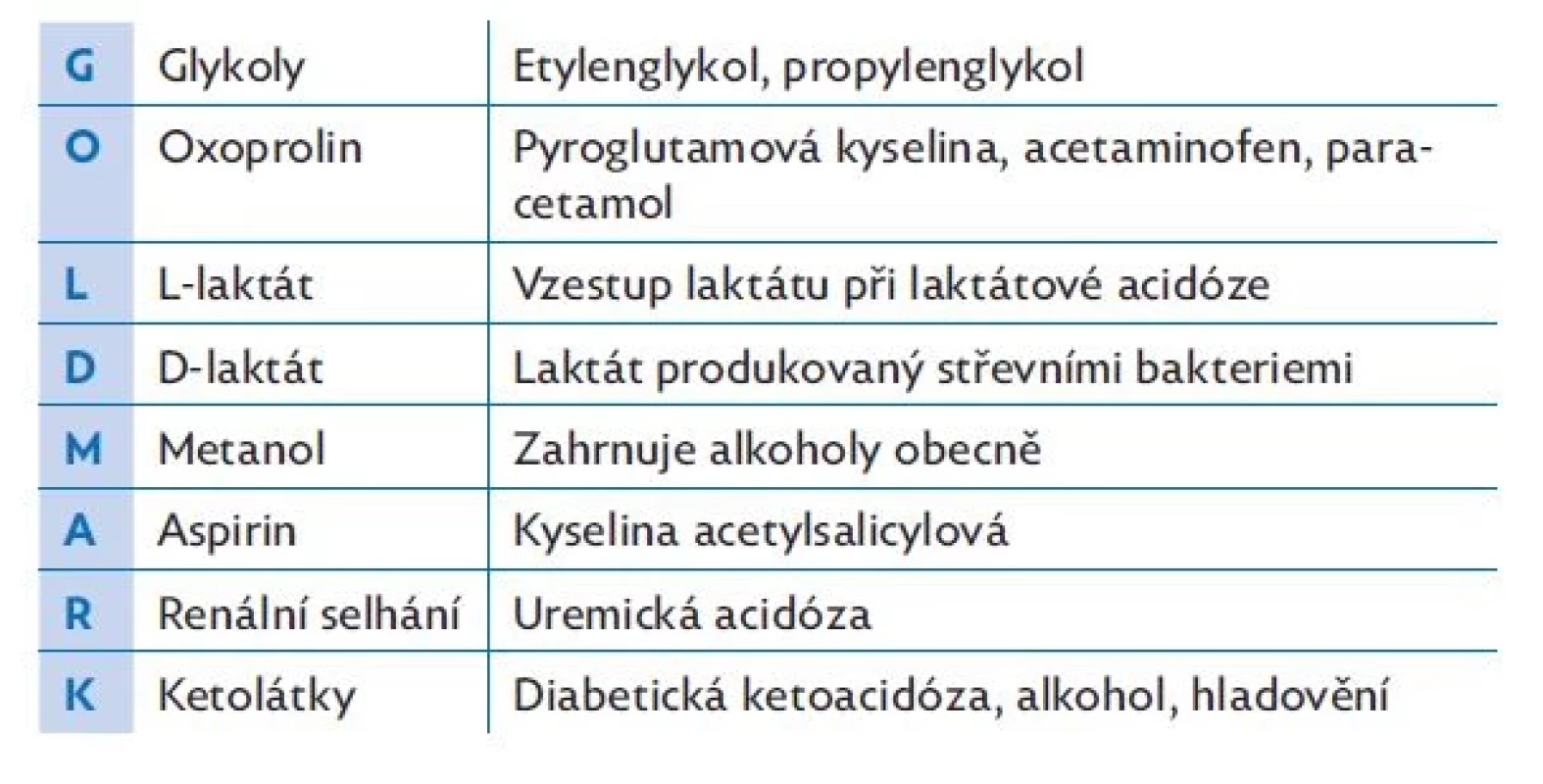
Respirační acidóza (RAc) je charakterizovaná zvýšením paCO2. U zdravých osob se vyšší paCO2 nevyskytuje, protože je samo o sobě stěžejním podnětem k dýchání. Příčinou RAc je většinou vážná porucha ventilace. Tabulka 2 přináší přehled nejčastějších příčin obou typů acidózy.
Tab. 2. Příčiny metabolické a respirační acidózy 
Obecným příznakem acidemie je snížená dráždivost tkání (nervového systému a svalového aparátu), což je dáno uvolněním vápenatých iontů z vazby na albumin, který slouží jako pufr pro vodíkový iont. Volný vápník stabilizuje membrány buněk. Acidemie snižuje afinitu hemoglobinu ke kyslíku a posunuje disociační křivku doprava, což sice umožní snazší uvolňování kyslíku ve tkáních, ale v plicích se bude méně kyslíku vázat. Neurologická manifestace acidemie zahrnuje bolesti hlavy, letargii a zmatenost. Acidemie také zvyšuje inzulinovou rezistenci a degradaci proteinů a snižuje tvorbu adenosintrifosfátu. Objevují se i nespecifické příznaky jako bolesti břicha, nauzea a zvracení.(2)
Samotná MAc bývá oproti respirační variantě klinicky více vyjádřena, a to zejména kvůli hyperkalemii se všemi svými důsledky – poruchy srdečního rytmu včetně fibrilace komor. Snížení pH o 0,1 zvyšuje koncentraci draslíku o 0,4 – 0,6 mmol/l. Kompenzačně zvýšená ventilace může dítě energeticky vyčerpat a nakonec vést k respiračnímu selhání (vznikne kombinovaná metabolická a respirační acidóza). V plicích se rozvíjí vazokonstrikce plicních arterií a porucha poměru ventilace/perfuze, což zvýší tlak v plicním řečišti (a časem až k pravostrannému srdečnímu selhání). Toto riziko je zvlášť významné u novorozenců s perzistující plicní hypertenzí.(4) Pro mírnou MAc je typická tachykardie, která však může být způsobena i jinými stavy zvyšujícími tepovou frekvenci. Při snížení pH pod 7,2 způsobí negativně inotropní účinek poruchu funkce srdce a periferní dilataci. Navíc se snižuje odpověď myokardu na endogenní i exogenní katecholaminy.( 2,4)
Nejčastější acidózou je u dětí RAc při respirační insuficienci. Častá je však i MAc, např. ketóza při hladovění u batolat a předškolních dětí, diabetická ketoacidóza, MAc při dehydrataci u akutního průjmového onemocnění, intoxikace či vrozené poruchy metabolismu (nemoc javorového sirupu, izovalerová nebo glutarová acidurie).(2) Zvláštní příčinou MAc může být i sekundární pseudo-hypo-aldosteronismus vyvolaný zánětem močových cest.(5) Chronická acidóza způsobuje poruchy růstu a neprospívání, neboť snižuje sekreci růstového hormonu (vč. IGF1), inzulinu, glukokortikoidů, hormonů štítné žlázy, parathormonu a kromě toho aktivuje proteolýzu.(6)
Alkalemie je stav organismu, kdy je pH plazmy vyšší než horní hranice normy. Vyvíjí se méně často než acidemie, proto je její kompenzace obtížnější. Příčiny vedoucí k alkalemii mají také dvě podoby: metabolickou a respirační. Metabolická alkalóza (MAl) vzniká buď ztrátou kyselin (zvracení, odsávání žaludečního obsahu), nebo změnou koncentrace silných iontů – zvýšením koncentrace bazí (bikarbonátu), hypokalemií nebo ztrátami chloridů (diuretika).
Pro snadnější diagnózu je možné MAl rozdělit na dva typy podle množství chloridů v moči. Pro chloridy responzivní MAl je typická snížená koncentrace chloridů v moči (méně než 10 mmol/l) a současně snížená koncentrace chloridů v plazmě, většinou současně s dehydratací (například při zvracení nebo fyziologicky u hyperaldosteronismu). Naopak pro chloridy rezistentní MAl je typická koncentrace chloridů v moči vyšší než 20 mmol/l a její nejčastější příčinou je primární hyperaldosteronismus (Connova nemoc) nebo hyperkortizolismus (Cushingův syndrom).(7)
Respirační alkalóza (RAl) vzniká při hyperventilaci, která vede k hypokapnii. Hyperventilace může nastat ve stresu, při dráždění dechového centra (např. při intoxikaci některými léky – aspirin), při záchvatu úzkosti, ale i fyziologicky při volní hyperventilaci či ve vysoké nadmořské výšce. Zvýšená námaha (sport) však obvykle ke změně paCO2 nevede, protože tělo stíhá vyloučit vyprodukovaný CO2. Respirační alkalóza je kompenzovaná ledvinami. Tabulka 3 uvádí přehled nejčastějších příčin obou základních typů alkalózy.
Tab. 3. Příčiny metabolické a respirační alkalózy 
Obecným příznakem alkalózy je zvýšená dráždivost (příčiny jsou opačné než u acidózy). Může se projevovat neklidem, agresivitou, bolestmi hlavy, zvracením, křečemi a poruchou vědomí. Lehká nebo středně těžká MAl většinou není sama o sobě klinicky závažná. Pokud však není dostatečně kompenzovaná (růst bikarbonátu není sledován dostatečným zvýšením paCO2), jedná se o těžkou MAl. Ta způsobuje posun disociační křivky hemoglobinu doleva (kyslík se ve tkáních obtížněji uvolňuje) a vzniklá hypoxie tkání je ještě zhoršovaná kompenzační hypoventilací.( 7) Při MAl vzniklá hypokalemie vyvolává především kardiovaskulární účinky – život ohrožující arytmie nereagující na antiarytmika – a vazokonstrikci arteriol. U pacienta se snižuje úroveň bdělosti, má bolesti hlavy a objevují se tetanické křeče, zpočátku karpo-pedální. Chronická metabolická alkalóza způsobuje cestou hypokalemie diabetes insipidus a poruchy prospívání a růstu (snižuje sekreci hormonů – antidiuretického hormonu, aldosteronu a inzulinu).
Poruchy ABR mohou vzniknout i z několika příčin najednou. Mluvíme pak o kombinovaných poruchách. Příkladem kombinace MAc s MAl je průjmové onemocnění (ztráta bikarbonátů) a zvracení (ztráta HCl a chloridů). Mohou se kombinovat i dvě různé příčiny MAc (např. při poruše vylučování kyselin u pacienta se selhávajícími ledvinami a diabetickou ketoacidózou) nebo MAl (např. zvracení a hyperaldosteronismus). Na druhou stranu respirační poruchy ABR se navzájem kombinovat nemohou (acidóza je způsobena hypoventilací a alkalóza hyperventilací), ale kombinují se s poruchami metabolickými, např. RAc s MAl (pacient s chronickou pneumopatií opakovaně zvrací).
Indikace a interpretace ABR v pediatrii
Už samotná anamnéza může napovědět, že je třeba ABR vyšetřit a co je možnou příčinou její změny.(8) U pediatrického pacienta lze akutní poruchy ABR nejčastěji očekávat v oblasti akutních stavů, mezi které patří zejména akutní respirační či renální insuficience, diabetická ketoacidóza, závažná akutní gastroenteritida, šok, intoxikace či situace vedoucí k útlumu centrálního nervového systému, eventuálně ke zvýšení intrakraniálního tlaku.(9)
Existují však i chronické stavy, u kterých může být odchylka v acidobázi nápomocná v diagnostickém a léčebném procesu. Jmenovitě lze uvést neprospívající/podvyživené jedince v důsledku chronického onemocnění ledvin včetně tubulopatií (např. renální tubulární acidóza), chronické respirační insuficience (např. cystická fibróza), vrozené poruchy metabolismu (např. dědičné poruchy glykosylace) či poruchy příjmu potravy.(9)
Jednoduché acidobazické poruchy lze vyhodnotit snadno podle pH, paCO2 a bikarbonátu.(10) Hodnoty mohou být buď přímo měřené ze vzorku plné heparinizované krve (dle situace arteriální či kapilární, výjimečně venózní), nebo přístrojem kalkulované. Mezi přímo měřené parametry patří pH, paCO2 a paO2. Ostatní, tj. bikarbonát, deficit bazí (base excess, BE) a laktát, analyzátor dopočítává.(9,10) Výhodu přináší možnost tzv. POCT (point of care testing), tedy vyšetření přímo u lůžka nemocného, s čímž se v poslední době setkáváme nejen v rámci jednotek intenzivní péče, ale i urgentních příjmů a příjmových ambulancí. Tabulka 4 přináší fyziologická rozmezí jednotlivých parametrů ABR.
Tab. 4. Fyziologická rozmezí parametrů acidobazické rovnováhy 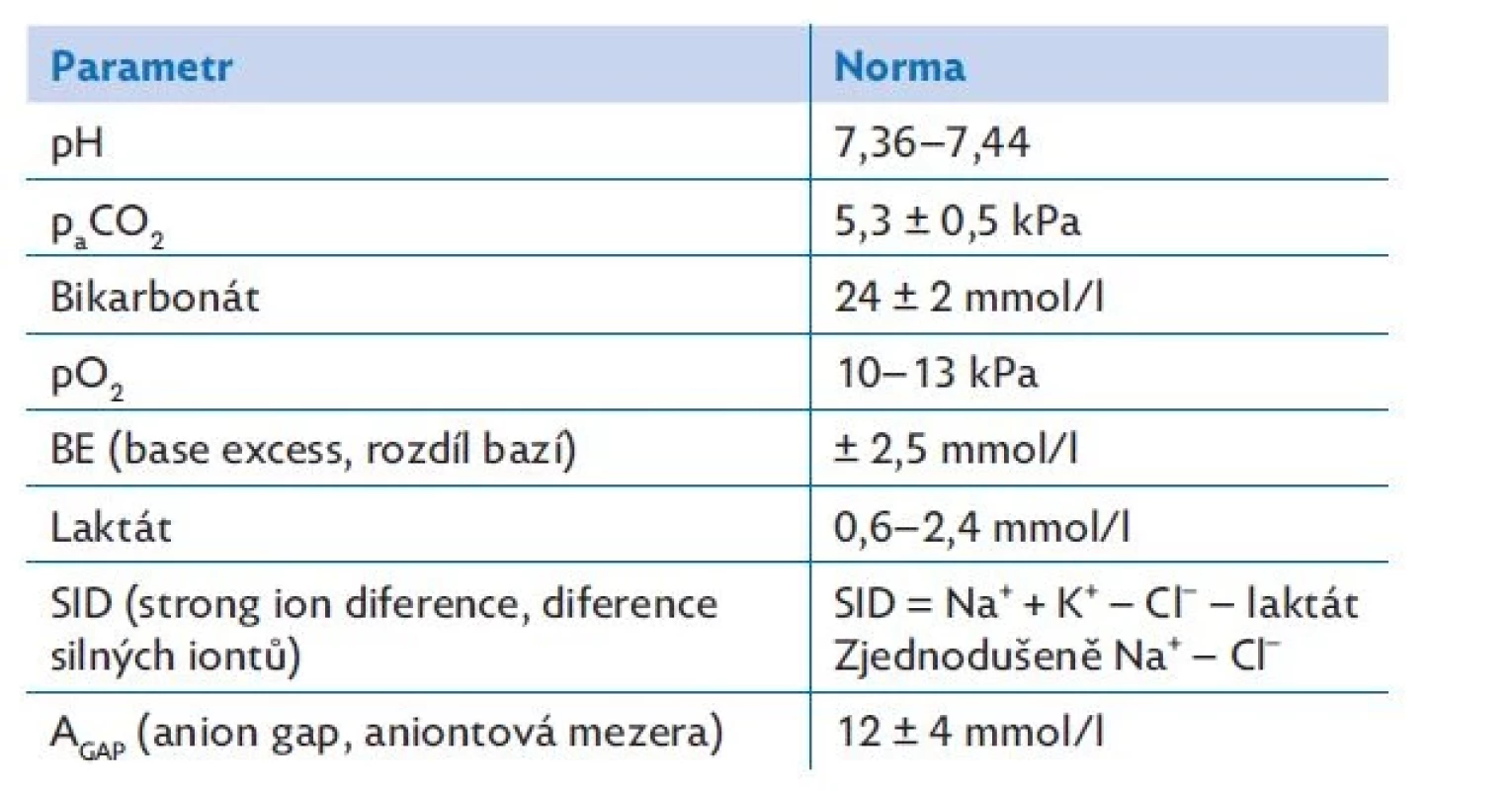
Níže uvádíme jeden z možných způsobů analýzy parametrů ABR, který je v praxi relativně dobře použitelný:(9,11,12)
• Nejprve zhodnotíme diferenci silných iontů (SID, strong ion difference), která určí předpokládanou odchylku BE (obr. 1).(9,13) Zjednodušeně počítáme rozdíl v koncentraci sodíku a chloridů, který by měl být zhruba 40 mmol/l. Pokud je tento rozdíl menší (< 40 mmol/l), očekáváme acidemii (např. hyperchloremickou při nadměrném podávání fyziologického roztoku), naopak při rozdílu > 40 mmol/l alkalemii.(11)
Obr. 1. Princip elektroneutrality tělních tekutin, upraveno dle(13) 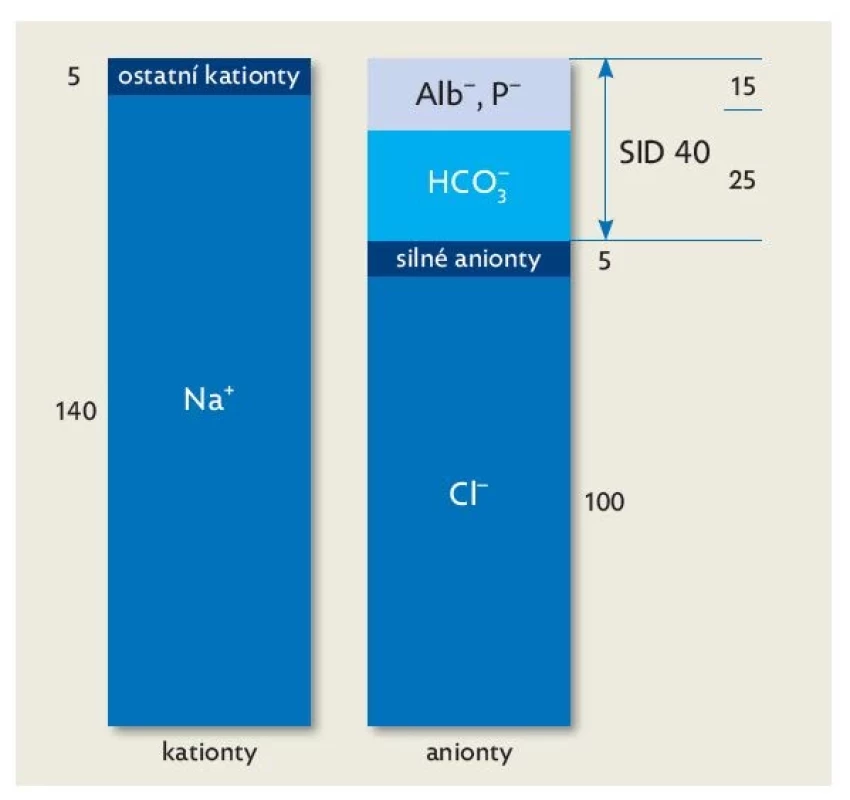
Alb− – negativní náboje na albuminu, Cl− – chloridový aniont, HCO3 − – bikarbonát, Na+ – sodíkový kationt, P− – negativní náboje na fosfátu, SID – diference silných iontů (strong ion difference). • Ve druhém kroku hodnotíme vliv koncentrace albuminu, který obdobně určuje předpokládanou odchylku BE (např. hypoalbuminemickou alkalózu). Každý pokles albuminu o 10 g/l indikuje vzestup BE o 3 mM.(11)
• Ve třetím kroku identifikujeme neměřitelný aniont. Odhalení silné neměřené kyseliny (může se počítat také jako anion gap)(12) provedeme porovnáním BE, který jsme odhadovali v předchozích dvou bodech, s hodnotou BE ve skutečnosti naměřenou. Je-li skutečná hodnota BE nižší než ta predikovaná, musíme pátrat po silné neměřené kyselině (silný aniont). Zvažujeme vliv laktátu či ketolátek (obr. 1).(13)
• Ve čtvrtém kroku zhodnotíme pH a paCO2 pomocí tzv. Bostonského pravidla, které bylo vytvořeno pro hodnocení kombinovaných poruch v obou systémech (např. MAc a RAl) a počítá hodnotu predikovaného paCO2 při adekvátní kompenzaci dané poruchy. Při MAc Bostonské pravidlo uvádí hodnotu predikovaného paCO2, podle vzorce bikarbonát/5 + 1 (kPa). Je však také nutno myslet na fakt, že akutní retence CO2 je spojena s vyšší koncentrací bikarbonátu, což ale není projevem kompenzace. Proto pro zhodnocení metabolické kompenzace primárně respirační poruchy svědčí lépe hodnota BE.(10,11,13)
• V posledním, pátém kroku zhodnotíme výše uvedené výsledky v kontextu klinického stavu pacienta.
Zjednodušený přehled celého postupu uvádí obrázek 2. Ke správné interpretaci výsledků je nutné si také uvědomit, jak samotný odběr probíhal, resp. jaký krevní vzorek analyzujeme. Pre-analytická fáze totiž přináší prostor pro mnoho úskalí. Obtížný odběr (zejména u malých dětí) může způsobit arteficiální hyperkalemii a hyperlaktacidemii. Naopak odběr u významně křičícího (hyperventilujícího) pacienta způsobí respirační alkalózu. Podobně i nedodržení podmínek odběru, včetně delší doby dodání do analyzátoru, zkreslí některé parametry a znesnadní pak jejich hodnocení. Ve všech situacích je potřeba výsledky srovnat s klinickým stavem pacienta. Například kalemie 7 mmol/l u stabilního dítěte při plném vědomí s fyziologickými renálními parametry, bez snížené diurézy a s normální elektrokardiografickou křivkou je málo pravděpodobná a může být způsobena špatným odběrem krve. Na druhou stranu nelze každý patologický výsledek považovat za pre-analytickou chybu a ignorovat jej.(11,13)
Obr. 2. Zjednodušený postup při hodnocení parametrů acidobazické rovnováhy 
Závěr
Na základě důsledných znalostí patofyziologických mechanismů lze v klinické praxi rutinně využívat principu elektroneutrality k diagnostice kombinovaných poruch ABR. Akutní změny ABR mohou být život ohrožující, naopak ty chronické způsobují poruchy růstu, resp. prospívání. Pokud se rozhodneme do složení vnitřního prostředí zasahovat, měli bychom vědět, co je příčinou odchylky stavu a co naopak fyziologickou reakcí (korekcí nebo kompenzací). Vždy je nutno léčit příčinu, nikoliv změnu ABR samotnou. Zároveň je nutné všechny nálezy srovnávat s klinickým stavem pacienta.
Korespondenční adresa:
MUDr. Jan David, Ph.D.
Soukromá pediatrická a nutriční ambulance
Podolská 1485/10a 147 00 Praha
Zdroje
1. Carmody JB, Norwood VF. A clinical approach to paediatric acid-base disorders. Postgrad Med J 2012; 88(1037): 143–151.
2. Story DA, Morimatsu H, Bellomo R. Strong ions, weak acids and base excess: a simplified Fencl-Stewart approach to clinical acid-base disorders. Br J Anaesth 2004; 92(1): 54–60.
3. Fencl V, Jabor A, Kazda A, et al. Diagnosis of metabolic acid-base disturbances in critically ill patients. Am J Respir Crit Care Med 2000; 162(6): 2246–2251.
4. Tepaev RF, et al. Metabolic Acidosis: Diagnostics and Treatment. Pediatricheskaya farmakologiya — Pediatric pharmacology 2016; 13(4): 384–389.
5. Štíchová L, Pajerek J. Neprospívání a recidivující hyponatremie u kojence. Pediatria pre prax 2013; 14(4): 167–169.
6. Mitch WE. Metabolic and clinical consequences of metabolic acidosis. J Nephrol 2006; 19 Suppl 9: S70–75.
7. Kopač M. Evaluation and treatment of alkalosis in children. J Pediatr Intensive Care 2019; 8(2): 51–56.
8. Hsu BS, Lakhani SA, Wilhelm M. Acid-base disorders. Pediatr Rev 2016; 37(9): 361–369.
9. Ševčík P, et al. I ntenzivní medicína. 3. přeprac. a rozš. vyd. Praha: Galén c2014.
10. Duška F, Waldauf P. Diagnostika akutních poruch acidobazické rovnováhy. Vnitř Lék 2019; 65(6): 400–404.
11. Ševela S, et al. Realimentační syndrom. Čas lék čes 2016; 155(2): 34–40.
12. Durward A., Murdoch I. Understanding acid-base balance. Current Pediatrics 2003; 13 : 513–519.
13. Kohout P, et al. Klinická výživa. Praha: Galén 2021.
14. Brubaker RH, Vashisht R, Meseeha M. High anion gap metabolic acidosis. In: StatPearls (Internet). Treasure Island (FL): StatPearls Publishing 2022.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2023 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Význam a interpretace poruch acidobazické rovnováhy
- František Kaván: Zimní krajina
- Tuberkulózní spondylitida neboli Pottova nemoc – relikt minulosti?
- Velmi neobvyklá příčina bolesti břicha
- Co jsme psali
- Akútna intoxikácia preparátom železa u 16-ročnej pacientky
- Neinvazivní monitoring vitálních funkcí u novorozence
- Role dětského podpůrného týmu v rozvoji nemocniční paliativní péče ve Fakultní nemocnici v Motole
- Pět let zkušeností s poskytováním nemocniční paliativní péče dětským pacientům
- Regulace energetické rovnováhy a jídelního chování
- Editorial
- Cena ministra zdravotnictví za zdravotnický výzkum a vývoj
- Pediatrická poezie
- Cyanotické srdeční vady
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Význam a interpretace poruch acidobazické rovnováhy
- Cyanotické srdeční vady
- Velmi neobvyklá příčina bolesti břicha
- Akútna intoxikácia preparátom železa u 16-ročnej pacientky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



