-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chronické záněty placenty neinfekční etiologie
Chronic non-infectious inflammations of the placenta
In addition to the well-known group of inflammations of infectious etiology, placental inflammations arising on immunological basis are also encountered. The incidence of the latter far exceeds the group of infectious lesions of the placenta caused mainly by microorganisms of the TORCH group.
Given the current knowledge of the possible complications of these inflammations, their precise diagnosis becomes more important not only from the clinicopathological point of view, but also because of potential forensic consequences.
The aim of this article is to provide readers with a basic overview of the morphology, classification, presumed pathogenesis and clinical aspects of these entities.
Keywords:
Chorioamnionitis – Placenta – fetal growth restriction – chronic inflammation – villitis – VUE – deciduitis – intervillositis – FGR – intrauterine fetal demise – IUFD
Autoři: Magdaléna Daumová 1,2; Šárka Hadravská 1,2; Lenka Planičková 3; Andrea Straková Peteříková 1
Působiště autorů: Šiklův ústav patologie LFP UK a FN Plzeň 1; Bioptická laboratoř s. r. o., Plzeň 2; Ústav patologie 1. LF UK a VFN v Praze 3
Vyšlo v časopise: Čes.-slov. Patol., 57, 2021, No. 4, p. 208-215
Kategorie: Přehledový článek
Souhrn
Kromě všeobecně známé a dobře definované skupiny zánětů infekčního původu se v placentě setkáváme se záněty neinfekční etiologie, vznikajícími na imunopatologickém podkladě. Jedná se o záněty chronické, které svojí incidencí zdaleka předčí skupinu chronických infekčních zánětů vyvolaných především mikroorganismy ze skupiny TORCH.
Vzhledem k současným znalostem možných komplikací těchto zánětů nabývá jejich precizní diagnostika na významu, a to nejen z hlediska klinicko-patologického, ale potenciálně i z hlediska forenzního.
Cílem tohoto článku je poskytnout čtenářům základní přehled o morfologii, klasifikaci, předpokládané patogenezi a klinických aspektech těchto jednotek.
Klíčová slova:
placenta – růstová restrikce plodu – chorioamnionitída – chronický zánět – vilitida – VUE – deciduitida – intervilositida – FGR – nitroděložní odumření plodu – IUFD
Záněty patří mezi nejčastější patologické léze postihující placentu. Zdaleka nejčastěji se jedná o záněty infekční etiologie reprezentované především akutní chorioamnionitidou. Ve stínu této majoritní skupiny do jisté míry zůstávají záněty vznikající na imunopatologickém podkladě, které jsou však neméně důležité.
Manifestace těchto zánětů je značně heterogenní, v některých případech mohou tyto léze způsobit závažné fetální komplikace, jindy jsou pouze náhodným nálezem při vyšetření placenty. Klinicky je lze jen obtížně diagnostikovat a predikovat. I z tohoto důvodu jsou terapeutické možnosti prozatím omezené. Lze však předpokládat, že nové studie ještě detailněji objasní mechanismy, které se uplatňují v patogenezi těchto jednotek, a že tyto výsledky ovlivní diagnostický i terapeutický přístup.
Chronická vilitida/Vilitida neznámé etiologie (Villitis of Unknown Etiology, VUE)
Nejčastějším zástupcem ze skupiny chronických zánětů neinfekčního původu je vilitida neznámé etiologie (VUE). Tento zánět komplikuje 5–15 % gravidit, přičemž nejčastěji je diagnostikován v placentách plodů porozených v řádném termínu (1,2). Lze však předpokládat, že incidence VUE je daleko vyšší. Ačkoli většina z těchto zánětů bývá spíše náhodným nálezem, je nezbytné lékaře indikujícího vyšetření placenty o této diagnóze informovat. Hlavním důvodem je především poměrně vysoké riziko recidivy (1,3,4) a možnost stupňování intenzity zánětu s každou další graviditou (5,6). Těžké formy VUE bývají asociovány se závažnými komplikacemi, mezi něž patří fetální růstová restrikce (FGR), neurologické postižení plodu, případně i jeho nitroděložní odumření (IUFD) (1,7,8). VUE se s vyšší frekvencí vyskytuje u matek trpících autoimunními chorobami (9), u gravidit z darovaného oocytu (10), recentně byla popsána i zvýšená incidence VUE u obézních rodiček (11).
V patogenezi tohoto chronického zánětu se uplatňuje reakce mateřského imunitního systému proti antigenům plodu, který lze z genetického hlediska považovat za semiallograft (12). Složité molekulární interakce probíhající na fetomaternálním rozhraní vedou k aktivaci maternálního, ale i fetálního imunitního systému, jejímž výsledkem je destruktivní zánět choriových klků. Dominantní komponentu zánětlivého infiltrátu ve stromatu choriových klků představují buňky mateřského původu, reprezentované především CD8+ cytotoxickými T-lymfocyty (9,13,14). Perzistence těchto specifických T-lymfocytů v mateřské cirkulaci i řadu let po porodu (15,16) a zvýšení jejich počtu během následující gravidity je předpokládanou příčinou již zmiňované rekurence (9). Kromě buněk mateřského původu lze ve stromatu postižených choriových klků pozorovat hyperplázii Hofbauerových buněk, které zvýšeně exprimují MHC glykoproteiny třídy II. Tato exprese stoupá kontinuálně s délkou gravidity, čímž lze vysvětlit, proč se VUE vyskytuje častěji v placentách plodů porozených v termínu (9). V patogenezi VUE je často diskutována i role regulačních T-lymfocytů (Treg), které se podílejí na imunitní toleranci plodu mateřským organismem (17,18), a které bývají v placentách postižených tímto zánětem pozorovány ve zvýšeném množství. Dosud však není objasněno, zda tyto buňky sehrávají roli v genezi této zánětlivé léze, anebo zda jde o snahu organismu tuto imunitní odpověď tlumit (19).
Placenty postižené VUE mohou být malé (zejména při difúzních formách zánětu) a v případě zmnožení perivilózního fibrinoidu, které může tuto lézi provázet, lze někdy makroskopicky pozorovat neostře ohraničená mapovitá ložiska světle šedé či bílé barvy (Obr. 1), která mají tužší konzistenci než okolní parenchym. V těchto případech může placenta naopak nabývat vyšší hmotnosti, než by odpovídalo hmotnostnímu průměru pro daný gestační věk (2,20,21). Makroskopický nález je však velmi často nespecifický a klíčovou úlohu v diagnostice sehrává mikroskopické vyšetření. Doporučené postupy uvádějí, že v případě vyšetření 3 tkáňových bloků z placenty (vyšetřené řezy by měly zahrnovat celou tloušťku placentárního disku) je pravděpodobnost zastižení této léze v makroskopicky normální placentě přibližně 60 %, v případě vyšetření 6 až 7 tkáňových bloků se tato pravděpodobnost blíží 85 % (20).
Obr. 1. Depozita perivilózního fibrinoidu. 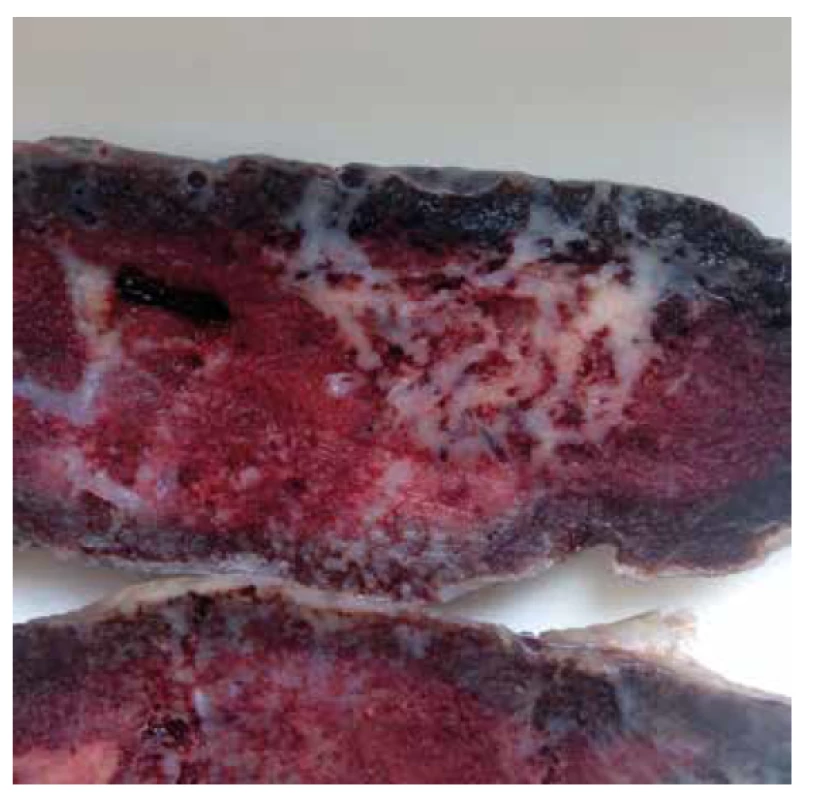
Jedním ze základních mikroskopických znaků, mimo jiné odlišujících VUE (Obr. 2) od zánětů infekční etiologie, je asymetrické postižení placentárního parenchymu; okrsky placentárního parenchymu postiženého zánětem bývají poměrně ostře ohraničeny od okolních choriových klků, které zpravidla nevykazují podstatnější morfologické změny (2,21). Ve stromatu choriových klků je přítomna lymfohistiocytární zánětlivá celulizace. Přítomnost lymfocytů, které představují hlavní zánětlivou komponentu, lze v případě pochybností ověřit imunohistochemickým průkazem CD3, resp. CD8. V menší míře mohou být zastiženy i neutrofilní granulocyty či plasmatické buňky; jejich zvýšené zastoupení v zánětlivém infiltrátu by však mělo vzbuzovat podezření na možnou infekční etiologii léze (21). Postiženy bývají zejména terminální a zralé intermediární choriové klky (tzv. distální typ VUE), zánět se však může šířit i na klky kmenové (tzv. proximální typ VUE) a může být doprovázen chronickou perivaskulitidou vedoucí k obliteraci cévního lumina (tzv. fetální obliterativní vaskulopatie). V povodí postižených kmenových klků lze často pozorovat skupiny avaskulárních choriových klků (2,22). Právě tyto těžké formy VUE bývají asociovány s FGR a neurologickým postižením plodu (1,2,23). Distribuce zánětu rovněž do jisté míry koreluje s jeho intenzitou i s případnými komplikacemi. Zatímco záněty lokalizované subchoriálně a v centru placenty mívají většinou charakter high-grade léze s postižením kmenových klků včetně jejich vaskulatury, tzv. bazální vilitida představuje obvykle mírný zánět terminálních klků, který obvykle není příčinou FGR ani IUFD. Recentní práce však opakovaně potvrzují zvýšený výskyt bazální vilitidy v placentách patologicky adherujících k děložní stěně a v placentách matek trpících hypertenzními chorobami (24,25). VUE bývá v některých případech doprovázena zvýšenou akumulací perivilózního fibrinoidu, která dále přispívá ke zhoršení placentární funkce a představuje tedy i zvýšené riziko fetálních komplikací. Častěji je tento jev pozorován v asociaci s maternálními autoimunními chorobami. U lézí tohoto charakteru se předpokládá i vyšší riziko recidivy v následujících graviditách (1,9).
Obr. 2. VUE. A: Chronická zánětlivá celulizace ve stromatu choriových klků a přilehlé avaskulární choriové klky (HE, 100x). B: Chronická perivaskulitida s obliterací cévních lumin (tzv. fetální obliterativní vaskulopatie) (HE, 400x). C: CD8 pozitivní lymfocyty ve stromatu choriových klků (CD8, 200x). 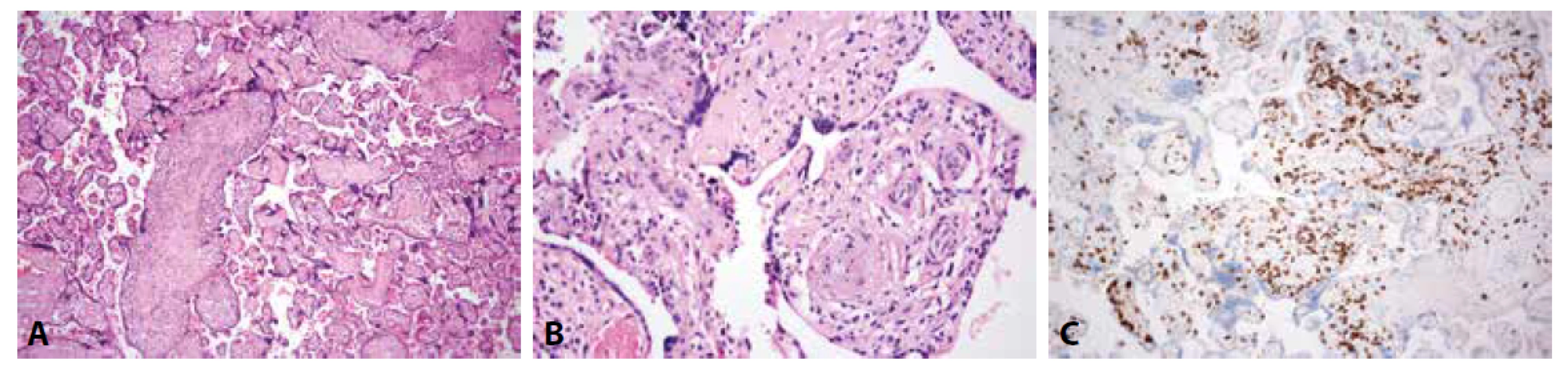
Základní rozdělení VUE na low-grade a high-grade léze je založeno na stanovení počtu postižených choriových klků v zánětlivém ložisku (Tab. 1).
Tab. 1. Vilitida neznámé etiologie (VUE) – doporučená klasifikace. 
Low-grade VUE je charakterizována postižením méně než 10 sousedících choriových klků v jednom ložisku, přičemž kritériem pro stanovení diagnózy VUE je přítomnost alespoň 2 takovýchto ložisek. Pokud jsou výše popsané změny přítomny pouze v 1 vyšetřeném řezu, jedná se o fokální low-grade VUE, pokud jsou přítomny ve 2 a více vyšetřených řezech je léze klasifikována jako multifokální low-grade VUE. Pokud je alespoň jedno zánětlivé ložisko tvořeno 10 a více choriovými klky, je léze klasifikována jako high-grade VUE. High-grade VUE lze dále rozdělit na formu disperzní, tvořenou mnohočetnými ložisky, a na formu difúzní, postihující více než 30 % distálních choriových klků (2,3,20).
Vzácněji může být při vyšetření placenty nalezeno pouze 1 ložisko postižených choriových klků odpovídající VUE. Pokud je toto ložisko tvořeno méně než 10 choriovými klky, je doporučeno tuto lézi hodnotit jako potenciální low-grade VUE (orig. „ungradable-possible low-grade“), pokud jde o skupinu tvořenou 10 a více choriovými klky, je doporučeno označení potenciální high-grade VUE (orig. „ungradable-possible high-grade“) (20).
Diferenciálně diagnosticky je důležité odlišit VUE zejména od infekčních zánětů způsobených mikroorganismy ze skupiny TORCH. Ačkoli je morfologie těchto zánětů dosti variabilní, znalost některých charakteristických znaků může významně přispět ke stanovení správné diagnózy (Obr.3). Důležité je rovněž odlišení VUE od fetální vaskulární malperfúze (FVM), která je způsobena různými stavy vedoucími k omezení průtoku krve fetální krevním řečištěm. Nejčastěji se v etiopatogenezi tohoto procesu uplatňuje mechanická obstrukce umbilikálních cév, z čehož vyplývá, že riziko recidivy v následující graviditě je oproti VUE minimální. Zmnožení perivilózního fibrinoidu (ať již ve formě masivních depozit či solitárního ložiska) může rovněž napodobovat některé formy high-grade VUE. Absence signifikantní lymfocytární zánětlivé celulizace ve stromatu choriových klků však diagnózu VUE vylučuje. Diagnostické rozpaky mohou vzniknout i v případě vyšetření druhotrimestrových placent, neboť stroma choriových klků je v tomto období přirozeně celulárnější. Hyperplázie Hofbauerových buněk, která může provázet různé patologické stavy včetně akutní chorioamnionitidy, fetálního hydropsu, opožděné maturace choriových klků a mnohých dalších, může rovněž imitovat chronickou vilitidu (2,21). Využití imunohistochemického barvení (popřípadě i metod molekulární biologie) lze z vlastní zkušenosti v diagnosticky obtížných nebo nejasných případech vřele doporučit.
Obr. 3. A: Chronická lymfoplasmocytární vilitida při infekci CMV (HE, 200x). B: CMV placentitida. Drobná depozita hemosiderinu (šipky) ve stromatu choriového klku (HE, 400x). C: CMV placentitida. Virové inkluze (šipky) (HE, 400x). D: Granulomatózní vilitida při infekci Toxoplasma gondii (HE, 150x). E: Toxoplasmová infekce placenty. Granulomatózní vilitida s přítomností obrovských mnohojaderných buněk (HE, 400x). F: Syfilis. Lymfoplasmocytární vilitida a koncentrická perivaskulární fibroproliferace (HE, 100x). G: Syfilis. Koncentrická perivaskulární fibroproliferace („onion skin villi“) (HE, 400 x). 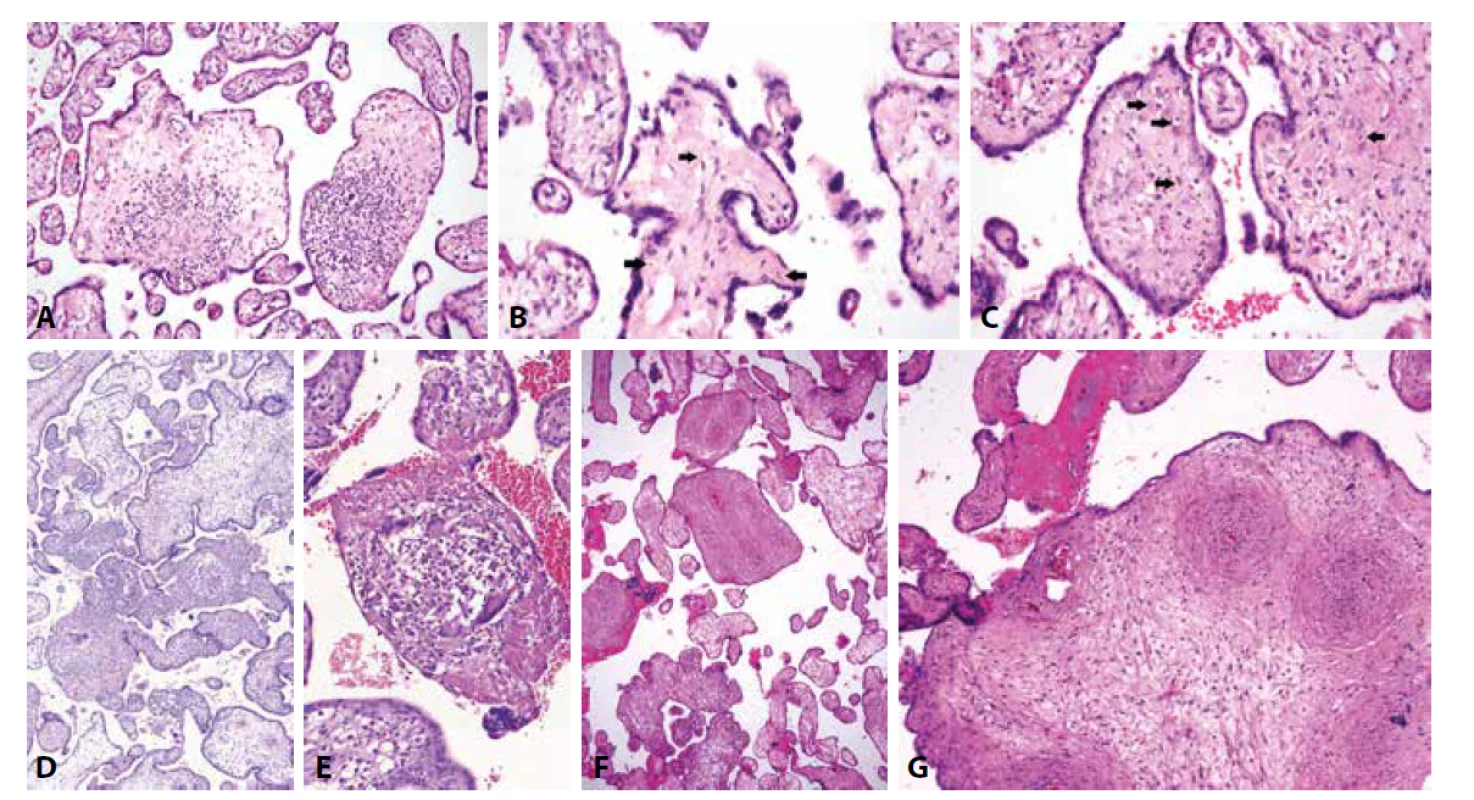
Chronická chorioamnionitida
Chronická chorioamnionitida je poměrně častou lézí, která se může vyskytovat samostatně, v řadě případů však doprovází VUE (26-28) či chronickou deciduitidu (26,29). Na rozdíl od VUE bývá chronická chorioamnionitidia s vysokou frekvencí diagnostikována v placentách předčasně porozených plodů a podle dostupných dat lze tuto jednotku pozorovat až u 39 % případů předčasného odtoku plodové vody před termínem porodu (PPROM) (12,26) a až u 60 % případů IUFD (12).
Definujícím znakem chronické chorioamnionitidy je přítomnost lymfocytární zánětlivé celulizace v choriu (a amniu) plodových obalů či choriové plotny (Obr. 4).
Obr. 4. A: Chronická chorioamnionitida plodových obalů (HE, 200x). B: Chronická chorioamnionitida. CD8 pozitivní lymfocyty v chorioamniální pojivé tkáni (CD8, 100x). 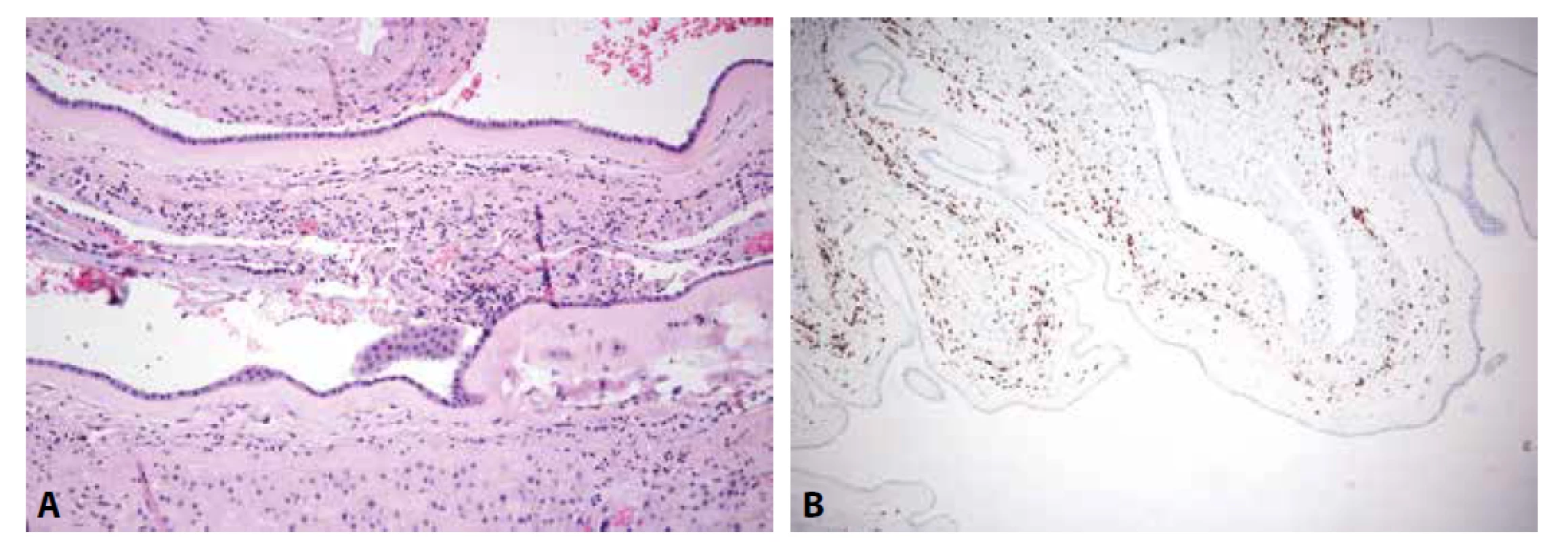
V patogenezi chronické chorioamnionitidy se stejně jako v předchozím případě uplatňuje inadekvátní reakce mateřského imunitního systému na antigeny plodu. Předpokládá se, že při rozvoji zánětu zřejmě sehrává klíčovou úlohu dysregulace některých chemokinů, která vede k migraci lymfocytů z mateřské tkáně (decidua) do tkáně fetální (chorion, resp. trofoblast). Tato skutečnost byla potvrzena recentními studiemi, které prokázaly zvýšení koncentrace chemokinových ligandů CXCL10 a CXCL9 v plodové vodě (30), resp. zvýšení exprese mRNA pro ligandy CXCL9, CXCL10 a CXCL11 v plodových obalech v placentách postižených chronickou chorioamnionitidou (26).
Zánět je obvykle lokalizován v plodových obalech. V případě postižení choriové plotny lze častěji pozorovat současný výskyt chronických zánětů i v dalších kompartmentech placenty (21). Mateřské T-lymfocyty bývají obvykle rozptýleny disperzně v chorion laeve a v některých případech může být zánět doprovázen drobnými nekrózami trofoblastu (26).
Současná klasifikace (Tab. 2) doporučovaná v moderních učebnicích placentární patologie zohledňuje při hodnocení distribuci a intenzitu zánětlivého infiltrátu. Pokud je zánět omezen pouze na chorion (resp. na vrstvu extravilózního trofoblastu), je hodnocen jako stage 1. V případě postižení chorioamniální pojivové tkáně se jedná o stage 2. Grade 1 je definován přítomností disperzních lymfocytů, přičemž ke stanovení diagnózy je nutná přítomnost více než 2 ložisek zánětlivé celulizace. Grade 2 je charakterizován difúzní zánětlivou celulizací (31,32).
Tab. 2. Chronická chorioamnionitida – doporučená klasifikace. 
Chronická (lymfoplasmocytární) deciduitida
Tento zánět je charakterizovaný přítomností chronické zánětlivé celulizace v deciduy (32). Ačkoli většina současných publikací uvádí, že pro stanovení této diagnózy je nezbytná přítomnost plasmatických buněk v zánětlivém infiltrátu, někteří autoři se přiklánějí k názoru, že diagnóza chronické deciduitidy může být stanovena i při absenci plasmocytů, přítomna však musí být intenzivní lymfocytární zánětlivá celulizace (33).
Chronická deciduitida poměrně často doprovází VUE (zejména bazální) či chronickou chorioamnionitidu, může se však vyskytovat i izolovaně (1,26). Vyšší frekvence tohoto zánětu byla zaznamenána v placentách předčasně porozených plodů (26,34) a v materiálech ze spontánních abortů získaných kyretáží dutiny děložní. Podle dostupných informací lze tento typ zánětu najít v 9-20 % spontánně potracených konceptů bez přítomnosti chromozomální aberace a u 4-30 % spontánně potracených konceptů s chromozomální aberací (35,36). Nelze vyloučit ani možnou souvislost zánětu s habituálním potrácením (35). Poměrně nedávno byla popsána zvýšená incidence chronické deciduitidy v placentách patologicky adherujících k děložní stěně (24).
Předpokládá se, že i chronická deciduitida představuje imunologicky podmíněný zánět charakteru materální anti-fetální rejekce. Pro tuto skutečnost svědčí zvýšená koncentrace IgG protilátek anti-HLA třídy I a II v mateřském séru (29) či přítomnost depozit C4d v placentární tkáni (36) a podporuje ji i fakt, že tento zánět častěji komplikuje graviditu z darovaného oocytu (10,37).
Histologicky nacházíme v bazální (méně často v kapsulární) deciduy chronickou zánětlivou celulizaci (Obr. 5), která je tvořena převážně lymfocyty, mezi nimiž jsou rozptýleny méně početné plasmatické buňky, jejichž přítomnost je někdy vhodné ověřit imunohistochemickým průkazem CD138 (32). V případě intenzivní lymfocytární zánětlivé celulizace (≥ 50 lymfocytů/ HPF) přítomné minimálně v jednom vyšetřeném řezu může být diagnóza chronické deciduitidy stanovena i při absenci plasmatických buněk v zánětlivém infiltrátu (33). Ačkoli se současné studie shodují na diagnostickém kritériu 50 lymfocytů/HPF, grading a staging chronické deciduitidy není prozatím pevně stanoven. Někteří autoři doporučují třístupňový gradingový systém, ve kterém je zohledněna i distribuce zánětlivého infiltrátu (grade 1 – ložisko ≥ 50 lymfocytů/HPF; grade 2 – mnohočetná ložiska; grade 3 – difúzní zánětlivá infiltrace) (38), jiní doporučují samostatné hodnocení rozsahu (fokální, multifokální, difúzní) a intenzity zánětu (mírný, střední, těžký), což však činí z chronické deciduitidy do značné míry diagnózu zatíženou subjektivním vnímáním hodnotícího patologa. Z praktického hlediska i z osobní zkušenosti lze doporučit především důkladný popis této léze, který by měl zahrnovat informaci o přítomnosti plasmatických buněk v zánětlivém infiltrátu (chronická deciduitida s přítomností, resp. s absencí plasmatických buněk), počtu zánětlivých fokusů (1 ložisko tvořené ≥ 50 lymfocyty/HPF; mnohočetná ložiska tvořená ≥ 50 lymfocyty/HPF; difúzní chronická zánětlivá infiltrace deciduy) a v neposlední řadě i počtu tkáňových bloků, v nichž byl zánět identifikován.
Obr. 5. A: Chronická lymfoplasmocytární deciduitida s asociovanou chronickou bazální vilitidou (HE, 100x). B: Chronická deciduitida s účastí plasmatických buněk v zánětlivém infiltrátu (HE, 400x). 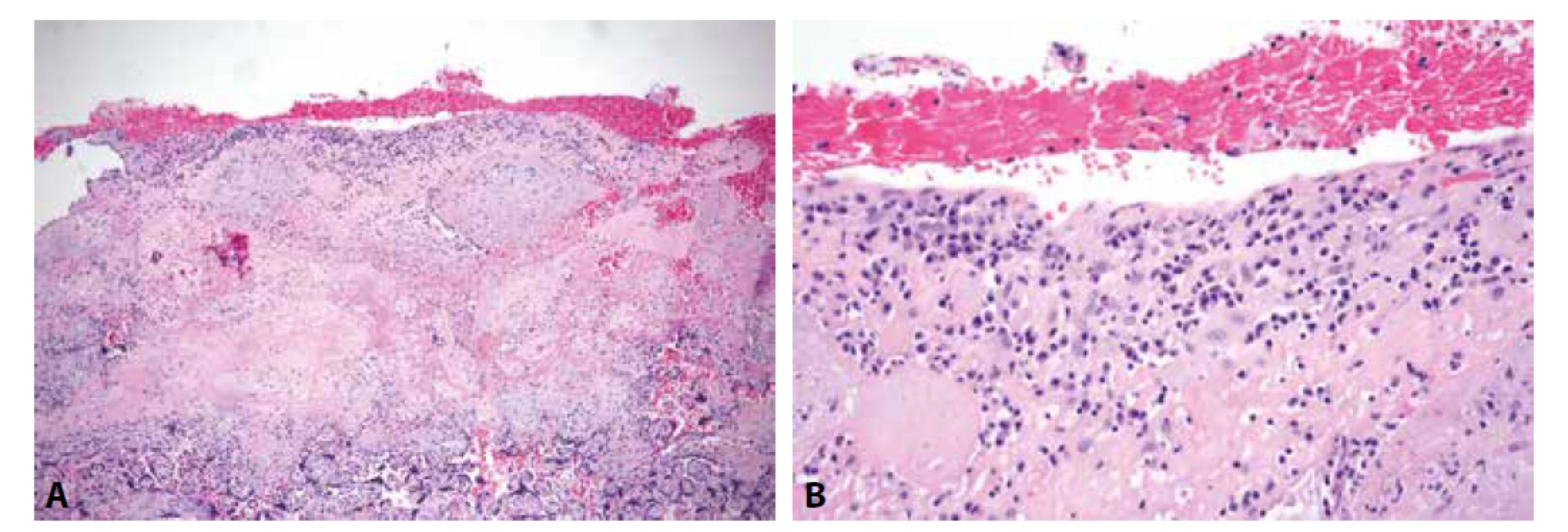
V diferenciální diagnostice je nutné vyloučit infekční etiologii zánětu, neboť chronická deciduitida může být vzácně projevem mikrobiální kolonizace a subklinického zánětu endometria (31,32). Při hodnocení je rovněž důležité nezaměňovat přítomnost perivaskulárních lymfocytů za chronickou deciduitidu. Perivaskulární lymfocytární infiltrace bývá totiž projevem maternální (deciduální) vaskulopatie (39).
Tab. 3. Chronická deciduitida – doporučená klasifikace. 
Eosinofilní/T-lymfocytární vaskulitida cév choriové plotny (Eosinophilic/T cell Chorionic Vasculitis, ETCV)
Vzácnou jednotkou zařazenou do skupiny chronických neinfekčních zánětů placenty je eosinofilní/T-lymfocytární vaskulitida cév choriové plotny (Obr. 6). Tato léze je diagnostikována v méně než 1 % vyšetřovaných placent (udávaná frekvence výskytu se pohybuje mezi 0,37 % a 0,6 %) (40,41). ETCV se vyskytuje především v placentách plodů porozených v termínu a v řadě případů bývá asociována s VUE (41,42). Tato asociace však vzhledem k odlišné patogenezi obou lézí zůstává neobjasněna. Na rozdíl od VUE nebylo u ETCV popsáno zvýšené riziko recidivy v následujících graviditách (43).
Obr. 6. ETCV. A: Zánětlivá celulizace ve stěně cévy choriové plotny s organizovanou nástěnnou trombózou (HE, 100x). B: Zánětlivá celulizace tvořená lymfocyty a ojedinělými eosinofilními granulocyty (HE, 200x). C: Výraznější příměs eosinofilních granulocytů v zánětlivém infiltrátu patrná po prokrájení parafinového bloku (HE, 200x). 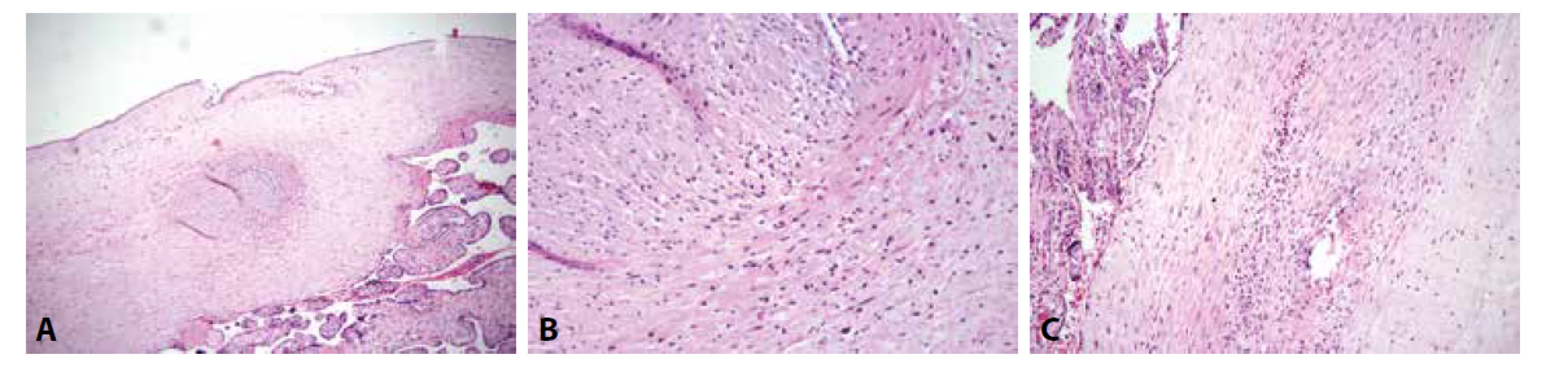
Fokální povaha zánětu, absence nekróz i omezení zánětlivého infiltrátu zpravidla pouze na stěnu jedné cévy vzbuzuje podezření, že by se spíše mohlo jednat o ložiskovou reakci na poškození cévní stěny (40). Zánět bývá často doprovázen trombózou postižené cévy, není však jasné, zda je tato trombóza důsledkem, nebo naopak vyvolávající příčinou zánětu (41).
Na rozdíl od ostatních zánětů zařazených do této skupiny je zánětlivý infiltrát u ETCV tvořený buňkami fetálního původu (44). Zánětlivá celulizace sestává převážně z T-lymfocytů (CD3+, CD4+, CD8+), přičemž 20-26 % z nich tvoří Treg (FOXP3+, CD25+), které se zřejmě uplatňují jako modulátory imunitní reakce (42). Eosinofilní granulocyty představují obvykle méně početnou komponentu a jejich přítomnost v zánětlivém ložisku je pravděpodobně reakcí na působení cytokinů uvolňovaných z lymfocytů (31). V některých případech mohou být přítomny i CD20+ B-lymfocyty a CD68+ makrofágy (41,45). Zánět je obvykle lokalizován pouze v jediné cévě choriové plotny, vzácněji bývá multifokální nebo postihuje i cévy kmenových klků (41). Ve většině případů bývá postižena pouze část cévní stěny (41). ETCV je náhodným nálezem, který není spojován se zvýšenou perinatální morbiditou (43).
Chronická histiocytární intervilositida (Chronic Histiocytic Intevillositis, CHIV)
Chronická histiocytární intervilositida (CHIV) je vzácný zánět vyskytující se s vyšší prevalencí v časných stádiích gravidity. Tento zánět lze identifikovat přibližně ve 4,4 % placent plodů spontánně potracených v prvním trimestru gravidity a pouze v 0,6 % placent porozených ve druhém a třetím trimestru gravidity (46,47).
CHIV je zatížena extrémně vysokým rizikem rekurence (67 - 100 %) (47-49) a bývá spojována s habituálním potrácením (35,48). Zánět je často asociován s maternálními autoimunními chorobami, zejména SLE, antifosfolipidovým syndromem či lupus anticoagulans (48,50). Současné práce navíc poukazují na možnou souvislost tohoto zánětu s fetální/neonatální alloimunní trombocytopenií (FNAIT) (51,52). Mezi dobře známé komplikace CHIV patří FGR a IUFD, jejichž výskyt do značné míry koreluje s rozsahem postižení placenty (resp. množstvím perivilózního fibrinoidu) (53). Podle některých prací dosahuje perinatální mortalita až 80 % (54).
Předpokládá se, že i v případě tohoto zánětu hraje roli v patogenezi maternální imunitní odpověď na antigeny plodu, konkrétně na antigeny vilózního trofoblastu. V nadpoloviční většině případů lze v mateřské krvi detekovat nápadnou elevaci alkalické fosfatázy, která je zřejmě uvolňována z poškozeného syncytiotrofoblastu (53). V syncytiotrofoblastu postižených placent byla prokázána zvýšená exprese ICAM-1 (55,56) a TLR1 (57). V mateřské krvi lze detekovat zvýšenou koncentraci anti-HLA protilátek i zvýšené množství prekurzorů CD8+ lymfocytů zaměřených proti antigenům paternálního původu (58). Molekulárně biologické studie odhalily v placentách postižených chronickou intervilositidou zvýšenou expresi genů pro matrixové metaloproteinázy (MMP9) a pro TGF beta receptor 1 (59).
Hmotnost placent postižených tímto zánětem bývá často nižší, než by odpovídalo udávanému gestačnímu věku, placentární disk může být nápadně tenký a v některých případech mohou být na řezu patrná neostře ohraničená tužší šedobílá ložiska odpovídající depozitům perivilózního fibrinoidu (31,60,61).
Histologicky nacházíme v intervilózních prostorách chronický zánětlivý infiltrát sestávající z histiocytů (> 80 %) a v menší míře z T-lymfocytů. Zánětlivé elementy tvoří obvykle různě objemná ložiska a v řadě případů adherují na povrch vilózního trofoblastu (Obr. 7). Hranicí pro stanovení diagnózy chronické histiocytární intervilositidy je postižení minimálně 5 % intervilózních prostor (61). Zánět bývá zpravidla doprovázen zmnožením perivilózního fibrinoidu, které může být masivní a může představovat dominantní mikroskopický nález. V těchto případech je vhodné ověřit přítomnost zánětlivých elementů imunohistochemickým průkazem CD 68, popř. CD 163 (31,60,61).
Obr. 7. CHIV. A: Chronická zánětlivá celulizace v intervilózních prostorách a depozita perivilózního fibrinoidu obklopující choriové klky (HE, 200x). B: CD68 pozitivní histiocyty v intevilózních prostorách (CD68, 400x). 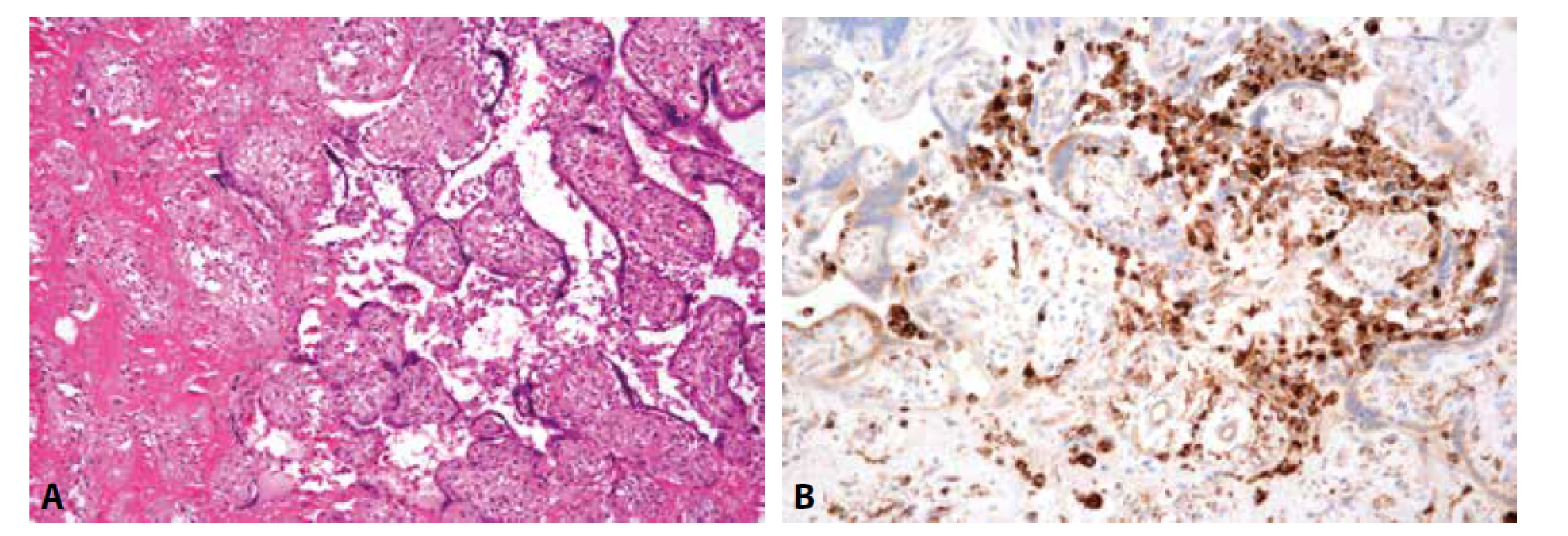
Tab. 4. Chronická histiocytární intervilositida (CHIV) – doporučená klasifikace. 
Při hodnocení zánětu je vhodné kvantifikovat rozsah postižení placentárního parenchymu, což má svůj praktický význam při korelaci histologického nálezu s nálezem klinickým. Podle jedné ze studií lze tento zánět dále klasifikovat jako fokální, mírný či masivní. V případě fokální CHIV zaujímají zánětlivé elementy a perivilózní fibrinoid méně než 10 % intervilózních prostor. Mírný zánět je charakterizován postižením 10 – 50 % intervilózních prostor. Pokud je postiženo více než 50 % intervilózních prostor, je zánět hodnocen jako masivní (62).
CHIV se může vyskytovat současně s VUE, některé práce popisují společný výskyt těchto jednotek až ve 30 %, resp. 47 % případů (55,62).
Do diferenciální diagnózy CHIV vstupují zejména léze charakterizované ložiskovou či difúzní akumulací perivilozního fibrinoidu (Maternal floor infarction, Massive perivillous fibrin deposition, Perivillous fibrin plaque). Společným znakem těchto jednotek je absence signifikantní zánětlivé celulizace (60). CHIV je nutné rovněž odlišit od zánětů infekčního původu. Kromě bakterií, zejména z rodu Listeria, může být zánět intervilózních prostor způsoben i řadou dalších mikroorganismů (např. rod Francisella, Escherichia, Campylobacter atd.). Mikroskopicky však v těchto případech bývá přítomna smíšená zánětlivá celulizace s převahou neutrofilních granulocytů (63). Mononukleární infiltrát v intervilózních prostorách může být někdy součástí zánětu způsobeného CMV (64). CHIV může v některých případech věrně napodobovat placentární malarie. I přesto, že v našich končinách jde o lézi zcela raritní, lze ji při znalosti pozitivní cestovatelské anamnézy rovněž zařadit do diferenciální diagnózy. Zánětlivý infiltrát tvořený histiocyty a neutrofilními granulocyty bývá doprovázen zvýšenou akumulací fibrinoidu v intervilózních prostorách. V placentě lze identifikovat depozita tmavého malarického pigmentu (hemozoinu) a spíše vzácně i trofozoity v napadených erytrocytech (63,65,66). Recentně byla popsána asociace CHIV s infekcí SARS-CoV-2 (67-69), tuto možnost je při současné epidemiologické situaci tedy rovněž důležité vyloučit.
ZÁVĚR
Imunopatologicky podmíněné záněty placenty představují diagnosticky důležitou skupinu lézí, se kterou by měl být obeznámen každý patolog, který se věnuje vyšetřování placent a materiálu z abortů získaných kyretáží dutiny děložní. Tyto chronické záněty mohou být příčinou závažných komplikací a jejich riziko spočívá i v možné recidivě v následujících graviditách. Stanovení správné diagnózy představuje pro klinické lékaře velmi cenné informace, které mohou vysvětlit řadu patologických stavů provázejících graviditu a mohou do jisté míry ovlivnit i management následující gravidity.
PODĚKOVÁNÍ
Práce byla podpořena grantem MŠMT SVV-2021-22 639.
Seznam použitých zkratek
CHIV: chronická histiocytární intervilositida
CMV: cytomegalovirus
CXCL: chemokinový ligand s C-X-C motivem
ETCV: eosinofilní/T-lymfocytární vaskulitida cév choriové plotny (Eosinophilic/T cell Chorionic Vasculitis)
FGR: růstová restrikce plodu (Fetal Growth Restriction)
FNAIT: fetální/neonatální alloimunní trombocytopenie
FVM: fetální vaskulární malperfúze
ICAM-1: intercelulární adhezivní molekula 1 (Intercellular Adhesion Molecule 1)
IUFD: nitroděložní odumření plodu (Intrauterine Fetal Demise)
MHC: hlavní histokompatibilní komplex (Major Histocompatibility Complex)
MMP9: matrixová metaloproteináza 9
PPROM: předčasný odtok plodové vody před termínem porodu (Preterm Premature Rupture of Membranes)
SLE: systémový lupus erythematodes
TLR1: Toll-like Receptor 1
TORCH: toxoplazmóza, ostatní, rubeola, cytomegalovirus, herpes simplex (Toxoplasmosis, Others, Rubella, Cytomegalovirus, Herpesvirus)
Treg: regulační T-lymfocyty
VUE: vilitida neznámé etiologie (Villitis of Unknown Etiology)
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i spoluautorů.
Adresa pro korespondenci:
MUDr. Magdaléna Daumová, Ph.D.
Šiklův ústav patologie LFP UK a FN Plzeň
Edvarda Beneše 1128/13, 305 99 Plzeň
tel.: 377 402 089
e-mail: daumovam@fnplzen.cz
Zdroje
1. Redline RW. Villitis of unknown etiology: noninfectious chronic villitis in the placenta. Hum Pathol 2007; 38(10): 1439-1446.
2. Redline RW, Ravishankar S, Bagby CM, Saab ST, Zarei S. Four major patterns of placental injury: a stepwise guide for understanding and implementing the 2016 Amsterdam consensus. Mod Pathol 2021; 34(6): 1074-1092.
3. Redline RW. Classification of placental lesions. Am J Obstet Gynecol 2015; 213(4 Suppl): S21-28.
4. Chen A, Roberts DJ. Placental pathologic lesions with a significant recurrence risk - what not to miss! APMIS 2018; 126(7): 589-601.
5. Becroft DM, Thompson JM, Mitchell EA. Placental villitis of unknown origin: epidemiologic associations. Am J Obstet Gynecol 2005; 192(1): 264-271.
6. Boog G. Chronic villitis of unknown etiology. Eur J Obstet Gynecol Reprod Biol 2008; 136(1): 9-15.
7. Nowak C, Joubert M, Jossic F, et al. Perinatal prognosis of pregnancies complicated by placental chronic villitis or intervillositis of unknown etiology and combined lesions: About a series of 178 cases. Placenta 2016; 44 : 104 - 108.
8. Derricott H, Jones RL, Greenwood SL, Batra G, Evans MJ, Heazell AE. Characterizing Villitis of Unknown Etiology and Inflammation in Stillbirth. Am J Pathol 2016; 186(4): 952-961.
9. Tamblyn JA, Lissauer DM, Powell R, Cox P, Kilby MD. The immunological basis of villitis of unknown etiology - review. Placenta 2013; 34(10): 846-855.
10. Perni SC, Predanic M, Cho JE, Baergen RN. Placental pathology and pregnancy outcomes in donor and non-donor oocyte in vitro fertilization pregnancies. J Perinat Med 2005; 33(1): 27-32.
11. Leon-Garcia SM, Roeder HA, Nelson KK, et al. Maternal obesity and sex-specific differences in placental pathology. Placenta 2016; 38 : 33-40.
12. Kim CJ, Romero R, Chaemsaithong P, Kim JS. Chronic inflammation of the placenta: definition, classification, pathogenesis, and clinical significance. Am J Obstet Gynecol 2015; 213(4 Suppl): S53-69.
13. Myerson D, Parkin RK, Benirschke K, Tschetter CN, Hyde SR. The pathogenesis of villitis of unknown etiology: analysis with a new conjoint immunohistochemistry-in situ hybridization procedure to identify specific maternal and fetal cells. Pediatr Dev Pathol 2006; 9(4): 257-265.
14. Redline RW, Patterson P. Villitis of unknown etiology is associated with major infiltration of fetal tissue by maternal inflammatory cells. Am J Pathol 1993; 143(2): 473-479.
15. Verdijk RM, Kloosterman A, Pool J, et al. Pregnancy induces minor histocompatibility antigen-specific cytotoxic T cells: implications for stem cell transplantation and immunotherapy. Blood 2004; 103(5): 1961-1964.
16. Kinder JM, Turner LH, Stelzer IA, et al. CD8(+) T Cell Functional Exhaustion Overrides Pregnancy-Induced Fetal Antigen Alloimmunization. Cell reports 2020; 31(12): 107784.
17. Tsuda S, Nakashima A, Shima T, Saito S. New Paradigm in the Role of Regulatory T Cells During Pregnancy. Frontiers in immunology 2019; 10): 573.
18. Jorgensen N, Persson G, Hviid TVF. The Tolerogenic Function of Regulatory T Cells in Pregnancy and Cancer. Frontiers in immunology 2019; 10): 911.
19. Katzman PJ, Murphy SP, Oble DA. Immunohistochemical analysis reveals an influx of regulatory T cells and focal trophoblastic STAT-1 phosphorylation in chronic villitis of unknown etiology. Pediatr Dev Pathol 2011; 14(4): 284-293.
20. Khong TY, Mooney EE, Ariel I, et al. Sampling and Definitions of Placental Lesions: Amsterdam Placental Workshop Group Consensus Statement. Arch Pathol Lab Med 2016; 140(7): 698-713.
21. Parast M. Chronic Villitis/Villitis of Unknown Etiology. In: Redline RW, Boyd TK, Roberts DJ, eds. Placental and Gestational Pathology (Diagnostic Pediatric Pathology. Cambridge: Cambridge University Press; 2017 : 137-144.
22. Redline RW, Ariel I, Baergen RN, et al. Fetal vascular obstructive lesions: nosology and reproducibility of placental reaction patterns. Pediatr Dev Pathol 2004; 7(5): 443-452.
23. Redline RW. Severe fetal placental vascular lesions in term infants with neurologic impairment. Am J Obstet Gynecol 2005; 192(2): 452-457.
24. Ernst LM, Linn RL, Minturn L, Miller ES. Placental Pathologic Associations With Morbidly Adherent Placenta: Potential Insights Into Pathogenesis. Pediatr Dev Pathol 2017; 20(5): 387-393.
25. Katzman PJ, Blitman J, Metlay LA. Basal Chronic Villitis and Disorders of the Placental Basal Plate: A Possible Immunological Link Between Hypertensive Disorders of Pregnancy and Morbidly Adherent Placenta. Pediatr Dev Pathol 2019; 22(4): 334-339.
26. Kim CJ, Romero R, Kusanovic JP, et al. The frequency, clinical significance, and pathological features of chronic chorioamnionitis: a lesion associated with spontaneous preterm birth. Mod Pathol 2010; 23(7): 1000-1011.
27. Gersell DJ, Phillips NJ, Beckerman K. Chronic chorioamnionitis: a clinicopathologic study of 17 cases. Int J Gynecol Pathol 1991; 10(3): 217-229.
28. Jacques SM, Qureshi F. Chronic chorioamnionitis: a clinicopathologic and immunohistochemical study. Hum Pathol 1998; 29(12): 1457-1461.
29. Lee J, Romero R, Xu Y, et al. Maternal HLA panel-reactive antibodies in early gestation positively correlate with chronic chorioamnionitis: evidence in support of the chronic nature of maternal anti-fetal rejection. Am J Reprod Immunol 2011; 66(6): 510-526.
30. Maymon E, Romero R, Bhatti G, et al. Chronic inflammatory lesions of the placenta are associated with an up-regulation of amniotic fluid CXCR3: A marker of allograft rejection. J Perinat Med 2018; 46(2): 123-137.
31. Heerema-McKenney A, Popek EJ, De Paepe M. Diagnostic Pathology: Placenta (2nd Edition). Philadelphia, PA: Elsevier; 2019 : 146-167.
32. Jacques S, Quereshi F. Chronic Inflammatory Lesions Sometimes Associated with Villitis of Unknown Etiology (VUE). In: Redline RW, Boyd TK, Roberts DJ, eds. Placental and Gestational Pathology (Diagnostic Pediatric Pathology. Cambridge: Cambridge University Press; 2017 : 145-151.
33. Khong TY, Bendon RW, Qureshi F, et al. Chronic deciduitis in the placental basal plate: definition and interobserver reliability. Hum Pathol 2000; 31(3): 292-295.
34. Kraus FT, Redline RW, Gersell DJ, Nelson DM, Dicke JM. Inflammation and infection. In: Kaplan CG. Placental Pathology: Atlas of Non-tumor Pathology (First Series, Fascicle 3). Wahington (DC): American Registry of Pathology; 2004 : 75-115.
35. Redline RW, Zaragoza M, Hassold T. Prevalence of developmental and inflammatory lesions in nonmolar first-trimester spontaneous abortions. Hum Pathol 1999; 30(1): 93-100.
36. Lee JY, Hong JS, Kim EN, et al. Placental C4d as a common feature of chromosomally normal and abnormal miscarriages. Virchows Arch 2014; 464(5): 613-620.
37. Gundogan F, Bianchi DW, Scherjon SA, Roberts DJ. Placental pathology in egg donor pregnancies. Fertil Steril 2010; 93(2): 397-404.
38. Maroun LL, Mathiesen L, Hedegaard M, Knudsen LE, Larsen LG. Pathologic evaluation of normal and perfused term placental tissue. Pediatr Dev Pathol 2014; 17(5): 330-338.
39. Stevens DU, de Nobrega Teixeira JA, Spaanderman MEA, Bulten J, van Vugt JMG, Al-Nasiry S. Understanding decidual vasculopathy and the link to preeclampsia: A review. Placenta 2020; 97 : 95-100.
40. Fraser RB, Wright JR, Jr. Eosinophilic/T-cell chorionic vasculitis. Pediatr Dev Pathol 2002; 5(4): 350-355.
41. Jacques SM, Qureshi F, Kim CJ, et al. Eosinophilic/ T-cell chorionic vasculitis: a clinicopathologic and immunohistochemical study of 51 cases. Pediatr Dev Pathol 2011; 14(3): 198-205.
42. Katzman PJ, Oble DA. Eosinophilic/T-cell chorionic vasculitis and chronic villitis involve regulatory T cells and often occur together. Pediatr Dev Pathol 2013; 16(4): 278-291.
43. Katzman PJ. Chorionic Plate Chronic Inflammatory Lesions Including Eosinophilic/T-cell Chorionic Vasculitis. In: Khong TY, Mooney EE, Nikkels PGJ, Morgan TK, Gordijn SJ., eds. Pathology of the Placenta. A Practical Guide. Springer, Cham: Springer Nature Switzerland AG; 2019 : 109-113.
44. Katzman PJ, Li L, Wang N. Identification of Fetal Inflammatory Cells in Eosinophilic/T-cell Chorionic Vasculitis Using Fluorescent In Situ Hybridization. Pediatr Dev Pathol 2015; 18(4): 305-309.
45. Katzman PJ, Oble DA. Eosinophilic/T-cell chorionic vasculitis and chronic villitis involve regulatory T cells and often occur together. Pediatr Dev Pathol 2013; 16(4): 278-291.
46. Boyd TK, Redline RW. Chronic histiocytic intervillositis: a placental lesion associated with recurrent reproductive loss. Hum Pathol 2000; 31(11): 1389-1396.
47. Vardi L, Paterson H, Hung NA. Successful pregnancy following treatment of recurrent chronic histiocytic intervillositis. BMJ case reports 2017; 2017.
48. Mekinian A, Costedoat-Chalumeau N, Masseau A, et al. Chronic histiocytic intervillositis: outcome, associated diseases and treatment in a multicenter prospective study. Autoimmunity 2015; 48(1): 40-45.
49. Bos M, Nikkels PGJ, Cohen D, et al. Towards standardized criteria for diagnosing chronic intervillositis of unknown etiology: A systematic review. Placenta 2018; 61 : 80-88.
50. Revaux A, Mekinian A, Nicaise P, et al. Antiphospholipid syndrome and other autoimmune diseases associated with chronic intervillositis. Arch Gynecol Obstet 2015; 291(6): 1229-1236.
51. Dubruc E, Lebreton F, Giannoli C, et al. Placental histological lesions in fetal and neonatal alloimmune thrombocytopenia: A retrospective cohort study of 21 cases. Placenta 2016; 48 : 104-109.
52. Tchakarov A, Coffey A, Tatevian N. Neonatal alloimmune thrombocytopenia associated with massive chronic intervillositis: a case report and review of the literature. Pediatr Dev Pathol 2013; 16(1): 32-34.
53. Marchaudon V, Devisme L, Petit S, Ansart - Franquet H, Vaast P, Subtil D. Chronic histiocytic intervillositis of unknown etiology: clinical features in a consecutive series of 69 cases. Placenta 2011; 32(2): 140-145.
54. Contro E, deSouza R, Bhide A. Chronic intervillositis of the placenta: a systematic review. Placenta 2010; 31(12): 1106-1110.
55. Labarrere CA, Hardin JW, Haas DM, Kassab GS. Chronic villitis of unknown etiology and massive chronic intervillositis have similar immune cell composition. Placenta 2015; 36(6): 681-686.
56. Labarrere CA, Bammerlin E, Hardin JW, Dicarlo HL. Intercellular adhesion molecule-1 expression in massive chronic intervillositis: implications for the invasion of maternal cells into fetal tissues. Placenta 2014; 35(5): 311 - 317.
57. Hussein K, Stucki-Koch A, Kreipe H, Feist H. Expression of Toll-Like Receptors in Chronic Histiocytic Intervillositis of the Placenta. Fetal and pediatric pathology 2015; 34(6): 407-412.
58. Reus AD, van Besouw NM, Molenaar NM, et al. An immunological basis for chronic histiocytic intervillositis in recurrent fetal loss. Am J Reprod Immunol 2013; 70(3): 230-237.
59. Freitag L, von Kaisenberg C, Kreipe H, Hussein K. Expression analysis of leukocytes attracting cytokines in chronic histiocytic intervillositis of the placenta. International journal of clinical and experimental pathology 2013; 6(6): 1103-1111.
60. Redline RW. Chronic Histiocytic Intervillositis. In: Redline RW, Boyd TK, Roberts DJ, eds. Placental and Gestational Pathology (Diagnostic Pediatric Pathology). Cambridge: Cambridge University Press; 2017 : 152-156.
61. Mooney EE. Chronic Histiocytic Intervillositis. In: Khong TY, Mooney EE, Nikkels PGJ, Morgan TK, Gordijn SJ., eds. Pathology of the Placenta. A Practical Guide. Springer, Cham: Springer Nature Switzerland AG; 2019 : 207-211.
62. Parant O, Capdet J, Kessler S, Aziza J, Berrebi A. Chronic intervillositis of unknown etiology (CIUE): relation between placental lesions and perinatal outcome. Eur J Obstet Gynecol Reprod Biol 2009; 143(1): 9-13.
63. Heerema-McKenney A. Defense and infection of the human placenta. APMIS 2018; 126(7): 570-588.
64. Taweevisit M, Sukpan K, Siriaunkgul S, Thorner PS. Chronic histiocytic intervillositis with cytomegalovirus placentitis in a case of hydrops fetalis. Fetal and pediatric pathology 2012; 31(6): 394-400.
65. Ordi J, Ismail MR, Ventura PJ, et al. Massive chronic intervillositis of the placenta associated with malaria infection. Am J Surg Pathol 1998; 22(8): 1006-1011.
66. Carmona-Fonseca J, Arango E, Maestre A. Placental malaria in Colombia: histopathologic findings in Plasmodium vivax and P. falciparum infections. Am J Trop Med Hyg 2013; 88(6): 1093-1101.
67. Hosier H, Farhadian SF, Morotti RA, et al. SARS-CoV-2 infection of the placenta. J Clin Invest 2020; 130(9): 4947-4953.
68. Linehan L, O’Donoghue K, Dineen S, White J, Higgins JR, Fitzgerald B. SARS-CoV-2 placentitis: An uncommon complication of maternal COVID-19. Placenta 2021; 104 : 261-266.
69. Schwartz DA, Morotti D. Placental Pathology of COVID-19 with and without Fetal and Neonatal Infection: Trophoblast Necrosis and Chronic Histiocytic Intervillositis as Risk Factors for Transplacental Transmission of SARSCoV - 2. Viruses 2020; 12(11).
Štítky
Patologie Soudní lékařství Toxikologie
Článek 'NEUROPATOLOGIEČlánek 'HEPATOPATOLOGIEČlánek 'PULMOPATOLOGIEČlánek 'ORTOPEDICKÁ PATOLOGIEČlánek 'PATOLOGIE GITČlánek 'PATOLOGIE ORL OBLASTIČlánek 'GYNEKOPATOLOGIEČlánek 'UROPATOLOGIEČlánek 'KARDIOPATOLOGIEČlánek 'CYTODIAGNOSTIKAČlánek 'HEMATOPATOLOGIEČlánek Pathologia mutansČlánek Jaká je vaše diagnóza?
Článek vyšel v časopiseČesko-slovenská patologie

2021 Číslo 4-
Všechny články tohoto čísla
- Patologie placenty – nové a méně známé jednotky
- Placenta je tichým svědkem gravidity, jen je potřeba ho donutit mluvit
- 'NEUROPATOLOGIE
- 'HEPATOPATOLOGIE
- 'PULMOPATOLOGIE
- 'ORTOPEDICKÁ PATOLOGIE
- 'PATOLOGIE GIT
- 'PATOLOGIE ORL OBLASTI
- 'GYNEKOPATOLOGIE
- 'UROPATOLOGIE
- 'KARDIOPATOLOGIE
- 'CYTODIAGNOSTIKA
- Morfologické nálezy v placentě asociované s infekcí SARS-CoV-2
- Placentární mezenchymální dysplázie – morfologie a diferenciální diagnostika
- Chronické záněty placenty neinfekční etiologie
- Neimunitní hydrops plodu asociovaný se dvěma hemangiomy pupečníku a vaskulární malformací mesocolon transversum - popis případu
- 'HEMATOPATOLOGIE
- Symplastický hemangiom v podkoží po adjuvantní radioterapii: kazuistické sdělení
- Pathologia mutans
- Jaká je vaše diagnóza?
- Profesor Jaroslav Hlava a jeho následníci – vzpomínka u příležitosti 100. výročí otevření Hlavova ústavu
- Hlavův ústav slaví stoleté výročí založení
- Jaká je vaše diagnóza? Odpověď: Karcinom prsu metastazující do placenty
- Prof. MUDr. František Fakan, CSc. in memoriam
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chronické záněty placenty neinfekční etiologie
- Morfologické nálezy v placentě asociované s infekcí SARS-CoV-2
- Patologie placenty – nové a méně známé jednotky
- Placentární mezenchymální dysplázie – morfologie a diferenciální diagnostika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



