-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Terapeutická endosonografia – súčasné postavenie
Therapeutic endosonography – current position
Technological advances in echoendoscopes and their accessories has contributed to the continuing employment of therapeutic endosonography (EUS). EUS-guided therapy can be divided into EUS-guided drainage/anastomosis therapy and EUS-guided injection therapy. EUS-guided transmural drainage of pancreatic fluid collections and EUS-guided coeliac plexus neurolysis are now well established therapeutic techniques. Another technically and clinically effective procedure is EUS-guided drainage of abdominal (non-pancreatic) and pelvic collections adjacent to the gastric, duodenal and rectal wall (periproctal, hepatal, and subphrenic abscesses), although the data regarding these procedures are limited. EUS-guided biliary drainage/anastomosis (EUS-hepaticogastrostomy and EUS-choledocholduodenostomy) in the hands of an experienced interventional endoscopist with the support of an interventional radiologist and a surgeon is an alternative to percutaneous transhepatic biliary drainage. EUS-guided pancreaticogastrostomy is more technically challenging and has higher complication rates. In the case of conventional bile duct or pancreatic duct cannulation failure, the EUS-guided rendezvous technique is an option for achieving successful cannulation. EUS-guided antitumorous therapy including EUS-alcohol ablation of pancreatic cystic neoplasia is currently the object of ongoing clinical studies. Potential uses of therapeutic EUS in the future could be EUS-guided vascular therapy and EUS-guided gastroenteroanastomosis. The aim of this article is to provide up-to-date information on the current position of therapeutic EUS in clinical practice using evidence-based data in the literature.
Key words:
endosonography – endoscopic ultrasound-guided therapy – endosopic pseudocystogastrostomy
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
12. 4. 2016Accepted:
20. 5. 2016
Autoři: M. Kliment
Působiště autorů: Gastroenterologie und Hepatologie, Klinik für Innere Medizin, Vivantes Klinikum Spandau, Berlin, Německo
Vyšlo v časopise: Gastroent Hepatol 2016; 70(3): 208-216
Kategorie: Digestivní endoskopie: přehledová práce
doi: https://doi.org/10.14735/amgh2016208Souhrn
Technologickým rozvojom echoendoskopov a akcesórií dochádza k rozširujúcemu sa uplatneniu endosonografie (EUS) v terapii. EUS-navigovanú terapiu možno rozdeliť na EUS-navigovanú drenáž/ anastomózu a EUS-navigovanú injekčnú terapiu. Medzi etablované EUS-navigované výkony patria EUS-navigovaná transmurálna drenáž pankreatických tekutinových kolekcií a EUS-navigovaná celiakálna gangliolýza. Technicky a klinicky efektívna je aj EUS-navigovaná drenáž abdominálních (nepankreatických) a pelvických kolekcií naliehajúcich na stenu žalúdka, duodena a rekta (periproktálnych, hepatálnych a subfrenických abscesov), hoci literárne dáta sú zatiaľ obmedzené. EUS-navigovaná drenáž žlčových ciest je v rukách skúseného endoskopistu so zázemím intervenčního radiológa a chirurga možnou alternatívou perkutánnej transhepatálnej biliárnej drenáže. EUS-navigovaná drenáž pankreatického vývodu je technicky náročnejšia s vyšším rizikom komplikácií. Pri neúspešnej kanylácii žlčovodu alebo pankreatického vývodu je v obidvoch prípadoch efektívnou EUS-navigovaná „rendezvous“ technika. EUS-navigovaná antitumorózna terapia a EUS-navigovaná ablácia cystických neoplázií pankreasu je v súčasnosti predmetom klinických štúdií. Potenciálne využitie EUS predstavuje EUS-navigovaná vaskulárna terapia, atraktívnou by mohla byť EUS-navigovaná gastroenteroanastomóza. Cieľom tohoto prehľadového článku je na základe publikovaných dát informovať o súčasnom postavení terapeutickej EUS.
Kľúčové slová:
endosonografia – endosonograficky navigovaná terapia – endoskopická pseudocystogastrostómiaÚvod
Endosonografia (EUS) sa postupne vyvinula z čisto diagnostickej na terapeutickú intervenčnú endoskopickú metódu predstavujúcu minimálne invazívnu alternatívu intervenčným radiologickým a chirurgickým technikám. Zásadný pokrok nastal vyvinutím lineárneho echoendoskopu umožňujúceho endosonografickú vizualizáciu ihly, prípadne iného terapeutického akcesória zasunutého pracovným kanálom echoendoskopu do cieľovej štruktúry. To ďalej umožnilo vznik cielenej terapie. Cieľom tejto práce je informovať o súčasných možnostiach EUS-navigovanej terapie s ohľadom na dostupné vedecké dáta.
EUS-navigované intervenčné metódy možno zjednodušene rozdeliť na dve základné skupiny: 1. EUS-navigovanú drenáž a anastomózu a 2. EUS-navigovanú injekčnú terapiu (EUS-FNI – EUS guided fine needle injection).
Do obidvoch skupín patria viaceré typy terapeutických výkonov, ktoré našli doposiaľ rozličné uplatnenie v klinickej praxi a sú uvedené v tab. 1.
Tab. 1. Prehľad jednotlivých typov EUS-navigovanej terapie. Tab. 1. Summary of the types of EUS-guided therapy. 
EUS-navigovaná drenáž pankreatických tekutinových kolekcií
Najčastejšou a doposiaľ jedinou v klinickej praxi široko etablovanou technikou EUS-navigovanej drenáže je drenáž pankreatických tekutinových kolekcií (PFC – pancreas fluid collections) – pseudocysty pankreasu a ohraničenej pankreatickej nekrózy (WOPN – walled-off pancreatic necrosis), ktoré sa objavujú najčastejšie ako komplikácie akútnej pankreatitidy (AP).
Technika spočíva v endosonografickej vizualizácii miesta optimálneho na drenáž (vzdialenosť steny žalúdka a pseudocysty ≤ 1 cm, vylúčená interpozícia cievy alebo varixu), punkcii tekutinovej kolekcie pomocou 19G aspiračnej ihly alebo ihlového noža cystotómu pod EUS-kontrolou, aspirácii tekutiny, zobrazení dutiny pseudocysty kontrastnou látkou, zavedení vodiča do dutiny kolekcie, vytvorení kanála stómie pomocou cystotómu, bužiového dilatátora alebo balóna (dilatácia na priemer 8 – 10 mm) a implantácii buď viacerých plastových „double-pigtail“ stentov (najčastejšie tri stenty s priemerom 10 Fr) alebo jedného celoobaleného samoexpandibilného kovového stentu (SEMS – self-expanding metal stents) do dutiny pseudocysty alebo WOPN (obr. 1, 2).
Obr. 1. EUS-trangastrálna drenáž WOPN – punkcia a zobrazenie dutiny nekrózy kontrastnou látkou. Fig. 1. EUS-guided transgastric drainage of WOPN – puncture and imaging of the WOPN cavity with a contrast. 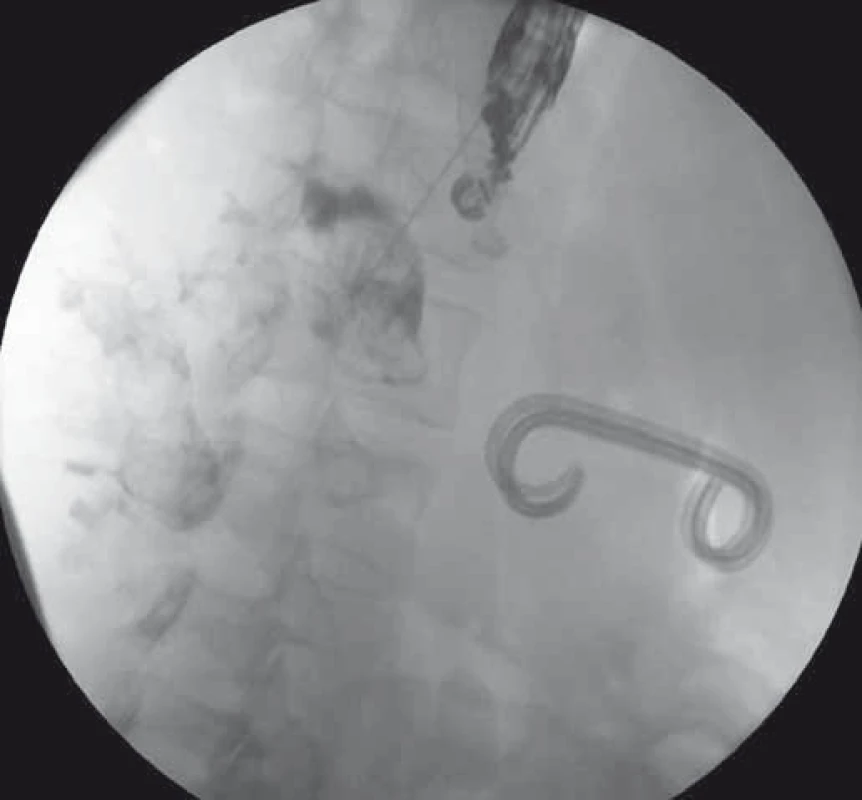
Obr. 2. EUS-transgastrálna drenáž WOPN pomocou FC-SEMS (NAGI™ stent) – odtok skalenenej tekutiny z dutiny nekrózy po implantácii stentu. Fig.2. EUS-guided transgastric drainage of WOPN using a FC-SEMS (NAGI™ stent) – outfl ow of a turbid liquid out of the necrotic cavity after stent implantation. 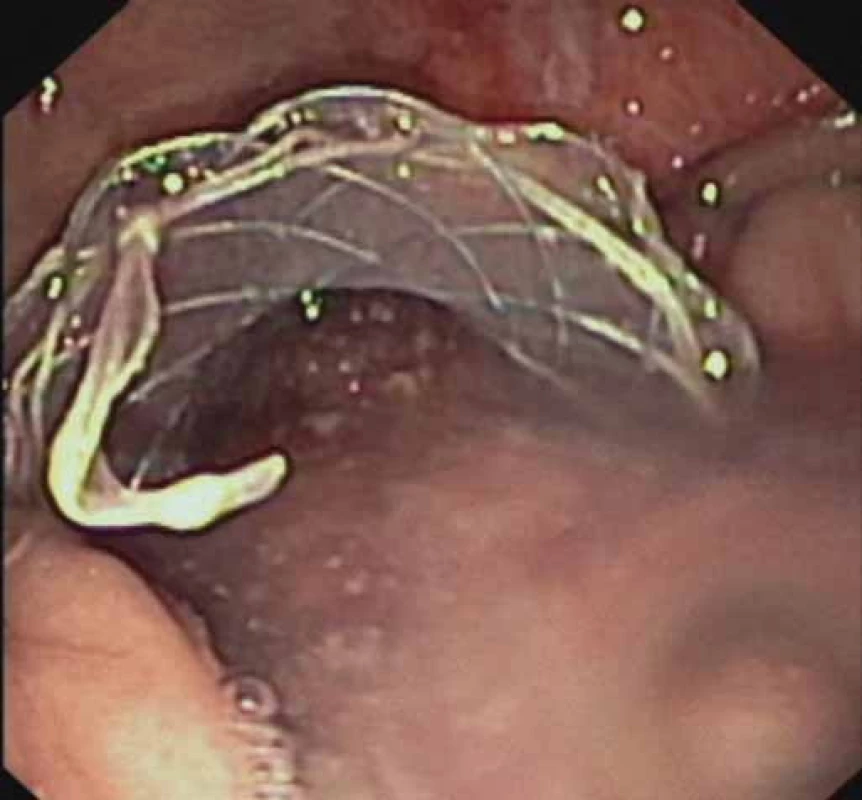
Doposiaľ publikované štúdie zaoberajúce sa problematikou EUS-navigované drenáže PFC zahrňujú celkovo 2 115 pacientov, pričom technický a klinický úspech v prácach s viac ako 10 pacientami je udávaný 97 a 90 %, výskyt komplikácií 17 % a recidíva pseudocysty 8 % [1]. Medzi najčastejšie komplikácie patrí krvácanie, superinfekcia, migrácia stentov, perforácia s nutnosťou chirurgickej liečby a pneumoperitoneum. Výhoda EUS-navigovanej drenáže oproti chirurgickej drenáži pseudocysty spočíva v kratšom čase hospitalizácie a nižšej cene liečby. Riziko komplikácií a klinický efekt sú podľa randomizovaných štúdií u oboch techník identické [2]. Transmurálna drenáž pseudocysty pod EUS-kontrolou má vyšší technický, klinický úspech a lepší bezpečnostný profil v porovnaní s konvenčnou drenážou bez EUS-kontroly, vykonanej duodenoskopom [3 – 5]. Konvenčná endoskopická drenáž zlyháva pri neprítomnom vyklenutí steny žalúdka alebo duodena (tzv. buldgingu). V súčasnosti je jednoznančne preferovaná technika EUS-navigovanej drenáže. Pri použití terapeutického echoendoskopu je možné zavádzať stenty s priemerom až 10 Fr a SEMS. Na zlepšenie drenáže boli vyvinuté špeciálne celoobalené kovové stenty (FC-SEMS – fully covered SEMS). Tzv. NAGI™ stent (Taewoong-Medical Co, Južná Kórea) a AXIOS™ stent (Boston Scientific, USA) majú širší lumen a špeciálny antimigračný mechanizmus na oboch koncoch. Rozvinutým stentom možno gastroskopom prenikať do dutiny WOPN a opakovane vykonávať nekrektómiu. V súčasnosti je dostupný NAGI™ stent s dĺžkou 10, 20 alebo 30 mm a vnútorným priemerom 10, 12, 14 a 16 mm. K dispozícii sú však zatiaľ limitované dáta zo sérií pacientov. Hoci sa NAGI™ stent ukazuje v klinických štúdiách ako efektívny, u 24 % pacientov môže nastať jeho dysfunkcia v dôsledku jeho neúspešného zavedenia (7,4 %), migrácie stentu do dutiny (1,9 %) vrátane oneskorenej migrácie (11,1 %), prerastania stentu granulačným tkanivom znemožňujúcim jeho extrakciu (3,7 %) [6]. EUS-navigovaná drenáž PFC s použitím AXIOS™ stentu sa ukazuje ako technicky a klinicky efektívna, pričom v jednej publikovanej sérii sa nevyskytla dysfunkcia, migrácia alebo prerastanie stentu u žiadneho z deviatich pacientov [7].
Použitie nazocystického drénu (spolu s transmurálnymi drénmi) s kontinuálnym preplachovaním dutiny WOPN vedie k zníženiu rizika oklúzie drénov a zlepšeniu krátkodobých klinických výsledkov liečby, nie je však potrebné v prípade pseudocysty [8].
Endoskopická nekrektómia
Debridement pankreatickej nekrózy bol donedávna štandardne vykonávaný chirurgicky. Endoskopická nekrektómia predstavuje v súčasnosti menej invazívnu alternatívu. Po klasickej EUS-navigovanej drenáži PFC sa dilatuje kanál stómie balónom na 15 – 20 mm a po zavedení gastroskopu do dutiny nekrózy sa mechanicky odstraňujú nekrózy pomocou Dormia košíka alebo extrakčnej sieťky. Dutina nekrózy sa naviac preplachuje fyziologickým roztokom. Na konci nekrektómie sa znovu zavedú tri double-pigtail drény, prípadne aj nazocystický drén. Nekrektómia sa opakuje v niekoľkodňových intervaloch až do úplného odstránenia nekróz (obr. 3) s dosiahnutím viabilného granulačního tkaniva na spodine (obr. 4). Pri použití vyššie spomenutých špeciálne upravených SEMS sa tieto neodstraňujú a do dutiny WOPN sa preniká endoskopom cez lumen stentu. U 283 doposiaľ publikovaných pacientov s EUS-navigovanou nekrektómiou boli na úplnú rezolúciu WOPN potrebné v priemere štyria sedenia nekrektómie. Metóda má vysoký technický (100 %) a klinický (88 %) úspech, riziko komplikácií však nie je zanedbateľné (28 %) [1]. Napriek tomu je EUS-navigovaná nekrektómia výhodnejšia ako klasická chirurgická nekrektómia vzhľadom na nižší výskyt proinflamatórnej odpovede, orgánového zlyhania a komplikácií [9].
Obr. 3. Endoskopická nekrektómia pomocou Dormia košíka. Fig. 3. Endoscopic necrectomy using a Dormia basket. 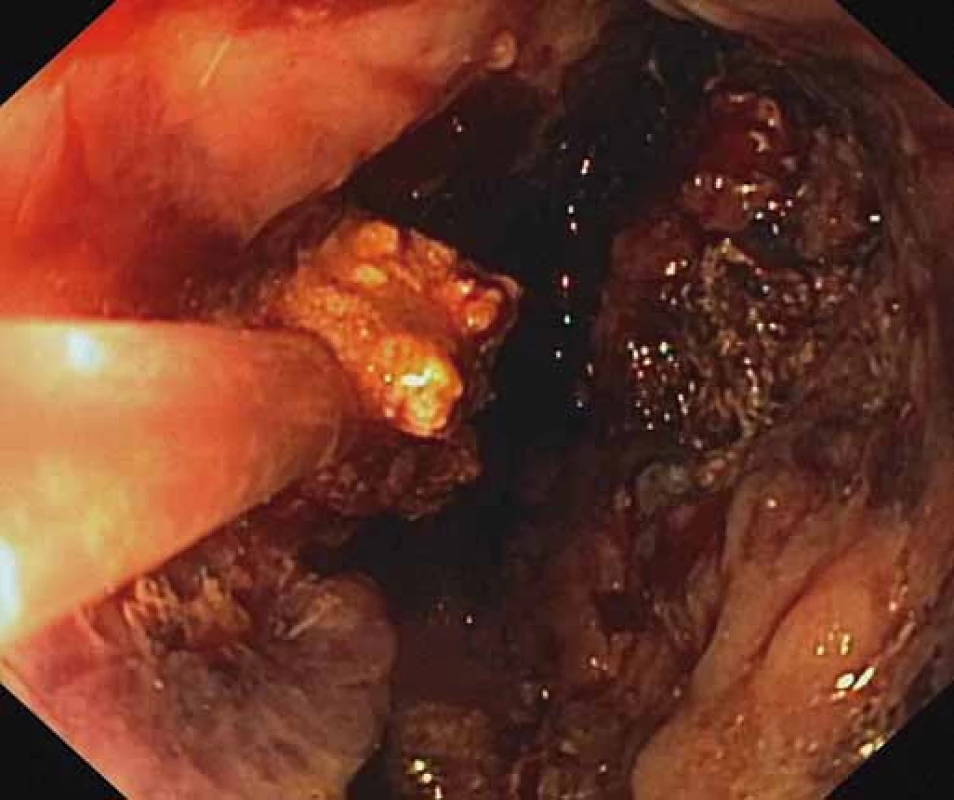
Obr. 4. Viabilné granulačné tkanivo na spodine nekrózy po úspešnej nekrektómii. Fig. 4. Viable granulation tissue after a successful necrectomy. 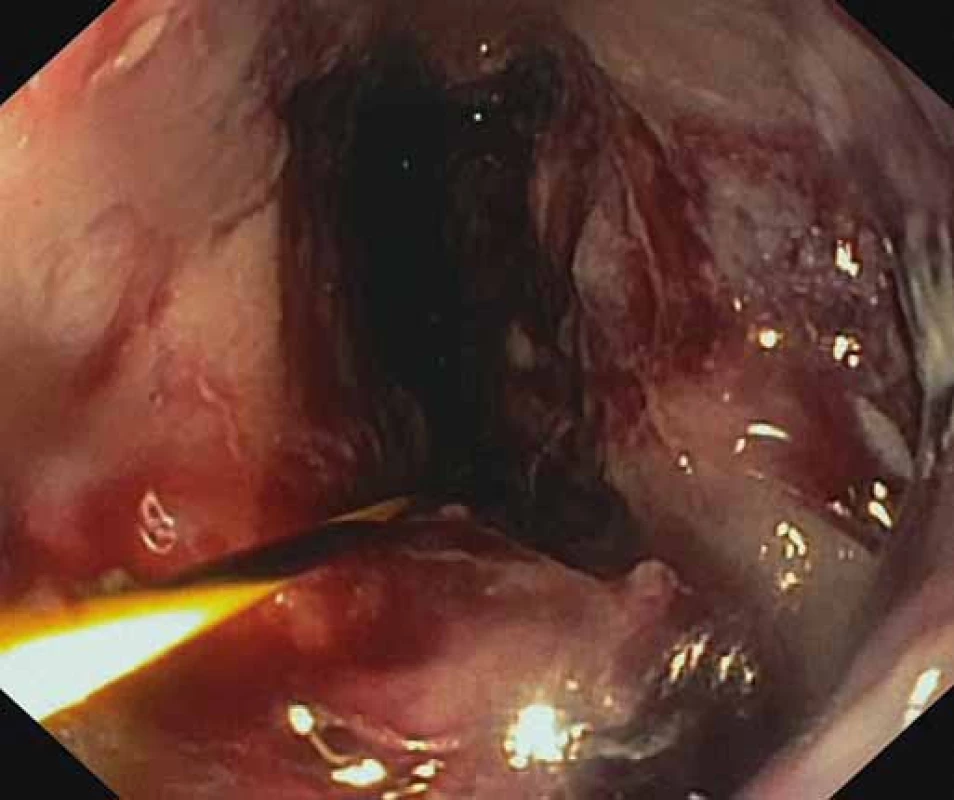
EUS-navigovaná biliárna drenáž
Pri biliárnej obštrukcii a neúspešnej kanylácii žlčovodu pomocou endoskopickej retrográdnej cholangiopankreatikografie (ERCP) alebo nedostupnej Vaterskej papile sú ďalšími alternatívami liečby perkutánna transhepatálna drenáž (PTD), chirurgický bypass na žlčových cestách alebo EUS-navigovaná biliárna drenáž (EUS-BD). Pri EUS-BD sú k dispozícii nasledovné techniky:
- rendezvous technika s transpapilárnym antegrádnym zavedením vodiča intrahepatálnym alebo extrahepatálnym prístupom,
- transluminálny stenting transgastricky – EUS-hepatikogastrostómia (HGS),
- transluminálny stenting transduodenálne – EUS choledochoduodenostómia (CDS).
Pod EUS-kontrolou je vykonanátransgastrálna punkcia dilatovaného ľavého ductus hepaticus v segmente II alebo III (EUS-HGS) alebo transduodenálna punkcia žlčovodu (EUS-CDS) s použitím aspiračnej ihly s priemerom 19 alebo 22 G. Po vytvorení cholangiogramu (obr. 5) je ihlou do žlčovodu zavedený vodič s priemerom 0,035 alebo 0,025. Na vytvorenie kanála stómie je možné použiť ERCP kanylu, cystotóm s priemerom 6 – 8,5 Fr (v prípade EUS-HGS), bužiový dilatátor (Soehendra, Cook Endoscopy, USA), dilatačný balón s priemerom 4 – 6 mm (Hurricane RX, Boston Scientific, USA). Nakoniec je do kanála stómie vložený buď plastový stent s priemerom 5 – 10 Fr alebo povlečený SEMS s priemerom 8 – 10 mm (obr. 6). Na vytvorenie EUS-CDS je výhodný AXIOS™ stent. Na EUS-HGS bol vyvinutý špeciálne upravený SEMS, tzv. GIOBOR™ stent (Taewoong Medical, Južná Kórea), ktorý má jednu polovicu nepovlečenú (lokalizovanú v intrahepatálnom žlčovode) a druhú polovicu povlečenú (lokalizovanú v kanále stómie a stene žalúdka). Povlečená časť znižuje riziko biliárneho leaku, nepovlečená časť fixuje stent, zabraňuje dislokácii a obturácii periférnych žlčovodov stentom.
Obr. 5. EUS-HGS – cholangiogram po transgastrickej punkcii ľavého ductus hepaticus u pacientky s Klatskinovým tumorom, pôvodný SEMS a plastový stent v žlčovode. Fig. 5. EUS-HGS – cholangiogram after transgastric puncture of the left hepatic duct in a patient with Klatskin tumour, SEMS and plastic stent in the bile duct. 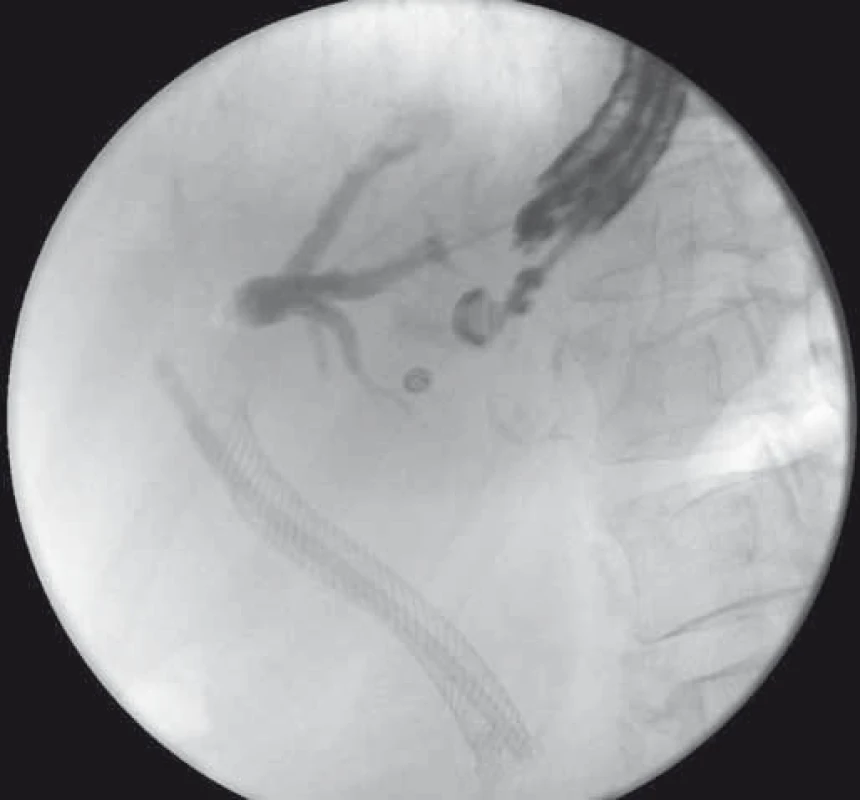
Obr. 6. EUS-HGS – transgastricky zavedený SEMS v ľavom ductus hepaticus. Fig. 6. EUS-HGS – transgastrically deployed SEMS in the left hepatic duct. 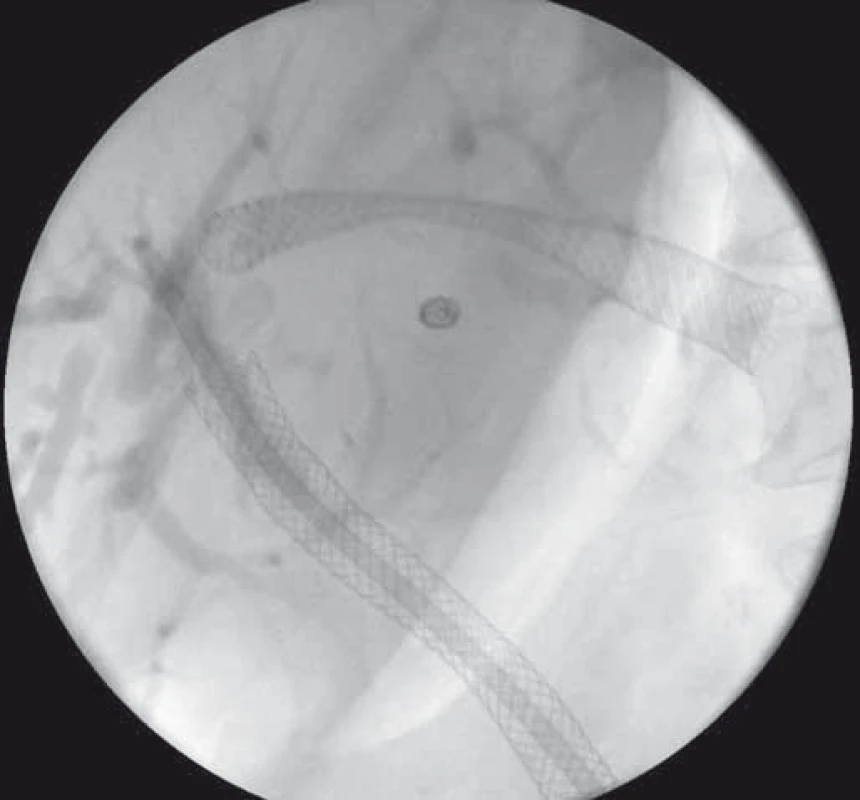
Nedávno bola popísaná nová metóda tzv. antegrádneho stentingu, ktorý možno vykonať transgastricky alebo transduodenálne. Po vytvorení transgastrálneho alebo transduodenálneho prístupu do žlčových ciest sa vodič zavedie cez stenózu žlčovodu a papilu až do duodena. Následne sa antegrádne do stenózy zavedie a vloží SEMS, ktorý distálne prechádza papilou až do duodena. Nakoniec sa do vytvorenej fistuly vloží druhý plastový alebo metalický stent, ktorý zabráni leaku žlče. Metóda je technicky vysoko efektívna (100 %), literárne dáta sú však obmedzené len na niekoľko kazuistík a tri série s maximálnym počtom päť pacientov.
V literatúre bolo doposiaľ celkovo publikovaných 1 127 prípadov EUS-BD s technickým úspechom 92 % (EUS-CDS) až 95 % (EUS-HGS) a klinickým úspechom 88 % [1]. Komplikácie sa vyskytujú u 15 – 24 % pacientov, pričom niektoré môžu byť klinicky závažné [10,11]. Medzi komplikácie patrí biliárny leak, peritonitída, pneumoperitoneum, krvácanie, bolesť brucha, cholangitida, obturácia alebo dislokácia stentu. Nebol popísaný rozdiel vo výskyte komplikácii medzi použitím plastového stentua SEMS.
Dáta porovnávajúce EUS-BD a PTD sú zatiaľ limitované. Randomizovaná štúdia 25 pacientov s inoperabilnou malígnou biliárnou obštrukciou a neúspešnou ERCP nepotvrdila rozdiel v technickom a klinickom úspechu EUS-BD a PTD (100 % v oboch skupinách) [12]. Predbežné výsledky inej randomizovanej štúdie však potvrdili signifikantne kratšiu dobu hospitalizácie (6 vs. 12 dní) a nižší výskyt komplikácií (35 vs. 60 %) u pacientov liečených EUS-BD v porovnaní s pacientami liečenými PTD [13].
V súčasnosti neexistujú doporučenia na výber techniky EUS-BD. Podľa dvoch randomizovaných štúdií sú obe techniky (trans - a extrahepatálny prístup) rovnako technicky aj klinicky úspešné [11]. Transhepatálny prístup drenáže (EUS-HGS) mal však v jednej štúdii signifikantne vyšší počet komplikácií ako extrahepatálny prístup (30,5 vs. 9,3 %) [11]. Extrahepatálny prístup bol naviac asociovaný s kratším trvaním samotného výkonu a kratšou dobou hospitalizácie [14].
Nový SEMS s rozšírenými distálnymi koncami (AXIOS™), umožňujúcimi fixáciu stentu, možno tiež použiť pri EUS-CDA s technickým úspechom 98,2 % a výskytom komplikácií 7 %. Ako komplikácia bola popísaná perforácia duodena, krvácanie a tranzientná cholangitida [15].
EUS-navigovaná drenáž žlčníka (EUS-cholecysto-gastro-/ duodenostómia)
Kriticky chorí pacienti s akútnou cholecystitídou nereagujúcou na konzervatívnu liečbu vyžadujú dekompresiu žlčníka. Vzhľadom na celkovo závažný stav nie sú kandidátmi na emergentnú chirurgickú liečbu. K dispozícii je buď perkutánna drenáž alebo EUS-navigovaná vnútorná drenáž žlčníka. Dáta k EUS-navigovanej drenáži sú limitované a obmedzené na malé súbory pacientov. U doposiaľ publikovaných 97 pacientov bol technický a klinický úspech drenáže 98 % a výskyt komplikácií 16 % [1].
V randomizovanej štúdii s 59 pacientami nebol pozorovaný rozdiel v technickom, klinickom úspechu a výskyte komplikácií medzi EUS-navigovanou a perkutánnou drenážou žlčníka [16]. Na EUS-drenáž žlčníka možno použiť transgastricky alebo transduodenálne zavedený plastový double-pigtail stent, SEMS alebo ich kombináciu [17,18]. Vzhľadom na vyššie riziko migrácie a biliárneho leaku u transgastricky zavedeného stentu je niektorími autormi odporúčaná transduodenálna drenáž [17]. Predbežné dáta prebiehajúcich štúdií EUS-cholecystoduodenostómie s použitím lumen-apozičného stentu (AXIOS™) prinášajú pozitívne výsledky.
EUS-navigovaná drenáž pankreatického vývodu
Túto techniku možno použiť u pacien-tov vyžadujúcich dekompresiu pankreatického vývodu po neúspešnom alebo technicky nerealizovateľnom ERCP. Medzi potenciálne indikácie patria pacienti:
- s chronickou pankreatitídou a stenózou hlavného pankreatického vývodu (MPD – main pancreatic duct),
- po duodenopankreatektómii so stenózou pankreatikojejunostómie,
- s disrupciou hlavného pankreatického vývodu.
Podobne ako pri EUS-navigovanej drenáži žlčových ciest existujú tri techniky drenáže pankreatického vývodu: rendezvous technika, antegrádna drenáž a transmurálna drenáž.
Na vstup do pankreatického vývodu sa používa ihla s priemerom 19 G (s vodičom 0,035) alebo 22 G (s vodičom 0,018). Po transgastrálnej punkcii pankreatického vývodu, vytvorení pankreatikogramu a zavedení vodiča, optimálne transpapilárne alebo cez anastomózu (obr. 7), nasleduje dilatácia kanála pomocou kanyly, bužiového dilatátora alebo balóna so zavedením plastového stentu. Použiť možno rovný alebo pigtail stent s priemerom 7, 8,5 a 10 Fr.
Obr. 7. EUS-navigovaná drenáž ductus pancreaticus rendezvous technikou – trangastricky zavedený vodič do dilatovaného ductus pancreaticus s distálnym koncom prechádzajúcim stenotickou pankreatikogastrostómiou, pacient po resekcii hlavy pankeasu. Fig. 7. EUS-guided rendezvous drainage of the pancreatic duct – transgastrically introduced guide wire in a dilated pancreatic duct with its distal end passing through the stenotic pancreaticogastrostomy, a patient after a hemiduodenopancreatectomy. 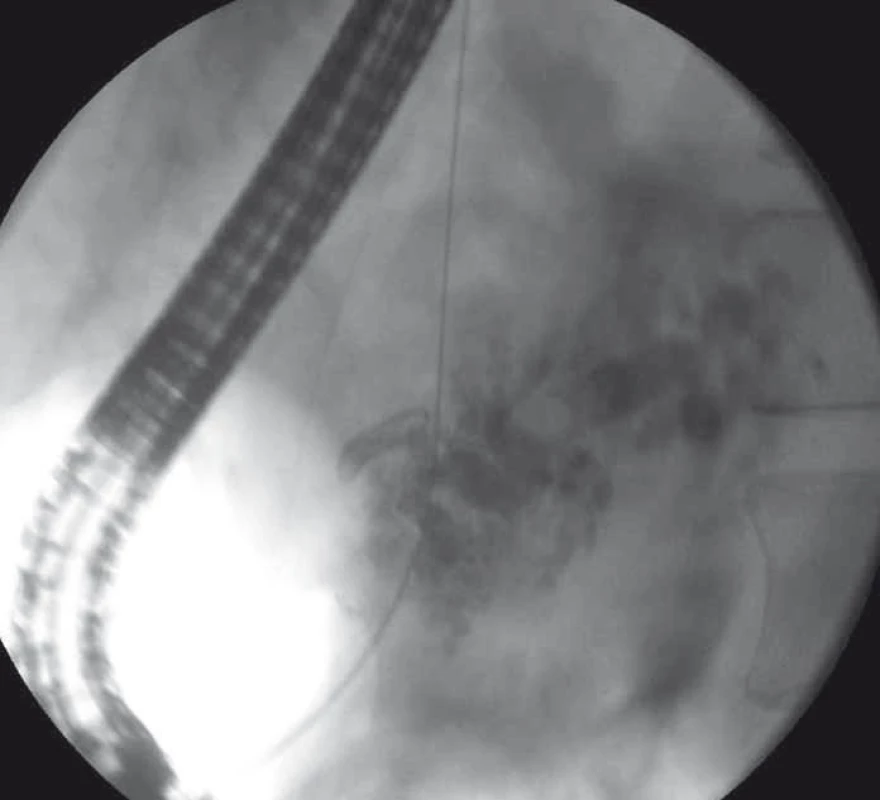
Z celkového počtu 222 doposiaľ publikovaných pacientov bola EUS-navigovaná drenáž MPD technicky úspešná u 76,6 % pacientov, s výskytom komplikácií u 18,9 % pacientov [19].
Medzi potenciálne komplikácie patrí bolesť brucha, AP, krvácanie, perforácia, peripankreatický absces, vyzlečenie povrchového obalu vodiča [19].
Dlhodobý (≥ 12 mesiacov) klinický úspech metódy je podľa literatúry 69,6 %.
Metóda je technicky náročná s viacerými potenciálnymi technickými prekážkami, ktoré môžu viesť k technickému neúspechu.
EUS-navigovaná drenážabdominálnych nepankreatických a pelvických kolekcií
Pod EUS kontrolou je možné vykonať drenáž nepankreatických tekutinových kolekcií v anatomických oblastiach naliehajúcich na hornú časť tráviacej trubice (žalúdok, proximálne duodenum) a rektum, väčšinou neprístupných perkutánnej drenáži. Jedná sa o nasledujúce oblasti:
- subfrenická oblasť,
- ľavý lalok pečene,
- perirektálna oblasť.
Technické aspekty a postup je identický s drenážou PFC. Doposiaľ bolo celkovo publikovaných približne 20 prác s celkovým počtom 120 pa-cientov s technickým a klinickým úspechom drenáže u 99 a 92 % pacientov a výskytom komplikácií u 13 % pacientov [1]. V drenáži pelvických kolekcií boli donedávna používané len plastové double-pigtail stenty alebo drenážne katétre umožňujúce kontinuálny preplach. Podľa najnovších prác je však vzhľadom na minimalizáciu rizika peritoneálneho leaku a obturácie stentu použitie FC-SEMS výhodnejšie [20]. Príklad EUS-navigovanej transgastrálnej drenáže abscesu v lobus caudatus pečene je uvedený na obr. 8 a 9.
Obr. 8. CT obraz abscesu v lobus caudatus pečene. Fig. 8. CT image of an abscess in the caudate lobe of the liver. 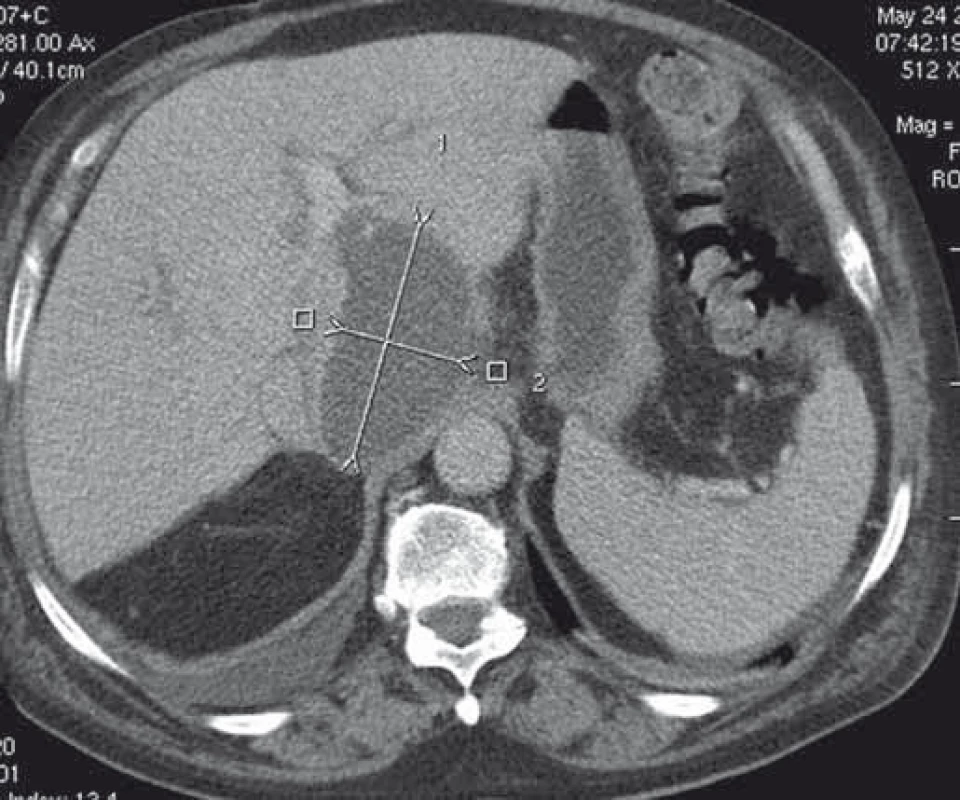
Obr. 9. CT – úplná regresia abscesu dva mesiace po drenáži, double-pigtail stenty in situ. Fig. 9. CT – complete resolution of an abscess two months after drainage, double-pigtail stents in situ. 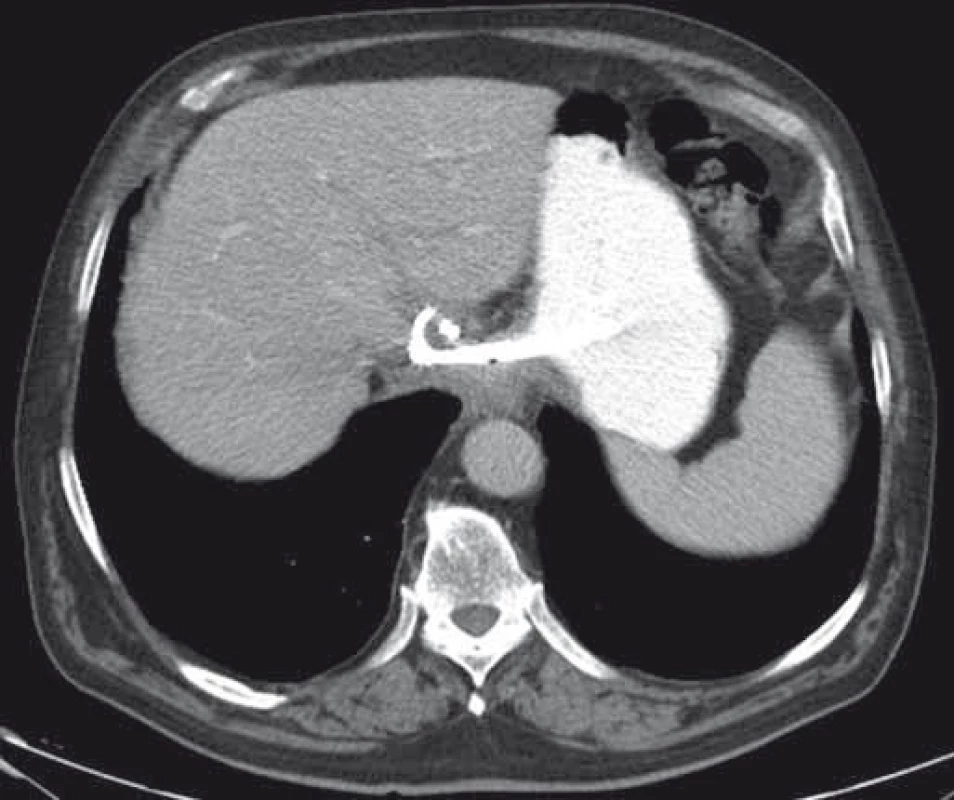
Atraktívnou koncepciou je vytvorenie endoskopickej gastroenteroanastomózy alebo enteroenteroanastomózy pod EUS kontrolou pomocou špeciálne upravených stentov (napr. AXIOS™ stent, SPAXUS™ stent), kompresívneho gombíka (compression button) alebo magnetov. Metóda je však zatiaľ predmetom klinických štúdií.
EUS-FNI
Pod EUS-kontrolou sa do cieľovej štruktúry ihlou aplikuje látka s potenciálnym terapeutickým účinkom. Cieľovou štruktúrou je buď oblast celiakálních ganglií alebo nádor, najčastejšie pankreasu (cystický alebo solídny). EUS-antitumorózna terapia je v súčasnosti realizovaná len v rámci klinických štúdií.
EUS-navigovaná celiakálna neurolýza a blok
Doposiaľ jedinou etablovanou a v bežnej klinickej praxi používanou metódou EUS-FNI je EUS-navigovaná neurolýza celiakálneho plexu (EUS-CPN)a blok (EUS-CPB). Princíp spočíva v aplikácii kombinácie lokálneho anestetika (bupivakaínu) a vysoko koncentrovaného (90 – 98%) etylalkoholu (EUS-CPN) alebo kombinácie bupivakaínu a kortikosteroidu, napr. 60 ml metylprednizolonu (EUS-CPB) do oblasti celiakálních ganglií. Patofyziologicky dochádza k trvalému (lýza) alebo prechodnému (blok) prerušeniu aferentnej sympatikovej dráhy pre bolesť. Jedná sa teda o liečbu bolesti.
Indikovaní na EUS-CPN/ EUS-CPB sú pacienti s:
- inoperabilnou abdominálnou malignitou, najčastejšie karcinómom pankreasu, a chronickou bolesťou brucha (EUS-CPN),
- chronickou pankreatitídou a chronickou bolesťou brucha (EUS-CPB).
Techniky aplikácie
EUS-CPN – neurolýza celiakálneho plexu
Celý objem 0,25% bupivakaínu (3 až 10 ml) a alkoholu (20 ml) je instilovaný do oblasti plexus celiacus, medzi odstup aorty a kmeňa truncus cealiakus (centrálna CPN) alebo po oboch stranách odstupu kmeňa truncus celiacus je aplikovaná polovica celkového objemu alkoholu a bupivakaínu (bilaterálna CPN). Randomizovaná štúdia s 50 pacientami s karcinómom pankreasu neukázala rozdiel v nástupe a trvaní analgézie medzi oboma technikami [21].
EUS-CGN – neurolýza celiakálních ganglií
Instilácia alkoholu a bupivakaínu priamo do celiakálních ganglí, ktoré je možné vizualizovať pomocou EUS až v 80 % prípadov. Metóda je efektívnejšia v terapii bolesti ako EUS-CPN [22].
EUS-BPN – rozšírená neurolýza plexu (broad plexus neurolysis)
Celý objem alkoholu a bupivakaínu je instilovaný ventrálne a kaudálne od odstupu arteria mesenterica superior [23].
K zmierneniu bolesti a zníženiu dávky analgetík dochádza po EUS-CPNu 72,5 % pacientov s karcinómom pankreasu [24] a po EUS-CPB u 51,5 % pacientov s chronickou pankreatitídou. Po 24. týždni od EUS-CPB však efekt terapie pretrváva len u 10 % pacientov [24]. Vzhľadom na nedostatočný klinický efekt nenašla EUS-CPB doposiaľ širšie uplatnenie v bežnej klinickej praxi. EUS-CPN/ EUS-CPB predstavujú alternatívu CT-navigovanej CPN/ CPB realizovanej transabdominálnym alebo dorzálnym prístupom. EUS-CPN má lepší bezpečnostný profil, keďže potenciálne závažné komplikácie perkutánnej techniky (paraplégia, pneumotorax) sa pri EUS-navigovanom prístupe nevyskytujú. Komplikácie EUS-CPN/ EUS-CPB sa vyskytujú u 30 % pacientov, väčšinou sú mierne a spontánne odoznievajú. Medzi najčastejšie patrí prechodná hnačka, bolesť brucha a hypotenzia.
EUS-navigovaná alkoholová ablácia
V rámci klinických štúdií a v niekoľkých kazuistikách bola pod EUS-kontrolou vykonaná alkoholová ablácia niektorých solídnych nádorov (inzulinóm pankreasu, gastrointestinálny stromálny tumor, metastázy v pečeni) a alkoholová laváž niektorých cystických neoplázií pankreasu [25]. Vzhľadom na obmedzené dáta sa táto terapia nevykonáva mimo klinických štúdií.
EUS-navigovaná antitumorózna terapia
Jednotlivé typy tejto terapie sú uvedené v tab. 2. Táto terapia bola doposiaľ realizovaná len v niekoľkých humánnych klinických štúdiách alebo na experimentálnych zvieracích modeloch. Výsledky sú zatiaľ nepostačujúce na zavedenie do klinickej praxe.
Tab. 2. Typy EUS-navigovanej antitumoróznej terapie u pacientov s karcinómom pankreasu. Tab. 2. Types of EUS-guided antitumorous therapy in patients with a pancreatic carcinoma. 
EUS-navigovaná angioterapia
EUS v kombinácii s dopplerovským zobrazením umožňuje identifikáciu vaskulárnej anatómie, potenciálne rizikových ciev a skrytých zdrojov krvácania (napr. Dieulafoy lézie alebo pseudo-aneuryzmy). Naliehanie týchto štruktúr na stenu hornej časti tráviacej trubice umožňuje presnú vaskulárnu intervenciu. Fockens ako prvý publikoval prínos EUS v diagnostike Dieulafoy lézií u ôsmich pacientov, pričom v polovici prípadov bolo možné vykonať aj EUS-navigovanú sklerotizáciu aberantnej cievy [26]. EUS-navigovaná obliterácia žalúdočných varixov cyanoakrylátom môže viesť k signifikantnému zníženiu rizika neskorej recidívy krvácania v porovnaní so štandardnou endoskopickou terapiou [27].
V inej randomizovanej štúdii bol zaznamenaný signifikantne nižší výskyt komplikácií po EUS-navigovanom coilingu žalúdočných varixov (1× horúčka, 1× bolesť hrudníka) ako po štandardnej endoskopickej obliteračnej terapii (asymptomatická embolizácia lepidla do pľúcnice u 11 z 19 pacientov) [28]. Ďalšie potenciálne využitie EUS môže predstavovať EUS-portoangiografia vrátane intervencií, napr. implantácie transjugulárnej intrahepatálnej portosystémovej spojky (TIPS) pod EUS kontrolou.
Záver
Terapetická EUS vykonala v posledných rokoch významný progres. V súčasnosti etablované metódy EUS-navigovanej terapie predstavuje EUS-navigovaná drenáž PFC a EUS-CPN. S pribúdaním vedeckých dát a rozvojom nových akcesórií a špeciálnych stentov rastie význam EUS-BDa anastomózy u pacientov s inoperabilnou malígnou obštrukciou žlčových ciest a neprístupnou papilou, či neúspešnom ERCP. V terciárnych centrách s dostatočnou skúsenosťou s terapeutickou endoskopiou a zázemím multidisciplinárneho tímu predstavuje alternatívu perkutánnej BD. EUS-navigovaná drenáž pankreatického vývodu je technicky náročná a má nezanedbateľné riziko komplikácií, môže byť alternatívou v selektovaných prípadoch. EUS-antitumorózna terapia vyžaduje ďalší intenzívny výskum. EUS-angiografia možno bude v budúcnosti konkurovať perkutánnym angiografickým technikám. Pole EUS-navigovanej terapie sa naďalej intenzívne skúma a v budúcnosti možno očakávať rozšírenie spektra výkonov v terapeutickej EUS.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 12. 4. 2016
Přijato: 20. 5. 2016
MU Dr. Martin Kliment, Ph.D.
Gastroenterologie und Hepatologie
Klinik für Innere Medizin
Vivantes Klinikum Spandau
Neue Bergstraße 6
135 85 Berlin
Německo
martin_kliment@hotmail.com
Zdroje
1. Fabbri C, Luigiano C, Lisotti A et al. Endoscopic ultrasound-guided treatments: are we getting evidence based – a systematic review. World J Gastroenterol 2014; 20(26): 8424 – 8448. doi: 10.3748/ wjg.v20.i26.8424.
2. Varadarajulu S, Bang JY, Sutton BS et al. Equal efficacy of endoscopic and surgical cystogastrostomy for pancreatic pseudocyst drainage in a randomized trial. Gastroenterology 2013; 145(3): 583 – 590. doi: 10.1053/ j.gastro.2013.05.046.
3. Panamonta N, Ngamruengphong S, Kijsircharenchai K et al. Endoscopic ultrasound-guided versus conventional transmural techniques have comparable treatment outcomes in draining pancreatic pseudocysts. Eur J Gastroenterol Hepatol 2012; 24(12): 1355 – 1362. doi: 10.1097/ MEG.0b013e32835871eb.
4. Park DH, Lee SS, Moon SH et al. Endoscopic ultrasound-guided versus conventional transmural drainage for pancreatic pseudocysts: a prospective randomized trial. Endoscopy 2009; 41(10): 842 – 848. doi: 10.1055/ s-0029-1215133.
5. Varadarajulu S, Christein JD, Tamhane A et al. Prospective randomized trial comparing EUS and EGD for transmural drainage of pancreatic pseudocysts. Gastrointest Endosc 2008; 68(6): 1102 – 1111. doi: 10.1016/ j.gie.2008.04.028.
6. Chandran S, Efthymiou M, Kaffes A et al. Management of pancreatic collections with a novel endoscopically placed fully covered self-expandable metal stent: a national experience (with videos). Gastrointest Endosc 2015; 81(1): 127 – 135. doi: 10.1016/ j.gie.2014.06.025.
7. Gornals JB, De la Serna-Higuera C, Sánchez-Yague A et al. Endosonography-guided drainage of pancreatic fluid collections with a novel lumen-apposing stent. Surg Endosc 2013; 27(4): 1428 – 1434. doi: 10.1007/ s00464-012-2591-y.
8. Siddiqui AA, Dewitt JM, Strongin A et al. Outcomes of EUS-guided drainage of debris-containing pancreatic pseudocysts by using combined endoprosthesis and a nasocystic drain. Gastrointest Endosc 2013; 78(4): 589 – 595. doi: 10.1016/ j.gie.2013.03.1337.
9. Bakker OJ, van Santvoort HC, van Brunschot S et al. Endoscopic transgastric vs surgical necrosectomy for infected necrotizing pancreatitis: a randomized trial. JAMA 2012; 307(10): 1053 – 1061. doi: 10.1001/ jama.2012.276.
10. Iwashita T, Lee JG, Shinoura S et al. Endoscopic ultrasound guided rendezvous for biliary access after failed cannulation. Endoscopy 2012; 44(1): 60 – 65. doi: 10.1055/ s-0030-1256871.
11. Dhir V, Artifon EL, Gupta K et al. Multicenter study on endoscopic untrasound-guided expandable biliary metal stent pacement: choice of access route, direction of stent insertion, and drainage route. Dig Endosc 2014; 26(3): 430 – 435. doi: 10.1111/ den.12153.
12. Artifon EL, Aparicio D, Paione JB et al. Biliary drainage in patients with unresectable, malignant obstruction where ERCP fails: endoscopic ultrasonograhy-guided choledochoduodenstomy versus perctutaneous drainage. J Clin Gastroenterol 2012; 46(9): 768 – 774. doi: 10.1097/ MCG.0b013e31825f264c.
13. Giovannini M, Bories E, Napoleon B et al. Multicebter randomized phase II study: percutaneous biliary drainage vs. EUS guided biliary drainage: results of the intermediate analysis. Gastrointest Endosc 2015; 81 (Suppl): AB174.
14. Dhir V, Bhandari S, Bapat M et al. Comparison of transhepatic and extrahepatic routes for EUS-guided rendezvous procedur efor distal CBD obstruction. United European Gastroenterol J 2013; 1(1): 103 – 108. doi: 10.1177/ 2050640613480145.
15. Kunda R, Pérez-Miranda M, Will U et al. EUS-guided choledochoduodenostomy for malignant distal biliary obstruction using a lumen-apposing fully covered metal stent after failed ERCP. Surg Endosc 2016. [In press].
16. Jang JW, Lee SS, Song TJ et al. Endoscopic ultrasound-guided transmural and percutaneous transhepatic gallbladder drainage are comparable for acute cholecystitis. Gastroenterology 2012; 142(4): 805 – 811. doi: 10.1053/ j.gastro.2011.12. 051.
17. Song TJ, Park DH, Eum JB et al. EUS-guided cholecystoenterostomy with single-step placement of a 7F double-pigtail plastic stent in patients who are unsuitable for cholecystektomy: a pilot study (with video). Gastrointest Endosc 2010; 71(3): 634 – 640. doi: 10.1016/ j.gie.2009.11.024.
18. Takagi W, Ogura T, Sano T et al. EUS-guid-ed cholecystoduodenostomy for acute cholecystitis with an anti-stent migration and anti-food impaction system: a pilot study. Therap Adv Gastroenterol 2016; 9(1): 19 – 25. doi: 10.1177/ 1756283X15609285.
19. Larrisa L, Fujii-Lau, Levy MJ. Endosocopic ultrasound-guided pancreatic duct drainage. J Hepatobiliary Pancreat Sci 2015; 22(1): 51 – 57. doi: 10.1002/ jhbp.187.
20. Luigiano C, Togliani T, Cennamo V et al. Transrectal endoscopic ultrasound-guided drainage of pelvic abscess with placement of a fully covered self-expandable metal stent. Endoscopy 2013; 45 (Suppl 2): E245 – E246. doi: 10.1055/ s-0032-1326250.
21. LeBlanc JK, Al-Haddad M, McHenry L et al. A prospective, randomized study of EUS-guided celiac plexus neurolysis for pancreatic cancer: one injection or two? Gastrointest Endosc 2011; 74(6): 1300 – 1307. doi: 10.1016/ j.gie.2011.07.073.
22. Doi S, Yasuda I, Kawakami H et al. Endoscopic ultrasound-guided celiac ganglia neurolysis vs. celiac plexus neurolysis: a randomized multicenter trial. Endoscopy 2013; 45(5): 362 – 369. doi: 10.1055/ s-0032-1326225.
23. Sakamoto H, Kitano M, Kamata K et al. EUS-guided broad plexus neurolysis over the superior mesenteric artery using a 25--gauge needle. Am J Gastroenterol 2010; 105(12): 2599 – 2606. doi: 10.1038/ ajg. 2010.339.
24. Kaufman M, Singh G, Das S et al. Efficacy of endoscopic ultrasound-guided celiac plexus block and celiac plexus neurolysis for managing abdominal pain associated with chronic pancreatitis and pancreatic cancer. J Clin Gastroenterol 2010; 44(2): 127 – 134. doi: 10.1097/ MCG.0b013e3181bb854d.
25. Kliment M, Urban O, Žiak D et al. Endosonograficky navigovaná alkoholová laváž cystickej neoplázie pankreasu. Gastroenterol Hepatol 2012; 66(3): 183 – 186.
26. Fockens P, Meenan J, van Dullemen HM et al. Dieulafoy’s disease: endosonographic detection and endosonography-guided treatment. Gastrointest Endosc 1996; 44 : 437 – 442.
27. Lee YT, Chan FK, Ng EK et al. EUS-guided injection of cyanoacrylate for bleeding gastric varices. Gastrointest Endosc 2000; 52(2): 168 – 174.
28. Romero-Castro R, Ellrichmann M, Ortiz-Moyano C et al. EUS-guided coil versus cyanoacrylate therapy for the treatment of gastric varices: a multicenter study (with videos). Gastrointest Endosc 2013; 78(5): 711 – 721. doi: 10.1016/ j.gie.2013.05.009.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Lymfom imitující GISTČlánek Správná odpověď na kvíz
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2016 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Digestivní endoskopie a endoterapie
- Diferenciální diagnostika artralgií u Crohnovy nemoci vyžaduje komplexní přístup a někdy vede k překvapujícímu výsledku
- Renesance cholangiopankreatoskopie a nové možnosti intraduktální endoskopické terapie
- Terapeutická endosonografia – súčasné postavenie
- Endoskopické řešení volvulu sigmatu
- Neuroendokrinní nádory v gastroenterologické praxi
- První endoskopická submukózní resekce subepiteliálního nádoru (GIST) jícnu v ČR
- Lymfom imitující GIST
- Stenóza tlustého střeva neobjasněné etiologie
- Těžký (komplikovaný) průběh virové hepatitidy A v Cotonou (Benin) u nedostatečně očkovaného pacienta španělského původu
- Využití panelu somatických genových mutací a amplifikací pro odhad prognózy pacientů s karcinomem žaludku
- Doporučené postupy chirurgické léčby pacientů s idiopatickými střevními záněty – 3. část: ulcerózní kolitida, indikace k operaci
- SOUTĚŽ O DVĚ NEJLEPŠÍ PŮVODNÍ PRÁCE 2016
- The 38th Czech and Slovak Endoscopic Days
- Vyhlášení soutěže o nejlepší kazuistiku 2015
- 15th Czech-Slovak IBD symposium and IBD work ing days, Hořovice 2016
- Přemysl Falt: Jeseniovu cenu beru jako ocenění práce celého týmu
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: digestivní endoskopie
- Mutaflor® – Escherichia coli (Nissle 1917), sérotyp O6:K5:H1 – nejlépe prozkoumané probiotikum současnosti
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Stenóza tlustého střeva neobjasněné etiologie
- Mutaflor® – Escherichia coli (Nissle 1917), sérotyp O6:K5:H1 – nejlépe prozkoumané probiotikum současnosti
- Endoskopické řešení volvulu sigmatu
- Neuroendokrinní nádory v gastroenterologické praxi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



