-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Moderní diagnostika Lynchova syndromu
Modern diagnostics of Lynch syndrome
Lynch syndrome (formerly known as hereditary non-polyposis colorectal cancer – HNPCC) is the most common hereditary colorectal cancer syndrome. The syndrome is caused by a germline mutation of one of the mismatch repair (MMR) genes which are responsible for DNA replication error repair. Impaired function of the proteins encoded by these genes leads to microsatellite instability (MSI) and forms a suitable background for development and progression of tumours, mainly colorectal cancer. According to recent estimates up to 5% of all cases of colorectal cancer are associated with Lynch syndrome. Due to this relatively high frequency, familial occurence, absence of premorbid phenotype and development of malignant tumors in productive age, correct diagnosis is important not only from the ethical but also the economical point of view. Unfortunately, clinical means of diagnostics of Lynch syndrome (like the Amsterdam criteria and Bethesda guidelines) lacks sensitivity. It was shown that predictive models based on histological signs of MSI are more sensitive than the clinical criteria used to detect patients with suspected Lynch syndrome. Of all MSI-H colorectal cancers, 1/5 is caused by Lynch syndrome, while the rest are sporadic cancers caused by epigenetic inactivation of an MMR gene. To rule out the sporadic cases, molecular genetic investigation of the BRAF gene and methylation analysis of the MLH1 promoter is used in the diagnostic workup of Lynch syndrome. The suspicion of Lynch syndrome, based on the results of the complex of diagnostic methods mentioned above, should be proved by detection of a germline mutation of an MMR gene in peripheral blood, and followed by screening of family members, which is a necessary condition for efficient prevention.
Key words:
colorectal cancer – Lynch syndrome – HNPCC – microsatellite instability
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
9. 2. 2014Accepted:
31. 3. 2014
Autoři: B. Kokošková 1,2; O. Daum 1; Z. Beneš 3; M. Dušek 1,2; J. Stehlík 2; Karin Černá 2
; L. Hadravský 1; M. Michal 1
Působiště autorů: Šiklův ústav patologie, LF UK a FN Plzeň 1; Bioptická laboratoř, s. r. o., Plzeň 2; Interní oddělení Fakultní Thomayerovy nemocnice, Praha 3
Vyšlo v časopise: Gastroent Hepatol 2014; 68(2): 157-165
Kategorie: Gastrointestinální onkologie: přehledová práce
Souhrn
Lynchův syndrom (dříve zvaný hereditární nepolypózní kolorektální karcinom – HNPCC) je nejčastější genetickou příčinou familiárního výskytu kolorektálního karcinomu. Příčinou je zárodečná mutace některého z MMR genů, které jsou zodpovědné za opravy chyb ve struktuře DNA vznikající při její replikaci. Tyto mutace způsobují dysfunkci opravného komplexu, která vede k rozvoji nestability mikrosatelitů (MSI) a ke vzniku a progresi nádorů, zejména kolorektálního karcinomu. V současné době se odhaduje, že až 5 % kolorektálních karcinomů vzniká v asociaci s Lynchovým syndromem. Vzhledem k této poměrně vysoké četnosti, absenci premorbidního fenotypu, familiárnímu výskytu a prezentaci maligních nádorů v produktivním věku je včasná diagnostika Lynchova syndromu důležitá nejen z etického, ale i ekonomického hlediska. Bohužel, Bethesda guidelines, natož Amsterdamská kritéria, nejsou dostatečně senzitivní. Vyšší senzitivitu vykazuje detekce morfologických znaků asociovaných s MSI při histologickém vyšetření vzorků kolorektálních karcinomů. Přibližně jedna pětina karcinomů s MSI je geneticky podmíněna Lynchovým syndromem, zbytek tvoří sporadické MSI-H karcinomy způsobené epigenetickou inaktivací MMR genu. K vyloučení těchto sporadických případů z dalšího testování slouží vyšetření genu BRAF a analýza metylace promotoru genu MLH1. Podezření na Lynchův syndrom vyplývající z výsledků výše uvedeného komplexu vyšetření by mělo být nakonec potvrzeno detekcí zárodečné mutace některého z MMR genů v periferní krvi pacienta s následným vyšetřením rodinných příslušníků pro zajištění účinné prevence.
Klíčová slova:
kolorektální karcinom – Lynchův syndrom – HNPCC – nestabilita mikrosatelitůLynchův syndrom – historie a současnost
V současné době je Lynchův syndrom (LS) definován jako autozomálně dominantně dědičné onemocnění vytvářející predispozici ke vzniku maligních nádorů, jehož podkladem je zárodečná mutace některého z genů odpovědných za opravy replikačních chyb v DNA, tzv. mismatch repair (MMR) genů. Nejčastějším karcinomem vznikajícím při LS je kolorektální karcinom (CRC), je však zvýšené riziko vzniku i dalších malignit, zejména karcinomů endometria, žaludku, tenkého střeva, ovaria, ledvinné pánvičky a močovodu, nádorů mozku a kůže.
Navzdory svému názvu je první literární zpráva o LS obsažena v publikaci Prof. Warthina z roku 1913, v níž je popsána „karcinomová rodina G“ [1]. Obdobné pozorování rodinného výskytu kolorektálního karcinomu při absenci polypózy [2] přivedlo dr. Lynche k návratu ke „karcinomové rodině G“, aktualizaci informací a rozpoznání základních znaků tohoto syndromu, kterými jsou [3]:
- zvýšená incidence adenokarcinomů, zejména kolorektálních a endo-metriálních,
- zvýšené riziko multiplicity nádorů,
- autozomálně dominantní dědičnost,
- vznik karcinomů v mladším věku.
Onemocnění bylo zpočátku označováno jako „syndrom karcinomové rodiny“, později „hereditární nepolypózní kolorektální karcinom“ (HNPCC) [4]. Zároveň se však začalo synonymně používat označení „Lynchův syndrom“ [5]. Z důvodu možnosti výskytu extrakolonických malignit se v současné době upouští od zavádějícího termínu HNPCC, přičemž označení „Lynchův syndrom“ se používá pro případy způsobené germinální mutací některého z MMR genů, zatímco pro případy splňující Amsterdamská kritéria, ale bez prokazatelné zárodečné mutace některého z MMR genů, se doporučuje termín „familiární kolorektální karcinom typu X“ [6].
Na podkladě LS vzniká podle současných odhadů až 5 % CRC. Důvodem, proč přesto stále zůstává ve stínu méně časté familiární adenomatózní polypózy (FAP, cca 1 %) je, že tyto nádory nevznikají v terénu polypózy (definované jako > 100 polypů), což však neznamená, že nemohou být přítomny žádné polypy. Absence „premorbidního fenotypu“, tedy přítomnosti benigních změn, které by umožňovaly diagnostikovat tento syndrom ještě před vznikem maligního tumoru (jako je tomu třeba v případě FAP, neurofibromatózy 1. typu a dalších familiárních karcinomových syndromů) výrazně ztěžuje jeho včasnou klinickou diagnostiku. Výjimkou z tohoto pravidla je fenotypická varianta LS projevující se vznikem kožních sebaceózních nádorů, označovaná jako Muir-Torreho syndrom (MTS) [7]. V ostatních případech může být LS diagnostikován prakticky až při nálezu maligního tumoru, případně při genetickém vyšetření rodinných příslušníků již diagnostikovaného probanda.
Lynchův syndrom z pohledu molekulární genetiky
MMR geny a MMR proteiny
Naprostá většina případů LS je způsobena zárodečnou mutací některého z genů odpovědných za opravy replikačních chyb v DNA (replication error repair, RER), které jsou označovány jako mismatch repair (MMR) geny [8,9]. Fyziologicky se MMR proteiny kódované těmito geny spojují do funkčních komplexů, především v heterodimery MLH1-PMS2 a MSH2-MSH6 (příp. MSH2-MSH3). Zatímco druhý jmenovaný dimer se uplatňuje v rozpoznávání chyb (především nespárovaných nebo špatně spárovaných nukleotidů) v DNA, první heterodimer slouží k opravě těchto nalezených chyb. Inaktivace obou alel některého ze jmenovaných genů vede k dysfunkci celého komplexu a ke vzniku nádorů charakteristických vysokým stupněm tzv. nestability mikrosatelitů [10,11].
Mikrosatelity a MSI
Mikrosatelity jsou úseky DNA tvořené několikanásobným opakováním jednoho až čtyř, vzácněji i více nukleotidů. Tyto krátké repetitivní sekvence se vyskytují v genomu poměrně hojně, přičemž délky jednotlivých mikrosatelitů (tedy počty opakování těchto sekvencí) jsou za normálních okolností v rámci jedince stejné, ale mohou se lišit mezi jednotlivci. Sekvence mikrosatelitů jsou snadno zranitelné při replikaci DNA, protože DNA polymeráza v oblasti repetic „sklouzává“ a v důsledku toho dochází ke vzniku delších či kratších úseků. Jestliže nedochází ke korekci těchto chyb, potom může délka mikrosatelitů v rámci jednoho jedince kolísat, což je stav označovaný jako nestabilita mikrosatelitů (microsatellite instability, MSI). MSI však není jednoznačně daným stavem, který by přímo způsoboval vznik nádorů. Jde spíše o semikvantitativní vyjádření genetického poškození DNA uvedeným mechanizmem. Stanovení stupně MSI je tedy arbitrární a spočívá ve stanovení nestability mezinárodně kodifikovaných markerů, přičemž na základě počtu postižených markerů se rozlišují stavy (hlavně nádory) se stabilními mikrosatelity (microsatellite stable, MSS), s nízkým stupněm nestability (microsatellite instability – low, MSI-L) a s vysokým stupněm nestability mikrosatelitů (microsatellite instability – high, MSI-H) [12].
MMR geny a MSI-H tumory
Tumory s MSI-H vznikají dvěma různými mechanizmy, a to buď jako sporadické nádory vyvolané genetickými a/nebo epigenetickými změnami v somatické buňce, nebo jako familiárně se vyskytující nádory v rámci LS způsobené zárodečnou mutací některého z MMR genů. Ačkoli je mutovaná alela děděna autozomálně dominantně, k vlastnímu vzniku nádoru dochází až somatickou inaktivací druhé alely téhož genu, což je dáno tím, že MMR geny patří mezi typické tumor supresorové geny s recesivním charakterem účinku [13]. Teprve tehdy, je-li u osob nesoucích jednu zárodečně mutovanou alelu MMR genu během jejich života inaktivována i alela druhá, dochází ke vzniku maligních tumorů. Příčinou této inaktivace může být somatická mutace v druhé alele genu, ztráta heterozygosity (LOH) nebo metylace promotoru, jak tomu bývá u genu MLH1 [14].
Nejčastěji postiženými geny při LS jsou MLH1 a MSH2 (dohromady více než 80 %) [15], dále následuje MSH6 (10 %) a zbylé případy představují vzácná zárodečná postižení dalších MMR genů (PMS2, PMS1, MSH3, MLH3).
Vzácné příčiny Lynchova syndromu
Ačkoli je LS obecně vnímán jako důsledek zárodečné mutace MMR genů, vzácně může vést ke stejné dysfunkci MMR proteinů, a tím i ke stejnému klinickému postižení, odlišný mechanizmus, jehož neznalost může mít za následek diagnostické rozpaky. V případě genu MLH1 byly například popsány zárodečné hypermetylace promotoru vedoucí k jeho epigenetické inaktivaci [16,17]. V nedávné době byly popsány i zárodečné delece 3´ konce genu EPCAM (TACSTD1), které zase vedou k epigenetické inaktivaci MSH2 [18,19]. Navíc dosud u řady mutací a polymorfizmů MMR genů nebyl objasněn jejich klinický význam.
Klinické a genetické varianty Lynchova syndromu
Klinické projevy LS se mohou lišit podle postiženého genu, případně i podle konkrétního typu mutace. Například u nosičů zárodečné mutace MLH1 často bývá kolorektální karcinom jedinou diagnostikovanou malignitou na rozdíl od pacientů se zárodečnou mutací v MSH2, u nichž se častěji vyskytují i extrakolonické nádory [20]. Mutace v MSH6 mají jednak nízkou penetranci, dále jsou šestkrát častěji asociovány s karcinomy endometria než s nádory kolorekta, a navíc jsou u těchto pacientů kolorektální karcinomy (v porovnání s LS způsobeným mutacemi jiných MMR genů) častěji levostranné. Důležité také je, že mutace v MSH6 nevedou vždy k MSI-H, pravděpodobně díky tvorbě alternativního heterodimeruMSH2-MSH3, což může ovlivnit jejich diagnostiku [21,22]. Naopak mutace v PMS2 vedou většinou ke vzniku MSI-H tumorů a jsou asociovány jak s časným kolorektálním, tak endometriálním karcinomem, avšak ani zde penetrance není příliš vysoká [23–25]. Nádory pacientů s LS a MTS jsou v 89 %, resp. 70 % MSI-H, na rozdíl od sporadických kolorektálních karcinomů, kde se MSI-H status vyskytuje pouze u 15 % pacientů a v naprosté většině případů bývá asociován s hypermetylací promotoru genu MLH1, nikoli se somatickými mutacemi MMR genů [10,26,27]. V některých případech je kombinace klinických znaků natolik výrazná, že dala vznik novým klinickým syndromům, které ve skutečnosti představují pouze varianty LS.
Muir-Torreho syndrom
MTS zahrnuje kombinaci nejméně jednoho kožního nádoru se sebaceózní diferenciací a minimálně jednoho viscerálního tumoru. Byl to právě „otec“ LS Henry Lynch, kdo v roce 1981 poukázal na společnou možnou etiologii MTS a LS, poté co identifikoval pacienty s fenotypem MTS v rodině postižené LS [28]. MTS jako varianta LS je unikátní v tom, že jako jediná představuje premorbidní fenotyp, tedy vykazuje znaky umožňující diagnózu LS ještě před rozvojem CRC.
Mezi kožní léze asociované s MTS patří sebaceózní adenom, sebaceom a extraokulární sebaceózní karcinom (naopak výskyt periokulárních sebaceózních tumorů je u MTS vzácný). Kožní tumory jsou většinou mnohočetné, ale byly popsány i případy solitárních lézí [29]. Klinický obraz se neliší od jejich sporadických protějšků, které jsou statisticky častější. Ve většině případů se jedná o nenápadné papuly a noduly hladkého povrchu, nažloutlé či růžové barvy anebo zbarvení kůže, velikosti od několika mm do 5 cm. U sebaceózních karcinomů mohou léze dosahovat větších rozměrů, vyznačují se nepřesným ohraničením, rychlým růstem a možnou ulcerací jejich povrchu. Přítomna může být také hyperplazie mazových žlázek [30]. Ta se jeví jako žlutobělavé papulky velikosti několika milimetrů, s typickou centrální vkleslinou. Obecně lze shrnout, že mnohočetné kožní nádory se sebaceózní diferenciací vyskytující se u jedinců před 50. rokem života nebo postihující tělní partie mimo obličej jsou silným indikátorem MTS [31]. Podobně i mnohočetné keratoakantomy vznikající na místech chráněných před sluncem u mladých osob slouží jako vodítko pro správnou diagnózu. Tyto se nejprve manifestují jako narůžovělé noduly s rychlým růstem, později na vrcholu s rohovatěním, případně i ulcerací.
Na vzniku MTS se podílí především zárodečné mutace v genech MLH1 a MSH2, přičemž mutace v genu MSH2 je převažující [32,33].
Turcotův syndrom 1. typu
Turcotův syndrom (TS) je klasicky charakterizován společným výskytem nádorů mozku a CRC. Podtyp označovaný jako TS 1. typu je blíže specifikován vazbou mozkového nádoru (hlavně gliomu) s CRC bez polypózy, přičemž může být také způsoben zárodečnou mutací některého z MMR genů; mutace byly detekovány zejména v MLH1 a PMS2 [34]. Za těchto podmínek se TS 1. typu jeví ve většině případů jako fenotypická varianta LS.
Syndrom konstitučního mismatch repair deficitu
Syndrom konstitučního mismatch repair deficitu (constitutional mismatch repair deficiency, CMMRD) je velmi vzácně se vyskytující zárodečná bialelická mutace genů MMR. Vzhledem k tomu, že jde o onemocnění dědičné autozomálně recesivně, vyskytuje se zejména jako následek incestu. Tento stav je charakteristický vznikem CRC již v mladém věku, hematologickými malignitami a fenotypickým obrazem připomínajícím neurofibromatózu 1. typu, zejména skvrnami café-au-lait [35,36]. Z diagnostického hlediska je také důležité, že imunohistochemicky stanovený deficit MMR proteinu má vyšší senzitivitu než vyšetření MSI [37]. V některých pramenech se tento syndrom označuje jako Turcotův syndrom. Přestože je i v tomto případě přítomna koincidence mozkového nádoru s CRC, celková odlišnost fenotypového obrazu i genetického podkladu je jasným argumentem proti zaměňování těchto dvou syndromů.
Tradiční diagnostika Lynchova syndromu
Ke klinické diagnostice HNPCC sloužila Amsterdamská kritéria [38], která byla pro zvýšení senzitivity, zejména s přihlédnutím k možnosti prezentace syndromu extrakolonickou malignitou (tzv. LS 2. typu), v roce 1998 revidována na Amsterdamská kritéria II [39]. Nicméně protože se postupně zlatým standardem diagnózy LS stávalo molekulárně genetické vyšetření, prioritou se stal záchyt co největšího množství pacientů pro toto vyšetření, nikoli samotná klinická diagnóza LS.
Bethesda guidelines
K identifikaci pacientů s CRC, u kterých by měla být vyšetřena nestabilita mikrosatelitů (MSI), případně provedeno molekulárně genetické vyšetření, byla v roce 1996 vypracována a v roce 2002 revidována tzv. Bethesda guidelines (BG, resp. RBG), která berou v potaz nejen klinická kritéria, ale i morfologické znaky tumoru [40]. Bohužel ani tato širší kritéria nezachytí všechny případy LS [41], zejména v případě postižení MSH6 a PMS2 [24,42–45]. Podle současných odhadů není až 25 % pacientů s LS zachyceno systémem kritérií RBG. Vzhledem k tomu, že falešná negativita v případě LS nemá za následek nerozpoznání tohoto syndromu pouze u vyšetřovaného pacienta, ale i u jeho případných příbuzných, nelze senzitivitu RBG pokládat za dostatečnou.
Moderní diagnostika Lynchova syndromu
Výše uvedená nedostatečná senzitivita RBG, případně další klinická kritéria sloužící k záchytu pacientů s LS, je příčinou současné snahy o zavedení senzitivnějšího systému depistáže, byť i za cenu snížení specificity. V tomto případě je možné familiární tendence ke vzniku maligních nádorů ospravedlnit jak z hlediska etického, tak ekonomického.
Mezi hlavní argumenty pro zvýšení senzitivity systému depistáže patří fakt, že 1 ze 660 lidí je nositelem germinální mutace některého z MMR genů [46], riziko vzniku CRC u LS je 60–80 % [47,48], dále že k progresi z adenomu do karcinomu pravděpodobně dochází během 2–3 let na rozdíl od 8–10 let u sporadických případů [49,50], a zejména že průměrný věk v době diagnózy je 45 let, tedy asi o 20 let méně než u sporadického CRC, navíc se zvýšeným rizikem synchronního a metachronního CRC [49].
V současné době jsou k dispozici tři základní senzitivní modely vyhledávání pacientů s podezřením na LS, přičemž každý z nich má své výhody a své nevýhody. Všechny tři mají společné, že detekují tumory s MSI-H, a to buď přímo (tedy molekulárně genetickým stanovením MSI), nebo zprostředkovaně. Do druhé skupiny patří jednak imunohistochemická detekce exprese MMR proteinů, jednak histologický průkaz morfologických znaků asociovaných s MSI.
Nicméně čtyři z pěti MSI-H CRC jsou sporadické tumory způsobené somatickou epigenetickou inaktivací MMR genu (zdaleka nejčastěji metylací promotoru MLH1). Tyto sporadické nádory je třeba odlišit před nákladnou analýzou jednotlivých MMR genů. V současné době umožňuje rozlišení sporadických a LS-asociovaných MSI-H karcinomů zapojení dvou metod molekulární patologie do managementu CRC. První z nich je analýza genu BRAF, konkrétně průkaz mutace V600E, která je přítomna až u poloviny sporadických MSI-H CRC, ale (téměř) nikdy u LS. Druhou metodu představuje průkaz hypermetylace promotoru MLH1, která je markerem sporadických MSI-H CRC a naopak až na výjimky nebývá přítomna u LS [51]. S vědomím určitého statistického zjednodušení lze tedy tyto dvě metody využít k vyřazení pacientů z dalšího (nákladného) diagnostického managementu, pokud tomu nebrání jiné okolnosti (např. nízký věk, výrazné familiární postižení, multiplicita nádorů).
Stanovení MSI
Rozlišení tumorů na MSS, MSI-L a MSI-H na základě stanovení nestability mezinárodně kodifikovaných markerů se samozřejmě v diagnostice Lynchova syndromu využívalo již dříve, ale cíleně, nikoli plošně. Plošné využití stanovení MSI k depistáži Lynchova syndromu je založeno na vyšetření všech CRC touto metodou. Mezi nevýhody systému patří výrazný nárůst zátěže laboratoří molekulární genetiky, absence informace o postiženém genu a konečně i fakt, že (navzdory obecnému přesvědčení) ne všechny LS-asociované nádory musí vykazovat MSI-H. Praktické využití plošného vyšetřování MSI naráží též na nezbytnost porovnání stavu markerů ve tkáni nádoru s tkání nenádorovou. To vyžaduje buď přítomnost nenádorové tkáně v materiálu (např. chirurgický okraj střevního resekátu), nebo odběr periferní krve pacienta (zejména v případě endoskopicky získaných vzorků).
Imunohistochemická detekce MMR proteinů
Zprostředkovanou informaci o funkci MMR komplexu lze získat pomocí imunohistochemického vyšetření exprese hlavních MMR proteinů (tedy MLH1, PMS2, MSH2 a MSH6). Ačkoli zpočátku, kdy byla imunohistochemicky stanovována pouze exprese MLH1 a MSH2, bylo preferováno stanovení MSI, po zavedení protilátek proti jejich dvěma partnerům pro tvorbu heterodimerů (PMS2 a MSH6) je senzitivita imunohistochemického vyšetření a stanovení MSI srovnatelná [52]. V současné době jsou obě metody (stanovení MSI a imunohistochemické vyšetření) vnímány jako komplementární, protože v kombinaci mají vyšší senzitivitu než při samostatném použití [53,54]. Typickým příkladem přínosu imunohistochemie jsou případy s mutací MSH6, které mohou uniknout při detekci MSI pomocí PCR, protože MSH2 může také tvořit komplex s MSH3, a tím nemusí nutně vést ke stavu MSI-H [52,55]. Imunohistochemická detekce MMR proteinů navíc (na rozdíl od stanovení MSI) umožňuje predikovat postižený gen pro molekulárně genetické vyšetření, což výrazně sníží náklady při následné detekci případné zárodečné mutace. Nicméně, názory na prioritu stanovení MSI nebo imunohistochemického vyšetření nejsou jednotné a různí autoři prosazují plošný screening pomocí MSI nebo pomocí imunohistochemie.
Detekce morfologických znaků MSI konvenční histologií
Histologické vyšetření představuje finančně nejméně náročnou metodu plošné depistáže. Je založeno na detekci histologických znaků charakteristických pro CRC s vysokým stupněm nestability mikrosatelitů, tedy tzv. MSI-H histologii, která samotná má vyšší senzitivitu než souhrn zbývajících čtyř kritérií RBG [56]. Ačkoli byly morfologické znaky pozorovatelné v MSI-H CRC popsány již v RBG (konkrétně byly uváděny karcinomy se špatnou diferenciací, karcinomy mucinózní, medulární nebo „z buněk pečetního prstenu“, přítomnost Crohn-like lymfoidních nodulů a tumor-infiltrujících lymfocytů (TIL)), nebyla dostatečně známa ani prediktivní hodnota jednotlivých znaků ani jejich reprodukovatelná kvantitativní definice, která by byla použitelná v rutinní praxi [40,57]. Z různých studií, jejichž cílem bylo nalézt racionální algoritmus detekce MSI-H karcinomů [58], se v současné době jako nejužitečnější jeví model Model PREDICT (Pathological RolE in the Determination of Instability in Colorectal Tumors) [56], zejména ve své zjednodušené formě jako Semi PREDICT skóre (tab. 1). Histologickými znaky, na nichž je tento model založen, jsou: přítomnost mucinu dissekujícího stroma v jakémkoli množství, přítomnost tumor-infiltrujících lymfocytů (TIL), peritumorální lymfoidní lem a zastoupení plazmatických buněk mezi leukocyty ve stromatu převyšující 25 % (obr. 1).
Obr. 1. Příklad „MSI-H histologie“. Jeden z typických obrazů MSI-H CRC, zde představovaný zejména intraepiteliální lymfocytózou vytvářející v dolní části obrázku „posypání“ nádorových žlázek lymfocyty obklopenými světlými halo a souvislým lymfoidním lemem v horní části snímku (HE, původní objektiv 10×). Fig. 1. Example of "MSI-H histology". One of the typical images of MSI-H CRC is represented in particular by intraepithelial lymphocytosis forming the "sprinkling" of cancer glandular cells with lymphocytes surrounded by bright halos at the bottom of the picture and continuous lymphoid band in the upper part of the image (HE, original lens 10×). 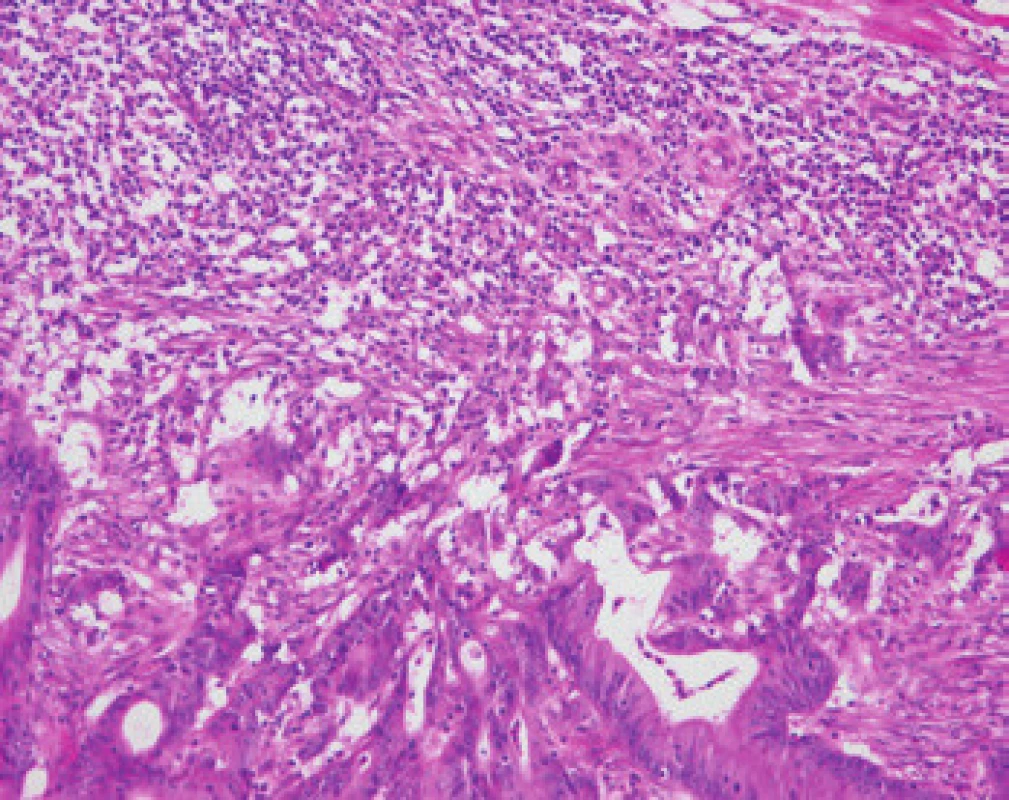
Tab. 1. Model PREDICT. Tab. 1. Model PREDICT. 
PREDICT skóre: Maximální možné skóre: 7,8 Suspekce na MSI-H: skóre ≥ 2,5 Semi PREDICT skóre: přítomny dva a více znaků → MSI-H susp. Mezi výhody histologického vyšetření patří i možnost levného, rychlého a jednoduchého vyloučení sporadických MSI-H karcinomů podmíněných většinou somatickou metylací promotoru genu MLH1. Zatímco tyto vznikají z tzv. „sesilních serrated adenomů“ (do češtiny někdy nešťastně překládaných jako „přisedlé pilovité adenomy“), prekurzorovou lézí karcinomů v terénu LS je „konvenční“ (tubulární, tubulovilózní nebo vilózní) adenom. Jsou-li tedy v periferii tumoru zbytky prekurzorového sesilního serrated adenomu, jde s největší pravděpodobností o sporadický MSI-H karcinom [59]. Nicméně tento jednoduchý diagnostický znak vylučující LS nemusí být vždy dostupný, ať již z důvodu nedostatečného samplingu nebo destrukce adenomu pokročilým adenokarcinomem.
Protože informace, kterou poskytuje histologické vyšetření o MSI, je značně zprostředkovaná, nemůže samozřejmě plnit roli samostatné metody depistáže. Pro svou finanční nenáročnost je však velmi vhodná jako první linie plošného vyšetřování CRC v rámci komplexního diagnostického managementu.
Komplexní diagnostický management CRC
Efektivní algoritmus diagnostiky LS by měl být vysoce senzitivní, dostatečně specifický, (relativně) levný a logisticky jednoduchý. Z hlediska senzitivity a specificity se ukázalo zcela nedostatečným spoléhat se na klinická kritéria (zejména rodinnou anamnézu). Proto se současné postupy zaměřují na detekci MSI-H tumorů, a to buď přímo, zprostředkovaně pomocí imunohistochemie, nebo na základě histologického průkazu morfologických znaků specifických pro MSI-H karcinomy.
Vzhledem k současným možnostem systému zdravotnictví a zvážení poměru ceny a užitku jsme na našem pracovišti místo plošného vyšetřování MSI či exprese MMR proteinů k vyhledávání pacientů s LS zavedli „komplexní diagnostický management“, na jehož počátku stojí mikroskopické vyšetření histologických řezů obarvených hematoxylinem a eozinem, na něž v případě přítomnosti znaků „MSI-H histologie“ navazuje sada metod imunohistochemických a molekulárně patologických, jejichž cílem je potvrdit přítomnost MSI-H, vyloučit možnost sporadického MSI-H karcinomu a určit pravděpodobně postižený gen k detekci zárodečné mutace.
Nádory, jejichž Semi PREDICT skóre vzbuzuje podezření na MSI-H, vykazují ztrátu exprese některého (nebo některých) z MMR proteinů, nemají hypermetylovaný promotor genu MLH1 a nebyla u nich prokázána substituce V600E genu BRAF, jsou určeny k detekci germinální mutace MMR genu určeného na základě imunohistochemického vyšetření (obr. 2). Podobně jako již bylo uvedeno u vyšetřování MSI, i stanovení hypermetylace promotoru MLH1 vyžaduje srovnání s nenádorovou tkání. Tato sice bývá běžně dostupná v případě chirurgických resekátů, většinou však není k dispozici při vyšetřování endoskopických biopsií. V těchto případech je nutná domluva se zainteresovaným gastroenterologem, aby zajistil kontrolní tkáň, ať už v podobě endoskopického vzorku z nenádorové sliznice nebo nesrážlivé periferní krve. Pokud jde o finální analýzu MMR genů, zde je optimálním materiálem nesrážlivá periferní krev, protože průkaz mutace mimo nádorovou tkáň potvrzuje její zárodečnou povahu, přičemž z důvodu technické náročnosti analýzy těchto genů je výtěžnost z krve výrazně vyšší než z nenádorové tkáně fixované ve formolu.
Obr. 2. Komplexní management diagnostiky Lynchova syndromu. Na základě mikroskopického nálezu MSI-H histologie (nebo klinické žádosti) je proveden komplex vyšetření situovaný do hnědého obdélníku, který sestává z imunohistochemického vyšetření exprese MMR proteinů, analýzy MSI, metylace promotoru <em>MLH1</em> a stavu genu <em>BRAF</em>. Tyto metody jsou v současné době na našem pracovišti z časových důvodů prováděny simultánně. K dalšímu genetickému vyšetření zárodečných mutací MMR genů jsou primárně vybráni pacienti s MSI-H tumory bez mutace <em>BRAF</em> a bez hypermetylace promotoru genu <em>MLH1</em>. Za zvláštních okolností (zejména při ztrátě imunoexprese MSH6) je však vhodné testovat i MSS karcinomy (převzato z webu http://www.lynch.cz). Fig. 2. Comprehensive management of Lynch syndrome diagnosis. Based on the microscopic finding of MSI-H histology (or clinical request), a complex of examinations is made (situated in the brown rectangle), which consist of immunohistochemical examination of the expression of MMR proteins, MSI analysis, methylation of the <em>MLH1</em> promoter, and <em>BRAF</em> gene status. These methods are currently performed simultaneously in our department because of the time conditions. Further genetic testing of germ-line mutations of MMR genes is primarily made in patients with MSI-H tumors without <em>BRAF</em> mutations and without <em>MLH1</em> gene promoter hypermethylation. Under special circumstances (especially the loss of MSH6 immunoexpression) it is appropriate to test also MSS carcinoma (taken from website http://www.lynch.cz). 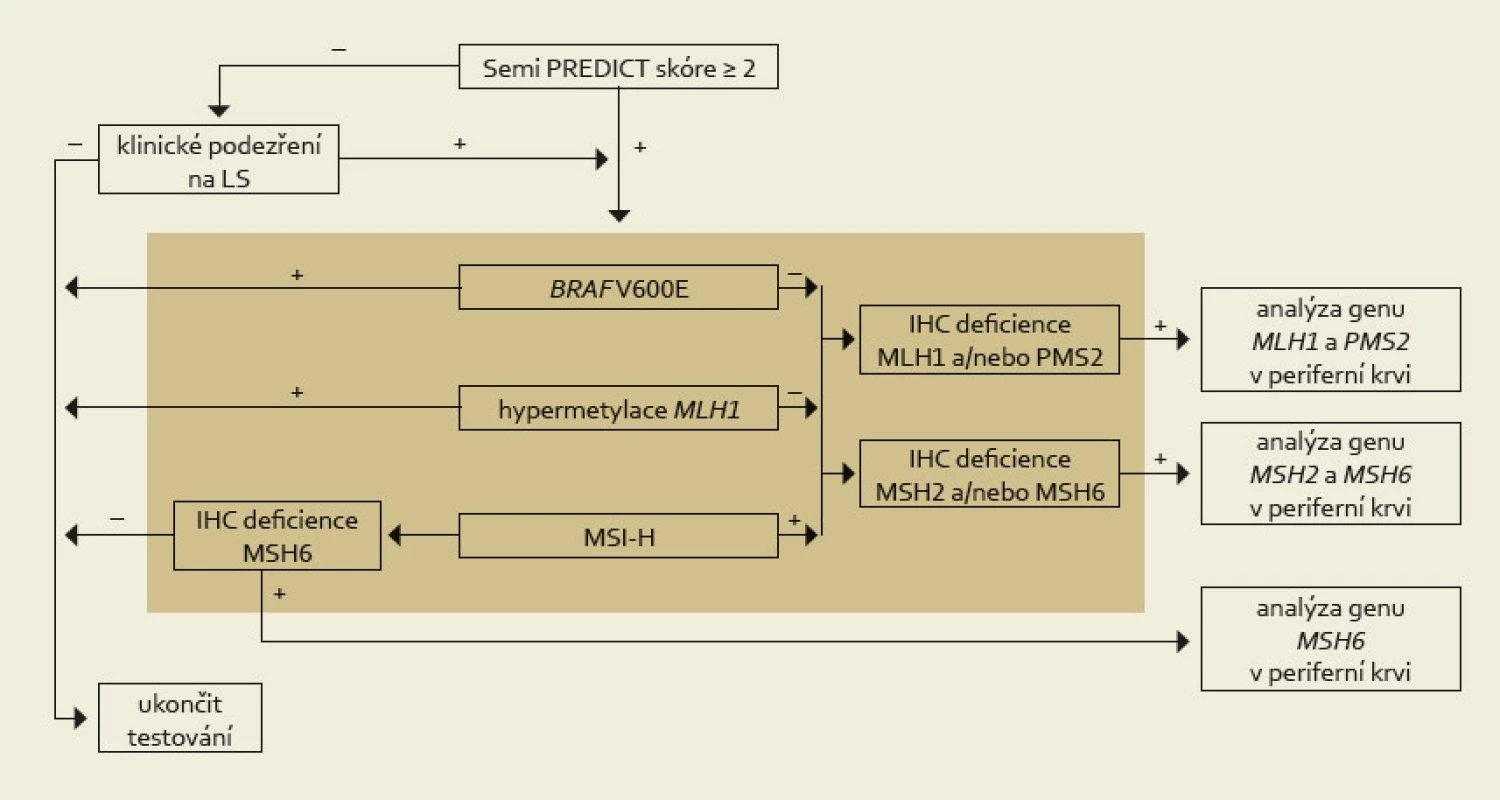
Ať už je konkrétní uspořádání tohoto algoritmu jakékoli, plnohodnotný postup by každopádně měl zahrnovat všechny uvedené diagnostické modality. Důvodem je jejich vzájemná komplementárnost. Kupříkladu samotné vyšetření MSI bez analýzy genu BRAF a stavu metylace promotoru MLH1 nedokáže odlišit sporadické CRC od syndromových, dále značná část karcinomů s mutací MSH6 nemusí vykazovat MSI-H a konečně bez imunohistochemického vyšetření nelze zúžit spektrum MMR genů, jejichž stav má být analyzován.
Závěr
Lynchův syndrom (LS) je familiární karcinomový syndrom způsobený zárodečnou mutací některého z genů, jehož proteinový produkt se účastní opravy chyb v DNA vzniklých při replikaci. Vzhledem k tomu, že se nyní výskyt LS v populaci odhaduje až na 5 % a vede ke vzniku maligních nádorů již v produktivním věku, sílí v současné době tlak na zvýšení senzitivity jeho detekce. Protože klinická kritéria jeho diagnostiky nedosahují dostatečné senzitivity, klade se dnes stále větší důraz na morfologickou a molekulárně patologickou diagnostiku. Podle našich zkušeností je nezbytné zavést jasný algoritmus, aby se diagnostika LS stala rutinní záležitostí a její management se co nejvíce zautomatizoval. Bohužel se dosud nepodařilo v našich podmínkách vytvořit spolehlivě fungující systém zpětné vazby s klinickými lékaři, kteří by měli organizovat další průběh vyšetření rodiny nemocného s LS. V nejbližších letech je tedy nezbytné zainteresovat do diagnostiky LS i klinické lékaře, bez jejichž aktivní účasti není možná ani kompletní diagnostika pacienta ani další vyšetření jeho rodinných příslušníků.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 9. 2. 2014
Přijato: 31. 3. 2014
doc. MUDr. Ondřej Daum, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Edvarda Beneše 13, 305 99 Plzeň
DAUM@fnplzen.cz
Zdroje
1. Warthin AS. Heredity with reference to carcinoma as shown by the study of the cases examined in the pathological laboratory of the University of Michigan, 1895–1913. Arch Intern Med 1913; 12(5): 546–555.
2. Lynch HT, Shaw MW, Magnuson CW et al. Hereditary factors in cancer. Study of two large midwestern kindreds. Arch Intern Med 1966; 117(2): 206–212.
3. Lynch HT, Krush AJ. Cancer family “G” revisited: 1895–1970. Cancer 1971; 27(6): 1505–1511.
4. Lynch HT, Drouhard TJ, Schuelke GS et al. Hereditary nonpolyposis colorectal cancer in a Navajo Indian family. Cancer Genet Cytogenet 1985; 15(3–4): 209–213.
5. Boland CR, Troncale FJ. Familial colonic cancer without antecedent polyposis. Ann Intern Med 1984; 100(5): 700–701.
6. Lindor NM, Rabe K, Petersen GM et al. Lower cancer incidence in Amsterdam-I criteria families without mismatch repair deficiency: familial colorectal cancer type X. JAMA 2005; 293(16): 1979–1985.
7. Kacerovská D, Kazakov DV, Černá K et al. Muir-Torre syndrom – a phenotypic variant of Lynch syndrome. Cesk Patol 2010; 46(4): 86–94.
8. Fishel R, Lescoe MK, Rao MR et al. The human mutator gene homolog MSH2 and its association with hereditary nonpolyposis colon cancer. Cell 1993; 75(5): 1027–1038.
9. Leach FS, Nicolaides NC, Papadopoulos N et al. Mutations of a mutS homolog in hereditary nonpolyposis colorectal cancer. Cell 1993; 75(6): 1215–1225.
10. Peltomäki P, Lothe RA, Aaltonen LA et al. Microsatellite instability is associated with tumors that characterize the hereditary non-polyposis colorectal carcinoma syndrome. Cancer Res 1993; 53(24): 5853–5855.
11. Thibodeau SN, Bren G, Schaid D. Microsatellite instability in cancer of the proximal colon. Science 1993; 260(5109): 816–819.
12. Boland CR, Thibodeau SN, Hamilton SR et al. A National Cancer Institute Workshop on Microsatellite Instability for cancer detection and familial predisposition: development of international criteria for the determination of microsatellite instability in colorectal cancer. Cancer Res 1998; 58(22): 5248–5257.
13. Yuen ST, Chan TL, Ho JW et al. Germline, somatic and epigenetic events underlying mismatch repair deficiency in colorectal and HNPCC-related cancers. Oncogene 2002; 21(49): 7585–7592.
14. Kruse R, Rütten A, Hosseiny-Malayeri HR et al. “Second hit” in sebaceous tumors from Muir-Torre patients with germline mutations in MSH2: allele loss is not the preferred mode of inactivation. J Invest Dermatol 2001; 116(3): 463–465.
15. Nyström-Lahti M, Wu Y, Moisio AL et al. DNA mismatch repair gene mutations in 55 kindreds with verified or putative hereditary non-polyposis colorectal cancer. Hum Mol Genet 1996; 5(6): 763–769.
16. Gazzoli I, Loda M, Garber J et al. A hereditary nonpolyposis colorectal carcinoma case associated with hypermethylation of the MLH1 gene in normal tissue and loss of heterozygosity of the unmethylated allele in the resulting microsatellite instability-high tumor. Cancer Res 2002; 62(14): 3925–3928.
17. Hitchins MP, Wong JJ, Suthers G et al. Inheritance of a cancer-associated MLH1 germ-line epimutation. N Engl J Med 2007; 356(7): 697–705.
18. Ligtenberg MJ, Kuiper RP, Chan TL et al. Heritable somatic methylation and inactivation of MSH2 in families with Lynch syndrome due to deletion of the 3’ exons of TACSTD1. Nat Genet 2009; 41(1): 112–117. doi: 10.1038/ng.283.
19. Kovacs ME, Papp J, Szentirmay Z et al. Deletions removing the last exon of TACSTD1 constitute a distinct class of mutations predisposing to Lynch syndrome. Hum Mutat 2009; 30(2): 197–203. doi: 10.1002/humu.20942.
20. Kastrinos F, Stoffel EM, Balmana J et al. Phenotype comparison of MLH1 and MSH2 mutation carriers in a cohort of 1,914 individuals undergoing clinical genetic testing in the United States. Cancer Epidemiol Biomarkers Prev 2008; 17(8): 2044–2051. doi: 10.1158/1055-9965.EPI-08-0301.
21. Hampel H, Frankel W, Panescu J et al. Screening for Lynch syndrome (hereditary nonpolyposis colorectal cancer) among endometrial cancer patients. Cancer Res 2006; 66(15): 7810–7817.
22. Berends MJ, Wu Y, Sijmons RH et al. Molecular and clinical characteristics of MSH6 variants: an analysis of 25 index carriers of a germline variant. Am J Hum Genet 2002; 70(1): 26–37.
23. Nakagawa H, Lockman JC, Frankel WL et al. Mismatch repair gene PMS2: disease-causing germline mutations are frequent in patients whose tumors stain negative for PMS2 protein, but paralogous genes obscure mutation detection and interpretation. Cancer Res 2004; 64(14): 4721–4727.
24. Hendriks YM, Jagmohan-Changur S, van der Klift HM et al. Heterozygous mutations in PMS2 cause hereditary nonpolyposis colorectal carcinoma (Lynch syndrome). Gastroenterology 2006; 130(2): 312–322.
25. Truninger K, Menigatti M, Luz J et al. Immunohistochemical analysis reveals high frequency of PMS2 defects in colorectal cancer. Gastroenterology 2005; 128(5): 1160–1171.
26. Kámory E, Kolacsek O, Ottó S et al. HMLH1 and hMSH2 somatic inactivation mechanisms in sporadic colorectal cancer patients. Pathol Oncol Res 2003; 9(4): 236–241.
27. Entius MM, Keller JJ, Drillenburg P et al. Microsatellite instability and expression of hMLH-1 and hMSH-2 in sebaceous gland carcinomas as markers for Muir-Torre syndrome. Clin Cancer Res 2000; 6(5): 1784–1789.
28. Lynch HT, Fusaro RM, Roberts L et al. Muir-Torre syndrome in several members of a family with a variant of the Cancer Family Syndrome. Br J Dermatol 1985; 113(3): 295–301.
29. Graham R, McKee P, McGibbon D et al. Torre-Muir syndrome. An association with isolated sebaceous carcinoma. Cancer 1985; 55(12): 2868–2873.
30. Esche C, Kruse R, Lamberti C et al. Muir-Torre syndrome: clinical features and molecular genetic analysis. Br J Dermatol 1997; 136(6): 913–917.
31. Schwartz RA, Torre DP. The Muir-Torre syndrome: a 25-year retrospect. J Am Acad Dermatol 1995; 33(1): 90–104.
32. Mathiak M, Rütten A, Mangold E et al. Loss of DNA mismatch repair proteins in skin tumors from patients with Muir-Torre syndrome and MSH2 or MLH1 germline mutations: establishment of immunohistochemical analysis as a screening test. Am J Surg Pathol 2002; 26(3): 338–343.
33. Mangold E, Pagenstecher C, Leister M et al. A genotype-phenotype correlation in HNPCC: strong predominance of msh2 mutations in 41 patients with Muir-Torre syndrome. J Med Genet 2004; 41(7): 567–572.
34. De Rosa M, Fasano C, Panariello L et al. Evidence for a recessive inheritance of Turcot‘s syndrome caused by compound heterozygous mutations within the PMS2 gene. Oncogene 2000; 19(13): 1719–1723.
35. Gallinger S, Aronson M, Shayan K et al. Gastrointestinal cancers and neurofibromatosis type 1 features in children with a germline homozygous MLH1 mutation. Gastroenterology 2004; 126(2): 576–585.
36. Bandipalliam P. Syndrome of early onset colon cancers, hematologic malignancies & features of neurofibromatosis in HNPCC families with homozygous mismatch repair gene mutations. Fam Cancer 2005; 4(4): 323–333.
37. Bakry D, Aronson M, Durno C et al. Genetic and clinical determinants of constitutional mismatch repair deficiency syndrome: Report from the constitutional mismatch repair deficiency consortium. Eur J Cancer 2014; 50(5): 987–996. doi:10.1016/j.ejca.2013.12.005.
38. Vasen HF, Mecklin JP, Khan PM et al. The International Collaborative Group on Hereditary Non-Polyposis Colorectal Cancer (ICG-HNPCC). Dis Colon Rectum 1991; 34(5): 424–425.
39. Vasen HF, Watson P, Mecklin JP et al. New clinical criteria for hereditary nonpolyposis colorectal cancer (HNPCC, Lynch syndrome) proposed by the International Collaborative group on HNPCC. Gastroenterology 1999; 116(6): 1453–1456.
40. Umar A, Boland CR, Terdiman JP et al. Revised Bethesda Guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst 2004; 96(4): 261–268.
41. Hampel H, Frankel WL, Martin E et al. Screening for the Lynch syndrome (hereditary nonpolyposis colorectal cancer). N Engl J Med 2005; 352(18): 1851–1860.
42. Liu T, Yan H, Kuismanen S et al. The role of hPMS1 and hPMS2 in predisposing to colorectal cancer. Cancer Res 2001; 61(21): 7798–7802.
43. Van der Klift H, Wijnen J, Wagner A et al. Molecular characterization of the spectrum of genomic deletions in the mismatch repair genes MSH2, MLH1, MSH6, and PMS2 responsible for hereditary nonpolyposis colorectal cancer (HNPCC). Genes Chromosomes Cancer 2005; 44(2): 123–138.
44. Dovrat S, Figer A, Fidder HH et al. Mutational analysis of hMsh6 in Israeli HNPCC and HNPCC-like families. Fam Cancer 2005; 4(4): 291–294.
45. Hegde MR, Chong B, Blazo ME et al. A homozygous mutation in MSH6 causes Turcot syndrome. Clin Cancer Res 2005; 11(13): 4689–4693.
46. De la Chapelle A. The incidence of Lynch syndrome. Fam Cancer 2005; 4(3): 233–237.
47. Jenkins MA, Baglietto L, Dowty JG et al. Cancer risks for mismatch repair gene mutation carriers: a population-based early onset case-family study. Clin Gastroenterol Hepatol 2006; 4(4): 489–498.
48. Quehenberger F, Vasen HF, van Houwelingen HC. Risk of colorectal and endometrial cancer for carriers of mutations of the hMLH1 and hMSH2 gene: correction for ascertainment. J Med Genet 2005; 42(6): 491–496.
49. Lynch HT, de la Chapelle A. Genetic susceptibility to non-polyposis colorectal cancer. J Med Genet 1999; 36(11): 801–818.
50. Jass JR, Stewart SM. Evolution of hereditary non-polyposis colorectal cancer. Gut 1992; 33(6): 783–786.
51. Domingo E, Laiho P, Ollikainen M et al. BRAF screening as a low-cost effective strategy for simplifying HNPCC genetic testing. J Med Genet 2004; 41(9): 664–668.
52. Shia J. Immunohistochemistry versus microsatellite instability testing for screening colorectal cancer patients at risk for hereditary nonpolyposis colorectal cancer syndrome. Part I. The utility of immunohistochemistry. J Mol Diagn 2008; 10(4): 293–300. doi: 10.2353/jmoldx.2008.080031.
53. Funkhouser WK Jr, Lubin IM, Monzon FA et al. Relevance, pathogenesis, and testing algorithm for mismatch repair-defective colorectal carcinomas: a report of the association for molecular pathology. J Mol Diagn 2012; 14(2): 91–103. doi: 10.1016/j.jmoldx.2011.11.001.
54. Halvarsson B, Lindblom A, Rambech E et al. Microsatellite instability analysis and//or immunostaining for the diagnosis of hereditary nonpolyposis colorectal cancer? Virchows Arch 2004; 444(2): 135–141.
55. Boland CR, Koi M, Chang DK et al. The biochemical basis of microsatellite instability and abnormal immunohistochemistry and clinical behavior in Lynch syndrome: from bench to bedside. Fam Cancer 2008; 7(1): 41–52.
56. Hyde A, Fontaine D, Stuckless S et al. A histology-based model for predicting microsatellite instability in colorectal cancers. Am J Surg Pathol 2010; 34(12): 1820–1829. doi: 10.1097/PAS.0b013e3181f6a912.
57. Jenkins MA, Hayashi S, O‘Shea AM et al. Pathology features in Bethesda guidelines predict colorectal cancer microsatellite instability: a population-based study. Gastroenterology 2007; 133(1): 48–56.
58. Román R, Verdú M, Calvo M et al. Microsatellite instability of the colorectal carcinoma can be predicted in the conventional pathologic examination. A prospective multicentric study and the statistical analysis of 615 cases consolidate our previously proposed logistic regression model. Virchows Arch 2010; 456(5): 533–541. doi: 10.1007/s00428-010-0896-6.
59. Jass JR. Classification of colorectal cancer based on correlation of clinical, morphological and molecular features. Histopathology 2007; 50(1): 113–130.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Správná odpověď na kvízČlánek Projekt RISING STARSČlánek MUDr. Boris Pekárek (1978)Článek OznámeníČlánek OmluvaČlánek Kvíz
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2014 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Léčba portální hypertenze pomocí transjugulární intrahepatální portosystémové spojky – prvních 1 000 výkonů ve FN Hradec Králové
- 1 000 TIPS ve FN Hradec Králové: indikace a přežívání nemocných
- Budd-Chiari syndrom a TIPS – 21 let zkušeností
- Transjugulární intrahepatální portosytémová spojka v terapii refrakterního ascitu: současný pohled jednoho pracoviště
- Dispenzarizace nemocných po zavedení transjugulární intrahepatální portosystémové spojky – diagnostika dysfunkce zkratu a možnosti intervence
- Transplantace jater pro hepatocelulární karcinom, dlouhodobé přežití a faktory ovlivňující rekurenci tumoru (zkušenosti jednoho centra)
- Využití EUS navigované choledochoduodenostomie v léčbě biliární obstrukce
- Hereditárny angioedém ako príčina bolestí brucha
- Malígny melanóm konečníka – zriedkavá kazuistika a prehľad literatúry
- Moderní diagnostika Lynchova syndromu
- Správná odpověď na kvíz
- Diskusia k príspevku „Moderní diagnostika Lynchova syndromu“
- Projekt RISING STARS
- doc. MUDr. Jan Martínek, Ph.D., AGAF (1969)
- MUDr. Ondřej Ryska, Ph.D. (1981)
- MUDr. Sylvia Dražilová (1972)
- MUDr. Boris Pekárek (1978)
- EUS workshop v Jablonci nad Nisou
- 13th Czech-Slovak IBD symposium
- 9th Congress of ECCO, Copenhagen, Denmark
- Oznámení
- Omluva
- Nový člen výkonné redakční rady
- Remsima™ – první biosimilární infliximab
- Autodidaktický test: hepatologie
- Hepatologie nejen z Hradce Králové
- Kvíz
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- doc. MUDr. Jan Martínek, Ph.D., AGAF (1969)
- MUDr. Sylvia Dražilová (1972)
- MUDr. Ondřej Ryska, Ph.D. (1981)
- Budd-Chiari syndrom a TIPS – 21 let zkušeností
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



