-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
ATP-senzitivní draslíkové kanály: klíčoví hráči v patofyziologii mnoha chorob
ATP-sensitive potassium channels: key players in pathophysiology of many diseases
ATP-sensitive potassium channels have been an intensively studied type of protein complexes incorporated in the cell membrane for several decades. Their unique function makes them special, as they create a connection between the metabolic state and membrane voltage of the cell. This position of a bridge involved in many cellular cascades allow them to participate in various processes at often surprising positions in nearly all organ systems of the body, from the pancreas, heart muscle or retina, to the central nervous system. This review summarizes the most important roles of ATP-sensitive potassium channels focusing on their possible clinical use within particular organ systems.
Keywords:
ATP-sensitive potassium channels – mitochondria – diabetes – Vasodilation – ischemic preconditioning – Arrhythmia – Cantú syndrome – leptin – Parkinsonʻs disease – Alzheimerʻs disease
Autoři: Kateřina Bláhová; Markéta Bébarová
Působiště autorů: Fyziologický ústav LF MU v Brně
Vyšlo v časopise: Čas. Lék. čes. 2021; 160: 71-80
Kategorie: Přehledový článek
Souhrn
ATP-senzitivní draslíkové kanály jsou už několik desetiletí podrobně zkoumaným typem proteinových komplexů začleněných do plazmatické membrány buňky. Jedinečnými je dělá jejich unikátní funkce, a sice propojení metabolického stavu buňky s napětím její povrchové membrány. Právě tato pozice jakéhosi mostu figurujícího v mnoha buněčných kaskádách jim dává neuvěřitelnou šíři využití na různorodých a často neočekávaných pozicích téměř ve všech orgánových soustavách těla, od pankreatu a srdečního svalu přes retinu až po centrální nervový systém. Tento článek shrnuje nejdůležitější funkce ATP-senzitivních draslíkových kanálů se zaměřením na jejich možná klinická využití v rámci jednotlivých orgánových soustav.
Klíčová slova:
ATP-senzitivní draslíkové kanály – mitochondrie – diabetes – vazodilatace – ischemický preconditioning – arytmie – Cantúův syndrom – leptin – Parkinsonova choroba – Alzheimerova choroba
ÚVOD
ATP-senzitivní draslíkové kanály (KATP kanály) jsou jedním z mnoha typů proteinových komplexů začleněných do buněčné membrány za účelem výměny látek mezi vnitřním a vnějším prostředím buňky. Jde o podtyp draslíkových kanálů, které obecně umožňují hydrofilním draslíkovým iontům (K+) pohybovat se přes hydrofobní membrány po jejich elektrochemickém gradientu, což u těchto iontů nejčastěji znamená směr z vnitřního prostředí buňky ven, kde je jejich koncentrace obvykle výrazně nižší. Membránové napětí díky tomu klesá do negativních hodnot (membrána se repolarizuje až hyperpolarizuje). Tento transport nastává po otevření póru kanálů, ke kterému dochází u různých typů draslíkových kanálů na různé podněty (např. při depolarizaci buněčné membrány, po vazbě intra - či extracelulárních ligandů, při měnícím se mechanickém napětí membrány).
KATP kanály se vyskytují v nejrůznějších typech membrán, a to jak v povrchové buněčné membráně, tak v membránách organel. V těle jsou přítomny v místech, která jsou asociovaná s energetickou rovnováhou; jejich funkce souvisejí s ději, pro něž je charakteristický dostatek nebo nedostatek ATP. (1) V případě malého množství ATP v buňce se KATP kanál se nemůže zavřít. K+ díky tomu opouští buňku po svém koncentračním gradientu a buněčná membrána se hyperpolarizuje. Naopak při dostatku ATP v buňce se KATP kanály uzavírají, což u některých buněčných typů (s převažujícími repolarizačními draslíkovými kanály) vede k depolarizaci buněčné membrány. Tyto změny membránového napětí jsou podnětem pro zahájení různých navazujících dějů.
KATP kanály byl objeveny v tkáni srdečního svalu v roce 1983, kdy jejich zjištění rovněž publikoval časopis Nature v práci Akinoriho Nomy. (2, 3) Poté byly nalezeny i v mnoha dalších tkáních, např. kosterních svalech, beta-buňkách pankreatu, hladké svalovině cév, endotelu a centrálním nervovém systému (CNS). (3) Postupně jsou odkrývány role, které KATP kanály hrají ve fyziologii různých tkání a rovněž v patofyziologii rozličných onemocnění. Jejich stručný přehled podává tato práce.
STRUKTURA A VLASTNOSTI KATP KANÁLŮ
KATP kanály se řadí do podkategorie inwardly rectifying draslíkových kanálů. (4) Dělí se na 2 základní podtypy: umístěné v povrchové buněčné membráně a nacházející se v membránách organel, konkrétně mitochondrií.
KATP kanály v plazmatické membráně
Z hlediska molekulární struktury KATP kanály představují heterooktamerní proteinové komplexy sestávající ze čtyř podjednotek Kir6.x a čtyř regulačních sulfonylureových receptorových podjednotek SURx (obr. 1).
Obr. 1. Schematické znázornění KATP kanálů při vysoké a nízké hladině ATP v cytoplazmě. Žlutě jsou znázorněny podjednotky Kir6.x, modře podjednotky SUR. 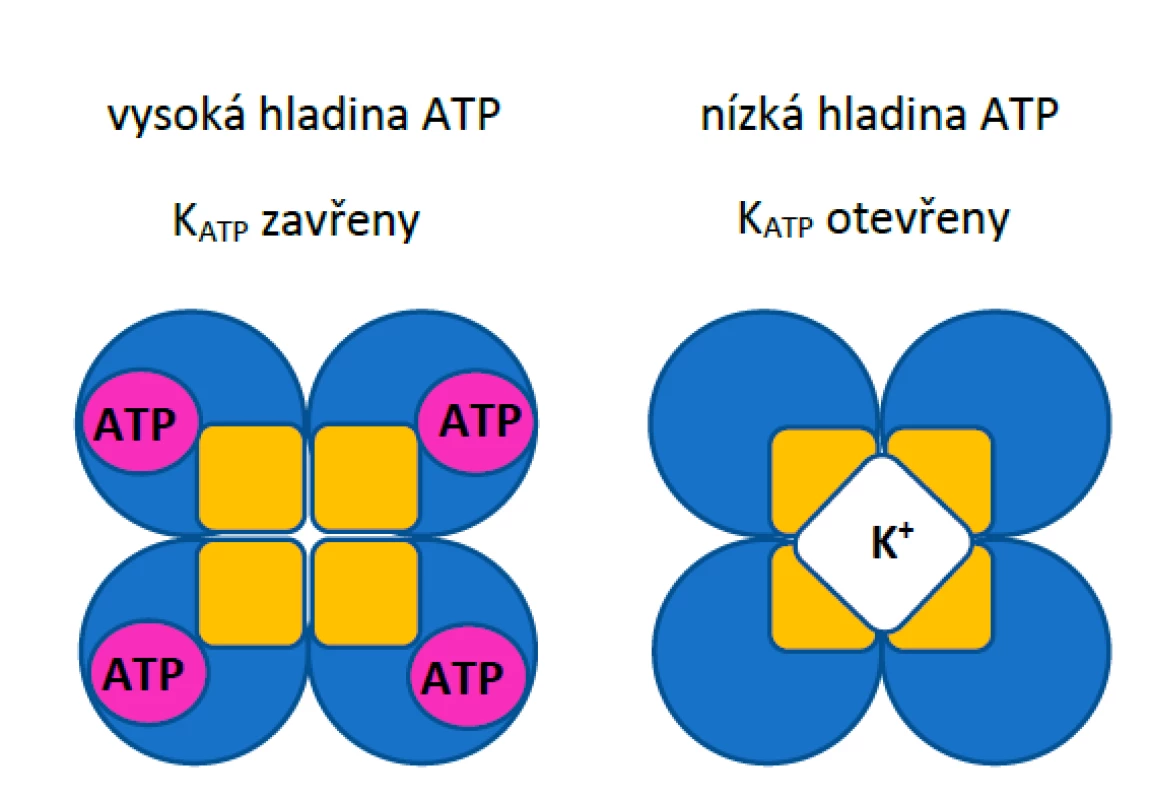
KATP kanály umístěné na plazmatické membráně buněk jsou v závislosti na anatomické lokalizaci tvořeny dvěma typy Kir6.x α-podjednotek. Kir6.1 se nejčastěji vyskytuje v kanálech v hladké svalovině, ale i v srdečním svalu, jak dokázaly pokusy na myších, u nichž mutace genů pro danou podjednotku vyvolaly vážné poruchy rytmu a kolísání krevního tlaku. (5–7) Podjednotku Kir6.2 najdeme převážně v buňkách srdečního svalu a beta-buňkách pankreatu. Huang et al. (3) také vyzdvihují podobné rozdíly mezi pomocnými podjednotkami SUR. SUR1 je hlavní regulační podjednotka v beta-buňkách pankreatu a byla nalezena i v atriích myší. SUR2 je přítomna hlavně v KATP kanálech srdce i cév. Zatímco Kir podjednotky jsou hlavním místem inhibiční aktivity ATP, ADP v buňce může uvolnit inhibici vyvolanou ATP interakcí s podjednotkami SUR. (8)
Funkcí KATP kanálů v povrchové membráně je propojit metabolický stav buňky s membránovým napětím. Změna tohoto napětí spouští rozmanité kaskády dalších dějů v závislosti na typu buňky, což vysvětluje, proč v mnoha tkáních KATP kanály hrají tak významné a občas až překvapivě různorodé role (specifikovány budou dále v textu).
KATP kanály v mitochondriích
KATP kanály lze najít i na vnitřních membránách mitochondrií (tzv. mito-KATP kanály), kde mají nezastupitelnou roli v ochraně buňky před zánikem v důsledku nejrůznějších poškození.
Mito-KATP kanály, podobně jako KATP kanály na buněčné membráně, se skládají z osmi podjednotek, které se nazývají MITOK a MITOSUR. Jejich funkce by mohla být analogická jako u podjednotek Kir6.x a SUR KATP kanálů na buněčné membráně s několika malými rozdíly. MITOK není, na rozdíl od podjednotek Kir, kompletně selektivní pro K+ (povoluje i průchod Na+) a očištěný protein sám o sobě nereagoval na přítomnost ATP. Je ale možné, že tuto senzitivitu v případě mito-KATP kanálů zajišťuje pomocná podjednotka MITOSUR. MITOK a MITOSUR dohromady totiž tvoří kanál, který je selektivní pro K+, reaguje na ATP, je aktivován diazoxidem a blokován glibenklamidem i 5-hydroxydekanoátem (5-HD), tedy kanál s vlastnostmi analogickými jako u klasických KATP kanálů nacházejících se v povrchové buněčné membráně. Pro více informací o výše zmíněných rozdílech viz Paggio et al. (9).
Tito autoři také zjistili, že nadměrná exprese MITOK způsobuje zvětšení objemu organely, zatímco odnětí této podjednotky má za následek nestabilitu membránového napětí, rozšíření intrakristálního prostoru a zeslábnutí oxidativní fosforylace. Výsledky pokusů na myších tedy dokázaly, že mito-KATP kanály odpovídají na energetický stav buňky regulací objemu a funkce mitochondrie, kdy ATP působí jako inhibitor kanálu.
Mitochondrie jsou klíčové jak pro přežití buňky, tak pro buněčnou smrt. Hlavním způsobem, jak mito-KATP kanály zasahují do těchto procesů s cílem zachránit buňku, je ischemický preconditioning. Skrze mito-KATP kanály aktivované cestou proteinkinázy C a adenosinu (10) mitochondrie prodělávají epizody přechodné ischemie, které zlepšují šance buňky na přežití a zmírňují rozsah poškození v případě skutečné ischemie, vzniklé z patologických příčin. Tento jev je nejlépe prostudován u buněk srdečního svalu, ale vyskytuje se i v buňkách mnoha dalších orgánových systémů, například retiny nebo CNS.
Akao et al. (11) si už v roce 2001 položili otázku, zda je tento cytoprotektivní účinek spojen s inhibicí apoptózy. Té se mitochondrie přímo účastní, depolarizace jejich membrány patří mezi možné spouštěče. Pokusy provedené na buňkách srdečního svalu komor novorozených myší skutečně prokázaly spojení mezi mito-KATP kanály a apoptózou buňky. Agonista KATP diazoxid, který zabraňuje depolarizaci, zvýšil přežití buněk srdečního svalu pod vlivem oxidačního stresu, zatímco přidání antagonistů KATP, jako jsou 5-HD nebo glibenklamid, tento efekt zcela inhibovalo.
Jak popisují Teshima et al. (12), otevření mito-KATP způsobí změny napětí na membráně, které vedou k poklesu akumulace Ca2+ v matrix. To preventuje vytvoření tzv. proteinu přechodné propustnosti (PTP – permeability transition protein). Tvorba a inkorporace PTP do vnitřní mitochondriální membrány jsou indukovány za patologických podmínek vedoucích apoptóze. PTP umožňuje zvýšení permeability membrány, což vede k zvětšení objemu mitochondrií a následně k buněčné smrti apoptózou nebo nekrózou. Potlačení vytvoření PTP inhibuje apoptózu, tedy ústí např. v neuroprotekci (obr. 2). V průběhu apoptotické kaskády zasahují mito-KATP kanály poměrně brzy a zmírní depolarizaci membrány. Když už k depolarizaci membrány a zahájení apoptózy dojde, jedná se o nevratný proces, do kterého ovlivňováním KATP nijak nezasáhneme. (12)
Obr. 2. Působení diazoxidu a 5-hydroxydekanoátu (5-HD) na mito- KATP kanály. 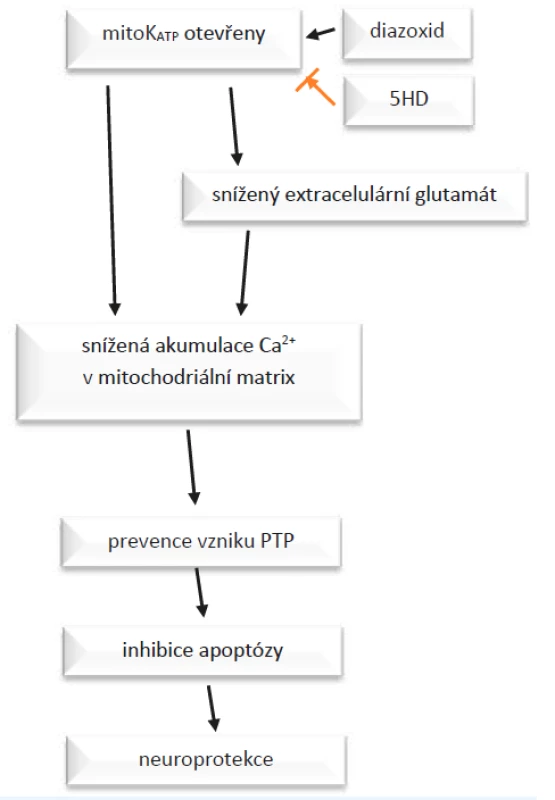
Zvýšení hladiny PTP vede k buněčné smrti následkem zvýšení permeability membrány. Mito-KATP nejsou ovlivněny pouze působením ischemie, jejich stav závisí na mnoha provázaných faktorech. V roce 2018 uveřejnili Walewska et al. (13) článek, v němž diskutují o významu propojení gasotransmiterů s funkcí KATP kanálů. Gasotransmitery, tj. malé signální molekuly plynů (např. H2S), jsou ve vyšších koncentracích toxické, zato v malých se účastní mnoha významných dějů v buňce. V roce 2016 Tang et al. (14) na univerzitě v Saskačevanu provedli pokusy, které prokázaly, že působení donoru H2S (4-karboxyfenyl izothiokyanátu) výrazně zlepšuje několik parametrů srdečních funkcí a brzdí rozvoj závažného poškození srdečního svalu po jeho ischemii.
Potrvá ještě nějakou dobu, než budeme plně chápat všechny významy a způsoby ovlivnění mito-KATP kanálů. V mnohých případech jsme zatím schopni pouze sledovat efekty jejich ovlivňování, aniž bychom si byli vědomi přesného principu daného děje. Již nyní je však jasné, že se jedná o důležité struktury přispívající k přežití buňky. Jejich ovlivnění by tedy v budoucnosti mělo být možné využít k léčbě nebo prevenci celé řady nejrůznějších chorob.
PATOLOGIE SPOJENÉ S GENETICKY PODMÍNĚNÝMI ZMĚNAMI EXPRESE ČI FUNKCE KATP KANÁLŮ
Vzhledem k důležité úloze, kterou KATP kanály v lidském těle mají, je jasné, že jejich poškození nebo nesprávná funkce může mít velice vážné dopady na celý organismus. Kromě jejich zásadní a dobře známé role při sekreci inzulinu lze při poruše funkce KATP kanálů pozorovat rozmanité patologické změny v nejrůznějších orgánových soustavách. Často se jedná o kombinace několika poruch sdružující se v charakteristické syndromy, jak bude rozvedeno dále.
Geneticky podmíněné patologické změny exprese či funkce KATP kanálů tvoří podklad mnoha kardiovaskulárních (KV) onemocnění. Klinické následky mutací se liší podle pozměněné (či nefunkční, resp. chybějící) podjednotky. V současné době známe kolem 50 různých mutací podjednotky Kir6.2. Její varianta E23K je častým nálezem u městnavých srdečních selhání a nacházíme ji i u pacientů s komorovými arytmiemi při dilatační kardiomyopatii. (3) Suzuki et al. ve své práci z roku 2001 (15) dokázali, že genetická ablace této podjednotky nijak nemění srdeční výkon za normálních podmínek, ale zhoršuje jeho zotavení po námaze a zvyšuje pravděpodobnost ischemicko-reperfuzního poranění.
Genetické změny podjednotky SUR1 způsobují v rámci KV systému hlavně onemocnění koronárních tepen, plicní hypertenzi a fibrilaci síní. (3) V této skupině vyniká missense varianta SUR1 spojovaná s Kir6.2 variantou E23K, která sice značně zvyšuje riziko vzniku diabetu mellitu 2. typu, ale působí výhodně pro tělesnou distribuci tukové tkáně a snižuje riziko ischemické choroby srdeční. Další varianty SUR1 mohou způsobovat vrozené vývojové vady srdce, velké síňové defekty, AV blok 1. stupně, flutter síní a defekt komorového septa. (16) Delece SUR1 na myších modelech nezpůsobovala žádné závažnější poruchy (17) a nadměrná exprese také ne, snad kromě prodlouženého PR intervalu, pokud ovšem nebyla nadměrně exprimována i podjednotka Kir6.2. (18) Vzhledem k tomu, že KATP kanály v buňkách srdečního svalu jsou u člověka z větší části tvořeny typem s podjednotkami SUR2, je s podivem, že mutace SUR1 způsobují takovou řadu nejrůznějších postižení KV systému. Anatomické rozdělení lokalizací KATP kanálů se SUR1 a SUR2 tedy nemusí být tak jednoznačné, jak by se mohlo zdát.
Kromě množství nespecifických poruch srdečního svalu způsobují mutace v podjednotce SUR2, konkrétně v genu ABCC6, zajímavý Cantúův syndrom. Jde o komplexní poruchu projevující se vrozenou hypertrichózou (nízká linie vlasů, ochlupené paže, nohy, záda), hrubými rysy tváře (epikanty, palpebrální fisury skloněné dolů, plné rty, široká tvář), osteochondrodysplazií, kardiomegalií a dilatovanými cévami. Poprvé byl popsán v roce 1982 a v roce 2012 byl dán do souvislosti s mutací v genu ABCC6. Dosud bylo zjištěno více než 15 různých mutací tohoto genu, ale vesměs u všech zahrnují sníženou ATP inhibici a zvýšenou aktivaci MgADP. (3, 19) Theis et al. (20) ve svém výzkumu z roku 2019 popisují Cantúův syndrom jako důsledek mutace genů ABCC9 a KCNJ8 působících zvýšenou funkci jejich bílkovinných produktů.
U mnohých genetických mutací podjednotek KATP kanálů v srdci nebyla zjištěna příčinná souvislost s klinickými projevy. Podle současných pokynů pro interpretaci těchto variant uznáváme pouze asociaci mutace genu ABCC9 s Cantúovým syndromem a genu ABCC8 s hyperinzulinismem. (3) Lze ale předpokládat brzké rozšíření tohoto seznamu, protože existují přesvědčivé důkazy například pro asociaci mutací v genu ABCC8 s neonatálním diabetem mellitem (DM) (3), jak to ukazuje např. kazuistika, kterou publikovali Cho et al. (21) Tito autoři popsali případ, kdy byly deriváty sulfonylurey úspěšně použity k léčbě tzv. DEND syndromu (developmental delay, epilepsy, neonatal diabetes), což je nejzávažnější forma postižení zvaného permanentní novorozenecký DM (PNDM). DEND syndrom je často zaměňován za diabetes 1. typu (DM1), jak se stalo právě v tomto případu. Krátce po narození byla laboratorně zjištěna hyperglykemie, diagnostikován DM1 a zahájena terapie inzulinem podkožně. Novorozenec začal krátce po porodu vykazovat záchvaty trvající 2–3 minuty, bez ztráty vědomí nebo postiktálního spánku. V 10 měsících věku dítě neudrželo hlavičku, nenavazovalo oční kontakt a nesedělo bez pomoci, jako 21měsíční byl vývojově na úrovni 3měsíčního kojence. U pacienta byla zahájena terapie antiepileptiky. Až v jeho 17 letech bylo provedeno přímé sekvenování genomu a odhalena heterozygotní mutace genu KCNJ11.
Mutace v genech KCNJ11 nebo ABCC8 způsobují změny podjednotek Kir6.2 a SUR1, což v raném věku může vést buď k rozvoji vrozeného hyperinzulinismu s permanentní hypoglykemií, pokud jde o mutace tlumicí funkci KATP kanálů, nebo naopak k symptomům DM, pokud jde o mutace, jež funkci KATP kanálů podporují. Mutace identifikovaná u výše zmíněného pacienta snižuje citlivost KATP kanálů, které zůstávají otevřené navzdory vysoké hladině ATP v buňce, což znemožňuje adekvátní sekreci inzulinu. U pacienta byla následně zahájena úspěšná léčba derivátem sulfonylurey gliklazidem, jenž stimuluje sekreci inzulinu zablokováním KATP kanálu. Po třech měsících podávání gliklazidu mohl být vysazen inzulin. Mohla být vysazena i antiepileptická terapie, EEG pacienta se dostalo do normy. Bohužel těžkou psychomotorickou retardaci už nebylo možné zvrátit. V současné době by tedy měli být všichni, kterým byl diabetes diagnostikován během prvních šesti měsíců života, testováni pro možné defekty genů KCNJ11 a/nebo ABCC8.
Lebl et al. (22) vysvětlují, že vrozený hyperinzulinismus může být způsoben i poruchou pouze jedné z podjednotek KATP kanálu. KCNJ11 a ABCC8 kódují obě, což zvlášť u homozygotních nositelů jejich defektů způsobuje život ohrožující stavy těžké hypoglykemie. Podezření na geneticky podmíněný hyperinzulinismus bychom měli podle těchto autorů pojmout, je-li koncentrace inzulinu u hypoglykemického novorozence neobvykle vysoká navzdory nízkým hladinám glukózy, které by za normálních okolností nadprodukci inzulinu potlačily.
Amaratunga et al. (23) zaznamenali častější výskyt defektních genů KCN11 a ABCC8 u dětí z kurdských rodin. Tým pediatrů z 2. lékařské fakulty UK v Praze ve spolupráci s pediatry z univerzity v irácké Sulejmánii popisuje hned 3 nově nalezené defektní varianty těchto genů u tří údajně nepříbuzných rodin s výskytem novorozeneckého hyperinzulinismu. Vzhledem k poměrně častým příbuzenským sňatkům v kurdské oblasti Iráku by se geneticky podmíněným hyperinzulinismem, který způsobily defekty genů pro KATP kanály, dalo vysvětlit vysoké procento prozatím neobjasněných náhlých úmrtí novorozenců. Roženková et al. (24), kteří stáli i za výše popisovaným výzkumem provedeným v Iráku, se ve své předchozí studii soustředili na rozložení defektních genů pro KATP kanály v české populaci. Celkem podrobili zkoumání 40 pacientů s vrozeným hyperinzulinismem. Mutace nalezli u poloviny z nich, 19 bylo heterozygotů a 1 homozygot. Nejčastěji se jednalo o změny v genu ABCC8.
Jak bylo zmíněno výše, v nepříliš vzdálené budoucnosti se seznam genů asociovaných s patologiemi vázanými na poruchu funkce KATP kanálů velmi pravděpodobně rozšíří. Uvedení těchto poznatků do klinické praxe je velmi významné pro včasné zahájení účinné léčby, ať medikamentózní nebo v budoucnu snad i přímo genovou terapií.
V následujících podkapitolách se budeme podrobněji věnovat specifikům KATP kanálů v různých orgánových systémech a jejich roli v patologiích těchto systémů.
KATP KANÁLY V MYOKARDU
KATP kanály hrají v srdečním svalu významnou protektivní roli při regulování jeho vzrušivosti během metabolického stresu. Aktivace KATP kanálů snižuje pravděpodobnost ischemicko-reperfuzního poranění, ochraňuje buňky myokardu před srdečním selháním a za určitých situací snižuje výskyt arytmií. (25)
Buněčná membrána srdečního svalu je místem, kde byly KATP kanály nalezeny poprvé. (2, 3) Vzhledem k jejich napojení na nitrobuněčné hladiny ATP a ADP byly považovány za významné pro ovlivnění kontraktility kardiomyocytů na základě jejich metabolického stavu. Bylo ale zjištěno, že fyziologické hladiny ATP v buňce srdečního svalu (rozmezí 1–5 mmol/l) jsou příliš nízké, než aby na ně KATP kanály reagovaly (26), proto bylo třeba hledat jiné způsoby, jak jsou tyto kanály ovlivňovány.
Fatehi et al. (8) naznačují, že KATP kanály v plazmatické membráně buněk myokardu reagují jako mechanoreceptory a jejich aktivita je provázaná se zvýšenou srdeční prací. Molekulární princip tohoto děje bohužel dosud není přesně znám. Na základě výsledků svého výzkumu v roce 2017 tento tým nakonec uvedl hypotézu, podle níž zvýšené mechanické napětí membrány ovlivní vnitřní Mg-ATP-ázovou aktivitu KATP kanálu. Mg-ATP-áza je enzymatický systém v plazmatické membráně, jehož substrátem je Mg-ATP a který transportuje Mg2+ a ATP v poměru 1 : 1. (27) Ovlivnění její aktivity způsobí otevření KATP kanálu. Tato aktivace natažením vyžaduje přítomnost podjednotky SUR. Inhibice Mg-ATP-ázy velice výrazně redukovala stimulační schopnosti mechanického natažení.
Katalytické místo tohoto enzymu se nachází na podjednotce SUR. To vysvětluje rozdíl mechanosenzitivity mezi kanály s podjednotkami SUR2 a SUR1, lišícími se složením v jedné aminokyselině, které jsou exprimovány na buňkách myokardu v různých anatomických lokalizacích srdce – SUR1 v síních a SUR2A komorách. Jako potvrzení této teorie by mohl sloužit fakt, že působením perorálního antidiabetika glibenklamidu byla mechanosenzitivita KATP kanálu zcela inhibována (mechanismem účinku je vazba na SUR). Sulfonylurea i další perorální antidiabetika glinidy fungují vazbou na KATP kanály, avšak liší se v rámci svých receptorů místem s největší afinitou. Repaglinid, gliklazid i glibenklamid inhibují KATP kanály mírně jiným způsobem. Lze proto předpokládat, že i jejich účinek na mechanosenzitivitu bude jiný. Experiment prokázal, že pouze glibenklamid, který má afinitu k vazebným místům jak gliklazidu, tak repaglinidu, je schopen stimulační efekt natažení membrány inhibovat, zatímco u zbylých dvou nebyl v této oblasti prokázán jakýkoliv účinek.
KATP kanály nabývají významu především za stavů charakteristických nedostatkem kyslíku pro buňky myokardu. Podílejí se na fenoménu, který se nazývá ischemický preconditioning a slouží jako prevence ischemicko-reperfuzního poškození. V případech, kdy z nejrůznějších důvodů nedochází k dostatečnému zásobení srdce krví, vznikají v srdečních buňkách nedostatek ATP, acidóza a nahromadění toxinů. Po odeznění této hypoxické epizody se dále přidají volné kyslíkové radikály a změny protonového gradientu, a to jak na buněčné membráně, tak na membráně mitochondrií dané buňky. To vše ústí v značné poškození buňky, i když byl průtok okysličené krve obnoven. Právě tento fenomén se nazývá ischemicko-reperfuzní poškození. (28)
Ischemický preconditioning je obecně definován jako krátká, opakovaná navození ischemie, jejichž důsledkem je větší odolnost srdce během patologických stavů ischemie, nejčastěji infarktu myokardu. KATP kanály hrají v tomto procesu jednu z hlavních rolí, a to jak KATP kanály na buněčné membráně buňky srdečního svalu, tak na vnitřní membráně jejích mitochondrií (mito-KATP kanály). (28) Při nedostatku ATP, který následuje ischemii, jsou mito-KATP kanály otevřené, což sníží elektrický gradient na membráně. Mitochondrie se tak stanou odolnějšími vůči stresu uchováváním energie (při nepotřebě zachování elektrického gradientu) a zvyšují šanci buněk na přežití. Na snížení hladin ATP v buňce reagují i KATP kanály na buněčné membráně a způsobí hyperpolarizaci. (29) To sníží vtok Ca2+ přes napěťově řízené vápníkové kanály, a zabrání tak vzestupu koncentrace Ca2+ v cytoplazmě, což by spustilo apoptózu. (30)
Ošťádalová et al. (31) experimentovali se srdci novorozených myší, aby zjistili, zda ischemický preconditioning nebo hypoxie prenatálně či časně postnatálně zvyšuje jejich odolnost vůči ischemii. Tato zjištění by mohla mít velký klinický význam pro udržení co nejlepších podmínek srdcí novorozenců operovaných pro závažné srdeční vady. Ukázalo se, že ischemický preconditioning kombinovaný s prenatální hypoxií je mnohem účinnější než osamocený protektivní účinek jednoho či druhého fenoménu. Zpochybnili také vliv mito-KATP kanálů na ischemický preconditioning u srdcí v prvních dnech života novorozence, což zdůvodnili rozdílnou strukturou myokardu v různých fázích vývoje. Toto potvrdili i Doul et al. (32), kteří experimentálně dokázali, že mito-KATP kanály nemají vliv na odolnost srdce novorozených myší vůči ischemicko-reperfuznímu poranění.
Pertiwi et al. (28) uveřejnili v roce 2019 svůj výzkum, v jehož rámci se věnovali změnám srdečních fibroblastů v myofibroblasty vlivem ischemie. Rovněž se zabývali otázkou, jak může ischemický preconditioning tyto změny, které tvoří jeden z důvodů poruchy elasticity srdeční tkáně po infarktu myokardu, ovlivnit. Série pokusů dokázala, že ischemický preconditioning snížil množství změn fibroblastů v myofibroblasty. Dále se prokázalo, že použití aktivátorů (pinacidil, diazoxid) KATP kanálů vyvolá stejný efekt jako ischemický preconditioning, zatímco blokátory (glibenklamid, 5-HD) jeho efektivitu snižují.
Podpora funkce KATP kanálů, která by pomohla zmenšit poškození srdce po ischemii, je tedy pro klinickou praxi očividně velice žádoucí. Práce z roku 2017 (33) shrnuje dosud známé možnosti využití tohoto fenoménu v praxi. Mohlo by jít o ischemický postconditioning, při němž bychom myokard vyváděli z hypoxie pouze pomalu, což by zmírnilo poškození z reperfuze. Farmakologický preconditioning byl zaznamenán při použití inhalačních anestetik. (34) Stejný preventivní účinek má i pravidelná aerobní fyzická aktivita, která se z výše uvedeného výčtu zdá jako nejvhodnější. Bylo by ovšem nutné začít ji provozovat již před nástupem ischemie, což naráží na nedostatečnou ochotu ke spolupráci ze strany pacientů. (35)
V roce 1993 byl poprvé popsán tzv. vzdálený preconditioning, kdy preventivně a dočasně uvádíme myokard do hypoxie blokováním povodí koronárních tepen. Krátkodobé epizody ischemie jednoho povodí ochrání od následného poškození nejen ty buňky srdečního svalu, které jsou zásobeny danou okludovanou tepnou, ale i buňky ostatních povodí. (36) Dosažení koronárních tepen za tímto účelem je příliš problematické, než aby se tato strategie dala využít klinicky. Stejné ochrany myokardu však bylo dosaženo i navozením epizod ischemie jiných orgánů, což už by mohlo jít v praxi aplikovat snadněji. (37)
KATP KANÁLY V CÉVÁCH
KATP kanály hrají významnou roli jak v hladké svalovině cév, tak v endotelu. Jedním z nejdůležitějších efektů KATP kanálů hladké svaloviny cév je vazodilatace při hypoxii. Při depolarizaci membrány jsou vápníkové kanály řízené napětím otevřené a umožňují prostup Ca2+ po koncentračním gradientu do buňky. To vede k fosforylaci myozinových vláken a svalové kontrakci. Hyperpolarizace způsobená KATP kanály aktivovanými díky poklesu hladiny ATP v buňce během hypoxie způsobí uzavření napěťově řízených vápníkových kanálů, což vede k relaxaci buňky hladkého svalu, a tedy k vazodilataci.
Zajímavé je srovnat efekt KATP kanálů v cévách systémového řečiště s působením O2-senzitivních draslíkových kanálů (dále KO2 kanálů) v plicních cévách. Zde totiž hypoxie, právě přes ovlivnění aktivity KO2 kanálů, působí naopak vazokonstrikci. Nízká hladina kyslíku v plicním alveolu znamená, že daný alveolus nepracuje efektivně. Proto by bylo nehospodárné, a navíc přímo kontraproduktivní, aby byl takový alveolus zásoben krví s cílem okysličit ji. Vedlo by to k navýšení pravolevého zkratu a snížení saturace hemoglobinu kyslíkem. Na tomto příkladu jasně vidíme, jak tentýž stimul způsobuje odlišné odpovědi v různých částech cévního řečiště podle druhu tamních draslíkových kanálů. (1)
Z důvodu výše zmíněné indukce vazodilatace v systémovém řečišti lze používat agonisty KATP (kromakalim, pinacidil, diazoxid, minoxidil a nikorandil) k farmakologickému navození vazodilatace (např. pro navození efektu ischemického preconditioningu, při léčbě vysokého nitroočního tlaku, viz dále), která je ukončena působením glibenklamidu (perorální antidiabetikum, má potenciál pro léčbu Alzheimerovy choroby).
Přes KATP působí i řada endogenních vasodilatátorů – neurotransmitery, endotelové faktory a buněčné metabolity. Mezi takové látky patří například protein CGRP (calcitonin gene-related peptide), který se nachází v perivaskulárních nervech mnoha tkání a otevírá KATP kanály. Jeho efekt ovšem není zcela vyrušen blokátory KATP kanálů, proto se dá usuzovat, že pracuje i jinými mechanismy. Podobný případ představuje i vazoaktivní intestinální polypeptid (VIP). Endotelem je produkován oxid dusný (NO), který způsobuje vasodilataci hned několika mechanismy včetně ovlivnění KATP kanálů. (38)
V roce 2019 uveřejnili Centeno et al. zajímavou práci (39) zmiňující sulfan (H2S), který ovlivňuje více než jeden druh draslíkových kanálů. Na KATP kanály působí H2S přes receptory na podjednotce Kir6.x, sníží afinitu k ATP a vyvolává otevření kanálu. Jako agens ovlivňující KATP kanály v cévách tedy způsobuje vazodilataci. Jeho hladiny mají tendenci klesat při diabetu, což vede ke změnám zapojení, exprese nebo funkce ovlivňovaných draslíkových kanálů včetně KATP. Tento efekt byl doložen v aortě, mezenterických arteriích a plicnici. (40) Exprese KATP kanálů nebyla u diabetických králíků nijak modifikována. Ukázalo se, že DM zvyšuje senzitivitu k agonistovi KATP kanálů pinacidilu, po jeho podání docházelo k výraznější vazorelaxaci. Po přidání antagonisty těchto kanálů (glibenklamidu) byla senzitivita králičí karotidy k pinacidilu naopak nižší u diabetických subjektů než u kontrol. Relaxace byla sice inhibována u diabetických i kontrolních probandů, diabetičtí ale vykázali větší míru relaxace než kontrolní. To naznačuje vyšší aktivitu KATP kanálů v králičích karotidách při DM.
KATP KANÁLY V PANKREATU
KATP kanály tvoří nedílnou součást systému, který umožňuje správnou funkci beta-buněk pankreatu. Jsou nezbytné k propojení metabolismu glukózy a sekrece inzulinu. Jedná se o evolučně velice starý a neměnný princip, což jen dokazuje jeho efektivitu napříč nejrůznějšími živočišnými třídami, tedy i u člověka. Empfinger et al. (41) zkoumali fungování těchto kanálů u dánia pruhovaného a zjistili, že vykazují strukturu podjednotek a metabolickou citlivost velice podobnou lidským.
Existuje několik druhů transportérů glukózy (GLUT), které mají za úkol pasivně přenášet hydrofilní glukózu z krevního oběhu do nitra buňky, kde je použita při tvorbě ATP. Na povrchu beta-buněk se nachází izoforma GLUT2, přítomná také v játrech, s vysokou kapacitou a nízkou afinitou pro glukózu, což umožňuje, aby sloužila jako senzor hladiny glukózy pro potřeby beta-buněk pankreatu. (42)
Při nízké plazmatické hladině glukózy je množství tohoto sacharidu proudící do buňky malé, což znamená, že hladina ATP zůstává nízká a KATP kanály jsou otevřené. V důsledku toho dochází k úniku K+ z buňky a buněčná membrána se hyperpolarizuje. Jak hladina glukózy v krvi stoupá (obr. 3), vstupuje do buňky přes transportéry GLUT2. Hladina ATP se zvyšuje, což působí uzavření KATP kanálů. Dochází k depolarizaci plazmatické membrány a otevření vápníkových kanálů řízených napětím. Vtok Ca2+ do buňky navodí sekreci inzulinu exocytózou. (41)
Obr. 3. Princip fungování KATP kanálů v rámci beta-buňky pankreatu. 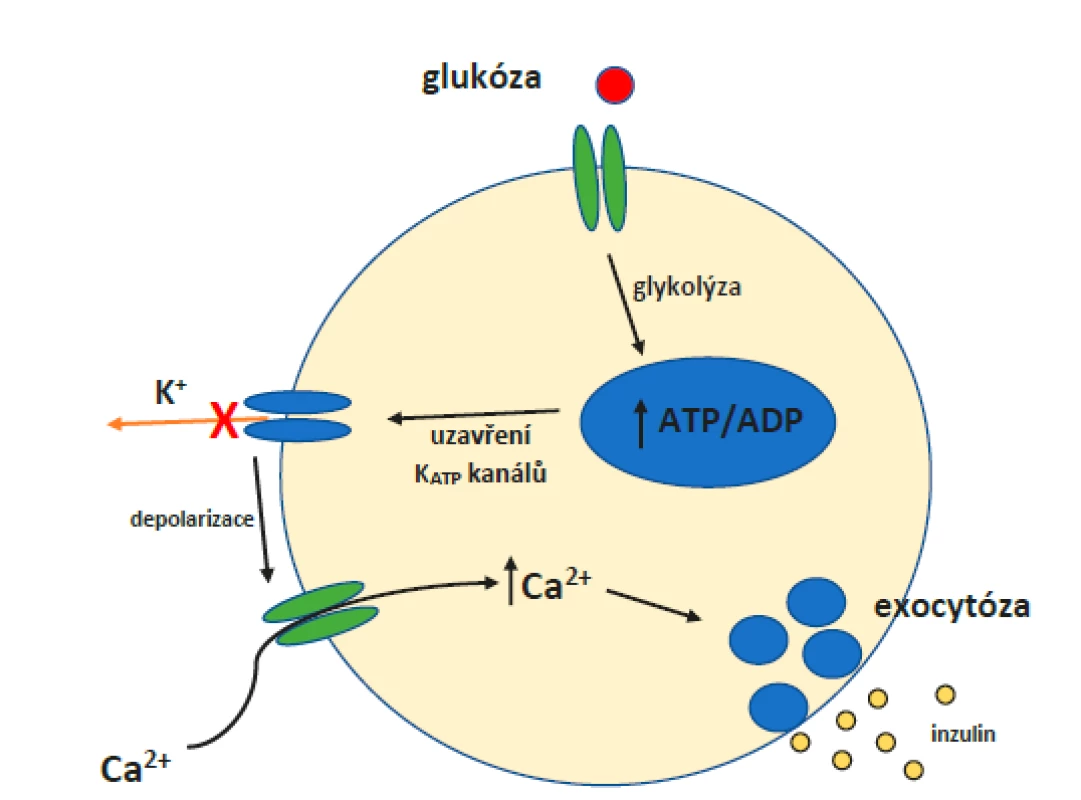
Cesta od vstupu molekuly glukózy do buňky přes glykolýzu, zvýšení poměru ATP/ADP, uzavření KATP kanálů, depolarizaci membrány, aktivaci a otevření napěťově řízených vápníkových kanálů a přírůstek nitrobuněčného množství Ca2+ až po exocytózu inzulinu. Vylučování inzulinu a jeho závislost na hladině glukózy v krvi je složitě vyvažovaný proces, který zdaleka nezávisí jen na KATP kanálech. V roce 2019 vydali Cochrane et al. článek, v němž shrnoval závěry výzkumů ohledně vlivu leptinu na beta-buňky pankreatu a samotné KATP kanály. (43, 44) Leptin je peptidický hormon produkovaný buňkami bílé tukové tkáně. Říká se mu také „hormon sytosti“. Experimenty na myších prokázaly, že jedinci s vyřazeným genem pro leptin vykazují energetickou nestabilitu, která se projevuje obezitou, hyperinzulinemií a jinými příznaky typickými pro DM 2. typu (DM2). (45) Je ovšem zajímavé, že hyperinzulinemie spojená s hypoglykemií se vyvinula nejprve a všechny ostatní příznaky až v návaznosti na ni. Dodávání leptinu myším v tomto stadiu dokonce zabránilo vývoji obezity a dalších příznaků. (46) Z toho je patrné, že leptin hraje významnou roli v homeostáze glukózy, a ač jeho nejznámější účinky jsou centrální, beta-buňky pankreatu byly identifikovány jako nejpravděpodobnější periferní cíl leptinu. Samotné beta-buňky pro něj mají receptory. Jelikož jedním z účinků inzulinu je adipogeneze, bylo pro rovnováhu inzulin-leptin navrženo pojmenování „adipoinzulární osa“. (44)
Jak je popsáno výše, při nízké hladině ATP zůstávají KATP kanály otevřené, což vede k hyperpolarizaci buňky, a při vysoké hladině se zavřou, což vede k depolarizaci. Leptin podporuje přenos KATP kanálů na povrch buňky, což způsobí větší citlivost buňky a také výraznější následnou hyperpolarizaci, která brání sekreci inzulinu. Počet kanálů se po zásahu leptinu zvýší až čtyřnásobně. Tento efekt je pouze přechodný a fyziologicky má pravděpodobně za úkol zabránit dlouhodobému uvolňování inzulinu. Navázání leptinu ovlivní N-methyl-D-aspartátové (NMDA) receptory a umožní vtok Ca2+ do buňky, což spustí kalcium-dependentní signální kaskádu. Receptory NMDA jsou známy hlavně z CNS, kde hrají nezastupitelnou úlohu. V neuronech hipokampu funguje jejich signální kaskáda prostřednictvím CaMKKβ-AMPK, je proto velmi pravděpodobné, že se stejný princip uplatňuje i v pankreatu. CaMKKβ-AMPK je komplex AMP-aktivované proteinkinázy (AMPK), což je důležitý regulátor energetické homeostázy, fosforylované prostřednictvím CaMKKβ (Ca2+/calmodulin-dependent protein kinase kinase β). Pokusy in vitro i in vivo tuto domněnku potvrzují. (43) Bohužel zatím neznáme přesnou návaznost dějů od AMPK dále ke konečnému přesunu kanálů na povrch, jistý je pouze značný význam přestavby aktinových filament v buňce (obr. 4).
Obr. 4. Signální dráha od receptoru pro leptin až po transport KATP kanálu na povrch buňky 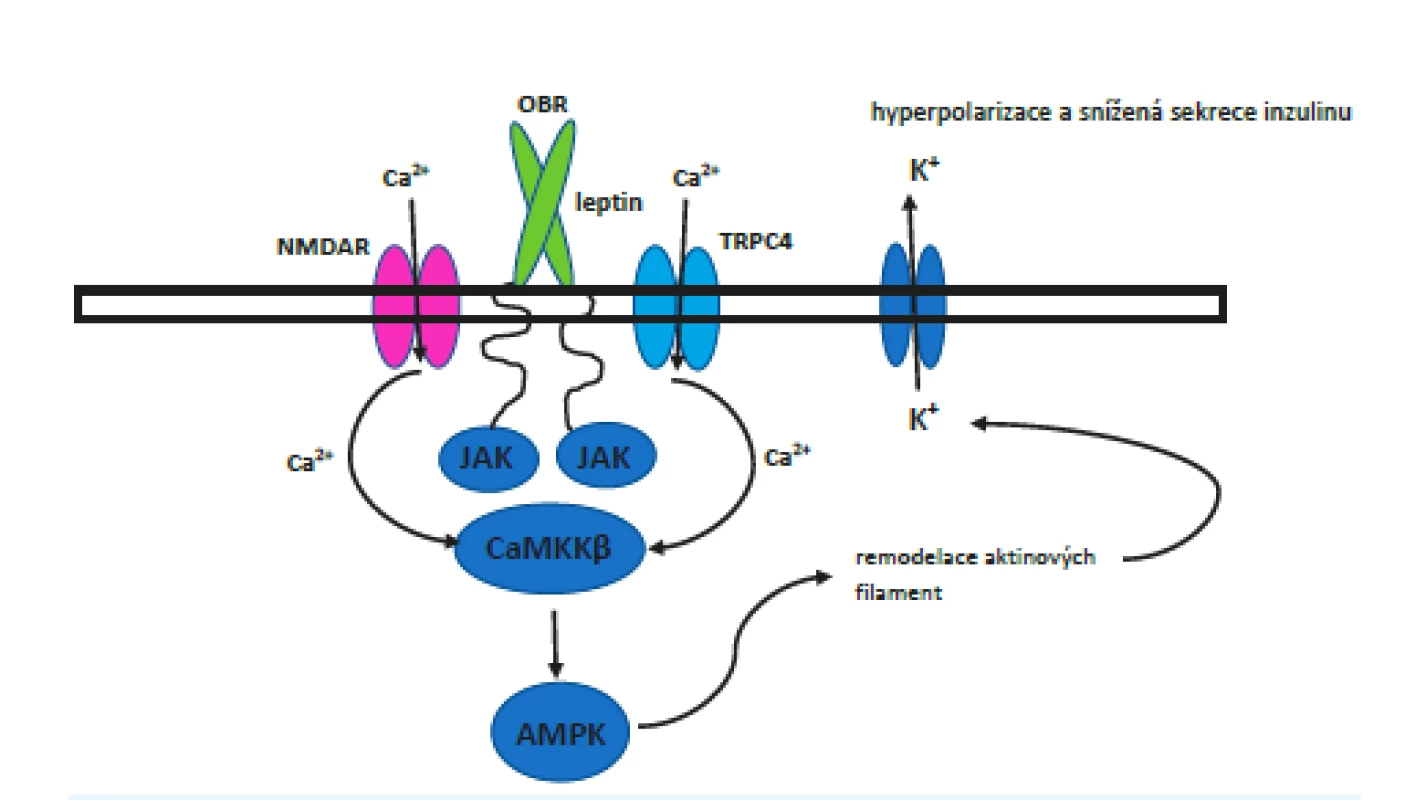
Pozn.: OBR - receptor pro leptin, NMDAR - N-methyl-D-aspartátový receptor; TRPC4 – TRP (transient receptor potential) iontový kanál 4; JAK – Janusova kináza; CaMKKβ – kalmodulin-dependentní proteinkináza-β; AMPK – proteinkináza aktivovaná AMP. Pokud by se v budoucnu podařilo plně odkrýt mechanismy účinku leptinu a hladiny glukózy na vystavování KATP kanálů na povrch beta-buněk a následné vylučování inzulinu, umožnilo by to terapeuticky ovlivnit další body kaskády vedoucí k hyperinzulinemii. Marquard et al. (47) provedli v tomto směru sérii pokusů, v nichž zjistili, že inhibice výše zmíněných NMDA receptorů v myších a lidských beta-buňkách zvýšila sekreci inzulinu vylučovaného v návaznosti na příjem potravy a také prodloužila čas, který beta-buňky stimulované glukózou strávily v depolarizovaném stavu s vysokými nitrobuněčnými koncentracemi Ca2+. Pokusy na myších dále ukázaly zvýšenou glukózovou toleranci u skupiny, které byl podán antagonista receptorů NMDA dextrometorfan. Dlouhodobá léčba dextrometorfanem ukázala vyšší sérové koncentrace inzulinu a zvýšenou glukózovou toleranci v pokusné skupině myší s modelovým DM2 v porovnání s kontrolami. V rámci této práce byly publikovány i výsledky menší klinické studie na dobrovolnících s DM2 (20 mužů; placebem kontrolovaná dvojitě zaslepená studie). V souladu s výsledky na animálním modelu došlo u těchto pacientů po aplikaci dextrometorfanu ke zvýšení sérové koncentrace inzulinu po perorálním podání glukózy a ke zlepšení glukózové tolerance.
Převedení těchto závěrů do praxe by mohlo znamenat nový způsob prevence nebo léčby diabetu 2. typu, zvláště u lidí s metabolickým syndromem, problémem jsou ovšem návykovost dextrometorfanu a možnost jeho zneužití jako rekreační drogy.
KATP KANÁLY V OČNÍCH TKÁNÍCH
Funkce retinálních gangliových buněk je závislá na přítomnosti iontových kanálů, přičemž různé typy draslíkových kanálů představují jejich nemalou část. Mimo jiné zde nalezneme i KATP kanály, které mají neuroprotektivní funkci a umožňují přežití buněk retinálního ganglia.
Ischemický preconditioning v retině
Ischemický preconditioning je v retině, podobně jako i v srdci, způsoben krátkodobými drobnými ischemiemi, což je vysoce efektivní v prevenci následků vážnějších ischemií a poškození z reperfuze. (48)
Ettaiche et al. (49) provedli sérii pokusů na myších, které podrobili sérii ischemií v trvání 3, 20 a 40 minut a na elektroretinogramech (ERG) zaznamenávali funkční zotavení retiny. Ischemický preconditioning byl napodoben agonistou KATP kanálů (kromakalim). Myši, kterým byl kromakalim podán jeden až tři dny před 20minutovou ischemií, měly výrazně lepší ERG než kontroly (A i B vlna na ERG se u kontrol normalizovala na své preischemické hodnoty za dobu dvojnásobně dlouhou). Ischemický preconditioning v retině tedy vzniká na stejném principu jako v buňkách srdečního svalu. Aktivací KATP kanálů můžeme zvýšit odolnost retiny vůči vážnému ohrožení dočasnou ischemií.
Ovlivnění nitroočního tlaku
Glaukom je nejčastějším onemocněním vzniklým v důsledku zvýšeného nitroočního tlaku, ale jeho současná léčba (analoga prostaglandinu, betablokátory) je zatížena množstvím nežádoucích účinků. Chowdhury et al. v roce 2017 uveřejnili článek (50), ve kterém vyzdvihli význam molekul, které pomáhají otevírat KATP kanály, jako možných účinných látek použitelných při přípravě léčiv cílících nejen na glaukom, ale na celé spektrum chorob související se zvýšeným nitroočním tlakem. Otevírání a zavírání KATP kanálů ovlivňuje kontraktilitu buněk, adhezi, gap junctions, různé druhy adaptace na stres. Všechny tyto procesy mají své místo v ovlivňování tvorby a odchodu nitrooční tekutiny.
Pokusy prokázaly, že použití látek otevírajících KATP kanály (diazoxid, nikorandil a kromakalim) vede ke zřetelnému poklesu nitroočního tlaku. Tento pokles byl navíc zcela reverzibilní a efekt účinných látek byl inhibován glibenklamidem, který KATP kanály uzavírá. Pro porovnání by se dal vyzdvihnout účinek klinicky využívaného latanoprostu, analogu prostaglandinu F2, který je v současnosti zařazen mezi léky první volby pro léčbu glaukomu s otevřeným komorovým úhlem a oční hypertenze. (51) Během 2 týdnů léčby latanoprost snížil nitrooční tlak o 18 %, zatímco látky působící na KATP o 19–25 %. Histologické zkoumání tkání, které byly pod vlivem KATP otevírajících látek, nepotvrdilo žádné změny buněk oproti fyziologickému stavu. Diazoxid, nikorandil a kromakalim proto můžeme pravděpodobně označit za účinné látky pro léčbu zvýšeného nitroočního tlaku bez vážných nežádoucích účinků na oko. (50)
ROLE KATP KANÁLŮ PŘI NEURODEGENERATIVNÍCH CHOROBÁCH
Parkinsonova choroba
Jak již bylo zmíněno výše, mito-KATP kanály hrají významnou roli ve fyziologii mitochondrií a ochraňují buňky proti nadměrné ischemii a reperfuznímu poranění. Peng et al. (52) prokázali jejich význam i v mozku, konkrétně v patogenezi Parkinsonovy nemoci (PN).
Parkinsonova choroba, jejíž hlavní znak představuje degenerace dopaminergních neuronů, je po Alzheimerově chorobě druhým nejčastějším neurodegenerativním onemocněním. Její příčiny tvoří hlavně mitochondriální dysfunkce, zánětlivé změny a oxidační stres, přičemž první ze zmíněných důvodů hraje klíčovou roli. Dřívější studie neobjasnily přesný mechanismus těchto dějů, ale dokázaly spojitost s mitochondriální dynamikou – dělením a fúzí. (53)
Novější výsledky ukázaly, že těchto dějů se účastní mito-KATP kanály. Byl sestaven pokus s agonisty a antagonisty mito-KATP, s cílem vyhodnotit rozdíly reakcí mozkových buněk na roteron, alkaloid vyvolávající degeneraci dopaminergních neuronů analogickou jako u PN. (52) Výsledky byly překvapivé. Působení diazoxidu (agonista KATP) zvýšilo neurotoxicitu způsobenou roteronem, naopak premedikace 5-HD (antagonista KATP) měla protektivní účinek – tato zjištění jsou tedy opačná než u případů poškození buňky ischemií, kdy otevření kanálů agonisty působí protektivně. Poznatky byly ověřeny in vivo na potkanech (52) a ukázalo se, že poškození mozku a strukturální abnormality skupiny ovlivněné současně diazoxidem a roteronem byly větší než v kontrolní skupině se samotným roteronem a že 5-HD vykazuje značný neuroprotektivní efekt proti roteronu. Otevřený stav mito-KATP tedy zhoršoval neurotoxicitu indukovanou roteronem, kdežto blokování kanálu bránilo dopaminergní neurodegeneraci.
Mito-KATP kanály jsou v dopaminergních neuronech zřejmě tvořeny podjednotkami Kir6.1 a SUR2B. (52) Jak bylo zjištěno, roteron použitý ve výše popsaném experimentu vedl ke značnému nárůstu exprese podjednotky Kir6.1 u buněk potkanů postižených Parkinsonovou chorobou. Zablokování Kir6.1 vykázalo výrazný protektivní účinek. Proto je pravděpodobné, že je to právě Kir6.1, co je regulováno roteronem a modulátory KATP a jejíž ovlivnění je klíčem k ochraně proti dopaminergní neurodegeneraci. Naopak podjednotka SUR2B zřejmě není do tohoto procesu zapojena. (52) Modulátory mito-KATP kanálů mohou ovlivnit expresi klíčových proteinů mitochondriální biogeneze a dělení/fúze, což vede k ochraně buňky proti PN. (54) Příkladem je faktor PGC-1α (peroxisome proliferator-activated receptor-γ coactivator 1α), který se zapojuje do regulace oxidačního stresu, mitochondriální biogeneze a rovnováhy mitochondriální homeostázy. Peng et al. (53) demonstrovali, že hladiny PGC-1α se zvýšily u buněk s uměle utlumenou expresí podjednotky mito-KATP Kir6.1. Můžeme tedy říct, že mito-KATP kanály mají díky této podjednotce vliv na regulaci PGC-1α, a tím na ovlivňování mitochondriální homeostázy.
Na základě výše uvedených výsledků se tedy zdá, že u PN je tomu opačně než u ostatních onemocnění, která byla dosud v této přehledové práci zmíněna. Zatímco v jiných případech by mělo být prospěšné KATP kanály aktivovat, zde je zlepšení stavu dosaženo jejich inhibicí.
Situaci kolem role mito-KATP kanálů v patogenezi PN bohužel komplikují výsledky další studie, kterou nedávno publikovali Hu et al. (55) Ti se zaměřili na analýzu role mito-KATP kanálů nacházejících se v astrocytech, a to na myším modelu s vyřazeným genem pro Kir6.1. Při použití 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridinu (MPTP) jako neurotoxinu pro vyvolání dopaminergní neurodegenerace pozorovali u těchto myší mnohem větší ztrátu neuronů v substantia nigra compacta, nižší hladiny dopaminu ve striatu a vážnější poruchy koordinace než u kontrol. Dále objevili v cytoplazmě astrocytů myší bez podjednotky Kir6.1 nižší hodnoty mitochondriálních proteinů Parkinu (ubikvitin-ligázy E3) a PINK1 (PTEN-indukované kinázy 1), jejichž přítomnost je známkou probíhající mitofagie. Mitofagie je fyziologický děj, kdy se buňka zbavuje poškozených mitochondrií, jejichž nahromadění by způsobilo vážné poškození buňky. Lze tedy říci, že ztráta Kir6.1 inhibuje mitofagii v astrocytech, a tím způsobuje horší průběh Parkinsonovy choroby.
Je zřejmé, že prozatím nelze jednoznačně uzavřít, zda je pro rozvoj PN aktivita mito-KATP kanálů žádoucí či naopak. Ovlivnění jejich funkce v rámci léčby PN tak prozatím není možné zvažovat.
Alzheimerova choroba
Moriguchi et al. (56) svými poznatky publikovanými v roce 2016 naznačili, že ovlivněním mito-KATP kanálů v mozku můžeme prospět pacientům s Alzheimerovou nemocí (AN). Jeho tým použil geneticky upravené myši a prováděl pokusy s memantinem, léčivem schváleným pro snižování glutamátové toxicity u pacientů s AN. Bylo zjištěno, že memantin zvyšuje nitrobuněčné hladiny Ca2+ a přímo blokuje KATP kanály v neuronech u všech skupin pokusných zvířat, s výjimkou myší vyšlechtěných bez podjednotky Kir6.2. Kir6.2 byla identifikována jako hlavní cíl memantinu a její inhibice zlepšuje kognitivní funkce. Ovlivňováním KATP kanálů memantin pomáhá u osob s AN kontrolovat i symptomy diabetu.
Jsou-li tedy KATP kanály zapojeny to patogeneze AN, látky použitelné pro jejich ovlivnění by mohly mít při léčbě této choroby pozitivní efekt. V roce 2018 Esmaeili et al. (57) vydali studii testující účinky glibenklamidu na pacienty s Alzheimerovou chorobou. Cílem bylo zjistit, zda by mohl potlačovat úzkosti a deprese u těchto pacientů úspěšněji než běžně používaná antidepresiva. Skutečně se ukázalo, že farmakologická blokáda KATP kanálů glibenklamidem u pokusných zvířat snižuje úzkosti a deprese provázející AN v raných stadiích, zejména pak v kombinaci se SSRI antidepresivem (fluoxetinem). Naopak použití agonisty KATP kanálů (kromakalimu) účinek daný fluoxetinem zmenšilo.
Son et al. (58) nedávno zkoumali účinky sildenafilu na mitochondrie poškozené beta amyloidem, který je významným článkem v patogenezi Alzheimerovy choroby. Pod vlivem beta amyloidu se v mitochondriích neuronů zvýšila hladina Ca2+, což vedlo k zahájení apoptotické kaskády. Hladinu Ca2+ se během pokusu podařilo snížit jak sildenafilem, tak agonistou KATP kanálů diazoxidem. Použití 5-HD, tedy blokátoru KATP kanálů, pozitivní efekt na buňku výrazně omezilo. Tyto závěry naznačují, že pro neuroprotektivní účinek sildenafilu proti vlivu beta amyloidu jsou potřeba otevřené mito-KATP kanály.
Jak je vidět z výsledků výše zmíněných studií, mohlo by být vhodné zvážit KATP kanály jako nový cíl v léčbě Alzheimerovy choroby, ovšem jen za předpokladu, že bychom byli schopni účinky léčivých látek dostatečně dobře zacílit na problémovou oblast. Bylo by také nutné vytyčit přesnou fázi choroby, ve které se pacient nachází, a příznaky, o jejichž ovlivnění usilujeme. Jak bylo zmíněno výše, jako součást prevence AN by mohli sloužit agonisté KATP kanálů napomáhající neuroprotektivnímu účinku sildenafilu. Naopak při již vzniklé AN jsou to antagonisté KATP kanálů, kteří by mohli společně s fluoxetinem snižovat úzkosti a deprese spojené nástupem této choroby. Možné budoucí využití ovlivnění KATP kanálů v prevenci a/nebo léčbě Alzheimerovy nemoci jednoznačně vyžaduje další podrobné studium všech aspektů takového zásahu.
ZÁVĚR
Je zřejmé, že KATP kanály jsou nenahraditelnou strukturou v celé řadě signálních drah a důležitým prvkem v základních fyziologických dějích, bez nichž by život vůbec nebyl možný. Nějakou dobu ještě potrvá, než skutečně porozumíme všem principům fungování těchto kanálů v jasných souvislostech s ostatními ději a než dokážeme tyto znalosti dovést na praktickou úroveň a využít v klinické praxi tak, jak se už stalo s deriváty sulfonylurey v léčbě diabetu. Lze však předpokládat, že látky ovlivňující činnost KATP kanálů časem najdou své místo v léčbě celé řady dalších patologií postihující různé orgány lidského těla.
Čestné prohlášení
Autorky prohlašují, že se nenacházejí v žádném střetu zájmů.
Seznam zkratek
5-HD 5-hydroxydekanoát
ADP adenosindifosfát
AMPK AMP-aktivované proteinkinázy
ATP adenosintrifosfát
AV atrioventrikulární
CaMKKβ Ca2+/CaM-dependent protein kinase kinase β
CGRP calcitonin gene-related peptide
DEND syndrom developmental delay, epilepsy, neonatal diabetes
EEG elektroencefalografie
ERG elektroretinografie
GLUT transportér glukózy
H2S sulfan
KATP ATP-senzitivní draslíkové kanály
KO2 kyslíkově senzitivní draslíkové kanály
mito-KATP ATP-senzitivní draslíkové kanály v mitochondriální membráně
MPTP 1-methyl-4-fenyl-1,2,3,6-tetrahydropyridin
NMDA N-methyl-D-aspartát
NO oxid dusnatý
PGC-1α peroxisome proliferator-activated receptor-γ coactivator 1α
PINK1 PTEN-indukované kinázy 1
PNDM permanentní novorozenecký diabetes mellitus
PTP protein přechodné propustnosti (permeability transition protein)
SSRI inhibitory selektivního vychytávání serotoninu
VIP vazoaktivní intestinální polypeptid
Adresa pro korespondenci:
doc. MUDr. Markéta Bébarová, Ph.D.
Fyziologický ústav LF MU
Kamenice 5, 625 00 Brno
Tel.: 549 493 147
e-mail: mbebar@med.muni.cz
Zdroje
- Nalgirkar V. K+ channels: ATP-sensitive and O2-sensitive. 2019 Nov. Dostupné na: www.youtube.com/watch?v=s1Lxy_9Vma0
- Noma A. ATP-regulated K+ channels in cardiac muscle. Nature 1983; 305(5930): 147–148.
- Huang Y, Hu D, Huang C et al. Genetic discovery of ATP-sensitive K+ channels in cardiovascular diseases. Circ Arrhythm Electrophysiol 2019; 12(5): e007322.
- Hibino H, Inanobe A, Furutani K et al. Inwardly rectifying potassium channels: their structure, function, and physiological roles. Physiol Rev 2010; 90(1): 291–366.
- Miki T, Suzuki M, Shibasaki T et al. Mouse model of Prinzmetal angina by disruption of the inward rectifier Kir6.1. Nat Med 2002; 8(5): 466–472.
- Aziz Q, Thomas AM, Gomes J et al. The ATP-sensitive potassium channel subunit, Kir6.1, in vascular smooth muscle plays a major role in blood pressure control. Hypertension 2014; 64(3): 523–529.
- Li A, Knutsen RH, Zhang H et al. Hypotension due to Kir6.1 gain‐of‐function in vascular smooth muscle. J Am Heart Assoc Cardiovasc Cerebrovasc Dis 2013; 2(4).
- Fatehi M, Carter CC, Youssef N et al. The mechano-sensitivity of cardiac ATP-sensitive potassium channels is mediated by intrinsic MgATPase activity. J Mol Cell Cardiol 2017; 108 : 34–41.
- Paggio A, Checchetto V, Campo A et al. Identification of an ATP-sensitive potassium channel in mitochondria. Nature 2019; 572(7771): 609–613.
- Minatoguchi S, Uno Y, Kariya T et al. Cross-talk among noradrenaline, adenosine and protein kinase C in the mechanisms of ischemic preconditioning in rabbits. J Cardiovasc Pharmacol 2003; 41 (Suppl. 1): 39–47.
- Akao M, Ohler A, O’Rourke B et al. Mitochondrial ATP-sensitive potassium channels inhibit apoptosis induced by oxidative stress in cardiac cells. Circ Res 2001; 88(12): 1267–1275.
- Teshima Y, Akao M, Li RA et al. Mitochondrial ATP-sensitive potassium channel activation protects cerebellar granule neurons from apoptosis induced by oxidative stress. Stroke 2003; 34(7): 1796–1802.
- Walewska A, Szewczyk A, Koprowski P. Gas signaling molecules and mitochondrial potassium channels. Int J Mol Sci 2018; 19(10): 3227.
- Tang G, Wu L, Liang W et al. Direct stimulation of KATP channels by exogenous and endogenous hydrogen sulfide in vascular smooth muscle cells. Mol Pharmacol 2005; 68(6): 1757–1764.
- Suzuki M, Li RA, Miki T et al. Functional roles of cardiac and vascular ATP-sensitive potassium channels clarified by Kir6.2-knockout mice. Circ Res 2001; 88(6): 570–577.
- Bohnen MS, Ma L, Zhu N et al. Loss-of-function ABCC8 mutations in pulmonary arterial hypertension. Circ Genomic Precis Med 2018; 11(10): e002087.
- Elrod JW, Harrell M, Flagg TP et al. Role of sulfonylurea receptor type 1 subunits of ATP-sensitive potassium channels in myocardial ischemia/reperfusion injury. Circulation 2008; 117(11): 1405–1413.
- Flagg TP, Patton B, Masia R et al. Arrhythmia susceptibility and premature death in transgenic mice overexpressing both SUR1 and Kir6.2[ΔN30,K185Q] in the heart. Am J Physiol-Heart Circ Physiol 2007; 293(1): H836–H845.
- McClenaghan C, Hanson A, Sala-Rabanal M et al. Cantu syndrome–associated SUR2 (ABCC9) mutations in distinct structural domains result in KATP channel gain-of-function by differential mechanisms. J Biol Chem 2018; 293(6): 2041–2052.
- Theis NJ, Calvert T, McIntyre P et al. Cantu syndrome and hypopituitarism: implications for endocrine monitoring. Endocrinol Diabetes Amp Metab Case Rep 2019.
- Cho JH, Kang E, Lee BH et al. DEND syndrome with heterozygous KCNJ11 mutation successfully treated with sulfonylurea. J Korean Med Sci 2017; 32(6): 1042.
- Lebl J, Roženková K, Průhová Š. Congenital hyperinsulinism: loss of B-cell self-control. Vnitř Lékařství. 2016; 62(11): 4S72–4S76.
- Amaratunga SA, Hussein Tayeb T, Roženková K et al. Congenital hyperinsulinism caused by novel homozygous KATP channel gene variants may be linked to unexplained neonatal deaths among Kurdish consanguineous families. Horm Res Paediatr 2020; 93(1): 58–65.
- Roženková K, Malíková J, Nessa A et al. High incidence of heterozygous ABCC8 and HNF1A mutations in Czech patients with congenital hyperinsulinism. J Clin Endocrinol Metab 2015; 100(12): E1540–E1549.
- Ye P, Zhu YR, Gu Y et al. Functional protection against cardiac diseases depends on ATP-sensitive potassium channels. J Cell Mol Med 2018; 22(12): 5801–5806.
- Zhang H, Flagg TP, Nichols CG. Cardiac sarcolemmal KATP channels: latest twists in a questing tale! J Mol Cell Cardiol 2010; 48(1): 71–75.
- Nozadze E, Arutinova N, Tsakadze L et al. Molecular mechanism of Mg-ATPase activity. J Membr Biol 2015; 248(2): 295–300.
- Pertiwi KR, Hillman R, Scott CA et al. Ischemia reperfusion injury produces, and ischemic preconditioning prevents, rat cardiac fibroblast differentiation: role of KATP channels. J Cardiovasc Dev Dis 2019; 6(2): 22.
- Zhong YS, Wang J, Liu WM et al. Potassium ion channels in retinal ganglion cells (Review). Mol Med Rep 2013; 8(2): 311–319.
- Pinton P, Giorgi C, Siviero R et al. Calcium and apoptosis: ER-mitochondria Ca2+ transfer in the control of apoptosis. Oncogene 2008; 27(50): 6407–6418.
- Ošťádalová I. Ischemic preconditioning in chronically hypoxic neonatal rat heart. Pediatr Res 2002; 52(4): 561–567.
- Doul J, Miková D, Rašková M et al. Possible role of mitochondrial K-ATP channel and nitric oxide in protection of the neonatal rat heart. Mol Cell Biochem 2019; 450(1): 35–42.
- Borges JP, da Silva Verdoon K. Cardiac ischemia/reperfusion injury: the beneficial effects of exercise. In: Exercise for cardiovascular disease prevention and treatment. Advances in Experimental Medicine and Biology. Springer, Singapur, 2017 : 155–179.
- Riess ML, Stowe DF, Warltier DC. Cardiac pharmacological preconditioning with volatile anesthetics: from bench to bedside? Am J Physiol Heart Circ Physiol 2004; 286(5): H1603–H1607.
- Kavazis AN. Exercise preconditioning of the myocardium. Sports Med 2009; 39(11): 923–935.
- Przyklenk K, Bauer B, Ovize M et al. Regional ischemic “preconditioning” protects remote virgin myocardium from subsequent sustained coronary occlusion. Circulation 1993; 87(3): 893–899.
- Hausenloy DJ, Yellon DM. The second window of preconditioning (SWOP): where are we now? Cardiovasc Drugs Ther 2010; 24(3): 235–254.
- Brayden JE. Functional roles of KATP channels in vascular smooth muscle. Clin Exp Pharmacol Physiol 2002; 29(4): 312–316.
- Centeno JM, López-Morales MA, Aliena-Valero A et al. Potassium channels contribute to the increased sensitivity of the rabbit carotid artery to hydrogen sulfide in diabetes. Eur J Pharmacol 2019; 853 : 33–40.
- Denizalti M, Bozkurt TE, Akpulat U et al. The vasorelaxant effect of hydrogen sulfide is enhanced in streptozotocin-induced diabetic rats. Naunyn Schmiedebergs Arch Pharmacol 2011; 383(5): 509–517.
- Emfinger CH, Welscher A, Yan Z et al. Expression and function of ATP-dependent potassium channels in zebrafish islet β-cells. R Soc Open Sci 4(2):160808.
- Bell GI, Kayano T, Buse JB et al. Molecular biology of mammalian glucose transporters. Diabetes Care 1990; 13(3): 198–208.
- Cochrane V, Shyng SL. Leptin-induced trafficking of KATP channels: a mechanism to regulate pancreatic β-cell excitability and insulin secretion. Int J Mol Sci 2019; 20(11): 2660.
- Kieffer TJ, Habener JF. The adipoinsular axis: effects of leptin on pancreatic β-cells. Am J Physiol-Endocrinol Metab 2000; 278(1): E1–E14.
- Dubuc PU. The development of obesity, hyperinsulinemia, and hyperglycemia in ob/ob mice. Metab Clin Exp 1976; 25(12): 1567–1574.
- Pelleymounter MA, Cullen MJ, Baker MB et al. Effects of the obese gene product on body weight regulation in ob/ob mice. Science 1995; 269(5223): 540–543.
- Marquard J, Otter S, Welters A et al. Characterization of pancreatic NMDA receptors as possible drug targets for diabetes treatment. Nat Med 2015; 21(4): 363–372.
- Obolensky A, Berenshtein E, Konijn AM et al. Ischemic preconditioning of the rat retina: protective role of ferritin. Free Radic Biol Med 2008; 44(7): 1286–1294.
- Ettaiche M. ATP-sensitive potassium channels (KATP) in retina: a key role for delayed ischemic tolerance. Brain Res 2001; 890(1): 118–129.
- Roy Chowdhury U, Dosa PI, Fautsch MP. ATP-sensitive potassium channel openers: a new class of ocular hypotensive agents. Exp Eye Res 2017; 158 : 85–93.
- Varcholová D. Latanoprostum. Remedia 2004; 14(5): 406–413.
- Peng K, Hu J, Xiao J et al. Mitochondrial ATP-sensitive potassium channel regulates mitochondrial dynamics to participate in neurodegeneration of Parkinson’s disease. Biochim Biophys Acta BBA – Mol Basis Dis 2018; 1864(4, Part A): 1086–1103.
- Peng K, Yang L, Wang J et al. The interaction of mitochondrial biogenesis and fission/fusion mediated by PGC-1α regulates rotenone-induced dopaminergic neurotoxicity. Mol Neurobiol 2017; 54(5): 3783–3797.
- Wang J, Li Z, Feng M et al. Opening of astrocytic mitochondrial ATP-sensitive potassium channels upregulates electrical coupling between hippocampal astrocytes in rat brain slices. PLoS One 2013; 8(2): e56605.
- Hu ZL, Sun T, Lu M. Kir6.1/K-ATP channel on astrocytes protects against dopaminergic neurodegeneration in the MPTP mouse model of Parkinson’s disease via promoting mitophagy. Brain Behav Immun 2019; 81 : 509–522.
- Moriguchi S, Ishizuka T, Yabuki Y. Blockade of the K ATP channel Kir6.2 by memantine represents a novel mechanism relevant to Alzheimer’s disease therapy. Mol Psychiatry 2016; 23 : 211–221.
- Esmaeili MH, Bahari B, Salari AA. ATP-sensitive potassium-channel inhibitor glibenclamide attenuates HPA axis hyperactivity, depression - and anxiety-related symptoms in a rat model of Alzheimer’s disease. Brain Res Bull 2018; 2018(137): 265–276.
- Son Y, Kim K, Cho HR. Sildenafil protects neuronal cells from mitochondrial toxicity induced by β-amyloid peptide via ATP-sensitive K+ channels. Biochem Biophys Reasearch Commun 2018; 500(2): 504–510.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek Představujeme publikaciČlánek ÚVODEM
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
2021 Číslo 2-3- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Pitvy před Vesaliem a Jeseniem
- Špitální péče řádu sv. Jana na evropské půdě do 18. století
-
Gertrude Belle Elionová
(1918–1999) - Zamyšlení nad Spolkem českých lékařů v Praze
-
K devadesátinám prof. MUDr.
Jany Pařízkové, DrSc. - Sedmdesát let prof. Aleše Žáka
- Vzpomínka na prof. Rostislava Koďouska
- Představujeme publikaci
- ÚVODEM
- Alokace vzácných zdrojů v době pandemie
- Protilátkové repetitorium – vyšetření protilátek proti koronaviru v běžné praxi
- Techniky zvládání stresu jako součást profesní výbavy zdravotníků (nejen) pro boj s pandemií COVID-19
- Využití kognitivně-behaviorálního přístupu k terapii nadváhy a obezity
- Nealkoholová tuková choroba jater: Jak nejúčinněji bojovat s nejčastějším hepatologickým onemocněním současnosti?
- ATP-senzitivní draslíkové kanály: klíčoví hráči v patofyziologii mnoha chorob
- Rizika přenosu nemocí hmyzem na území Česka a Slovenska
- Syndrom počítačového vidění – projevy a možnosti předcházení
- Principy medicíny založené na důkazu: od postulátů Roberta Kocha po současnou EBM
- K počátkům evropské gynekologie: archeologické a literární prameny k vývoji gynekologie v Řecku před rokem 500 př. Kr.
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Protilátkové repetitorium – vyšetření protilátek proti koronaviru v běžné praxi
- Rizika přenosu nemocí hmyzem na území Česka a Slovenska
- Syndrom počítačového vidění – projevy a možnosti předcházení
- Nealkoholová tuková choroba jater: Jak nejúčinněji bojovat s nejčastějším hepatologickým onemocněním současnosti?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



