-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Problematika činnosti etických komisí v České republice*
Autoři: Anna Zemčíková 1; Věra Strnadová 2
Působiště autorů: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta 1; Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav humánní farmakologie a toxikologie 2
Vyšlo v časopise: Čas. Lék. čes. 2012; 151: 83-87
Kategorie: Původní práce
Souhrn
Východisko.
Cílem šetření bylo získat údaje od etických komisí ustavených dle zákona č. 378/2007 Sb., o léčivech, týkající se jejich charakteristik, způsobu posuzování předkládané dokumentace, vydávání stanovisek a dalších aktivit souvisejících s jejich činností. Vyhodnocené údaje následně využít ke zmapování aktuálního stavu posuzování klinických hodnocení léčivých přípravků s důrazem na dodržování legislativy, a také k popisu rozdílů v činnosti jednotlivých etických komisí.Metody a výsledky.
On-line dotazník, tvořený 36 otázkami, vyplnilo 66 etických komisí, což představuje 64 % ze 104 oslovených aktivních etických komisí. Všechny zúčastněné EK pokračují v činnosti i v roce 2011. Celkem 74 % sledovaných etických komisí vykonává činnost v souladu s legislativou. Etická doporučení vyplývající z mezinárodních úmluv a doporučení nad rámec české legislativy aplikuje 62 % komisí a čtvrtina etických komisí (26 %) porušuje některé ustanovení zákona.Závěr.
Vzhledem k tomu, že jsme se mohly zaměřit pouze na formální stránku činnosti etických komisí, lze konstatovat, že jednotlivé etické komise se liší zejména v obecných charakteristikách, dále v podmínkách vytvořených k jejich činnosti a v některých procesních aspektech, což ale neznamená automaticky závažné porušení zákona a okamžitou potřebu nápravy. Zdá se ale, že ne všichni členové EK si dostatečně uvědomují také závažnost své činnosti v etickém nazírání na současný výzkum prováděný s lidskými subjekty.Klíčová slova:
etická komise, klinické hodnocení léčivých přípravků, správná klinická praxe.*Prezentované výsledky vznikly jako součást diplomové práce připravené k obhajobě v roce 2011. Velmi ráda bych poděkovala a vyslovila uznání všem etickým komisím, jež mi poskytly údaje o činnosti, a vedoucí diplomové práce MUDr. Věře Strnadové, CSc. za odborné vedení i MUDr. Alici Němcové za poskytnuté rady při sestavování dotazníku.
ÚVOD
Etická komise (EK) ve smyslu zákona č. 378/2007 Sb., o léčivech, je definována jako nezávislý orgán tvořený zdravotnickými pracovníky i osobami bez lékařského vzdělání, jejichž odpovědností je ochrana práv, bezpečnosti a kvality života osob zařazených v klinickém výzkumu (1). V roce 2009, kdy jsme začali se šetřením, evidoval Státní ústav pro kontrolu léčiv (dále jen Ústav) 117 etických komisí. V současné době je jich v České republice uváděno 119, přičemž devět z nich má statut multicentrické etické komise (MEK) a zbývajících několik desítek působí ve zdravotnických zařízeních (ZZ) jako místní etické komise (2).
Zatímco multicentrické etické komise jsou v úzkém kontaktu s Ústavem a účastní se diskuzí a vzdělávání v rámci Fóra etických komisí, činnost lokálních etických komisí není dosud dostatečně koordinovaná, neboť jejich spolupráce s Ústavem je v mnoha případech nulová. Také podmínky vytvořené ustavitelem pro činnost lokálních etických komisí jsou velmi rozdílné, jejich pracovní postupy nejsou vždy dostupné a členové lokálních etických komisí nejsou většinou doškolováni ani v zákonných požadavcích, natož pak v otázkách filozoficko-etických. Zejména mezi zadavateli přetrvává někdy oprávněný názor, že místní etické komise nemají svoji činnost zharmonizovanou se současnými legislativními požadavky. Nejen z těchto důvodů je jejich činnost často diskutována zadavateli a patří k oblastem dlouhodobě sledovaným Evropskou lékovou agenturou (EMA). Problematika lokálních etických komisí je rovněž opakovaně diskutována v České republice na zasedáních Fóra etických komisí (www.forumek.cz).
Vzhledem k výše uvedeným skutečnostem bylo naší snahou získat od etických komisí prostřednictvím dotazníku údaje, na jejichž základě bychom byli schopni formulovat rozdíly mezi jednotlivými komisemi, popsat způsoby posuzování předkládané dokumentace, vydávání stanovisek a provádění dalších aktivit, které s jejich činností souvisejí. Získané údaje jsme chtěli využít jednak ke zmapování aktuálního stavu posuzování klinických hodnocení léčivých přípravků (KH) s důrazem na dodržování legislativy, ale také k prezentování odlišností mezi jednotlivými etickými komisemi, a tak pomoci v hledání optimálních podmínek pro činnost lokálních etických komisí.
SOUBOR ETICKÝCH KOMISÍ A POUŽITÉ METODY
Na konci roku 2009 jsme kontaktovali 117 etických komisí dle seznamu Ústavu z 24. srpna 2009 s žádostí o vyplnění dotazníku, před jehož rozesláním jsem předsedy etických komisí písemně a následně i telefonicky informovala o probíhajícím šetření. Z toho čtyři etické komise se mi dle uvedených kontaktních údajů vůbec nepodařilo dohledat. Po složitém dotazování jsem zjistila, že šest etických komisí již neexistuje, další tři neposuzují klinická hodnocení léčivých přípravků, ale 104 etických komisí se jevilo jako aktivní. Z nich 14 odmítlo spolupráci vzhledem k nedostatku času, jedna lokální a jedna multicentrická etická komise nepovažovaly spolupráci za vhodnou a pět etických komisí odmítlo účast bez vysvětlení. Spolupráci přislíbilo 83 etických komisí (80 %), ale on-line dotazník nakonec vyplnilo pouze 66 etických komisí (58 lokálních a osm multicentrických), tedy necelých 64 % oslovených aktivních etických komisí. Náš soubor netvoří pouze místní etické komise, ale protože všech devět multicentrických etických komisí občas plní funkci lokální etické komise, odpovídaly i multicentrické etické komise na naše otázky, což mohlo mírně zkreslit některé výsledky. V tabulkách výsledkové části jsou proto jejich odpovědi uvedeny odděleně.
Seznam Ústavu z 19. července 2011 uvádí oproti stavu z roku 2009 zrušení osmi etických komisí. Z toho u šesti jsme neexistenci odhalili již při rozesílání dotazníku a další dvě zaniklé etické komise se rovněž odmítly zúčastnit našeho dotazníkového šetření. Tři etické komise odmítly spolupráci, protože neposuzují klinická hodnocení, a jsou v seznamu Ústavu v současné době vedeny jako nečinné. Oproti roku 2009 v seznamu figuruje 13 nových adres etických komisí (2).
Ve výsledkové části uvádíme údaje získané on-line od etických komisí, které se k dané otázce vyjádřily. Etické komise, které se šetření zúčastnily, ale danou otázku nezodpověděly, jsme zařadili do skupiny No answers (NA’s).
VÝSLEDKY
Předmětem činnosti etických komisí je dle zákona o léčivech posuzování žádostí o povolení klinických hodnocení léčiv aplikovaných lidským subjektům. Adekvátní posouzení studie závisí zejména na složení etických komisí, které by měly být tvořeny dostatečným počtem členů kvalifikovaných k posouzení výzkumu z hlediska vědeckého, lékařského i etického, a se zkušenostmi v oboru. I vědecky špatně připravený výzkumný projekt je totiž neetický. Jak je z naší práce zřejmé, české etické komise jsou zastoupeny 5–19 členy v závislosti na jejich vytížení. Převážnou většinu členů tvoří odborníci, ale v 95 % etických komisí zasedá také minimálně jeden člen bez zdravotnického vzdělání, tedy laik. Tuto část zákonné podmínky usnášeníschopnost i(3) v našem souboru porušuje jedna etická komise, která žádného laika ve svých řadách nemá. Tři etické komise zařadily mezi laiky chybně zdravotní sestry a jedna dokonce lékaře záchranné služby, kteří ale nesplňují požadavky na laika. V jedné z těchto etických komisí je zdravotní sestra navíc jediným laikem a je tak de facto již druhou etickou komisí, která žádného laika ve svých řadách nemá. Obdobně dvěma etickým komisím chybí člen, který není v pracovním poměru či v přímém závislém postavení k ustaviteli etické komise, jehož přítomnost legislativa také vyžaduje. Pozitivním zjištěním z hlediska dodržování mezinárodních etických doporučení je fakt, že 21 % etických komisí pravidelně obměňuje určitý počet svých členů a celá polovina etických komisí vyžaduje od členů písemné prohlášení o možném střetu zájmů. V souladu se směrnicemi CIOMS (viz diskuze) vyžaduje dále více než třetina etických komisí (38 %) předkládání prohlášení o možném střetu zájmů také od zkoušejících.
Vzhledem k tomu, že s vývojem vědy dochází k aktualizaci předpisů a doporučení včetně např. i Helsinské deklarace, bylo by žádoucí, aby byli i členové etických komisí seznámeni se změnami v oblasti nahlížení na biomedicínský výzkum, čehož bývá nejlépe dosaženo pomocí dalšího vzdělávání – doškolování. Z odpovědí vyplývá, že v 75 % etických komisí se členové pravidelně účastní vzdělávacích seminářů, členové 15 etických komisí ale ke školením nemají přístup. Zaměření jednotlivých seminářů absolvovaných členy etických komisí uvádí tabulka 1.
Tab. 1. Typy školení, které členové etických komisí absolvují 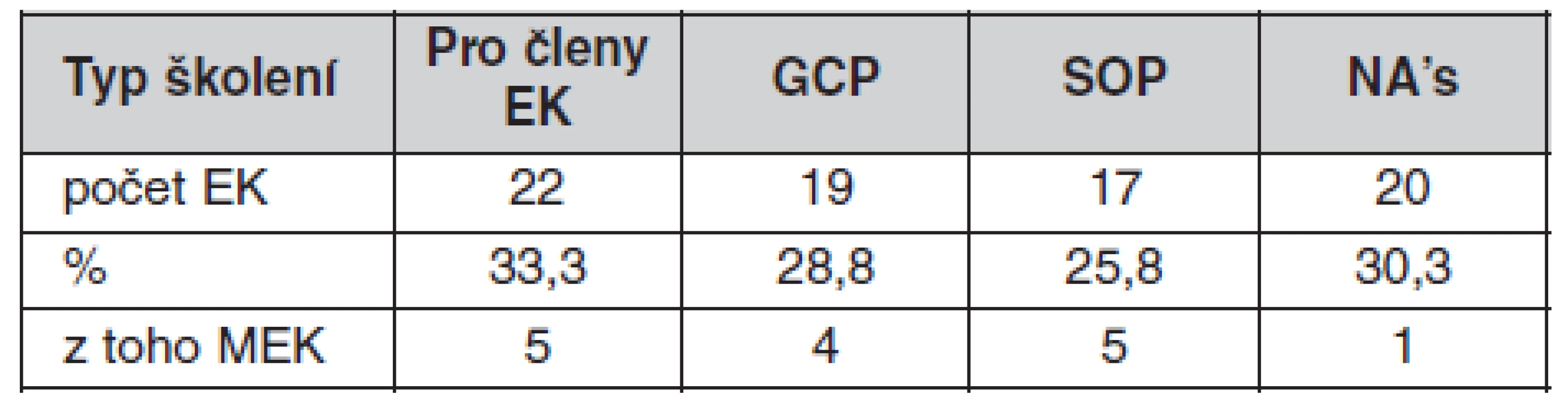
Pozn.: n = 66 vč. NA’s – neodpověděly, některé EK uvedly více typů školení, GCP – správná klinická praxe, SOP – standardní pracovní postupy Z odpovědí dále vyplynulo, že nejčastěji se školení účastní 1–2 zástupci etické komise, a to buď v případě potřeby, nebo při změnách, či pravidelně jednou za rok. Pouze necelá čtvrtina etických komisí (23 %) v dotazníku projevila zájem o školení svých členů ve zdravotnickém zařízení, kde vykonává činnost. Dvě etické komise tuto možnost přímo odmítly, neboť považují další školení za nadbytečná vzhledem k jejich dostatečné současné nabídce, a zbývající se nevyjádřily.
Veškerá činnost etických komisí by měla probíhat v souladu s písemnými standardními pracovními postupy (SOP), které má vypracované 85 % etických komisí. Sedm etických komisí uvedlo, že SOP nemá a činnost podřizuje svému statutu, jednacímu řádu a údajně také legislativě. Pracovní postupy etické komise by dle zákona měly být k dispozici subjektům, jež se podílejí na organizování klinického výzkumu. Třetina etických komisí (35 %) zpřístupňuje SOP odborné veřejnosti volně na webových stránkách, nebo umožňuje jejich nahlédnutí ve svých dokumentech. Až na požádání poskytuje pracovní postupy zkoušejícímu či zadavateli 53 % etických komisí. Ostatní etické komise se k těmto podotázkám nevyjádřily.
Z výsledků je zřejmé, že hlavním předmětem činnosti etických komisí je posuzování klinických hodnocení léčivých přípravků, kterým se zabývá 70 % etických komisí, 32 % posuzuje také státní granty a 24 % etických komisí se vyjadřuje rovněž k ostatním typům výzkumu jako např. testování zdravotnických prostředků, neintervenčním studiím atp. Pro polovinu etických komisí představuje posuzování klinických hodnocení léčiv 90–100 % veškeré činnosti. Počty klinických hodnocení posouzených jednotlivými etickými komisemi za rok 2008 jsou uvedeny v tabulce 2.
Tab. 2. Počty klinických hodnocení posouzených jednotlivými EK za rok 2008 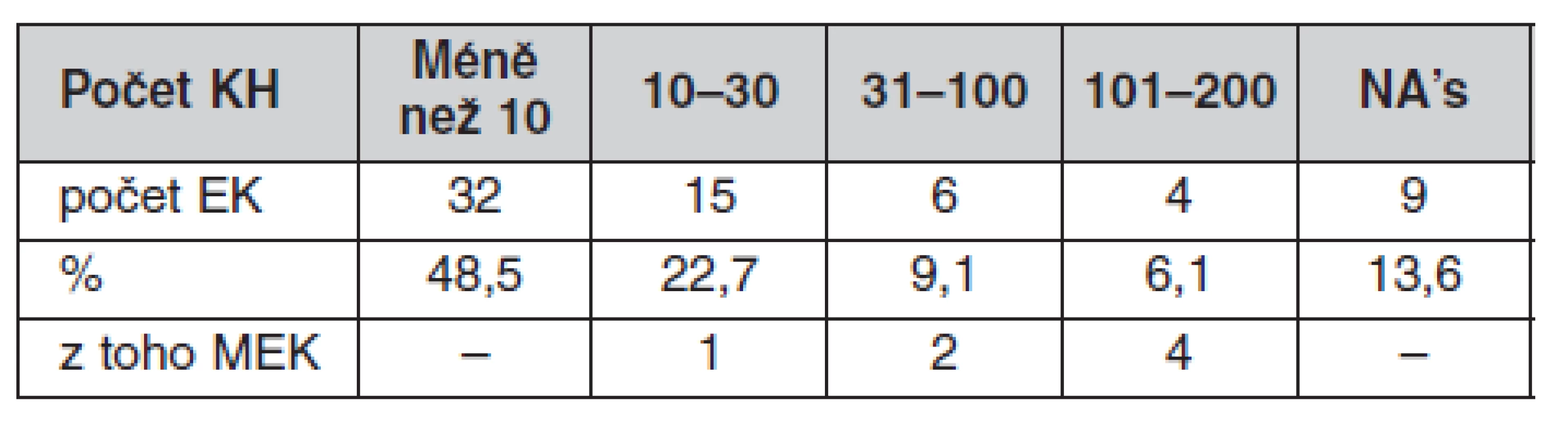
Pozn.: n = 66 vč. NA’s – neodpověděly Ročně je v České republice posouzeno cca 350 klinických hodnocení léčivých přípravků, většina je však multicentrických, proto stanovisek etických komisí bylo vydáno několikanásobně více – v dotaznících uvedeno 1229. Velmi důležitým zjištěním je, že z 1229 žádostí předložených 57 etickým komisím za rok 2008 bylo zamítnuto pouhých 36 žádostí (3 %), a to v 10 etických komisích. Ostatní etické komise všechny posuzované žádosti schválily. Tři etické komise v průběhu studie odvolaly své souhlasné stanovisko jednak z důvodu porušení pravidel náboru subjektů hodnocení (SH), dále vzhledem k náročnosti studie pro SH, anebo pro výskyt nežádoucích účinků, které převážily nad benefity studie.
Stanoviska k provádění klinických hodnocení vydávají etické komise na svých zasedáních, jejichž konání jsou předem naplánována (3). Nadpoloviční většina etických komisí se schází pravidelně 1krát měsíčně, z toho necelá třetina v případě potřeby i častěji. S frekvencí zasedání úzce souvisí i doba od podání žádosti potřebná pro vyjádření stanoviska, kterou u jednotlivých etických komisí uvádí tabulka 3.
Tab. 3. Doba potřebná pro vyjádření stanoviska etických komisí 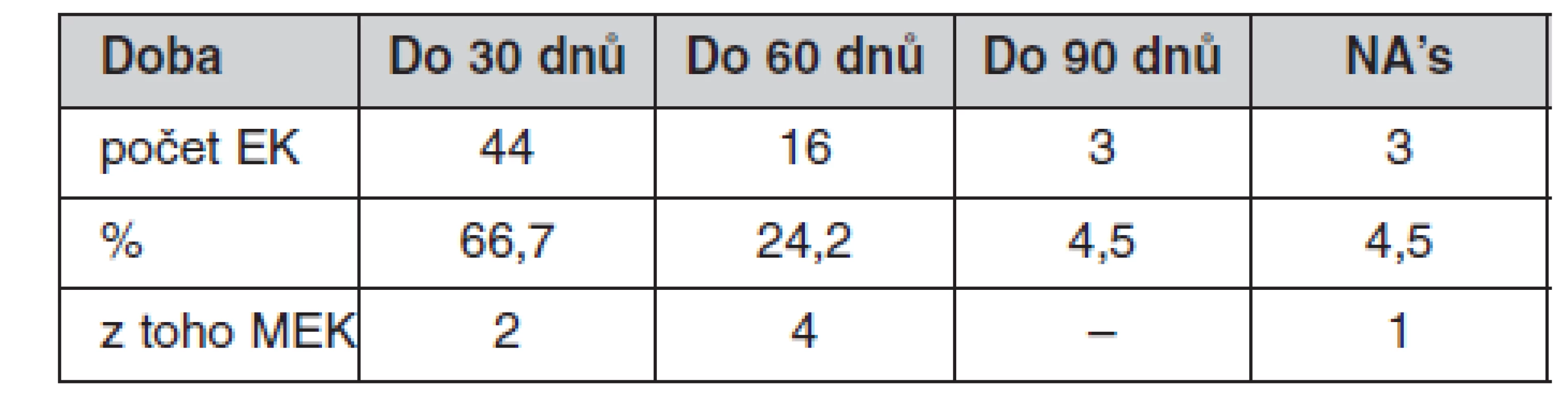
Pozn.: n = 66 vč. NA’s – neodpověděly Povinností etické komise je vypracovávat ze schůzí zápisy, které 26 % z nich předkládá v písemné formě ustaviteli (vedení nemocnice) ke schválení. Pouze šest etických komisí v dotazníku uvedlo, že dává zápisy vedení ve zkrácené formě jen na vědomí a tři EK uvedly, že zápisy ke schválení vedení zdravotnického zařízení nepředkládají.
Za posouzení projektu a náklady vynaložené v souvislosti s vydáním stanoviska mohou etické komise dle zákona o léčivech požadovat finanční úhradu (1). Poplatky za vyjádření stanoviska ke klinickým studiím sponzorovaným farmaceutickou firmou vybírá 73 % etických komisí, nezanedbatelný počet lokálních etických komisí (18 %) tyto kompenzace ovšem doposud nevyžadoval. K úhradě nákladů za posouzení státních grantů se vyjádřilo pouze 19 etických komisí (29 %), přičemž poplatky vybírá 11 z nich (17 %), a osm etických komisí (12 %) posuzuje státní granty ze svého zdravotnického zařízení zdarma.
Subjekty, které jsou zodpovědné za hospodaření s vybíranými poplatky, uvádí tabulka 4 a možnosti využití finančních prostředků etickými komisemi ukazuje tabulka 5.
Tab. 4. Subjekty hospodařící s vybíranými poplatky 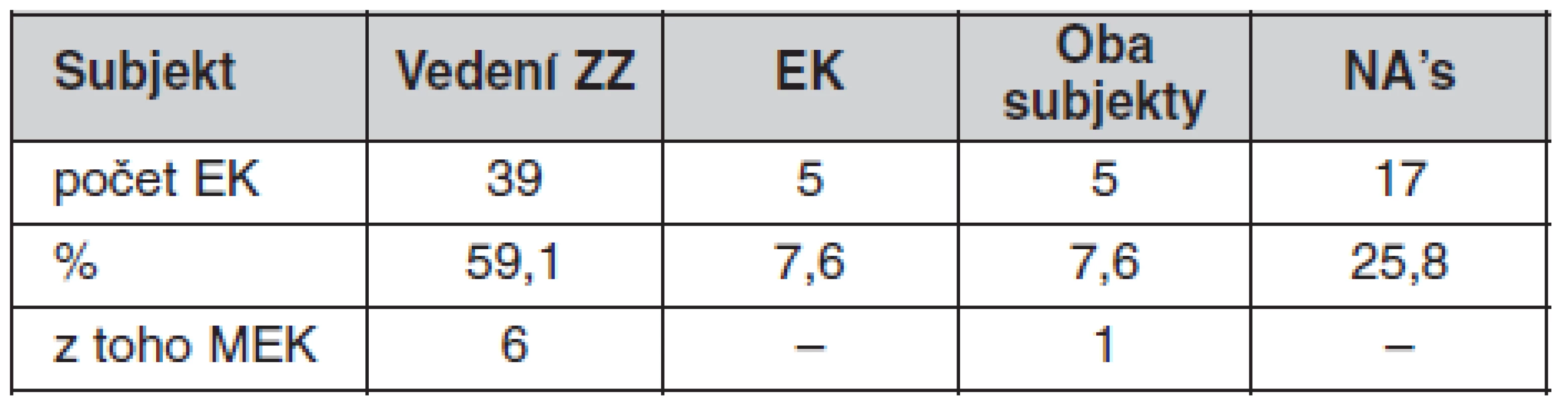
Pozn.: n = 66 vč. NA’s – neodpověděly, ZZ – zdravotnické zařízení Tab. 5. Možnosti využití finančních prostředků z poplatků za posouzení klinických hodnocení 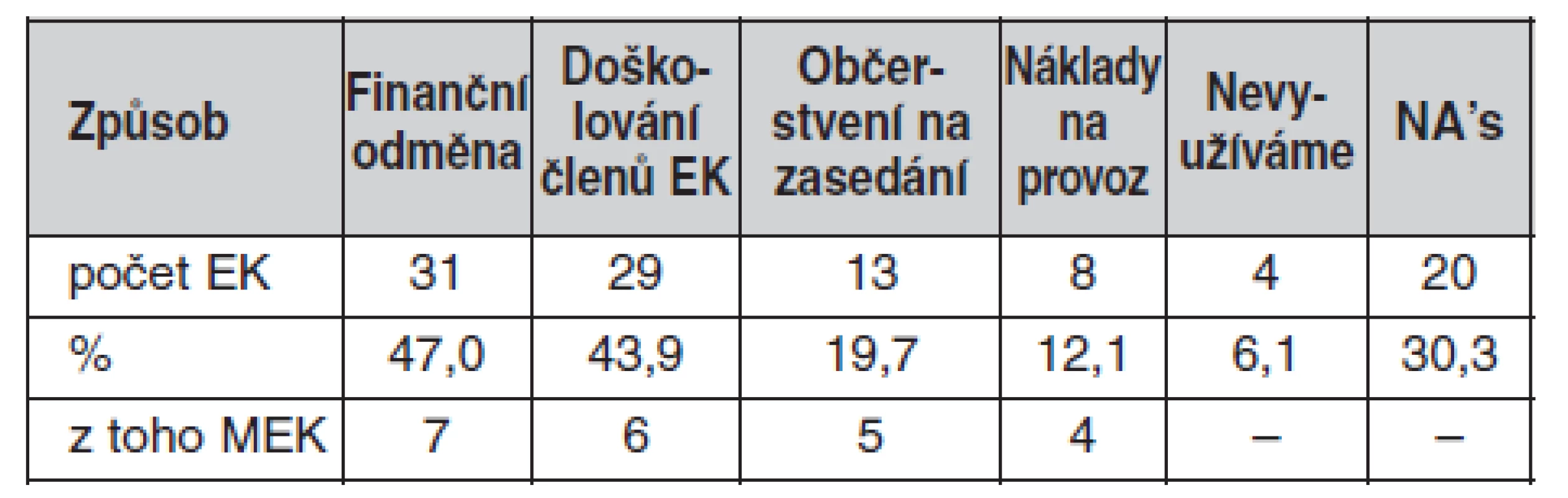
Pozn.: n = 66 vč. NA’s – neodpověděly, některé EK uvedly více možností Zákon o léčivech i Správná klinická praxe (GCP) vyžaduje, aby etické komise prováděly nad probíhajícími klinickými hodnoceními dohled, a to v intervalech přiměřených stupni rizika pro subjekty hodnocení, nejméně však 1krát za rok (1). Toto ustanovení zákona dodržuje 80 % etických komisí, které dohlížejí na průběh klinických hodnocení v půlročních či ročních intervalech. Dvě etické komise ale vykonávají dohled pouze jednou za celou dobu trvání klinického hodnocení, a čtyři etické komise uvedly, že průběh studie nekontrolují vůbec. Pokud se podíváme na způsob, jakým etické komise dohled vykonávají, polovina z nich k tomu využívá zpráv od zadavatele či zkoušejícího a dalších 21 % uvedlo, že dohlíží na studie osobními návštěvami svých členů ve studijním týmu a kontrolou dokumentů. Zajímavým zjištěním je fakt, že pouze 11 etických komisí si přeje být informováno od zadavatele v případě, že zkoušející nedodržuje, či porušuje protokol. Dalších 12 etických komisí o tyto informace výslovně nemá zájem a zbývajících 43 (65 %) se k otázce nevyjádřilo.
DISKUZE
Již úvodní kontaktování lokálních etických komisí ukázalo, že na požadavek zákona o povinném oznámení ustavení etické komise regulační autoritě mnozí ustavitelé nereagují, neboť „aktuální“ seznam etických komisí obsahoval nejen nedostupné kontakty, ale i kontaktní osoby, které s etickou komisí neměly co do činění, či etické komise, které již zanikly. Zastaralé zveřejňované údaje, chybění vlastní emailové adresy, na které by bylo možné etickou komisi kontaktovat přímo, či neposkytnutí informací o etické komisi, aby mohla být zařazena do seznamu, byly jedny z nedostatků zjištěných při inspekcích Ústavu v roce 2010 (4).
Jak jsme již uvedli, po písemném i telefonickém vysvětlení smyslu dotazníku přislíbila účast na dotazníkovém šetření více než polovina aktivních etických komisí v České republice. Z výsledků výzkumu je ale patrné, že na některé dotazy (a zejména na doplňující či vysvětlující podotázky) jsme od etických komisí získali jen velmi nízký počet odpovědí. Můžeme se jen domnívat, zda neochota odpovídat na všechny podotázky byla způsobená nedostatkem času v důsledku pracovní vytíženosti předsedů etických komisí, nebo nejistotou, zda budou uvedené údaje v souladu se současnými požadavky legislativy. Další možností také je, že žádná odpověď byla zvolena místo negativní odpovědi, kterou by etické komise přiznaly nedostatky ve své činnosti. Jako příklad můžeme uvést dotaz na odvolání souhlasného stanoviska, který zodpověděly pouze tři etické komise. U ostatních můžeme předpokládat, že své stanovisko neodvolaly, což může vést k domněnkám o nedostatečně prováděném dohledu nad průběhem studie. Obdobně řada etických komisí neuvedla, zda má zájem o informování v případě, že zkoušející nedodržuje protokol, což může značit, že nechtěla přiznat, že zájem nemá, čímž by vystoupila proti podstatě své činnosti.
Důležité ale je, že vyhodnocení získaných údajů ukazuje, že 49 etických komisí vykonává svou činnost v souladu s platnou legislativou. Všechny etické komise splňují první část podmínky usnášeníschopnosti, tedy potřeby vyjádření nejméně pěti členů etické komise pro přijetí stanoviska (3). Všechny etické komise také postupují v souladu se zákonem při archivaci dokumentace a plánování zasedání, jejichž frekvence je určující pro včasné vyjádření stanoviska k předloženým klinickým hodnocením.
Nejen podle ústních sdělení žadatelů, ale i podle údajů od etických komisí z našeho souboru se potvrdilo, že čtvrtina lokálních etických komisí (26 %) neplní důsledně požadavky platné legislativy. Tyto nedostatky mohou být způsobeny neznalostí, neboť z dotazů na doškolování členů se zdá, že etické komise mají pocit, že doškolování nepotřebují. Celých 23 % jich na dotaz, zda jejich členové absolvují školení, odpovědělo záporně a ani zájem etických komisí o školení přímo v jejich zdravotnickém zařízení nebyl nijak velký. Projevilo ho pouze 15 z nich. Dalším problematickým aspektem vzdělávání členů etických komisí je fakt, že jsou nejčastěji doškolováni pouze 1–2 zástupci etické komise, kteří pak na zasedání tlumočí důležité informace ostatním členům. Při takovém přenosu informací ale může velmi lehce dojít k jejich ztrátám či k neporozumění.
První nedostatky se objevily již v oblasti základních charakteristik etických komisí. Tři etické komise totiž nesplňují druhou část podmínky usnášeníschopnosti týkající se jejich složení při vyjadřování stanoviska – dvě lokální etické komise nemají laika a jedné chybí na ustaviteli nezávislý člen. Čtvrtina etických komisí (27 %) má jednoho nebo oba tyto členy zastoupené pouze po jednom, což ovšem Ústav po vykonaných inspekcích nepovažuje za vhodné, neboť tito se pak musí účastnit všech projednávání a schvalování předložených studií, což může být velmi problematické, jak ostatně potvrzují chyby ve stanoviscích etických komisí, jež byly podrobeny inspekci (4).
Ani zákonem stanovenou dobu pro vydání stanoviska – 60 dnů – nejsou schopny dodržet všechny etické komise. Tři z nich potřebují k vyjádření delší dobu.
Jak také vyplynulo z výsledků, poměrně vysoký počet – sedm etických komisí – nedodržuje ustanovení legislativy týkající se vypracování standardních operačních postupů, podle nichž mají etické komise dle vyhlášky o správné klinické praxi plnit své funkce (3). Vzhledem k tomu, že se tyto etické komise při své činnosti řídí jednacím řádem a statutem, zdá se, že nevypracování operačních postupů je snad pouze otázkou odlišné terminologie používané etickými komisemi, nikoliv otázkou jejich faktického chybění. Přitom členové etických komisí mají posuzovat výzkumné studie v souladu s legislativou České republiky, směrnicemi Evropské unie a pokyny Ústavu – tzv. KLH, které však nemají závaznost zákona. Chybění a případně odkazy na zastaralé údaje (týkající se složení etických komisí či platné legislativy) v pracovních postupech odhalily i inspekce regulační autority(4).
Dále je rovněž problematické provádění dohledu nad průběhem schválených studií, který dle ankety čtyři etické komise nevykonávají vůbec a další dvě sledují studie pouze jednou za dobu jejich trvání. Protože ale není v předpisech stanoveno, jakým způsobem má být dohled vykonáván, většina etických komisí vychází při provádění dohledu z písemných zpráv, což z filozofického (etického) hlediska je dohled nedostatečný, respektive žádný. Sami členové etických komisí navíc přiznali, že by v případě výkonu osobního dohledu nevěděli jak tento provádět a pravděpodobně by tedy nebyli schopni odhalit nesoulad. Nejefektivnější metodou výkonu dohledu se zdá být kontakt se subjekty hodnocení, ať už ve formě osobního rozhovoru či pomocí pacientských dotazníků, které začala nedávno využívat jedna etická komise při velké nemocnici. Přitom právě dobře prováděný dohled může odhalit důvody pro odvolání souhlasu. Například to může být zjištění výskytu nežádoucích účinků, závažné odchylky od protokolu nebo nedodržení podmínek, za kterých byla studie schválena. Právo odvolat souhlasné stanovisko uděluje etické komisi zákon o léčivech. Jak ale ukazují výsledky i praxe, není tato pravomoc etickými komisemi téměř vůbec uplatňována. Překvapivě nízký je také počet zamítnutých klinických studií – pouhá 3 % nesouhlasných stanovisek za rok – což je ale v souladu s celoevropským trendem, který se obvykle pohybuje kolem méně než 1 % zamítnutých studií (5). Přitom v historii nalezneme nejeden důkaz o tom, že se právě vydáním záporného stanoviska k etické stránce studie předešlo poškození zdraví subjektů hodnocení. Příkladem za všechny je studie s přípravkem Contergan (thalidomid), která byla zamítnuta v USA Americkým úřadem pro léky a potraviny (FDA), zatímco ve 48 dalších zemích světa si použití přípravku v padesátých až šedesátých letech 20. století vyžádalo tisíce novorozenců s vrozenými malformacemi končetin a s polyneuritidou (6).
Není pochyb o tom, že práce etických komisí je spojena s celou řadou administrativních úkonů, a tak k náležitému výkonu činnosti potřebují etické komise i administrativní zázemí a také finanční zdroje, které mají sloužit především k zajištění formální stránky jejich činnosti a k nezbytnému doškolování. Zákon etickým komisím umožňuje výběr správních poplatků za posouzení dokumentace a vydání stanoviska k předložené studii (1). Financování etických komisí by ale nemělo sloužit jako motivace ke schválení či zamítnutí studie. Odměny by tedy neměly být závislé na tom, kolik kladných stanovisek etické komise vydají (7). Jak ukazují naše výsledky, ve výběru poplatků za posouzení studií existují mezi jednotlivými etickými komisemi rozdíly, neboť nemalé procento poplatky za posouzení studií doposud nevybírá, a to zejména u posuzování grantových projektů vlastních zdravotnických zařízení. Díky finančním prostředkům získaným z poplatků mohou etické komise pokrýt náklady na svoji činnost, případně ji ještě zefektivnit. Téměř polovina etických komisí tyto poplatky používá na finanční odměny členům, a jak ve svém stanovisku uvádí Fórum etických komisí: „je možné důvodně očekávat, že placený člen etické komise bude lépe vykonávat svou práci poradce a garanta dodržení etických standardů klinického výzkumu a obavy, že placený člen bude více závislý na plátci svého platu, nejsou v tomto případě na místě (5).“ Výběr poplatků je tedy zcela přirozený vzhledem k vývoji činnosti etických komisí, která nabyla výrazně na objemu.
Otázka nezávislosti na zadavateli, zkoušejícím a ustaviteli etické komise je v České republice nejčastěji zpochybňována mezi etickou komisí a jejím ustavitelem. Je to patrné i z předkládání zápisů ze zasedání ustaviteli ke schválení, které přiznala čtvrtina etických komisí. Etická komise je definována jako nezávislý orgán (1), a tak by neměla být podřízena při vytváření svého stanoviska ani svému ustaviteli. Ten má mít pouze jistotu, že etická komise vykonává svoji činnost v souladu s jejím posláním, může kontrolovat, jak často se schází k jednání, a sledovat, zda při posuzování klinických hodnocení dodržuje zákon. K takové kontrole však nemají sloužit podrobné zápisy z jednání etické komise. Zasedání etické komise je neveřejné, její členové jsou ze zákona vázáni mlčenlivostí a vzhledem k tomu, že zápisy z jednání obsahují konkrétní údaje a zachycují diskuzi a hlasování, nemají být zveřejňovány, ale mají zůstat v archivu etické komise. Vědomí, že podrobné zápisy dostává vedení nemocnice, může ovlivnit rozhodování a vést k nižší objektivitě členů – zaměstnanců. Ustavitelé etických komisí by měli být vyrozuměni, že jejich počínání je v rozporu s etikou činnosti etických komisí a komise samotné by jim měly poskytovat pouze zkrácené verze těchto dokumentů, nebo sumarizující zápisy za delší období. Všechny etické komise by měly zjištěné nedostatky v tomto smyslu co nejdříve odstranit, má-li být jejich stanovisko právoplatné a nemá-li být v rozporu se zákonem.
Na druhé straně je možné konstatovat, že několik etických komisí aplikuje při své činnosti etická doporučení vypracovaná mezinárodními organizacemi nad rámec zákona, jako např. směrnice CIOMS. Mezinárodní etické směrnice pro biomedicínský výzkum s lidskými subjekty vypracované Radou mezinárodních organizací lékařských věd (CIOMS), patří mezi zásadní dokumenty o etice klinického výzkumu, a lze je považovat za základní studijní materiál pro členy etických komisí (8). Pozitivním zjištěním je také kladný postoj etických komisí k doškolováním v oblasti legislativních požadavků, které dle výsledků absolvuje 74 % z nich, což ovšem není zcela v souladu s praxí zjištěnou na Ústavu, kde v minulosti byli nuceni rušit naplánovaná školení pro členy etických komisí v důsledku malého zájmu ze strany lokálních etických komisí. Stále velmi málo členů se účastní diskuzí o etice a filozofických otázkách morálky současného výzkumu v rámci Fóra etických komisí. Pravidelné konání vzdělávacích akcí a zejména jejich absolvování co nejvyšším počtem členů etické komise by mělo být podporováno jak ze strany ustavitelů, státních regulačních orgánů, tak i komisí samotných. V diskuzních fórech Správné klinické praxe v rámci Evropy (European Forum for Good Clinical Practice – EFGCP) je totiž stále častěji zmiňována nutnost harmonizace činnosti etických komisí, která by měla vyústit až v zavedení jejich akreditací, s čímž půjde ruku v ruce také nutnost kontinuálního vzdělávání všech členů jak při zahájení činnosti v etické komisi, tak dále v pravidelných intervalech (4). Zavedení těchto akreditací by mohlo přispět ke zvýšení prestiže etických komisí v České republice a snad i k omezení formalismu v jejich činnosti.
V roce 2010 zahájil Ústav inspekce v lokálních etických komisích, při nichž se potvrdila i řada zjištění našeho dotazníkového šetření (4). Doufejme, že i tyto inspekce jsou jednou z cest jak ukázat lokálním etickým komisím jejich eventuální nedostatky a způsoby, jak je napravit.
ZÁVĚR
V naší práci jsme se pokusili popsat situaci v českých místních etických komisích z pohledu dodržování zákonných požadavků. Jsme si přitom vědomi, že by bylo třeba, aby si všichni členové etických komisí uvědomovali důležitost své činnosti v etickém nazírání na výzkum prováděný s lidskými bytostmi. Proto považujeme za nutné, aby byli členové etických komisí erudováni nejen v zákonných požadavcích, ale také v etickém nazírání současných výzkumných problémů, které vyplývají z filozofických základů, ale i z kulturně historických a sociologických podmínek tak, aby posuzování výzkumných projektů spočívalo v živé diskuzi o etické stránce výzkumu (9).
Zkratky
CIOMS – Council for International Organisations of Medical Science (Rada mezinárodních organizací lékařských věd)
FDA – Food and drug administration (Americký úřad pro léky a potraviny)
EFGCP – European Forum for Good Clinical Praktice (Evropské fórum správné klinické praxe)
EK – etická komise
GCP – Good Clinical Practice (Správná klinická praxe)
KH – klinické hodnocení léčivých přípravků
KLH – klinické hodnocení – pokyn Ústavu
MEK – Etická komise pro multicentrické klinické hodnocení léčiv
SH – subjekt hodnocení
SOP – standardní pracovní postupy
ZZ – zdravotnické zařízení
Adresa pro korespondenci:
Mgr. Anna Zemčíková
Farmaceutická fakulta VFU
Palackého 1–3, 612 42 Brno
e-mail: annazemcikova@gmail.com
Zdroje
1. Zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech), § 53–54. Sbírka zákonů 2007, částka 115, s. 5384–5386.
2. Seznam etických komisí ke dni 19. 7. 2011. http://www. sukl. cz/sukl/eticke-komise-ustavene-pri-zdravotnickych-zarizenich
3. Vyhláška č. 226/2008 Sb., o správné klinické praxi a bližších podmínkách klinického hodnocení léčivých přípravků, Sbírka zákonů 2008, částka 72, s. 3246–3297.
4. Němcová A. Etické komise – diskusní fórum k činnosti, inspekčním nálezům, chystaným novinkám – ústní sdělení, Fórum etických komisí, Letní škola lékařské etiky, 18.–21. 7. 2011.
5. Stanovisko k hospodaření EK a honorování členů EK. http://www.forumek.cz/documents/hospodareni_ek_a_honorovani_clenu_ek.pdf
6. Kopečná E, Paseka J, Jedličková A. Monitorace, audit a inspekce v klinickém hodnocení. 1. vyd. Praha: Galén 2009, 144 s.
7. Research Ethics Committees: Basic concepts for capacity – building, WHO, Ženeva: WHO Press 2009, 72 s.
8. International Ethical Guidelines for Biomedical Research Involving Human Subjects, CIOMS, Ženeva: 2002, 69 s.
9. Strnadová V, Svobodník A, Křepelka F. Úvod do metodiky klinického hodnocení léčivých přípravků. 1. vyd. Praha: Grada Publishing 2007, 150 s.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek Moravský kazuistický seminářČlánek Geny KRT1, KRT10Článek KnihaČlánek Julius AxelrodČlánek Relabujúca polychondritída
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
-
Všechny články tohoto čísla
- 12. konference Tabák a zdraví v Lékařském domě
- Spolek českých lékařů v Praze
- Mezinárodní konference Analytical Cytometry VI
- XVIII. jihočeské onkologické dny
- XXIV. kurz endoskopické endonazální chirurgie
- Beskydské alergologické a imunologické dny 2011
- Moravský kazuistický seminář
- Otologický den k 85. narozeninám prof. MUDr. Lubomíra Faltýnka, DrSc.
- 11. setkání lékařů ČR a SR v Litomyšli
- Prof. Koďousek pětaosmdesátiletý
- Geny KRT1, KRT10
- Kniha
- Julius Axelrod
- Morfologie a etiopatogeneze aneuryzmatu břišní aorty
- Plánované akce odborných složek ČLS JEP
- Relabujúca polychondritída
- Plánované akce odborných složek ČLS JEP
- Mužský hypogonadismus a civilizační nemocnění*
- Jodový deficit – současný stav a problémy
- Současný výskyt diabetes mellitus typu 1 a autoimmunitní tyroiditidy – klinické aspekty
- Abdominální obezita a metabolický syndrom u dospívajících – výsledky studie COPAT(Childhood Obesity Prevalence and Treatment)
- Prevalence trombofilních mutací FV Leiden, protrombinu G20210A a PAI-1 4G/5G a jejich vzájemných kombinací v souboru 1450 zdravých osob středního věku v regionu Praha a střední Čechy (výsledky real-time PCR analýzy FRET)
- Problematika činnosti etických komisí v České republice*
-
Ostravský den preventivní pediatrie
16. března 2012, Ostrava – hotel Clarion Congress - Projekt spolupráce a kategorizace pracovišť pro léčbu závislosti na tabáku v Evropě
- XI. sjezd České společnosti chirurgie ruky ČLS JEP s mezinárodní účastí
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prevalence trombofilních mutací FV Leiden, protrombinu G20210A a PAI-1 4G/5G a jejich vzájemných kombinací v souboru 1450 zdravých osob středního věku v regionu Praha a střední Čechy (výsledky real-time PCR analýzy FRET)
- Relabujúca polychondritída
- Mužský hypogonadismus a civilizační nemocnění*
- XI. sjezd České společnosti chirurgie ruky ČLS JEP s mezinárodní účastí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



