-
Medical journals
- Career
Ultrazvukové vyšetření skrota: principy a praktické využití
: D. L. Gilbert; B. R. Gilbert
: Philadelphia, PA ; Jefferson Medical College
: Urol List 2010; 8(2): 58-70
Ultrazvukové vyšetření (US) skrota představuje běžnou, a v některých případech dokonce nezbytnou součást vyšetřování pacientů se symptomy v oblasti skrota. Toto neinvazivní vyšetření poskytuje urologovi ve skutečném čase informace, které mají v mnoha případech obrovský význam pro rychlé a správné stanovení diagnózy. V případě, že je prováděno přímo v ordinaci urologa, pomůže pacientovi ušetřit čas i peníze.
Urolog si v průběhu výcvikových programů a své praxe osvojí jedinečnou schopnost provádění, interpretace a dokumentace výsledků sonografie skrota a je nutné, aby v této kvalifikaci trvale dosahoval vysoké úrovně. Primárním cílem tohoto článku je poskytnout praktickým urologům informace týkající se základních principů a praktických aspektů ultrazvukového vyšetření skrota, jež může urolog provádět přímo ve své ambulanci. Většina rezidentských programů v USA poskytuje svým rezidentům praktický výcvik pod vedením zkušeného sonografisty. Americká urologická asociace (AUA), rozličné akademické školící programy a výrobci ultrazvukových přístrojů nabízejí kurzy pro udržování a zdokonalování této kvalifikace. Řada vynikajících výukových programů je také k dispozici online.Klíčová slova:
ultrazvukové vyšetření skrota, varle, diagnostika, DopplerJAK FUNGUJE ULTRAZVUKOVÉ VYŠETŘENÍ
Zeslabení, rozlišení a biologický efekt ultrazvuku souvisí s fyzikální podstatou zvukového vlnění. Zvuková vlna je ve skutečnosti podélné tlakové vlnění – částice v médiu kmitají ve stejném směru jako zvuk. Vzhledem k tomu, že kmitají dopředu a zpět, jedná se ve své podstatě o mechanické vlnění. Tato fakta jsou významná při průchodu zvukové vlny tkání.
Zatímco rozsah slyšitelnosti lidského ucha se pohybuje v rozmezí 20–20 000 Hz cyklů/s, ultrazvuková sonda obvykle vysílá vlnění o frekvenci 2–15 mil. cyklů/s (MHz). Je důležité si uvědomit, že frekvence a vlnová délka jsou nepřímo úměrné ve vztahu k rychlosti (kdy rychlost = frekvence × vlnová délka).
Existují dva druhy ultrazvukových vln:
- kontinuální ultrazvukové vlnění: obsahuje dvě sondy – jedna sonda slouží k vysílání, druhá k přijímání signálu – ultrazvuk je konstantně aktivní. Tento systém není vhodný pro zobrazovací vyšetření, je však užitečnou pomůc-kou při měření rychlosti a směru toku krve.
- pulzní ultrazvukové vlnění: obsahuje pouze jedinou sondu pro generování i přijímání signálu. Tento systém je vhodný pro zobrazovací vyšetření. Poté, co sonda vygeneruje několik cyklů, se vysílání přeruší a čeká na signál, který je zachycen tkání, a následně vrací část zvukové vlny zpět do sondy, která signál přijme a analyzuje (echo).
DOKUMENTACE A ZÁKLADNÍ ORIENTAČNÍ BODY
Správná dokumentace sonografie skrota vyžaduje vhodnou orientaci varlete a adekvátní označení snímků.
Echogenicita. Při ultrazvukovém vyšetření skrota v podélné (sagitální) rovině se užívají následující termíny: anteriorní, posteriorní, superiorní, inferiorní, a v rovině příčné (transverzální): anteriorní, posteriorní, mediální a laterální echogenicita. Při většině urologických vyšetření skrota je rovněž důležité porovnat echogenicitu obou varlat.
Pro srovnání relativní echogenicity varlat oproti referenčnímu objektu se užívají termíny hypoechogenní (tzn. tmavší a černé oblasti), hyperechogenní (světlé a bílé oblasti) a izoechogenní (srovnatelné s referenčním objektem). Tkáně s vysokým obsahem vody se zobrazují jako hypoechogenní oblasti, a naopak tkáně s vysokým podílem tukové tkáně se jeví jako hyperechogenní. Pro další charakteristiku složení a struktury zobrazované tkáně se užívá následující terminologie: anechogenní (absence echa), homogenní (jednotná echogenicita) a heterogenní (smíšená echogenicita).
Základem je terminologie užívaná pro popis signálu
Je nezbytné, aby urolog porozuměl všem termínům užívaným pro popis přenášeného signálu (schéma 1) vzhledem k tomu, že tyto proměnné může v mnoha případech sám modifikovat, a zvýšit tak kvalitu a spolehlivost zobrazení.
Schéma 1. Termíny užívané pro popis přenášeného ultrazvukového signálu. 
Opakovací frekvence pulzů. PRF vyjadřuje počet vyslaných impulzů za sekundu (v kHz). Jedná se o nejvýznamnější proměnnou v klinické praxi (zejména při užívání barevné Dopplerovy sonografie). Při dané PRF se maximální měřitelná Dopplerova frekvence (bez narušení) rovná polovině PRF (tato závislost se rovněž nazývá jako Nyquistův limit), což je významná nevýhoda všech pulzních systémů. Pakliže kombinace rychlosti proudu krve a úhel paprsku/proudu vytváří Dopplerovu frekvenci překračující polovinu PRF, vzniká tzn. aliasing efekt (schéma 2).
V pulzním Dopplerově systému je nutné zajistit dostatečný časový interval mezi tím, než pulz dorazí do reflektoru a vrátí se zpět do sondy (předtím, než je vygenerován druhý pulz). Pakliže je druhý impulz vyslán ještě před přijetím prvního impulzu, není možné je vzájemně rozlišit a výsledný obraz je nejednoznačný. Rovněž čím hlouběji se reflektor nachází, tím delší musí být časový interval před tím, než může být vygenerován druhý signál. Maximální měřitelná Dopplerova frekvence se tedy snižuje spolu se zvyšující se hloubkou.
Nízká PRF se užívá k hodnocení proudu o malé rychlosti (například žilní tok krve, varikokéla při Valsavově manévru), zatímco vysoký PRF k hodnocení proudu o vyšší rychlosti. V případě, že při užívání nízké PRF narazíme na proud o vysoké rychlosti, vzniká aliasing. Naopak může být při užívání vyšší PRF mylně interpretován proud o nízké rychlosti [1].
Perioda opakování pulzu. (PRP = pulse repetition period). PRP vyjadřuje interval mezi vysláním dvou po sobě následujících impulzů (v ms).
Délka pulzu v prostoru. (SPL = spatial pulse length). SPL vyjadřuje prostor, který zaujme jeden pulz (vlnová délka × počet cyklů/pulz) (v mm).
Trvání pulzu. (PD). PD vyjadřuje délku trvání jednoho pulzu (v ms).
Amplituda. Velikost zvukové vlny (v jednotce tlaku – Mpa).
Intenzita. Vyjadřuje koncentraci energie ve zvukové vlně (rovná se druhé mocnině amplitudy, v mW/cm2).
Rychlost šíření. Vyjadřuje rychlost šíření ultrazvukové vlny skrze lidskou tkáň. Ultrazvukové systémy při měření intervalu do návratu echa (pro výpočet hloubky měřeného objektu) předpokládají konstantní rychlost šíření = 1 540 m/s. Vzhledem k tomu, že rychlost šíření ve skutečnosti závisí na hustotě tkáně (tab. 1), dochází k mylnému záznamu artefaktů, což vede k tomu, že ultrazvukový snímek neodráží skutečné anatomické rozložení.
1. Rychlost ultrazvukové vlny v různých tělesných tkáních. 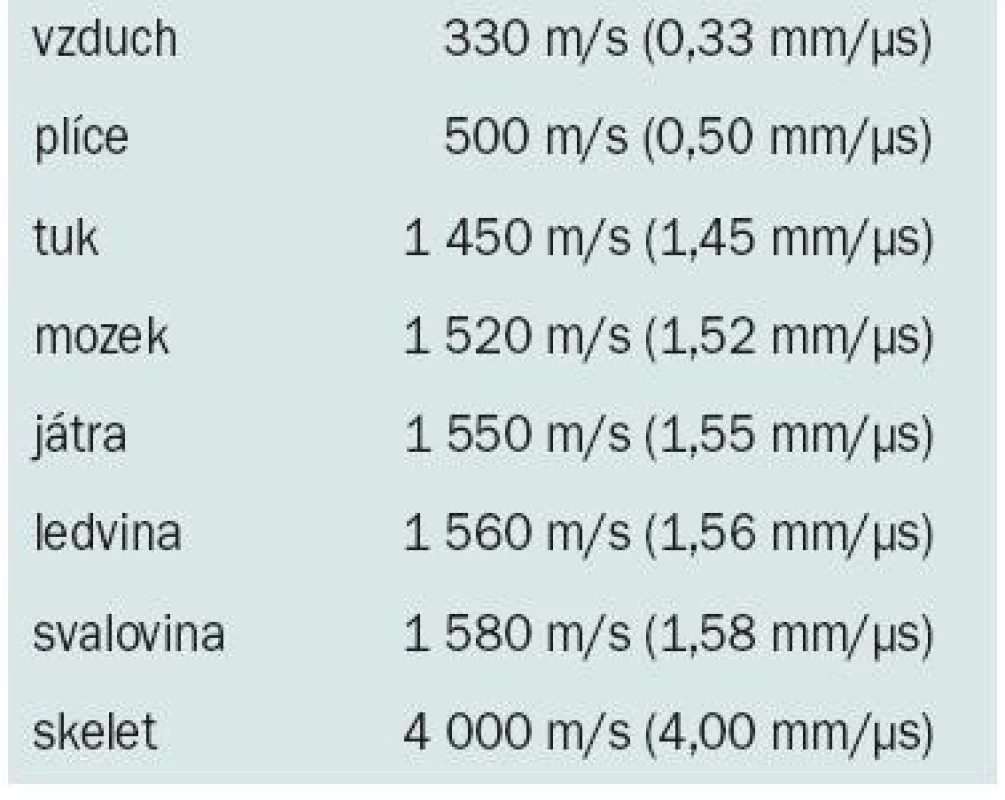
Rozlišení, odpor a odraz
Termíny rozlišení, odpor a odraz jsou důležité při popisu kvality obrazu. Rovněž pomohou lékaři lépe pochopit, proč se rozlišení mění v závislosti na frekvenci sondy a jakým způsobem lze zlepšit kvalitu zobrazení změnou nastavení.
Rozlišení. Prostorové (nebo detailní) rozlišení zahrnuje axiální (podélné), laterální a elevační rozlišení.
- axiální rozlišení umožňuje samostatně identifikovat dva objekty (kdy se jeden nalézá před druhým) ve směru šíření zvukové vlny. Axiální rozlišení se rovná jedné polovině SPL (která je definovaná jako součin vlnové délky a počtu cyklů v pulzu), což znamená, že se axiální rozlišení zvyšuje spolu se snižující se SPL (snížením vlnové délky a/nebo počtu cyklů v pulzu). Zkrácení vlnové délky (v důsledku zvýšení frekvence) nebo PRF má tedy za následek zlepšení axiálního rozlišení.
- laterální rozlišení umožňuje rozlišit dva objekty nalézající se vedle sebe (side-by-side). Vzhledem k tomu, že laterální rozlišení je podmíněno šířkou paprsku ve směru šíření zvukové vlny, lze nejlepší kvality zobrazení dosáhnout v ohnisku (nejužší místo paprsku).
- transverzální rozlišení je podmíněno šířkou paprsku kolmo ke směru šíření vlny. Vzhledem k tomu, že kolmá orientace se nachází hluboko k zobrazované rovině, může se při zobrazení objevit artefakt tloušťky řezu. Dobrým příkladem je zobrazení ech v anechoidní struktuře (např. cysta) v případě, kdy je kolmý paprsek širší než sledovaná struktura.
- časové rozlišení umožňuje identifikovat polohu pohybující se struktury v daný okamžik. Tento typ rozlišení je přímo závislý na počtu snímků, jež ultrazvukový systém vygeneruje za sekundu (snímková frekvence). Snímkovou frekvenci je tedy nutné nastavit tak, abychom maximalizovali časové rozlišení.
Odpor a odraz. Kvalita echa, jež vytváří US vlna odrazem od rozhraní tkáně, závisí na akustickém odporu tkání (tj. jejich rezistenci ke zvukovým vlnám na základě hustoty tkání a rychlosti šíření vlny), úhlu dopadu (úhel mezi zvukovou vlnou a rozhraním tkáně) a charakteru povrchu tkáně (hladké nebo drsné). Velký rozdíl odporu při kolmém úhlu dopadu ku hladkému povrchu se nazývá zrcadlový odraz. Pakliže je odpor tkáně stejný, nevzniká žádné echo (dokonce ani v případě zrcadlového odrazu).
Většina tkáňových rozhraní způsobuje nezrcadlový odraz – jedná se o nepravidelné nebo nerovnoměrně ohraničené oblasti tkáně s rozdílným odporem a nekolmým úhlem dopadu. Rozptýlení, k němuž v těchto případech dochází, může být na jednu stranu přínosné (zaručuje, že alespoň část paprsku se vrátí zpět do sondy), na druhou stranu však narušuje kvalitu obrazu a představuje technickou výzvu.
PRAKTICKÉ VYUŽITÍ
Pakliže urolog porozumí výše popsaným principům, bude schopen sám modifikovat nastavení systému, a optimalizovat tak kvalitu obrazu, zvolit nejvhodnější sondu a zajistit pacientovu bezpečnost.
Vzhledem k tomu, že vyšší frekvence je pohlcována více než nižší frekvence, hloubka zobrazení je v případě užívání vysokofrekvenčních sond značně limitována. Sondy užívající vyšší frekvenci (HFT) však díky lepšímu axiálnímu rozlišení poskytují lepší obraz než sondy, které pracují při nižší frekvenci (LFT). Při zobrazování struktur lokalizovaných v blízkosti sondy (jako jsou například varlata a prostata) se doporučuje užívat HFT, zatímco při zobrazování hlouběji lokalizovaných struktur (močový měchýř, ledviny) je vhodnější LFT. Vzhledem k tomu, že nejsilnější signál se vrací do sondy kolmým nebo zrcadlovým odrazem, může být pro zajištění nejlepšího obrazu během vyšetření nutné upravovat úhel dopadu (tzn. jak je sonda skloněna).
Nové technologie (např. sondy s různými vlnovými pásmy a elektronické zaměřování) významně usnadnily ono „štelování“ a omezily nutnost úpravy nastavení a přemisťování sondy během ultrazvukového vyšetření.
ARTEFAKTY: KDY A PROČ VZNIKAJÍ
Artefakt vzniká v případě, že je vyšetřovaná anatomická struktura nesprávně zobrazena – jedná se o nesprávnou lokalizaci, echogenicitu nebo pohyb objektu komplikující interpretaci obrazu. Artefakty nemusejí vznikat nutně v důsledku chyby sonografisty nebo chybné funkce přístroje. Obvykle však souvisejí s předpoklady učiněnými na základě fyzikálních zákonitostí šíření zvuku, které nemusejí být vždy pravdivé. Jedná se o následující předpoklady:
- vždy je přítomen zrcadlový (kolmý) odraz
- nedochází k rozptýlení paprsku
- šířka paprsku se vždy rovná průměru zobrazovaného objektu
- zvuková vlna se ve všech tkáních šíří rychlostí 1 540 m/s
Některé artefakty, běžně se vyskytující při ultrazvuku skrota, mohou být ve skutečnosti užitečné. Nejčastější artefakty, které vznikají při 2D sonografii (v reálném čase) jsou uvedeny v tab. 2, artefakty vyskytující se při barevné Dopplerově sonografii jsou uvedeny v tab. 3.
2. Artefakty vznikající při 2D ultrazvukovém vyšetření. 
3. Artefakty na barevné sonografii. 
Akustický stín. Vzniká v případě, že struktura vlnění silně oslabí nebo odráží zvukové vlnění, čímž snižuje amplitudu echa. Tento artefakt vzniká při zobrazování testikulárních kalcifikací, jako např. při mikrolitiáze (schéma 3). Akustický stín je nejvýraznější při zobrazování větších kalcifikovaných struktur.
Schéma 3. Minimální akustický stín při zobrazení testikulárních mikrokalcifikací. 
Akustické zesílení („enhancement“). Vzniká v případě, že struktura vlnění zeslabí nebo odráží, čímž dochází ke zvýšení amplitudy echa za strukturou. Tento artefakt vzniká při zobrazování benigních cystických struktur, jako jsou např. cysty epididymis (schéma 4). Akustické zesílení (hladce vymezená vnější hranice) a anechogenní střed jsou ve skutečnosti parametry usnadňující diagnostiku cysty.
Schéma 4. Akustické zesílení posteriorně za cystou nadvarlete. 
Artefakt reverberace (artefakt násobným odrazem). Vzniká v případě, že parciální odraz vracejícího se echa způsobuje vznik druhého a třetího echa nebo dalších ech, která se objevují na monitoru ve větší hloubce, kde se ve skutečnosti nenalézají žádné další odrazy. Ozvěna vzniká kupříkladu při zobrazování testikulární protézy (schéma 5).
Schéma 5. Artefakt reverberace při zobrazení testikulární protézy. 
Okrajový artefakt. Jedná se o lineární anechoidní pruh, který vzniká fázovým vyrušením efektů na zvlněném rozhraní. Okrajový artefakt vzniká často při zobrazování hlavy nadvarlete (schéma 6).
Schéma 6. Okrajový artefakt (šipky) při zobrazení hlavy nadvarlete. 
Artefakt způsobený tloušťkou řezu. Vzniká v případě, že šířka paprsku kolmá k rovině je větší než zobrazovaný objekt. Obraz tedy obsahuje i echa nalézající se mimo zobrazovanou strukturu. Tento druh artefaktu se často vyskytuje u pacientů s hydrokélou větších rozměrů, kdy echo vzniká v anechoidní struktuře (schéma 7). Vznik artefaktu lze minimalizovat zúžením paprsku nebo opakovaným zaměřením paprsku.
Schéma 7. Artefakt způsobený tloušťkou řezu (ve směru šipky). 
DOPPLEROVO ULTRAZVUKOVÉ VYŠETŘENÍ
Tato zobrazovací modalita se stala nedílnou součástí ultrazvukového vyšetření skrota. Princip barevné sonografie spočívá v Dopplerově posunu – změně frekvence způsobené pohybem mezi ultrazvukovým paprskem a přijímačem.
Úhel dopadu mezi ultrazvukovým paprskem a odhadovaným směrem průtoku (schéma 8a) se nazývá Dopplerovský úhel. Dopplerovo ultrazvukové vyšetření umožňuje přesné měření průtokové rychlosti (rychlosti a směru pohybu) pouze v Dopplerovských úhlech 0 ° a 180 °. Měření v úhlech 60 ° a 120 ° se vzhledem ke vzniku velké chyby nedoporučuje. Pro nejlepší zobrazení prokrvených struktur ve skrotu je nutné sondu nastavit (ručně či elektronicky) podél požadované cévy (schéma 8b).
Schéma 8 a,b. Dopplerův úhel se rovná úhlu dopadu mezi ultrazvukovým paprskem a odhadovaným směrem proudění krve (a). Dopplerovo ultrazvukové vyšetření přesně měří velocitu (rychlost a směr pohybu) pouze v Dopplerovských úhlech 0 ° a 180 °. 
Dopplerův ultrazvukový systém obsahuje filtry, které umožňují eliminovat jakoukoli vysokou amplitudu – signály o nízké frekvenci, které běžně vznikají v důsledku pohybů tkáně. Vzhledem k tomu, že pohyb cévní stěny je primární příčinou vzniku pohybového artefaktu, užívá se označení tkáňový filtr. Tento filtr však bohužel rovněž limituje schopnost měřit nízkou rychlost průtoku, je tedy nutné nastavení filtru modifikovat.
Existují různé druhy Dopplerova zobrazení (schéma 9):
Schéma 9 a,b,c. Dva obrázky provedené pomocí duplexního Dopplerova ultrazvukového vyšetření (a). Barevné Dopplerovo ultrazvukové vyšetření a spektrální Dopplerovo ultrazvukové vyšetření (průtok krve je zobrazen jako vlna) (c). Barevné Dopplerovo ultrazvukové vyšetření (a) zobrazuje směr průtoku pomocí různých barev. Krev proudící směrem k sondě (barvy v horní části barevné škály) je nutné odlišit od krve proudící směrem od sondy (barvy ve spodní části barevné škály) pomocí barevné škály (zobrazeno v (c)). Power Dopplerovo ultrazvukové vyšetření (b) poskytuje informaci o množství průtoku, ovšem bez informace o směru průtoku. 
Kontinuální Dopplerovo zobrazení (CWD). Využívá dva krystaly (jeden přijímá a druhý vysílá signál). Tento systém nelze užívat pro barevné zobrazení rychlosti toku. CW se při zobrazování skrota neužívá, v některých případech se užívá pro měření vysoké průtokové rychlosti v aortě.
Pulzní Dopplerovo zobrazení (PWD). Umožňuje lékaři umístit gate (elektronicky ovladatelnou krabičku) do cévy, v níž potřebujeme změřit rychlost průtoku krve. PWD poskytuje data pro barevnou Dopplerovu sonografii (schéma 9a), power Dopplerovu sonografii (energetický Doppler) (schéma 9b) a spektrální Dopplerovu ultrasonografii (schéma 9c).
Barevná Dopplerova sonografie (CD). Převádí Dopplerův posun do barev a následně je promítne do 2D zobrazení. CD obsahuje několik gates, které jsou umístěny v různé hloubce podél mnohočetných zobrazovacích linií. CD poskytuje informace týkající se průtokové rychlosti (rychlost a směr). Krev pohybující se směrem k snímací hlavě je zobrazena v barvách horní strany barevného spektra, krev pohybující se v opačném směru v barvách dolní strany barevného spektra. CD má následující omezení [2]:
- v případě, že je příjmové zesílení signálu příliš vysoké, nebo prahová hodnota příliš nízká, může docházet k tomu, že šum překryje vysílaný signál, což může narušovat obraz a komplikovat jeho interpretaci
- výsledky závisí na správném nasměrování sondy
- při pulzním Dopplerově zobrazení dochází běžně ke vzniku tzv. aliasing efektu (přetékání), kdy se signál vysoké rychlosti průtoku zobrazuje v záporné oblasti grafu (schéma 2)
Barevné power Dopplerovo zobrazení (CPD). Kóduje energii Dopplerova signálu pomocí barev tak, že zobrazuje celkový integrovaný signál namísto průměrné hodnoty Dopplerova posunu frekvence [3]. Zásadní nevýhoda CPD spočívá v tom, že neposkytuje informace o směru průtoku. Ve srovnání s CD je v mnoha případech citlivější při detekci průtoku krve o nižší rychlosti.
Spektrální Dopplerovo zobrazení (SD). Slouží k vyšetření průtoku krve v jediném místě, často se používá v kombinaci s CD. Tento systém má vynikající časovou rozlišovací schopnost umožňující detailní analýzu křivky (zahrnující kalkulaci průtokové rychlosti a ukazatelů).
BEZPEČNOST PACIENTA
Ultrasonografie má vynikající bezpečností profil. The American Institute of Ultrasound in Medicine opakovaně potvrdil následující tvrzení: „Nebyl zaznamenán jediný případ biologického účinku diagnostických ultrazvukových systémů na zdraví pacienta ani zdravotnického personálu“. Vzhledem k tomu, že se ultrazvuk šíří tkání, existuje zde potenciální riziko poškození tkáně následkem tepelných i jiných efektů (např. kavitace).
V kontextu se zobrazovacími modalitami se často užívá akronym ALARA („as low as reasonably achiavable“, což v překladu znamená „tak nízké, jak je rozumně dosažitelné“). Při ultrazvukovém vyšetření je možné riziko minimalizovat užíváním technik a vybavení, které je navrženo tak, aby omezovalo mechanické a termální účinky ultrazvukových vln:
- užívání co možná nejnižšího napájení
- omezení doby aktivního působení sondy
- správný výběr sondy (sondy s vyšší frekvencí vyžadují vyšší intenzitu, aby umožnily zobrazení ve větší hloubce)
- správné nastavení PRF, zaostření, napájení a délku pulzu
Dále je nezbytné, aby bylo vybavení pravidelně kontrolováno a sondy před i po použití vydezinfikovány. Každá ordinace by měla mít k dispozici manuál dokumentující principy použití a dokumentace.
V každém případě je nutné dodržovat pokyny výrobce systému. Jakoukoli komplikaci nebo vadu systému je nutné zdokumentovat a věnovat jí další pozornost.
NORMÁLNÍ ULTRAZVUKOVÉ VYŠETŘENÍ SKROTA
Varle dospělého muže je přibližně 4–5 cm dlouhé, 3 cm široké, s AP (anteriorně-posteriorní) vzdáleností 2–3 cm. Objem varlete se obvykle pohybuje mezi 20 a 30 ml. Jedná se o hladkou žlázu elipsovitého tvaru, která vykazuje homogenní echogenicitu. 250 kónických lalůčků (tvořených seminiferózními tubuly) se sbíhá v mediastinu a vytváří rete testis. 8–12 eferentních duktů spojuje rete testis s hlavou (caput nebo globus major) epididymis, čímž vytváří jediný ductus epididymis. Septum a mediastinum se mohou na ultrazvukovém obraze jevit jako lineární echogenní oblasti (schéma 10b).
Epididymis u dospělého muže měří 6–7 cm, hlava (caput) o rozměru 1–2 cm, tělo (corpus) 2–4 cm a ocas (cauda) 2–5 cm v největším rozměru. Hlava epididymis je často (ovšem nikoli ve všech případech) echogeničtější než varle a má hrubší povrch (schéma 10a). Menší corpus epididymis se na snímku jeví jako hypoechogenní objekt obsahující několik echogenních lineárních struktur, které zobrazují svinutý epididymální kanálek [7]. U mužů, kteří podstoupili vasektomii, nebo trpí epididymitidou, je často méně echogenní než varle (schéma 10c).
Schéma 10. 10a normální caput epididymis, 10b normální mediastinum, 10c dilatované epididymis po vasektomii. 
SKENOVACÍ PROTOKOL: TIPY A TECHNIKY
Základem pro důkladné a pečlivé vyšetření skrota je vytvoření protokolu a jeho dodržování při každém vyšetření. Přístup, který prezentuji v tomto článku, je třeba považovat za jakési vodítko, které lze na základě vlastních zkušeností a preferencí modifikovat.
Příprava pacienta. Skrotum je třeba podložit. Obvykle se užívají roušky, nejlepší podporu však ve skutečnosti poskytuje poloha, kdy je pacient umístěn snožmo. Úd je překryt rouškou. Pacienta je možné požádat o spolupráci – pokud pacient drží špičku penisu, nebude úd překážet v pracovním poli.
Výběr sondy. Při zobrazování skrota se doporučuje užívat vysokofrekvenční sondu (7,5–10 MHz). Sonda se širokým rozpětím vlnového pásma umožňuje zobrazit více ohnisek, čímž eliminujeme potřebu dalšího nastavování sondy během vyšetření. Existují sondy s větším frekvenčním rozsahem, které lze nastavit na jednu konkrétní frekvenci (z výběru). Ideální je lineární sonda s plochou dotyku, která umožňuje změřit délku varlete. Konvexní sondy lze užívat při zobrazování větších varlat a při srovnávání obou varlat. Konvexní sondy však mají nižší frekvenci, což má za následek méně detailní zobrazení. Barevné a spektrální Dopplerovo zobrazení se stává nedílnou součástí ultrazvukového vyšetření skrota, protože poskytuje informace o průtoku krve varletem a paratestikulárních strukturách.
Přehledové zobrazení. Seznam snímků, které je třeba získat, je uveden v tab. 4. Vyšetření zahájíme longitudinálním přehledným zobrazením skrota, pokračujeme mediolaterálně, abychom získali celkový obraz varlete a paratestikulárních struktur. Standardní orientace zobrazení by měla být následující: horní pól na levé straně a dolní pól na pravé straně. V případě, že je varle větší než plocha dotyku sondy, je třeba myslet na to, abychom pořídili snímky superiorní a inferiorní části varlete, včetně epididymis v těchto oblastech. Společně s AP rozměrem měříme rovněž dlouhou osu ve středu varlete.
4. Doporučené obrazy při ultrazvukovém vyšetření skrota (v ordinaci urologa). 
Rotací sondy o 90 ° proti směru hodinových ručiček přejdeme do příčného zobrazení. Standardní orientace pravého varlete je následující: laterální aspekt se nalézá na levé straně a mediální aspekt na pravé straně. Naopak při zobrazení levého varlete je laterální aspekt na pravé straně a mediální aspekt na levé straně. Jako výchozí bod použijeme střed varlete, nejprve směřujeme k hornímu pólu, vracíme se zpět ke středu varlete a pokračujeme k dolnímu pólu. Šířku varlete a AP vzdálenost měříme ve středu varlete. Pakliže zobrazovací systém nabízí možnost rozdělit displej na dvě nebo více částí, lze snadno provést srovnávací zobrazení echogenicity a průtoku krve.
Barevné Dopplerovo zobrazení by mělo představovat nedílnou součást ultrazvukového vyšetření skrota. Řada zánětlivých, neoplastických a benigních onemocnění se vyznačuje charakteristickým průtokem krve, což může být dobrou pomůckou při diagnostice.
SPRÁVNÁ DOKUMENTACE
Lékařská zpráva a uložené snímky jsou svědectvím o kvalitě vyšetření. Při sestavování kvalitní zprávy by se měl sonografista řídit starým příslovím „co nebylo zdokumentováno, neexistuje“. Statické snímky pořízené během vyšetření by měly vyjadřovat lékařův dojem z nálezu. V případě, že to paměť ultrazvukového systému dovoluje, je vhodnější ukládat video klipy, které lépe reprezentují nálezy. Kvalitní zpráva může významně pomoci při diagnostice, a je tedy v nejlepším zájmu pacienta.
Kromě výsledků měření a anatomického nálezu je nutné do zprávy zaznamenat identifikační údaje pacienta, datum konání vyšetření a indikace. Lékař provádějící vyšetření by měl zprávu podepsat.
Snímky je vhodné přiložit ke zprávě. Každý snímek by měl být opatřen údaji o datu, čase provádění vyšetření, identifikačními údaji pacienta, typu sondy a frekvence. Zobrazovaný objekt by měl být jasně identifikován. Dále je nutné jasně označit orientaci objektu, všechny rozměry, odpovídající anatomické struktury a jakékoli abnormality.
Co a kdy hledat
Existuje celá řada indikací pro ultrazvukové vyšetření skrota (tab. 5). Sonografie skrota je často indikována v případě, že je fyzikální vyšetření neprůkazné, nebo je jeho provedení komplikované z důvodu dyskomfortu pacienta nebo nemožnosti identifikovat skrotální struktury při palpaci. Ultrazvukové vyšetření je tedy nedílnou součástí fyzikálního vyšetření mužského genitálu.
5. Indikace pro ultrazvukové vyšetření skrota (v ordinaci urologa). 
Vyšetření skrotální rezistence představuje nejčastější indikaci pro ultrazvukové vyšetření skrota. Jakoukoli skrotální rezistenci je nutné vyšetřit pomocí ultrazvuku a nálezy správně zaznamenat (včetně lokalizace objektu, echogenicity, velikosti, barevného mapování toku krve, a klinický dojem jakékoli rezistence). Rezistence může být klasifikována jako testikulární, epididymální, paratestikulární, nebo jako součást skrotální stěny. Na základě echogenicity a charakteristik barevného mapování lze rozhodnout, zda se jedná o vaskulární, solidní rezis-tenci nebo útvar naplněný tekuti-nou. Rezistence může být bolestivá i nebolestivá.
BOLESTIVÉ ZVĚTŠENÍ SKROTA
Tento stav, který se obvykle vyskytuje u pacientů s epididymitidou, orchitidou, testikulárním abscesem a/nebo testikulární torzí, má obvykle rozdílnou manifestaci. Ačkoli výhoda sonografie spočívá v rychlosti, neinvazivní povaze a senzitivitě, toto vyšetření není vždy specifické. Například u pacientů s akutním skrotem a vyšším průtokem krve varletem (při ultrazvukovém vyšetření) se může jednat o orchitidu nebo stav po torzi a následné detorzi (schéma 11). Ultrazvukové vyšetření neumožňuje diferencovat hyperemii, která se často vyskytuje u pacientů s obnovením průtoku (jako kupříkladu v případě torze-detorze) od zánětu. Já se domnívám, že ultrazvuk neumožňuje „vyloučit“ přítomnost torze při vyšetřování akutního skrota vzhledem k tomu, že umožňuje identifikovat pouze stav, který je přítomen během vyšetření. Torzi je možné diagnostikovat pouze na základě anamnézy (např. charakteristický začátek onemocnění a symptomy jako dysurie, horečka, třesavka), nálezů fyzikálního vyšetření (zarudnutí, otok, rezistence a citlivost) nebo diagnostických vyšetření (rozbor a kultivace moči, počet leukocytů).
Schéma 11. Zvýšený průtok krve po manuální detorzi varlete. 
Epididymitida/orchitida. Tělo normálního epididymis je oproti hlavě o něco méně echogenní. U pacientů s akutní epididymitidou může být epididymis zasaženo fokálně (obvykle od kaudy) nebo globálně (zvětšení a zesílení stěny epididymis, snížení echogenicity a zvýšený průtok při Dopplerově barevném zobrazení). Při vyšetření vidíme vysoký průtok s nízkým odporem. Při žilním infarktu dochází během diastoly k obrácení průtoku [8]. Obvykle je rovněž přítomna reaktivní hydrokéla. Komplikace zahrnují šíření infekce do varlete (epididymo-orchitida, schéma 12,13), vznik abscesu, infarkt varlete (obvykle v důsledku obstrukce žilního průtoku s následnou atrofií varlete) a chronickou bolest. Barevné Dopplerovo zobrazení umožňuje obvykle stanovení diagnózy.
Schéma 12. Epididymitida na power Dopplerově ultrazvukovém vyšetření. 
Schéma 13. Epididymitida-orchitida na 2D ultrazvukovém zobrazení v šedé škále zobrazena jako zvětšené a heterogenní varle i nadvarle. 
U pacientů s orchitidou je varle zvětšené, nehomogenní a vykazuje nižší cévní odpor (RI resistive index). RI epididymální a testikulární arterie je významně nižší u pacientů s epididymo-orchitidou než u kontrolních subjektů [9].
Pacienti s chronickou epididymitidou (schéma 14) obvykle trpí přetrvávající bolestí. U těchto mužů odhalí ultrazvuk zvětšené epididymis s větší echogenicitou a v některých případech přítomnost kalcifikací.
Schéma 14. Chronická epididymitida s výraznější echogenicitou a mikrokalcifikacemi v caput epididymis. 
Testikulární absces. Přibližně u 5 % pacientů s orchitidou se vyskytuje přetrvávající horečka, bolest ve skrotu a otok. Všechny tyto nálezy jsou charakteristickými klinickými symptomy testikulárního abscesu. Charakteristický ultrazvukový nález je obvykle přítomen mezi prvním a sedmým týdnem. Neúčinná léčba epididymo-orchitidy může mít za následek vznik pyokély, testikulárního nebo skrotálního abscesu a případně fasciitidu. Skrotální absces může připomínat tumor, anamnéza (která předchází epididymo-orchitidu) spolu s ultrazvukem prokázanými známkami zánětu obvykle umožní tato dvě onemocnění rozlišit.
Torze. Ačkoli jsou testikulární torze a torze apendixu nadvarlete považovány za častější nález než torze semenného provazce, torze semenného provazce představuje skutečně akutní urologickou situaci. Ačkoli se předpokládá, že ke vzniku nezvratného poškození varlete dojde až 4 hod po torzi semenného provazce [10–14], pouze 50 % mužů, u nichž byla torze vyřešena < 4 hod, mělo po této příhodě ejakulát normální kvality.
Torze je klinická diagnóza, která se prokáže během operačního řešení. Ultrazvukové vyšetření neumožňuje diagnostikovat přítomnost torze – tento závěr může vyvodit pouze urolog (patolog). Sonografie se v tomto případě užívá pouze k dokumentaci nálezu. Řada stavů (např. torze-detorze, intermitentní torze, perzistentní kapsulární průtok, artefakty přítomné při barevném zobrazení průtoku) mohou vyvolávat dojem prokrvení tam, kde neexistuje.
Při ultrazvukovém zobrazení se postižené varle obvykle jeví jako hypoechogenní. Velikost varlete může být různá – od hypertrofického až po atrofické varle. Sonografista by měl v každém případě pomocí podélného, příčného a koronálního zobrazení porovnat poškozené a kontralaterální varle (schéma 15). Velkou informační hodnotu může mít apikální pohled, který vzniká v případě, kdy se sonografista pokouší sondu nastavit paralelně s průtokem krve. Další užitečnou pomůckou může být spektrální analýza s kalkulací RI. Tato metoda však, jak již bylo uvedeno výše, neumožňuje stanovení diagnózy. U pacientů s akutní torzí se může epididymis jevit jako zvětšená hypoechogenní struktura (podobně jako tomu je u pacientů s epididymitidou).
Schéma 15. Torze pravého varlete ve srovnání s normálním levým varletem (pro srovnání echogenicity). 
NEBOLESTIVÉ ZVĚTŠENÍ SKROTA
Vznik nebolestivého útvaru ve skrotu nebo jeho nebolestivé zvětšení může mít celou řadu příčin. Pro identifikaci etiologie tohoto stavu je nejvhodnější modalitou ultrazvukové vyšetření. Ultrazvuk se užívá rovněž při intraoperační lokalizaci nehmatných lézí [16].
Testikulární tumor. Nejčastější ultrazvukový nález maligního testikulárního útvaru (ať se jedná o tumor ze zárodečných buněk, tumor z jiných než zárodečných buněk, nebo metastazující lézi, která nepochází z varlete) je následující: homogenní echogenní struktura, která je hypoechogenní vůči okolnímu parenchymu a vaskularizovaná (schéma 16a,b,c) [17]. Testikulární tumor se může manifestovat celou řadou způsobů – jako nehmatná léze [18], hyperechogenní léze, heterogenní s oblastmi kalcifikace, cystické změny [19] a/nebo různé typy vaskularity. U pacientů s daleko rozsáhlými metastázami může být při zobrazení viditelné pouze zjizvení nebo oblast kalcifikace, která představuje „vyhořelý“ tumor, u něhož došlo k involuci vlivem vysoké metabolické aktivity přesahující vlastní krevní zásobení (schéma 17). Karcinomatózní tkáň nelze spolehlivě diferen-covat pouze na základě ultrazvukového zobrazení.
Schéma 16 a,b,c,d. Různé testikulární tumory na 2D ultrazvukovém zobrazení v šedé škále ((a) a (c)) jako hypoechogenní a dobře ohraničená oblast (a) a špatně ohraničené multifokální oblasti (c). 2D barevná Dopplerova sonografie ((b) a (d)) ukazuje vyšší průtok krve. 
Schéma 17. „Vyhořelý“ testikulární tumor. 
Hydrokéla. Způsobená nashromážděním serózní tekutiny mezi parietální a viscerální vrstvou tunica vaginalis se manifestuje bezbolestným otokem skrota. Přestože se hydrokéla obvykle jeví jako anechoidní struktura, může obsahovat echogenní krystaly cholesterolu. Přítomnost sept (schéma 18) bývá obvykle spojena s infekcí, traumatem nebo metastazujícím onemocněním. Ačkoli etiologie může být idiopatická, hydrokéla může vznikat v důsledku infekce, traumatu, torze, tumoru, nebo otevřeného procesus vagi-nalis. Varle je obvykle vytlačováno hydrokélou posteriorním směrem.
Schéma 18. Hydrokéla se septy. 
Skrotální hernie. U pacientů se skrotální hernií (schéma 19) je obvykle superiorně od varlete přítomen tuk v mesenteriu a/nebo střevní kličky. Typickým nálezem ultrazvukového vyšetření jsou peristaltika, střevní kličky naplněné tekutinou a vysoce echogenní tuková tkáň v omentu.
Cysta v epididymis/spermatokéla (schéma 20). Je nebolestivá skrotální struktura, která (při větších rozměrech) vytlačuje varle v inferiorním směru. Spermatokéla je benigní anechoidní cysta epididymis obsahující spermie, která je obvykle lokalizována v hlavě epididymis, často má septa.
Schéma 20. Cysta nadvarlete/ spermatokéla. 
TRAUMA
Traumatické poranění varlete může mít celou řadu příčin [20–22]. Polovinu případů tvoří poranění způsobená při sportu, 9–17 % případů vzniká při nehodách motorových vozidel. Odhaduje se, že sonografie je schopna zobrazit testikulární trauma se 100% senzitivitou a 80% specifitou [23]. V případě, že identifikujeme rupturu varlete (natržení tuniky albuginea), lze případ považovat za akutní. Charak-teristické znaky ruptury varlete na ultrazvuku zahrnují zesílení stěny skrota, přerušení kontinuity tuniky albuginea (u 17 % pacientů), nepravidelné okraje varlete, hematokélu nebo hematom varlete a snížení průtoku krve do postižené oblasti (na barevném Dopplerově ultrazvuku) (schéma 21 a,b) [24].
Schéma 21 a,b. Traumatické poranění varlete (a), pooperační hematom (b). 
ABNORMÁLNÍ SKROTUM
U pacientů s kryptorchismem nebo abnormálně zesílenou kůží skrota nám může US pomoci při identifikaci abnormalit.
Nesestouplé varle. Při absenci varlete ve skrotu se pokusíme potvrdit, případně vyvrátit jeho přítomnost. Ultrazvukové vyšetření představuje u novorozenců a malých dětí vzhledem k senzitivitě v inkvinálním kanálu (kde je nesestouplé varle ve většině případů lokalizováno), okamžité dostupnosti, bezpečnostnímu profilu a absenci potřeby anestezie první diagnostické vyšetření. V případě, že varle není identifikováno v inkvinálním kanálu, je obvykle indikováno CT nebo MRI s cílem lokalizovat varle v abdominální dutině. Zlatým standardem při identifikaci intra-abdominálního varlete však doposud zůstává operační explorace.
Kryptorchické varle lokalizované v inkvinálním kanále (identifikované na základě přítomnosti mediastina varlete) je obvykle menšího rozměru (hypotrofické). Kryptorchické varle můžeme odlišit od inkvinální hernie na základě absence peristaltiky, vysoce reflexní tukové tkáně v omentu (nebo obou symptomů) [23].
Zesílená kůže ve skrotu. Palpace skrota může být obtížná u pacientů se zesílenou stěnou skrota nebo retrahovaným skrotem (schéma 22). Ultrazvukové vyšetření skrota může být užitečné zejména při vyšetřování pacientů, u nichž došlo ke změnám stěny skrota v důsledku srdečního selhání, lymfatické nebo venózní obstrukci, infekci (např. filarióza) nebo jiného nezánětlivého stavu (např. celulitida nebo Fournierova gangréna) [25–28].
FERTILITA A SOUVISEJÍCÍ PROBLEMATIKA
U pacientů s onemocněními, která mohou mít potenciální dopad na fertilitu, může sonografie poskytnout užitečnou diagnostickou informaci a dokumentaci stavu před a po výkonu.
Varikokéla. Nejčastěji je varikokéla identifikována při vyšetření mužské infertility, v méně častých případech na základě bolesti ve skrotu. Varikokéla se vyskytuje přibližně u 15 % fertilních mužů, u 30–40 % mužů trpících primární subfertilitou a u 80 % mužů se sekundární subfertilitou. Klinicky signifikantní varikokéla způsobuje subfertilitu a zhoršení kvality semene (pokles počtu spermií, snížení motility, pokles počtu spermií s normální morfologií). U těchto pacientů je obvykle v ejakulátu přítomen vyšší počet spermií se zúženou hlavičkou a počet nezralých zárodečných forem.
Varikokéla je daleko častěji lokalizována na levé straně, což pravděpodobně souvisí s úhlem napojení a délkou levé testikulární cévy. Některé studie uvádějí, že u více než 80 % případů se jedná o bilaterální stav [29]. Ultrazvukový nález obvykle obsahuje četné plazivé tubulární struktury o různém průměru, které lze nejlépe zobrazit superiorně a posterolaterálně od varlete [30]. U pacientů s varikokélou o větší velikosti mohou takto dilatované žíly vyplňovat značnou část skrota (schéma 23). Barevné Dopplerovo zobrazení má významnou roli při dokumentaci přítomnosti a lokalizace varikokély a rozlišení intratestikulární varikokély (schéma 24) od dilatovaného rete testis [31,32]. Přítomnost bilaterální varikokély lze nejlépe identifikovat pomocí ultrazvukového vyšetření skrota.
Schéma 23. Bilaterální varikokéla. 
Schéma 24. Intratestikulární varikokéla. 
U pacientů, u nichž dojde k náhlému vzniku varikokély, případně tato přetrvává i v poloze na zádech, je třeba indikovat další zobrazovací vyšetření retroperitonea s cílem identifikace etiologických faktorů.
Testikulární atrofie. Tento stav může souviset s věkem pacienta, traumatem, infekcí nebo zánětem, případně může vzniknout v důsledku hypothyroidismu, medikamentózní terapie nebo chronického onemocnění. Nález na ultrasonografii je různorodý a vzhledem k příčině je obvykle charakterizován nižší echogenicitou a normálně vyhlížejícím epididymis.
Zobrazovací vyšetření u subfertilních pacientů umožňuje identifikovat případnou přítomnost tumoru (schéma 25) nebo testikulární mikrolitiázy (TM) před zahájením léčby.
Schéma 25 a,b. Atrofické varle s nehmatným tumorem z Leydigových buněk. 
Testikulární mikrolitiáza. TM je definována přítomností pěti nebo více mikrokalcifikací ve varleti. Pravděpodobná příčina spočívá v kalcifikaci degenerujících buněk v seminoferózních tubulech. Tento stav, vyskytující se přibližně u 1–5 % asymptomatických mužů, je obvykle symetrický (unilaterální výskyt u 20 % případů). Akustický stín v mnoha případech vzhledem k malé velikosti kalcifikací chybí (schéma 26).
Schéma 26 a,b. Mikrolitiáza ve varleti s několika mikrolity (a) a s mnoha mikrolity (b). 
Benigní i maligní tumory varlete mohou obsahovat mikrolity. Bennett et al prokázali přímou souvislost mezi počtem mikrolitů a incidencí tumoru varlete [37]. Testikulární tumor byl přítomen pouze u 1 (2 %) z celkem 65 pacientů s < 5 mikrolity, oproti 7 (18 %) z celkových 39 s ≥ 5 mikrolity. Bach et al ve své studii prokázali přítomnost mikrolitiázy u 48 (9 %) z 528 pacientů podstupujících ultrazvukové vyšetření skrota. Mikrolitiáza byla detekována rovněž u 13 (27 %) ze 48 pacientů s karcinomem varlete [33]. Pouze u 38 (8 %) ze 480 pacientů bez TM byl přítomen karcinom. Prospektivní analýza však prokázala, že pacienti s TM měli 5–10% riziko, že u nich bude přítomen tumor [34].
Riziko vzniku testikulárního tumoru u pacientů s TM nebylo dosud stanoveno [35,36]. Údaje od různých autorů nasvědčují tomu, že TM je benigní, neprogresivní stav (minimálně při 45měsíčním sledování) [37–39]. V několika nejnovějších kazuistikách však byl při dlouhodobějším sledování (> několik let) pacientů s TM popsán vznik testikulárního karcinomu, což jasně prokazuje, že tato populace pacientů vyžaduje pečlivější sledování [40–44]. Frekvence sledování a druh vyšetření nebyl doposud v současné literatuře jasně definován, stejně jako doporučovaná délka sledování pacientů. Řada urologů instruuje své pacienty, jak si jednou měsíčně mohou sami vyšetřit varlata, a každých 6–12 měsíců indikuje fyzikální vyšetření a ultrazvuk skrota. U pacientů s TM, u nichž jsou přítomna onemocnění související s vyšší incidencí tumoru ze zárodečných buněk (např. testikulární atrofie, infertilita, kryptorchismus, přítomnost intratubulárního neoplazmatu ze zárodečných buněk při biopsii) je tedy opodstatněné dlouhodobé sledování.
Zhoršená kvalita ejakulátu a azoospermie. Zhoršení kvality ejakulátu může být předzvěstí jiného onemocnění. Varikokéla, obstrukce duktu a tumor varlete – všechny tyto patologie lze snadno prokázat pomocí ultrazvukového vyšetření a lze (ale ne nutně) identifikovat pomocí fyzikálního vyšetření. Sonografie jako neinvazivní modalita umožňující zobrazení v reálném čase je obvykle indikována při komplexním vyšetření mužů se zhoršenou kvalitou ejakulátu s cílem prokázat přítomnost nebo absenci patologického nálezu, zejména v případech, kdy je fyzikální vyšetření neprůkazné nebo nasvědčuje přítomnosti intraskrotální patologie. U mužů s azoospermií může ultrazvuk často pomoci definovat příčinu (např. vrozená bilaterální absence chámovodu nebo mikrolitiáza) [45–47].
Protilátky proti spermiím. Přibližně u 10 % subfertilních mužů jsou přítomny protilátky proti spermiím (ve srovnání s pouhými 2 % v populaci fertilních mužů) [48–50]. Nejčastější příčiny (obstrukční azoospermie, vrozená bilaterální absence chámovodu, epididymitida, genitální trauma a kryptorchismus) lze odhalit pomocí ultrazvukového vyšetření skrota [51–55].
POOPERAČNÍ SLEDOVÁNÍ
Ultrazvukové vyšetření (v ordinaci urologa) představuje vynikající modalitu pro sledování pacientů po výkonu, ačkoli tato možnost nebývá často využívána. Změny v kvalitě ejakulátu po varikokelektomii lze korelovat s nálezem sonografické dokumentace pro potvrzení absence varikokély, přetrvávající varikokély nebo její recidivy. Ultrazvukové vyšetření představuje rovněž senzitivní modalitu pro vyšetření testikulárního parenchymu po biopsii varlete, extrakci ejakulátu z varlete nebo korekci hydrokély [56,57].
ZÁVĚR
Při porozumění anatomii varlete a základním principům ultrazvukového vyšetření a s vhodným vybavením je urolog schopen provádět, interpretovat a dokumentovat výsledky ultrazvukového vyšetření skrota, které poskytnou neocenitelné informace při diagnostice a léčbě řady urologických onemocnění. Urologové pomocí školení i vlastních zkušeností získají jedinečnou kvalifikaci pro provádění sonografie a měli by v této kvalifikaci trvale dosahovat vysoké úrovně.
Danielle L. Gilbert, BA
Jefferson Medical College,
Philadelphia, PA
Sources
1. Deane C. Doppler ultrasound: Principles and practice in Doppler in obstetrics. In: Nicolaides K, Rizzo G, Hecker K et al eds. Diploma in Fetal Medicine Series. ISUOG Educational Committee; 2002.
2. Keener TS, Nghiem HV, Kreiger JN et al. Comparison of conventional color Doppler with power Doppler sonography to depict normal prostatic vasculature. JDMS 1997; 13 : 63–67.
3. Rubin JM, Bude RO, Carson PL et al. Power Doppler US: a potentially useful alternative to mean frequency-based color Doppler US. Radiology 1994; 190(3): 853–856.
4. Atilla M, Sargin H, Yilmaz Y et al. Undescended testes in adults: clinical significance of resistive index values of the testicular artery measured by Doppler ultrasound as a predictor of testicular histology. J Urol 1997; 158(3 pt 1): 841–843.
5. Yee TY, Choe BY, Byun JY et al. Resistive index of the intrascrotal artery in scrotal inflammatory disease Acta Radiol 1997; 38(6): 1026–1030.
6. Mihmanli I, Kantarci F, Kulaksizoglu H et al. Testicular size and vascular resistance before and after hydrocelectomy. AJR Am J Roentgenol 2004; 183(5): 1379–1385.
7. Owen CA, Winter T. Color Doppler imaging of the scrotum. JDMS 2006; 22 : 221–230.
8. Sanders LM, Haber S, Dembner A et al. Significance of reversal of diastolic flow in the acute scrotum. J Ultrasound Med 1994; 13(2): 137–139.
9. Jee WH, Choe BY, Byun JY et al. Resistive index of the intrascrotal artery in scrotal inflammatory disease. Acta Radiol 1997; 38(6): 1026–1030.
10. Baker LA, Sigman D, Mathews RI et al. An analysis of clinical outcomes using color Doppler testicular ultrasound for testicular torsion. Pediatrics 2000; 105(3 pt 1): 604–607.
11. Blaivas M, Sierzenski P, Lambert M. Emergency evaluation of patients presenting with acute scrotum using bedside ultrasonography. Acad Emerg Med 2001; 8(1): 90–93.
12. Dogra V, Bhatt S. Acute painful scrotum. Radiol Clin North Am 2004; 42(2): 349–363.
13. Weber DM, Rosslein R, Fliegel C. Color Doppler sonography in the diagnosis of acute scrotum in boys. Eur J Pediatr Surg 2000; 10(4): 235–241.
14. Dogra VS, Bhatt S, Rubens DJ. Sonographic evaluation of testicular torsion. Ultrasound Clin 2006; 1 : 55–66.
15. Bartsch G, Frank S, Marberger H et al. Testicular torsion: late results with special regard to fertility and endocrine function. J Urol 1980; 124 : 375–378.
16. Kravets FG, Cohen HL, Sheynkin Y et al. Intraoperative sonographically guided needle localization of nonpalpable testicular tumors. AJR Am J Roentgenol 2006; 186(1): 141–143.
17. Steinfeld AD. Testicular germ cell tumors: review of contemporary evaluation and management. Radiology 1990; 175(3): 603–606.
18. Carmignani L, Morabito A, Gadda F et al. Prognostic parameters in adult impalpable ultrasonographic lesions of the testicle. J Urol 2005; 174(3): 1035–1038.
19. Cho JH, Chang JC, Park BH et al. Sonographic and MR imaging findings of testicular epidermoid cysts. AJR Am J Roentgenol 2002; 178(3): 743–748.
20. Bhandary P, Abbitt PL, Watson L. Ultrasound diagnosis of traumatic testicular rupture. J Clin Ultrasound 1992; 20(5): 346–348.
21. Dogra VS, Gottlieb RH, Oka M. Sonography of the scrotum. Radiology 2003; 227(1): 18–36.
22. Dogra VS, Bhatt S. Categorical Course in Diagnostic Radiology: Acute Scrotal Pain: Imaging Evaluation for a More Specific Diagnosis. Ramchandani P, ed. Oak Brook, Ill; Radiological Society of North America: Genitourinary Radiology 2006 : 255–270.
23. Herbener TE. Ultrasound in the assessment of the acute scrotum. J Clin Ultrasound 1996; 24(8): 405–421.
24. Haas CA, Brown SL, Spirnak JP. Penile fracture and testicular rupture. World J Urol 1999; 17(2): 101–106.
25. Grainger AJ, Hide, GH, Simon TE. The ultrasound appearances of scrotal oedema. Eur J Ultrasound 1998; 8(1): 33–37.
26. Sasso F, Nucci G, Palmiotto F et al. Acute idiopathic scrotal oedema: rare disorder or difficult diagnosis? Int J Urol Nephrol 1990; 22(5): 475–478.
27. Najmaldin A, Burge DM. Acute idiopathic scrotal oedema: incidence, manifestations and aetiology. Br J Surg 1987; 74(7): 634–635.
28. Brandes SB, Chelsky MJ, Hanno PM. Adult acute idiopathic scrotal edema. Urology 1994; 44 : 602–605.
29. Gat Y, Bachar GN, Everaert K et al. Induction of spermatogenesis in azoospermic men after internal spermatic vein embolization for the treatment of varicocele. Hum Reprod 2005; 20(4): 1013–1017.
30. Cornud F, Belin X, Amar E et al. Varicocele: strategies in diagnosis and treatment. Eur Radiol 1999; 9(3): 536–545.
31. Das KM, Prasad K, Szmigielski W et al. Intratesticular varicocele: evaluation using conventional and Doppler sonography. AJR Am J Roentgenol 1999; 173(4): 1079–1083.
32. Tasci AI, Resim S, Caskurlu T et al. Color Doppler ultrasonography and spectral analysis of venous flow in diagnosis of varicocele. Eur Urol 2001; 39(3): 316–321.
33. Bach AM, Hann LE, Hadar O et al. Testicular microlithiasis: what is its association with testicular cancer? Radiology 2001; 220(1): 70–75.
34. Peterson AC, Bauman JM, Light DE et al. The prevalence of testicular microlithiasis in an asymptomatic population of men 18 to 35 years old. J Urol 2001; 166(6): 2061–2064.
35. Middleton WD, Teefey SA, Santillan CS. Testicular microlithiasis: prospective analysis of prevalence and associated tumor. Radiology 2002; 224(2): 425–428.
36. von Eckardstein S, Tsakmakidis G, Kamischke A et al. Sonographic testicular microlithiasis as an indicator of premalignant conditions in normal and infertile men. J Androl 2001; 22(5): 818–824.
37. Bennett HF, Middleton WD, Bullock AD et al. Testicular microlithiasis: US follow-up. Radiology 2001; 218(2): 359–363.
38. Whitman GJ, Hall DA, McCarthy KA et al. Testicular microlithiasis: sonographic features and significance. Radiology 1994; 193(P): 335. Abstract.
39. Furness PD III, Husmann DA, Brock JW III et al. Multi-institutional study of testicular microlithiasis in childhood: a benign or premalignant condition? J Urol 1998; 160(3 pt 2): 1151–1154.
40. Gooding GAW. Detection of testicular microlithiasis by sonography. AJR Am J Roentgenol 1997; 168(1): 281–282.
41. Winter TC 3rd, Zunkel DE, Mack LA. Testicular carcinoma in a patient with previously demonstrated testicular microlithiasis. J Urol 1996; 155(2): 648.
42. Frush DP, Kliewer MA, Madden JF. Testicular microlithiasis and subsequent development of metastatic germ cell tumor. AJR Am J Roentgenol 1996; 167(4): 889–890.
43. McEniff N, Doherty F, Katz J et al. Yolk sac tumor of the testis discovered on a routine annual sonogram in a boy with testicular microlithiasis. AJR Am J Roentgenol 1995; 164 : 971–972.
44. Salisz JA, Goldman KA. Testicular calcifications and neoplasia in a patient treated for subfertility. Urology 1990; 36(6): 557–560.
45. Aizenstein RI, DiDomenico D, Wilbur AC et al. Testicular microlithiasis: association with male infertility. J Clin Ultrasound 1998; 26(4): 195–198.
46. Jarow JP. Life-threatening conditions associated with male infertility. Urol Clin North Am 1994; 21(3): 409–415.
47. Honig SC, Lipshultz LI, Jarow J. Significant medical pathology uncovered by a comprehensive male infertility evaluation. Fertil Steril 1994; 62(5): 1028–1034.
48. Clarke GN, Elliott PJ, Smaila C. Detection of sperm antibodies in semen using the immunobead test: a survey of 813 consecutive patients. Am J Reprod Immunol Microbiol 1985; 7(3): 118–123.
49. Sinisi AA, Di Finizio B, Pasquali D et al. Prevalence of antisperm antibodies by SpermMARtest in subjects undergoing a routine sperm analysis for infertility. Int J Androl 1993; 16(5): 311–314.
50. Gilbert BR, Witkin SS, Goldstein M. Correlation of sperm-bound immunoglobulins with impaired semen analysis in infertile men with varicoceles. Fertil Steril 1989; 52(3): 469–473.
51. Fuchs EF, Alexander NJ. Immunologic considerations before and after vasovasostomy. Fertil Steril 1983; 40(4): 497–499.
52. Patrizio P, Silber SJ, Ord T et al. Relationship of epididymal sperm antibodies to their in vitro fertilization capacity in men with congenital absence of the vas deferens. Fertil Steril 1992; 58(5): 1006–1010.
53. Iqbal PK, Adeghe AJ, Hughes Y et al. Clinical characteristics of subfertile men with antisperm antibodies. Br J Obstet Gynaecol 1989; 96(1): 107–110.
54. Heidenreich A, Bonfig R, Wilbert DM et al. Risk factors for antisperm antibodies in infertile men. Am J Reprod Immunol 1994; 31(203): 69–76.
55. Urry RL, Carrell DT, Starr NT et al. The incidence of antisperm antibodies in infertility patients with a history of cryptorchidism. J Urol 1994; 151(2): 381–383.
56. Harrington TG, Schauer D, Gilbert BR. Percutaneous testis biopsy: an alternative to open testicular biopsy in the evaluation of the subfertile male. J Urol 1996; 156(5): 1647–1651.
57. Schlegel PN, Su L-M. Physiological consequences of testicular sperm extraction. Hum Reprod 1997; 12(8): 1688–1692.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2010 Issue 2-
All articles in this issue
- KIDNEY CANCER: NEW CONCEPTS IN EVALUATION AND MANAGEMENT
- Tumor markes in renal cancer: help for diagnosis, prognosis, treatment and follow up
- A STANDARDIZED ANATOMICAL CLASSIFICATION OF SMALL RENAL TUMORS
- Management Renal Tumors
- Ablative therapies in the treatment of small renal tumors: how far from standard of care?
- NEW TRENDS IN SYSTEMIC TREATMENT OF RENAL CANCER
- SCROTAL ULTRASOUND: PRINCIPLES AND PRACTICE
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- SCROTAL ULTRASOUND: PRINCIPLES AND PRACTICE
- Management Renal Tumors
- Tumor markes in renal cancer: help for diagnosis, prognosis, treatment and follow up
- A STANDARDIZED ANATOMICAL CLASSIFICATION OF SMALL RENAL TUMORS
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career




