-
Medical journals
- Career
Komplexní odezva organizmu na trauma
: Renáta Ječmínková 1; Vladimír Ječmínek 2; Jan Divák 3; Marcela Káňová 3; Ondřej Jor 3; Kamil Tomášek 3,4; Leopold Pleva 2; David Holeš 4,5
: Oddělení centrálního příjmu, Fakultní nemocnice Ostrava 1; Klinika úrazové chirurgie, Fakultní nemocnice Ostrava 2; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Ostrava 3; Univerzita Komenského v Bratislave, Jesseniova lekárska fakulta v Martine 4; ÚSZS MSK Ostrava 5
: Úraz chir. 26., 2018, č.2
ÚVOD: Těžké trauma vede k porušení zevních i vnitřních bariérových systémů postiženého organizmu s následnou komplexní a velmi provázanou reakcí, která je spouštěna uvolněním signálních molekul z poškozených tkání. Tyto iniciují jak aktivaci vrozeného imunitního systému, tak i stimulaci získané imunity a ovlivnění systému nervového a hormonálního. Snahou organizmu je udržet rovnováhu a přiměřenost této složité reakce a zabránit nadměrné eskalaci původně protektivních fyziologických dějů.
CÍL: Cílem práce je poskytnout ucelený pohled na komplexní problematiku následných změn organizmu po těžkém traumatu.
METODOLOGIE: Přehledový článek.
ZÁVĚR: Stále podrobnější znalosti a metody odhalování patofyziologických procesů organizmu v souvislosti s těžkým traumatem mohou být klíčem dalších možných terapeutických intervencí u těchto zraněných.
Klíčová slova:
trauma – stresová reakce – nervová odpověď – hormonální odpověď – metabolická reakce – získaná a vrozená imunita
Úvod
Těžké úrazy patří mezi nejčastější příčinu úmrtí u věkové kategorie 1–40 let a podle Světové zdravotnické organizace (WHO) se procento příčiny úmrtí v souvislosti s traumatem následkem pouze dopravních nehod bude do budoucna dále zvyšovat až k předpokládanému pátému místu příčin smrti v roce 2030 [21].
Závažné trauma představuje pro postiženého zásadní stresový faktor, který v organizmu vyvolává odpověď jak na úrovni nervové, endokrinní, tak na úrovni imunitní i metabolické. Smyslem této fylogeneticky staré reakce je snaha o zachování homeostázy: a) limitací dalšího poškození, b) mobilizací energie a c) nastolením reparačních procesů. Míra této odpovědi koresponduje se závažností poranění, věkem a kondicí nemocného, ale i s vystupňováním či naopak potlačením úvodní imunitní a systémové zánětlivé odpovědi. Ta je nazývána „První linií obrany“ či „Odezvou akutní fáze“ [9, 10].
Cílem přehledového článku je seznámit čtenáře s novými poznatky, které se týkají této komplexní reakce.
Metodologie
Přehledový článek
Metodika
Pro vyhledání článků zabývajících se problematikou odezvy organizmu na trauma byla použita databáze PubMed /Medline (https://www.ncbi.nlm.nih.gov/pubmed). Byl použit vyhledávací algoritmus využívající klíčová slova „trauma“ AND „response“. Vyhledávání bylo omezeno na články publikované od roku ledna 1994 do září 2018 napsané v anglickém jazyce. Dalším zdrojem článků byly literární odkazy již vybraných publikací. Byla použita data i ze dvou českých monografií.
Imunitní reakce
Odpověď organizmu na trauma je vyvolána stresem, bolestí, rozvíjejícím se šokovým stavem (hypovolémií, hypoxií, acidózou), ale velmi podstatnou roli hraje uvolnění signálních molekul z poškozených, ischemických a nekrotických buněk –tzv. alarminů neboli DAMPs (damage associated molecular patterns). Jsou to molekulární vzorce, které jsou za normálních okolností vlastnímu imunitnímu systému skryty a stávají se imunologicky aktivní v souvislosti s poškozením buněk. Mohou se uvolňovat jak a) z jader poškozených buněk (DNA, histony, High mobility group box 1 - HMGB-1), tak i b) z jejich plazmy (RNA, mitochondriální DNA) [1, 8, 22, 31, 37, 40, 41]. Jakmile se objeví mimo buňku, podporují aktivaci přirozených imunitních buněk a stejně tak i antigen-prezentujících buněk (APCs), jež jsou do obrany organizmu zapojeny. DAMPs jsou záhy po traumatu rozpoznávány: a) specifickými membránovými nebo cytoplazmatickými receptory – PRRs/pattern-recognition receptors (jako Toll like receptors /TLRs/, Nucleotide-binding domain, leucin-rich repeat-containing proteins /NLRs/, Receptor for advanced glycosylation end products/RAGE) a jiné, ale také b) sérin-proteázovým systémem, zahrnujícím kininovou, koagulační a komplementovou kaskádu, a to záhy po traumatu [2, 5, 6, 14, 29]. DAMPs samy o sobě jsou potentními aktivátory komplementu, vedou k rychlé tvorbě C3a C5a [20, 23, 26].
Mezi nejvíce prostudované DAMPs v souvislosti s traumatem asociovanou imunitní reakcí patří HMGB 1 protein, který se uvolňuje do oběhu již během 30 minut po traumatu. Je to chromozomální protein podílející se např. na obnově DNA a transkripci. HMGB1 je rovněž secernován imunokompetentními buňkami po setkání s infekčním agens, po rozpoznání povrchových znaků PAMPs (pathogen - associated molecular patterns) - např. endotoxinu (G+), lipopolysacharidu (G-). Reaguje tedy nespecificky na jakýkoli systémový zánět s uvolněním cytokinů - např. TNFα a IL-1. Navíc i aktivované neimunitní buňky, jako buňky endotelu a trombocyty mohou aktivně produkovat HMGB 1 [32].
Efekt vazby HMGB1, ale i jiných signálních proteinů na PRRs mj. zahrnuje: a) uvolnění cytokinů a chemokinů z makrofágů, monocytů a dendritických buněk, b) aktivaci a chemotaxi neutrofilů, c) alteraci epiteliální bariérové funkce se zvýšenou permeabilitou, d) vzestup prokoagulační aktivity na povrchu trombocytů. Dochází k rozvoji systémové odpovědi známé jako SIRS (systemic inflammatory response syndrome). Následuje spuštění dvou protichůdných pochodů: jak proinflamatorních, tak i antiinflamatorních dějů, a to již od počátku aktivace SIRS. Mezi hlavní proinflamatorní cytokiny patří TNF alfa, IL-1, IL-2, IL 6, IL-8, interferon, PAF (platelet activating factor). K antiinflamatorním cytokinům náleží IL-4, IL-10, IL-13, prostaglandin E2, TGFβ (tumor growth factor β) (obr. 1) [32].
1. Patofyziologie lokální zánětlivé reakce a její hlavní znaky: bolest, zarudnutí, zvýšená teplota, otok a porucha funkce (uvedeny tučně). DAMPs: damage - associated molecular patterns (molekulární vzorce asociované s poškozením); PAMPs: pathogen-associatied molecular patterns (molekulární vzorce asociované s patogeny); ROS: reactive oxygen species (reaktivní formy kyslíku). Podle M.L.Varela et al. Inflammation 2018 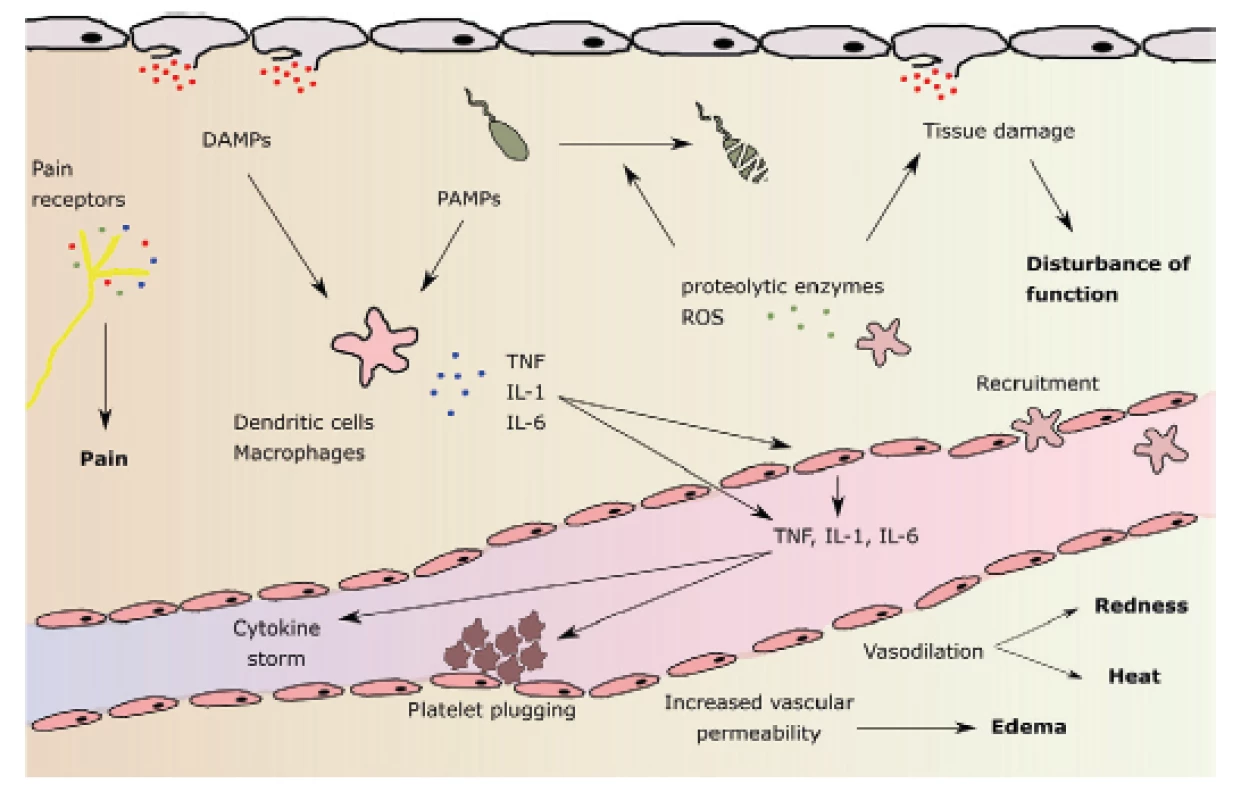
Stimulace neutrofilních leukocytů vede k aktivaci fagocytózy, uvolnění proteáz, formování leukocytárních pastí – NETs (neutrolil extracellular traps) a k tvorbě kyslíkových radikálů (ROS: reactive oxygen species), mezi které mj. řadíme hydroxylový radikál, superoxidový radikál, singletový kyslík, peroxid vodíku. ROS mají své fyziologické funkce: hrají např. důležitou roli v určování momentu vyřešení zánětu, neboť slouží jako důležité signální molekuly regulující buněčný růst, diferenciaci a apoptózu [6]. Avšak vysoké koncentrace ROS jsou škodlivé jak pro lokální, tak i vzdálené tkáně. ROS mohou být přítomny jak intracelulárně, tak i extracelulárně. Intracelulární ROS mají schopnost tvořit aktivní inflamasomy (skupina receptorových proteinů detekujících DAMPs a PAMPs a zajišťujících štěpení prekurzorů proinflamatorních proteinů) pro - IL-1beta a pro - IL-18/. Naopak extracelulárně působí např. peroxidázy obsažené v exozomech. Tyto po uvolnění do oběhu mohou poškodit plazmatické proteiny, vzdálené orgány i krevní buňky, mj. mohou být příčinou i předčasné smrti vyzrálých erytrocytů (eryptóza). K výsledné anémii pak ještě přispívá útlum produkce erytropoetinu v důsledku zánětu a předčasná destrukce mladých erytrocytů v tzv. neocytolýze [35, 38].
Mimo výše uvedené účinky aktivovaných neutrofilů dochází v důsledku působení uvolněných mikrovezikulí leukocytů k další podpoře leukocytární adheze a systémové zánětlivé odpovědi včetně aktivace koagulačního systému [16, 27].
Jako další imunokompetentní buňky fungují i vycestované monocyty, které se přeměňují na makrofágy, a to buď a) proinflamatorní fenotyp M1 nebo b) antiinflamatorní fenotyp M2. M1 makrofágy dále produkují ROS, zatímco typ M2 makrofágy působí v pozdější fázi – podporují hojení uvolněním růstových faktorů [25, 28].
Kromě včasné stimulace buněk přirozené i získané imunity dochází velmi brzy po traumatu i k aktivaci endotelových buněk jak primárně, tak i sekundárně uvolněnými cytokiny z neutrofilních leukocytů, které jsou prvními imunitními buňkami, které se translokují do tkání po stimulaci DAMPs. Endotelové buňky pak další sekrecí cytokinů zesilují imunitní reakci a stávají se jak spouštěčem, tak i cílovou tkání působících buněčných mediátorů. Uvolňují další mediátory jako vasokonstrikčně působící tromboxan A2, aktivují trombin a zapojují do komplexní reakce systém koagulační a kaskádu komplementu se vzájemnými vazbami. Tkáňový faktor uvolněný z poškozených buněk generuje trombin, který nejen aktivuje fibrinogen, ale i opět endotelové buňky. K aktivaci endotelu přispívají i uvolněné ROS. Ve svém důsledku dochází k přemrštění imunitní reakce a ztrátě kompartmentalizace zánětu. Výsledkem tzv. cytokinové bouře je alterace Na+-K+ATP - ázy s elektrofyziologickou membránovou dysfunkcí [15].
Při závažném traumatu, zvláště v přítomnosti hemoragického šoku či v případě nutnosti delší chirurgické intervence, dochází záhy v rozvoji jak traumatické koagulopatie, ale i tzv. endotelopatie a komplementopatie, souhrně nazývané „trauma - induced alteration to immune and inflamatory responses“ [5, 17]. K tomuto přispívá i efekt ischémie-reperfúze. Výsledkem je vystupňovaná imunitní, koagulační a ROS odpověď s mikroangiopatií a poruchou buněčných bariér, což může přispívat k další tvorbě a uvolnění DAMPs a ke vzniku circulus vitiosus. Klinickou manifestací této škodlivé imunitní reakce je infekce, sepse nebo MODS [40] (obr. 2).
2. Cesty vedoucí k tkáňovému a orgánovému poškození po traumatu. Cílovou tkání jsou endoteliální buňky. SIRS: systemic inflammatory response syndrome (syndrom systémové zánětlivé reakce; DAMPs: damage - associated molecular patterns (molekulární vzorce asociované s poškozením); PICS: persistent inflammation, immunosuppression and catabolism syndrom (syndrom perzistujícího zánětu, imunosuprese a katabolizmu). Podle J.M.Lord et al. Lancet 2014 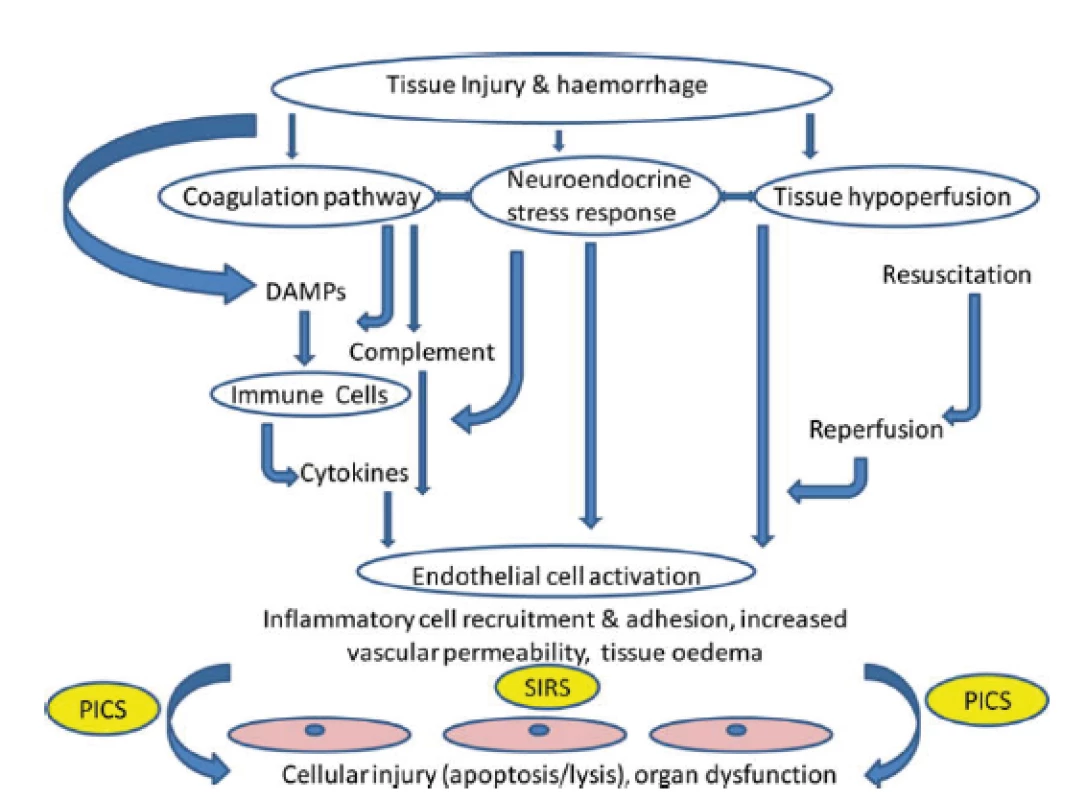
Mimo výše uvedených komplikací jsou kriticky nemocní po závažném traumatu ohrožení v delším časovém horizontu (14 dní a déle po úrazu) i tzv. PICS (persistent inflammation, immunosuppression and catabolism syndrom), který je spojován s pokračujícím katabolizmem a známkami vrozené i získané imunosuprese [12] (obr. 3). Dochází k redukované tvorbě cytokinů, ztrátě monocyto-makrofágové funkce, přetrvávajícímu vzestupu počtu MDSCs (myeloid-derived suppressor cells) a ke snížení počtu a oslabení funkce efektorových T-lymfocytů. Tento syndrom koreluje s horším hojením ran, infekcí, sarkopenií, delším zotavováním a zvýšenou mortalitou [12, 22].
3. Časová souvislost SIRS a CARS a možný rozvoj PICS. SIRS: systemic inflammatory response syndrome (syndrom systémové zánětlivé reakce); CARS: compensatory antiinflammatory response syndrome (syndrom kompenzatorní protizánětlivé reakce); PICS: persistent inflammation, immunosuppression, and catabolism syndrome (syndrom perzistujícího zánětu, imunosuprese a katabolismu); MODS: multiple organ dysfunction syndrome (syndrom multiogránové dysfunkce). Převzato z Gentile, L.F. et al. Persistent inflammation and immunosuppression: a common syndrome and new horizon for surgical intensive care. J. Trauma Acute Care Surg. 2012 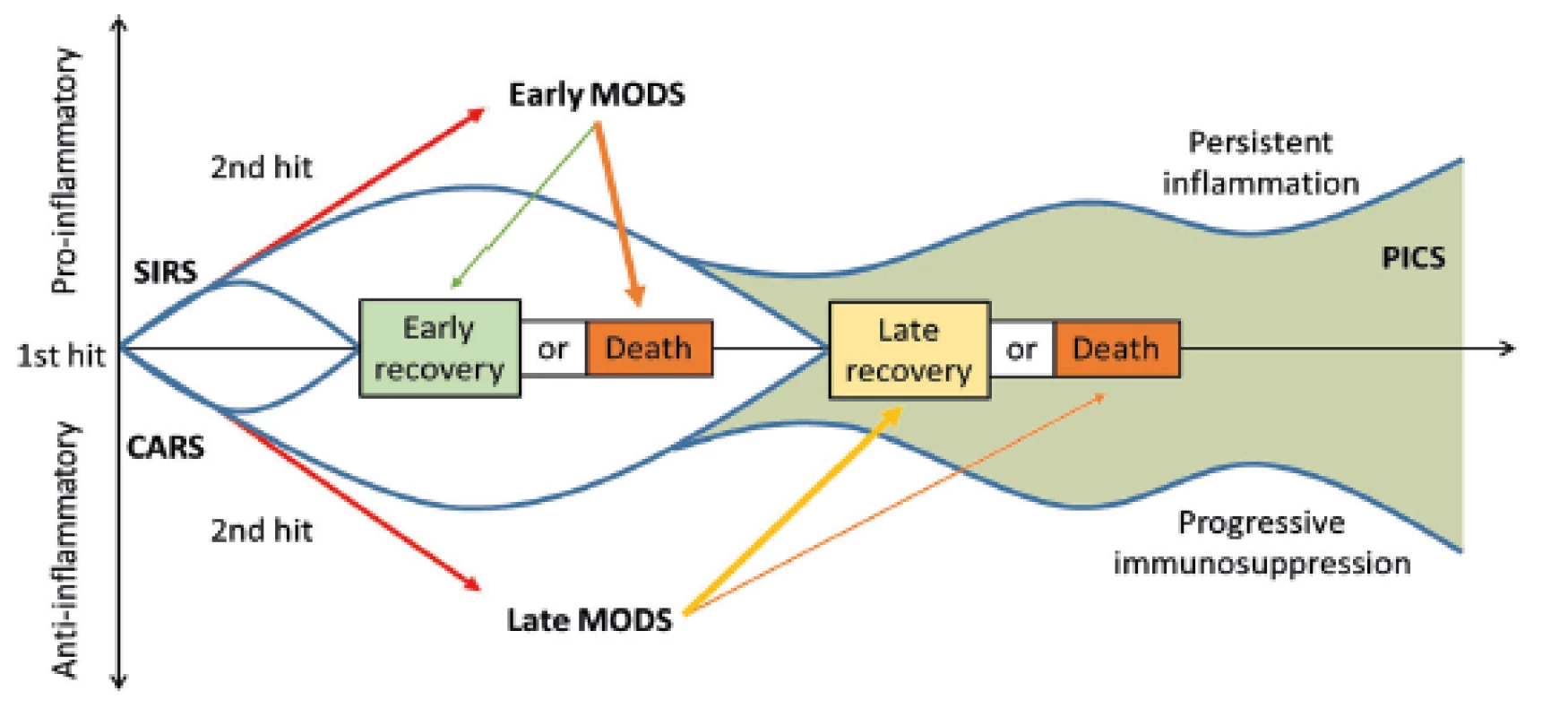
Proto schopnost organizmu nastavit rovnováhu pro a protizánětlivého stavu či naopak přetrvávající dysbalance těchto složitých imunitních pochodů může mít výrazný podíl na průběhu zotavení čí rozvoji komplikací léčby po traumatu.
Neuroendokrinní reakce
Aktivace sympatického nervového systému při těžkém traumatu je okamžitá, a to prostřednictvím stimulace postsynaptických vláken sympatických ganglií s uvolněním noradrenalinu, tak i stimulací pregangliových vláken sympatiku s uvolněním adrenalinu ve dřeni nadledvin. Rychlý efekt je realizován prostřednictvím alfa a beta receptorů s pozitivním efektem inotropním, chronotropním, vazodilatačním (mozek, srdce, kosterní sval), vasokonstrikčním (splachnikus, ledviny, kůže) a metabolickým. Ten spočívá v rychlé mobilizaci energetických rezerv s dostupností glukózy zvýšenou glykogenolýzou, zvýšenou sekrecí glukagonu, snížením sekrece inzulinu, stimulací lipolýzy, stimulací systému renin - angiotenzin - aldosteron a aktivaci hypotalamohypofyzární osy (HPA).
Naproti tomu aktivace parasympatického nervového systému má efekt antiinflamatorní. Aferentní vlákna vagového nervu vedou po stimulaci cytokiny i PAMPs do mozkového kmene a cestou eferentních vláken stimulují v celiakálním plexu splenická sympatická vlákna, která přes beta2 adrenergní receptor uvolňují acetylcholin z T lymfocytů, které obsahují funkční cholin acetyltransferázy. ACh reaguje s nikotinovými receptory (α7nAChRs) makrofágů, inhibuje NF kappa B a následně syntézu a uvolnění cytokinů vč. TNF alfa [13, 30].
Tato cholinergní protizánětlivá cesta se zdá být kriticky zapojena do kontroly systémového zánětu [27]. Zdrojem takto působícího acetylcholinu jsou nejenom nervová zakončení, ale také imunitní buňka [7]. Souhrnně tato regulační cesta byla nazvána „the cholinergic anti-inflammatory pathway“[19].
Osa hypotalalamus - hypofýza je rovněž stimulována stresem, bolestí, ale i přítomností uvolněných IL-1, IL-6, TNF alfa, kdy je iniciováno paraventrikulární jádro hypotalamu k sekreci CRH (corticotropin - releasing hormonu se stimulací hormonální sekrece adenohypofýzy - přes POMC) proopiomelanokortikotropin (k uvolnění ACTH) adrenokortikotropní hormon (s následnou sekrecí gluko a mineralokortikoidů). Mimo jiné stimuluje sekreci endorfinů a lipotropinů, sekreci STH (somatotropin), prolaktinu, TSH (thyreotropin), FSH (folikulostimulační hormon), LH (luteinizační hormon). Dále zajišťuje hypotalamus i přímou neuronální sekreci adiuretinu z neurohypofýzy.
Mezi hlavní stresové hormony patří kortizol, který je uvolňován po syntéze de novo kůrou nadledvin a jeho hladina pravděpodobně koreluje se stupněm zátěže organizmu. Nicméně mohou být přítomny i nízké hladiny kortizolu jako odraz relativně nedostatečné odpovědi organizmu na stres, nazývané „relativní nadledvinová nedostatečnost“. Rychlé zvýšení hladiny cirkulujícího kortizolu (již řádově v minutách po traumatu s vrcholem za 4–6 hod) má mnohočetné účinky. Metabolický efekt spočívá ve zvýšení glykémie, zvýšení inzulinové rezistence, proteolýze, lipolýze. Dalšími efekty jsou permisivní účinek katecholaminů se zvýšením inotropie, vazokonstrikce, protizánětlivý efekt zahrnuje involuci thymu, útlum buněčné imunity zprostředkovaný snížením funkce cytotoxických T-lymfocytů a NK-buněk, T-lymfocytární blastogenezi. Rovněž glukokortikoidy inhibují superoxidázovou aktivitu neutrofilů, suprimují chemotaxi a normalizují signální mechanizmus apoptózy, ale zachovávají fagocytární funkci neutrofilů [18, 36]. Vedou dále k omezení tvorby prostaglandinů a leukotrienů blokací fosfolipázy A2. Dále mají antialergické působení, kortizol rovněž zvyšuje kostní resorpci, snižuje vstřebávání kalcia ve střevě a při jeho přetrvávajících vysokých hladinách v krvi se může uplatňovat i efekt mineralokortikoidní.
Somatotropin kromě metabolického účinku s podporou glukoneogenze, antiinzulinovým a proteoanabolickým efektem ovlivňuje imunitu podporou tvorby protilátek, kolagenu, zvýšením syntézy IL-2, vznik NK buněk, makrofágů a cytotoxických T lymfocytů, stimuluje tvorbu erytropoetinu.
Prolaktin inhibuje příjem glukózy do buněk, má imunomodulační účinek stimulací T lymfocytů.
Testosteron celkový, testosteron volný a dihydrotestosteron klesají velmi záhy po traumatu jen s pozvolnou tendencí k úpravě. Deficit se projeví poruchou fyziologické funkce stimulace proteosyntézy.
Druhou významnou osou po HPA je systém renin-angiotenzin-aldosteron (RAAS). Je stimulován sympatikem, renální hypoperfúzí a sníženou koncentrací natria v macula densa. Renin konvertuje angiotenzinogen na angiotenzin I, ten je ACE (angiotenzin konvertující enzym) přeměněn na angiotenzin II s efektem na uvolnění aldosteronu ze zona glomerulosa nadledvin, dále stimulací hypotalamu ovlivňuje uvolnění ACTH a antidiuretického hormonu. Je velmi potentním vazokonstriktorem. Aldosteron zvyšuje reabsorpci natria v distální kličce ledvin s volumovým efektem.
Antidiuretický hormon je kromě angiotenzinu II uvolňován i působením adrenalinu, bolestí a hyperglykémií. Má především volumový efekt zvýšením zpětné rezorpce vody ve sběrném kanálku ledvin, ale má i endokrinní efekt, kdy přes CRH (kortikoliberin) stimuluje uvolnění POMC. Jeho hladina zůstává zvýšená až po dobu jednoho týdne od inzultu v závislosti na stupni poranění a době hemodynamické nestability. Jako potentní vasokonstriktor splachnického řečiště může přispívat ke vzniku ischémie střevní a dysfunkci bariérové funkce střeva [4].
Během reakce organizmu na trauma (ale i hemoragický šok, ischemii, hypoxii) oba systémy neuroendokrinní i imunitní „komunikují“. Sdílejí stejné informační molekuly (hormony, neurotransmitery, neuropeptidy, cytokiny a jejich receptory).
Je popisována přímá neuro-imunitní komunikace mezi hormony (CRH, ATH, prolaktin, TRH, vazopresin) a produkcí a aktivací lymfocytů [3, 18, 32, 33]. Nejen vlivem uvolněných lymfokinů, ale i samotné lymfocyty jsou schopné syntetizovat neuroendokrinní peptidy, jako ACTH, gama-endorphin-related substances, imunoreaktivní růstový hormon a thyreotropin. Tyto peptidy pak mohou modulovat odpovědi lymfocytů a jiných imunokompetentních buněk jako regulování počtu nových B lymfocytů produkovaných v kostní dřeni [24]. Existují důkazy o produkci opoidních peptidů, noradarenalinu a adrenalinu jak lymfocyty, tak i makrofágy [11].
Díky četným zpětným vazbám mezi neuroendokrinním a imunitním systémem, označovaným jako šestý smyl, ovlivňují tyto vazby funkci řady orgánů. Mezi klinicky nejrychleji odpovídající orgány patří mozek s rozvojem delirantního stavu. Na tom, zda se podaří obnovit rovnováhu pro a protizánětlivých dějů s ohledem na závažnost traumatu, záleží, jestli dojde k regeneraci tkání nebo naopak k rozvoji MODS (multiple organ dysfunction syndrome).
Metabolická reakce
Metabolická odpověď na stres je součástí adaptivní reakce ve snaze přežít trauma. Díky aktivovaným náhradním metabolickým drahám, zvláště produkci katabolických hormonů a inzulinové anabolické periferní rezistenci, je získávána energie z alternativních zdrojů. Daň za přežití zaplatí organizmus především ztrátou svaloviny.
Již ve čtyřicátých letech minulého stolení dr. Guthbertson představil hlavní fáze průběhu šokového stavu. Jsou to: ebb (odlivová) fáze - časný šok s útlumem metabolismu, dále následuje flow (přílivová) fáze neboli fáze katabolismu a na ni navazuje po různě dlouhé době fáze rekonvalescence a anabolismu [39].
V ebb fázi trvající 24–48 hod po insultu dochází následkem působení cytokinů, eikosanoidů, ROS a dalších lokálních mediátorů k potlačení metabolické aktivity, je snížena spotřeba kyslíku, snížen srdeční výdej, zvýšená periferní vazokonstrikce. V reakci na vyplavené katecholaminy a hormony dochází k rozvoji inzulínové rezistence, zvýšení glykémie, aktivaci lipolýzy. Vlivem přetrvávající hypoxie se rozvíjí metabolická acidóza s poruchou endotelu, zhoršeným transportem O2 k buňkám tkání, hromaděním metabolitů s možným energetickým selháním buněk [35].
Ve flow fázi je dominující hyperkinetická cirkulace se zvýšeným prokrvením jater, ledvin i poraněných oblastí, zvýšenou spotřebou O2, energetických substrátů, zvyšuje se periferní utilizace glukózy, stoupá glukoneogeneze, která je první metabolickou změnou po traumatu. Rovněž se zvýšeně mobilizují mastné kyseliny. Velká část vystupňované energetické poptávky je proporcionální k závažnosti traumatu a uplatní se na vrub kompenzace poškozených membránových potenciálů působením cytotoxinů a endotoxinů. Předpokládá se, že až 40 energetické potřeby se použije na pokrytí energie iontových pump a transportních procesů [28].
Dominantní je v hypermetabolické fázi výrazný svalový katabolizmus. Uvolněné aminokyseliny slouží jednak jako zdroj pro glukoneogenezu, jednak k syntéze proteinů akutní fáze. Glukoneogeneze je vitálně důležitá jako energetický zdroj glukosy pro neurony, leukocyty, makrofágy a buňky kompromitovaných tkání - hypoxické, zánětlivé a hojící se oblasti, kde není možná mitochondriální respirace. Zdrojem jsou nejen aminokyseliny, ale i laktát (Corriho cyklus) a glycerol. Zásoby glykogenu jsou spotřebovány v krátkém časovém intervalu. Působením hormonsenzitivní lipázy se uvolňují do oběhu mastné kyseliny (MK) a glycerol. MK mohou být reesterifikovány na triglyceridy, a to při jejich částečné oxidaci v játrech, což může mít za následek tukovou infiltraci jater, zvláště v přítomnosti vyšší dávky kontinuálně podávané glukózy (limit u dospělých 4mg/kg/min) nebo u pacientů s diabetem, obézních a septických nemocných [34].
Závěr
Komplexní akutní odezva organizmu na trauma je reakcí s primárním cílem zachování homeostázy a ačkoliv je nastavena jako protektivní, její vystupňování či nadměrná délka trvání včetně přidružených komplikací může být pro postiženého fatální.
Znalosti a pochopení provázanosti výše uvedených integračních mechanizmů a případné možnosti jejich terapeutického ovlivnění jsou nadále předmětem dalších výzkumů a ve svém důsledku dávají naději na další snížení morbidity a mortality nemocných po závažném poranění. V tomto pohledu se otevírá možnost mapování genomové a metabolomové odpovědi jako součásti komplexní odezvy organizmu na trauma.
MUDr. Renáta Ječmínková
Sources
- Beghard, F., Hubert-Lang, M. Polytrauma – pathophysiology and management principles. Langenbecks Arch Surg. 2008, 393, 825–831. ISSN 1435-2451
- Billiar, TR, Vodovitz, Y. Time for trauma imunology. PLoS Med. 2017, 14, e 1002342. ISSN 1544-9173
- Brian, S., Zuckerbraun et al. Shock. In: Schwartz´s principles of surgery. New York: McGraw-Hill Medical, 2015, 109–134. ISBN 978-0-07-180092-1
- Brunicardi, FC. Schwartz´s Principles of Surgery. 10th ed. New York: McGraw-Hill Medical, 2015. 2069 p. ISBN 978-0-07-180092-1
- Burk, AM. et al. Early complementopathy after multiple injuries in humans. Shock. 2012, 37, 348–354. ISSN 1073-2322
- Ceki, C., Linden, J. Purinergic regulation of the immune system. Nat Rev Immunol. 2016, 16, 177–192. ISSN 1474-1776
- Dash, PK et al. Activation of alpha7 cholinergic nicotinic receptors reduce blood-brain barrier permeability following experimental traumatic brain injury. J Neurosci. 2016, 36, 2809–2818. ISSN 0270-6474
- Davis, GE., Bayless, KJ., Davis, M. et al. Regulation of tissue response by the exposure of matricryptic sites within extracellular matrix molecules. Am J Pathol. 2000, 156, 1489–1498 ISSN 1432-0533
- DINARELLO, CA. Interleukin I and the pathogenesis of the acute phase response. N Engl J Med. 1984, 311, 1413–1418. ISSN 1310-1314
- BAUMANN, H., GAULDIE, JH. The acute phase response. Immunol Today. 1994, 15, 74–80. ISSN 0167-5699
- DOLEČEK, R. et al. Endokrinologie traumatu. Praha : Maxdorf, 2016. 215 s. ISBN 978-80-7345-484-5
- Engler, KL, Rudd, ML, Ryan, JJ. et al. Autocrine actions of macrophage-derived catecholamines on interleukin 1 beta. J Neuroimmunol. 2005, 160, 87–91. ISSN 0165-5728
- Frith, D. et al. Definition and drivers of acute traumatic coagulopathy: clinical and experimental investigation. J Tromb Haemost. 2010, 8, 1919–1925. ISSN 1212-0383
- Gentile, LF. et al. Persistent inflammation and immunosuppression: a common syndrome and new horizon for surgical intensive care. J Trauma Acute Care Surg. 2012, 72, 1491–1501. ISSN 2163-0755
- Gnater, MT. et al. Role of the alternative pathway in the early complement activation following major trauma. Shock. 2007, 28, 29–34. ISSN 1073-2322
- Griffiths, H., Gao, D., Pararasa, C. Redox regulation in metabolic programming and inflammation. Redox Biology. 2017, 12, 50–57 ISSN 2213-2317.
- Hayden, S., Albert, T., Watkins, T. et al. Anemia in critical illness. American Journal o Respiratory and Critical Care Medicine. 2012, 185,1049–1057. ISSN 1073-449X
- Chen, W. et al. Cytokine cascades induced by mechanical trauma injury alter voltage-gated sodium channel activity in intact cortical neurons. J Neuroinflammation. 2017, 14, 73. ISSN 1742-2094
- Igors, I., Maris, M., Viesturs, B. Stress response to surgery and possible ways of its correction, Proc Latvian Acad Sci. 2012, sekce B, 66. ISSN1407-009X
- Kawashima, F. 2004, Expression of non-neuronal acetylcholine in lympfocytes and its contribution to the regulativ of immune function. Front Biosci. 2009, 9, 908–910. ISSN 1093-9946
- Lord, AB, Martin, M., Flierl, MA. Early complementopathy after multiple injurie in humans. Shock. 2012, 37, 348–354. ISSN1073-2322
- Lord, JM. et al. The systemic immune response to trauma: an overview of pathophysiology and treatment. Lancet. 2014, 384, 1455–1465. ISSN 0140-6736
- Lung, MH., Kambria, JD., Ward, PA. Innate immune responses to trauma. Nat Imunol. 2018, 19, 327-341. ISSN 1529-2908
- MHuber, L., Kovkun, A., Ignatius, A. The role of complement in trauma and fracture healing. Semin Immunol. 2013, 25, 73–78. ISSN 1044-5323
- Maren, S., Fragala, W., Kraemer, J. et al. Neuroendocrine-Immune Interactions and Responses to Exercise. Sports Med. 2011, 41, 8, 621–639. ISSN 1044-5323
- Matijevic, N. et al. Microvesicle phenotypes are asssociated with transfusion requirements and mortality in subjects with severe injuries. J Extracell. 2015, 4, 29338. ISSN 2001-3078
- MDNeher, M., Weckbach, S., Flierl, MA. et al. Molecular mechanism of inflammation and tissue injury after major trauma-is complement the „bad guy“? Journal of Biomedical Science. 2011, 18, 90. ISSN 1423-0127
- Mitchell, TA. et al. Traumatic hemothorax blood contains elevated levels of microparticles that are prothrombotic but inhibic platelet aggregation. Shock. 2017, 47, 680–687. ISSN 1073-2322
- Mittal, M., Siddiqui, M., Tran, K. et al. Reactive oxygen species in inflammation and tissue injury. Antioxidants and Redox Signaling. 2014, 20, 1126–1167. ISSN 1523-0864
- Netea, MG. et al. A guiding map for inflammation. Nat Immunol. 2017, 18, 826–831. ISSN 1529-2908
- Pavlov, VA., Tracey, KJ. Neural regulation of immunity: molecular mechanisms and clinical translation. Nat Neurosci. 2017, 20, 156–166. ISSN 1097-6256
- Qiang, X. et al.Cold inducible RNA-binding protein (CIRP) triggers inflammatory response in hemorrhagic shock and sepsis. Nat Med. 2013, 19, 1489–1495. ISSN 1078-8956
- Siobhan, A. Corbett, SL. Systemic Response to Injury and Metabolit Support. In: Schwartz´s principles of surgery. New York: McGraw-Hill Medical, 2015, s. 13–63. ISBN 978-0-07-180092-1
- Smith, EM. Neuropeptides as signal molecules in common with leucocytes and the hypothalamic-pituitary-adrenal axis. Brain Nebav Immun. 2008, 22, 3–14. ISSN 0889-1591
- Sobotka, L., Soeters, PB. Metabolic response to injury and sepsis. In: Basics in clinical nutrition. Praha: Galén, 2011, s. 197–202. ISBN 978-80-7262-821-6
- Tafani, M., L.Sansone, F. Limana, T. et al. The interplay of reactive oxygen species, hypoxia, inflammation and sirtuins in cancer initiations and progression. Oxidative Medicíne and Cellular Longevity. 2016, 20, 1–18. ISSN 1942-0994
- Tracey, KJ. Physiology and immunology of the cholinergic anti-inflammatory pathway. J Cli Invest. 2007, 117, 289–296. ISSN 0021-9738
- Trebichavský, I. Vznik a ukončení zánětu. Živa. 2017, 65, 2–4. ISSN 0044-4812
- Walsh, TS, Saleh, EE. Anaemia during critical illness. Br J Anaesth. 2006, 97, 278–279. ISSN 0007-0912
- ZADÁK, Z. Výživa v intenzivní péči. Praha : Grada Publishing a.s., 2008. 544 s. ISBN 978-80-247-2844-5
- Zhang, Q. et al. Circulating mitochondrial DAMPs cause inflammatory response to injury. Nature. 2010, 464, 104–107. ISSN 1476-4687
- Zhao, H., Kilgas, S., Alarm, A. et al. The role of extracellular adenosine triphosphate in ischemic organ injury. Crit Care Med. 2016, 44, 1000–1012. ISSN 1530-0293
Labels
Surgery Traumatology Trauma surgery
Article was published inTrauma Surgery
2018 Issue 2-
All articles in this issue
- Kelly MJ., Holton AE., Cassar-Gheiti AJ., Hanna SA., Quinlan JF., Molony DC.: The aetiology of posterior glenohumeral dislocation and occurrence of associated injuries. A systematic review.
- Addressing of trochanteric femoral fractures using a revision femoral stem with a cervicocapital prosthesis – coxofemoral by-pass
- Abdominal trauma and wandering spleen - case report
- Complex Response of the Organism to Trauma
- Results of Achilles tendon rupture repair. Classical open approach versus percutaneous suture
- Trauma Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Results of Achilles tendon rupture repair. Classical open approach versus percutaneous suture
- Complex Response of the Organism to Trauma
- Addressing of trochanteric femoral fractures using a revision femoral stem with a cervicocapital prosthesis – coxofemoral by-pass
- Abdominal trauma and wandering spleen - case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

