-
Medical journals
- Career
Experimentální léčba diafyzárního kostního defektu využitím biodegradabilních materiálů a spongioplastiky a jejich srovnání
: Jan Škvařil; Ladislav Plánka; Robert Srnec; Pavel Proks; Alois Nečas; Petr Gál
: Klinika chorob psů a koček, Oddělení chirurgie a ortopedie ; Veterinární a Farmaceutická Univerzita Brno, Fakulta Veterinárního lékařství ; Klinika dětské chirurgie, ortopedie a traumatologie, Fakultní nemocnice Brno
: Úraz chir. 21., 2013, č.1
CÍL:
Kostní defekty jsou problematikou zejména traumatologie, ortopedie a onkologie. Tradiční metodou léčby je autospongioplastika, v popředí zájmu je dnes použití resorbovatelných materiálů s osteoindukčními vlastnostmi (trikalciumfosfát - ChronOS). Cílem předkládané studie je ověření použití samotného trikalciumfosfátu v léčbě velkého diafyzárního defektu na modelu miniaturního prasete. Pozitivní výsledek by mohl omezit nutnost provádění spongioplastiky a zjednodušit celý proces léčby. Získané výsledky budou také sloužit jako technologická východiska pro studium možnosti náhrady kostních defektů mezenchymovými kmenovými buňkami.MATERIÁL A METODIKA:
Experimentální skupinu tvořilo 25 miniaturních prasat z certifikovaného chovu Ústavu živočišné fyziologie a genetiky Akademie věd. U 12 prasat byl použit k náhradě defektu Trikaciumfosfát a u 13 prasat autogenní spongiózní štěp. Do vytvořeného diafyzárního defektu byl vložen Trikalciufosfát či autoštěp a zafixován. V obou skupinách byla fixace provedena LCP dlahou a intramedulárně Kirschnerovým drátem. Po zhojení byla tato oblast histologicky zpracována a hodnocena stran tvorby nové kostní tkáně a přihojení k původní kosti v místě okrajů defektu.VÝSLEDKY:
Z výsledků vyplývá, že ve skupině s po-užitím autoštěpů došlu k výraznější novotvorbě zralé kostní tkáně. Při hodnocení okrajů defektu stran přihojení k původní kosti byly výsledky u skupiny s autoštěpem výrazně lepší.ZÁVĚR:
Očekávané osteoindukční vlastnosti samotného trikalciumfosfátu se u rozsáhlého defektu diafýzy stehenní kosti v provedeném experimentu nepotvrdily. Náhradu autospongioplastiky jinou neinvazivní metodou v léčbě velkých kostních defektů je třeba nadále experimentálně hledat. Východiskem může být použitá operační metodika a využití vhodného biologického nosiče poskytujícího mechanickou oporu v kombinaci s trikalciumfosfátem nebo mezenchymovými kmenovými buňkami.Klíčová slova:
kostní defekt, trikalciumfosfát, autospongioplastika.ÚVOD
Kostní defekty jsou problematikou zejména traumatologie, ortopedie a onkologie. Vznikají porušením integrity kosti samotným úrazem, iatrogenně nebo v patologicky změněném terénu. V závislosti na velikosti defektu, stavu kostní tkáně a etiologii poranění je defekt schopen spontánního zhojení nebo je potřeba zvolit adekvátní náhradu. Tradiční metodou léčby je autospongioplastika, v popředí zájmu je dnes použití resorbovatelných materiálů s osteoindukčními vlastnostmi (trikalciumfosfát - ChronOS) [3,4]. Osteoinduktivita materiálu stimuluje diferenciaci mezenchymálních buněk na buňky kostní a indukuje tak novotvorbu kompletní kostní tkáně. Ve stadiu experimentu je i použití kostních růstových faktorů či studium kmenových buněk. V případě velkého defektu zůstává metodou volby přenos kostního štěpu s cévní stopkou.
Dosavadní klinické zkušenosti s náhradou kostních defektů biodegradabilními materiály se týkají spíše řešení malých defektů (juvenilní kostní cysty, drobné resekce pro kostní tumor). Zde bylo možné využít dokonce perkutánní aplikaci trikalciumfosfátu, což mělo dobrý funkční i kosmetický efekt. V případě větších kostních defektů bylo testováno použití biodegradabilního materiálu pouze v kombinaci se spongioplastikou. Cílem předkládané studie je ověření použití samotného trikalciumfosfátu v léčbě velkého diafyzárního defektu na modelu miniaturního prasete. Pozitivní výsledek by mohl omezit nutnost provádění spongioplastiky a zjednodušit celý proces léčby.
Získané výsledky budou také sloužit jako technologická východiska pro studium možnosti náhrady kostních defektů mezenchymovými kmenovými buňkami.
Cílem naší studie bylo vytvořit vhodnou metodiku pro experimentální a ke spongioplastice alternativní řešení náhrad kostních defektů. Rovněž bylo cílem ověřit, zda po 4. měsících hojení lze očekávat srovnatelné stadium hojení kostního defektu u zvířat léčených autospongioplastikou a trikalciumfosfátem.
Stanovené cíle:
- Vypracovat metodiku pro experimentální náhradu a léčbu rozsáhlého kostního defektu
- Porovnat stadium hojení kostního defektu ve 4. měsíci ve skupinách léčených trikalciumfosfátem v porovnání s kontrolní skupinou léčenou spongioplastikou
MATERIÁL A METODIKA
Experimentální skupinu tvořilo 25 miniaturních prasat z certifikovaného chovu Ústavu živočišné fyziologie a genetiky Akademie věd (Liběchov, Česká republika). Stáří prasat v době operace bylo v rozmezí 4 – 8 měsíců, hmotnosti v intervalu 20,86±6 kg. Pro provedení experimentu byla vybrána oblast diafýzy femuru, která je vzhledem k délce a mohutnosti ideální pro tvorbu defektu, přičemž operována byla vždy levá zadní končetina. Experimentální zvířata byla rozdělena do dvou skupin. Skupinu A tvořilo 12 prasat, u nichž byl vytvořený defekt léčený aplikací trikalciumfosfátu. Skupinu B tvořilo 13 prasat, u nichž byl vytvořený defekt léčený autospongioplastikou z L humeru. U obou skupin byla použita stejná osteosyntéza. Obě skupiny byly následně podrobeny histologické analýze (tab. 1, 2):
Skupina A (13 vzorků) - skupina s použitím autogenního spongiózního štěpu k náhradě defektu, zafixováno úhlově stabilní pětiděrovou LCP dlahou a intramedulárním Kirschnerovým drátem o průměru 3.0 mm.
Skupina B (12 vzorků) - skupina s použitím trikalciumfosfátu k náhradě defektu, zafixováno LCP a intramedulárním Kirschnerovým drátem.
1. Histologické hodnocení novotvořené tkáně kostního defektu 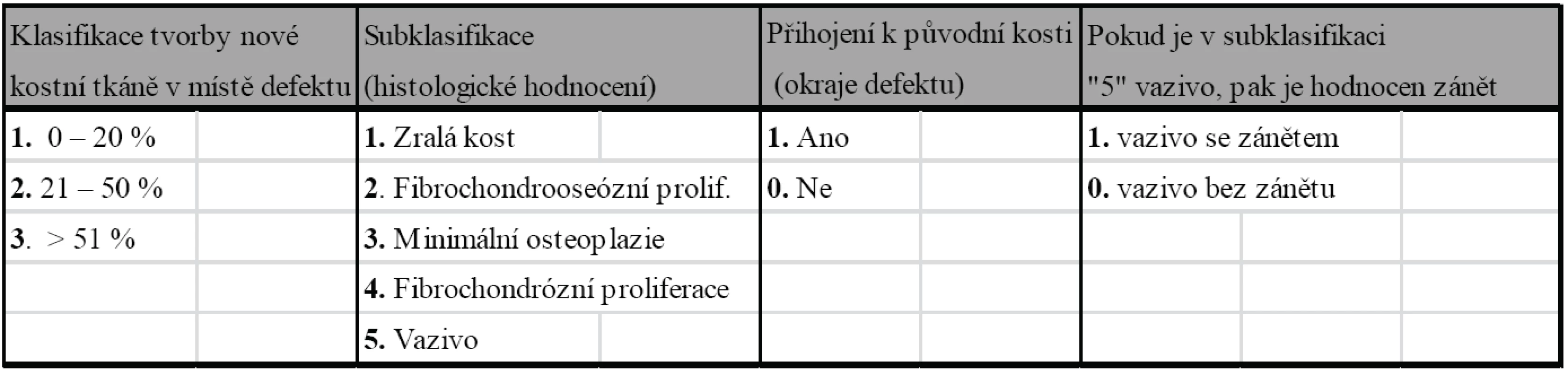
2. Výsledky histologického hodnocení u jednotlivých experimentálních skupin 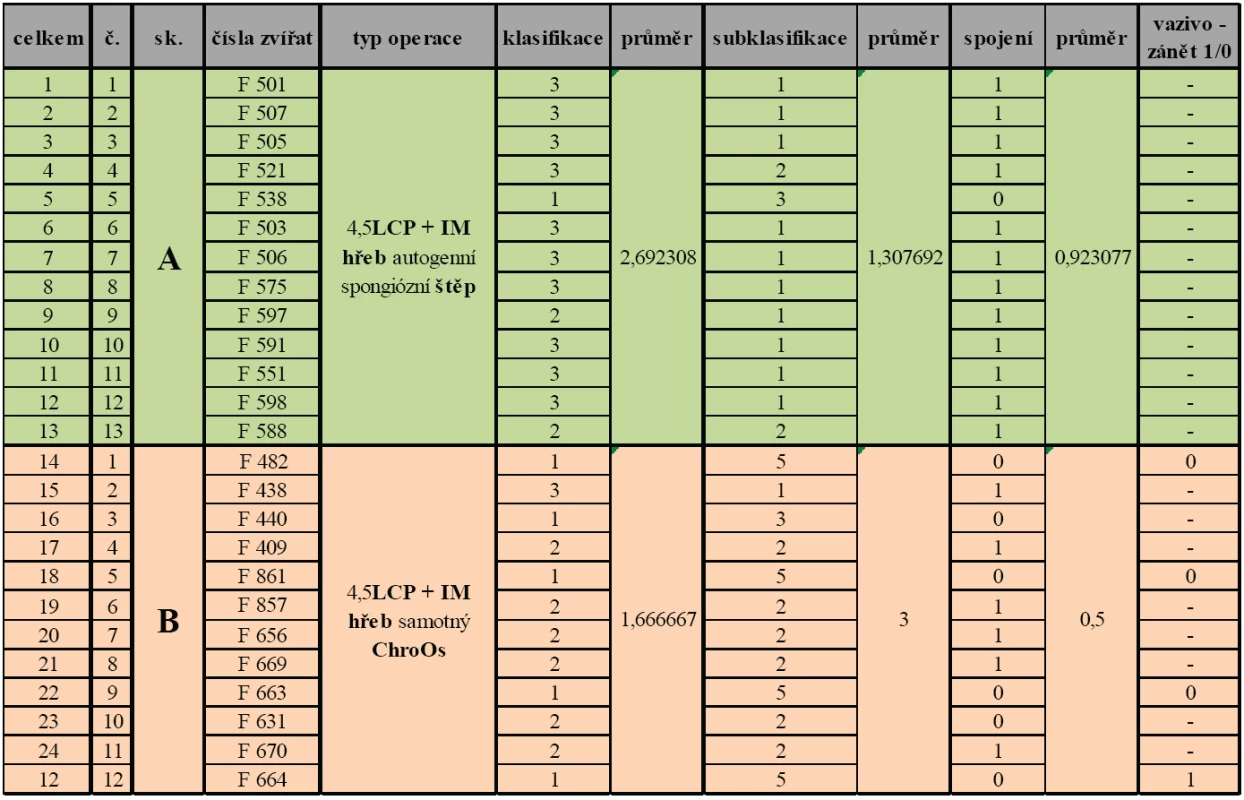
Anestézie u prasat - pro omezení perioperačních a pooperačních komplikací, zejména jako prevence aspirace zvratků, byla zvířatům těsně před operací odejmuta voda a 12 hodin před výkonem odejmuta strava. Obecně platí, že vzhledem k rychlé pasáži potravy trávicím traktem prasat je zcela dostačující hladovka 6−8 hodin, příjem tekutin může být neomezený až do začátku anestézie. Delší hladovka se nedoporučuje z důvodu sklonu prasat k hypoglykémii. Poté byla intramuskulární aplikací Tiletamin-Zolazepamu (2 mg/kg, Zoletil 100, Virbac, Francie), Xylazinu (2 mg/kg, Sedazine, Fort Dod-ge, USA) a Ketaminu (2 mg/kg, Ketaset, Fort Dodge, USA) navozena sedace. Po jejím nástupu, byla následně zavedena do ušní žíly intravenózní kanyla s Propofolem (1 mg/kg, Propofol 1%, Fresenius, Rakousko) a zaveden endotracheální tubus. Prase bylo uloženo do polohy na pravém boku a napojeno na anesteziologický inhalační přístroj. Zvířatům byla po celou dobu výkonu podávána směs kyslíku a rajského plynu (1 : 1) v dávkování 25 ml/kg/min. Všem zvířatům byly monitorovány životní funkce a byla sledována srdeční frekvence, dechová frekvence, střední arteriální tlak, saturace SpO2 a koncentrace CO2 na konci výdechu. Srdeční frekvence byla měřena za pomoci 3svodového EKG s elektrodami umístěnými na hrudníku zvířete a střední arteriální tlak byl měřen pomocí jednorázového snímače krevního tlaku. Dechová frekvence a ETCO2 byly zjišťovány sidestreamovou metodou se senzorem umístěným na kraji endotracheální trubice a SpO2 bylo měřeno pomocí senzoru umístěného na jazyku zvířete.
Operační výkon - miniaturní prase bylo po uvedení do anestézie zbaveno srsti v oblasti zadního levého stehna, poté byla provedena opakovaná toaleta kůže mýdlovou vodou a roztokem jodu. Konečná dezinfekce operačního pole byla provedena Chlorhexidinem (Gaba GmbH) a prase bylo uloženo do polohy na pravém boku. K diafýze stehenní kosti bylo proniknuto laterálním řezem. Po odklopení svalového aparátu v adek-vátní délce byla ke kosti nejdříve fixována pětiděrová LCP. Dlaha je koncipována tak, aby byl omezen její kontakt s kostí a tak napomáhá k zachování krevního zásobení periostu. Délka šroubů v dlaze byla volena vždy vzhledem k šířce femuru. Po zafixování dvěma šrouby nad a dvěma šrouby pod místem budoucího defektu byla LCP odstraněna, následně osteostomií oscilační pilou vytnuta část diafýzy femuru v celé šířce kosti a v délce 1,5 cm a opět byly fragmenty ve stejné poloze fixovány LCP. V obou skupinách byl zaváděn intramedulárně silný drát (Kirschnerův drát 3.0 mm, Medin, Česká republika) vždy z defektu nejprve do distálního fragmentu femuru, dále pomocí vrtačky vyveden přes kortikalis distální epifýzy femuru, dokud neperforoval kůži. Následně byl drát vrtačkou zaveden zpět retrográdně přes vloženou náhradu defektu do dřeňové dutiny proximálního fragmentu femuru a takto byl štěp odebraný z tuberculum majus humeri l. sin nebo trikalciumfosfát zafixován do místa vytvořeného defektu.
1. Femorální defekt s náhradou autospongioplastikou (fixace LCP dlaha a Kirschnerův drát) 
2. Femorální defekt s náhradou Trikalciumfosfátem (fixace LCP dlaha a Kirschnerův drát) 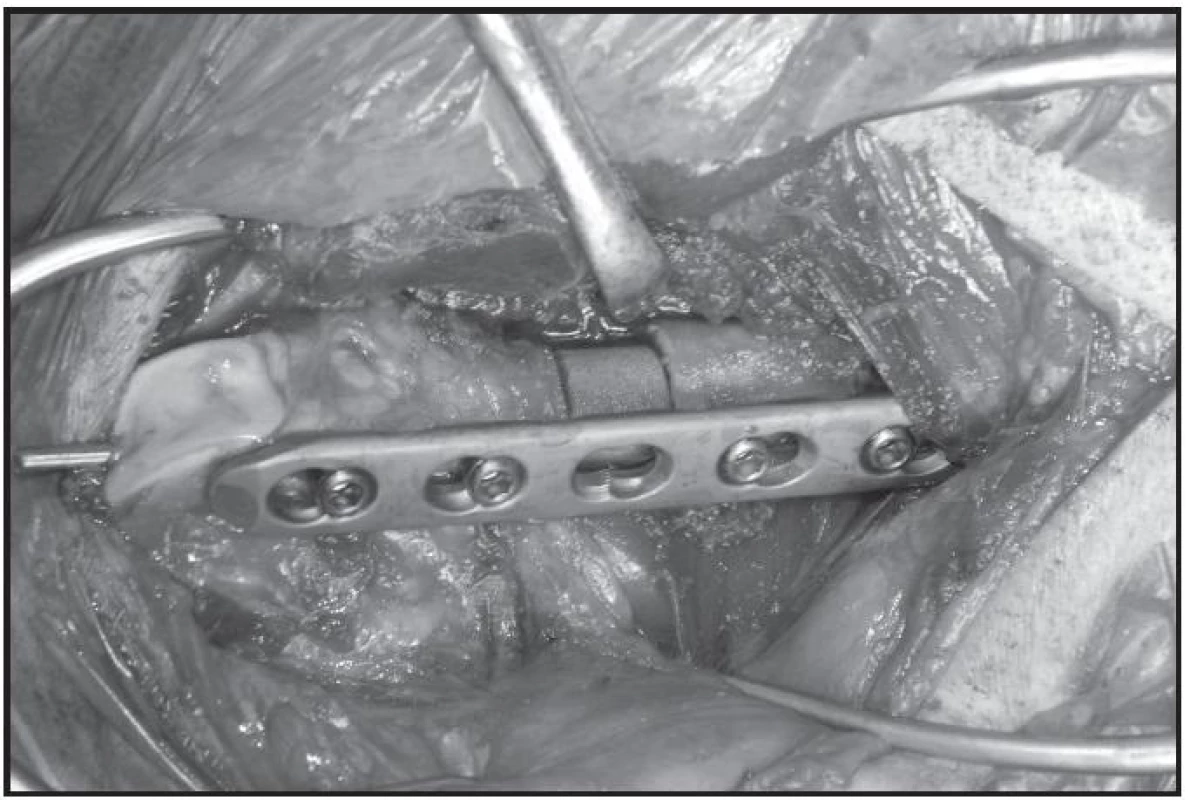
V celém experimentu byla používána bateriová vrtačka (Colibri system, SYNTHES, USA). Po zafixování fragmentů a náhrady defektu byla proveden sutura fascie a podkožní vrstvy. Použit byl pokračovací steh (PDS 3/0, Ethicon), sutura kůže byla provedena jednotlivými stehy (3/0 ETHILON, Ethicon).
Po skončení zákroku byla provedena antagonizace všech tří složek anestézie intramuskulární aplikací Naloxonu (0,03 mg/kg (INTRENON inj., Léčiva a.s.), Flumazenilu (0,1 mg/kg (ANEXATE, Hoffmann-La Roche Ltd.) a Atipamezolu (1,0 mg/kg (ANTISEDAN inj.ad us. vet., Pfizer Animal Health). K analgezii v pooperačním období byl použit Carprofen (RIMADYL inj. ad us. vet., Pfizer Animal Health) v dávce 2 mg/kg/den po dobu 3 dnů. Po zotavení bylo zvířatům umožněno volně se pohybovat a zatěžovat končetiny dle jejich možností.
V průběhu sledovaného období byla zvířata krmena, ustájena a bylo s nimi zacházeno v souladu s vyžadovanými zásadami [7]. Všechna zvířata byla sledována celkem 16 týdnů, každý týden bylo zaznamenáno event. napadání na zadní končetinu. Na konci experimentu (4 měsíce po zákroku) byla všechna zvířata protokolárně utracena. Nejprve byla navozena celková anestezie intravenózním podáním thiopentalu v dávce 20 mg/kg. Poté byl intravenózně aplikován přípravek T 61 inj. ad us. vet. (Hoechst Roussel Vet.) obsahující 20% embutramid, 5% mebezoniumjodid, 0,5% tetrakain hydrochlorid a dimetylformamid. Byly vypreparovány stehenní kosti, provedena fotodokumentace zhojených kostních defektů, RTG a CT dokumentace, měření kortexu, extrakce osteosyntetických materiálů a diafýza se zhojeným defektem (s 3cm lemem do zdravé kosti) byla po odříznutí od epifýz určena k dalšímu zpracování.
Veškeré postupy byly prováděny se souhlasem Etické komise (č. 46613/2003–1020).
3. Vyjmutý femur s vyříznutím původního defektu s 3cm lemem do zdravé kosti 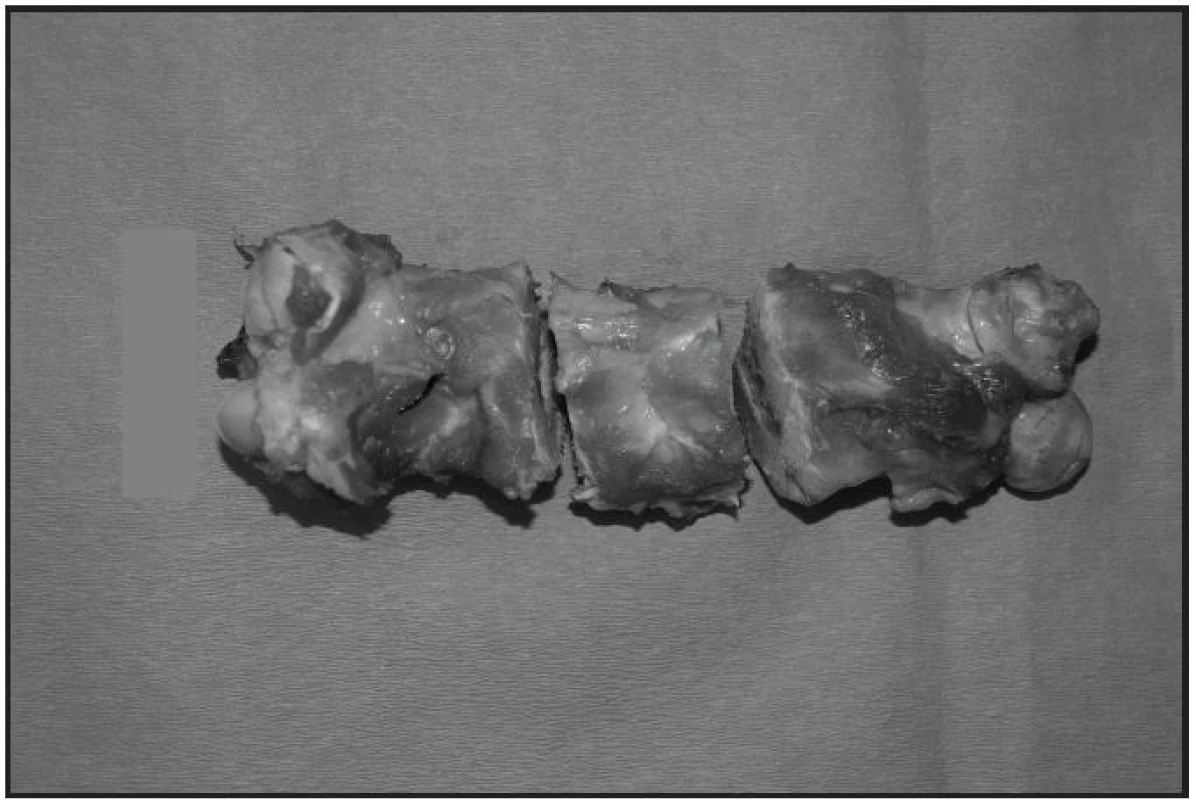
Histologické vyšetření - po utracení miniaturních prasat byly resekáty z oblasti diafýzy femuru přeneseny do roztoku 10% formalínu a dále fixovány. Fixované preparáty byly dále histologicky zpracovány v Ústavu patologie FN Brno. Po skončení fixace byly resekáty přeneseny do dekalcifikačního média a v něm ponechány k odvápnění 8-11 dní. Následovalo řezání preparátu skalpelem a dalším zpracováním byly připraveny bloky z centra a z periferie zhojeného defektu. Následovalo barvení a pozorování mikroskopem. Základním barvením byl hematoxilin-eosin pro přehled tkání v celém preparátu.
V každé skupině bylo hodnoceno procentuální množství nově vytvořené kostní tkáně v místě defektu, stanovena histologická vyzrálost nové tkáně a přihojení k původní kosti v místě okrajů defektu (tab. 2). V případě, že byla histologicky označena novotvořená tkáň jako vazivo, bylo navíc sledováno, jestli je přítomen zánět. Tato skutečnost byla hodnocena jako negativní nález zhoršující výsledek hojení. Všechny tyto čtyři parametry byly podrobeny statistické analýze v rámci vzájemného srovnání obou experimentálních skupin. Očekávalo se, že lepší výsledek stran množství novotvořené kostní tkáně, histologického hodnocení stupně zralosti a kvality připojení k okolí defektu bude ve skupině s použitím trikalciumfosfátu, tedy ve skupině B, a horší výsledek ve skupině s použitou autospongioplastikou, tedy ve skupině A. Jako statistická metoda byl zvolen binomický test (jednovzorkový podílový test), Fisherův přímý exaktní test a Mann-Whitney pořadový U test.
VÝSLEDKY
Ve skupině A s použitím autogenního spongiózního štěpu k náhradě defektu a fixací LCP dlahou a intramedulárním Kirschnerovým drátem je v 10 případech z 13 (77 %) zastoupena novotvořená kostní tkáň ve více než 51% defektu. Ve 2 případech z 13 (15 %) byla novotvořená kostní tkáň zastoupena v rozmezí 21 - 50 % defektu a pouze v 1 případu (8 %) zastoupena v rozmezí 0 - 20 %defektu. V 10 případech (77 %) je tkáň histologicky hodnocena jako kost, ve 2 případech (15 %) jako fibrochondrooseózní proliferace a pouze v 1 případu z 13 (8 %) jako minimální osteoplázie. Stran hodnocení okrajů defektu bylo u 12 případů (92 %) přihojení hodnoceno jako dobré a pouze v 1 případu (8 %) jako špatné nebo žádné (tab. 2).
Ve skupině B s použitím Trikalciumfosfátu k náhradě defektu a fixací LCP dlahou a intramedulárním Kirschnerovým drátem je pouze v 1 případu z 12 (8 %) zastoupena novotvořená kostní tkáň ve více než 51% defektu. V 6 případech z 12 (50 %) je zastoupena novotvořená kostní tkán v rozmezí 21 - 50 % defektu a v 5 případech (42 %) zastoupena v rozmezí 0 - 20 % defektu. Pouze v 1 případu z 12 (8 %) je tkáň histologicky hodnocena jako kost. V 6 případech z 12 (50 %) je tkáň histologicky hodnocena jako fibrochondrooseózní proliferace, v 1 případu (8 %) jako minimální osteoplázie a ve 4 případech (34 %) jako vazivo. U poloviny vzorků (50 %) bylo přihojení k okrajům defektu hodnoceno jako dobré a u poloviny vzorků jako špatné nebo žádné. V jednom ze 4 případů histologicky hodnoceného vzorku jako vazivo byla prokázána i přítomnost zánětu (tab. 2).
Souhrnně lze říci, že ve skupině A je novotvořená kostní tkáň zastoupena v průměru ve více než 51% objemu kostního defektu, což je výrazně více než ve skupině B s použitím trikalciumfosfátu, kde se tato hodnota pohybuje v průměru od 0 do 20 %. Dle histologické subklasifikace je ve skupině A rovněž novotvořená tkáň klasifikována jako kost či fibrochondrooseózní proliferace, kdežto ve skupině B je tento výsledek v průměru hodnocen jako minimální osteoplazie. Při hodnocení okrajů kostního defektu stran přihojení vloženého materiálu k okrajům původní kosti byl významně lepší výsledek u skupin s použitým autogenním spongiózním štěpem. Vazivo se ve sledované skupině prasat objevilo ve zhojeném defektu pouze ve 4 případech, tj. u 16 %, z toho s nálezem zánětu v 1 případě, tj. 4 % případů z 25. Souhrnně jsou uvedeny výsledky v tabulce 2.
DISKUZE
Obecně platí, že kostní defekty vyskytující se v různých lokalizacích ohrožují stabilitu kosti a mohou mít za následek zlomeninu, která bývá často prvním příznakem takového defektu. Cystické kostní defekty v dětském věku ohrožují rostoucí skelet poškozením růstových zón kosti. Léze bývají asymptomatické a bývají diag-nostikovány často náhodně při RTG vyšetření skeletu [1,4].
K výplňovým materiálům používaným v léčbě kostních defektů patří strukturální kostní náhrady (cementy – polymetylmetakrylát), osteogenní agens (demineralizovaná kostní matrix) ve formě prášku nebo gelu s osteoindukčními vlastnostmi a náhrady spongiózní kosti (kalciumfosfátová keramika, hydroxyapatit, kalciumsulfát). Výhodou těchto materiálů je jejich osteoinduk-ční vlastnost, tj. přirozený proces resorpce a novotvorby kosti. Osteoinduktivita materiálu stimuluje vývoj mezenchymálních buněk na kostní buňky a indukuje tak tvorbu nové kostní tkáně [8]. Později v důsledku hydrolytické koroze a aktivní fagocytózy dochází k postupné dezintegraci materiálu a jeho resorpci a nahrazování nově se vytvářející kostní tkání. Zlepšení biologických vlastností je docíleno použitím kolagenních materiálů nebo tkáňových materiálů, jako je autologní kostní dřeň. Nejvýhodnějším ze zkoumaných biomateriálů je právě trikalciumfosfát, jehož výzkum byl započat již v roce 1920. Tento materiál byl k dispozici jak ve formě granulí s nutností otevřeného operačního výkonu, nebo ve formě pasty k miniinvazivní perkutánní aplikaci. Perkutánní aplikace je vhodná jen u juvenilních kostních cyst. U ostatních benigních kostních defektů, jako jsou metafyzární fibrózní defekty, neosifikující fibromy, enchondromy či defekty u fibrózní dysplázie, je před aplikací výplňovým materiálem nutný otevřený operační přístup a exkochleace obsahu defektu [3, 4, 5, 6].
V literatuře jsou uváděné i studie zabývající se srovnáním hojení benigních kostních cystických lézí aplikací syntetického trikalciumfosfátu ve formě granulí smíchaných s autologní kostní dření s hojením cystických defektů aplikací samostatných granulí trikalciumfosfátu [4]. Zlepšení biologických vlastností je docíleno použitím kolagenních materiálů nebo tkáňových mate-riálů, jako je autologní kostní dřeň.
V klinické praxi je léčebnou metodou kostního defektu exkochleace léze a vyplnění autologní kostní tkání. Výhodou autoštěpů je vysoká biologická aktivita, rychlá integrace a možnost revaskularizace. Nevýhodou je omezené množství štěpů, a to převážně v dětském věku, zásah na zdravé končetině, a tím i prodloužení celkové doby léčby a rekonvalescence a u dětí pak poškození apofýzy kyčelní kosti. Po vzniku kostních bank se nabízí metoda alloštěpů, využívaných hlavně u masivních kostních defektů, velké strukturální allografty se používají při řešení náhrad části dlouhých kostí a kloubních konců kostí po radikálních resekcích tumorózních afekcí skeletu. Použití allogenních transplantátů je využíváno zejména v případech, kdy není možné odebrat vlastní kost pacienta (krvácivé stavy, léčba léky na ředění krve), případně pokud není možné odebrat dostatečné množství vlastní kostní tkáně. Výhodou alloštěpů je možnost naplánování aplikace i množství alloštěpů. Při řešení velkých defektů kostí se kombinuje dárcovský i vlastní štěp. Allogenní transplantáty mohou vykazovat vysokou antigenní nesnášenlivost, kterou lze konzervací a dalšími technologiemi v kostních bankách částečně snížit. Kostní štepy lze použít samotné nebo v kombinaci s cementem, pokud je reziduální kost mechanicky nedostatečná, pokud by bylo místo defektu ohroženo frakturou nebo pokud tímto způsobem je ošetřena kost v blízkosti kloubních hlavic nebo růstových plotének. Po vložení kostních štěpů je nezbytná vnitřní fixace a zevní imobilizace [2, 4, 5].
Srovnání skupin s použitím trikalciumfosfátu a autogenního štěpu k náhradě velkého diafyzárního defektu v celé šíři kosti je v experimentální fázi raritní a může vést k dalším studiím v preklinické fázi výzkumu. Metody použité osteosyntézy, vedoucí k lepší stabilizaci vloženého výplňového materiálu a kostních fragmentů, nevedly k výraznějšímu ovlivnění kvality novotvořené kostní tkáně. Výsledek této studie ukazuje, že použití samotného biodegradabilního materiálu typu Trika-ciumfosfát, je pro rozsáhlé diafyzární defekty nevhodné a osteoindukční vlastnost tohoto preparátu se nepotvrdila. V klinické praxi je ovšem pozitivní efekt perkutánního použití Trikalciumfosfátu v léčbě juvenilních kostních cyst zcela jasný [4, 5]. U ostatních benigních kostních defektů nelze využít injektabilní formu materiálu z důvodu nutnosti exkochleace obsahu defektu. U neossifikujícíh fibromů vyžadujících operační řešení je nejrozšířenější metodou autospongioplastika. Nadějné výsledky výzkumů popisují terapii trikalciumfosfátem v kombinaci právě s autologní kostní dření [5]. Izolovaná aplikace autogenního spongiózního štěpu do rozsáhlého diafyzárního defektu se v našem zkoumaném souboru zdá být výrazně lepší.
Chirurgické řešení nestejné délky dolních končetin využívají metody zkrácení delší dolní končetiny a metody prodlužování kratší končetiny. Preferovaná postupná prolongace zahrnuje metody kontrolované distrakční epifyzeolýzy a dnes nejčastěji používanou metodou je postupná distrakce nově se formujícího regenerátu (kalus - distrakce). V některých případech došlo k selhání tvorby kostního regenerátu a bylo nutné přistoupit k podpoře hojení a náhradě defektu spongioplastikou. V literatuře jsou také uváděna prolongovaná hojení při použití oscilační pily. Bylo by s výhodou v těchto případech podpořit kostní hojení aplikací osteoinduktivních materiálů podporujících novotvorbu kostní tkáně (BMP, TGF beta), kalciumfosfátovou keramikou, hydroxyapatitem nebo právě kalciumfosfátem a zkrátit tak celý proces léčby.
Našim cílem bylo zjistit, zda je schopen v klinice ověřený syntetický materiál za stejný časový interval srovnatelně nahradit spongioplastiku, prohojit oblast defektu a omezit tak nutnost dalšího invazivního přístupu do organizmu. Výsledkem experimentální náhrady velkého diafyzárního defektu však bylo lepší prohojení u skupin s použitou autospongioplastikou. Nabízí se otázka, zda by se výsledek změnil, kdyby byl defekt histologicky hodnocen za delší časový interval (6-18 měsíců), což bude předmětem dalšího zkoumání. Dalším experimentálním východiskem bude náhrada jiným materiálem, např. vhodným biologickým nosičem poskytujícím mechanickou oporu v kombinaci s trikalciumfosfátem nebo mezenchymovými kmenovými buňkami.
ZÁVĚR
- Výsledkem studie je vhodná metodika pro experimentální a ke spongioplastice alternativní řešení náhrad kostních defektů.
- Porovnali jsme stadium hojení u skupin s použitým trikalciumfosfátem a autospongioplastikou s výsledem lepšího prohojení u skupiny s použitím autospongioplastiky.
Očekávané osteoindukční vlastnosti samotného trikalciumfosfátu se u rozsáhlého defektu po 4 měsících hojení v provedeném experimentu nepotvrdily. Ve skupině prasat, u nichž byl vytvořený defekt stehenní kosti léčen s použitím autoštěpů, došlo k výraznější novotvorbě zralé kostní tkáně a histologicky byla klasifikovaná novotvořená tkáň jako kost či fibrochondrooseozní proliferace. Ve skupině s aplikací trikalciumfosfátu byla tkáň hodnocena nejčastěji jako minimální osteoplazie ve vytvořeném defektu. Také při hodnocení přihojení implantátu k původní kosti byly výsledky u skupiny s autoštěpem výrazně lepší. Trikalciumfosfát tedy nadále zůstává indikován v léčbě menších kostních defektů, jako jsou juvenilní kostní cysty. Náhradu autospongioplastiky jinou neinvazivní metodou v léčbě velkých kostních defektů je tedy třeba nadále experimentálně hledat. Východiskem může být použití vhodného biologického nosiče poskytujícího mechanickou oporu v kombinaci s trikalciumfosfátem nebo mezenchymovými kmenovými buňkami. V těchto případech budou získané výsledky předložené studie sloužit jako kontrolní skupiny.
MUDr. Jan Škvařil
skvaraho@seznam.cz
Sources
1. AHN, J. I., PARK, J. S. Pathological fractures secondary to unicameral bone cysts. Int Orthop. 1994, 18, 20–22.
2. CAMPANACCI, M., ENNEKING, W.F. Bone and soft tissue tumors. Piccin Nuova Libraria S.p.A., Padova Italy, 1999, 57-171.
3. DUNGL, P. Ortopedie. Praha: Grada Publishing. 2005, 1280.
4. ONDRUŠ, Š., STRAKA, M., BAJEROVÁ, J. Trikalciumfosfát v kombinaci s autologní kostní dření v léčbě cystických kostních defektů v dětském věku, Acta Chir Orthop Traumatol Čech. 2011,78, 544–550.
5. PLÁNKA, L., ONDRUŠ, Š., ŠKVAŘIL, J. et al. Použití biodegradabilních materiálů v léčbě kostních cyst u dětí, Rozh chir. 2008, 87, 585-589.
6. POUL, J. Dětská ortopedie. Praha: Galén, 2009, 40.
7. SÝKORA I, DYNTEROVÁ A, HOLDA J, et al. Chov laboratorních zvířat. Institut výchovy a vzdělávání MZVž Praha. 1983.
8. URBAN, K., STRNAD, Z., POVÝŠIL, C. et al. Trikalcium fosfát jako substituce kostní tkáně (testování biologických vlastností v experimentu na zvířatech). Acta Chir orthop Traum čech. 1996, 63, 16–20, 151.
Labels
Surgery Traumatology Trauma surgery
Article was published inTrauma Surgery

2013 Issue 1-
All articles in this issue
- Intensity and duration of tissue ischemia in severe polytraumatized patients in dependent on duration of prehospital care, care in emergency and operation time registred by microdialysis
- Experimental treatment of the diaphyseal bone defect by using tricalcium phosphate
- Evaluation of results of spleen embolization in polytraumatized patients – 4year experience
- Hinged external fixation of the elbow - optimal axis alignment to minimize motion resistence during the movement - cadaveric study
- Trauma Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Experimental treatment of the diaphyseal bone defect by using tricalcium phosphate
- Evaluation of results of spleen embolization in polytraumatized patients – 4year experience
- Hinged external fixation of the elbow - optimal axis alignment to minimize motion resistence during the movement - cadaveric study
- Intensity and duration of tissue ischemia in severe polytraumatized patients in dependent on duration of prehospital care, care in emergency and operation time registred by microdialysis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

