-
Medical journals
- Career
Hereditary haemorrhagic teleangiectasia (Rendu-Osler-Weber disease)
Authors: M. Bradáčová 1; E. Faber 1; J. Minařík 1; F. Čtvrtlík 2; E. Čecháková 2
Authors‘ workplace: Hemato-onkologická klinika LF UP a FN Olomouc 1; Radiologická klinika LF UP a FN Olomouc 2
Published in: Transfuze Hematol. dnes,29, 2023, No. 3, p. 171-176.
Category:
doi: https://doi.org/10.48095/cctahd2023prolekare.cz5Overview
Hereditární teleangiektazie je vrozené onemocnění, při kterém se u pacientů na kůži a sliznicích objevuje charakteristické rozšíření drobných kapilár nazývané jako teleangiektázie. Teleangiektázie se stoupajícím věkem často praskají a způsobují krvácení. Pokud se krvácení opakuje příliš často, ať už ve formě epistaxí, hemoptýz, nebo krvácení do trávicího traktu, rozvíjí se u pacientů anémie, často vedoucí k významnému defi citu železa. Daleko závažnější je výskyt arteriovenózních malformací v parenchymatozních orgánech. Malformace postupně rostou se zvyšujícím se věkem pacienta. Nejčastěji jsou postiženy plíce, žaludek, játra a mozek. Krvácení z malformací v těchto lokacích může být smrtelné, a proto je jejich včasná identifi kace důležitá. Screening arteriovenózních malformací ve výše zmíněných rizikových lokacích je doporučován nejen u samotného pacienta, ale i u jeho rodiny. Aktuálně se nabízí také možnost průkazu kauzálních mutací. Léčba by vždy měla být posouzena individuálně. Někdy postačí pouze lokální terapie, hemostyptika nebo substituce železa, jindy je potřeba nasadit systémovou léčbu.
Klíčová slova:
krvácení – anémie – hereditární hemoragická teleangiektazie – arteriovenózní malformace – syndrom Rendu-Osler-Weber – teleangiektázie
ÚVOD
Hereditární hemoragická teleangiektázie (HHT), známá též jako syndrom Rendu-Osler-Weber, je vrozené dědičné onemocnění, jehož přenos se uskutečňuje autozomálně dominantním typem (AD) dědičnosti. Nemoc zapříčiňuje oslabení cévní stěny, v důsledku čehož je oproti cévní stěně u zdravých lidí mnohem náchylnější k ruptuře a následnému krvácení. Postupem času se navíc u nemocných vytvářejí arteriovenózní malformace (AVM) v parenchymatózních orgánech (zejména v plicích, mozku a játrech) [1]. V AVM arteriální krev proudí přímo do vén, aniž by před tím prošla kapilárami, které u AVM chybí. Závažnost krvácení a případné následky se pro pacienta odvíjí od umístění teleangiektázií či AVM.
Syndrom se u pacientů většinou projeví až v pozdějším období života, nejčastěji kolem 20.–30. roku života. Mezi první klinické projevy nejčastěji patří nepříliš specifické a často ničím nevyprovokované epistaxe. Nízká frekvence onemocnění zapříčiňuje jeho pozdní diagnostiku, neboť na něj lékaři při diferenciální diagnostice nemyslí.
PREVALENCE ONEMOCNĚNÍ
V České republice na rozdíl od zahraničí zatím bohužel nejsou k dispozici oficiální statická data o výskytu tohoto vzácného onemocnění. Jak uvádí článek z roku 2020, prevalence HHT v Severní Americe se pohybuje kolem 1 : 5 000 obyvatel [2]. Ve skutečnosti je počet pacientů, kteří onemocnění mají, ještě vyšší, než jaký poskytují oficiální statické data. Jako hlavní příčinu tohoto podhodnocení je skutečnost, že pokud se u někoho HHT diagnostikuje, obvykle se jeho příbuzní nenechají vyšetřit, přestože je u nich velmi pravděpodobný nález stejného onemocnění [3]. Výskyt HHT je také vázán na etnický a geografický původ. Příkladem je vysoká četnost tohoto onemocnění u lidí pocházejících z Nizozemských Antil [4]. Zvýšený výskyt tohoto onemocnění byl též zaznamenán u žen. Rozdíl prevalence mezi pohlavími ale může být zkreslen díky obecnému přístupu žen ke zdravotní péči. Ženy mezi 15–70 lety jsou totiž mnohem častěji „nuceny“ vyhledat lékařskou pomoc kvůli problémům s početím nebo komplikacemi v těhotenství [5]. Během těhotenství je popisováno zvýšené riziko rozvoje (někdy až život ohrožujících) komplikací u HHT [5,6].
PATOFYZIOLOGIE A GENETIKA ONEMOCNĚNÍ
HHT je vrozenou poruchou tvorby cévní stěny. Buňky endoteliální části stěny cév jsou tenčí a oslabené, a v důsledku toho postkapilární venuly ztrácí svou elasticitu. Jsou rozšířené (tudíž mohou být viditelné na povrchu kůže), fragilnější a více náchylné k ruptuře a následnému krvácení. U lidí, v jejichž cévním řečišti se vyskytují AVM, chybí odpor kapilárních cév. V důsledku toho je průtok krve v žilách vysoký. Tok krve může dosáhnout takových hodnot, že cévní stěna AVM, která není na tento nápor přizpůsobena, nevydrží a praskne.
Za patologickou tvorbou cév u HHT stojí genetické mutace. Podle postižených genů dělíme HHT na 5 podskupin, označované jako HHT 1–5. Podskupiny se liší mutacemi ovlivňujícími signální dráhu transforming growth factor-beta (TGF-b), která je nepostradatelná v tvorbě, zrání a stabilizaci cév. Dvě nejčastější mutace, vyskytující se přibližně u 80 % pacientů, jsou v ENG genu (který kóduje protein endoglin) a v genu activin receptor-like kinase 1 (zkráceně ACVRLK1 – kódující protein ALK-1). Další mutace, která svým působením zasahuje do cesty TGF-b a ovlivňuje tím angiogenezi, byla nalezena v genu MADH4 – tento gen v sobě obsahuje informace pro tvorbu proteinu, který se následně podílí na přenosu chemických signálů z povrchu buňky do jejího jádra. Je součástí signální dráhy TGF-b. Je ovšem velmi vzácná a je přítomna pouze u 1–2 % pacientů. Vyskytuje se u případů společného výskytu HHT a juvenilní polypózy. Signální dráha TGF-b je součástí mnoha procesů v buňkách, jako jsou např. buněčný růst, diferenciace, apoptóza, buněčná homeostáza a další. TGF-b se vyskytuje i v endoteliálních buňkách cév a v pericytech (buňkách obklopujících endotelie s podpůrným a regulačním významem), kde obstarává tubulogenezi a zajišťuje další funkce. V důsledku poškození těchto mechanizmů je endotel cév u HHT abnormálně hyperplastický a vyznačuje se patologickou morfogenezí (zvýšený obsah kolagenu, aktinu, zvlněná bazální membrána). Cévy tím ztrácejí své přirozené vlastnosti, jako je např. pružnost [7,8].
DĚLENÍ A CHARAKTERISTIKA JEDNOTLIVÝCH TYPŮ HHT
- HHT typ 1 podskupina s mutací v ENG genu. Je u ní vyšší prevalence AV malformací nacházejících se především v mozku a plicích; je typická častějším výskytem epistaxí.
- HHT typ 2 je charakterizován mutací v genu ACVRL1. Zde je popisována vyšší prevalence AVM v játrech; častější výskyt primární plicní hypertenze.
- U typu HHT 3 jsou postižené geny lokalizované na 5. chromozomu. Zatím se nepodařilo geny přesně identifikovat, lze ovšem předpokládat, že ovlivňují TGF-b.
- Stejně tak u HHT typu 4 nejsou patogenní mutace ani postižené geny zatím známé, jejich lokalizace je ovšem na 7. chromozomu.
- HHT typ 5 je zapříčiněn mutací v tzv. Growth Differentiation Factor 2 gene (GDF-2).
- JPHT typ, který je spojen s mutací v genu SMAD4 a klinicky se vyskytuje spolu s juvenilní polypózou (známou pod názvem juvenilní polypóza asociovaná s hereditární hemoragickou teleangiektázií) [9–12].
Image 1. Teleangiektázie na jazyku u pacientky s diagnózou Rendu-Osler-Weberovy choroby. 
Image 2. Teleangiektázie na tvrdém patře u pacientky s diagnózou Rendu-Osler-Weberovy choroby. 
Image 3. Teleangiektázie na prstech horní končetiny u pacientky s diagnózou Rendu-Osler-Weberovy choroby. 
DIAGNOSTICKÁ KRITÉRIA
- Oficiální diagnostická kritéria pro stanovení diagnózy Rendu-Osler-Weberova syndromu v klinické praxi byla publikována v roce 2000 [13]. Tato kritéria jsou známá jako Curaçao criteria [14]:
- Spontánní a opakující se epistaxe.
- Teleangiektázie v charakteristických lokacích (rty, dutina ústní, nos, prsty na horních končetinách – obr. 1–3).
- Viscerální arteriovenózní malformace nebo teleangiektazie (obr. 4).
- Příbuzní prvního stupně s diagnostikovanou HHT.
Jestliže pacient splňuje 3 a více výše uvedených kritérií, klasifikujeme to jako jistou HHT. Při splnění 2 kritérií ze 4 se jedná o pravděpodobnou HHT, s nutností doplnění dalších vyšetření k potvrzení či vyloučení syndromu. Pokud je splněno pouze 1 kritérium, onemocnění je u pacienta nepravděpodobné [13,15].
Pacienti, u nichž se vyskytují všechny 4 znaky, mají až 87% pravděpodobnost, že mají jednu z genetických mutací [14].
Navzdory veškerým doporučeným postupům v diagnostice a screeningu je HHT stále diagnostikována nedostatečně a někdy je cesta ke správné diagnóze neúměrně dlouhá [15].
Image 4. Arteriovenózní malformace na plicích u pacientky s hereditární hemoragickou teleangiektázií před odstraněním malformace pomocí endovaskulárního výkonu. 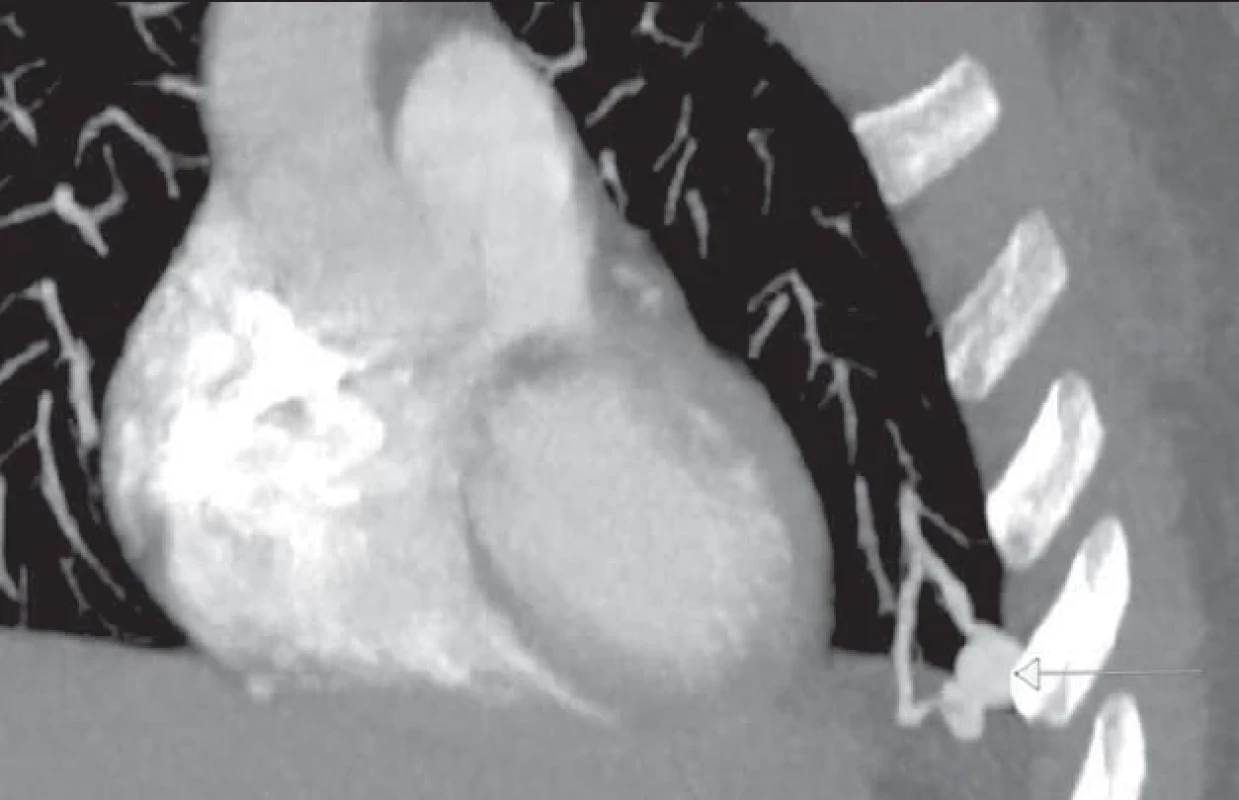
Image 5. Snímek plic (HRCT) po odstranění arteriovenózního zkratu po endovaskulárním výkonu. 
SCREENINGOVÝ PROTOKOL PRO HHT
Screeningový protokol obsahuje:
- pečlivý odběr anamnézy u pacienta a fyzikální vyšetření;
- vyšetření nosní sliznice či dutiny ústní;
- laboratorní vyšetření závažnosti anémie a deficitu železa.
- Ze zobrazovacích metod provedení transtorakální kontrastní echokardiografie (TTCE) ke zjištění přítomnosti plicních AV malformací (PAVMs). Vyšetření je indikované k detekci pravolevého zkratu sekundárně způsobeného PAVMs.
- Pokud zobrazení potvrdí pravolevý zkrat, který má středně těžký až těžký stupeň závažnosti, mělo by být doplněno zobrazení hrudníku počítačovou tomografií (CT) bez kontrastu (obr. 5).
- Nemocným s potvrzenou HHT (ať už podle klinických kritérií, či prokázáním jedné z genetických mutací pro tuto nemoc) je doporučeno podstoupit další zobrazovací vyšetření, především pro vyloučení AVM v mozku, nejlépe bez použití kontrastní látky (např. MRI – obr. 6).
- Co se týče screeningu možného postižení dalších viscerálních orgánů, nejsou prováděny standardně, ale pouze po indikaci ošetřujícího lékaře. Např. screening pro AVM v játrech pro elevaci jaterních enzymů.
Screening pro dospělé a dětské pacienty se liší jen nepatrně. U dětí se klade větší důraz na doplnění podrobné rodinné a osobní anamnézy s otázkami zaměřenými na případné epizody hypoxie, bolesti hlavy, opožděný růst atd. Pokud pediatr na základě zjištěných informací pojme podezření o možné přítomnosti HHT u pacienta, indikuje další vyšetření s pokud možno co nejmenší zátěží pro dítě. Tedy od genetického až po klinické vyšetření, do kterého je zahrnuto: přítomnost viditelných teleangiektázií (v dutině ústní, na prstech horní končetiny atd.). Některé zahraniční zdroje uvádí, že jako první zobrazovací vyšetření u dětí by mělo proběhnout vyšetření k detekci případných AVM lokalizovaných v CNS pomocí MRI mozku a až následně při jejich přítomnosti indikovat další vyšetření. Toto doporučení ale nelze aplikovat plošně a konečné rozhodnutí o tom, jaké vyšetření pediatrický pacient podstoupí, je na ošetřujícím lékaři. K vyloučení, či potvrzení přítomnosti dalších možných AVM se provádí echokardiografií. Na rozdíl od HRCT plic, které je u dospělých většinou první volbou, u dětí nejdříve provádíme RTG snímek (pro zmenšení radiační zátěže). Až na základě případných nejasností na snímku se indikuje HRCT. Naopak ultrazvuk břicha s případným Dopplerem a CT břicha se u dětí provádějí jen zřídka [16,17].
Image 6. MRI snímek mozku pacientky s hereditární hemoragickou teleangiektázií, snímek v axiální rovině vpravo frontálně paramediálně je přítomna arteriovenózní malformace o průměru kolem 20 mm. 
Klinické projevy
Epistaxe
Jak již bylo zmíněno v úvodu, mezi nejčastější projevy syndromu patří (většinou samovolné) epistaxe. U 90 % lidí trpících HHT se krvácení z nosu projeví před 30. rokem života [18]. Dle závažnosti a frekvencí mohou epistaxe vyústit v sideropenickou anémii. Průměrná frekvence krvácivých epizod se udává kolem 18 za měsíc [1].
Teleangiektázie
Jestli je pro tuto nemoc něco typického na první pohled, tak to jsou právě teleangiektázie vypadající jako drobné zarudlé léze velikosti špendlíkové hlavičky. Typickou lokalizací pro ně je kůže – zvláště na prstech rukou, obličeje, rtů a bukální a nazální sliznice. V porovnání s epistaxemi se teleangiektázie objevují až později (což ovšem nevylučuje jejich výskyt i v dětském věku). Kvůli tenké stěně jsou velmi náchylné k prasknutí, a tedy i krvácení [18].
Anémie
Anémie s rozvinutým anemickým syndromem je u pacientů trpících HHT velmi běžná. Po čase se chronické ztráty krve projeví deficitem železa a v krevním obraze zprvu jako normocytární a posléze jako mikrocytární hypochromní anémie.
AV malformace
Arteriovenózní malformace mohou mít vícečetné lokalizace. Pro observaci jsou kvůli potenciálně závažnému až život ohrožujícímu krvácení, či dokonce srdečnímu selhání nejdůležitější lokalizace v plicích, játrech, mozku a v GIT.
Plicní AV malformace se vyskytují až u 70 % pacientů a téměř u všech postižených s HHT typem 1. Klinika projevů je různorodá. Od asymptomatických nemocných až po hemoptýzy a dyspnoe s hypoxií. Dalším nezanedbatelným zdravotním rizikem plicních AVM je možná embolizace z těchto ložisek do CNS. Následkem pak může být ischemická cévní mozková příhoda či mozkový absces. Tyto stavy mohou skončit fatálně či s trvalými následky pro pacienta, což ilustruje důležitost včasné diagnostiky nemoci u pacientů.
Vyšší výskyt AV malformací v játrech mají pacienti s HHT typu 2. Jaterní AV malformace mohou být příčinou portální hypertenze, jaterního nebo srdečního selhání.
Mozkové malformace jsou v porovnání s výskytem AVM v jiných lokacích vzácnější. Nalezneme je u 10 % pacientů a mohou se projevit již od narození, např. jako epilepsie, netraumatické krvácení do míchy, mozkové krvácení.
Postižení GIT se vyskytuje u 20 % nemocných, u kterých bývá postižen žaludek, tenké i tlusté střevo. Doposud nebyla označena žádná aktivita, potravina či nápoj, které by krvácení z GIT zhoršovaly [1,19].
LÉČBA
Jediný správný postup v léčbě HHT neexistuje. Přístup k léčbě se odvíjí podle individuálních klinických projevů u daného člověka a stupně jejich závažnosti. Pro malou četnost pacientů neexistují větší studie. Intervence thalidomidem a bevacizumabem se opírají o mechanizmus účinku těchto molekul v angiogenezi, ale účinek se u aktuálního pacienta nemusí dostavit.
Zkoumá se i účinnost dalších látek, jejichž mechanizmus působení je podobný s bevacizumabem. Jedná se o pazopanib, nintedanib, sunitinib a buparlisib. V budoucích možných seznamech léčiv figuruje i tacrolimus, protilátky ANTI-ANGPT2 a PI3 kinázové inhibitory. To, zda nám budoucnost dá více terapeutických (u účinnějších) možností pro pacienty s HHT, je otázka, na kterou si budeme muset ještě nějaký čas počkat [16].
Anémie
V případně výskytu deficitu železa je potřeba hradit jeho ztráty. Nejdříve zahajujeme substituci per os formou. Pokud není forma p. o. podání železa dostačující, zvážíme eskalaci na preparáty intravenózní. Při stále nedostatečné odpovědi můžeme doplnit hrazení ztrát současným pravidelným podáváním krevních transfuzí.
Epistaxe
Pro léčbu epistaxí se doporučuje lokální zvlhčující terapie, ablace teleangiektázií na nosní sliznici, hemostyptika či antifibrinolityka. Pokud lokální terapie není dostačující, měla by být zvážena kombinace se systematickou antiangiogenní terapií, např. thalidomid p. o., bevacizumab i.v. Úhradu léčby oběma přípravky je pro tuto diagnózu nutné nechat schválit pojišťovnou. Kontraindikací k nasazení systematické léčby, která má prokoagulační účinky (antifibrinolytika, hemostyptika), je nedávná epizoda trombózy v anamnéze. Relativními kontraindikacemi k individuálnímu posouzení je pak fibrilace síní nebo známá trombofilie v pacientově anamnéze (např. Leidenská mutace). V případě opakovaných epistaxí je velmi důležitá mezioborová spolupráce s ORL lékaři, kteří dokáží pro pacienty obtěžující krvácení zmírnit, či na nějakou dobu dokonce odstranit.
GIT krvácení
Dle závažnosti klinických projevů se dělí na:
- lehkou formu HHT – pro správné hodnoty hemoglobinu jsou postačující p. o. suplementace železem;
- středně závažnou formu HHT – nutná i.v. terapie železem;
- závažnou formu HHT – uspokojivých hladin hemoglobinu nelze dosáhnout ani při opakovaném podání transfuzí. Je nutná systematická léčba např. i.v. bevacizumabem [20].
AV malformace v plicích
V současnosti je 1. volbou terapie při AV malformacích v plicích, klinicky projevujících se jako epistaxe nebo hemoptýzy, selektivní embolizace pulmonálních arterií. Při tomto zákroku se pomocí embolizace uzavřou tepny zásobující plicní AVM. Výkon lze provádět v ambulantním režimu s minimem komplikací. Mezi ty nejčastější patří bolesti na hrudi lehce zvládnutelné analgetiky. Úspěšnost této léčby je až 98,7 % [21].
AV malformace v CNS
Názory na případnou léčbu AVM v CNS jsou často předmětem diskuze. Mezinárodní doporučení stále doporučují screening AVM u všech pacientů s potvrzenou diagnózou HHT, především pro možné fatální důsledky případné ruptury AVM. V současné době ovšem nemáme dostatek důkazů o prospěšnosti léčby AVM u asymptomatických pacientů s HHT. Faktem totiž zůstává, že riziko krvácení z AVM v CNS je asi 0,5 % za rok. Případná léčba musí být pečlivě individuálně posouzena a konzultována nejen s neurochirurgickým pracovištěm ale také se samotným pacientem. Otevřená excize AVM je stále nejlepším kurativním řešením. Pokud jsou léze inoperabilní, je možné provést stereotaktickou radiochirurgii. Procento vyléčených je však mnohem nižší a odvíjí se od velikosti AVM. Embolizace AVM v CNS je samostatně málokdy účinná a je indikována spíše jako doplnění chirurgického výkonu či radioterapie [22].
PROGNÓZA PACIENTŮ
Zdroje, které by objektivně zhodnotily délku přežití u pacientů s HHT, je málo. Některé retrospektivní studie prokázaly vliv HHT na délku života v porovnání se zdravou populací. Medián úmrtí lidí s HHT byl 63,2 let, naproti tomu u lidí bez HHT byl medián 70,0 let [1]. Zajímavostí je, že nejvyšší riziko úmrtí na komplikace spojené s HHT bylo během prvních 3 let od stanovení této diagnózy. Následně riziko klesalo. I na tomto příkladu lze potvrdit důležitost a včasnost diagnostiky a zahájení léčby, která tak může prodloužit nemocným život [1].
ZÁVĚR
Hereditární hemoragická teleangiektázie není příliš časté onemocnění. Pravděpodobnost, že se s ním setká běžný lékař, je malá, ovšem ne nulová. Neměli bychom na něj zapomínat, především už pro včasnou diagnostiku a zahájení adekvátní terapie. Měli bychom na něj pomýšlet, pokud pacient trpí opakovanými epistaxemi, má sideropenickou anémii, viditelné teleangiektázie, v rodinné anamnéze se vyskytuje někdo s podobnými problémy nebo je příbuznému přímo diagnostikována HHT. I když je léčba zatím spíše symptomatická nežli kauzální, můžeme díky ní významně zlepšit kvalitu života lidí trpících tímto onemocněním, a to nejen po stránce fyzické, ale i psychické a sociální.
ČESTNÉ PROHLÁŠENÍ AUTORŮ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
MB – příprava rukopisu
EF – revize, korekce rukopisu
JM – poskytnutí obrazové dokumentace
FČ – poskytnutí radiologických snímků a jejich popisu
EČ – poskytnutí radiologických snímků a jejich popisu
Všichni autoři schválili finální verzi rukopisu.
Do redakce doručeno dne: 12. 12. 2022.
Přijato po recenzi dne: 21. 2. 2023.
prof. MUDr. Edgar Faber, CSc.
Hemato-onkologická klinika
Fakultní nemocnice Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail:edgar.faber@fnol.cz
Sources
1. Locke T, Gollamudi J, Chen P. Hereditary hemorrhagic telangiectasia (HHT). Updated 2022 Jun 11. In: StatPearls Internet. Treasure Island (FL): StatPearls Publishing. Viděno: 16. duben 2022 Online. Dostupné z: https: //www.ncbi.nlm.nih.gov/books/NBK578186/
2. Faughnan ME, Mager JJ, Hetts SW, et al. Second international guidelines for the diagnosis and management of hereditary hemorrhagic telangiectasia. Ann Intern Med. 2020; 173 (12): 989–1001.
3. McDonald J, Stevenson DA, Adam MP, et al. Hereditary hemorrhagic telangiectasia. GeneReviews®; publikováno elektronicky 26. června 2000. DOI 10.7499/j.issn.1008-8830.2004196.
4. Westermann CJ, Rosina AF, De Vries V, de Coteau PA. The prevalence and manifestations of hereditary hemorrhagic telangiectasia in the Afro-Caribbean population of the Netherlands Antilles: a family screening. Am J Med Genet A. 2003; 116A (4): 324–328.
5. Donaldson JW, McKeever TM, Hall IP, Hubbard RB, Fogarty AW. The UK prevalence of hereditary haemorrhagic telangiectasia and its association with sex, socioeconomic status and region of residence: a population-based study. Thorax. 2014; 69 (2): 161–167.
6. Inocêncio G, Braga A, Lima T, Buchner G. Osler-Weber-Rendu syndrome during pregnancy. BMJ Case Rep.; publikováno elektronicky 25. června 2013. DOI 10.1136/bcr-2013-00 792.
7. Adam Z, Brančíková D, Romanová G, et al. Hereditární hemoragická teleangiektázie (syndrom Osler-Weber-Rendu) – Díl I. Patofyziologie, klinické příznaky a doporučený skrínink cévních malformací. Vnitř Lék. 2021; 67 (6): 339–344.
8. Bofarid S, Hosman AE, Mager JJ, Snijder RJ, Post MC. Pulmonary vascular complications in hereditary hemorrhagic telangiectasia and the underlying pathophysiology. Int J Mol Sci. 2021; 22 (7): 3471.
9. Grigg C, Anderson D, Earnshaw J. Diagnosis and treatment of hereditary hemorrhagic telangiectasia. Ochsner J. 2017; 2 : 157–160.
10. Cole SG, Begbie ME, Wallace GM, Shovlin CL. A new locus for hereditary haemorrhagic telangiectasia (HHT3) maps to chromosome 5. J Med Genet. 2005; 42 (7): 577–582.
11. Kim D, Seo EJ, Song YS, et al. Current status of clinical diagnosis and genetic analysis of hereditary hemorrhagic telangiectasia in South Korea: multicenter case series and a systematic review. Neurointervention. 2019; 14 (2): 91–98.
12. Botella LM, Albiñana V, Ojeda-Fernandez L, Recio-Poveda L, Bernabéu C. Research on potential biomarkers in hereditary hemorrhagic telangiectasia. Front Genet. 2015; 6 : 115.
13. Shovlin CL, Guttmacher AE, Buscarini E, et al. Diagnostic criteria for hereditary hemorrhagic telangiectasia (Rendu-Osler-Weber syndrome). Am J Med Genet. 2000; 91 (1): 66–67.
14. Richards-Yutz J, Grant K, Chao EC, Walther SE, Ganguly A. Update on molecular diagnosis of hereditary hemorrhagic telangiectasia. Hum Genet. 2010; 128 (1): 61–77.
15. Pierucci P, Lenato GM, Suppressa P, et al. A long diagnostic delay in patients with hereditary haemorrhagic telangiectasia: a questionnaire-based retrospective study. Orphanet J Rare Dis. 2012; 7 : 33.
16. Robert F, Desroches-Castan A, Bailly S, Dupuis-Girod S, Feige JJ. Future treatments for hereditary hemorrhagic telangiectasia. Orphanet J Rare Dis. 2020; 15 (1): 4.
17. de Gussem EM, Kroon S, Hosman AE, et al. Hereditary hemorrhagic telangiectasia (HHT) and survival: the importance of systematic screening and treatment in HHT centers of excellence. J Clin Med. 2020; 9 (11): 3581.
18. Berg J, Porteous M, Reinhardt D, et al. Hereditary haemorrhagic telangiectasia: a questionnaire-based study to delineate the different phenotypes caused by endoglin and ALK1 mutations. J Med Genet. 2003; 40 (8): 585–590.
19. Kritharis A, Al-Samkari H, Kuter DJ. Hereditary hemorrhagic telangiectasia: diagnosis and management from the hematologist‘s perspective. Haematologica. 2018; 103 (9): 1433–1443.
20. Al-Samkari H. Hereditary hemorrhagic telangiectasia: systemic therapies, guidelines, and an evolving standard of care. Blood. 2021; 137 (7): 888–895.
21. Martinez-Pitre PJ, Khan YS. Pulmonary arteriovenous malformation (AVMs) Updated 2022 Jun 27. In StatPearls Internet. Treasure Island (FL): StatPearls Publishing. Viděno: 19. duben 2022 Online. Dostupné z: https: //www.ncbi.nlm.nih.gov/ book/NBK559289/
22. Garg N, Khunger M, Gupta A, Kumar N. Optimal management of hereditary hemorrhagic telangiectasia. J Blood Med. 2014; 5 : 191–206.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today
2023 Issue 3-
All articles in this issue
- Hereditary haemorrhagic teleangiectasia (Rendu-Osler-Weber disease)
- Managing BTK inhibitor treatment-related adverse events in patients with chronic lymphocytic leukaemia – cardiovascular complications and bleeding
- Covid score – the contribution in prognostic stratification of patients with COVID-19
- Report on the program of the use of convalescent plasma in the treatment of patients with COVID-19 in the Czech Republic and the results of the national multicentre study RESCOVID-19
- Životní jubileum paní primářky MUDr. Jarmily Živné
- Boris Bubeník slaví sedmdesátiny
- MUDr. Jaroslava Voglová slaví 70 let
- Teklistamab with the latest two-year effi cacy and safety data in the treatment of RRMM
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hereditary haemorrhagic teleangiectasia (Rendu-Osler-Weber disease)
- Boris Bubeník slaví sedmdesátiny
- Managing BTK inhibitor treatment-related adverse events in patients with chronic lymphocytic leukaemia – cardiovascular complications and bleeding
- Teklistamab with the latest two-year effi cacy and safety data in the treatment of RRMM
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

