-
Medical journals
- Career
Bezpečnost a efektivita léčby rituximabem u dětí s autoimunitním onemocněním
Authors: V. Lukášová 1; H. Schneiderová 2; V. Fiamoli 1; O. Zapletal 1; S. Köhlerová 1; J. Blatný 1
Authors‘ workplace: Oddělení dětské hematologie FN Brno a Masarykova univerzita Brno 1; Pediatrická klinika FN Brno a Masarykova univerzita Brno 2
Published in: Transfuze Hematol. dnes,24, 2018, No. 4, p. 270-282.
Category: Original Papers
Overview
Rituximab je monoklonální protilátka namířená proti CD20 molekulám exprimovaným na povrchu B lymfocytů. Po navázání rituximabu na buněčný povrch dochází ke smrti B buněk a jeho užití vede k přechodné depleci B buněk související se snížením/vymizením patologických (auto)protilátek. Tohoto efektu se využívá v léčbě autoimunitních onemocnění (v režimu „off-label“).
Práce je zaměřena na zhodnocení bezpečnosti a efektivity léčby rituximabem v souboru 11 dětských pacientů s autoimunitním onemocněním. Vyhodnocovaná data byla shromažďována retrospektivně, proto výsledky některých vyšetření nebyly k dispozici u všech sledovaných pacientů. Z hlediska bezpečnosti byla věnována pozornost jak akutním nežádoucím účinkům vázaným na vlastní podání léku, tak nežádoucím účinkům dlouhodobým, mezi které patří dlouhodobá deplece B buněk, hypogamaglobulinemie a závažné infekce. Z hlediska efektivity bylo posuzováno dosažení definovaných kritérií parciální a kompletní remise u jednotlivých diagnóz.
V souboru sledovaných dětí byla zaznamenána akutní nežádoucí reakce u 5 pacientů (45,5 % ze všech pacientů). U 2 pacientů (25 % hodnocených) nedošlo ani po delším časovém období po terapii rituximabem k obnově B buněk k fyziologickým hodnotám. Mírnou hypogamaglobulinemii po terapii vyvinuli 2 pacienti (25 % hodnocených). Závažná infekce po terapii byla zaznamenána u 1 pacienta (9,1 % ze všech pacientů). Léčbu rituximabem lze v našem souboru pacientů považovat za efektivní u 45,5 % pacientů. Kompletní remise bylo dosaženo u 9 % pacientů, parciální remise u 36,5 % pacientů. Dlouhodobé remise trvající déle než 1 rok dosáhlo 27,3 % sledovaných.
Ve výsledcích našeho sledování se shodujeme se současnými doporučeními řadit léčbu rituximabem do linie druhé volby v terapii autoimunitních onemocnění u dětí.
KLÍČOVÁ SLOVA:
rituximab – autoimunitní onemocnění u dětí – nežádoucí účinky – hypogamaglobulinemie – remise
ÚVOD
Charakteristika
Rituximab je chimérická monoklonální protilátka (její variabilní část zodpovědná za vazbu na antigen je původu myšího, zbytek molekuly je lidského původu). Protilátka se specificky váže na CD20 molekuly exprimované na povrchu B lymfocytů, nikoli však na B lymfocyty všech stadií. Tyto transmembránové proteiny jsou na buňkách přítomny ve stadiu pre-B lymfocytu, zralého B lymfocytu a paměťové buňky, nenajdeme je ale na hematopoetické kmenové buňce, na pro-B lymfocytu, ani na plazmatické buňce. Po navázání rituximabu na buněčný povrch dochází ke smrti B lymfocytu třemi možnými mechanismy: aktivací na protilátkách závislé buněčné toxicity, aktivací komplementu nebo spuštěním procesu apoptózy [1]. Tím dochází k přechodné depleci B lymfocytů trvající obvykle kolem 6 měsíců, ale tato doba se může individuálně lišit [2]. Rituximab byl původně vyvinut k eliminaci maligních klonů B lymfocytů u hematoonkologických onemocnění, ale vzhledem k tomu, že B buňky hrají pravděpodobně zásadní roli také v průběhu autoimunitního onemocnění, jeho použití se postupně rozšiřuje i do této oblasti [3]. Rituximab totiž snižuje hodnoty patologických (auto)protilátek v plazmě. Mechanismus jejich vymizení tkví pravděpodobně ve zpomalení novotvorby plazmatických buněk, protože mezistupněm jejich vývoje je právě CD20+ B buňka, která je rituximabem eliminována, a také alterace dalších imunitních funkcí B lymfocytů (prezentace antigenů, stimulace T buněk, produkce cytokinů) [4, 5].
Indikace
Mezi indikace pro podání rituximabu schválené Státním ústavem pro kontrolu léčiv (SÚKL) v současné době patří non-Hodgkinské lymfomy různých typů, chronická lymfocytární leukemie, revmatoidní artritida, Wegenerova granulomatóza a mikroskopická polyangiitida, přípravek je takto užíván v léčbě dospělých pacientů. V režimu off-label je rituximab zkoušen u řady zánětlivých a systémových autoimunitních onemocnění, hematologických i nehematologických. Patří mezi ně například imunitní trombocytopenická purpura, autoimunitní hemolytická anémie, antifosfolipidový syndrom, systémový lupus erythematodes, dermatomyositida, systémové vaskulitidy, onemocnění ledvin (membranózní glomerulonefritida s nefrotickým syndromem, fokální segmentální glomeruloskleróza), Sjögrenův syndrom, neuromyelitis optica, myasthenia gravis a puchýřnatá kožní onemocnění (pemphigus vulgaris, jizvící pemphigoid) [6–9]. Rituximab se užívá také v transplantační medicíně k prevenci a léčbě akutní rejekce štěpu a k léčbě potransplantační lymfoproliferativní poruchy [1, 10]. K off-label indikacím patří také použití tohoto medikamentu u dětských pacientů.
Nežádoucí účinky
V souvislosti s podáváním rituximabu byly popsány nežádoucí účinky, které se dají rozdělit na nežádoucí účinky v průběhu aplikace nebo v krátkém čase po ní a nežádoucí účinky dlouhodobé.
Reakce vázané na vlastní podání (infuzi) léku se s nejvyšší četností objevují v prvním cyklu podávání rituximabu a (nej)běžnější jsou po aplikaci první dávky. Podkladem tohoto jevu je pravděpodobně snižující se množství cytokinů uvolňovaných z rozpadajících se B buněk, jejichž počet je při první aplikaci nejvyšší a s každou další aplikací klesá [11]. Nejčastěji se jedná o pruritus, svědění a sevření hrdla, flush, dyspnoi, rash, bolesti na hrudi a zimnici [12]. Tyto reakce se objevují častěji u pacientů léčených pro hematologickou malignitu než u pacientů s autoimunitním onemocněním [3].
Se vznikající a po určité časové období přetrvávající deplecí B buněk souvisí dlouhodobé snížení hladin imunoglobulinů jako další možný nežádoucí účinek léku. Tento efekt by se z podstaty věci dal očekávat u všech pacientů, přesto k závažné symptomatické hypogamaglobulinemii doprovázené infekcemi a vyžadující tedy náhradu IgG dochází jen zřídkakdy [14]. V naprosté většině případů je pokles fyziologických protilátek pouze přechodný, zřejmě v důsledku perzistence dlouho žijících plazmatických buněk, které neexprimují CD20 antigen [13]. Další postterapeutickou komplikací navazující na problematiku hypogamaglobulinemie je vyšší četnost či vyšší míra závažnosti infekcí [14].
SOUBOR A METODY
Vyhodnocovaná klinická i laboratorní data byla manuálně extrahována z elektronických záznamů o léčbě v Dětské nemocnici Fakultní nemocnice Brno, a to retrospektivně od počátku sledování konkrétního pacienta na Oddělení dětské hematologie po dobu maximálně šesti let od podání léku. Posuzovali jsme záznamy 11 pacientů léčených rituximabem pro autoimunitní onemocnění refrakterní na předchozí medikaci (tab. 1). Soubor obsahoval pacienty s chronickou imunitní trombocytopenickou purpurou (n = 5), se syndromem Evanse (n = 2, u jednoho pacienta přítomna trombocytopenie s anémií, u druhého trombocytopenie s neutropenií), s autoimunitní hemolytickou anémií (n = 2) a s hemofilií A s vyvinutým inhibitorem faktoru VIII (n = 2). Jednalo se o 7 chlapců a 4 dívky, jejichž věkový průměr v době diagnózy základního onemocnění činil 6,3 roku (medián 6,3 roku, v rozmezí 0–14 roků). Sedmi pacientům byl podán rituximab v dávce 375 mg/m 2 v intravenózní infuzi jednou týdně po dobu 4 po sobě následujících týdnů. Jeden pacient obdržel ve snaze o maximalizaci efektu totéž množství léku jednou týdně po dobu 6 po sobě následujících týdnů a u třech pacientů se cyklus 4 dávek následně znovu opakoval (s časovým odstupem 8 měsíců, 14 měsíců a 5 let – důvody opakování cyklu jsou uvedeny v tabulce 2). Věkový průměr pacientů v době aplikace léku byl 9,6 roku (medián 8,1 let, v rozmezí od půl roku do téměř 17 let). Premedikace před infuzí rituximabu byla podávána podle zvyklostí oddělení a zvážení ošetřujícího lékaře, standardně vyžadována nebyla. Většinou šlo o antipyretikum v kombinaci s antihistaminikem, případně s kortikoidem (premedikace některých pacientů je uvedena v tabulce 3).
Table 1. Základní charakteristiky pacientů 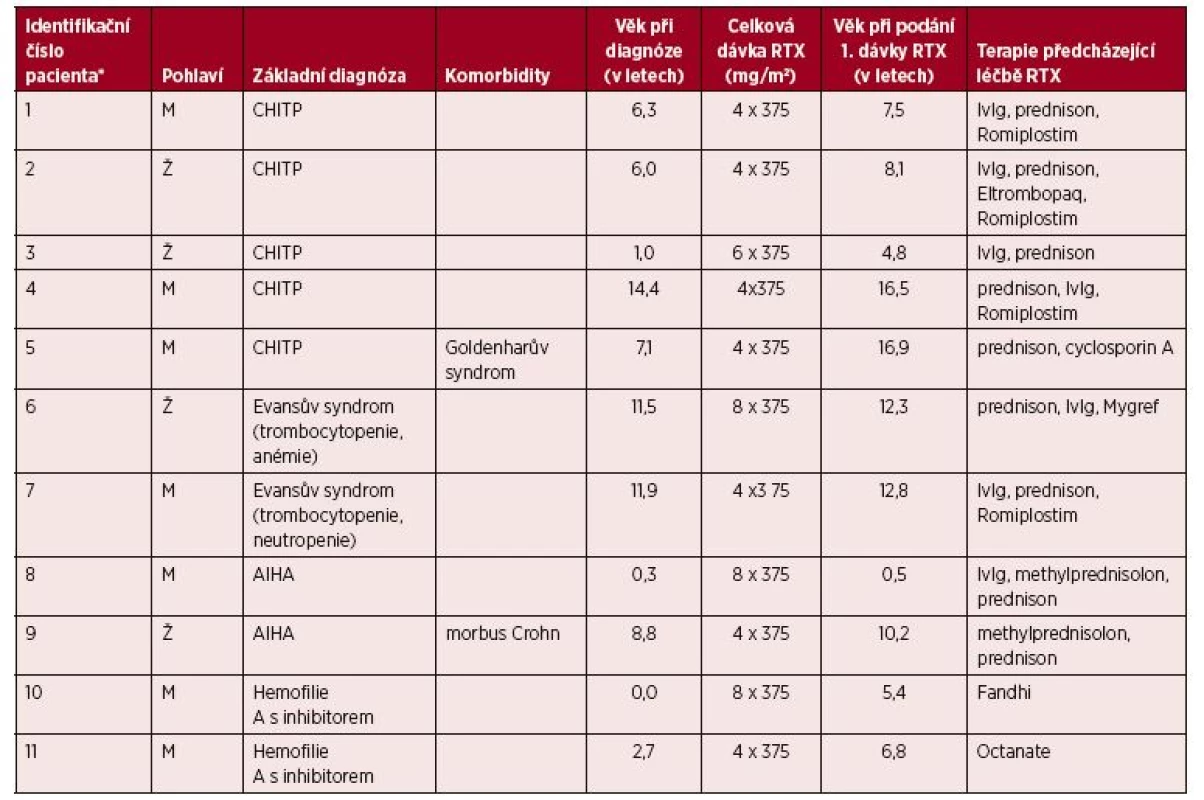
*Identifikační čísla jednotlivých pacientů v dalším textu i ve všech ostatních tabulkách odpovídají identifikačním číslům v tabulce 1.
CHITP – chronická imunitní trombocytopenická purpura
AIHA – autoimunitní hemolytická anémie
RTX – rituximab
IvIg – intravenózní imunoglobulinTable 2. Důvody k opakování série RTX 
*Interval mezi cykly je časové období mezi podáním 1. dávky I. cyklu a 1. dávky II. cyklu terapie rituximabem.
AIHA – autoimunitní hemolytická anémie.
iFVIII – inhibitor faktoru VIIITable 3. Popis akutních nežádoucích reakcí a jejich léčby 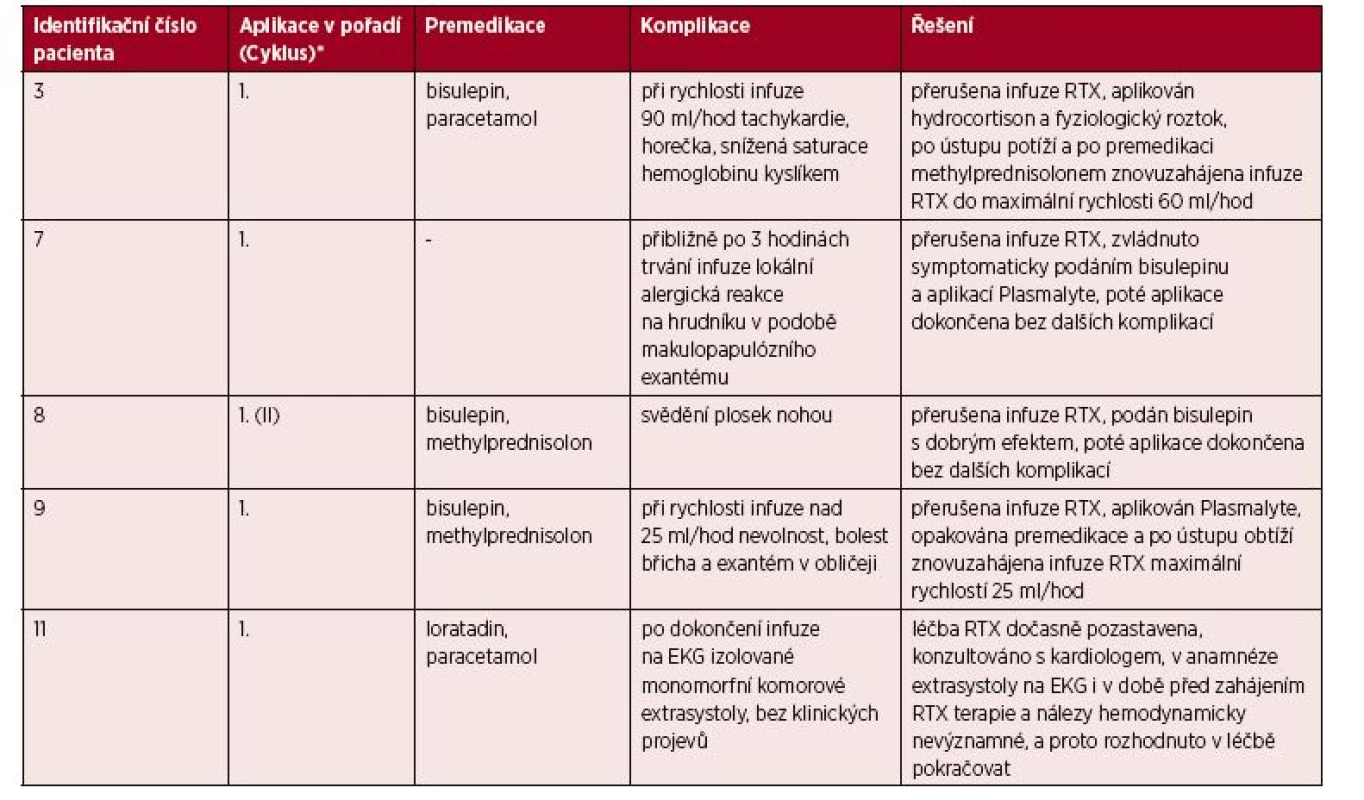
*Sloupec upřesňuje, při které z jednotlivých terapeutických aplikací rituximabu došlo ke vzniku nežádoucí reakce. V případě, že bylo aplikováno více sérií rituximabu, v závorce je uvedeno také číslo série, v rámci které byla aplikována dávka, při níž došlo k nežádoucí reakci.
RTX – rituximabCílem naší práce bylo posoudit bezpečnost léčby rituximabem a vyhodnotit její efektivitu ve výše zmíněných indikacích.
Klinicky jsme u pacientů z hlediska posouzení bezpečnosti léčby sledovali případné akutní nežádoucí reakce na podání rituximabu, s odstupem od léčby pak případný výskyt závažnějších infekcí, které by mohly souviset s terapií. Z hlediska vyhodnocení efektivity jsme sledovali případné projevy základního onemocnění pacientů (krvácivé projevy, ikterus, infekce).
Laboratorně jsme u pacientů sledovali hodnoty krevního obrazu (vyšetřovány metodou fluorescenční průtokové cytometrie a metodou hydrodynamické fokusace přístrojem XE-5000 od firmy Sysmex), hladiny imunoglobulinů (vyšetřovány turbidimetricky přístrojem Cobas 8000 od firmy Roche Diagnostics), hladiny CD20+ B lymfocytů (vyšetřovány průtokovou cytometrii přístrojem FACSCanto II od firmy Becton Dickinson), u pacientů s hemofilií A hladiny inhibitoru faktoru VIII (vyšetřovány Nijmegenskou modifikací Bethesda metody přístrojem CA-1500 od firmy Sysmex), a u pacientů s autoimunitní hemolytickou anémií a pacientky s Evansovým syndromem s anémií jsme sledovali také celkový bilirubin a hladiny laktátdehydrogenázy v séru (oba parametry vyšetřovány fotometricky přístrojem Cobas Integra 400plus od firmy Roche Diagnostics) a případnou pozitivitu antierytrocytárních protilátek (vyšetřovány metodou sloupcové aglutinace v gelu s využitím diagnostických karet a diagnostických erytrocytů od firmy BioRad analyzátorem ID Gelová stanice).
VÝSLEDKY A JEJICH DISKUSE
Náš zájem byl směrován především na získání informací o bezpečnosti užívání rituximabu, tedy na případné nežádoucí účinky, které se vyskytly u našich pacientů, na jejich závažnost a způsob jejich řešení. Sekundárními cíli pak bylo získání informací o efektivitě léku, tedy o tom, kolik pacientů dosáhlo remise svého onemocnění a v jakém časovém horizontu se tak stalo.
Akutní nežádoucí účinky
Prvním pozorovaným jevem byly nežádoucí účinky vázané na vlastní podání (infuzi) rituximabu. Reakce byla zaznamenána u 5 z 11 pacientů (u 1 pacienta s hemofilií A, u 2 pacientů léčených pro imunitní trombocytopenickou purpuru a u obou pacientů s autoimunitní hemolytickou anémií), tedy u 45,5 % sledovaných (viz tab. 3). Ve všech případech se objevila při aplikaci první dávky (v jednom z nich šlo o první dávku druhé série). V tomto pozorování se shodujeme s již publikovanými poznatky [3, 11–13, 15–17]. Všechny reakce byly bez problémů zvládnuty režimovým opatřením a/nebo běžnou symptomatickou medikací (viz tab. 3) a žádná z nich nebyla natolik závažná, že by nebylo možné po jejím odeznění pokračovat v infuzi léčiva. Aplikace byla poté u všech pacientů dokončena bez dalších komplikací a všichni obdrželi plánovaný počet dávek léku. Reakce se manifestovaly kožními projevy ve formě makulopapulózního exantému na hrudníku a v obličeji, svěděním plosek nohou, horečkou, tachykardiemi, sníženou saturací hemoglobinu kyslíkem či nevolností a bolestmi břicha u pacientky sledované současně pro Crohnovu chorobu. Poslední z uvedených stavů mohl být jak reakcí na podanou léčbu, tak projevem základního onemocnění gastrointestinálního traktu. Příčinnou souvislost nebylo možno prokázat ani vyloučit.
U jednoho dítěte se po dokončení infuze vyskytly monomorfní izolované komorové extrasystoly. Arytmie patří podle SPC k řídkým, ale závažným nežádoucím reakcím při podání léku, proto byla terapie rituximabem dočasně přerušena a stav byl konzultován s kardiologem. Podle anamnézy se u chlapce na EKG vyskytly komorové extrasystoly i v době před zahájením terapie rituximabem (i když nebyl proveden EKG Holter k jejich kvantifikaci a nelze proto hodnotit, zda jsou nálezy před a po podání infuze identické). Na základě této anamnézy a také vzhledem k tomu, že EKG nálezy nebyly hemodynamicky významné, bylo rozhodnuto v terapii pokračovat a sérii dokončit.
U dvou pacientů se reakce objevila až po zvýšení rychlosti infuze nad určitou hodnotu (viz tab. 3). Korelaci mezi rychlostí infuze a výskytem akutních nežádoucích účinků demonstruje skutečnost, že nežádoucí účinky obvykle odpovídají na snížení rychlosti infuze[3, 15, 19]. Po podání medikace (viz tab. 3) a ústupu obtíží byla aplikace infuze v obou případech dokončena s nižší rychlostí bez znovuobjevení jakýchkoli dalších nežádoucích reakcí.
Dlouhodobé nežádoucí účinky
Deplece B buněk a jejich „recovery“
Pacientům byly před započetím terapie rituximabem kontrolovány hladiny CD20+ B buněk, které se u všech nacházely ve fyziologickém rozmezí pro daný věk. Terapie rituximabem byla podle očekávání spojena s deplecí těchto buněk. Průtokovou cytometrii byly vyšetřovány buňky exprimující nejen CD20 antigen, ale také CD19 znak. CD19 marker je přítomen na povrchu B lymfocytů po celu dobu jejich maturace (od stadia pre-B lymfocytu až po proces terminální diferenciace v plazmatickou buňku) [18], a vyšetření proto slouží ke kontrole, zda rituximab cílí skutečně na B lymfocyty. První kontrolní odběr krve k vyšetření průtokovou cytometrii proběhl ve vztahu k datu první dávky léku v intervalu od jednoho týdne do jednoho roku (průměr 72 dní; medián 35 dní). U dvou pacientů, u nichž byl interval příliš dlouhý (20 týdnů a 1 rok), nelze tuto postterapeutickou depleci hodnotit, jelikož jejich hladiny CD20+ B buněk již dosahují hodnot částečného či úplného „recovery“. U všech ostatních pacientů byly hodnoty CD20+ B buněk při tomto odběru nulové nebo se nule blížily.
Dobu, za kterou došlo k obnově CD20+ B buněk, lze hodnotit jen u 8 pacientů, u ostatních nebyly hladiny opakovaně vyšetřeny v dostatečném časovém odstupu od léčby. Rychlost „recovery“ B buněk se u jednotlivých pacientů lišila (tabulka 4).
Table 4. „Recovery“ CD20+ B buněk 
*U pacientů, kteří absolvovali 2 terapeutické série RTX, bylo „recovery“ B buněk hodnoceno zvlášť pro jednotlivé série a výsledky jsou prezentovány odděleně.
**V případě, že u pacienta došlo k obnově B buněk, je v tabulce uveden interval od 1. dávky RTX do doby, kdy byly poprvé naměřeny hodnoty B buněk ve fyziologickém rozmezí (parciální/ úplná obnova).
V případě, že u pacienta k obnově B buněk k fyziologickým hodnotám nedošlo, je v tabulce uveden interval od 1. dávky RTX do posledního provedeného odběru.
***Obnovu B buněk k hodnotám fyziologickým pro daný věk a zároveň k hodnotám nižším než preterapeutickým (méně než 75 % původní hodnoty) u konkrétního pacienta považujeme za obnovu parciální. Návrat hodnot k hodnotám fyziologickým a zároveň pro konkrétního pacienta před terapií běžným, nebo dokonce k hodnotám vyšším než preterapeutickým, považujeme za obnovu úplnou.
RTX – rituximab
FCM – průtoková cytometrieU 4 pacientů (2, 6, 7 a 10) z 8 došlo k úplné obnově B buněk, a to v průměru za 18 měsíců po první dávce rituximabu (medián 19 měsíců, v rozmezí 7–27 měsíců). U pacienta 1 došlo pouze k obnově parciální, zjištěné za 40 měsíců po podání první dávky léku. U pacienta 8, který absolvoval dvě terapeutické série, došlo po první z nich za 5 měsíců k obnově parciální, po druhé z nich taktéž za 5 měsíců k obnově úplné. U 2 pacientů (4 a 11) k obnově k fyziologickým hodnotám ani po delším časovém období nedošlo (měřeno za 14 a 44 měsíců po první dávce léku).
Hypogamaglobulinemie
S deplecí B buněk souvisí hypogamaglobulinemie jako jeden z možných dlouhodobých nežádoucích účinků rituximabu.
Máme možnost objektivně zhodnotit vývoj hladiny imunoglobulinů u 6 pacientů (grafy 1–6), u 2 pacientů můžeme hodnotit pouze postterapeutické hladiny protilátek, aniž bychom znali jejich hladiny před léčbou.
Graph 1. Dynamika hladiny CD20+ B buněk a IgG protilátek a jejich vzájemný vztah 
Graph 2. Dynamika hladiny CD20+ B buněk a IgG protilátek a jejich vzájemný vztah 
Graph 3. Dynamika hladiny CD20+ B buněk a IgG protilátek a jejich vzájemný vztah 
Graph 4. Dynamika hladiny CD20+ B buněk a IgG protilátek a jejich vzájemný vztah 
Graph 5. Dynamika hladiny CD20+ B buněk a IgG protilátek a jejich vzájemný vztah 
Graph 6. Dynamika hladiny CD20+ B buněk a IgG protilátek a jejich vzájemný vztah 
Pacienti 1 a 2, kterým byly IgG vyšetřovány pouze po terapii rituximabem, měli hladiny těchto protilátek ve fyziologickém rozmezí. Pacientka 3 vykazovala před terapií hodnoty IgG fyziologické, blížící se spíše dolní hranici věkové normy, po terapii protilátky klesly mírně pod tuto hranici. Pacient 4 měl před terapií rituximabem mírně sníženou hodnotu IgG, tato nicméně zůstala po léčbě stejná. U pacientky 6 se IgG drží po aplikaci léku trvale na dolní hranici normy až mírně pod ní, její preterapeutická hladina IgG byla fyziologická, spíše v horní polovině rozmezí. Pacienti 7 a 10 měli hodnoty IgG protilátek zcela fyziologické jak před léčbou, tak dlouhodobě po ní. U pacienta 8 došlo po terapii k přetrvávajícímu poklesu IgG asi na polovinu preterapeutické hodnoty, přesto hladiny zůstaly ve fyziologickém rozmezí.
V souhrnu k poklesu IgG oproti původním hodnotám došlo u 3 pacientů z oněch 6, u kterých můžeme hodnotit dynamiku protilátek před a po terapii, z toho u 2 mírně pod hranici věkové normy (pacient 3 a 6), u 1 v rámci fyziologického rozmezí (pacient 8). Zároveň lze říci, že mírnou hypogamaglobulinemii po terapii rituximabem vyvinuli 2 pacienti z 8, u kterých bylo vyšetření na IgG po léčbě provedeno, to je 25 % pacientů. U žádného ze sledovaných pacientů nedošlo k takovému poklesu, který by si vyžádal podání/podávání parenterálních přípravků gamaglobulinů. Poklesy IgG byly delší a významnější u 2 ze 3 pacientů, kteří dostali rituximab opakovaně (viz grafy 3 a 5) v porovnání s těmi, kteří dostali rituximab pouze v jedné sérii.
Odběry k vyšetření IgG po terapii u pacientů probíhaly různě v rozmezí od 2 dnů do 55 měsíců ve vztahu k první dávce I. nebo II. série rituximabu. U pacientů, u kterých se projevil pokles hladiny IgG, bylo vyšetření provedeno v rozmezí 2 dnů a 18 měsíců.
Grafy 1–6 znázorňují dynamiku hladiny CD20+ B buněk a IgG protilátek a jejich vzájemný vztah u 6 pacientů s dostupnými výsledky obou vyšetření před i po terapii rituximabem.
Infekce
U pacienta 10 léčeného pro hemofilii A s inhibitorem se 26 měsíců po podání první dávky I. série rituximabu rozvinul septický stav při bronchopneumonii s nutností hospitalizace a intravenózního podávání antibiotik. Infekce na léčbu dobře zareagovala, klinický stav se během několika dní výrazně zlepšil. Tento pacient byl léčen parenterálně podávanými antibiotiky také pro septický port (19 a 20 měsíců po první dávce II. série). Epizodu septického portu pacient nicméně prodělal i před terapií rituximabem. Perorálními antibiotiky byl pacient léčen pro infekci horních cest dýchacích, bronchitidu, pansinusitidu a tonzilitidy (v odstupu 20, 21, 22 a 26 měsíců od první dávky I. série, 18 měsíců od 1. dávky II. série). Vzhledem k úplné obnově B buněk (viz tab. 4) a fyziologickým pre - i postterapeutickým hladinám IgG protilátek lze korelaci laboratorních parametrů se zmíněnými infekcemi u tohoto pacienta vyloučit.
Pacient 11, taktéž hemofilik A s inhibitorem, byl léčen parenterálně podávanými antibiotiky jedenkrát pro febrilní infekci (v odstupu 31 měsíců od první dávky rituximabu). Vzhledem k tomu, že u tohoto pacienta nedošlo ani po delší době k obnově B buněk k fyziologickým hodnotám (viz tab. 4), spojitost mezi nízkými postterapeutickými hladinami B buněk a zmíněnou infekcí vyloučit nelze. IgG protilátky po terapii rituximabem vyšetřeny nebyly.
U žádného dalšího pacienta nebyla terapie rituximabem asociována s častějšími a/nebo závažnými infekcemi s nutností hospitalizace či intravenózní antibiotické terapie.
Efektivita terapie rituximabem
Ke zhodnocení účinnosti terapie rituximabem jsme si pro potřeby této publikace u každého laboratorního parametru definovali hraniční hodnoty, na základě kterých jsme rozhodovali, zda došlo k remisi daného onemocnění a zda šlo o remisi parciální nebo kompletní. Případný efekt terapie rituximabem by se měl projevit do několika týdnů, nejpozději však do půl roku od začátku léčby. Za dlouhodobou remisi považujeme u všech diagnóz takovou, která trvá déle než jeden rok.
Chronická imunitní trombocytopenie (CHITP)
U pacientů s CHITP (pacienti 1–5) je kritériem pro zhodnocení účinnosti terapie rituximabem hladina trombocytů v krvi. Za částečnou remisi považujeme počet trombocytů vyšší než 40 x 109/l, za kompletní remisi normalizaci počtu trombocytů vzhledem k věku pacienta. U pacientky 3 došlo k částečné remisi již jeden týden po podání první dávky rituximabu, tato remise trvala 5 měsíců a následně došlo k relapsu, pravděpodobně v souvislosti s prodělanou virovou infekcí. U ostatních čtyř pacientů k remisi nedošlo: ve třech případech byla léčba zcela bez odpovědi, u jednoho pacienta byla odpověď minimální (hodnoty trombocytů se oproti preterapeutickým mírně zvýšily, hranici částečné remise však nepřekročily). Můžeme říci, že ve skupině pacientů s diagnózou CHITP došlo k parciální remisi u 20 % sledovaných.
Autoimunitní hemolytická anémie (AIHA)
U pacientů s AIHA za částečnou remisi považujeme návrat hodnot hemoglobinu k hodnotám fyziologickým ve vztahu k věku pacienta za současného přetrvání hemolýzy. Kompletní remise je charakterizována věkovou normalizací hodnot hemoglobinu a navíc eliminací protilátek proti erytrocytům a vymizením hemolýzy. Mezi laboratorní znaky hemolýzy patří hyperbilirubinemie, retikulocytóza, která ale vzhledem k tomu, že protilátky mohou napadat i retikulocyty, přítomna být nemusí [20], dále zvýšená laktátdehydrogenáza a její poměr k aspartátaminotransferáze (vyšší LD/AST) a výrazné zvýšení volného hemoglobinu v krvi. Z klinických korelátů remise jsme zvolili jako kritérium nepřítomnost ikteru.
Pacient 8 podstoupil 2 série terapie rituximabem v odstupu necelých 9 měsíců. Po I. cyklu hladina hemoglobinu pozvolna narůstala, počet retikulocytů postupně klesal a fyziologických hodnot vzhledem k věku pacienta tyto parametry dosáhly 11 týdnů po 1. dávce rituximabu. Osm týdnů po 1. dávce se normalizoval také celkový bilirubin, hladina laktátdehydrogenázy se výrazně snížila, ale fyziologických hodnot nedosáhla. Pacient měl po celou dobu také výrazně pozitivní antierytrocytární protilátky. Bylo dosaženo parciální remise, ale 5 měsíců po rituximabu terapii došlo pravděpodobně v souvislosti s horečnatou infekcí k relapsu s opětovným prohloubením hemolýzy a poklesem hemoglobinu. Série rituximabu byla po 9 měsících zopakována, 8 týdnů po 1. dávce II. série opět došlo k normalizaci hemoglobinu a bilirubinu, ke snížení laktátdehydrogenázy a poklesu retikulocytů za výrazné pozitivity antierytrocytárních protilátek. Bylo znovu dosaženo parciální remise onemocnění, trvala však jen 2 měsíce a následně došlo opět k relapsu.
U pacientky 9 došlo k věkové normalizaci hladiny hemoglobinu 5 týdnů po 1. dávce rituximabu. Ve fyziologickém rozmezí se hodnoty hemoglobinu drží již po dobu 3 let od aplikace rituximabu. V řádu týdnů po terapii došlo postupně také k signifikantnímu snížení počtu retikulocytů, k výraznému poklesu celkového bilirubinu i laktátdehydrogenázy v krvi, nikoli však k normalizaci těchto parametrů. Známky hemolýzy přetrvávaly nejméně 1 rok po léčbě rituximabem. Vyšetření provedené 2 roky po terapii již prokázalo hodnoty fyziologické, došlo také k vymizení preterapeuticky přítomných antierytrocytárních protilátek. Podle výše definovaných kritérií můžeme říci, že pacientka po terapii rituximabem dosáhla dlouhodobé remise, která se po dobu jednoho roku po léčbě dá považovat vzhledem k přetrvávající hemolýze za remisi parciální, následující 2 roky vzhledem k vymizení hemolýzy za remisi kompletní. Je však nutno vzít v úvahu, že pacientce byl rok a půl po terapii rituximabem diagnostikován morbus Crohn, nasazena perorální kortikoterapie, azathioprin, mesalazin, později metotrexát a biologická léčba (adalimumab). Vliv této imunosupresivní terapie na aktivitu krevní hemolýzy je pravděpodobný, a proto není možno přikládat efekt kompletní remise pouze terapii rituximabem. Parciální remise (normalizace hladin hemoglobinu a snížení hemolytických parametrů) byla naopak nesporně přímým následkem léčby rituximabem. Dynamiku hematologických a biochemických parametrů této pacientky zobrazují grafy 7 a 8.
Graph 7. Dynamika hematologických parametrů u pacientky léčené rituximabem pro AIHA 
Graph 8. Dynamika biochemických parametrů u pacientky léčené rituximabem pro AIHA 
Můžeme říci, že u pacientů léčených rituximabem pro AIHA bylo dosaženo parciální remise ve 100 % případů, z toho v 50 % došlo s odstupem času k dosažení kritérií remise kompletní. Tento efekt však nelze přikládat pouze terapii rituximabem, protože pacientka byla následně léčena kombinovanou imunosupresivní terapií pro nově diagnostikovanou Crohnovu nemoc.
Evansův syndrom
Pacientka 6, léčená pro Evansův syndrom s trombocytopenií a hemolytickou anémií s tepelnými protilátkami absolvovala dvě terapeutické kúry rituximabu, v obou případech s velmi dobrou odpovědí. Osm týdnů po aplikaci 1. dávky I. série léčby došlo k normalizaci hodnot hemoglobinu a k vymizení hemolýzy. Screeningové vyšetření antierytrocytárních protilátek bylo provedeno 7 měsíců po podání 1. dávky I. série a bylo vyhodnoceno jako negativní. Hodnoty trombocytů se postupně normalizovaly, zcela fyziologické byly 3 měsíce po 1. dávce léku. Pacientka po I. sérii terapie rituximabem dosáhla kompletní remise. K relapsu došlo 11 měsíců po 1. dávce I. série. Bylo zjištěno výrazné snížení počtu trombocytů, opět se objevila pozitivita screeningového testu na antierytrocytární protilátky, avšak k hemolýze a k výraznějšímu poklesu hemoglobinu již nedošlo. Vzhledem k předchozí dobré odpovědi na terapii rituximabem bylo rozhodnuto v odstupu 14 měsíců od I. série tuto zopakovat a skutečně 3 týdny po 1. dávce II. cyklu bylo znovu dosaženo dlouhodobé kompletní remise s vymizením autoprotilátek proti erytrocytům. K opětovnému relapsu došlo 16 měsíců po 1. dávce II. série. Dynamiku počtu trombocytů a hladiny hemoglobinu v krvi této pacientky demonstruje graf 9.
Graph 9. Dynamika počtu trombocytů a hladiny hemoglobinu u pacientky léčené rituximabem pro syndrom Evanse s trombocytopenií a hemolytickou anémií 
Pacient 7 léčený pro Evansův syndrom s trombocytopenií a neutropenií remise po terapii nedosáhl, odpověď na léčbu byla pouze minimální. Kritéria pro hodnocení hladiny trombocytů a míry hemolýzy byla zmíněna výše, pro neutrofily je za částečnou remisi považována hodnota absolutního počtu neutrofilů (ANC) nad 1 x 109/l, za kompletní remisi je pokládán návrat hodnot ANC k hodnotám normálním ve vztahu k věku pacienta. Z pacientů léčených pro Evansův syndrom dosáhlo kompletní remise 50 % sledovaných.
Hemofilie A s inhibitorem FVIII
Ukazatelem efektu léčby rituximabem u pacientů s hemofilií A s inhibitory je pokles nebo úplná eliminace inhibitoru FVIII. Parciální remise je pro potřeby této práce definována jako pokles hladiny inhibitoru FVIII pod 5 Bethesda jednotek (BU), remise kompletní jako pokles hladiny inhibitoru FVIII pod 0,6 BU (do této hodnoty se hladina inhibitoru považuje za negativní). Mezi kritéria úplné remise u hemofiliků s inhibitorem dále patří normalizace poločasu FVIII a normalizace „recovery“, jež byly rovněž sledovány, ale nejsou zde explicitně zmíněny.
Pacient 10 absolvoval 2 terapeutické série rituximabu v odstupu 5 let. V obou případech došlo k signifikantnímu snížení inhibitoru FVIII v krvi pacienta. Dynamiku hladiny inhibitoru FVIII v krvi demonstruje graf 10. V průběhu 9 měsíců před zahájením I. série léčby rituximabem byla hladina inhibitoru v rozmezí 1,3–5,2 BU (průměr 2,81 BU; medián 2,32 BU). Po terapii rituximabem (vyhodnocována byla data z následujících 4 let a 9 měsíců) se hladina inhibitoru pohybovala v rozmezí 0–1,28 BU (průměr 0,61 BU; medián 0,62 BU). Je patrný výrazný postterapeutický pokles hodnot inhibitoru FVIII, ke znatelnému snížení došlo již jeden týden po 1. dávce rituximabu. K opětovnému vzestupu hladiny inhibitoru FVIII došlo 4 roky a 10 měsíců od I. série rituximabu. Měsíc a půl před zahájením II. cyklu RTX se hladina inhibitoru pohybovala v rozmezí 1,44–4,88 BU (průměr 2,62 BU; medián 2,12 BU). Po 5 letech byla terapie zopakována znovu s dobrou odpovědí. Po dobu 6 let od II. cyklu se hladina inhibitoru pohybuje v rozmezí 0–3,64 BU (průměr 0,71 BU; medián 0,48 BU). Vyšší hodnota horní hranice uvedeného intervalu je dána latencí nástupu účinku léku – ke snížení inhibitoru došlo 4 měsíce po 1. dávce II. série, tedy výrazně později než po I. sérii. Vzhledem k tomu, že se hladina inhibitoru nedrží trvale pod hraniční hodnotou 0,6 BU, považujeme stav po I. i II. sérii za parciální remisi.
Graph 10. Dynamika inhibitoru FVIII u pacienta léčeného rituximabem pro hemofilii A s inhibitorem 
Je třeba rovněž dodat, že po celou dobu sledování (a v podstatě po celou dobu svého života) je daný pacient léčen pravidelným podáváním FVIII v různých režimech. Opakované podávání substance, proti které je vytvořena protilátka (inhibitor), je považováno za imunotoleranční léčbu. Ta bezpochyby modifikuje i hodnoty neutralizujících protilátek/inhibitorů. Pakliže by tato léčba podávána nebyla, nelze vyloučit, že by hladiny inhibitorů ve sledovaném období byly vyšší. Efekt imunotoleranční léčby opakovaným podáváním FVIII (ITT) a konkomitantní imunosupresí pomocí rituximabu (IS) od sebe nelze oddělit. V neposlední řadě je pak literárně doloženo, že tam, kde je u osob s hemofilií vymizení inhibitorů dosaženo pomocí imunosuprese, je navození imunotolerance sice dosaženo v kratším čase, ale riziko relapsu je větší, než když je použita samotná ITT. Na druhou stranu použití imunosuprese rituximabem bez konkomitantní léčby FVIII nebývá úspěšné téměř nikdy [21–24]. Diferencovat tedy od sebe spolehlivě efekt ITT a IS je u osob s hemofilí A a inhibitory obtížné.
U pacienta 11 k vymizení ani k signifikantnímu snížení inhibitoru po terapii rituximabem nedošlo.
V této indikaci (cílem léčby je snížení hladiny/eliminace inhibitoru FVIII při hemofilii A) se podařilo dosáhnout parciální odpovědi u 50 % sledovaných.
Ve skupině jedenácti rituximabem léčených pacientů bylo dosaženo alespoň parciální remise u 5 z nich – tabulka 5 (u jednoho pacienta s CHITP, u dvou pacientů s AIHA, u jednoho se syndromem Evanse s trombocytopenií a anémií a u jednoho hemofilika s inhibitorem FVIII). Vzhledem k tomu, že 3 z těchto 5 pacientů absolvovali po 2 sériích rituximabu, hodnotili jsme odpověď celkem u 8 léčebných pokusů. V 6 případech (u 4 pacientů) bylo dosaženo parciální remise (u jednoho z nich došlo následně po roce od terapie rituximabem ke splnění kritérií kompletní remise), ve 2 případech (u 1 pacienta) bylo dosaženo přímo remise kompletní.
Table 5. Hodnocení efektivity terapie RTX 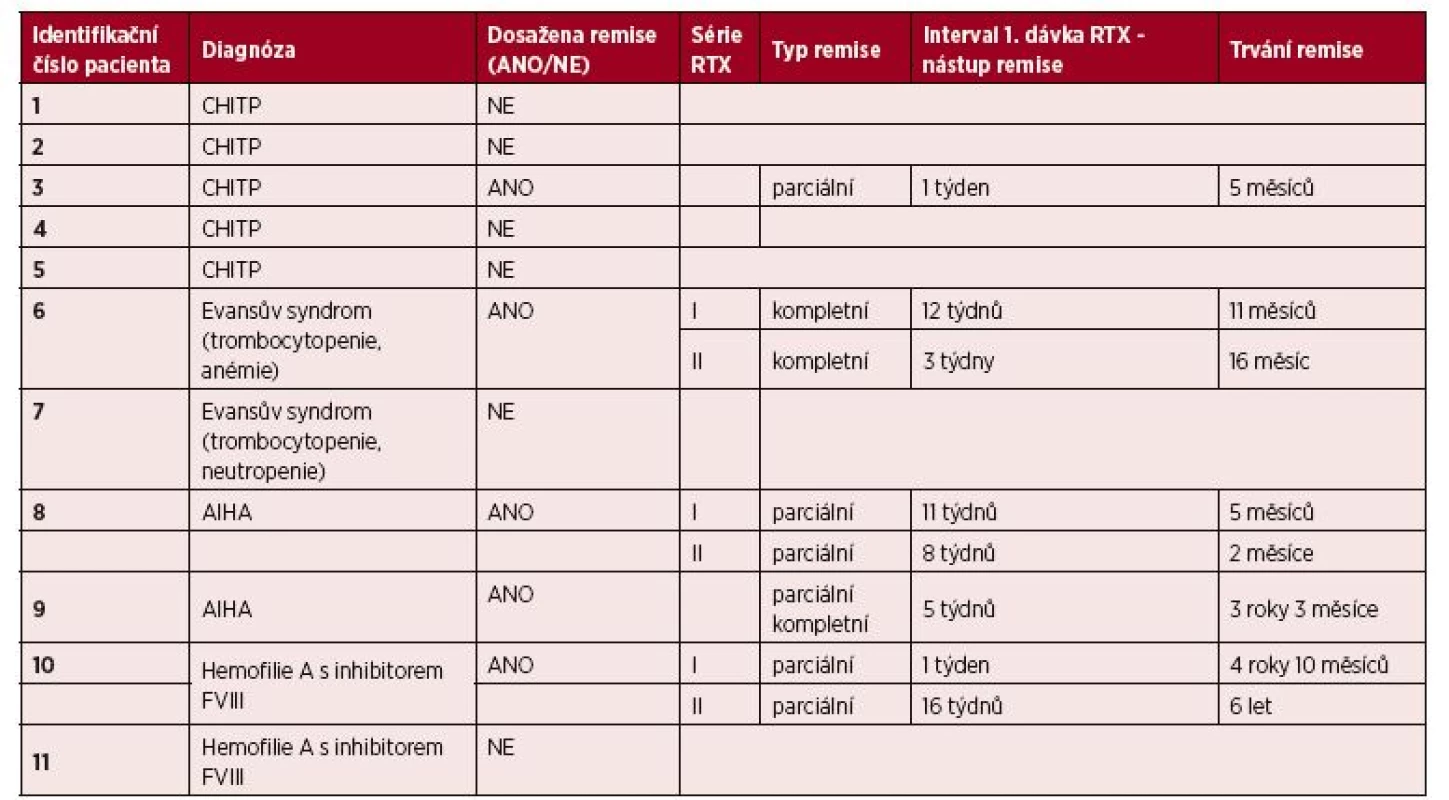
CHITP – chronická imunitní trombocytopenická purpura
AIHA – autoimunitní hemolytická anémie
RTX – rituximabSouhrnně můžeme říci, že remise bylo dosaženo u 45,5 % sledovaných pacientů (36,5 % pacientů dosáhlo remise parciální, 9 % pacientů remise kompletní), celkem u 57,1 % léčebných pokusů (viz tab. 5). Pacienti dosáhli remise onemocnění v intervalu od 1 do 16 týdnů (průměr 7,1 týdnů; medián 6,5 týdnů) a tato remise trvala od 2 měsíců do 6 let (průměr 26 měsíců; medi án 16 měsíců). Pouze u 3 pacientů bylo dosaženo remise dlouhodobé (27,3 % sledovaných), tedy trvající déle než 12 měsíců.
ZÁVĚRY
V průběhu infuzní aplikace rituximabu došlo v našem souboru u 5 pacientů (45,5 % sledovaných) k určitému typu nežádoucí reakce (tab. 3), ale ani v jednom případě nebyla tato reakce závažná a terapie rituximabem nemusela být předčasně ukončena.
Vzhledem k tomu, že data byla shromažďována retrospektivně, neměli jsme k dispozici výsledky některých vyšetření u všech sledovaných (vyšetření například nebyla provedena v dostatečném časovém odstupu od léčby rituximabem nebo nebyla provedena vůbec), a některé parametry proto nelze hodnotit u celého souboru pacientů.
Postterapeutický pokles CD20+ buněk bylo možno hodnotit u 9 pacientů. U všech došlo podle očekávání k poklesu CD20+ B buněk k nulovým hodnotám. „Recovery“ těchto buněk (zda a za jakou dobu došlo k obnově B buněk) můžeme hodnotit u 8 pacientů. U 2 z nich (25 %) k obnově B buněk ve sledovaném období nedošlo (viz tab. 4). U jednoho z těchto pacientů se v odstupu 31 měsíců od léčby vyskytla infekce s nutností léčby za hospitalizace, jejíž spojitost s přetrvávajícími nízkými hodnotami B buněk nelze vyloučit (IgG vyšetřeny nebyly). Závažné infekční komplikace se objevily také u pacienta, jehož postterapeutické hladiny B buněk i IgG byly opakovaně zcela fyziologické, proto u tohoto pacienta byla naopak korelace mezi laboratorními hodnotami a infekcemi vyloučena. Žádné další infekční komplikace zaznamenány nebyly. Závažnější infekce jako možný následek terapie rituximabem se tedy vyskytla u 1 z 11 pacientů (u 9,1 % sledovaných).
U žádného z pacientů se nerozvinula klinicky závažná hypogamaglobulinemie (taková, která by vyžadovala substituci imunoglobulinů). K postterapeutickému poklesu IgG pod dolní hranici věkové normy nicméně došlo u 2 z 8 (25 %) pacientů, u nichž byly údaje o IgG k dispozici (viz grafy 1 a 3). Ani u jednoho z těchto pacientů nebyl pokles IgG asociován s výskytem závažné infekce. Vzhledem k retrospektivnímu sběru dat a omezené délce sledování nelze říci, jak dlouho hypogamaglobulinemie po terapii rituximabem u těchto pacientů trvala. Lze však konstatovat, že u jednoho z pacientů přetrvávala nejméně po dobu 4 měsíců, u druhého nejméně po dobu 18 měsíců od podání 1. dávky rituximabu.
Můžeme říci, že závěry našeho retrospektivního sledování týkající se bezpečnosti užití léku podporují současná literární doporučení řadit léčbu rituximabem do linie druhé volby v terapii autoimunitních chorob. Nebezpečí závažných nežádoucích účinků sice není velké, avšak není ani zcela zanedbatelné.
Léčbu rituximabem lze v našem souboru pacientů považovat za efektivní u 45,5 % pacientů (viz tab. 5). Kompletní remise bylo dosaženo u 9 % pacientů, parciální remise u 36,5 % pacientů. Dlouhodobé remise trvající déle než 1 rok dosáhlo 27,3 % sledovaných.
Rituximab tedy lze považovat za lék relativně bezpečný a efektivní, pravděpodobnost dlouhodobého trvání remise však není velká. To je podle našeho názoru důvodem pátrat po dalších možnostech, jak v současnosti i v budoucnu ovlivnit autoimunitní onemocnění u dětí.
Seznam zkratek
IgG – imunoglobulin G
RTX – rituximab
CHITP – chronická imunitní trombocytopenická purpura
AIHA – autoimunitní hemolytická anémie
ANC – absolute neutrophil count
BU – Bethesda Unit
ITT – imunotoleranční terapie
IS – imunosuprese
FVIII – koagulační faktor VIII
Podíl autorů na přípravě rukopisu
VL – shromáždění, analýza a interpretace dat, příprava rukopisu
HS – doplnění a revize rukopisu
VF, OZ, SK – diagnostika, léčba a klinické sledování pacientů, evidence dat
JB – ideový námět práce, interpretace dat, doplnění, úpravy, revize a korektury rukopisu
Prohlášení o konfliktu zájmů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Rádi bychom na tomto místě poděkovali lékařkám Aleně Pejchalové, Haně Vinohradské, Libuši Janků a Ing. Olze Stehlíkové za jejich odborné konzultace.
Doručeno do redakce dne 5. 4. 2018.
Přijato po recenzi dne 16. 5. 2018.
MUDr. Jan Blatný, Ph.D.
Oddělení dětské hematologie FN Brno
Černopolní 9
613 00 Brno
e-mail: blatny.jan@fnbrno.cz
Sources
1. Pescovitz MD. Rituximab, an Anti-CD20 monoclonal antibody: history and mechanism of action. Am J Transplant 2006;5p1(6):859–866.
2. Randall KL. Rituximab in autoimmune diseases. Austr Prescriber 2016;4(39):131–134.
3. El-Hallak M, Binstadt BA, Leichtner AM, et al. Clinical effects and safety of rituximab for treatment of refractory pediatric autoimmune diseases. J Ped 2007;4(150):376–382.
4. Cooper N, Arnold DM. The effect of rituximab on humoral and cell mediated immunity and infection in the treatment of autoimmune diseases. Br J Haematol 2010;1(149):3–13.
5. Smith MR. Rituximab (monoclonal anti-CD20 antibody): mechanisms of action and resistance. Oncogene 2003;22(47):7359–7368.
6. Harb D. The off-label use of rituximab for the management of inflammatory disorders: American University of Beirut Medical Center experience. Arch Rheumatol 2014;29(3):194–202.
7. Butterly SJ, Pillans P, Horn B, Miles R, Sturtevant J. Off-label use of rituximab in a tertiary Queensland hospital. Int Med J 2010;40(6):443–452.
8. Etemadifar M, Salari M, Mirmosayyeb O, et al. Efficacy and safety of rituximab in neuromyelitis optica: Review of evidence. J Res Med Sci 2016;21(11):1–7.
9. Kumar D, Roubey RA. Use of rituximab in the antiphospholipid syndrome. Cur Rheumatol Rep 2010;12(1):40–44.
10. Nieto-Rios JF, De Los Ríos SMG, Serna-Higuita LM, et al. Treatment of post-transplantation lymphoproliferative disorders after kidney transplant with rituximab and conversion to m-TOR inhibitor. Colombia Med 2016;47(4):196–202.
11. Van Vollenhoven RF, Emery P, Bingham CO, et al. Longterm safety of patients receiving rituximab in rheumatoid arthritis clinical trials. Roman J Rheumatol 2010;19(1):20–30.
12. Levin AS, Otani IM, Lax T, Hochberg E, Banerji A. Reactions to rituximab in an outpatient infusion center. J Allergy Clin Immunol In Pract 2017;5(1):107–113.
13. Froissart A, Veyradier A, Hié M, Benhamou Y, Coppo P. Rituximab in autoimmune thrombotic thrombocytopenic purpura. Eur J Int Med 2015;26(9):659–665.
14. Roberts DM, Jones RB, Smith RM, et al. Rituximab-associated hypogammaglobulinemia: Incidence, predictors and outcomes in patients with multi-system autoimmune disease. J Autoimmun 2015;57 : 60–65.
15. Brown BA, Torabi M. Incidence of infusion-associatedr with rituximab for treating multiple sclerosis. Drug Safety 2011;34(2):117–123.
16. Pritchard CH, Greenwald MW, Kremer JM, et al. Safety of infusing rituximab at a more rapid rate in patients with rheumatoid arthritis: results from the RATE-RA study. BMC Musculoskeletal Disorders 2014;15(1):1–18.
17. Šimkovič M, Vodárek P, Motyčková M, Žák P, Smolej L. Infuzní toxicita rituximabu u nemocných s chronickou lymfocytární leukemií. Vnitř Lék 2015;61(7–8):626–632.
18. Kemeng W, Guoqing W, Delong L. CD19: a biomarker for B cell development, lymphoma diagnosis and therapy. Exp Hematol 2012;1(1):36.
19. SPC (Mabthera, Roche). Dostupné na www: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/000165/WC500025821.pdf.
20. Lawrence DP, Garratty G. Immune hemolytic anemias. 2. vyd. Philadelphia, Churchill Livingstone, 2004; p. 69–70.
21. Robertson JD, Higgins P, Price J, Dunkley S, Barrese G, Curtin J. Immune tolerance induction using a factor VIII/von Willebrand factor concentrate, with or without immunosuppression, in Australian paediatric severe haemophilia A patients with high titre inhibitors: A multicentre, retrospective study. Thromb Res 2014;134(5):1046–1051.
22. Collins PW, Mathias M, Hanley M, et al. Rituximab and immune tolerance in severe hemophilia A: a consecutive national cohort. J Thromb Haemost 2009;7(5):787–794.
23. Franchini M, Mengoli C, Lippi G, et al. Immune tolerance with rituximab in congenital haemophilia with inhibitors: a systematic literature review based on individual patients’ analysis. Haemophilia 2008;14(5):903–912.
24. Carcao M, St Louis J, Poon MC, et al. Rituximab for congenital haemophiliacs with inhibitors: a Canadian experience. Haemophilia 2006;12(1):7–18.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2018 Issue 4-
All articles in this issue
- Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny
- Vplyv nádorového metabolizmu na terapiu detských leukémií
- Registr dárců plné krve – srovnání dat 12 zařízení transfuzní služby v letech 2008 a 2016
- Bezpečnost a efektivita léčby rituximabem u dětí s autoimunitním onemocněním
- Dlouhodobé výsledky alogenních transplantací krvetvorných buněk u 533 pacientů: zkušenost jednoho centra
- Dlouhodobě skladované kryokonzervované transplantáty a jejich likvidace
- Prevence infekčních stavů u hematologických pacientů po splenektomii a s funkčním hyposplenismem – doporučení CzEch Leukemia Study Group for Life (CELL)
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Zvýšená hladina kalcia může být prvním příznakem mnohočetného myelomu, ale může mít i jiné příčiny
- Prevence infekčních stavů u hematologických pacientů po splenektomii a s funkčním hyposplenismem – doporučení CzEch Leukemia Study Group for Life (CELL)
- Dlouhodobé výsledky alogenních transplantací krvetvorných buněk u 533 pacientů: zkušenost jednoho centra
- Dlouhodobě skladované kryokonzervované transplantáty a jejich likvidace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

