-
Medical journals
- Career
Život ohrožující orgánové infiltrace u akutní myeloidní leukemie – kazuistiky
Authors: T. Karvunidis 1; 2; J. Raděj 1,2; D. Lysák 2,3; M. Matějovič 1,2
Authors‘ workplace: I. interní klinika, Lékařská fakulta v Plzni, Univerzita Karlova a Fakultní nemocnice Plzeň 1; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova 2; Hematologicko-onkologické oddělení, Fakultní nemocnice Plzeň 3
Published in: Transfuze Hematol. dnes,24, 2018, No. 2, p. 123-127.
Category: Case Reports
Overview
Soubor kazuistik popisuje dva případy kriticky stonajících nemocných s nově diagnostikovanou akutní myeloidní leukemií. Stručně diskutuje o významu extramedulární leukemické infiltrace orgánů na jejich dysfunkci, průběh stonání a léčbu. Současně také poukazuje na rychlou deterioraci klinického stavu, relativně typickou pro tento typ nemocných, a tedy i nutnost včasné terapeutické intervence.
Klíčová slova:
akutní myeloidní leukemie – leukemická infiltrace – intenzivní péče – orgánové selhání
KAZUISTIKA 1
Šedesátišestiletá obézní hypertonička, diabetička s dobrou kvalitou života a funkčním stavem byla přijata na standardní lůžko hematologicko-onkologického oddělení s podezřením na akutní myeloidní leukemii (AML) s hyperleukocytózou k další diagnostice a zahájení léčby. Již vstupně byla přítomna těžká trombocytopenie, klinické a laboratorní známky systémové infekce a víceorgánového poškození (tab. 1). Byla zahájena cytoredukční léčba hydroxyureou a empirická antimikrobiální léčba. Následující den došlo k rozvoji hypotenze tranzitorně reagující na volumoexpanzi, navazující poruše vědomí (sopor) a respirační insuficienci s klidovou dušností a hypoxií. Za pokračující tekutinové resuscitace byla nemocná přeložena na jednotku intenzivní péče (JIP). Stav měl charakteristiku hypovolemického šoku, respektive šoku kombinovaného – hypovolemického a distribučního/septického. Bezprostředně po přijetí byla nezbytná významná podpora vazopresorem (noradrenalin), orotracheální intubace a zahájení umělé plicní ventilace (UPV). Progredující anémie, trombocytopenie, metabolická acidóza (MAC) s hyperlaktatemií a hemodynamika s velkou pravděpodobností svědčila pro aktivní krvácení. Bed-side ultrasonografii (USG) byla identifikovaná volná tekutina v dutině břišní (cca 500–700 ml) a také subkapsulární hematom zvětšené sleziny (obr. 1). Za pokračující resuscitace hemodynamiky, substituce transfuzními přípravky a po krátké kardiopulmonální resuscitaci (KPR, respektive rozšířené KPR – advanced life support, ALS) pro hyposystolii byla nemocná transportována k urgentní splenektomii a tamponádě lůžka sleziny. Tento postup vedl k hemostáze, hemodynamickou stabilizaci však nenavodil. V následujících dvou dnech se do popředí dostal šok septický při pneumonii (susp. mykotické) a současné klostridiové enterokolitidě. I přes další empirickou i cílenou extenzi antimikrobiální léčby nedošlo ani k částečné kontrole systémové infekce, progredovalo multiorgánové poškození (játra, ledviny, koagulace, hemodynamika, plíce atd.) a šok se stal dále zcela refrakterním k léčbě včetně resuscitačních opatření. Za pokračující resuscitační léčby pak nemocná zemřela pátý den hospitalizace.
Image 1. USG sleziny s vyznačeným subkapsulárním hematomem. 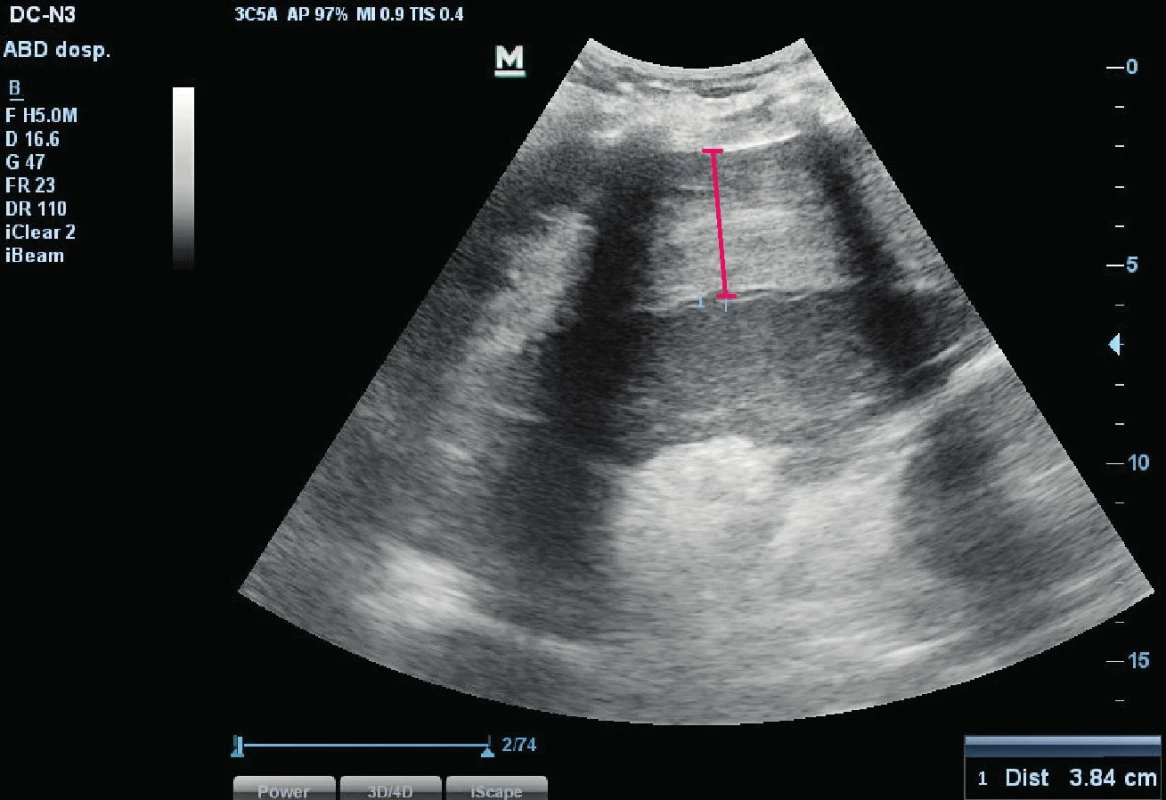
Table 1. Kazuistika 1 – vybrané laboratorní parametry 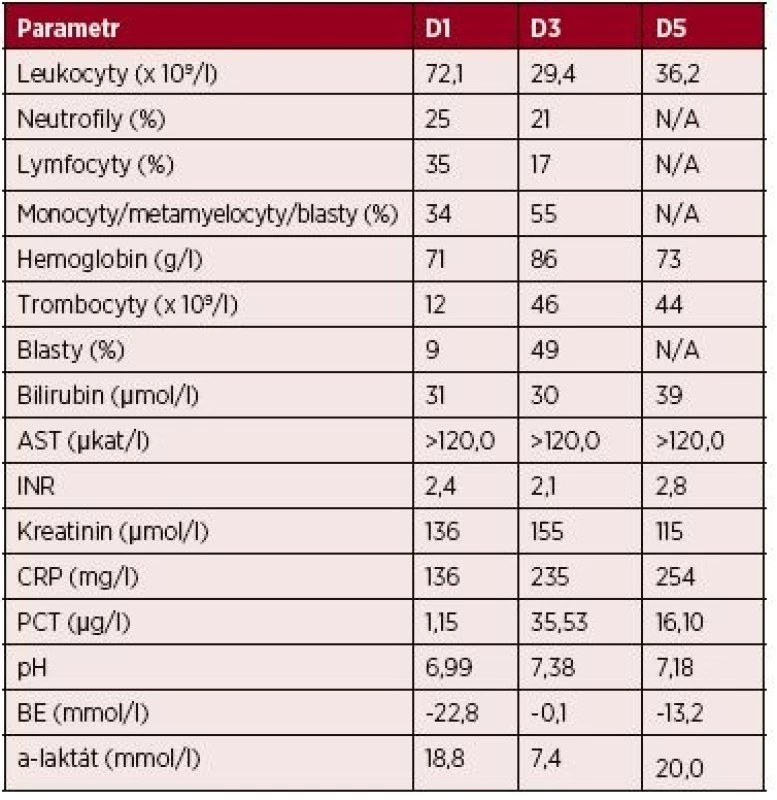
Vysvětlivky: D1 až 5– den 1.–5. hospitalizace na JIP; AST – aspartátaminotransferáza; INR – international normalized ratio (PT); CRP – C-reaktivní protein; PCT – prokalcitonin; BE – base-excess; N/A – neprovedeno, hodnota nedostupná Provedená patologicko-anatomická pitva prokázala histologickým vyšetřením rozsáhlou leukemickou infiltraci (myeloblasty) nejen kostní dřeně, ale i sleziny, jater, nadbráničních i nitrobřišních lymfatických uzlin, myokardu, plic, tenkého i tlustého střeva, nadledvin i ledvin (obr. 2 – A, B, C). Současně jako pravděpodobné zdroje infekce označila plíce (v. s. mykotická infekce) a tlusté střevo (transmurální zánětlivá infiltrace; kolitida). Vzhledem k perakutnímu průběhu stonání nebyla doplněna další podrobná diagnostika a konfirmace AML, a to ani z nekroptických vzorků tkání.
Image 2. Kazuistika 1– histologický obraz leukemické infiltrace orgánů 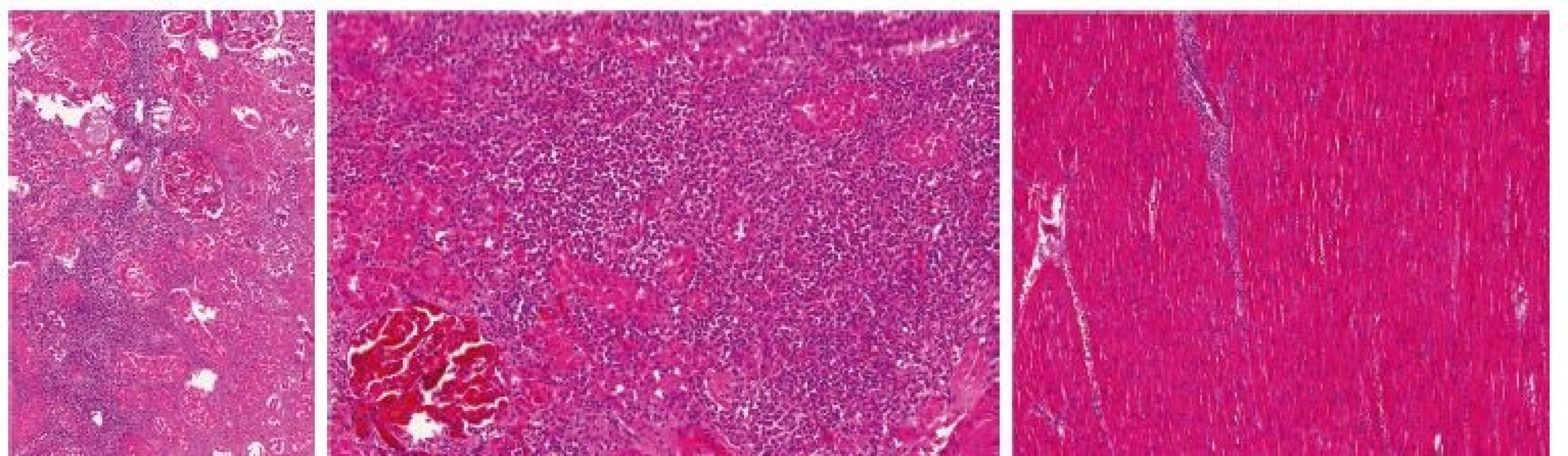
A – ledvina, B – ledvina – detail, C – myokard KAZUISTIKA 2
Šedesátipětiletá dosud interně nestonající žena s výbornou kvalitou života a funkčním stavem byla přijata na kliniku ortopedie a traumatologie pro traumatickou frakturu obratlového těla L1. Vstupní laboratorní screening ukazoval pouze lehkou normocytární normochromní anémii. Nekomplikovaně byla provedena transpedikulární stabilizace Th11–L3. Pátý pooperační den došlo k rychlému rozvoji a progresi dušnosti s hypoxií, tachypnoí a tachykardií. Provedená CT angiografie prokázala oboustrannou subsegmentární plicní embolizaci s akutním cor pulmonale a pravostrannou pneumonii. Laboratorně byla nově zjištěna hyperleukocytóza s přítomností blastů a těžkou trombocytopenií (tab. 2). Nemocná byla přeložena na JIP. Zde byla extendována antimikrobiální léčba, subrenálně zaveden kavální filtr vzhledem ke kontraindikaci antikoagulační léčby při zmíněné trombocytopenii a doplněna diagnostika s potvrzením akutní myeloidní leukemie (AML M5; dvě populace blastů s monocytárním imunofenotypem). Cytogenetické vyšetření neprokázalo žádné strukturální ani početní chromozomální aberace. Následně byla zahájena indukční chemoterapie (cytosinarabinosid + idarubicin; „7 + 3“). Bed-side transtorakální echokardiografické vyšetření (TTE) prokázalo mírnou dilataci a dysfunkci pravé srdeční komory (PKS), absenci postižení levé srdeční komory (LKS) a přítomnost stopového cirkulárního perikardiálního výpotku. Stav nemocné se v dalších dnech parciálně stabilizoval. Pátý den hospitalizace na JIP však došlo k recidivě klidové dušnosti s hypoxií, tachypnoí, tachykardií, k oběhové nestabilitě s hypotenzí a rozvoji metabolické acidózy s hyperlaktatemií (tab. 2). Současně nemocná udávala tupou bolest při pohmatu v pravém podžebří a středním epigastriu. CT vyšetření ukázalo stacionární nález v plicním parenchymu, vyloučilo intraabdominální katastrofu (např. viscerální ischemii). Zásadním nálezem byla významná progrese perikardiálního výpot-ku o vyšší denzitě (35–50 HU) dosahujícím až 30 mm za LKS. Vzhledem k další rychlé deterioraci vitálních funkcí byla nemocná připojena na UPV a byla zahájena podpora vazopresorem (noradrenalin). TTE vyšetření následně potvrdilo hemodynamicky významný perikardiální výpotek. S ohledem na objem, distribuci a dynamiku progrese výpotku a klinický stav nemocné bylo možné mluvit o srdeční tamponádě. Po částečné korekci trombocytopenie byla provedena TTE navigovaná punkce perikardu v oblasti hrotu a do perikardiálního vaku byl zaveden tenký drén (pig-tail). Všechna tato diagnostická a terapeutická opatření se podařilo uskutečnit cca do 2 hodin od vzniku obtíží. Z perikardu bylo odsáto přibližně 50 ml tmavé krve, další evakuace se nedařila. Současně docházelo k další progresivní deterioraci stavu nemocné, horšila se MAC, laktatemie i anémie (viz tab. 2). USG vyloučilo pneumotorax a TTE prokazovalo identickou separaci perikardu výpotkem. V následujících minutách došlo k náhlé zástavě oběhu (NZO) při hyposystolii, respektive bezpulzové elektrické aktivitě (pulsless electrical activity, PEA). Bezprostředně byla zahájena KPR/ALS včetně mechanizované nepřímé srdeční masáže (LUCAS II) a korekce anémie, trombocytopenie a koagulopatie. Ze zvažovaných příčin byla stále na prvním místě srdeční tamponáda. Přizvaný kardiochirurg za pokračující KPR/ALS odstranil stávající a zavedl nový silnější drén do perikardu s evakuací cca 400–500 ml krve. Ani toto opatření však nevedlo ke zlepšení a obnovení spontánní cirkulace. PEA přešla v asystolii. V rámci probíhající KPR/ALS jsme se jako k ultimativnímu řešení rozhodli provést sternotomie a perikardiotomie na lůžku JIP. Kardiochirurg při tomto evakuoval další velké množství tmavé krve z perikardu, pokračoval v přímé masáži srdce a ozřejmil několikamilimetrovou laceraci ve střední části stěny PKS. I při jejím tamponování, pokračující přímé srdeční masáži a dalších opatřeních se stav stal refrakterním a resuscitace byla po 60 minutách ukončena, celkem po necelých 5 hodinách od začátku nových obtíží.
Table 2. Kazuistika 2 – vybrané laboratorní parametry 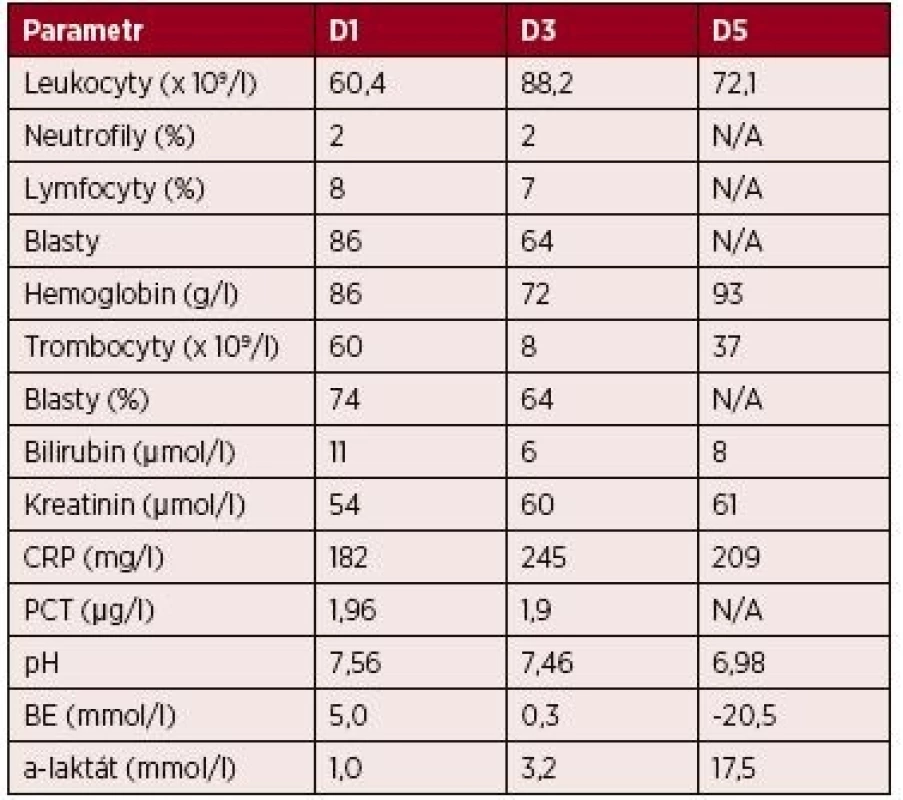
Vysvětlivky: D1 až 5 – den 1–5 hospitalizace na JIP; CRP – C-reaktivní protein; PCT – prokalcitonin; BE – base-excess; N/A – neprovedeno, hodnota nedostupná. Patologicko-anatomická pitva ukázala obdobně jako v předchozím případě excesivní orgánovou infiltraci myeloidními blasty, zejména srdce – myokardu, endokardu i perikardu (obr. 3 – A), dále také jater a sleziny, ledvin i plic. Potvrdila také fibrinózní perikarditidu a laceraci PKS (3 mm) (obr. 3 – B a obr. 4).
Image 3. Kazuistika 2 – histologický obraz leukemické infiltrace orgánů 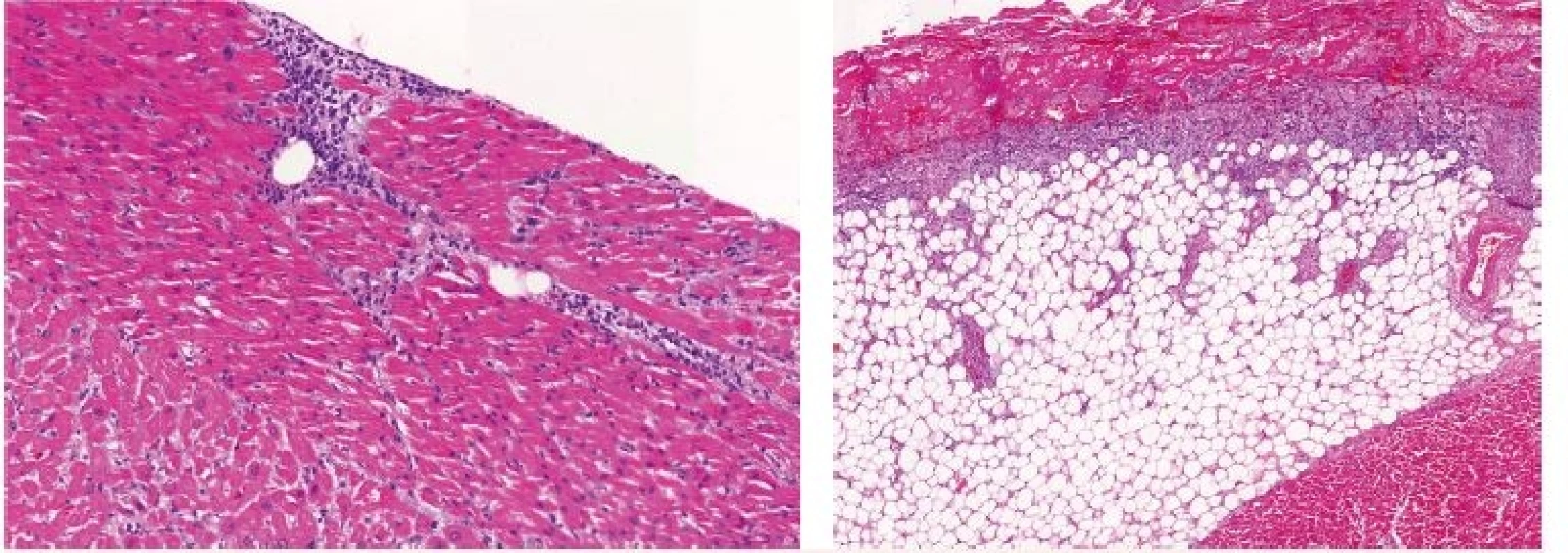
A – myokard, B – perikard. Image 4. Kazuistika 2 – pitevní nález lacerace pravé komory srdeční 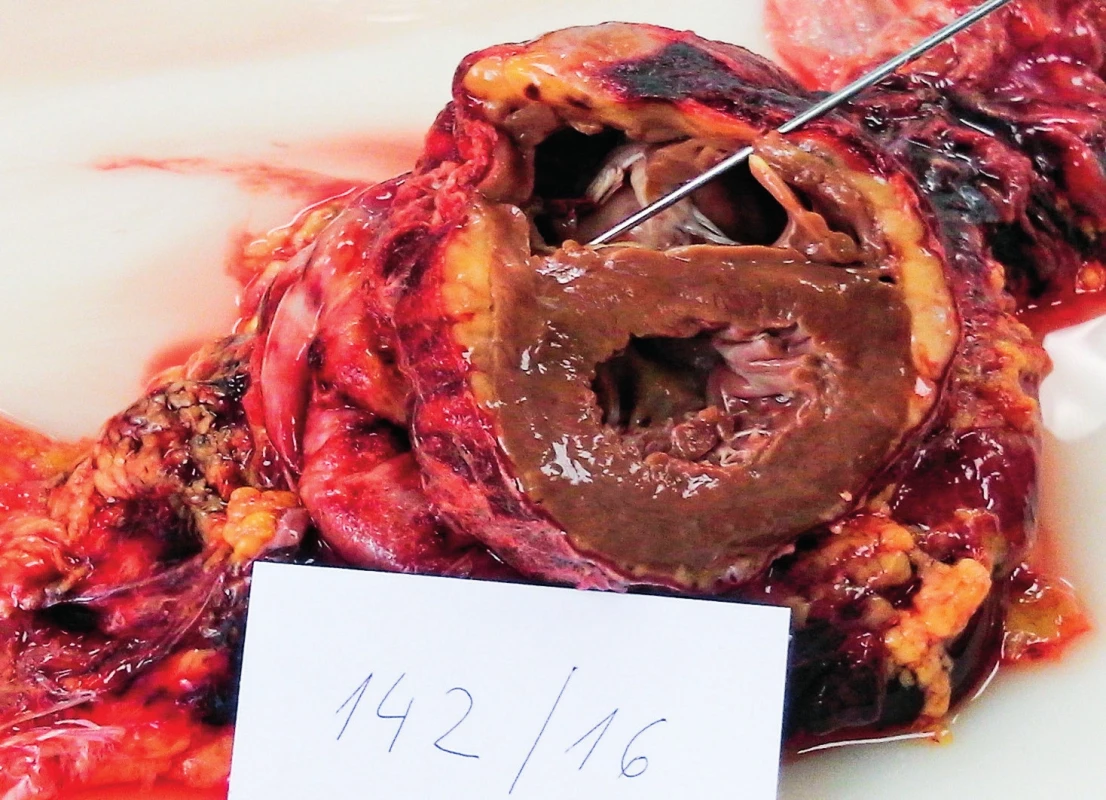
DISKUSE
Infiltrace tkání a orgánů u AML není zdaleka raritní [1]. Chudá literární data uvádějí široké rozmezí incidence od 2 % do 40 % v závislosti na biologické povaze AML a studované tkáni či orgánu [1–8]. Nemocní s myelomonocytární/monocytární AML (AML M4/5 podle FAB) a s t(8;21) mají relativně vyšší incidenci extramedulárního postižení [1]. Možná infiltrace jater a/nebo sleziny je poměrně známá a zvažovaná při diferenciální diagnostice postižení těchto orgánů u nemocných s AML. Překvapivě často jsou myeloidními blasty infiltrovány i ledviny (až 35 %). Rovněž leukemické postižení srdce, respektive myokardu, je zřejmě častější, než se obecně domníváme; ale je současně ve více než 95 % případů klinicky němé [5, 9, 10, 11]. Perikardiální výpotek je u nemocných s AML rovněž relativně častý (21 %); objemný a tedy potenciálně hemodynamicky významný je pouze u 0,5 % z nich. Klinicky významný (objem a/nebo dynamika vzniku a progrese) či dokonce tamponující perikardiální výpotek ovlivňuje morbiditu a mortalitu nemocných zřejmě obdobně jako u jiných populací nemocných. Vliv méně významných výpotků na smrtnost je spíše nejasný [12]. Samotná extramedulární infiltrace orgánů a tkání není zřejmě nezávislým prognostickým faktorem a nesehrává tak roli ve výběru postremisní léčby [1].
Ještě méně dat než zmíněných epidemiologických, pak najdeme k vysvětlení případné patofyziologické souvislosti blastické infiltrace a vlastního orgánového poškození. Mechanické působení infiltrujících myeloblastů, „shunting“ energetických substrátů, navození či potenciace lokální změny acidobazické rovnováhy (metabolická acidóza, hyperlaktatemie) či parakrinní efekt uvolňovaných cytokinů mohou být jen jedněmi z mnoha myslitelných patofyziologických mechanismů. Lze tedy pouze spekulovat nad aditivním efektem leukemické infiltrace při postižení orgánů v důsledku např. systémové infekce (sepse, septický šok – plíce, ledviny, játra, myokard) či toxického efektu chemoterapie (játra, myokard) a vice versa. Z tohoto pohledu je lépe na tuto eventualitu pomýšlet a zvážit zahájení či pokračování léčby AML (chemoterapie) i u kriticky nemocných v prostředí intenzivní péče (IP). Tato léčba je modalitou s případným kurativním potenciálem a v mnoha případech ji lze považovat za léčbu zásadní ke kontrole AML, a to včetně případného extramedulárního postižení. Aplikace chemoterapie v průběhu IP je možná a nepředstavuje zřejmě rizikový faktor vyšší mortality ani u nemocných se systémovou infekcí a s orgánovým postižením [13–16].
Přestože obě uvedené kazuistiky končí úmrtím nemocných, lze tento výsledek ve světle aktuálních poznatků a možností považovat za menšinový. Krátkodobá mortalita pacientů s hematologickými malignitami je srovnatelná s populací kriticky nemocných se závažnými chronickými onemocněními (např. diabetes mellitus) a/nebo chronickými orgánovými dysfunkcemi (chronické onemocnění srdce, chronické onemocnění ledvin, chronické onemocnění jater aj.) [16–18]. Popsané kazuistiky ilustrují případy kriticky nemocných s hematologickými malignitami s možným víceorgánovým postižením daným možnou kombinací leukemické infiltrace a dalších patofyziologických dějů a současně ukazují i rychlost a rozsah závažné deteriorace stavu této skupiny nemocných. Bez ohledu na etiologii je tedy i zde časná identifikace problému a jeho řešení nejlepší cestou ke snížení morbidity a mortality těchto pacientů.
Podíl autorů na přípravě rukopisu:
KT – připravil první a finální verzi rukopisu a léčil nemocné
RJ – léčil nemocné
LD, M – revidovali rukopis
Čestné prohlášení
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Poděkování
Podpořeno Programem rozvoje vědních oborů Univerzity Karlovy (PROGRES – projekt Q39) a Projektem institucionálního výzkumu MZČR – FNPl 00669806.
Doručeno do redakce dne 6. 12. 2017.
Přijato po recenzi dne 1. 2. 2018.
MUDr. Thomas Karvunidis, Ph. D.
JIP, I. Interní klinika, FN Plzeň
Alej Svobody 80
32330 Plzeň
Tel.: +420 377 103 165
e-mail: karvunidist@fnplzen.cz
Sources
1. Ganzel C, Manola J, Douer D, et al. Extramedullary disease in adult acute myeloid leukemia is common but lacks independent significance: analysis of patients in ECOG-ACRIN cancer research group trials, 1980–2008. J Clin Oncol 2016;34(29):3544–3553.
2. Byrd JC, Mrózek K, Dodge RK, et al. and Cancer and Leukemia Group B (CALGB 8461). Pretreatment cytogenetic abnormalities are predictive of induction success, cumulative incidence of relapse, and overall survival in adult patients with de novo acute myeloid leukemia: results from Cancer and Leukemia Group B (CALGB 8461). Blood 2002;100(13):4325–4336.
3. Marsh WL, Bylund DJ, Heath VC, Anderson MJ. Osteoarticular and pulmonary manifestation of acute leukemia. Case report and review of the literature. Cancer 1986;57(2):385–390.
4. Evans TI, Nercessian BM, Sanders KM. Leukaemic arthritis. Semin Artritis Rheum 1994;24(1):48–56.
5. Makaryus AN, Tung F, Liu W, et al. Extensive neoplastic cardiac infiltration in a patient with acute myelogenous leukemia: role of echocardiography. Echocardiography 2003;20(6):539–544.
6. Sharma T, Grewal J, Gupta S, Murray PI. Ophthalmic manifestation of acute leukaemias: the ophthalmologists´ role. Eye (Lond) 2004;18(7):663–672.
7. Bakst RL, Tallman MS, Douer D, Yahalom J. How I treat extramedullary acute myeloid leukemia. Blood 2011;118(14):3785–3793.
8. Alakel N, Stoelzel F, Mohr B, et al. Symptomatic central nervous system involvement in adult patients with acute myeloid leukemia. Cancer Manag Res 2017;9 : 97–102.
9. Roberts WC, Bodey GP, Wertlake PT. The heart in acute leukemia. A study of 420 autopsy cases. Am J Cardiol 1968;21(3):388–412.
10. ung MH, Lee YH, Lee KY, et al. Leukemic infiltration presenting as myocardial hypertrophy after complete remission of acute myeloid leukemia. Echocardiography 2017;34(1):136–138.
11. da Silva GL, Valle S, Pinto FJ, Almeida AG. Leukaemic myocardial infiltration presenting as acute heart failure. Eur Heart J Cardiovasc Imaging 2015;16(4):460.
12. Sampat K, Rossi A, Garcia-Gutierrez V, et al. Characteristics of pericardial effusions in patients with leukemia. Cancer 2002;116(10):2366–2371.
13. Darmon M, Thiery G, Ciroldi M, et al. Intensive care in patients with newly diagnosed malignancies and a need for cancer chemotherapy. Crit Care Med 2005;33(11):2488–2493.
14. Benoit DD, Depuydt PO, Vandewoude KH, et al. Outcome in severely ill patients with hematological malignancies who received intravenous chemotherapy in the intensive care unit. Intensive Care Med 2006;32(1):93–99.
15. Vandijck DM, Benoit DD, Depuydt PO, et al. Impact of recent intravenous chemotherapy on outcome in severe sepsis and septic shock patients with hematological malignancies. Intensive Care Med 2008;34(5):847–855.
16. Karvunidis T, Lysák D, Matějovič M. Dospělý onkologický nemocný v intenzivní péči. Je již čas říci „ano, zvážíme to“, než říkat „ne“,?! Anest Intenziv Med 2017;28 : 346–353.
17. Tanvetyanon T, Leighton JC. Life-sustaining treatments in patients who died of chronic congestive heart failure compared to metastatic cancer. Crit Care Med 2003;31 : 60–64.
18. Benoit DD, Vandewoude KH, Decruyenaere JM, et al. Outcome and early prognostic indicators in patients with a hematologic malignancy admitted to the intensive care unit for life-threatening complication. Crit Care Med 2003;31 : 104–112
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2018 Issue 2-
All articles in this issue
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Automatizované promývání transplantátů krvetvorných buněk pro autologní použití
- Život ohrožující orgánové infiltrace u akutní myeloidní leukemie – kazuistiky
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- S imunoglobulinem IgG4 asociované onemocnění
- Chronická recidivující kopřivka, bolesti kostí i kloubů, horečka nejasného původu a monoklonální imunoglobulin typu IgM = syndrom Schnitzlerové
- Vrozené erytrocytární enzymopatie vedoucí k hemolytické anémii – jejich diagnostika v české a slovenské populaci
- Trombóza splachnických žil u pacientů s ph-negativní myeloproliferativní nemocí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

