-
Medical journals
- Career
Transfuze a imunohematologie v ÚHKT
: M. Písačka; H. T. Bolcková; J. Králová; E. Matějková; E. Miarková
: Ústav hematologie a krevní transfuze, Praha
: Transfuze Hematol. dnes,23, 2017, No. Supplementum1, p. 87-93.
:
Transfuzní léčba v Ústavu hematologie a krevní transfuze (ÚHKT) se stále vyvíjí v souladu s trendy moderního transfuzního lékařství, směřujícími k maximalizaci bezpečnosti a personalizaci transfuzních přípravků. Imunohematologie propojuje transfuziologický úsek s klinickými odděleními. Při vyšetřování složitých případů diagnosticky obtížných a diskrepantních nálezů spolupracuje Referenční laboratoř s širokým spektrem pracovišť v České republice (ČR) i v zahraničí. Referenční laboratoř se podílí na výrobě vzorků a vykonává supervizi nad cykly externí kontroly (SEKK). V rámci rozšiřování a zpřesňování imunohematologické diagnostiky zavádí nové molekulárně biologické techniky a podílí se na jejich vývoji. Při řešení atypických nálezů byla v Referenční laboratoři popsána řada nových alel pro krevně skupinové antigeny. Oddělení imunohematologie se rovněž zabývá vyšetřováním antitrombocytových a HLA protilátek. Při fetomaternální aloimunní trombocytopenii (FMAIT) a refrakternosti na trombocytové přípravky vybírá vhodné dárce a ve spolupráci s aferetickým oddělením zajišťuje výrobu vhodných transfuzních přípravků. Rutinní i výzkumná činnost transuziologického úseku je důležitá nejen pro léčbu pacientů ÚHKT, ale i pro celý zdravotnický systém v ČR a má i nadnárodní přesah.
KLÍČOVÁ SLOVA:
transfuze – imunohematologie – Ústav hematologie a krevní transfuze (ÚHKT) – Národní referenční laboratoř (NRL) pro imunohematologii – nové diagnostické metody v imunohematologii – nové alely krevních skupin – HPA (human platelet antigen) – HLA (human leukocyte antigen) – FMAIT (fetomaternální aloimunní trombycytopenie) – refrakternostÚVOD
Transfuze krve, respektive jejích jednotlivých složek ve formě transfuzních přípravků, je stále nepominutelnou součástí léčby stavů, spojených s její nedostatečnou tvorbou nebo ztrátou. Výroba transfuzních přípravků v zařízeních transfuzní služby tak propojuje transfuzní lékařství s řadou jiných medicínských oborů. Transfuzní část Ústavu hematologie a krevní transfuze (ÚHKT) je v tomto směru specifická a liší se od jiných zařízení svým napojením převážně jen na jeden z oborů, a to na klinickou hematologii. Co však „chybí“ transfuznímu oddělení v šíři spektra spolupracujících oborů je nahrazeno činností jiné části transfuziologického úseku, a to oddělení imunohematologie a zejména jeho části – Referenční laboratoří pro imunohematologii. Tato poskytuje vysoce specializovaný diagnostický imunohematologický servis všem laboratořím v České republice a někdy i v zahraničí (Slovensko) – ročně se jedná o cca 1 000 vyšetření, většinou složitějších. Stejně široké je i působení Referenční laboratoře v oblasti kontroly kvality v imunohematologii, podílí se totiž na výrobě vzorků a vykonává supervizi nad cykly externí kontroly (SEKK). Nelze opominout ani zapojení celého Transfuziologického úseku do pregraduální i postgraduální výuky transfuzního lékařství a hematologie.
V rámci ÚHKT představuje Oddělení imunohematologie organické laboratorní propojení Transfuziologického a Klinického úseku. Vyšetřuje totiž imunohematologické parametry dárců krve na straně jedné, a pacientů všech oddělení Klinického úseku na straně druhé, včetně „fyzického propojení“ ve formě laboratorních zkoušek kompatibility jak v červené, tak i v bílé krevní řadě. Tato předtransfuzní vyšetření se tradičně provádějí s cílem zamezit nežádoucím imunohematologickým účinkům transfuze, a to zejména potransfuzním hemolytickým reakcím, popř. jiným klinicky významným nežádoucím efektům (TRALI – transfusion associated lung injury, refrakternost aj.). V současné době jsou kromě klasické chemoterapie v léčbě hematologických onemocnění stále častěji užívány moderní postupy „biologické léčby“, využívající monoklonální protilátky a případně jiné formy aktivace imunitního systému k eradikaci patologických buněk a tkání (vakcíny, imunomodulace aj.). Tato biologická léčba je často „personalizovaná“, tedy jsou vyráběny a podávány preparáty „na míru“ – podle individuálních parametrů daného pacienta. Narůstající význam imunoterapie přináší i nový pohled na imunohematologii – potřebu zajištění „personalizované“ transfuzní terapie. Je potřeba si uvědomit, že podání alogenní transfuze představuje mohutný zásah do imunitního systému příjemce – dnes jsou známy již stovky antigenů krevních buněk ((354 antigenů krevních skupin erytrocytů, HLA (human leukocyte antigen), HNA (human neutrophil antigen) a HPA (human platelet antigen)). To, že k tvorbě detekovatelných aloprotilátek dochází jen u malého počtu příjemců (v řádu jednotek procent) neznamená, že jde o marginální záležitost. Sama tvorba protilátek je až pomyslným „vrcholkem ledovce“ imunitní odpovědi na kontakt s buňkami s antigenními odlišnostmi, předchází jí mnoho neviditelných kroků (identifikace antigenu, jeho vzájemná prezentace mezi imunokompetentními buňkami a jejich komunikace různými formami signálních drah). Tím může docházet k „odčerpávání“ kapacit imunitního systému, které mohou chybět jinde – v boji proti maligním buňkám, v obraně proti infekcím a v neposlední řadě také v mobilizovatelnosti protinádorové imunity imunoterapeutickými postupy. Podávání „personalizovaných transfuzí“ – tedy přípravků, vybíraných s co největší možnou mírou shody mezi imunohematologickými parametry příjemce a přípravku, by mohlo významně přispět k úspěšnosti konvenční i moderní hematologické terapie.
Aby bylo možné transfuzní substituční terapii personalizovat, je zapotřebí rozšiřovat a zpřesňovat možnosti imunohematologické diagnostiky. K tomu v poslední době přispívá rozvoj molekulárně biologické diagnostiky, tedy genotypovací postupy ((PCR, microarray techniky, v blízké budoucnosti i rozšíření sekvenování nové generace (NGS) v imunohematologii) [1, 2]. Pro zavádění nových technik je důležité zmapování limitů technik současných a publikace nových, dosud neznámých fenotypů a genotypů. Genotypování je důležité i pro stavy, kdy nestačí rutinní sérologická diagnostika (určování genotypu u pacientů s AIHA, polytransfundovaných, při léčbě monoklonálními protilátkami interferujícími s předtransfuzními testy a při nedostupnosti spolehlivých diagnostických protilátek).
Na Oddělení imunohematologie ÚHKT zavádíme moderní diagnostické metody pro vyšetřování imunohematologických parametrů krevních buněk. V rámci Referenční laboratoře pro imunohematologii jsme často konfrontování s diagnosticky složitými a diskrepantními nálezy, při jejichž řešení se někdy poštěstí dostat se „za hranice učebnic“ – tedy popsat nové případy fenotypů a genotypů. Česká stopa v imunohematologii má již dlouhou historii. Obor „spatřil světlo světa“ nedaleko za hranicemi a tehdy ve společném Rakousko-Uhersku [3]. Krátce potom přinesl nové poznatky v ABO náš Jan Janský [4], ale i v nedávné době jsme měli možnost přispět do bohaté mozaiky imunohematologického poznání – blíže v přehledných článcích v Transfuzi a hematologii dnes 2009 [5] a ve Vnitřním lékařství 2012 [6]. V následujícím textu jsou uvedeny další nové imunohematologické poznatky z posledních let.
Nová mutace AB0 genu, způsobující slabý B fenotyp (Bw)
Slabé varianty skupiny B jsou vzácnější než u skupiny A, dosud bylo popsáno 38 různých alelických forem. V naší studii jsme charakterizovali novou alelu, projevující se výrazným zeslabením exprese B antigenu a asociovanou s fenoménem alelického zesílení v heterozygotní kombinaci s normální A alelou. Podnětem pro zkoumání tohoto fenotypu byl diskrepantní nález při určování AB0 skupiny u 55letého pacienta, kdy při určení aglutinogenů byl nález odpovídající skupině 0, ale při komplementárním stanovení aglutininů v gelovém testu chyběla reakce s B erytrocyty (obr. 1). V aglutinačním testu v automatickém analyzátoru však byla zachycena slabá anti-B protilátka a skupina byla tedy interpretována jako běžná 0 (obr. 2). Genotypování však prokázalo přítomnost B alely a sekvenační analýza prokázala dosud nepopsanou bodovou mutaci v exonu 7 ABO genu (c.662G>A). Tato mutace působí záměnu glycinu v pozici 221 za asparagin a tato změna přímo ovlivňuje katalytické působení B enzymu (galaktosyltransferázy) – brání ve využití UDP-galaktózového substrátu k syntéze B antigenu. Průtoková cytometrie prokázala výrazné zeslabení až téměř chybění exprese B antigenu (u pacienta a jeho sestry), u neteře byl pozorován fenomén alelického zesílení díky interferenci s funkční A alelou (obr. 3). Fakt, že u pacienta i jeho neteře byla pozorována slabá reaktivita anti-B aglutininu vyvolává podezření na možnost kvalitativní změny B antigenu (analogicky k podskupinám A1 a A2 a k výskytu nepravidelné protilátky anti-A1 u A2 podskupiny). Klinický význam spočívá v možném chybném určení AB0 a následně v možném podání přípravku se slabým B antigenem (pravděpodobně by nedošlo k těžké hemolytické reakci, ale je možné vyvolání nežádoucího nárůstu titru anti-B protilátky). Práce byla publikována na kongresu ISBT 2016 v Dubaji [7].
1. Typování ABO systému v kartách DG Gel 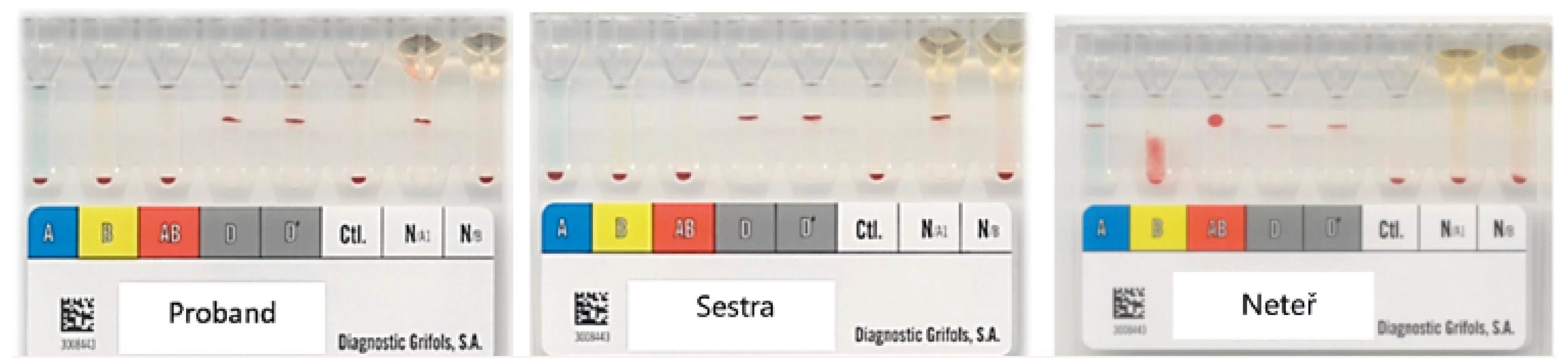
U probanda a jeho sestry byl B antigen příliš slabý a nebyl detekován. V případě neteře je B antigen detekovatelný díky alelickému zesílení. 2. Výsledky z analyzátoru Galileo 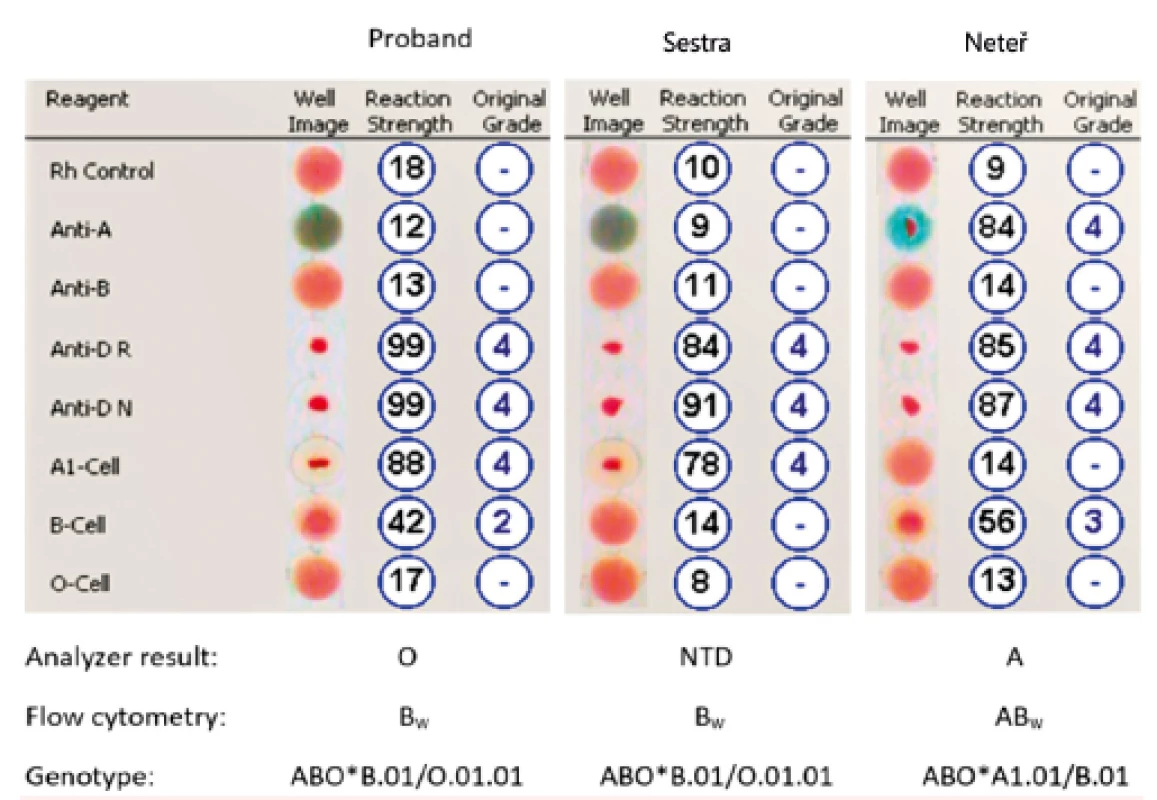
Proband Bw (vlevo), jeho sestra (uprostřed) a neteř (vpravo). Pozn.: Reakce anti-B v plazmě probanda a neteře měla za následek automatickou interpretaci výsledků jako skupina O (proband) a A (neteř). 3. Dot plot a histogram 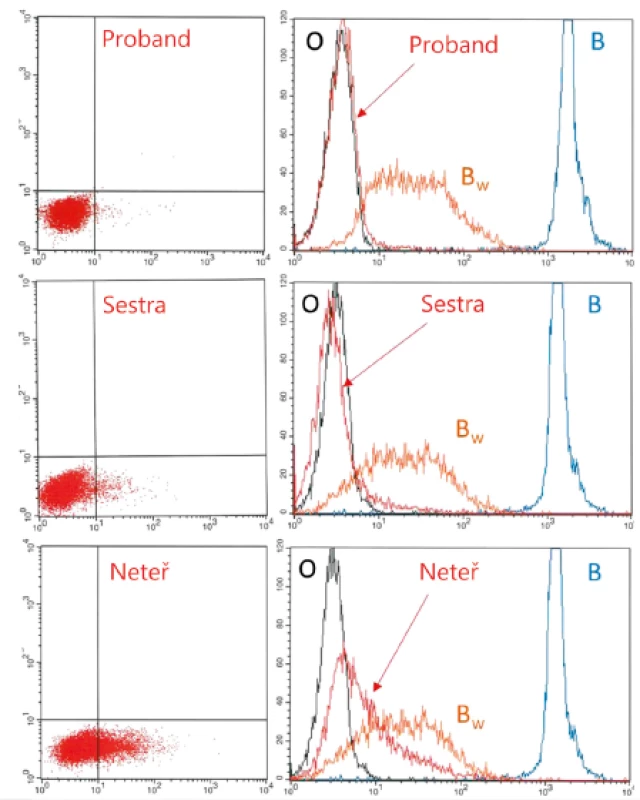
Testování erytrocytů probanda, sestry a neteře (červené linky) s protilátkou anti-B (clone 9621A8) pomocí průtokové cytometrie. Kontrolní reakce zahrnují erytrocyty skupin: B (modrá), Bw (ABO*BW.03/O.01.01, oranžová) a O (černá). Slabý B fenotyp způsobený mutací v non-AB0 lokalizaci – nová para-Bombay (FUT1) mutace
Tento případ slabé B skupiny ilustruje komplexnost AB0 systému, kdy jsou A a B antigeny neseny na H-prekurzorovém řetězci, jehož syntéza je řízena geny FUT1 (v hematopoetické tkáni) a FUT2 (v epiteliální, sekretorské tkáni). Jsou-li nefunkční obě tyto transferázy, chybí na krvinkách zcela H antigen a i A a/nebo B antigeny (= Bombay fenotyp, Oh). Pokud je nefunkční jen hematopoetická FUT1 transferáza, mohou být na krvinkách detekovány stopy H, respektive A a/nebo B antigenů, naadsorbované na krvinky ze solubilních ABH substancí z plazmy. Pozorovaná diskrepance při určení AB0 skupiny se vyskytla u 33leté zdravé ženy, vyšetřované v souvislosti s těhotenstvím. B antigen byl zeslabený až nedetekovatelný, ale chyběla protilátka anti-B (obr. 4). Na rozdíl od jiných slabých AB0 podskupin však zcela chyběla reaktivita s anti-H lektinem (obr. 5). AB0 genotyp byl zcela normální (ABO*B.01/O.01.01), avšak při sekvenaci FUT1 genu byla nalezena homozygocie pro novou mutaci (duplikace 7 nukleotidů – c.13_19dup), která způsobuje posun čtecího rámce a vznik předčasného stop-kodónu (p.Arg7Glnfs*93). Následně je hematopoetická FUT1 fukosyltransferáza nefunkční a tudíž nedochází k syntéze erytroidních H antigenů a následně se nemůže projevit fungující B transferáza (nemá “kam” syntetizovat D-galaktózu). Přesto jsou však detekovatelné stopy B antigenu, pocházející z naadsorbovaných solubilních B substancí (obr. 6). Práce byla publikována na kongresu ISBT 2017 v Kodani [8].
4. Typování AB0 systému v gelových kartách 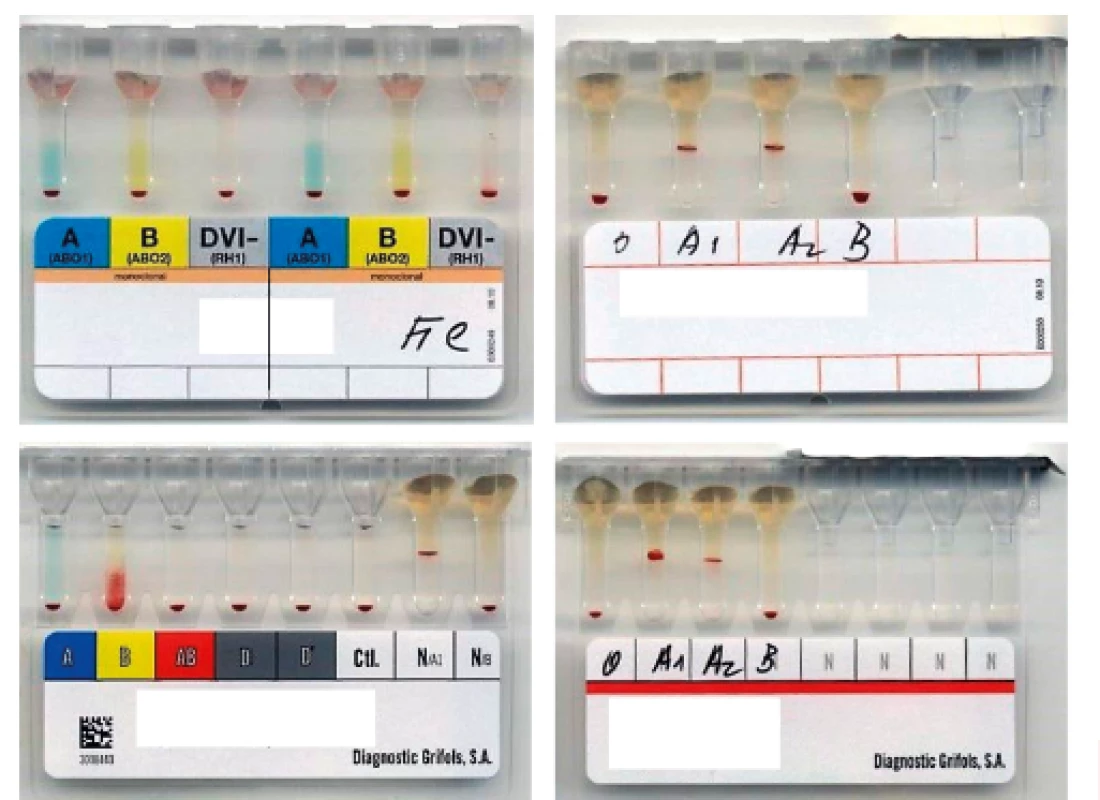
V kartě BioRad AB0 nebyl antigen B detekován. Slabá exprese antigenu byla pozorována pouze v AB0 DG Gel. 5. Typování antigenu H v gelové kartě BioRad 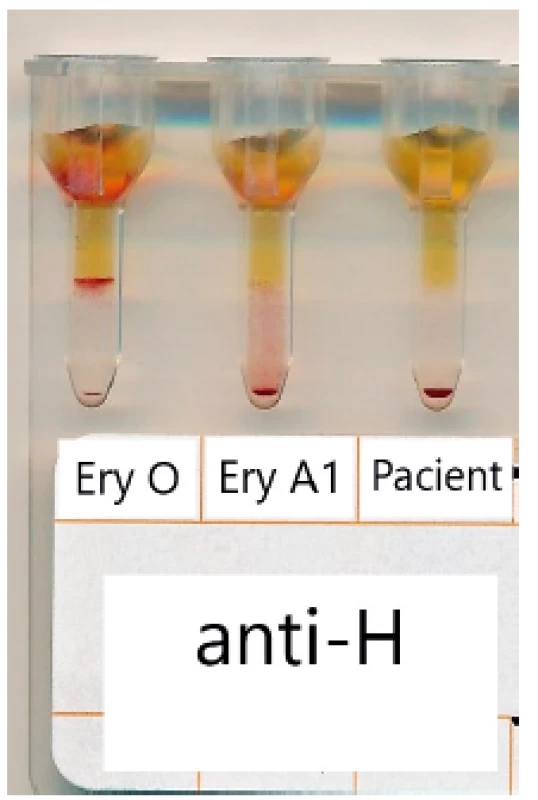
Negativní reakce s anti-H lektinem u probanda. Pro kontrolní reakce použity erytrocyty skupiny O (pozitivní reakce) a A1 (negativní reakce). 6. Testování erytrocytů metodou průtokové cytometrie 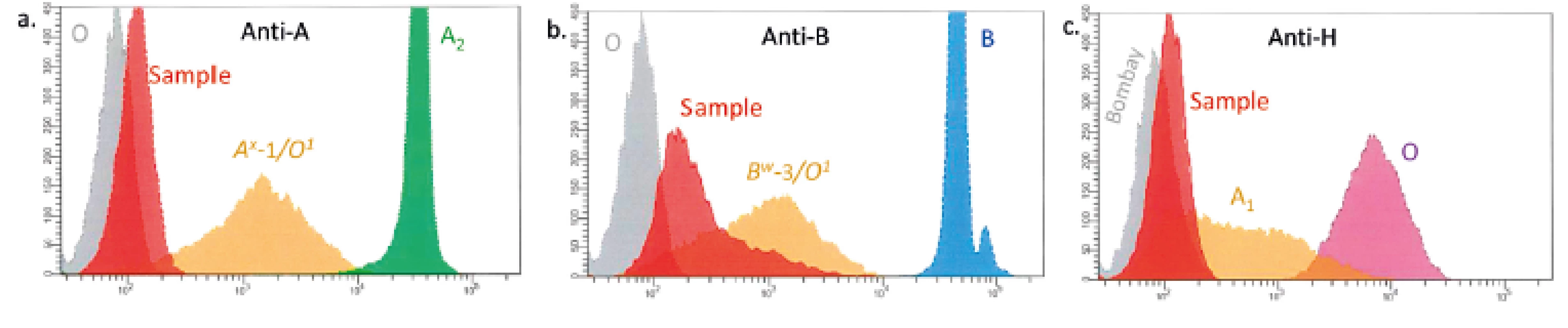
a) Testování s anti-A. Kontroly: A2 (pozitivní kontrola, zelená), Aw (weak kontrola, oranžová), O (negativní kontrola, šedá). Vzorek (červená) odpovídá kontrole ery O. b) Testování s anti-B. Kontroly: B (pozitivní kontrola, modrá), O (negativní kontrola, šedá), Bw (weak kontrola, oranžová). Vzorek (červená) slabě exprimuje B antigen. c) Testování s anti-H. Kontroly: O (pozitivní kontrola, fialová), A1 (weak kontrola, oranžová), Bombay (negativní kontrola, šedá). Vzorek (červená) odpovídá negativní kontrole. Nová nulová Duffy alela FY*A(-69C) jako podklad chybění exprese Fya antigenu
Duffy antigeny jsou neseny glykoproteinem DARC/ACKR1, který má funkci chemokinového receptoru a je kódován FY* genem se dvěma alelickými formami – FY*A (FY*01) a FY*B (FY*02). Nulový Duffy fenotyp – Fy(a-b-) – je asociován s rezistencí k Plasmodium vivax infekci a je rozšířen v oblastech s endemickým výskytem malárie (africká populace), v kavkazské populaci je extrémně vzácný. Molekulární podklad má dva typy – mutace v oblasti promotoru FY* genu (tzv. GATA mutace) a vzácnější genové změny v oblasti exonu 2 (stop-kodóny). U prvního typu je ovlivněna pouze erytroidní exprese Duffy antigenů, jinde v tkáních je jejich exprese normální a tudíž daní jedinci nevytvářejí anti-Duffy protilátky. GATA mutace v africké populaci je podmíněná mutací T>C v pozici -67 a asociovaná s FY*B alelou. V případě, který jsme pozorovali, jsme detekovali vzácný Fy(a-b-) fenotyp u dárce krve kavkazské rasy, žijícího v Čechách, ale s kořeny z řecké menšiny z tureckého Černomoří. Genotypování odhalilo přítomnost alely FY*X, způsobující výrazné zeslabení Fyb antigenu, GATA oblast FY*B alely byla normální – tedy rutinní PCR metoda detekovala genotyp FY*A/FY*BW.01. Tomu ale neodpovídalo úplné chybění exprese Fya (obr. 7). Sekvenování odhalilo dosud neznámou mutaci, a to T>C v pozici -69 v alele FY*A (obr. 8). Tato mutace působí stejným mechanismem, jako africká GATA mutace FY*B, brání erytroidní transkripci a tedy syntéze Fya antigenu. Význam poznání této nové mutace je v tom, že případní nositelé nulového genotypu nebudou vytvářet anti-Fya protilátku a dále v tom, že diagnostické krvinky, vyžadující FY*A homozygocii, mohou být na tuto mutaci testovány. Práce byla publikována v časopise Transfusion [9] a na kongresu ISBT 2015 v Londýně [10].
7. Typování Duffy antigenů metodou sloupcové aglutinace 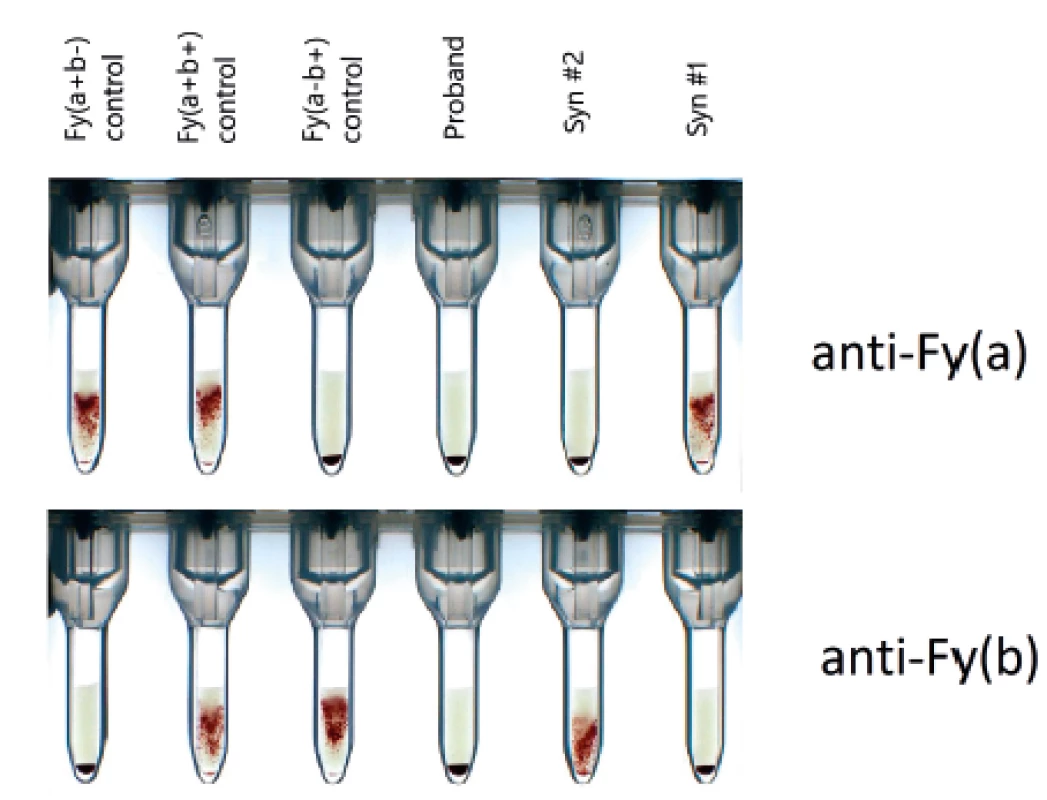
3 kontrolní reakce (vlevo), proband (obě reakce negativní), dva synové (vpravo) 8. Sekvenace 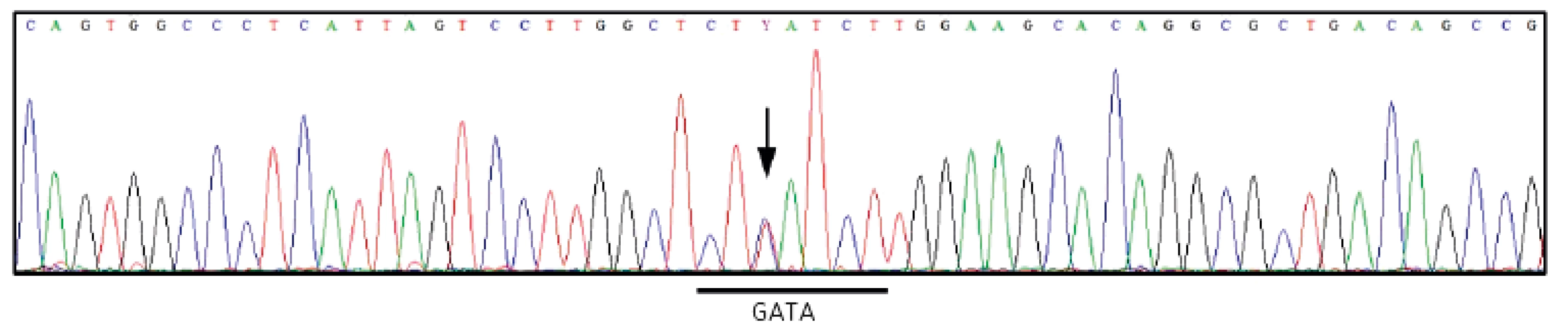
Chromatogram zobrazuje GATA oblast a přilehlé části promotoru FY*A genu. Šipka označuje pozici c.1-69T/C. HPA a HLA strategie při výběru optimální substituční terapie
Díky rozvoji technik umožňujících identifikaci protilátek proti trombocytovým (HPA) antigenům bylo možno v minulých letech zlepšit diagnostiku klinických stavů způsobených antitrombocytovými aloprotilátkami jako je potransfuzní purpura, refrakternost na podání trombocytů, s transplantací asociovaná aloimunní trombocytopenie a fetomaternální aloimunní trombocytopenie.
Od roku 1999, kdy jsme tyto nové metody zavedli, jsme u 105 žen potvrdili imunizaci trombocytovými antigeny jako příčinu trombocytopenie u jejich novorozenců. 16 z těchto žen jsme sledovali i v následujících graviditách. Jako imunní příčina trombocytopenie novorozence byla u většiny žen nalezena aloprotilátka anti-HPA-1a (75 %), druhou nejčastěji zachycenou aloprotilátkou byla anti-HPA-5b (9 %), dále jsme detekovali aloprotilátky se specifitou anti-HPA-1b (2 %), anti-HPA-3a (1 %) a anti-HPA-3b v kombinaci s anti-HPA-1a (1 %), ve čtyřech případech se nám antitrombocytové protilátky nepodařilo specifikovat. Mateřské antitrombocytové autoprotilátky byly zaznamenány v deseti případech (9 %). Naše dárce krve jsme otypovali na HPA-1a antigen a našli jsme 71 vzácných dárců HPA-1a negativních (frekvence cca 2 % v kavkazské populaci). Od těchto dárců Aferetické oddělení ÚHKT připravuje trombocytové HPA-1a negativní přípravky pro transfuzní terapii těžce trombocytopenických novorozenců nebo plodů matek s aloprotilátkou anti-HPA-1a.
Oddělení imunohematologie má ve své náplni i HLA problematiku. Zajišťuje zejména personalizovaný výběr dárce krve z hlediska HLA kompatibility pro HLA alosenzibilizované pacienty. Při refrakternosti na trombocytové přípravky se vhodný dárce vyhledává na základě optimální shody v HLA I. třídy mezi dárcem a příjemcem, vylučují se dárci s HLA fenotypy, proti nimž byly u pacienta již zjištěny HLA protilátky. Vyšetření HLA protilátek se provádí také profylakticky u nemocných potencionálně HLA alosenzibilizovaných (polytransfundovaní pacienti, zejména před transplantací krvetvorných buněk). Odhalení responderů (aloimunizovaných pacientů) může při substituční terapii trombocytovými přípravky oddálit či zcela předejít vzniku refrakternosti, pokud je respektována kompatibilita v HLA I. třídy mezi dárcem a příjemcem. Podchycení respondérů již při velmi nízkých hladinách HLA protilátek umožňuje zavedení nových vysoce citlivých metod pevné fáze (ELISA a LUMINEX testy na HLA, HPA protilátky). Uvedené metody jsou využívány též v profylaxi TRALI při vyšetřování dárců s možnou HLA alosenzibilizací v anamnéze (transfuze, gravidita), protože tuto sice vzácnou, ale nebezpečnou potransfuzní reakci mohou vyvolat i HLA protilátky přítomné u dárce.
Dalším přístupem k vyhledávání eventuálních respondérů se může stát typizace HLA antigenů II. třídy, protože některé HLA-DR fenotypy pravděpodobně představují genetickou predispozici k tvorbě aloprotilátek.
ZÁVĚR
Transfuzní léčba na ÚHKT se stále vyvíjí v souladu s trendy moderního transfuzního lékařství, směřujícími k maximalizaci bezpečnosti a personalizaci transfuzních přípravků. Imunohematologie přispívá k propojování transfuziologického úseku s klinickými odděleními a při vyšetřování složitých případů v Referenční laboratoři ke spolupráci s širokým spektrem pracovišť v ČR i v zahraničí a svým skromným dílem i k rozšiřování obecného imunohematologického poznání. Některé studované případy otevírají nové pohledy na zažitá schémata a přinášejí potenciál pro další výzkum – například na vysvětlení čeká u nás objevený tzv. “super-para-Bombay” fenotyp [11] nebo zatím nepublikovaný případ vymizení exprese získaného dárcovského RhD antigenu u transplantovaného pacienta při přítomnosti nezměněného RHD genu – oba případy ukazují na suspektní dosud neznámé mechanismy regulace exprese produktů krevně skupinových genů.
Rutinní i výzkumná činnost transfuziologického úseku je důležitá nejen pro léčbu pacientů ÚHKT, ale i pro celý zdravotnický systém v ČR a má i nadnárodní přesah.
Podíl autorů na přípravě rukopisu
MP – příprava rukopisu, výběr kazuistik, výběr literatury
HTB – vyšetřování antitrombocytových a anti-HLA protilátek, příprava rukopisu (problematika trombocytů)
JK – podíl na kazuistikách, genotypování, úprava obrázků
EMa – vyšetřování anti-HLA protilátek, příprava rukopisu (problematika HLA)
EMi – vyšetřování antitrombocytových a anti-HLA protilátek, genotypování
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
MUDr. Martin Písačka
Transfuziologický úsek
Ústav hematologie a krevní transfuze
U Nemocnice 1
128 20 Praha 2
e-mail: martin.pisacka@uhkt.cz
Sources
1. Moulds JM. Future of molecular testing for red blood cell antigens. Clin Lab Med 2010;30(2):419–429.
2. Anstee DJ. Red cell genotyping and the future of pretransfusion testing. Blood 2009;114(2):248–256.
3. Landsteiner K. Uber agglutinationserscheinungen normalen menschlichen blutes. Wien Klin Wochenschr 1901;14 : 1132–1134.
4. Janský J. Hematologické studie u psychotiků. Sborník klinický 1907;8 : 85–139.
5. Písačka M. Krevní skupiny – historické aspekty, současné poznatky a „česká stopa“ v imunohematologii. Slavnostní Janského přednáška. Transfuze Hematol dnes 2009;15(Suppl 3):20–25.
6. Písačka M, Kořínková P, Matějková E, Bolcková HT. Imunohematologie – historie, současný stav poznání a role ÚHKT. Vnitř Lék 2012;58(Suppl. 2):103–114.
7. Písačka M, Králová M, Králová J, et al. Bw phenotype caused by a new missense mutation in exon 7 – a family study in Northern Moravia. Vox Sanguinis 2016;111 (Suppl.1):226.
8. Písačka M, Králová M, Králová J, et al. Weak B phenotype caused by a novel para-Bombay mutation. Vox Sanguinis 2017;112(Supplement S1):520.
9. Písačka M, Marinov I, Králová M, et al. FY*A silencing by the GATA-motif variant FY*A(-69C) in a Caucasian family. Transfusion 2016;55 : 2616–2619.
10. Písačka M, Marinov I, Králová M, et al. FY*A(-69C): A novel FY*A expression silencing allele occuring in a Caucasian family. Vox Sanguinis 2015;109 (Suppl.1):298.
11. Storry JR, Pisacka M, Pejchalova A, Hult AK, Olsson ML. Heterozygosity for consensus FUT1 associated with a new ABH phenotype challenging current dogma: H-negative group A or B. Vox Sanguinis 2010;99 : 379–380.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2017 Issue Supplementum1-
All articles in this issue
- Genetic tests for selecting haematopoietic stem cell donors and post-transplant monitoring
- Centre for rare disorders of haematopoiesis at the Institute of Haematology and Blood Transfusion
- Transfusion and immunohematology at the Institute of Haematology and Blood Transfusion
- Standard and large volume leukapheresis of peripheral blood progenitor cells using the new Spectra Optia continuous mononuclear cell collection protocol
- Dysfibrinogenaemia and afibrinogenaemia in the Czech Republic
- Molecular genetic tests in patients with myelodysplastic syndrome performed at the Institute of Haematology and Blood Transfusion
- Functional consequences of mutations in the nucleophosmin gene in acute myeloid leukaemia
- Current trends in the treatment and diagnostics of chronic myeloid leukaemia
- Use of molecular cytogenetic techniques in the analysis of chromosomal aberrations in haematological malignancies
- Haematopoietic cell transplantation at the Institute of Haematology and Blood Transfusion (1986–2016)
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dysfibrinogenaemia and afibrinogenaemia in the Czech Republic
- Centre for rare disorders of haematopoiesis at the Institute of Haematology and Blood Transfusion
- Transfusion and immunohematology at the Institute of Haematology and Blood Transfusion
- Functional consequences of mutations in the nucleophosmin gene in acute myeloid leukaemia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

