-
Medical journals
- Career
Sekvenování nové generace u akutní myeloidní leukemie: nový pohled na patogenezi a vývoj leukemických klonů
Authors: M. Čulen 1,2,3; Z. Kosařová 1,2; I. Ježíšková 2; A. Folta 2; D. Dvořáková 1,2; L. Semerád 1,2; Z. Šustková 1,2; Z. Ráčil 1,2,3
Authors‘ workplace: Interní hematologická a onkologická klinika, Lékařská fakulta, Masarykova univerzita, Brno 1; Interní hematologická a onkologická klinika, Fakultní nemocnice Brno 2; CEITEC – Středoevropský technologický institut, Masarykova univerzita, Brno 3
Published in: Transfuze Hematol. dnes,23, 2017, No. 4, p. 185-191.
Category:
Overview
Patogeneze akutní myeloidní leukemie je několikastupňový heterogenní proces, který v naprosté většině případů vychází z vícečetných genetických aberací. Ukazuje se, že jednotlivé genetické léze hrají v tomto procesu specifickou roli, spolupracují mezi sebou a opakovaně se vyskytují v určitém hierarchickém uspořádání. V mnoha případech předchází samotné leukemii rozvoj nemaligní klonální hematopoézy, která se s výskytem dalších mutací přetváří na maligní. Postupný proces hromadění mutací dále generuje leukemické subklony, které mohou představovat i různé fenotypicky odlišné populace, s různou citlivostí na terapii a schopností vyvolat relaps onemocnění. Cílem této přehledové práce je podat stručný souhrn posledních poznatků o kinetice vzniku a rovněž relapsu akutní myeloidní leukemie a roli nejčastějších somatických mutací v těchto procesech.
Klíčová slova:
AML – klonalita – NGS – hematopoéza – relapsÚVOD
Akutní myeloidní leukemie (AML) představuje heterogenní hematoonkologické onemocnění ovlivňující myeloidní vývojovou větev krvetvorných buněk. Velké rozdíly v patologii na buněčné úrovni se odrážejí v různé prognostické závažnosti a přežívání jednotlivých pacientů. Dřívější rozdělení AML podle Francouzsko-Americko-Britské (FAB) klasifikace definovalo 8 subtypů podle morfologie, typu a stupně zralosti leukemických buněk. Novější klasifikace Světové zdravotnické organizace (WHO) vychází ze specifických genetických aberací, ať už na cytogenetické nebo molekulární úrovni, a definuje prognosticky odlišné podskupiny pacientů [1]. Vedle skupiny AML s rekurentními chromozomálními abnormalitami existuje ještě další velká skupina (okolo 45 % případů) cytogeneticky normálních AML (CN AML) [2]. U této skupiny lze identifikovat somatické mutace v různých genech (často i ve více najednou), které mohou být v klinické praxi využity pro sledování minimální reziduální nemoci nebo prognostické hodnocení. Sledování širokého spektra mutací pomocí sekvenování nové generace (NGS) pak v posledních letech ukázalo, že mutace často vykazují specifické a opakující se hierarchické uspořádání, které navíc reflektuje postupný vývoj onemocnění [3–5].
PATOGENEZE AML
Mutace u AML postihují široké spektrum genů s odlišnými funkcemi, které se mohou vzájemně doplňovat. U CN AML dřívější model „dvou zásahů“ předpokládal přítomnost mutací ze dvou mutačních tříd k plnému rozvinutí leukemie, kde mutace I. třídy poskytují proliferační výhodu a mutace II. třídy blokují buněčnou diferenciaci [1]. NGS metody v posledních letech však poskytly přesnější náhled na mutační pozadí AML. Významná studie skupiny The Cancer Genome Atlas Research Network nejdříve navrhla novou kategorizaci mutovaných AML genů podle jejich funkce (tab. 1) [3, 4]. Další práce se zaměřením na „dešifrování“ klonality AML pak potvrdily, že leukemogeneze představuje převážně vícestupňový proces, kdy malignímu stadiu často předchází pre-leukemická fáze charakterizovaná přítomností klonální, ale pre(ne)-maligní hematopoézy [5, 6]. Preleukemická fáze je charakteristická výskytem zakládajících mutací (označovaných též jako „landscaping“ mutace), a to hlavně v genech ovlivňujících epigenetické mechanismy, např. DNMT3A, TET1 a TET2, IDH1 a IDH2. Samotná leukemie je pak vyvolána až další mutací v genech spojených s proliferací (např. NPM1), tzv. progresorové mutace. Tento proces byl dokumentován na izolovaných buněčných populacích, kde bylo prokázáno, že nejprimitivnější hematopoetické kmenové buňky (HSC, z angl. „hematopoietic stem cells“) a multipotentní progenitorové buňky (MPP, z angl. „multipotent progenitors“) nesly preleukemické zakládající mutace, ale výskyt progresorových mutací se potvrdil až ve více diferencovaných progenitorových buňkách a leukemických blastech [5]. Zdá se proto, že buňky zodpovědné za expanzi leukemického klonu se nacházejí až v hierarchicky nižší populaci více diferencovaných buněk, což je v souladu i s předpokládanými modely zdravé hematopoézy, kde proliferační potenciál zdravých progenitorových buněk značně převyšuje hematopoetické kmenové buňky [7, 8]. U preleukemických mutací bylo popsáno jejich přetrvávání i v remisi onemocnění (např. mutace v genu DNMT3A) a dále výskyt v T - a B-lymfocytech (v nízké frekvenci), což potvrzuje, že původní preleukemická kmenová buňka má stále multilineární diferenciační potenciál [5, 6, 9–11]. Mutace v genech DNMT3A, TET2 a ASXL1 byly rovněž nalezeny u osob bez historie hematoonkologického onemocnění, což je označováno jako „klonální hematopoéza neurčitého významu“ (CHIP, z angl. clonal hematopoiesis of indeterminate potential) [12, 13]. Riziko výskytu CHIP vzrůstá se stárnutím organismu, přičemž výskyt maligního onemocnění krvetvorby byl pozorován pouze u přibližně 4 % jedinců s CHIP. Tato data ukazují, že hematopoetické klony obsahující mutace výše zmíněných genů nejsou maligní, ačkoliv mají pravděpodobně určitou růstovou výhodu. Je nutné zmínit, že přítomnost CHIP byla asociována kromě rizika vzniku hematologické malignity i s onemocněním kardiovaskulárního systému (ischemická srdeční choroba a cévní mozkové příhody) a s diabetes mellitus 2. typu [12–14].
Table 1. Přehled funkčních kategorií nejčastěji mutovaných genů u AML [3] ![Přehled funkčních kategorií nejčastěji mutovaných genů u AML [3]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d9fdb8b38122dee550ff7a1c41a562b1.png)
Vedle výše zmíněné vícekrokové leukemogeneze AML je uvažován i přímý, jednokrokový model, kde výskyt jedné aberace je dostatečný k plnému rozvoji AML. Jako příklad je možné uvést fúze KMT2A (dříve MLL), kde například KMT2A-AF4 a KMT2A-GAS7 vedly v myším modelu ke vzniku leukemie i bez přítomnosti dalších mutací [15, 16]. Navíc ve skupině 130 pacientů s AML se KMT2A fúze nikdy nevyskytovaly spolu s mutací v DNMT3A a IDH1/IDH2. Naproti tomu byly často doprovázeny mutacemi v genech KRAS a NRAS (23,2 % a 25,6 % případů), které patří mezi typické pozdní léze u AML, což ukazuje na to, že KMT2A fúze jsou první a zároveň leukemii indukující událostí [17]. Naopak KMT2A-parciální tandemové duplikace (KMT2A-PTD) představují progresorové mutace a vyskytují se velmi často spolu s typickými zakládajícími mutacemi v genech DNMT3A, IDH1/2, TET1/2 [17–19]. Jako další léze se silným, případně samostatným, leukemogenním potenciálem se jeví i fúze PML-RARA (definující M3-AML) [20]. Podobně i pro cytogeneticky definované AML se změnami RUNX1-RUNX1T1, CBFB-MYH11, GATA2, MECOM, DEK-NUP214 platí, že dané aberace jsou identifikovány jako první získaná léze a jsou asociovány s výskytem nižšího počtu jiných mutací, které pak představují hlavně pozdní léze [4, 19–21]. Uvažuje se proto, že uvedené chromozomální aberace mají silný leukemogenní potenciál a vyžadují menší počet dalších mutací k iniciaci AML.
Obecně platí, že leukemické AML buňky mohou v průběhu onemocnění získat další mutace, čímž dochází ke klonální evoluci a případně rozvětvení klonality. Mutace z prvotního leukemického klonu jsou tak přítomny ve všech odvozených sub/klonech (obr. 1) [5, 6]. Zároveň klon, který je v době diagnózy dominantní bývá typicky identifikován mutacemi s vysokou variantní alelickou frekvencí (VAF) – až 50%, což značí přítomnost ve všech analyzovaných buňkách (platí pro heterozygotní mutace). Mutace s nižší VAF (typicky do 25 %) jsou pak přítomny pouze v některých buňkách a představují minoritní subklony. Nejčastěji se jedná o mutace v proliferačních genech, přičemž některé z nich jsou specificky a opakovaně nalézány pouze jako subklonální, přidružené, nebo „pozdní“ aberace s nízkou alelickou frekvencí. Typickým příkladem je již zmiňovaný gen RAS, ve kterém může být přítomno i vícero samostatných mutací najednou; dále pak FLT3-ITD nebo gen KIT [3, 4, 18, 22].
Image 1. Zjednodušené schéma vícekrokového postupného vývoje AML Z hematopoetického klonu nesoucího zakládající mutaci vzniká po získání druhé, progresorové mutace klon s plně leukemogenní kapacitou. Po výskytu další mutace u jedné z leukemických buněk vzniká subklon, který v době diagnózy představuje pouze minoritní část leukemických buněk. Velikost kruhů vyjadřuje poměrné zastoupení jednotlivých mutací. 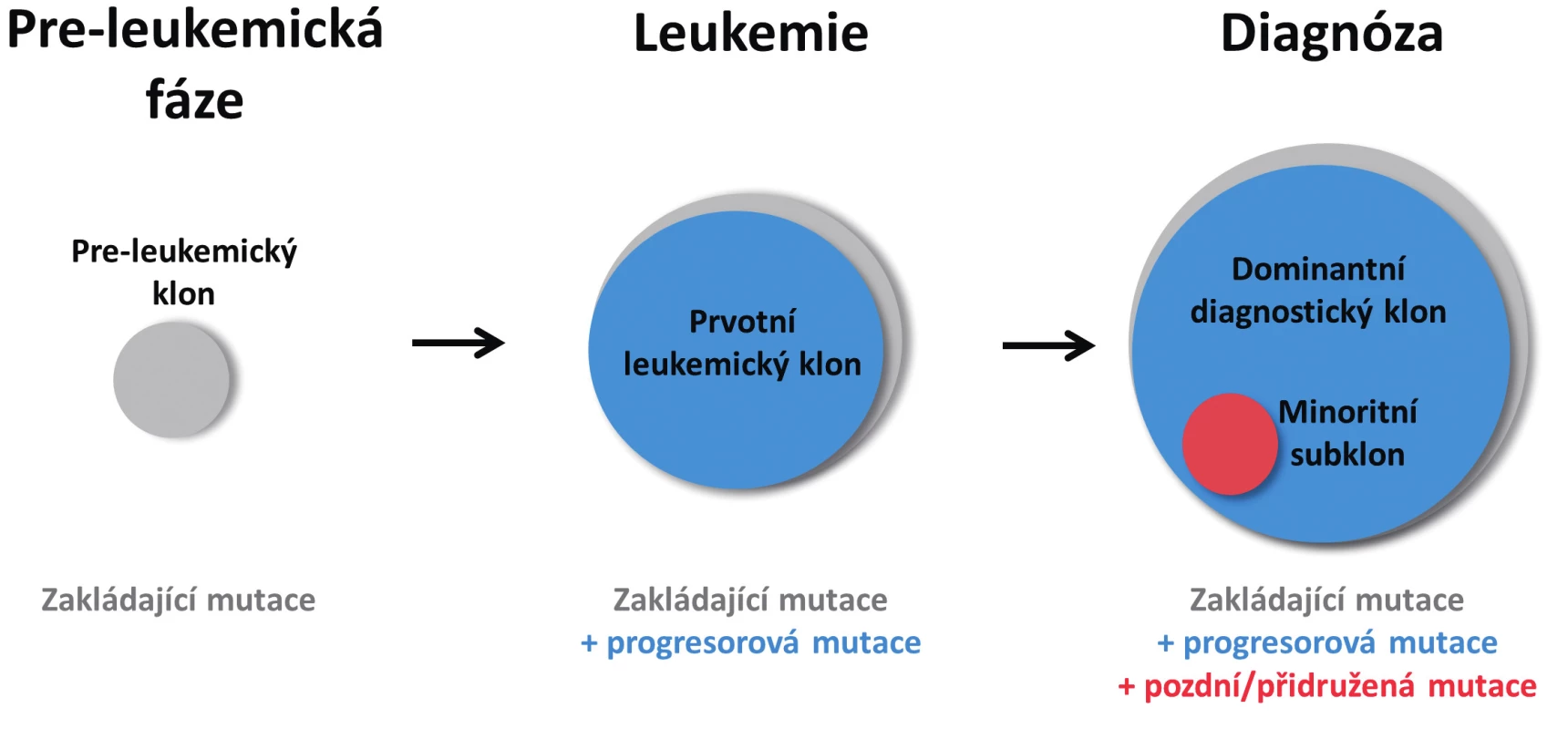
KINETIKA RELAPSU
Indukční a konsolidační terapie vytváří selekční tlak na koexistující AML klony. Běžně používané chemoterapeutické léčebné protokoly cílí na proliferující buňky, což vede k eliminaci množících se leukemických buněk, zatímco preleukemické buňky často přežívají a přetrvávají i v remisi onemocnění [6, 9, 11, 23]. Tuto situaci lze dobře demonstrovat na případech diagnostikovaných s mutací v genu DNMT3A a zároveň NPM1, kde je progresorová mutace NPM1 terapií odstraněna, avšak mutace DNMT3A je detekovatelná i v remisi.
Scénáře pro vznik relapsu byly detailně popsány Corces-Zimmerman et al., kteří pozorovali 4 různé průběhy:
- relaps dominantního diagnostického klonu;
- relaps diagnostického klonu po získání dalších mutací;
- relaps klonu předcházejícího dominantnímu diagnostickému klonu, tj. i z možné preleukemické kmenové buňky;
- relaps minoritního subklonu z doby diagnózy [6].
Toto rozdělení primárně zohledňuje vývoj klonality nemoci a vyžaduje přesné stanovení VAF mutací, ideálně u velkého počtu genů, ke zjištění, zda se daný subklon vyskytoval již v době diagnózy nebo nikoliv. Alternativně lze relapsy definovat jednoduše pouze na základě zisku/ztráty mutací:
- a) relaps dominantního diagnostického klonu (stabilní průběh),
- b) zisk mutace/í v relapsu,
- c) ztráta mutace/í v relapsu,
- d) ztráta + zisk mutací (obr. 2).
Image 2. Scénáře relapsu na základě zisku/ztráty mutací a) relaps hlavního diagnostického klonu, bez zisku/ztráty mutací; b) zisk mutace v relapsu; c) ztráta mutace v relapsu – dominantní diagnostický klon zaniká, relaps pochází z vývojově předcházejícího leukemického klonu; d) současná ztráta a zisk jiné mutace – dominantní diagnostický subklon zaniká, relaps pochází z vývojově předcházejícího leukemického klonu V případech b) a d) se může jednat o evoluci nového leukemického subklonu během léčby nebo po léčbě, nebo o nárůst minoritního subklonu, který byl již přítomen v době diagnózy. 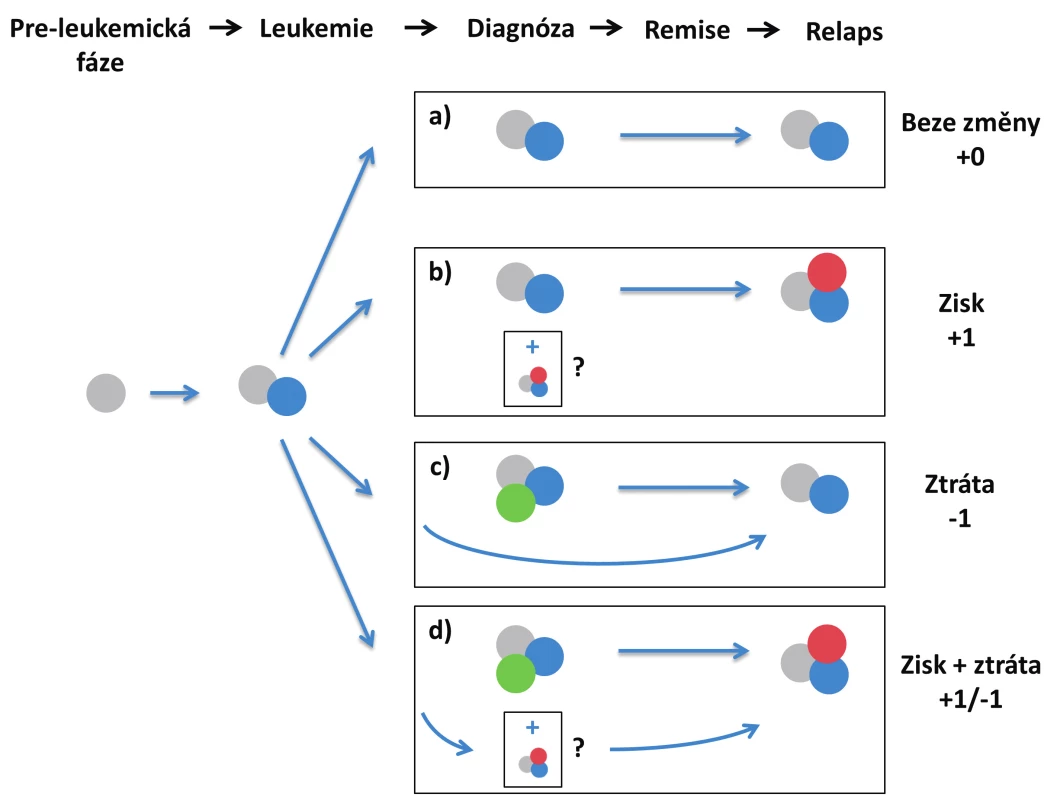
Minoritní mutace/klony s VAF kolem 5 % je možné nezohledňovat. V případě zisku mutace v relapsu (b) tak není rozlišováno, jestli došlo k jejímu nabytí v průběhu léčby nebo se jedná o expanzi minoritního klonu přítomného již v době diagnózy. Z hlediska klinického hodnocení to umožňuje univerzální klasifikaci relapsů i za použití metod s různou citlivostí nebo s různým počtem sekvenovaných genů. Z pohledu klonality, nestabilní mutace, které se objevují nebo zanikají v době relapsu, identifikují subklony s různou proliferační aktivitou a rezistencí na terapii. Jedná se zpravidla o pozdní/přidružené mutace, přičemž bylo popsáno, že mutace v genech rodiny RAS u AML častěji zanikají/klesají, zatímco mutace genu FLT3 se v relapsu častěji objevují/rostou [24]. Podle vědomostí autorů, dosud chybí obecné informace o zastoupení jednotlivých mutací v době relapsu, pocházející z jednotného, většího souboru pacientů.
V některých případech AML byly popsány i rozdíly ve fenotypu a morfologii jednotlivých subklonů, které tvořily odlišné buněčné populace s rozdílnou schopností přežít léčbu a vyvolat relaps [6]. Je popsán případ pacienta s akutní monocytární leukemií, kde monocyty představovaly hlavní klon a blasty minoritní klon, přičemž diferencovanější monocytární klon byl eradikován léčbou, zatímco primitivní blastický subklon později vyvolal relaps, což bylo určeno na základě rozdílných mutací přítomných v obou klonech [25]. Shlush et al. dále dokumentovali na skupině 11 pacientů, že v některých případech vznikal relaps pouze z leukemických kmenových buněk, nebo pouze z blastů [5].
Kromě hierarchicky uspořádané klonality byla u AML popsána i existence nemaligních mutantních klonů nezávislých na AML, označených jako „narůstající klony“ (z angl. rising clones) [26]. Tyto klony se vyskytovaly ve velmi nízké frekvenci (< 0,75 %) již v době diagnózy. Po indukční terapii rychle expandovaly (pravděpodobně díky růstové výhodě a zároveň sníženému počtu ostatních hematopoetických buněk) a v remisi i relapsu koexistovaly bez ohledu na vývoj relabujícího leukemického klonu. Tato data dokládají klonální spletitost AML a ukazují, že k přesnému určení klonální hierarchie je často potřeba použít vysoce citlivých metod a provést analýzu materiálu také z remise nebo relapsu pacienta, případně izolovaných buněčných frakcí.
ZÁVĚR
Data ze sekvenačních studií poskytují nový pohled na klonální organizaci AML. Ukazuje se, že při detekci jednotlivých mutací je důležité stanovení frekvence (VAF) k rozlišení mutací stojících na začátku leukemogeneze a pozdních mutací, které dávají vzniknout dceřiným sub/klonům. Je nutno poznamenat, že role jednotlivých mutací se může lišit u různých pacientů, obecně se však ukazuje, že mutační hierarchie se opakuje. Typickým příkladem je často pozorovaná kombinace zakládající mutace DNMT3A (preleukemický klon), progresorové mutace NPM1 (prvotní leukemický klon) a pozdní mutace FLT3 (subklon). Z hlediska eradikace leukemie cílenou léčbou je proto nutné identifikovat a zaměřit se na mutace v prvotních leukemických klonech. Vhodnými se jeví inhibitory DNMT3A a IDH1/2. Nicméně, jejich použití nevede k uniformnímu vymýcení leukemických buněk z důvodu širokého epigenetického vlivu daných mutací. Při cílení na pozdní subklonální mutace v genu FLT3, pomocí FLT3 inhibitorů, pak lze z principu očekávat pouze eradikaci části leukemických buněk nesoucích tuto mutaci, nikoliv však prvotního leukemického klonu, u kterého ještě nebyla přítomna. U pacientů se zakládajícími mutacemi, typicky v epigenetických modifikátorech, např. DNMT3A, TET2, IDH2, byla pozorována perzistence preleukemické klonální hematopoé-zy i v době remise. Nemaligní preleukemické buňky se zdají být náchylnější k hromadění dalších mutací, čímž slouží jako zdroj pro tvorbu nových maligních klonů vedoucích k relapsu. Nepřímým důkazem je pozorované kratší přežití do selhání (EFS, z angl. event free survival) a kratší celkové přežití (OS, z angl. overall survival) [11, 27]. U daných pacientů je pak možné zvažovat přínos alogenní transplantace krvetvorných buněk, kterou by bylo možné indikovat již při stanovení diagnózy na základě přítomnosti preleukemických mutací v izolovaných lymfocytech.
Jak bylo zmíněno výše, vědecky přesné a správné definování klonálního vývoje u jednotlivých AML případů vyžaduje použití velmi citlivých metod pro odhalení všech minoritních (sub)klonů. I tak zde ale zůstávají biologické limitace – odebraný vzorek kostní dřeně nemusí dostatečně reprezentovat celou kostní dřeň, případně jiné tkáně osídlené leukemickou krvetvorbou. Detailnější poznání klonální kinetiky nádorových onemocnění může být umožněno novými sekvenačními metodami nebo zaměřením se na sekvenování genomu a transkriptomu jednotlivých buněk. Z prognostického hlediska je možné do budoucna očekávat nejenom zohledňování přítomnosti jednotlivých mutací ale i frekvence jejich výskytu (VAF). Zavedení metod NGS do běžné diagnostické praxe pak bude vyžadovat ucelené metody/algoritmy pro vyhodnocování sekvenačních dat, dále snížení nákladů na přístrojové vybavení i sekvenační chemii a v neposlední řadě určení prognostického významu všech analyzovaných mutací nebo jejich specifických kombinací.
Podíl autorů na přípravě rukopisu
MČ – návrh a příprava první verze rukopisu
ZK, IJ, AF, DD, LS, ZŠ, ZR – kritická revize rukopisu a schválení konečné verze
Poděkování
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 15-25809A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Tato publikace vznikla na Masarykově univerzitě v rámci projektu „Nové přístupy ve výzkumu, diagnostice a terapii hematologických malignit III“, číslo MUNI/A/1106/2016 podpořeného z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2017.
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 13. 7. 2017.
Přijato po recenzi dne 7. 9. 2017.
PharmDr. Martin Čulen, Ph.D.
Interní hematologická a onkologická klinika LF MU
Kamenice 5
625 00 Brno
e-mail: mculen@gmail.com
Sources
1. Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016;127 : 2391–2405.
2. Falini B, Mecucci C, Tiacci E, et al. Cytoplasmic nucleophosmin in acute myelogenous leukemia with a normal karyotype. N Engl J Med 2005;352 : 254–266.
3. Cancer Genome Atlas Research N. Genomic and epigenomic landscapes of adult de novo acute myeloid leukemia. N Engl J Med 2013;368 : 2059–2074.
4. Metzeler KH, Herold T, Rothenberg-Thurley M, et al. Spectrum and prognostic relevance of driver gene mutations in acute myeloid leukemia. Blood 2016;128 : 686–698.
5. Shlush LI, Zandi S, Mitchell A, et al. Identification of pre-leukaemic haematopoietic stem cells in acute leukaemia. Nature 2014;506 : 328–333.
6. Corces-Zimmerman MR, Hong W-J, Weissman IL, Medeiros BC, Majeti R. Preleukemic mutations in human acute myeloid leukemia affect epigenetic regulators and persist in remission. P Natl Acad Sci USA 2014;111 : 2548–2553.
7. Busch K, Klapproth K, Barile M, et al. Fundamental properties of unperturbed haematopoiesis from stem cells in vivo. Nature 2015;518 : 542–546.
8. Sun J, Ramos A, Chapman B, et al. Clonal dynamics of native haematopoiesis. Nature 2014;514 : 322–327.
9. Pløen GG, Nederby L, Guldberg P, et al. Persistence of DNMT3a mutations at long-term remission in adult patients with AML. Brit J Haematol 2014;167 : 478–486.
10. Jeziskova I, Musilova M, Culen M, et al. DNMT3a gene: Distribution of the mutations and their stability during treatment in patients with AML. Ann Hematol 2015;94: S78–S78.
11. Thol F, Klesse S, Kohler L, et al. Acute myeloid leukemia derived from lympho-myeloid clonal hematopoiesis. Leukemia 2017;31 : 1286–1295.
12. Jaiswal S, Fontanillas P, Flannick J, et al. Age-related clonal hematopoiesis associated with adverse outcomes. N Engl J Med 2014;371 : 2488–2498.
13. Genovese G, Kahler AK, Handsaker RE, et al. Clonal hematopoiesis and blood-cancer risk inferred from blood DNA sequence. N Engl J Med 2014;371 : 2477–2487.
14. Jaiswal S, Natarajan P, Silver AJ, et al. Clonal hematopoiesis and risk of atherosclerotic cardiovascular disease. N Engl J Med 2017;377 : 111–121.
15. Bursen A, Schwabe K, Ruster B, et al. The AF4.MLL fusion protein is capable of inducing ALL in mice without requirement of MLL.AF4. Blood 2010;115 : 3570–3579.
16. So CW, Karsunky H, Passegue E, et al. MLL-GAS7 transforms multipotent hematopoietic progenitors and induces mixed lineage leukemias in mice. Cancer Cell 2003;3 : 161–171.
17. Haferlach C, Kohlmann A, Kern W, Haferlach T, Schnittger S. Cytogenetic and molecular genetic characterization of MLL-PTD positive AML in comparison to MLL-translocated AML. Blood 2013;122 : 2557.
18. Sun QY, Ding LW, Tan KT, et al. Ordering of mutations in acute myeloid leukemia with partial tandem duplication of MLL (MLL-PTD). Leukemia 2017; 31 : 1–10.
19. Weisser M, Kern W, Schoch C, et al. Risk assessment by monitoring expression levels of partial tandem duplications in the MLL gene in acute myeloid leukemia during therapy. Haematologica 2005;90 : 881–889.
20. Welch JS, Ley TJ, Link DC, et al. The origin and evolution of muta-tions in acute myeloid leukemia. Cell 2012;150 : 264–278.
21. Hirsch P, Zhang Y, Tang R, et al. Genetic hierarchy and temporal variegation in the clonal history of acute myeloid leukaemia. Nat Commun 2016;7 : 12475.
22. Shouval R, Shlush LI, Yehudai-Resheff S, et al. Single cell analysis exposes intratumor heterogeneity and suggests that FLT3-ITD is a late event in leukemogenesis. Exp Hematol 2014;42 : 457–463.
23. Jeziskova I, Musilova M, Culen M, et al. Distribution of mutations in DNMT3a gene and the suitability of mutations in R882 codon for MRD monitoring in patients with AML. Int J Hematol 2015;102 : 553–557.
24. Vosberg S, Hartmann L, Metzeler KH, et al. Evolutionary patterns of cytogenetically normal acute myeloid leukemia correlate with time to relapse. Blood 2016;128 : 288.
25. Klco JM, Spencer DH, Miller CA, et al. Functional heterogeneity of genetically defined subclones in acute myeloid leukemia. Cancer Cell 2014;25 : 379–392.
26. Wong TN, Miller CA, Klco JM, et al. Rapid expansion of preexisting nonleukemic hematopoietic clones frequently follows induction therapy for de novo AML. Blood 2016;127 : 893–897.
27. Klco JM, Miller CA, Griffith M, et al. Association between mutation clearance after induction therapy and outcomes in acute myeloid leukemia. JAMA 2015;314 : 811–822
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2017 Issue 4-
All articles in this issue
- 25 let Českého národního registru dárců dřeně (ČNRDD) a Nadace pro transplantace kostní dřeně
- Epigenetické změny jako nový nástroj pro prognostickou stratifikaci pacientů s chronickou lymfocytární leukemií
- Angioimunoblastický T-lymfom: přehled problematiky, zkušenosti centra a kazuistika sekvenčního vzniku difuzního velkobuněčného B-lymfomu
- Sekvenování nové generace u akutní myeloidní leukemie: nový pohled na patogenezi a vývoj leukemických klonů
- Možnost ukončení terapie tyrozin-kinázovými inhibitory u nemocných s chronickou myeloidní leukemií a koncept „treatment-free remission“
- První perorální inhibitor proteazomu v léčbě relabujícího/refrakterního mnohočetného myelomu
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Angioimunoblastický T-lymfom: přehled problematiky, zkušenosti centra a kazuistika sekvenčního vzniku difuzního velkobuněčného B-lymfomu
- Sekvenování nové generace u akutní myeloidní leukemie: nový pohled na patogenezi a vývoj leukemických klonů
- Možnost ukončení terapie tyrozin-kinázovými inhibitory u nemocných s chronickou myeloidní leukemií a koncept „treatment-free remission“
- První perorální inhibitor proteazomu v léčbě relabujícího/refrakterního mnohočetného myelomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

