-
Medical journals
- Career
Autoimunitní hemolytická anémie – diagnostika a léčba, včetně transfuze erytrocytů
Authors: M. Lukášová 1; J. Procházková 2; A. Hluší 2
Authors‘ workplace: Hemato-onkologická klinika Fakultní nemocnice Olomouc 1; Hemato-onkologická klinika, Lékařská fakulta Univerzity Palackého v Olomouci a Fakultní nemocnice Olomouc 2
Published in: Transfuze Hematol. dnes,23, 2017, No. 1, p. 41-51.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Diagnostika autoimunitní hemolytické anémie nečiní obvykle potíže. Je založena na klinickém a laboratorním obrazu hemolytické anemie a sérologické detekci antierytrocytárních autoprotilátek. Výjimku tvoří 5–10 % případů, u nichž se průkaz antierytrocytárních autoprotilátek konvenčními metodami nezdaří. Komplikovanější je však otázka terapie, zejména rozhodovací proces při indikaci splenektomie. Vzhledem k relativní vzácnosti onemocnění chybí robustní, prospektivní, randomizované srovnávací studie. Při terapii onemocnění refrakterních na více léčebných linií, či tak vzácných, jako je potransplantační autoimunitní hemolytická anémie, jsme odkázáni na popisy jednotlivých případů.
KLÍČOVÁ SLOVA:
autoimunitní hemolytická anémie – diagnostika – léčba – autoimunitní hemolytická anémie s tepelnými protilátkami – autoimunitní hemolytická anémie s chladovými protilátkamiÚVOD – PATOGENEZE, KLASIFIKACE
Autoimunitní hemolytické anémie (AIHA) jsou heterogenní skupinou onemocnění podmíněných tvorbou autoprotilátek proti nejrůznějším povrchovým antigenům exprimovaným na vlastních erytrocytech. Destrukce erytrocytů probíhá s účastí či bez účasti aktivovaného komplementu. Typ hemolýzy je ovlivněn třídou a titrem autoprotilátky. K intravaskulární hemolýze dochází při aktivaci C1q složky komplementu, ke které je nutná vazba se dvěma receptory na Fc fragmentu protilátky. IgM protilátka vzhledem ke své pentamerické struktuře je schopna aktivace C1q složky komplementu i při nižších titrech, IgG protilátka je však monomer, může tedy aktivovat C1q složku komplementu jen při vysokých titrech.
Patogeneze AIHA zůstává stále v mnoha ohledech nejasná, z dosavadních poznatků je však zřejmé, že stěžejním momentem je porucha kooperace mezi T a B lymfocyty a mezi jednotlivými subpopulacemi T lymfocytů navzájem. Tato dysregulace vyúsťuje v nedostatečné potlačení tvorby protilátek proti vlastním antigenům nebo dokonce ve stimulaci jejich tvorby, dochází k nerovnováze mezi autoimunní protekcí a autoimunitní reakcí [1]. CD4+ pomocné T (Th) lymfocyty jsou děleny na dvě hlavní subpopulace Th1 (obecně podporující cytotoxickou, buněčnou imunitní odpověď, působí prozánětlivě) a Th2 (obecně podporující protilátkovou imunitní odpověď, působí protizánětlivě), nerovnováha produkce těchto dvou hlavních subpopulací Th lymfocytů se uplatňuje v patogenezi AIHA. S novými poznatky roste význam CD4+/CD25+ regulačních T lymfocytů (Treg) odvozených od Th1, které u zdravého člověka tvoří přibližně 5 % CD4+ T lymfocytů a jsou silnými supresory autoreaktivní T buněčné odpovědi, hrají tedy zásadní protektivní roli v rozvoji autoimunitních onemocnění [1, 2, 3]. V souladu s výše uvedeným bylo v periferní krvi pacientů s AIHA zjištěno statisticky významně nižší procento cirkulujících Treg v porovnání se zdravými kontrolami [4]. Relativně nedávno byl popsán Th17 subtyp Th lymfocytů, který je charakterizován produkcí prozánětlivého interleukinu (IL) 17 a je zapojen v autoimunitní reakci. Ukazuje se, že zvýšené zastoupení Th17, potažmo zvýšená hladina IL-17, úzce koreluje s aktivitou onemocnění [5]. Také nerovnováha mezi IL-10 a IL-12 může mít zásadní roli v rozvoji AIHA a v udržení aktivity choroby [4]. IL-10 podporuje produkci protilátek B lymfocyty, zatímco IL-12 podporuje buňkami zprostředkovanou imunitu a potlačuje protilátkovou imunitní odpověď. Výzkum abnormalit imunoregulačních cytokinů je v současnosti v popředí zájmu, a to nejen v případě AIHA, což pravděpodobně souvisí také s možnými terapeutickými konsekvencemi získaných výsledků. Dalším z uplatňujících se mechanismů je nedostatečně efektivní prezentace vlastních antigenů, dochází k poruše apoptózy a nedostatečnému útlumu autoreaktivních T lymfocytů. Antigen prezentující buňky (APC) předkládají za normálních okolností vlastní antigeny autoreaktivním T lymfocytům k navození T buněčné tolerance [1]. Funkční abnormality B a T lymfocytů může také navodit, prostřednictvím polyklonální lymfocytární aktivace, těžká virová či parazitární infekce nebo chronická reakce štěpu proti hostiteli [1]. Tabulka 1 shrnuje hlavní imunologické abnormality zapojené v patogenezi AIHA.
Table 1. Hlavní imunologické abnormality zapojené v patogenezi AIHA 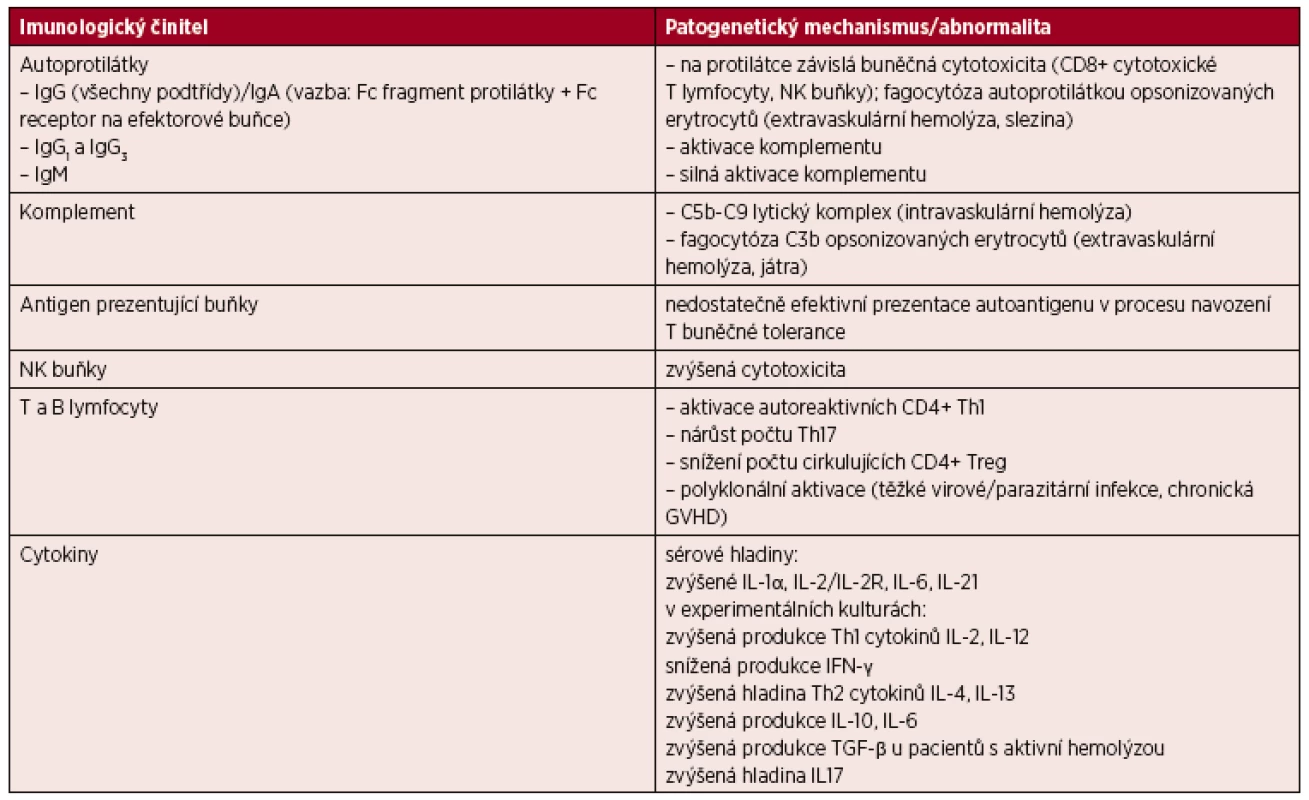
Vysvětlivky: AIHA – autoimunitní hemolytická anémie, Ig – imunoglobulin, CD – cluster of differentiation, diferenciační skupina, NK – natural killer , Th – pomocný T lymfocyt, Treg – T regulační lymfocyt, GVHD – reakce štěpu vůči hostiteli (graft versus host disease) , IL – interleukin, INF – interferon, TGF – transforming growth factor . Incidence AIHA u dospělé populace je odhadována na 1 případ na 100 000 obyvatel za rok [6], prevalence 17 na 100 000 obyvatel, úmrtnost je nejčastěji udávána 11 % [7], v některých novějších publikacích kolem 4 % [8].
Podle spouštěcího mechanismu rozlišujeme AIHA primární (idiopatické, 50 %) a sekundární, indukované jiným onemocněním – nejčastěji při lymfoproliferativních stavech (20 %), autoimunitních chorobách (20 %), infekcích a tumorech [7, 8, 9]. Základní klasifikace AIHA je postavena na teplotním reakčním optimu detekovaných autoprotilátek. AIHA s tepelnými protilátkami (WAIHA) představuje 70 % případů. Druhou nejpočetnější skupinu (15 %) představuje AIHA s chladovými protilátkami, nazývaná nemocí chladových aglutininů (CAD). Ze skupiny chladových protilátek jsou vyčleněny bifázické (Donath-Landsteinerovy) protilátky uplatňující se při paroxysmální chladové hemoglobinurii (PCH, 2 %). Při současné detekci tepelných i chladových protilátek hovoříme o AIHA smíšeného typu (8 %) [6, 7, 9], tato forma bývá často asociována se systémovým lupus erythematodes (SLE, 25 %).
Samostatně uváděné jsou polékové imunitní hemolytické anémie (DIHA, 12 %). Je popsáno více než 100 různých vyvolávajících léků. Jejich vlivem dochází k indukci „pravé“ antierytrocytární autoprotilátky (např. metyldopa, fludarabin) nebo je hemolýza erytrocytů závislá na přítomnosti vyvolávajícího léku, připomíná aloimunitní hemolýzu – „allo-like“ DIHA [10]. „Allo-like“ DIHA může vznikat několika mechanismy. V prvním případě se lék váže na membránu erytrocytu, kde působí jako antigen a vyvolá tvorbu protilátek, které se vážou na membránu krvinky, jde o tzv. haptenový typ (např. penicilin, cefalosporiny, tetracykliny). Ve druhém případě lék či jeho metabolit vázaný s některou plazmatickou bílkovinou indukuje tvorbu protilátek, tyto se vážou s indukující látkou, vytváří se tak imunokomplexy, které adherující k membráně erytrocytu a poškozují ji (např. chinidin, diklofenak). Ve třetím případě je imunitním podnětem komplex erytrocyt – navázaný lék [11]. Toto klasické dělení DIHA má však své limitace, neboť některé léky mohou u jednoho pacienta působit více způsoby a/nebo u různých pacientů fungovat odlišně [10].
Zvláštní kapitolu tvoří Evansův syndrom (ES), definovaný jako výskyt dvou nebo více hematologických imunitních cytopenií, nejčastěji WAIHA a imunitní trombocytopenie (ITP). Přibližně u poloviny pacientů doprovází jinou autoimunitní poruchu, často SLE.
DIAGNOSTIKA
Klinický obraz, průkaz hemolytické anémie/hemolýzy
Klinický obraz je velmi variabilní, odvíjí se od rychlosti vzniku a intenzity hemolýzy (akutní/chronická forma) a jejího typu (extravaskulární/intravaskulární hemolýza), je modifikován kompenzační schopností erytropoézy, věkem, komorbiditou a celkovou kondicí pacienta, případně základním onemocněním. Setkáváme se tedy s projevy od mírné hemolýzy, kdy může být rozpad erytrocytů kompenzován jejich zvýšenou produkcí v kostní dřeni (hemolytický syndrom se subikterem/ikterem), přes postupně se prohlubující anémii s různě vyjádřenou škálou subjektivních obtíží a s objektivním nálezem odvíjejícím se od tíže anémie (anemický syndrom), až po život ohrožující akutně vzniklou těžkou intravaskulární hemolýzu s horečkou, třesavkou, bolestmi v bedrech, ikterem, tmavou močí, se selháním ledvin a poruchou vitálních funkcí (hemolytická krize).
V krevním obraze vidíme různě hlubokou normocytární až mírně makrocytární anémii. Laboratorní vyšetření cílíme na průkaz hemolýzy – zvýšený nepřímý bilirubin a laktát dehydrogenáza (LDH), snížený haptoglobin, retikulocytóza. V nátěru periferní krve můžeme pozorovat sférocytózu, anizocytózu, polychromázii, případně penízkovatění erytrocytů (tvorba „řetízků“) způsobené zvýšenou hladinou sérových bílkovin navázaných na povrchu erytrocytů. Vzácně se setkáme s aglutinací erytrocytů (tvorba „shluků“) vlivem autoprotilátek IgM. U těžších forem můžeme vidět přítomnost normoblastů, dále Howell-Jollyho tělíska (HJ, bazofilní tělíska v erytrocytech, zbytky DNA) jako projev dysfunkce sleziny. Případy s intravaskulární hemolýzou provází volný hemoglobin v séru, hemoglobinurie a hemosiderinurie (s latencí). Při chronickém průběhu hemolýzy lze prokázat splenomegalii a mírnou hepatomegalii.
Odrazem přítomné reaktivní hyperplazie erytropoézy je retikulocytóza v periferní krvi. Při chronické hemolýze (za předpokladu nepoškozené kostní dřeně) odráží retikulocytóza intenzitu hemolýzy a koreluje se zvýšeným středním objemem erytrocytů [12]. Při nižším vzestupu retikulocytů, než by odpovídalo stupni anémie, vylučujeme i možné nutriční deficity (železo, vitamin B12, kyselina listová). Retikulocytopenie je popisována u 20 % AIHA dospělých a 39 % AIHA dětí, může být důsledkem autoimunitní reakce proti erytroidním prekurzorům kostní dřeně, často jde o klinicky závažný stav s horší prognózou [7, 13]. K vyšetření kostní dřeně přistupujeme v rámci diferenciální diagnostiky sekundárních forem AIHA.
Na CAD upozorní cyanotické zbarvení aker v chladu (Raynaudův fenomén), způsobené aglutinací erytrocytů při ochlazení krve v krevním řečišti periferních částí těla. Někdy je možné pozorovat livedo reticularis, vzácně se rozvíjí i kožní nekróza.
Charakteristický klinický obraz má PCH, kdy po vystavení chladu dochází k intravaskulární hemolýze s následnou hemoglobinurií. Dříve PCH provázela terciární a vrozenou syfilis. V současnosti je onemocněním dětského věku spjatým s virovými infekcemi, hemolýza bývá prudká, s bolestí hlavy, břicha a zad, s třesavkou, výrazným poklesem v krevním obraze, po několika dnech dochází většinou ke spontánní úpravě. Výjimečně se setkáváme s idiopatickou chronickou formou.
Klinické projevy u „allo-like“ DIHA při prvním kontaktu s lékem nastupují za cca 5 dnů po podání, uplatňuje se primární imunitní odpověď. Při opětovné expozici se díky sekundární imunitní odpovědi mohou symptomy objevit již po první dávce léku.
Retrospektivní studie GIMEMA (308 pacientů s primární AIHA) se zabývala mimo jiné i trombotickými komplikacemi. Trombotické příhody byly statisticky významně asociovány s iniciální hladinou hemoglobinu (Hb) ≤ 60 g/l, intravaskulární hemolýzou a předchozí splenektomií [8].
Odlišení sekundární formy AIHA
Anamnesticky pátráme po infekci (zejména dýchacích cest), odebíráme sérologická či PCR vyšetření na HIV, HCV a EBV (WAIHA), na Mycoplasma pneumoniae a infekční mononukleózu (CAD). Vylučujeme autoimunitní onemocnění (zejména SLE, thyreoiditidu), lymfoproliferativní choroby či jiné malignity. Využíváme revmatologické screeningové testy, vyšetření orgánově specifických autoprotilátek a nádorových markerů. Je známo, že až 18 % idiopatických AIHA předchází s mediánem 2 roky diagnóze lymfoproliferace a naopak až u třetiny pacientů s chronickou lymfatickou leukemií (CLL) se v průběhu onemocnění rozvíjí WAIHA [9].
Průkaz antierytrocytárních autoprotilátek
Rychlost a typ hemolýzy jsou dány vlastnostmi antierytrocytárních autoprotilátek: třída, podtřída, teplotní amplituda, účinnost při aktivaci komplementu, koncentrace/titr a specificita. Základními vyšetřeními k jejich průkazu a bližší identifikaci jsou sérologické imunohematologické testy.
Přímý antiglobulinový (Coombsův) test (PAT) prokazuje autoprotilátky/složky komplementu navázané in vivo na povrchu erytrocytů pacienta. Vyšetření se primárně provádí s polyspecifickým antiglobulinovým sérem (anti-IgG + anti-C3d; AGH), výjimečně je schopna antiglobulinová složka tohoto séra reagovat i s IgA či IgM. Kvalitativní upřesnění nálezu ve smyslu odlišení IgG a C3d, detekce IgA a IgM i určení podtříd IgG je možné pomocí monospecifických diagnostik [1, 10, 14].
Nepřímý antiglobulinový test (NAT) detekuje vazbu erytrocyt-protilátka/erytrocyt-C3 složka komplementu vzniklou in vitro, prokazuje tedy přítomnost volných autoprotilátek v séru pacienta, určuje jejich specificitu a titr. Vyšetření lze doplnit enzymovým testem. Působením proteolytických enzymů jsou odštěpeny extramembranózní části některých proteinů. Tím dochází k arteficiálnímu přiblížení dvou krvinek na vzdálenost, kterou přemostí i IgG autoprotilátky a také k odhalení/zpřístupnění některých antigenů, jiné antigeny jsou naopak tímto způsobem destruovány.
Síla a charakter nálezu PAT a NAT se mohou v průběhu onemocnění a léčby vyvíjet, závisí i na použité testovací metodě, citlivost zkumavkového testu je nižší než sloupcové aglutinace (gelový test).
Výsledek konvenčně prováděného PAT je u 5–10 % AIHA negativní [7, 9, 13, 14], tyto atypické případy mohou být způsobeny tepelnými IgM autoprotilátkami, které můžeme identifikovat například duálním PAT, využívajícím dvou antiglobulinových činidel (anti-IgM a anti-IgG) [15, 16]. V identifikaci PAT negativních AIHA se uplatňují i další testy s vyšší senzitivitou, zejména na průtokové cytometrii založený PAT, který stanoví relativní množství imunoglobulinů/složek komplementu navázaných na erytrocytech (cut-off 17,5 % [17]) [19, 20]. V roce 2003 popsali Barcellini et al. průkaz antierytrocytárních autoprotilátek na mitogenem stimulovaných kulturách plné krve (MS-DAT) [18]. Možnost využití monospecifických diagnostických sér a enzymového testu již byla zmíněna, také se uplatňují ELISA metodiky [1, 21].
AIHA s tepelnými protilátkami
Tepelné protilátky jsou převážně třídy IgG (IgG1 90 %, IgG3 10 %, ostatní podtřídy vzácně). K optimální vazbě na erytrocyty dochází při tělesné teplotě 37 °C. Autoprotilátkami, eventuálně komplementem opsonizované erytrocyty jsou vázány na receptory makrofágů (Fc respektive C3b receptory), v případě IgG autoprotilátek zejména ve slezině, jsou sekvestrovány a extravaskulárně hemolyzovány. Fc-receptory makrofágů jsou vysoce afinitní pro IgG3, méně afinitní pro IgG1, slabě afinitní pro IgG2 a žádné pro IgG4. Podtřídy IgG1 a IgG3 jsou také schopné aktivovat komplement. Těmito charakteristikami je dána účinnost jednotlivých podtříd IgG v rozvoji hemolýzy, tedy jejich klinická významnost. V ojedinělých případech je WAIHA zprostředkována tepelnými IgM autoprotilátkami, tyto formy mívají fulminantní průběh a nereagují dostatečně na kortikoterapii.
Typická pro WAIHA je IgG i C3d pozitivita PAT, častá je také jen IgG pozitivita. Pouze C3d pozitivita PAT je vzácná a setkáváme se s ní při nízkém titru protilátek. Může jít o klinicky závažnou situaci, kdy je počet molekul IgG navázaných na erytrocyt potřebných k indukci fagocytózy a aktivaci komplementu nižší než citlivost užitého testu (IgG3). Diferenciálně diagnosticky je při izolované C3d pozitivitě PAT nutné zvážit PCH. Stejně tak je vzácná izolovaná pozitivita IgA či IgM [10, 14]. Ve 40 % případů současně prokazujeme pozitivitu NAT, ještě častěji bývá prokázána pozitivita enzymových testů. V ojedinělých případech se setkáme s nálezem PAT-/NAT+ [10]. Autoprotilátky jsou zaměřeny nejčastěji proti antigenům Rh systému (anti-e), ale byly popsány případy specificity téměř ve všech erytrocytárních systémech a i mimo systémy krevních skupin. Vzácně nelze specificitu autoprotilátky určit.
AIHA s chladovými protilátkami
Chladové protilátky (chladové aglutininy, CA) jsou převážně typu IgM, optimálně reagují při 4 °C, jejich teplotní amplituda může však být velmi široká, pohybuje se od 0 až do 37 °C. K vazbě na erytrocyty dochází tedy při teplotě nižší než 37 °C (většinou pokojové 23 až32 °C). Nejčastěji jsou zjišťovány CA proti antigenům I/i. Vzhledem ke své pentamerické struktuře jsou IgM schopny přímého shlukování (aglutinace) erytrocytů a účinné aktivace komplementu klasickou cestou (vazbou C1 složky), hemolýza může tedy probíhat extravaskulárně i intravaskulárně. Při chronickém průběhu je zřejmý extravaskulární podíl, zejména v játrech, kde jsou Kupferovými buňkami destruovány erytrocyty opsonizované C3b složkou komplementu [14].
Vzhledem k typu protilátky a aktivaci komplementu je pro CAD příznačná IgG negativita a C3d pozitivita PAT (mimo vzácné případy CAD s IgG autoprotilátkami). CAD jsou typické titry autoprotilátek vyššími než 2 000 (titr udává nejvyšší ředění vzorku séra, při kterém dojde při 4 °C k viditelné aglutinaci erytrocytů). U idiopatické CAD můžeme zjistit i extrémně vysoké titry autoprotilátek (50 000–100 000). Při titrech nižších než 512 se s hemolýzou setkáme zřídka. CA jsou v nízkém titru (obvykle méně než 10) přítomny prakticky u všech zdravých jedinců [10, 22]. Testy je nutné provést co nejdříve po odběru a zajistit teplotu (zejména transportu a zpracování) 37 °C, nebo ihned oddělit plazmu a erytrocyty. Klinicky nejzávažnější jsou autoprotilátky s širším teplotním rozmezím, neboť pro součinnost obou mechanismů (vazba IgM na erytrocyty, aktivace komplementu) je optimální rozmezí 20–22 °C. Patogenní chladové aglutininy lze tedy odlišit od benigních schopností reaktivity při 20 °C v 30 % hovězím albuminu.
Při potvrzení CAD je nezbytné provést vyšetření zaměřená na průkaz lymfoproliferace [22, 23]: imunoglobuliny v séru, elektroforézu proteinů séra, imunofixaci a zejména vyšetření aspirátu kostní dřeně cytologicky a průtokovou cytometrií, eventuálně biopsii kostní dřeně. Při průkazu monoklonálního IgM kappa je pravděpodobnost lymfoproliferace velmi vysoká, především u Waldenströmové makroglobulinemie či lymfomu marginální zóny. Paraneoplastické a idiopatické CAD bývají zapříčiněny monoklonálními autoprotilátkami, zatímco CAD spojené s infekcí vyvolávají autoprotilátky polyklonální.
Paroxysmální chladová hemoglobinurie
Přímou komplementem mediovanou intravaskulární hemolýzu (C5b–C9 lytickým komplexem) působí jen malá část autoprotilátek (některé klinicky významné aglutininy, Donath-Landsteinerův bifázický hemolyzin a některé „lék-dependentní“ autoprotilátky). Takzvaný bifázický Donath-Landsteinerův hemolyzin je polyklonální chladová komplement-fixující protilátka třídy IgG (zřídka IgM), specificity nejčastěji anti-P. V ochlazených částech těla se váže na erytrocyty, které jsou při tělesné teplotě 37 °C intravaskulárně hemolyzovány aktivovaným komplementem. Hemolyzin sám se v teplejších částech těla z vazby na krvinky uvolňuje. Výsledek imunohematologického vyšetření je tedy následující: pouze C3d pozitivita PAT, hemolyzin na krvinkách prokázán není, pozitivita NAT obvykle s nepříliš silnou reaktivitou (0–4 °C) a v relativně nízkém titru. Diagnostickým je test bifázické hemolýzy (DL test). Krvinky (0, P+), inkubované za chladu s protilátkou, po přenesení do 37 °C a za přítomnosti komplementu hemolyzují. Senzitivitu testu lze zvýšit přidáním papainu, čímž se lépe zpřístupní P antigen. [10, 14]
Polékové imunitní hemolytické anémie
„Pravé“ antierytrocytární autoprotilátky indukované léky jsou laboratorně neodlišitelné od WAIHA. K průkazu protilátek závislých na léku, vznikajících jedním z výše uvedených mechanismů, je nutná přítomnost léku/jeho metabolitu získaného ze séra či moče pacientů/dobrovolníků užívajících stejný lék.
TERAPIE
Primárním cílem je dosažení úplné normalizace hodnot hemoglobinu, vymizení známek hemolýzy a negativita PAT bez nutnosti udržovací terapie („kompletní remise“). Sekundárním cílem je co nejlepší kvalita života pacienta s uspokojivými hodnotami krevního obrazu s minimálními nežádoucími účinky léčby („parciální remise“) [24]. Kritéria léčebných odpovědí nejsou jednoznačně definována; toto je nutné brát v úvahu zejména při interpretaci a srovnávání publikovaných dat.
AIHA s tepelnými protilátkami
První linie
Léčbou 1. volby jsou kortikosteroidy, iniciální dávka prednisonu p. o. je 1–1,5 mg/kg/den, v závažných případech methylprednisolon i. v. 250–500 mg denně 3–5 dnů, s následným převodem na perorální léčbu. Jiná schémata udávají methylprednisolon i. v. 100–200 mg/den 10–14 dní nebo 250–1000 mg/den po dobu 1–3 dnů. Iniciální dávka prednisonu je podávána do dosažení hladiny hemoglobinu 100 g/l, poté během několika týdnů redukujeme na 20–30 mg/den. Rychlost snižování přizpůsobujeme rychlosti, jakou se stav upravoval, obvykle s poklesem o 10–15 mg týdně. Následně dávku upravujeme velmi pozvolně: o 2,5–5 mg měsíčně či o 5 mg co 1–2 týdny do dávky 15 mg/den, dále o 2,5 mg co 1–2 týdny [1, 7, 24]. K minimalizaci nežádoucích účinků je vhodné využít tzv. alternativního dávkování (např. při potřebné dávce 5 mg/den podáváme 10 mg obden) [24]. Minimální dávku ponecháváme alespoň 3–4 měsíce. Pokud pacient setrvává po celou dobu v remisi, lze zvážit úplné vysazení. U pacientů užívajících nízké dávky kortikosteroidů více než 6 měsíců je popisován nižší výskyt relapsu a delší trvání remise než při dřívějším ukončení léčby [7]. Iniciální kortikoterapií dosáhne 80 % pacientů léčebné odpovědi, avšak až u 50 % z nich může dojít k recidivě, jen 20–30 % pacientů zůstává po vysazení kortikoterapie v dlouhodobé remisi [6, 7, 9, 25, 26].
Přechod na 2. léčebnou linii je nutný:
- Nedojde-li ani po třech týdnech iniciálního dávkování kortikosteroidů k dosažení hladiny hemoglobinu 100 g/l (primárně refrakterní choroba).
- Je-li k udržení uspokojivé hladiny hemoglobinu 90–100 g/l nutná vyšší dávka prednisonu, než je pro dlouhodobé užívání akceptovatelné (tedy více než 15 mg/den, hodnoceno po 6 měsících léčby).
- Pozorujeme-li netolerovatelné nežádoucí účinky [1, 9, 24].
- Dochází-li k opakovaným relapsům (zejména během 1. roku).
U všech těchto pacientů je také vhodné opětovné přešetření možné sekundární etiologie.
V rámci podpůrné léčby při dlouhodobé kortikoterapii suplementujeme kyselinu listovou (konzumpce při zvýšené erytropoéze), kalcium, vitamin D, podáváme bisfosfonáty ke snížení rizika osteoporózy, monitorujeme hladiny glukózy a kalia, které případně doplňujeme. Samozřejmostí je včasná diagnostika a léčba infekčních a trombembolických komplikací.
Druhá linie
V praxi záleží zejména na zvyklostech a zkušenostech pracoviště, kterou z léčebných modalit zařadí u konkrétního pacienta do 2. linie, proto je výčet možností uveden v abecedním pořadí.
Rituximab, monoklonální anti-CD20 protilátka, je vzhledem k nevratnosti výkonu, jakým je splenektomie (SE), řadou pracovišť v současnosti preferován. Standardní dávkování je 375 mg/m2 i. v. v týdenním intervalu, celkem 4krát. Publikovaná data dokládají účinnost tohoto léčebného schématu v monoterapii i v kombinaci, a to bez ohledu na předchozí terapii [27]. Celková odpověď na rituximab je až 87%, kompletní odpověď až 60% [1, 7, 9]. Doba do dosažení léčebné odpovědi je značně individuální, někteří pacienti reagují velmi rychle, u jiných je dosažena maximální odpověď v horizontu měsíců. Významná část pacientů relabuje do dvou let po léčbě, v případě relapsu je možné terapii rituximabem s úspěchem opakovat [7, 26, 28]. Rituximab je účinný i v případě ES [7, 26]. Ve snaze minimalizovat vedlejší účinky a snížit náklady byl rituximab také podáván ve fixní dávce 100 mg i. v. týdně po dobu 4 týdnů, a to v monoterapii i v kombinaci s alemtuzumabem. „Low-dose“ rituximab v první či druhé linii léčby navodil vysoké procento celkových i kompletních odpovědí, přežití bez relapsu ve 3 letech přesáhlo 50 % [7, 29]. Ucelenější výsledky přinesla prospektivní randomizovaná srovnávací studie fáze III u pacientů s nově diagnostikovanou WAIHA: 75 % pacientů léčených kombinací rituximab + prednison bylo v kompletní remisi 12 měsíců od zahájení terapie, po třech letech setrvávalo v remisi 70 % pacientů, kteří dosáhli léčebné odpovědi [25]. Publikovaná data naznačují vhodnost zařazení rituximabu do prvních léčebných linií [30]. Rituximab má nezastupitelnou úlohu v léčbě WAIHA asociované s CLL [26]. Vzhledem k riziku reaktivace virových infekcí, včetně hepatitidy B, je doporučována při terapii rituximabem antivirová profylaxe. V případě léčby AIHA jde u rituximabu o indikaci off-label.
Splenektomie je u WAIHA obecně uznávána jako terapie s nízkým rizikem a vysokou účinností [1, 6, 7, 9, 24, 30]. Ve většině případů je možný šetrnější, bezpečnější laparoskopický výkon, jehož mortalita je udávána 0,5 %. Časná celková odpověď na léčbu dosahuje až 75 %, méně účinná je SE u sekundární formy WAIHA, výjimkou je WAIHA asociovaná se splenickým lymfomem marginální zóny a CLL [1, 7, 8, 9]. Výhodou v případě dosažení dlouhodobé léčebné odpovědi (3 a více let cca u 20 % pacientů) je oproštění od dlouhodobé medikace. V případě perzistence či relapsu po SE bývají potřebné dávky kortikosteroidů nižší než před ní [1, 9]. V době 2–3 týdny před plánovaným výkonem je doporučena vakcinace jako prevence postsplenektomických infekcí (OPSI): pneumokok (pravidelná revakcinace), meningokok, hemofilus; i přesto je riziko sepse způsobené opouzdřenými bakteriemi 3,3–5 % s úmrtností až 50% [1, 7, 9]. V případě horečnatého onemocnění splenektomovaného pacienta ihned zajišťujeme antibiotiky. Doporučováno je perioperační profylaktické krytí nízkomolekulárním heparinem. Nevýhodou je nedostatek spolehlivých prediktorů výsledku SE. Nebyla prokázána spojitost s dobou trvání onemocnění, reakcí na kortikosteroidy ani rozsahem sekvestrace ve slezině [30]. Opětovný průkaz HJ tělísek po SE může znamenat přítomnost akcesorní sleziny a pacient by mohl profitovat z jejího odstranění.
Další imunosupresiva a danazol
U pacientů, kde selhaly léčebné postupy 1. a 2. linie, lze zvážit podání cyklofosfamidu (konvenční dávka 100 mg/den p. o. nebo 200 mg/den i. v. či pulz 1 g i. v.), azatioprinu 100–150 mg/d p. o., cyklosporinu A 3 mg/kg/den p. o. s úpravou podle hladiny v krvi či mykofenolátu 1–2 g/den p.o. Popisovaná účinnost nedosahuje 30 %, jednalo se však o refrakterní a relabující případy [7, 24, 30]. Danazol je syntetický anabolický steroid s mírnou androgenní aktivitou, v posledním desetiletí nebyla publikována práce o jeho užití v terapii AIHA [1, 7, 30].
Alternativní možnosti
Alemtuzumab, humanizovaná anti-CD52 monoklonální protilátka, je řazen k posledním terapeutickým možnostem díky své vysoké toxicitě, podáváme 5krát 5 mg nebo 3krát 10 mg s. c. Jsou popisovány případy úspěšného použití včetně WAIHA asociované s CLL refrakterní na rituximab [7, 30].
Ofatumumab, anti-CD20 monoklonální protilátka cílená na epitop odlišný od cílového místa rituximabu, byl s úspěchem použit u WAIHA asociované s CLL nereagující na rituximab [7].
Těžké formy AIHA
Těžké formy AIHA s hladinou Hb pod 60 g/l mohou představovat až třetinu případů, alarmující by pro klinika měly být známky intravaskulární hemolýzy, hemoglobinurie, PAT pozitivita IgG+C3d, retikulocytopenie, průkaz ES, smíšené či atypické formy (PAT negativní) AIHA. V těchto případech podáváme i. v. vysoké dávky kortikosteroidů, případně v kombinaci s imunoglobuliny (IVIG), jejichž aplikace zlepšuje efekt podaných transfuzí [30]. Plazmaferéza je podle American Association of Blood Banks a American Society for Apheresis indikací kategorie III, reprezentuje léčebnou možnost pro fulminantně probíhající hemolýzu s vysokým titrem volných autoprotilátek [7, 13]. Časně by měla být zvážena aplikace rituximabu [13].
Dále je doporučena antitrombotická profylaxe, neboť procento trombembolických komplikací u těžkých forem AIHA je vyšší než obecně udávaných 10–15 % AIHA, a to zejména u splenektomovaných pacientů [8, 13].
SE je vhodné provést brzy po selhání rituximabu, neboť vložení dalších linií imunosupresivní terapie zhoršuje její prognózu [13].
Podání erytropoetinu (EPO) může pomoci překlenout období selhání kompenzační schopnosti kostní dřeně, zlepšit anémii a snížit transfuzní závislost, zejména u pacientů s refrakterní AIHA s retikulocytopenií [7, 31].
Za pozornost stojí prospektivní studie publikovaná v roce 2002. Devíti pacientům s těžkou refrakterní AIHA (7 WAIHA) byl aplikován s dobrou tolerancí „high-dose“ cyklofosfamid (HD-CFA) v transplantační dávce (50 mg/kg/d, 4 dny i. v.) s následnou podporou růstových faktorů (G-CSF). Všichni pacienti dosáhli transfuzní nezávislosti, kompletní remise dosáhlo 6 pacientů, u žádného z nich nedošlo v mediánu sledování 15 měsíců k relapsu [32].
AIHA s chladovými protilátkami
Základní součástí léčby jsou režimová opatření – vyvarování se chladu, včetně pití chladných nápojů. Tato mohou být u mírných chronických forem dostačující, v našem zeměpisném pásmu s občasnou transfuzní podporou v zimních měsících. Dále nepodáváme chladné infuze a transfuzní přípravky s vysokým obsahem plazmy. Indikovány k léčbě jsou těžší formy CAD se symptomatickou anémií, transfuzní závislostí, obvykle s hodnotami Hb nižšími než 85 g/l a formy sekundární.
Přestože nejsou k dispozici randomizované srovnávací studie, je možné říci, že nejlepších výsledků bylo v současné době dosaženo terapií rituximabem (375 mg/m2 i. v. týdně, celkem 4krát) [1, 22]. Je aplikován s cílem potlačení klonů B lymfocytů podílejících se na produkci autoprotilátek. Zkoušena je kombinace rituximabu s interferonem, též „low-dose“ rituximab (100 mg i. v. týdně, celkem 4krát) s prednisonem, který dosáhl ve studii 13 pacientů celkové odpovědi 85 % v 6. měsíci a přežití bez známek relapsu v 24. měsíci 57 % [29]. V několika sice prospektivních, ale nekontrolovaných, studiích byla prokázána celková odpověď na rituximab 58 %, kompletní odpovědi jsou však výjimečné (4,5 %) [7, 23]. Medián trvání odpovědi byl 11 měsíců a doby dosažení odpovědi 1–2 měsíce [9, 23]. Rituximab v kombinaci s kortikoidy je řadou expertů doporučován jako terapie 1. linie.
Monoterapie prednisonem nebývá účinná (14–35 %) a obvykle vyžaduje nepřijatelně vysoké dávky k udržení remise, neboť nesnižuje produkci protilátek, ale potlačuje fagocytózu [4, 22]. Účinnější je kortikoterapie u CAD s nízkým titrem protilátek s vysokou teplotní amplitudou, u vzácných případů s IgG chladovými protilátkami a u smíšené AIHA. Primární CAD lze také léčit kombinovanými imunosupresivními režimy, např. cyklofosfamid 250 mg + prednison 100 mg p. o. po dobu 4 dnů co 2–3 týdny podle hodnot krevního obrazu; pulz i. v. cyklofosfamid 1 g + methylprednisolon 500 mg.
CAD jsou však ve značném procentu sekundární (až 70 % spojeno s lymfoproliferací) a refrakterní na dostupné léčebné modality, zásadní je zde ovlivnění vyvolávající choroby. V případě sekundárních CAD asociovaných s infekcí je diskutována otázka kortikosteroidů při těžkém průběhu či v případě, že nedochází k úpravě během několika dnů antiinfekční terapie. U CAD vyvolaných infekcí Mycoplasma pneumoniae je možné použít IVIG.
Splenektomie není v terapii CAD účinná, neboť extravaskulární hemolýza v tomto případě probíhá převážně v játrech. Výjimkou jsou IgG zprostředkované CAD. Při akutní hemolytické krizi jako život zachraňující výkon, nebo v rámci přípravy k operačnímu výkonu v hypotermii, může být s přechodným efektem využita plazmaferéza [7, 22, 23].
Alternativní možnosti
Živě se diskutuje o použití fludarabinu, purinového analoga, účinného v léčbě lymfoproliferací. Podle souhrnu údajů o přípravku je tento kontraindikován v případě dekompenzované hemolytické anémie. V posledních letech zaznívají názory, že hemolýza není kontraindikací absolutní a podání lze zvážit u některých chronicky probíhajících AIHA, refrakterních na předchozí léčbu [23]. V norské prospektivní, nekontrolované, multicentrické studii 29 pacientů s diagnostikovanou primární chronickou CAD vyžadujících léčbu/substituci dostalo 4 cykly rituximabu ve standardní dávce den 1 a fludarabin 40 mg/m2 p. o. den 1–5 cyklu. Celkem dosáhlo léčebné odpovědi 22 pacientů (76 %), kompletní 6 pacientů (21 %). Z 10 pacientů dříve nereagujících na monoterapii rituximabem 1 dosáhl kompletní a 6 parciální odpovědi. Sledováním nebyl dosažen medián trvání odpovědi, odhad činí 66 měsíců [33].
V budoucnu lze předpokládat, při průkazu role komplementu v rozvoji hemolýzy u konkrétního pacienta, možnost cíleného užití inhibitorů komplementu (např. TNT003 – inhibitor serin proteázy C1s) [34, 35].
Tabulka 2 předkládá návrh léčebného algoritmu primární AIHA.
Table 2. Návrh léčebného algoritmu primární AIHA 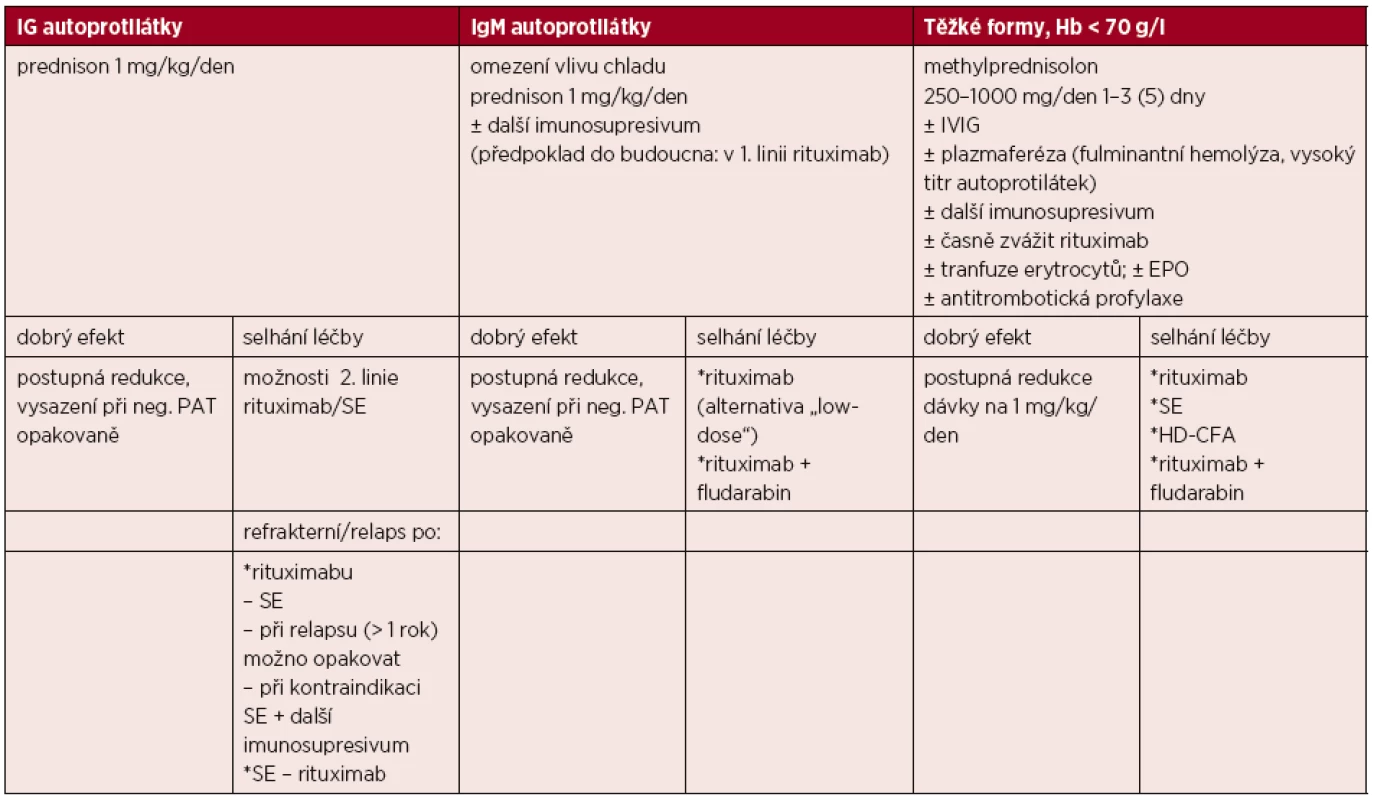
Rituximab – „off-label“ indikace; standardní dávkování 375 mg/m2 i. v. co týden, 4krát; alternativně „low-dose“ 100 mg i. v. co týden, 4krát. SE – zvážit časně (zejména po selhání rituximabu) s ohledem na horší prognózu SE po vícečetných liniích imunosupresivní terapie. Další imunosupresiva – cyklofosfamid (konvenční dávky 100 mg/den p. o. nebo 200 mg/den i. v., či pulz 1 g i. v., alternativně HD-CFA 50 mg/kg/den i. v. 4 dny + G-CSF), azatioprin 100–150 mg/den p. o., cyklosporin A 3 mg/kg/den p. o. s úpravou podle hladiny v krvi, mykofenolát 1–2 g/den p. o. Vysvětlivky: AIHA – autoimunitní hemolytická anémie, Ig – imunoglobulin, Hb – hemoglobin, IVIG – intravenózní gamaglobulin, EPO – erytropoetin, neg. – negativní, PAT – přímý antiglobulinový test, SE – splenektomie, HD-CFA – „high dose“ cyklofosfamid, G-CSF – granulocytární kolonie stimulující faktor. Paroxysmální chladová hemoglobinurie
Akutní epizoda u dětí vyžaduje podpůrnou léčbu spolu s adekvátní diagnostikou a léčbou infekce, obvykle ustoupí během několika týdnů. Pacienta sledujeme, udržujeme v teple, pravidelně kontrolujeme krevní obraz. Pokud dojde k závažné hemolytické anémii, je zapotřebí transfuzní podpora, bývají doporučovány i kortikosteroidy. V chronických případech u dospělých lze prednison ve zvyklé iniciální dávce kombinovat s cyklofosfamidem či azathioprinem. Role rituximabu v terapii PCH zatím nebyla zhodnocena, existují jen ojedinělé popisy užití u refrakterních případů. Splenektomie se nevyužívá.
Polékové imunitní hemolytické anémie
V naprosté většině je hemolýza nezávažná, postačí vysazení vyvolávající medikace. Výjimkou jsou případy život ohrožující prudké hemolytické anémie po fludarabinu v rámci terapie CLL. Základem léčby jsou i zde kortikosteroidy, často v kombinaci s rituximabem a cyklofosfamidem, tedy léky ovlivňujícími i základní onemocnění.
PODÁVÁNÍ TRANSFUZNÍCH PŘÍPRAVKŮ
Efekt transfuzí erytrocytů je bez terapeutického ovlivnění hemolýzy pouze krátkodobý, obecně jsou indikovány u pacientů s významnými projevy anemického syndromu nebo při velmi těžké anémii.
AIHA s tepelnými protilátkami
Navázané autoprotilátky komplikují předtransfuzní vyšetření. Mohou zapříčinit falešnou pozitivitu, vzácněji i negativitu, při vyšetření krevně skupinových antigenů. Na falešné výsledky je třeba pomyslet při diskrepanci mezi určením AB0 antigenů a protilátek nebo mezi aktuálním a v minulosti provedeným vyšetřením. Falešně pozitivní nálezy odhalí pozitivita diluentové kontroly (paralelní provedení reakce s diagnostikem se specifickou protilátkou a roztokem stejného složení bez specifické protilátky). Krevní skupina se často podaří určit až po opakovaném promytí erytrocytů, které odstraní navázané autoprotilátky.
Volné autoprotilátky zase komplikují stanovení AB0 protilátek, screening a identifikaci nepravidelných antierytrocytárních protilátek a test kompatibility s erytrocyty transfuzního přípravku. Protože je zde častý současný výskyt autoprotilátek a aloprotilátek (40 %, po aplikaci 5 a více transfuzí až 75 %) [1, 9, 10], je hlavním úkolem předtransfuzního vyšetření vyloučit aloprotilátky maskované nespecifickými autoprotilátkami. Autoprotilátku je možné „vysytit“ na vlastní krvinky, inkubaci séra se sedimentem vlastních krvinek je zapotřebí obvykle několikrát opakovat. V případě nedávno transfundovaného pacienta nemůžeme použít „vlastní“ krvinky, neboť přetrvávající dárcovské erytrocyty by mohly vyvázat případnou aloprotilátku. Použijeme krvinky dárce negativní pro antigeny, proti nimž by pacient mohl vytvářet aloprotilátky. Všechny vysycovací postupy ale provází riziko diluce slabých aloprotilátek, negativní reakce tedy neposkytuje naprostou jistotu jejich nepřítomnosti. Preferujeme fenotypově kompatibilní přípravky (ideálně v systému AB0, Rh, Kell, Kidd) a transfuze podáváme s premedikací [1, 9, 10].
Nelze-li vzhledem k závažnosti klinického stavu pacienta čekat na definitivní výsledek předtransfuzního vyšetření (vitální indikace), lze s premedikací kortikosteroidy a za pečlivého monitorování podat inkompatibilní přípravek [9, 10, 24]. Nepodaří-li se určit krevní skupina, podáváme přípravek 0 RhD negativní; jsou-li k dispozici některé validní výsledky, pak vybíráme přípravek fenotypově kompatibilní v Rh a Kell systému a respektujeme v minulosti určovanou klinicky významnou aloprotilátku. Diskutuje se, zda v případě dobře definované specificity autoprotilátky (nejčastěji v systému Rh), je tuto vhodné při výběru transfuze respektovat či ne, protože nejsou jednoznačné důkazy, že antigen-negativní transfuze prodlužují přežití transfundovaných erytrocytů [7].
AIHA s chladovými protilátkami, paroxysmální chladová hemoglobinurie
Diskrepance v AB0 systému je poměrně častá, k zamezení nežádoucího ovlivnění předtransfuzních vyšetření je nutno zabránit vlivu snížené teploty již při odběru a transportu vzorku, veškeré kroky provádět při 37 °C. Transfuzní přípravky podáváme ohřáté s premedikací kortikosteroidů [9]. Lze podat promyté erytrocyty (odstranění komplementu). U pacientů s PCH je možné užít i přípravek P+ (P-negativní erytrocyty jsou extrémně vzácné), je však nutné zahřátí podávaného přípravku a zamezení vlivu chladu na pacienta.
Použité zkratky
AGH polyspecifické antiglobulinové sérum
AIHA autoimunitní hemolytická anémie
APC antigen prezentující buňka
CA chladové aglutininy
CAD AIHA s chladovými protilátkami, nemoc chladových aglutininů
CLL chronická lymfatická leukemie
DIHA poléková imunitní hemolytická anémie
DL test Donath-Landsteinerův test, test bifázické hemolýzy
ELISA enzyme-linked immunosorbent assay
EPO erytropoetin
ES Evansův syndrom
G-CSF granulocytární kolonie stimulující faktor
HD-CFA „High-dose“ cyklofosfamid
Hb hemoglobin
HJ Howell-Jollyho tělíska
IL interleukin
ITP imunitní trombocytopenie
IVIG intravenózní imunoglobuliny
LDH laktátdehydrogenáza
NAT nepřímý antiglobulinový test
OPSI postsplenektomické infekce, overwhelming postsplenectomy infection
PAT přímý antiglobulinový (Coombsův) test
PCH paroxysmální chladová hemoglobinurie
SE splenektomie
SLE systémový lupus erythematodes
Th pomocný T lymfocyt (CD4+ T helper cell)
Treg T regulační lymfocyt
WAIHA AIHA s tepelnými protilátkami
Poděkování
Publikace byla podpořena projektem IGA LF 2017_007 Univerzity Palackého.
Podíl autorů na přípravě rukopisu
ML – napsání a revize rukopisu
JP, AH – připomínkování a schválení první a revidované verze rukopisu
Prohlášení o konfliktu zájmů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce dne 16. 12. 2016.
Přijato po recenzi dne 13. 3. 2017.
MUDr. Marie Lukášová
Hemato-onkologická klinika
FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: Marie.Lukasova@fnol.cz
Sources
1. Barros MM, Blajchman MA, Bordin JO. Warm autoimmune hemolytic anemia: recent progress in understanding the immunobiology and the treatment. Transfus Med Rev 2010; 24(3): 195–210.
2. Sakaguchi S, Ono M, Setoguchi R, et al. Foxp3 + CD25 + CD4 + natural regulatory T cells in dominant self-tolerance and autoimmune disease. Immunol Rev 2006; 212 : 8-27.
3. Ward FJ, Hall AM, Cairns LS, et al. Clonal regulatory T cells specific for a red blood cell autoantigen in human autoimmune hemolytic anemia. Blood 2008; 111 : 680–687.
4. Ahmad E, Elgohary T, Ibrahim H. Naturally occurring regulatory T cells and interleukins 10 and 12 in the pathogenesis of idiopathic warm autoimmune hemolytic anemia. J Investig Allergol Clin Immunol 2011; 21 : 297–304.
5. Xu L, Zhang T, Liu Z, Li Q, Xu Z, Ren T. Critical role of Th17 cells in development of autoimmune hemolytic anemia. Exp Hematol 2012; 40 : 994–1004.
6. Raida L. Autoimunitní hemolytické anémie. In: Indrák K (ed.) Hematologie a transfuzní lékařství, Triton, 2014; 39–42.
7. Zanella A, Barcellini W. Treatment of autoimmune hemolytic anemias. Haematologica 2014; 99(10): 1547–1554.
8. Barcellini W, Fattizzo B, Zaninoni A, et al. Clinical heterogeneity and predictors of outcome in primary autoimmune hemolytic anemia: a GIMEMA study of 308 patients. Blood 2014; 124 : 2930–2936.
9. Jaime-Pérez JC, Rodríguez-Martínez M, Gómez-de-León A, Tarín--Arzaga L, Gómez-Almaguer D. Current approaches for the treatment of autoimmune hemolytic anemia. Arch Immunol Ther Exp (Warsz) 2013; 61 : 385–395.
10. Písačka M. Autoimunitní hemolytické anémie. In: Řeháček V, Masopust J. a kol. Transfuzní lékařství, Grada, 2013; 144–151.
11. Čermák J. Anémie hemolytické indukované léky. In: Indrák K (ed.) Hematologie a transfuzní lékařství, Triton, 2014; 61–63.
12. Liesveld JL, Rowe JM, Lichtman MA. Variability of the erythrocyte response in autoimmune hemolytic anemias: analysis of 109 cases. Blood 1987; 69 : 820–826.
13. Fattizzo B, Zaninoni A, Nesa F, et al. Lessons from very severe, refractory and fatal primary autoimmune hemolytic anemias. Am J Hematol 2015; 90: E149–151.
14. Bass GF, Tuscano ET, Tuscano JM. Diagnosis and classification of autoimmune hemolytic anemia. Autoimmun Rev 2014; 13 : 560–564.
15. Arndt PA, Leger RM, Garratty G. Serologic findings in autoimmune hemolytic anemia associated with immunoglobulin M warm autoantibodies. Transfusion 2009; 49 : 235–242.
16. Bartolmas T, Salama A. A dual antiglobulin test for the detection of weak or nonagglutinating immunoglobulin M warm autoantibodies. Transfusion 2010; 50 : 1131–1134.
17. Fayek MH, Saad AA, Eissa DG, Tawfik LM, Kamal G. Role of gel test and flow cytometry in diagnosis of Coombs‘ negative autoimmune haemolytic anaemia. Int J Lab Hematol. 2012; 34(3): 311–319.
18. Barcellini W, Zaninoni A, Imperiali FG, Zenella A, et al. Mitogen-stimulated DAT: a new method for the diagnosis of AIHA. Blood Transf 2003; 2 : 127–136.
19. Thedsawad A, Taka O, Wanachiwanawin W. Development of flow cytometry for detection and quantitation of red cell bound immunoglobulin G in autoimmune hemolytic anemia with negative direct Coombs test. Asian Pac J Allergy Immunol 2011; 29(4): 364–367.
20. Meulenbroek EM, Haas M, Brouwer C, Folman C, Zeerleder SS, Wouters D. Complement deposition in autoimmune hemolytic anemia is a footprint for difficult-to-detect IgM autoantibodies. Haematologica 2015; 100(11): 1407–1414.
21. Jeong-Shi Lin, Tsung-Chi Hao, Jau-Yi Lyou, et al. Clinical application of a flow cytometric direct antiglobulin test. Transfusion 2009; 49 : 1335–1346.
22. Swiecicki PL, Hegerova LT, Gertz MA. Cold agglutinin disease. Blood 2013; 122 : 1114–1121.
23. Berentsen S. How I manage cold agglutinin disease. Br J Haematol 2011; 153 : 309–317.
24. Procházková J. Autoimunitní hemolytická anemie. In: Zadražil, Horák, Karásek Moderní farmakoterapie autoimunitních chorob, Maxdorf Jessenius, 2015; 333–337.
25. Birgens H, Frederiksen H, Hasselbalch HC, et al. A phase III randomized trial comparing glucocorticoid monotherapy versus glucocorticoid and rituximab in patients with autoimmune haemolytic anaemia. Br J Haematol 2013; 163 : 393–399.
26. Dierickx D, Kentos A, Delannoy A. The role of rituximab in adults with warm antibody autoimmune hemolytic anemia. Blood 2015; 125 : 3223–3229.
27. Peñalver FJ, Alvarez-Larrán A, Díez-Martin JL, et al. Rituximab is an effective and safe therapeutic alternative in adults with refractory and severe autoimmune hemolytic anemia. Ann Hematol 2010; 89 : 1073–1080.
28. Maung SW, Leahy M, O’Leary HM, et al. A multi-centre retrospective study of rituximab use in the treatment of relapsed or resistant warm autoimmune haemolytic anaemia. Br J Haematol 2013; 163(1): 118–122.
29. Barcellini W, Zaja F, Zaninoni A, et al. Low-dose rituximab in adult patients with idiopathic autoimmune hemolytic anemia: clinical efficacy and biologic studies. Blood 2012; 119 : 3691–3697.
30. Crowther M, Chan YL, Garbett IK, Lim W, Vickers MA, Crowther MA. Evidence-based focused review of the treatment of idiopathic warm immune hemolytic anemia in adults. Blood 2011; 118 : 4036–4040.
31. Arbach O, Funck R, Seibt F, Salama A. Erythropoietin may improve anemia in patients with autoimmune hemolytic anemia associated with reticulocytopenia. Transfus Med Hemother 2012; 39 : 221–223.
32. Moyo VM, Smith D, Brodsky I, Crilley P, Jones RJ, Brodsky RA. High-dose cyclophosphamide for refractory autoimmune hemolytic anemia. Blood 2002; 100 : 704–706.
33. Berentsen S, Randen U, Vagan AM, et al. High response rate and durable remissions following fludarabine and rituximab combination therapy for chronic cold agglutinin disease. Blood 2010; 116 : 3180–3184.
34. Shi J, Rose EL, Singh A, et al. TNT003, an inhibitor of the serine protease C1s, prevents complement activation induced by cold agglutinins. Blood 2014; 123 : 4015–4022.
35. Wouters D, Stephan F, Strengers P, et al. C1-esterase inhibitor concentrate rescues erythrocytes from complement-mediated destruction in autoimmune hemolytic anemia. Blood 2013; 121 : 1242–1244.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2017 Issue 1-
All articles in this issue
- Prevence a léčba venózního tromboembolismu u nemocných s nádorovým onemocněním
- Moderní léčba akutní myeloidní leukemie
- Zkušenosti s léčbou ruxolitinibem u pacientů s myelofibrózou a pravou polycytemií na českých hematologických pracovištích
- Autoimunitní hemolytická anémie – diagnostika a léčba, včetně transfuze erytrocytů
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Autoimunitní hemolytická anémie – diagnostika a léčba, včetně transfuze erytrocytů
- Moderní léčba akutní myeloidní leukemie
- Zkušenosti s léčbou ruxolitinibem u pacientů s myelofibrózou a pravou polycytemií na českých hematologických pracovištích
- Prevence a léčba venózního tromboembolismu u nemocných s nádorovým onemocněním
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

