-
Medical journals
- Career
Hodnocení časné molekulární odpovědi po 3 měsících léčby imatinibem může u nemocných s chronickou myeloidní leukemií přispět k upřesnění odhadu prognózy – zkušenosti jednoho centra
Authors: Š. Rožmanová; P. Rohoň; M. Divoká; J. Gazdová; M. Holzerová; I. Marešová; M. Jarošová; E. Faber; K. Indrák
Authors‘ workplace: Hemato-onkologická klinika FN a LF UP Olomouc
Published in: Transfuze Hematol. dnes,18, 2012, No. 2, p. 66-71.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Retrospektivní analýza souboru 54 dospělých nemocných s chronickou myeloidní leukemií (CML) v chronické fázi, kteří byli léčeni imatinib mesylátem (IM) v 1. linii, se zaměřuje na zhodnocení prognostického významu časné molekulární odpovědi po 3 měsících léčby jako kritéria předpovídajícího rychlost dosažení optimální léčebné odpovědi na IM. Léčebná odpověď byla hodnocena cytogenetickými a molekulárními metodami s využitím kritérií European LeukemiaNet (ELN) z roku 2009. Celková délka sledování byla 12 až 95 měsíců (medián 37 měsíců). Odhadované přežití bez progrese (PFS), přežití bez události (EFS) a celkové přežití (OS) celého souboru nemocných v 5 letech je 80 %, 71 % a 89 %. Celkový výskyt kompletní cytogenetické odpovědi (CCyR) a velké molekulární odpovědi (MMR) po 18 měsících léčby byl 81 % a 56 %. Podle kritérií ELN dosáhlo 32 (59 %) nemocných optimální a 13 (24 %) suboptimální odpověď, zatímco u 9 (17 %) nemocných došlo k selhání léčby. Nemocní byli dále rozděleni podle hladiny exprese BCR-ABL (IS) po 3 měsících léčby IM do 3 skupin: ≤ 1,0 % (12 nemocných), > 1,0 a ≤ 10 % (26 nemocných) a > 10 % (16 nemocných). Při porovnání těchto 3 skupin bylo prokázáno, že nemocní s nižšími hladinami BCR-ABL (IS) po 3 měsících léčby IM měli signifikantně vyšší pravděpodobnost následného dosažení CCyR (p < 0,0001) a MMR (p < 0,0001) než nemocní s vyššími hladinami transkriptu. Pokud byla hodnocena odpověď na léčbu dle ELN kritérií, bylo prokázáno, že úroveň molekulární odpovědi po 3 měsících určila nemocné rychleji dosahující optimální léčebnou odpověď. Časné hodnocení molekulární odpovědi po 3 měsících léčby IM tak může u nemocných s CML identifikovat ty nemocné, kteří dříve dosáhnou CCyR a MMR.
Klíčová slova:
chronická myeloidní leukemie, imatinib, molekulární odpověďÚvod
Určení proteinu Bcr-Abl a jeho klíčové role v patogenezi chronické myeloidní leukemie (CML) poskytlo příležitost k vývoji cílené léčby. Imatinib mesylát (IM, Glivec, STI571) je specifickým inhibitorem Bcr-Abl tyrozinkinázy (TKI), který dramaticky změnil přežití nemocných s CML. Aktualizované výsledky přežití nově diagnostikovaných nemocných s CML v chronické fázi zařazených do fáze III mezinárodní studie IRIS (International Randomized Study of Interferon and STI571) vyhodnocené po 8 letech ukázaly, že pravděpodobnost celkového přežití (OS) dosáhla 93 % (pokud byly zahrnuty úmrtí výlučně související s CML) a kumulativní pravděpodobnost dosažení kompletní cytogenetické odpovědi (CCyR) byla 83 % (1). Navzdory těmto výsledkům, přibližně u 35–40 % nově diagnostikovaných nemocných s CML, dochází k selhání léčby nebo pouze k dosažení suboptimální léčebné odpovědi. Proto narůstá potřeba definice biologických parametrů, které by predikovaly (buď v době diagnózy, nebo během prvních měsíců terapie) léčebnou odpověď na IM. Tím by bylo možné odlišit nemocné s menší nadějí na dosažení optimální léčebné odpovědi na IM, které je nutno dále bedlivě sledovat a v případě potřeby zvážit alternativní léčebný přístup. Ten v dnešní době představují především TKI 2. generace – dasatinib a nilotinib.
Jak již bylo zmíněno, většina nemocných s CML léčených TKI dosahuje CCyR. Cytogenetická odpověď je monitorována pomocí konvenční cytogenetiky s citlivostí 1–5 %. Pro detekci menšího množství leukemických buněk bylo tedy zapotřebí vyvinout metodu citlivější a přesnější. Nástroj pro sledování minimální reziduální nemoci představuje real-time kvantitativní polymerázová řetězová reakce (RQ-PCR) s citlivostí 0,01–0,001 % (2). Sledování dynamiky molekulární odpovědi neslouží pouze k monitorování léčebné odpovědi, ale má také prognostický význam. První randomizovaná studie, která ukázala prognostický význam monitorování BCR-ABL transkriptu pomocí RQ-PCR a definovala velkou molekulární odpověď (MMR), byla studie IRIS (3). V mezinárodní stupnici IS (international scale) je MMR definována jako hodnota BCR-ABL 0,1 % a představuje > 3-log pokles BCR-ABL transkriptu vůči standardizované hladině. Studie ukázaly, že nemocní, kteří nedosáhli MMR během léčby IM, mají vyšší riziko ztráty cytogenetické odpovědi a vzniku rezistence k IM (4, 5).
Při hledání prognostických faktorů, které by predikovali optimální léčebnou odpověď, ukazují výsledky některých studií právě na význam časného molekulárního monitorování. Míra poklesu BCR-ABL transkriptu po 3 nebo 6 měsících léčby IM může pomoci k identifikaci rychle odpovídajících nemocných, tzn. nemocných s větší nadějí na dosažení časné optimální léčebné odpovědi na IM. Studie ukazují, že hlubší molekulární odpověď (tzn. větší pokles hladiny BCR-ABL transkriptu) v časových intervalech je spojena s rychlejším nástupem CCyR, MMR a také s lepším PFS (6, 7).
Cílem naší studie tedy bylo zhodnotit hladinu molekulární odpovědi v definovaném čase 3 měsíců léčby IM jako kritérium předpovídající léčebnou odpověď na IM a ověřit tak výsledky výše uvedených studií.
Materiál a metodika
Soubor nemocných
Do studie bylo zahrnuto 54 nemocných (36 mužů, 18 žen), kteří zahájili léčbu první linie IM po stanovení diagnózy chronické fáze CML, a u kterých byl k dispozici vzorek pro kvantitativní RT-PCR po 3 měsících léčby. Analýza souboru byla provedena k 1. 1. 2011. Medián věku nemocných v době zahájení léčby IM byl 52 let (rozmezí 19–76). Medián intervalu od diagnózy do zahájení léčby IM byl 23 dnů (rozmezí 1–133). Nízké prognostické riziko dle Sokala mělo 16 (30 %) nemocných, střední 27 (50 %) nemocných a 11 (20 %) nemocných mělo riziko vysoké.
Nemocní byli léčeni IM dávkou 400 mg/den. V případech závažné hematologické toxicity byla dávka redukována nebo bylo použito intermitentní dávkování (8). V případech prokázané snížené hladiny IM v plazmě a/nebo při suboptimální odpovědi (většinou se jednalo o nedosažení MMR po 18 měsících léčby) byla dávka IM individuálně zvyšovaná. Standardní dávkou 400 mg/den bylo léčeno 36 (67 %) nemocných, u 7 (13 %) nemocných bylo nezbytné dávku redukovat (minimální použitá dávka byla 100 mg/den) a u 11 (20 %) nemocných bylo rozhodnuto dávku zvýšit na 500 až 800 mg denně. Iniciální cytoredukce byla při hyperleukocytóze realizovaná pomocí hydroxyurey, v některých případech doplněné o leukocytaferézu. Léčebná odpověď byla při retrospektivní analýze hodnocena podle kritérií ELN (9).
Kvantitativní detekce BCR-ABL
Molekulární odpověď byla sledována pomocí RQ-PCR. U všech vzorků byl pelet leukocytů izolován z periferní krve a/nebo kostní dřeně po lýze erytrocytů. Pro přípravu komplementární DNA (cDNA) byl použit 1 μg RNA, náhodné primery a reverzní transkriptáza Transcriptor Reverse Transcriptase (Roche Diagnostics, Mannheim, Německo). RQ-PCR byla prováděna na přístroji LightCycler 1.5 (Roche Diagnostics GmbH, Mannheim, Německo). Exprese BCR-ABL byla normalizována vůči expresi kontrolního genu ABL. Sekvence primerů a sond byly publikovány v EAC protokolu (10), hydrolyzační sondy byly značené fluorescenčními barvami FAM na 5´-konci a BHQ-1 na 3´-konci. Reakční podmínky byly identické pro fúzní gen BCR-ABL i referenční gen ABL. Do reakčního objemu (20 μl) bylo bráno 5 μl cDNA ∼ l00 ng celkové RNA. PCR reakční směs obsahovala 2 μl LightCycler FastStart DNA Master Hybridization Probes (Roche Diagnostics, Mannheim, Německo), 4 mM MgCl2, 300 nM oligonukleotidových primerů a 200 nM příslušné TaqMan sondy. PCR program zahrnoval počáteční denaturaci 10 min při 95 °C a 50 cyklů (95 °C, 10 s, 20 °C/s)/(60 °C, 30 s, 20 °C/s). Kvantifikace BCR-ABL a ABL genu byla u všech vzorků prováděna v duplikátech, crossing point (Cp) byl interpolován ke kalibrační křivce a určen počet kopií transkriptu v 5 μl. Kalibrační křivky pro gen BCR-ABL a ABL byly získány pomocí FusionQuant kitů (Ipsogen, Marseille, France). Normalizovaná hladina byla vypočtena jako poměr BCR-ABL/ABL a vyjádřena v procentech. Citlivost metody byla 10 kopií BCR-ABL. Počet kopií ABL genu u všech vzorků zahrnutých v této studii byl vyšší než 1,3 x 103. Poměr BCR-ABL/ABL byl nakonec pomocí konverzního faktoru přepočten na hodnotu v mezinárodní stupnici (IS). Vzorky, u kterých nebyl pomocí RQ-PCR detekován žádný transkript BCR-ABL, byly pro potvrzení dále analyzovány pomocí nested kvalitativní reverzně transkriptázové polymerázové řetězové reakce (nested RT-PCR). Ta byla prováděna podle protokolu BIOMED-1 (11). Kompletní molekulární odpověď (CMR) byla definována jako transkript BCR-ABL nedetekovatelný pomocí RQ-PCR a nested RT-PCR v nejméně 2 po sobě následujících odběrech.
Cytogenetická analýza
K hodnocení cytogenetické odpovědi byla použita metoda konvenční cytogenetiky s technikou G-pruhování. V každém vzorku bylo analyzováno minimálně 20 metafází.
Statistická analýza, metody
Přežití bez progrese (PFS) bylo definováno jako přežití bez akcelerované/blastické fáze, bez ztráty kompletní hematologické odpovědi (CHR), bez ztráty velké cytogenetické odpovědi (MCyR), bez ztráty CCyR, bez zvýšení počtu leukocytů a bez úmrtí z jakékoliv příčiny během léčby IM. Přežití bez události (EFS) bylo definováno jako přežití bez progrese (popsáno výše u PFS), nedosažení CHR po 6 měsících, nedosažení MCyR po 12 měsících, nedosažení CCyR po 18 měsících. Celkové přežití při léčbě IM (OS(IM)) bylo definováno jako interval od zahájení léčby IM do úmrtí nemocného z jakékoli příčiny.
K získání základních statistických parametrů (medián, rozmezí) byl použit software Excel 2003. Kumulativní pravděpodobnost dosažení CCyR, MMR a CMR byla vyhodnocena pomocí Kaplan-Meierovy metody a porovnána log-rank testem. Statistické rozdíly v distribuci parametrů (Hasfordovo a Sokalovo skóre; hodnocení dle ELN parametrů) byly hodnoceny pomocí Fischerova exaktního testu. Hladina pro statistickou významnost byla u všech testů p < 0,05.
Výsledky
Léčebná odpověď
CHR dosáhlo během sledování všech 54 (100 %) nemocných. Z toho 11 nemocných (20 %) dosáhlo po nasazení hydroxyurey CHR ještě před/v době nasazení IM. Zbylých 43 nemocných dosáhlo CHR během léčby IM v mediánu 3 měsíců od nasazení IM (rozmezí 1–6 měsíců). Celkem 46 (85 %) nemocných dosáhlo CCyR v mediánu 7 měsíců (rozmezí 3–38) od zahájení léčby IM. Celkem 8 (15 %), 37 (69 %), 44 (81 %) nemocných dosáhlo CCyR po 3, 12 a 18 měsících léčby. Velkou molekulární odpověď dosáhlo 40 z 54 (74 %) nemocných, medián času, kdy byla MMR poprvé dosažena, byl 12 měsíců (rozmezí 3–52) po nasazení IM. Celkem 2 (4 %), 25 (46 %), 30 (56 %) dosáhlo MMR po 3, 12 a 18 měsících léčby. Dosažení CMR bylo potvrzeno u 11 (20 %) nemocných. Medián prvního dosažení CMR byl 24 měsíců od zahájení léčby IM (rozmezí 6–41).
Odhadovaná PFS, EFS a OS(IM) celého souboru nemocných v 5 letech je 85 % (95% CI: 77,3–96,5 %), 71 % (95% CI: 57,6–85,0 %) a 89 % (95% CI: 79,2–99,6 %).
K datu analýzy bylo stále léčeno IM 43 (80 %) nemocných, 4 (7 %) nemocní zemřeli a 7 (13 %) nemocných léčbu IM ukončilo. V jednom případě úmrtí byla příčina progrese základního onemocnění a ve 3 případech se jednalo o příčinu nesouvisející se základní chorobou. Medián celkového sledování celého souboru nemocných byl 37 měsíců (rozmezí 12–95). U žijících byl medián sledování 42 měsíců (rozmezí 12–95), u zemřelých 20 měsíců (15–40).
Celkem u 7 nemocných bylo podávání IM z důvodu cytogenetické progrese/rezistence nebo nálezu mutace rezistentní k IM ukončeno. Medián délky léčby IM byl 43 měsíců (rozmezí 12–73) u nemocných, kteří v léčbě IM nadále pokračovali a 18 měsíců (7–44) u nemocných, kteří užívání IM z jakékoliv příčiny ukončili. Všech 7 nemocných, kteří ukončili léčbu IM, bylo převedeno na léčbu druhé linie. Dva z těchto nemocných byli dále indikováni k provedení alogenní transplantace krvetvorných buněk.
Prognostický vliv molekulární odpovědi ve 3. měsíci léčby na léčebnou odpověď
Dlouhodobé klinické výsledky byly analyzovány na základě molekulární odpovědi v definovaném časovém intervalu 3 měsíců od zahájení léčby. V tomto období byl medián hladin BCR-ABL(IS) u všech nemocných 4,354 % (rozmezí 0,041–29,360). Nemocní byli následně rozděleni podle hodnot molekulární odpovědi do 3 skupin: BCR-ABL (IS) ≤ 1,0 % - 12 nemocných, BCR-ABL (IS) > 1,0 a ≤ 10 % - 26 nemocných a BCR-ABL (IS) > 10 % - 16 nemocných. Všechny tři skupiny byly srovnatelné; co se týká Sokalova (p = 0,520) nebo Hasfordova (p = 0,154) skóre. Při posuzování prognostického vlivu byla hodnocena kumulativní pravděpodobnost dosažení CCyR, MMR a CMR během léčby IM do maximálně 73 měsíců pro každou z nich, medián délky léčby IM u všech nemocných byl 35 měsíců (rozmezí 7–73).
a) Vliv na dosažení CCyR
Při statistické analýze byl posuzován vliv stupně redukce BCR-ABL na následné dosažení CCyR. Nemocní s nižšími hladinami BCR-ABL (IS) dosáhli CCyR ve vyšším počtu než nemocní s vysokými hladinami (≤ 1,0 %; > 1,0 a ≤ 10 %; > 10 %) (100 %; 88 %; 69 %) (p < 0,0001) (obr. 1). Také, co se týká mediánu doby dosažení CCyR, bylo zjištěno, že nemocní s hlubší redukcí BCR-ABL po 3 měsících léčby dosáhli CCyR dříve (≤ 1,0 %; > 1,0 a ≤ 10 %; > 10 %) (3 měsíce; 8 měsíců; 12 měsíců).
Image 1. Kumulativní pravděpodobnost dosažení CCγR podle molekulární odpovědi ve 3. měsíci léčby. 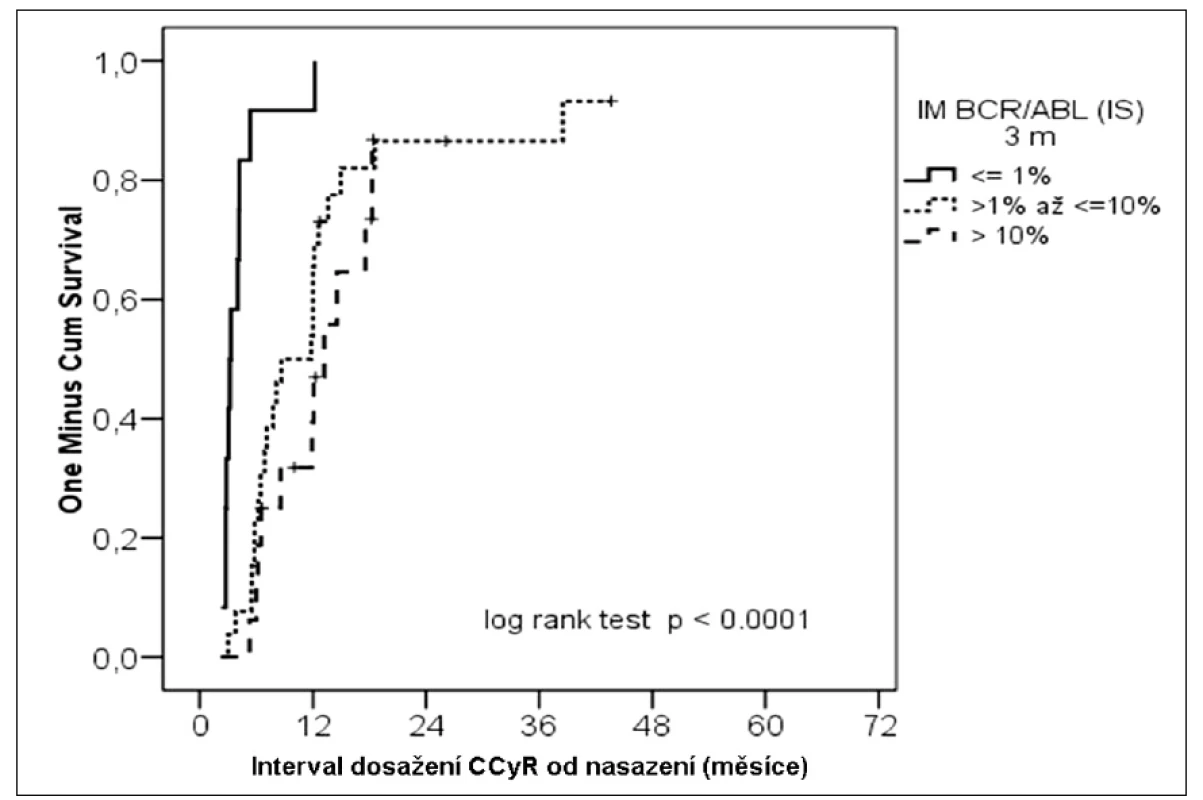
b) Vliv na dosažení MMR
Co se týká pravděpodobnosti dosažení MMR, pozorovali jsme, že míra redukce BCR-ABL ve 3. měsíci byla statisticky významně asociována s pravděpodobností následného dosažení MMR (obr. 2). Nemocní s menším poklesem exprese BCR-ABL dosáhli během dalšího průběhu léčby MMR v nižší míře (≤ 1,0 %; > 1,0 a ≤ 10 %; > 10 %) (100 %; 77 %; 50 %) (p < 0,0001). I u tohoto parametru jsme pozorovali, že medián doby do dosažení MMR byl kratší u nemocných s hlubší molekulární odpovědí po 3 měsících léčby (≤ 1,0 %; > 1,0 a ≤ 10 %; > 10 %) (6 měsíců; 12 měsíců; 14 měsíců).
Image 2. Kumulativní pravděpodobnost dosažení MMR podle molekulární odpovědi ve 3. měsíci léčby. 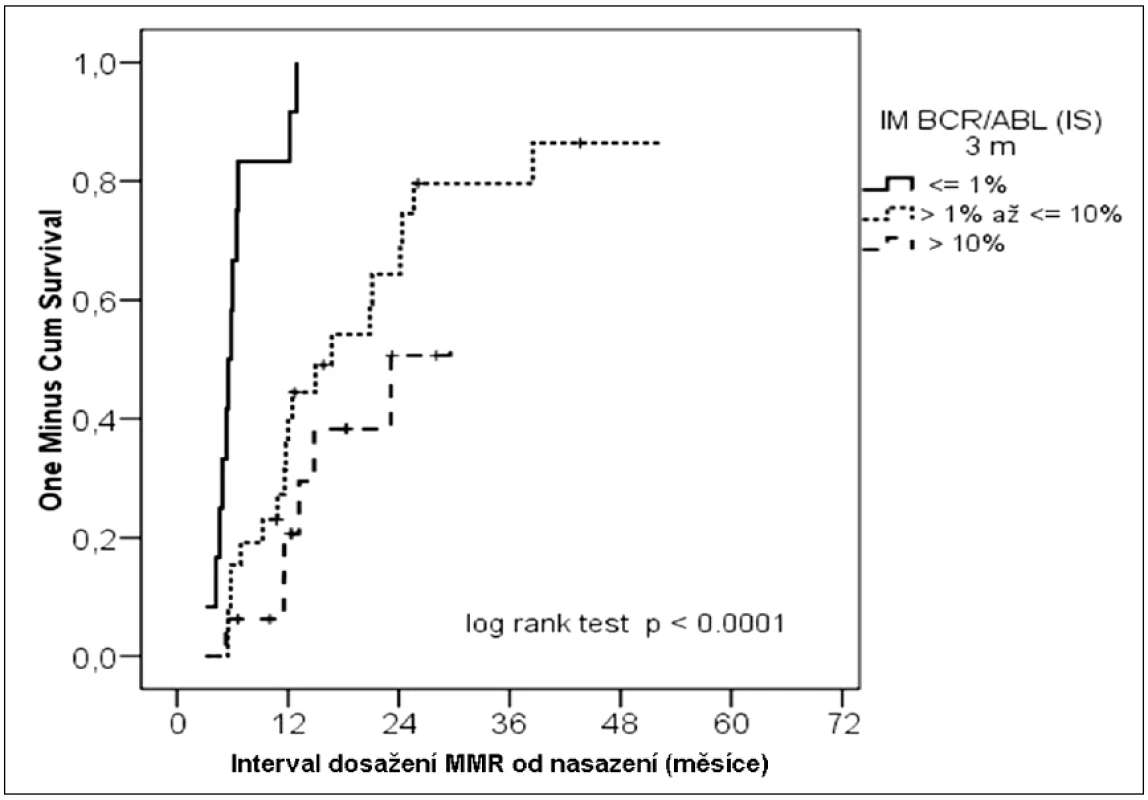
c) Vliv na dosažení CMR
V současné době není hodnocení CMR dořešeno a probíhají přípravy na její standardizaci. I přesto jsme v naší studii posuzovali také vliv stupně redukce BCR-ABL na dosažení CMR. Ta byla vyhodnocena celkově u 11 nemocných. I v tomto případě byl zjištěn signifikantní vliv stupně molekulární odpovědi ve 3. měsíci na následné dosažení CMR (p = 0,014) (obr. 3).
Image 3. Kumulativní pravděpodobnost dosažení CMR podle molekulární odpovědi ve 3. měsíci léčby. 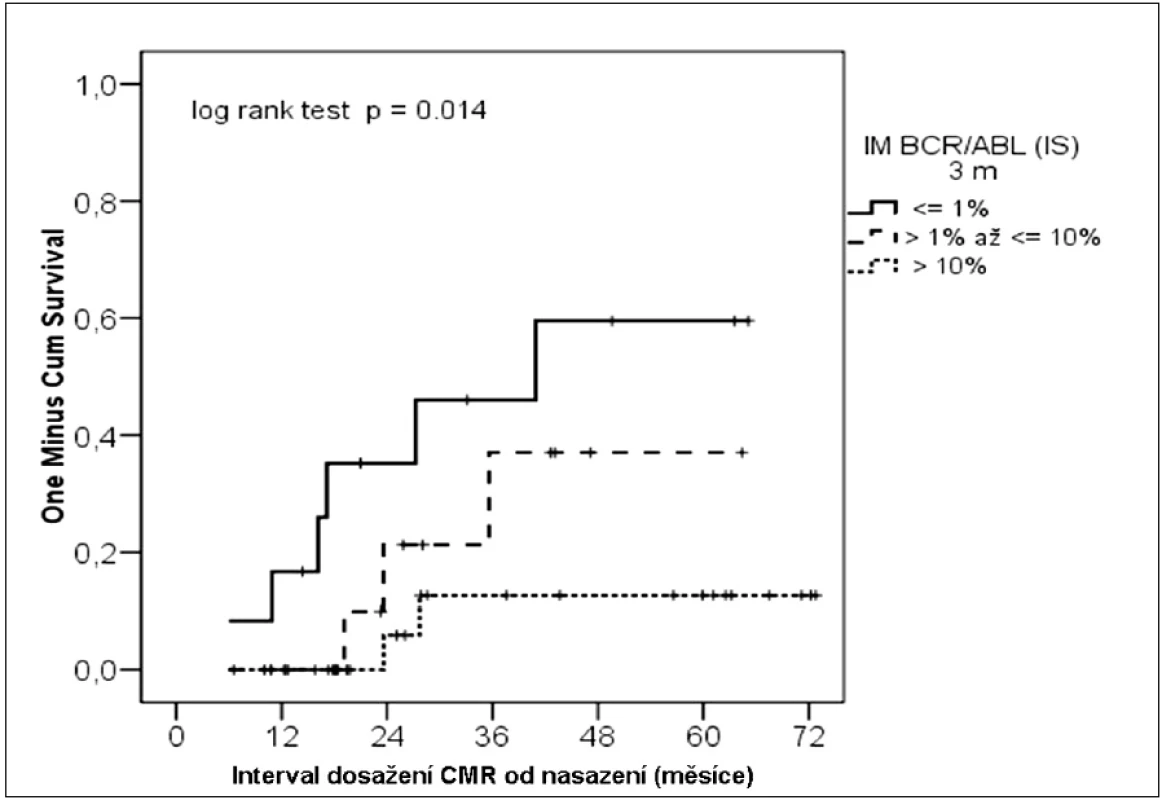
d) Vliv na celkovou léčebnou odpověď hodnocenou podle ELN kritérií
Podle ELN kritérií, celkově během léčby IM 32 (59 %) nemocných dosáhlo optimální odpovědi (O), 13 (24 %) mělo suboptimální odpověď (SU) a u 9 (17 %) nemocných došlo k selhání léčby (SE). Pro 7 nemocných byla k hodnocení léčby použita kritéria vztahující se k odpovědi po 12. měsících terapie (zastoupení O/SE 5/2). U 45 (83 %) nemocných byla hodnocena podle kritérií daných pro 18. měsíc léčby (zastoupení O/SU/SE 27/13/5). U 2 nemocných došlo k selhání léčby IM ještě před hodnoceným 12. měsícem (7. a 10. měsíc po zahájení).
Při korelaci léčebné odpovědi podle ELN kritérií s molekulární odpovědí ve 3. měsíci léčby bylo zjištěno, že již v tomto časovém intervalu hodnota BCR-ABL (IS) může předpovídat rychlost a pravděpodobnost dosažení optimální léčebné odpovědi na IM (p = 0,013) (tab. 1).
Table 1. Léčebná odpověď hodnocená podle ELN kritérií – prognostický vliv molekulární odpovědi ve 3. měsíci léčby. 
Všech 7 nemocných se SU ve skupině s > 1,0 a ≤ 10 % redukcí BCR-ABL dosáhlo MMR později než v hodnoceném 18. měsíci (medián 24 měsíců, rozmezí 21–52). Tři z nich dosáhli MMR po zvýšení dávkování IM. U všech těchto 7 nemocných MMR nadále přetrvává v mediánu 36 měsíců (rozmezí 20–43) od jejího 1. dosažení. Také 3 z 6 nemocných se SU ve skupině nemocných s > 10 % redukcí dosáhlo MMR. Medián dosažení byl 30 měsíců (rozmezí 23–30) od zahájení terapie IM. Dva z nich dosáhlo MMR po zvýšení dávky IM. Také u těchto sledovaných nemocných MMR dál trvá v mediánu 20 měsíců (rozmezí 13–35).
Diskuse
Imatinib je vysoce efektivní a dobře tolerovanou léčbou pro většinu nemocných s CML v chronické fázi, vedoucí k vysoké pravděpodobnosti dosažení CHR, CCyR a MMR. Odhalení molekulární podstaty CML učinilo z tohoto onemocnění model, na němž lze demonstrovat význam molekulárně genetické analýzy v definici, předpovědi a monitorování léčebné odpovědi.
Rozhodujícím prognostickým hlediskem u nemocných s CML léčených IM je hloubka dosažené odpovědi. „Zlatý“ standard představuje monitorování cytogenetické odpovědi. Studie ukázaly, že dosažení CCyR je spojeno s příznivou prognózou přežití bez progrese choroby (12). Proto je rozhodující časná identifikace nemocných s vysokým rizikem nedosažení CCyR. K tomu lze využít výsledků samotné cytogenetické analýzy. Cytogenetická odpověď po 6 měsících léčby je asociována s dosažením CCyR ve 2 letech (13).
Prognostický význam dosažení časné molekulární odpovědi byl poprvé referován ve studii IRIS. Nemocní s CCyR ve 12 měsících terapie IM a současně s MMR měli signifikantně lepší PFS než nemocní, kteří dosáhli pouze CCyR bez MMR (3). Několik následujících studií data IRIS studie potvrdilo a demonstrovalo, že nemocní s hlubší molekulární odpovědí mají velmi nízkou pravděpodobnost progrese a lepší PFS ve srovnání s nemocnými s horší odpovědí. Press a kol. publikovali práci, ve které byla prokázána asociace dosažení MMR do 12 měsíců léčby IM s delším trváním CCyR (14). Byly publikovány výsledky, které ukazovaly na souvislost mezi dobou dosažení MMR a délkou jejího trvání (15). Ukázalo se také, že časné monitorování po zahájení léčby IM může být užitečné v předpovědi optimální léčebné odpovědi. Monitorování hloubky molekulární odpovědi v určitých časových intervalech může predikovat pravděpodobnost dosažení CCyR, MMR a míru rizika progrese onemocnění. Časové období, ve kterém je molekulární odpověď nejčastěji hodnocena, je interval 3, 6 nebo 12 měsíců po zahájení terapie IM. Naopak výsledky jiných studií význam brzkého dosažení molekulární odpovědi pro prognózu nemocných relativizují a jako nejdůležitější výsledek potvrzují pouze dosažení kompletní cytogenetické odpovědi (16, 17). Tyto údaje mohou indukovat hypotézu, že v určitých časových intervalech má dosažení CCyR větší prognostický význam než dosažení molekulární odpovědi.
V této práci autoři hodnotili léčebnou odpověď souboru 54 nemocných s CML v chronické fázi léčených IM v 1. linii. Hlavním cílem bylo zhodnotit prognostický význam molekulární odpovědi v definovaném čase 3 měsíců léčby jako údaje predikujícího léčebnou odpověď. Naše analýza souboru, který byl rozdělen do 3 skupin podle hladiny BCR-ABL (IS), v souladu s literaturou (18, 19) prokázala, že nemocní s hlubší molekulární odpovědí po 3 měsících léčby mají větší pravděpodobnost dosažení CCyR do 1 roku terapie IM (≤ 1,0 %; > 1,0 a ≤ 10 %; > 10 %) (100 %; 69 %; 44 %). Při vyhodnocení molekulární odpovědi bylo zjištěno, že hodnota BCR-ABL (IS) ve 3. měsíci predikuje také následné dosažení MMR a CMR (p < 0,0001; p = 0,014). Tyto výsledky našeho zatím malého souboru nemocných plně korelují s literárními údaji (4, 20, 21).
European LeukemiaNet (ELN) kritéria byla definována za účelem klasifikace nemocných podle dynamiky léčebné odpovědi v čase. K monitorování se používají cytogenetické metody, RQ-PCR a analýza mutací v Abl kinázové doméně. V souladu s doporučením ELN lze předpokládat, že nemocní s hlubší léčebnou odpovědí po 3 měsících patří mezi rychle odpovídající nemocné, kteří pravděpodobně mohou mít lepší prognózu v důsledku brzkého dosažení optimální léčebné odpovědi (p = 0,013). V kritériích ELN však není zahrnuto časné sledování molekulární odpovědi na úrovních vyšších než je MMR. Důvodem může být nižší senzitivita metody v námi použitých rozmezích (BCR-ABL (IS) ≤ 1,0 %; > 1,0 a ≤ 10 % a > 10 %). Dalším důvodem jsou pravděpodobně stále určité rezervy v kvalitě výsledků, kdy podle externích kontrol stále určitá část laboratoří nedosahuje dostatečnou úroveň v přesnosti výsledků (22). Na druhé straně řada autorů nadále trvá na cytogenetické analýze jako základní metodě posuzování léčebné odpovědi na TKI u CML (23).
Nadále také trvá diskuse o významu suboptimální odpovědi dle ELN při posuzování léčebného výsledku TKI u CML. Předložená analýza, ale i naše dříve publikované zkušenosti (24), zpochybňují význam této kategorie. Její definitivní hodnocení je však nezbytné provést na větších souborech nemocných. Menší počet nemocných je přes dosaženou vysokou statistickou významnost v pozorovaných rozdílech mezi podskupinami nemocných samozřejmě největší limitací naší aktuální analýzy.
Přes všechna možná výše diskutovaná omezení se domníváme, že časné monitorování molekulární odpovědi nemocných s CML léčených v první linii IM může přispět jako další metoda ke zlepšení identifikace skupiny optimálně odpovídajících nemocných a nemocných, kteří mají větší riziko, že nedosáhnou optimální léčebnou odpověď v čase a měli by být pečlivě monitorováni.
Poděkování
Autorka děkuje Mgr. Janě Zapletalové, Dr. z Ústavu lékařské biofyziky LF UP Olomouc za pomoc při zpracování statistických údajů.
Práce byla podporována grantem IGA NT 12218-4/2011 a interním grantem LF-2011-006
Mgr. Šárka Rožmanová
Laboratoř molekulární biologie
Hemato-onkologická klinika FN a LF UP Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: rozmanova@centrum.cz
Doručeno do redakce: 21. 11. 2011
Přijato po recenzi: 13. 2. 2012
Sources
1. Deininger M, O’Brien SG, Guilhot F, et al. International randomized study of interferon vs STI571 (IRIS) 8-year follow up: sustained survival and low risk for progression or events in patients with newly diagnosed chronic myeloid leukemia in chronic phase (CML-CP) treated with imatinib. Blood (ASH Annual Meeting Abstracts) 2009; 114: Abstract 1126.
2. Guo JQ, Lin H, Kantarjian H, et al. Comparison of competitive-nested PCR and real-time PCR in detecting BCR-ABL fusion transcript in chronic myeloid leukemia patients. Leukemia 2002; 16 : 2447–2453.
3. Hughes TP, Kaeda J, Branford S, et al. Frequency of major molecular responses to imatinib or interferon alfa plus cytarabine in newly diagnosed chronic myeloid leukemia. N Engl J Med 2003; 349 : 1423–1432.
4. Cortez J, Talpaz M, OęBrien S, et al. Molecular responses in patients with chronic myelogenous leukemia in chronic phase treated with imatinib mesylate. Clin Cancer Res 2005; 11 : 3425–3432.
5. Branford S, Rudzki Z, Parkinson I, et al. Real-time quantitative PCR analysis can be used as a primary green to identify patients with CML treated with imatinib who have BCR-ABL kinase domain station. Blood 2004; 104 : 2926–2932.
6. Müller MC, Hanfstein B, Erben P, et al. Molecular response to first line imatinib therapy is predictive for long term event free survival in patients with chronic phase chronic myelogenous leukemia – an interim analysis of the randomized German CML study IV. Blood (ASH Annual Meeting Abstracts) 2008; 112: Abstract 333.
7. Quintás-Cardama A, Kantarjian K, Jones D, et al. Delayed achievement of cytogenetic and molecular response is associated with increased risk of progression among patients with chronic myeloid leukemia in early chronic phase receiving high-dose or standard-dose imatinib therapy. Blood 2009; 113 : 6315–6321.
8. Faber E, Nausova J, Jarosova M, et al. Intermittent dosage of imatinib mesylate in CML patients with a history of significant hematologic toxicity after standard dosing. Leuk Lymphoma 2006; 47 : 1082–90.
9. Baccarani M, Cortes J, Pane F, et al. Chronic myeloid leukemia: an update of concepts and management recommendations of European LeukemiaNet. J Clin Oncol 2009; 27 : 6041–51.
10. Gabert J, Beillard E, van der Velden VHJ, et al. Standardization and quality control studies of „real-time“ quantitative reverse transcriptase polymerase chain reaction of fusion gene transcripts for residual disease detection in leukemia - A Europe Against Cancer Program. Leukemia 2003; 17 : 2318–2357.
11. van Dongen JJ, Macintyre EA, Gabert JA, et al. Standardized RT-PCR analysis of fusion gene transcripts from chromosome aberrations in acute leukemia for detection of minimal residual disease. Report of the BIOMED-1 Concerted Action: Investigation of minimal residual disease in acute leukemia. Leukemia 1999; 13 : 1901–1928.
12. Druker BJ, Guilhot E, O’Brien SG, et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med 2006; 355 : 2408–2417.
13. O’Brien SG, Guilhot F, Larson RA, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 2003; 348 : 994–1004.
14. Press RD, Love Z, Tronnes AA, et al. BCR-ABL mRNA levels at and after the time of a complete cytogenetic response (CCR) predict the duration of CCR in imatinib mesylate-treated patients with CML. Blood 2006; 107 : 4250–4256.
15. Branford S, Lawrence R, Grigg A, et al. Long term follow up of patients with CML in chronic phase treated with first-line imatinib suggests that earlier achievement of a major molecular response leads to greater stability of response. Blood (ASH Annual Meeting Abstracts) 2008; 112: Abstract 2113.
16. Druker BJ, Guilhot E, O’Brien SG, et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med 2006; 355 : 2408–2417.
17. de Lavallade H, Apperley JF, Khorashad JS, et al. Imatinib for newly diagnosed patients with chronic myeloid leukemia: incidence of sustained responses in an intention-to-treat analysis. J Clin Oncol 2008; 26 : 3358–3363.
18. Vigneri P, Stagno F, Stella S, et al. BCR-ABLIS expression at diagnosis and after 3 or 6 months of treatment predicts CML response to imatinib therapy. Blood (ASH Annual Meeting Abstracts) 2010; 116: Abstract 3426.
19. Quintás-Cardama A, Kantarjian K, Jones D, et al. Delayed achievement of cytogenetic and molecular response is associated with increased risk of progression among patients with chronic myeloid leukemia in early chronic phase receiving high-dose or standard-dose imatinib therapy. Blood 2009; 113 : 6315–6321.
20. Branford S, Rudzki Z, Harper A, et al. Imatinib produces significantly superior molecular responses compared to interferon alfa plus cytarabine in patients with newly diagnosed chronic myeloid leukemia in chronic phase. Leukemia 2003; 17 : 2401–2409.
21. Hughes TP, Branford S, White DL, et al. Impact of early dose intensity on cytogenetic and molecular responses in chronic-phase CML patients receiving 600 mg/day of imatinib as initial therapy. Blood 2008; 112 : 3965-3973.
22. Müller MC, Cross NCP, Erben P, et al. Harmonization of molecular monitoring of CML therapy in Europe. Blood 2009; 23 : 1957-1963.
23. Jabbour E, Kantarjian H, O’Brien S, et al. The achievement of an early complete cytogenetic response is a major determinant for outcome in patients with early chronic phase chronic myeloid leukemia treated with tyrosine kinase inhibitors. Blood 2011; 118 : 4541–4546.
24. Rohoň P, Rožmanová Š, Zapletalová J, et al. Výsledky liečby pacientov v chronickej fáze chronickej myelocytovej leukémie na HOK v Olomouci v rokoch 2000-2009: prognostický význam Sokalovho indexu a ELN kritérií. Transfuze Hematol dnes 2010; 16(4): 202–209.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2012 Issue 2-
All articles in this issue
- Význam stanovení hladiny hepcidinu v diagnostice vybraných typů anémií v dětském věku
- Hodnocení časné molekulární odpovědi po 3 měsících léčby imatinibem může u nemocných s chronickou myeloidní leukemií přispět k upřesnění odhadu prognózy – zkušenosti jednoho centra
- Identifikace patogeneticky významných mutací u chronické lymfocytární leukemie pomocí „sekvenování nové generace“
- Současné možnosti laboratorní diagnostiky heparinem indukované trombocytopenie
- Kolapsový stav u 18leté dívky – kazuistika
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současné možnosti laboratorní diagnostiky heparinem indukované trombocytopenie
- Kolapsový stav u 18leté dívky – kazuistika
- Význam stanovení hladiny hepcidinu v diagnostice vybraných typů anémií v dětském věku
- Hodnocení časné molekulární odpovědi po 3 měsících léčby imatinibem může u nemocných s chronickou myeloidní leukemií přispět k upřesnění odhadu prognózy – zkušenosti jednoho centra
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

