-
Medical journals
- Career
Mobilizace krvetvorných buněk pomocí plerixaforu - zkušenosti transplantačních center v České republice
: Z. Kořístek 1; D. Pohlreich 2; D. Lysák 3; M. Lánská 4; J. Novák 5; T. Kepák 6; Skoumalová I. Mužík J. 7 8
: Interní hematoonkologická klinika, Fakultní nemocnice Brno 1; I. interní klinika, Všeobecná fakultní nemocnice Praha 2; Hematologicko-onkologické oddělení, Fakultní nemocnice Plzeň 3; 2. interní klinika - oddělení klinické hematologie, Fakultní nemocnice Hradec Králové 4; Oddělení klinické hematologie, Fakultní nemocnice Královské Vinohrady, Praha 5; Klinika dětské onkologie, Fakultní nemocnice Brno 6; Hemato-onkologická klinika, Fakultní nemocnice Olomouc 7; Institut biostatistiky a analýz, Masarykova univerzita, Brno 8
: Transfuze Hematol. dnes,18, 2012, No. 1, p. 6-12.
: Comprehensive Reports, Original Papers, Case Reports
Plerixafor je novým typem léku, jehož podání vede nezávisle na chemoterapii a na G-CSF k vyplavení progenitorů krvetvorby (HSC) do periferní krve. Plerixafor je derivát bicyklamu o malé molekule, který reverzibilně blokuje vazbu SDF-1/CXCR4. Tato vazba patří mezi nejdůležitější mechanismy, které udržují HSC v prostředí kostní dřeně a její inhibice vede k rychlé mobilizaci HSC do krve. Plerixafor je velmi cenným lékem zejména pro skupinu pacientů, u kterých standardní mobilizace (G-CSF ± chemoterapie) nevede k dostatečnému vyplavení HSC do krve a u kterých tak nelze získat bezpečný štěp periferních kmenových buněk (PBSC, peripheral blood stem cells) pro autologní transplantaci. Cílem této retrospektivní studie je vyhodnotit výsledky dosažené při podávání plerixaforu v transplantačních centrech České republiky.
Soubor pacientů a metody:
Plerixafor byl podáván od 2/2009 do 8/2011celkem 93 pacientům ve věku od 4 měsíců do 71 let (63 % muži, 37 % ženy), u kterých byla předchozí nebo stávající mobilizace neúspěšná (82 %) nebo u kterých byla vysoká pravděpodobnost neúspěšné standardní mobilizace (13,5 %).Výsledky:
Primární cíl odebrat bezpečný transplantát PBSC ( ≥ 2x106 CD34+ buněk/kg) byl splněn u 71,6 % mobilizací. Nežádoucí účinky plerixaforu byly mírné a dobře tolerované. Bylo provedeno 69 transplantací s použitím odebraných PBSC u 66 pacientů (71,0 %), s uspokojivě rychlou a trvalou obnovou krvetvorby.Závěr:
Autoři uzavírají, že plerixafor je velmi účinný mobilizační prostředek umožňující bez závažných nežádoucích účinků získat bezpečný a kvalitní autologní transplantát krvetvorby u většiny pacientů, u kterých standardní mobilizace selhala nebo selhává. Použití plerixaforu tak těmto pacientům umožňuje absolvovat vysokodávkovanou chemoterapii, která může výrazně zlepšit jejich prognózu a v některých případech vést ke kurativnímu léčebnému výsledku.Klíčová slova:
plerixafor, mobilizace, PBSC, CD34+ buňky, poor mobilizer, autologní transplantace krvetvorbyÚvod
Autologní transplantace krvetvorby (ASCT) po vysokodávkované chemo(radio)terapii jsou už přes 20 let pevnou součástí léčby především hematologických malignit, zejména mnohočetného myelomu a lymfomů. Své místo však ASCT nachází i v léčbě některých akutních leukemií a solidních nádorů, zejména dětského věku. Základním, a v současnosti téměř výhradním, zdrojem transplantátů pro ASCT jsou krvetvorné buňky získávané z periferní krve neboli peripheral blood stem cells (PBSC). První důkazy o trvalé cirkulaci krvetvorných buněk (HSC) v periferní krvi byly sice podány už v 60. letech minulého století (1), nejprve u myší a až později i u psů, opic a u člověka (2), ale praktickému získávání transplantátů PSBC z krevního oběhu bránila až na výjimky velmi nízká koncentrace těchto buněk v krvi. Situace se zásadně změnila s dostupností růstového faktoru pro granulocyty a makrofágy (GM-CSF) a pro granulocyty (G-CSF) na konci 80. let 20. století, kdy bylo zjištěno, že jejich podávání, ať už samostatně, nebo v kombinaci s chemoterapií, vede k vyplavování krvetvorných buněk do periferní krve. Pro vystupňované vyplavování PSBC do krve se postupně vžil termín mobilizace (3).
Během následujících deseti let se PBSC postupně prosadily jako hlavní zdroj HSC pro autologní transplantace, kdy v této indikaci nahradily až na výjimky transplantáty kostní dřeně. Díky relativní jednoduchosti a dostupnosti se mobilizace, odběry a transplantace PBSC rovněž velmi rychle rozšířily. V současnosti se pro mobilizaci téměř výhradně používá G-CSF, protože u většiny pacientů (samostatně nebo v kombinaci s chemoterapií) a u naprosté většiny dárců (samostatně) navodí uspokojivou mobilizaci s minimem nežádoucích účinků.
Problémem zůstává 10–20 % pacientů, označovaných termínem „poor mobilizers“, u kterých standardní mobilizace (G-CSF ± chemoterapie) nevede k uspokojivé mobilizaci PSBC. Schopnost mobilizace přitom může být negativně ovlivněna infiltrací kostní dřeně základní chorobou, vysokou intenzitou léčby, vyšším věkem, předcházející léčbou purinovými analogy, melfalanem, lenalidomidem, ve výjimečných případech může být nedostatečná mobilizace i habituální (s poor mobilizery se můžeme setkat i v populaci zdravých dárců). U naprosté většiny poor mobilizerů bohužel selhávají i různé alternativní mobilizační postupy, např. remobilizace, použití vysokých dávek G-CSF, vysokoobjemové aferézy (large-volume leukapheresis), kombinace G-CSF s jinými cytokiny atd. Nedostupnost bezpečného transplantátu PBSC samozřejmě u těchto pacientů neumožňuje indikovat ASCT, což s sebou nese zhoršení léčebných výsledků a horší prognózu těchto pacientů.
Zásadním průlomem v problematice mobilizací a nadějí pro nedostatečně mobilizující pacienty se stal až plerixafor, mobilizační látka nové generace. Plerixafor, malá molekula derivátu bicyklamu, je selektivní reverzibilní inhibitor vazby SDF-1/CXCR4. Vazba ligandu SDF-1 (stromal-derived factor 1) na jeho receptor CXCR4, který je přítomen na povrchu HSC v kostní dřeni, je jedním z nejdůležitějších mechanismů, který udržuje HSC v prostředí kostní dřeně. Inhibice interakce SDF-1/CXCR4 vede během několika hodin k vyplavení HSC do periferní krve a tento efekt je nezávislý na dalších mobilizačních podnětech (chemoterapie, G-CSF). Na druhé straně přináší kombinace plerixaforu s G-CSF nejméně aditivní mobilizační efekt, a proto by aplikaci plerixaforu měla předcházet určitá mobilizační příprava (priming) několikadenním podáváním G-CSF (4, 5).
Plerixafor v kombinaci s G-CSF se osvědčil nejen ve studiích s běžnými pacienty léčenými pro mnohočetný myelom a lymfomy, ale tato kombinace vykázala rovněž nečekaně vysokou efektivitu i u poor mobilizerů, tedy pacientů, u kterých předchozí pokusy o mobilizaci bez použití plerixaforu selhaly. Na základě dosažených výsledků plerixafor získal certifikaci FDA pro USA v roce 2008 a o necelý rok později bylo schváleno agenturou EMEA jeho používání i v Evropské unii.
Firma Genzyme v červenci 2008 zpřístupnila pro evropská pracoviště preparát bezplatně v rámci „named-patient compassionate use program“ (CUP), který byl určen pro pacienty s myelomy a lymfomy, u kterých selhala předchozí standardní mobilizace typu G-CSF ± chemoterapie. Program přitom umožňoval podání plerixaforu i pacientům s jinými diagnózami (vyjma leukemií), pokud ošetřující lékař indikaci obhájil. Česká transplantační centra se k programu připojila v lednu 2009 a v rámci CUP byl plerixafor v ČR použit u celkem 78 pacientů.
Plerixafor patří rozhodně mezi velmi cenné léky, na druhé straně je však určen pro poměrně malé množství pacientů. Proto se zástupci jednotlivých transplantačních center, která měla zkušenost s podáváním plerixaforu, dohodli, že své výsledky budou analyzovat společně. Za tímto účelem byla data o všech pacientech, kterým byl podán plerixafor v indikaci mobilizace, soustředěna v databázi SIMPLIFY (Systematic Investigation and Monitoring of Plerixafor Impact and Efficacy), kterou ve spolupráci s jednotlivými transplantačními centry vytvořil a spravuje Institut biostatistiky a analýz Lékařské a Přírodovědecké fakulty Masarykovy univerzity v Brně.
Soubor nemocných a metodika
Tato retrospektivní studie má za cíl vyhodnotit výsledky dosažené při použití plerixaforu u pacientů v České republice. Ve všech případech byl plerixafor indikován pouze u pacientů, u kterých 1) selhala nebo selhávala standardní mobilizace (G-CSF ± chemoterapie) – skupina prokázaných poor mobilizerů (proven poor mobilizers, ProPM) nebo 2) u kterých bylo na základě předchozí léčby vysoce pravděpodobné, že standardní mobilizace nebude úspěšná – skupina předpokládaných poor mobilizerů (predicted poor mobilizers, PrePM). Za zařazení pacientů do skupiny předpokládaných poor mobilizerů (PrePM) rozhodoval lékař daného centra.
Schémata mobilizace
Plerixafor byl ve všech případech použit v kombinaci s G-CSF. Standardní schéma mobilizace s plerixaforem bylo následující: G-CSF v dávce 10 μg/kg/den s.c. v jedné ranní dávce ode dne 1 do poslední aferézy nebo dne 7 (podle to, co nastalo dříve), plerixafor 240 μg/kg/den s.c. v jedné večerní dávce ve 22 h ode dne 4 do dne předcházející poslední aferéze nebo do dne 6 (podle toho, co nastane dříve). Z indikace ošetřujícího lékaře bylo v některých případech podávání plerixaforu zahájeno později (infekce, cytopenie), případně byl plerixafor podáván více než 3 dny. Aferézy byly standardně zahájeny v den 5 a pokračovaly každý den, dokud nebyl získán transplantát požadované kvality, nejméně však 2x106 CD34+ buněk/kg, pokud lékař neurčil jinak.
Kromě uvedeného standardního mobilizačního schématu byl plerixafor používán také v indikaci „on-demand“ (když to situace vyžaduje), dávka a způsob podání byly stejné (240 μg/kg/den s.c. ve 22 h). Použitím plerixaforu on-demand se rozumí doplnění obvyklé mobilizace (G-CSF ± chemoterapie) v případě, že u pacienta nedochází přes vzestup leukocytů k vyplavování CD34+ buněk. Jde tedy o posílení mobilizace pomocí plerixaforu u pacienta, který je v okamžiku indikace plerixaforu již zařazen mezi poor mobilizery (ProPM). Při podání plerixaforu on-demand se předpokládalo, že stávající mobilizace bude při přidání plerixaforu úspěšná a u pacienta nebude nutná remobilizace.
Kritéria pro zařazení pacientů
O zařazení pacientů do programu mobilizace s použitím plerixaforu rozhodoval ošetřující lékař na základě následujících kritérií: 1) pacient byl indikován k autologní transplantaci PBSC, 2) pacient při předchozí mobilizaci či mobilizacích nedosáhl v periferní krvi takové koncentrace CD34+ buněk, která by umožnila efektivní odběr PBSC pomocí leukaferézy (typicky < 15 CD34+ buněk/μl) a nebo 3) u pacienta nebyl pomocí leukaferéz při předcházejí mobilizaci získán bezpečný autologní transplantát PBSC (< 2x106 CD34+ buněk/kg) a nebo 4) pacient při současné mobilizaci nedosahoval přes adekvátní vzestup koncentrace leukocytů takovou koncentraci CD34+ buněk v periferní krvi, která by umožnila efektivní odběr PBSC pomocí leukaferézy.
Pacient nebyl zařazen do programu mobilizace s použitím plerixaforu v následujících případech: 1) renální selhávání s clearance < 30 ml/min nebo sérový kreatinin > 250 μmol/l, 2) bilirubin a jaterní testy převyšující dvojnásobek maxima normálních hodnot, 3) přítomnost aktivní hepatitidy B a C, 4) HIV pozitivita, 5) celkový klinický stav či komorbidity neumožňující bezpečnou mobilizaci a leukaferézy, 6) gravidita a kojení, 7) akutní nebo chronická leukemie, 8) autoimunitní onemocnění, 9) aktivní závažná bakteriální nebo mykotická infekce, 10) aktivní nádorová duplicita, 11) pacient nepodepsal informovaný souhlas s mobilizací s využitím plerixaforu.
Cíle a hodnocení úspěšnosti
Základním cílem mobilizace s použitím plerixaforu bylo získání bezpečného autologního transplantátu PBSC obsahujícího nejméně 2x106 CD34+ buněk/kg. Sekundární cíl byl charakterizován jako získání transplantátu, který by byl podle mínění ošetřujícího lékaře buď optimální (vyšší počet CD34+ buněk), nebo který by v indikovaných případech (např. pacienti s mnohočetným myelomem) umožnil provedení více než jedné autologní transplantace po vysokodávkované chemoterapii. Terciárním cílem bylo zjistit, zda se průběh transplantace s použitím autologních PBSC odebraných po mobilizaci s plerixaforem zásadně neliší od průběhu transplantací s použitím autologních PBSC odebraných po standardní mobilizaci bez použití plerixaforu, zejména z pohledu rychlosti a trvalosti obnovy krvetvorby.
Výsledky
Pacienti
Do studie bylo zařazeno 93 pacientů, kterým byl plerixafor podán v období únor 2009 až srpen 2011. Počet zařazených pacientů podle jednotlivých center je uveden v tabulce 1. Věk pacientů v době podání mobilizace s plerixaforem byl v průměru 52,6 let (medián 58 let, od 4 měsíců do 71 let), 59 pacientů (63,4 % pacientů) bylo mužského pohlaví, pacientek bylo 34 (36,6%). Hmotnost pacientů byla v průměru 79 kg (medián 80 kg; 6,5–125), výška 172 cm (medián; 67–195), BMI (body mass index) měl hodnotu 26,7 (medián; 13,4–45,6), přičemž 19 pacientů (20,2 %) mělo BMI vyšší než 30 (obezita) a dva pacienti (2,2 %) vyšší než 40. Diagnózy a další klinické a demografické údaje jsou shrnuty v tabulce 2.
1. Počet pacientů léčených a zařazených jednotlivými centry. 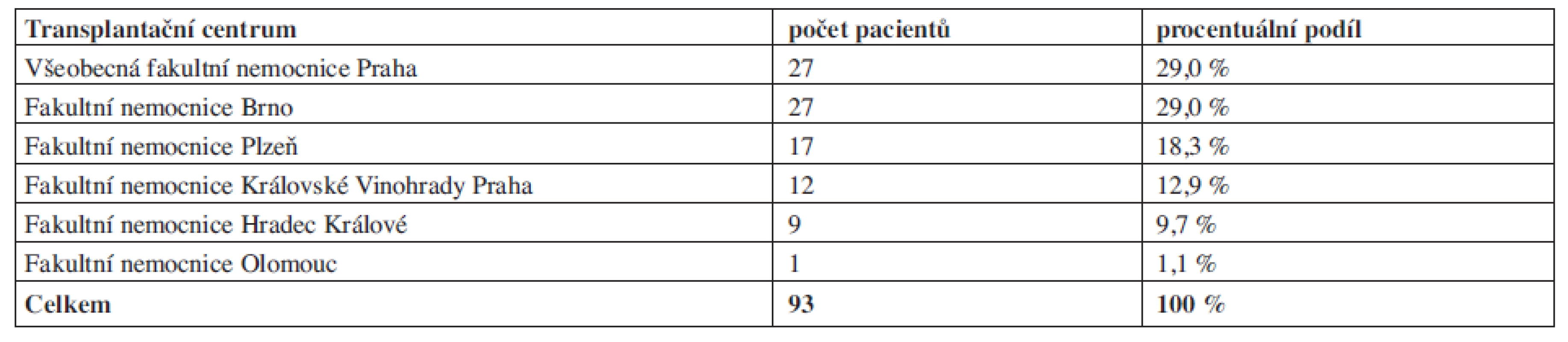
2. Klinické a demografické údaje o pacientech. 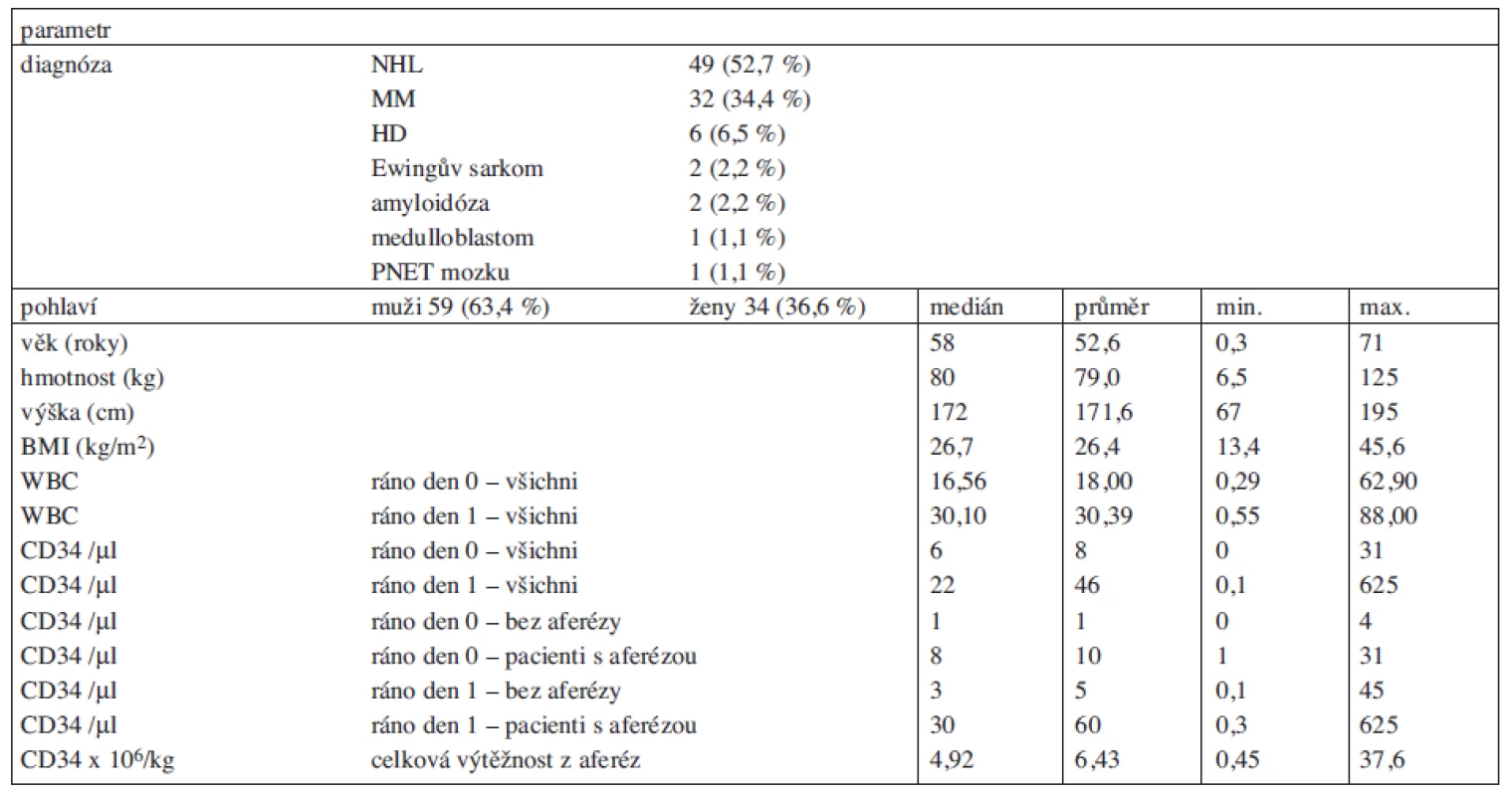
WBC = koncentrace leukocytů v krvi (x 109/l); CD34 = CD34+ buňky; CD34/μl = CD34+ buňky/μl periferní krve; den 0 = den 1. aplikace plerixaforu (před dnem očekávané první leukaferézy); den 1 = den následující po první aplikaci plerixaforu
Mobilizace s použitím plerixaforu
Plerixafor byl použit pro 95 mobilizací u 93 pacientů, z toho 48 % představovaly první mobilizace, dalších 47 % remobilizace, ve 4 % případů byl plerixafor použit v rámci druhé remobilizace a v jednom případě informace chybí. Plerixafor byl v 79 případech (82 %) indikován u pacientů, u kterých byla předchozí nebo stávající mobilizace neúspěšná (ProPM, proven poor mobilizers), indikace z důvodu vysoké pravděpodobnosti neúspěšné standardní mobilizace (PrePM, predicted poor mobilizers) byla méně častá (13 případů, 13,5 %) a ve 4 případech (4,2 %) nebyla indikace jasně stanovená. Od stanovení diagnózy do mobilizace s plerixaforem uběhlo od 20 dnů do více než 6 let (medián 7,6 měsíců).
Úprava dávkování plerixaforu byla provedena u 6 pacientů, jejichž hmotnost byla vyšší než 100 kg (1 ampule plerixaforu odpovídá dávce 240 μg/kg u pacienta s hmotností 100 kg), i když hmotnost přesahující 100 kg vykazovalo celkem 14 pacientů. Jedna pacientka dostala plerixafor v dávce pouze 154 μg/kg (větší dávka nebyla k dispozici). Snížení dávky plerixaforu je doporučené u pacientů s renální insuficiencí, pokud je clearance kreatininu menší než 50 ml/min. V našem souboru jsou k dispozici údaje o aktuální koncentraci kreatininu nebo clearance u 80 pacientů (85 %), z nichž tomuto kritériu sice vyhovovali 4 pacienti (dle zadané hodnoty clearance), resp. jeden pacient (dle aktuální koncentrace kreatininu), úprava dávky plerixaforu však u těchto pacientů provedena nebyla.
Účinnost plerixaforu
Obecně bylo ve všech případech cílem získat nejméně základní bezpečný transplantát autologních PBSC, tedy ≥ 2x106 CD34+ buněk/kg. Tento cíl se podařilo splnit u 68 mobilizací (71,6 %), z toho v 50 případech (73,5 %) bylo dosaženo primárního cíle již první leukaferézou (tedy po podání jedné dávky plerixaforu) a v 63 případech (92,6 %) postačovaly první dvě leukaferézy.
Sekundární cíl, tedy získání transplantátu odpovídajícího požadavku lékaře, tedy včetně transplantátů určených pro provedení více než jedné autologní transplantace PBSC, se podařilo dosáhnout u 45 mobilizací (47,4 %). V těchto případech byly požadavky kladené na kvalitu transplantátu často výrazně vyšší, základní kvalitu transplantátu (≥ 2x106 CD34+ buněk/kg) požadovali lékaři pouze u 7,4 % mobilizací, zatímco u 61,1 % mobilizací bylo požadováno více než 5x106 CD34+ buněk/kg a u 10,5 % mobilizací dokonce více jak 9x106 CD34+ buněk/kg.
V průměru bylo provedeno 1,7 leukaferézy při jedné mobilizaci (0–6, medián 2 leukaferézy). Zastoupení počtu leukaferéz u mobilizací ukazuje obrázek 1. Až na jeden případ byly všechny odběry PBSC provedeny pomocí separátoru COBE Spectra (65,8 % v režimu MNC a 34,2 % v režimu AutoPBSC).
1. Podíl počtu leukaferéz při mobilizacích 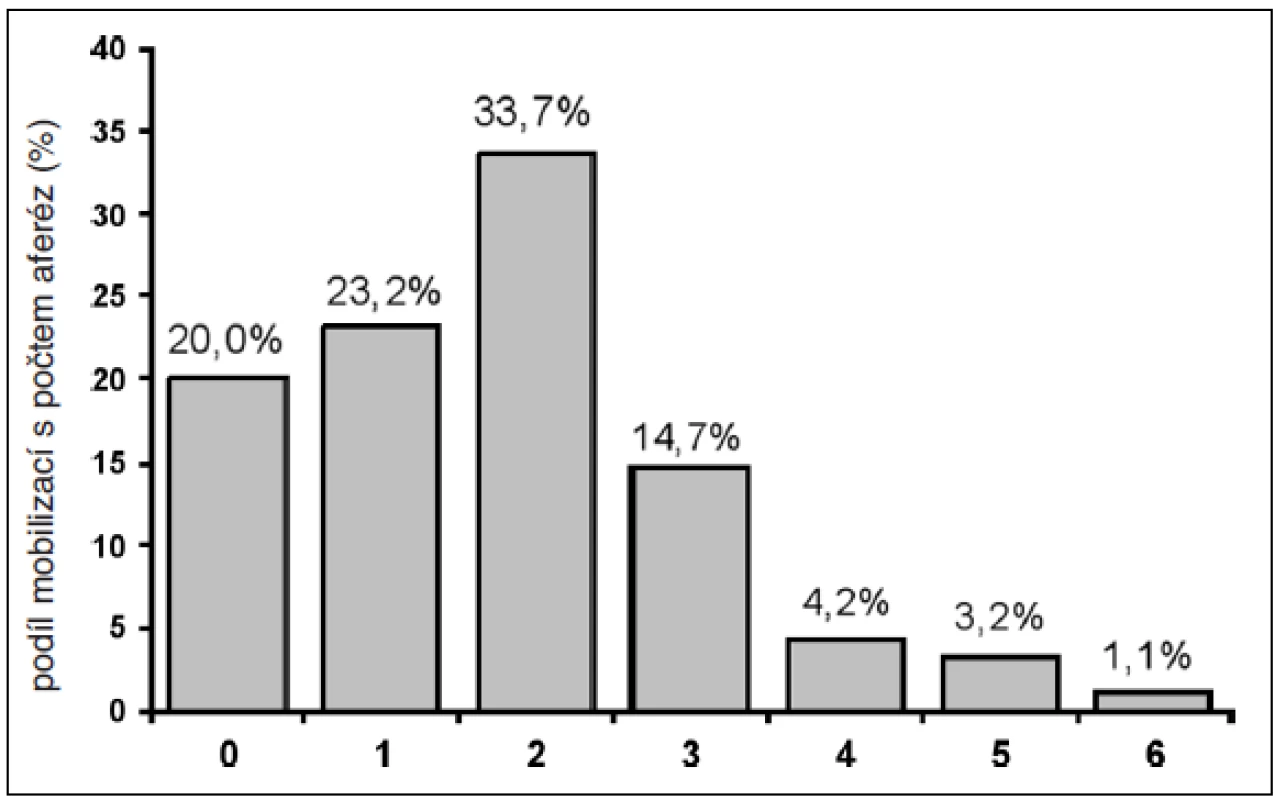
Kvalita mobilizace ve vztahu k leukocytóze
Bylo opakovaně prokázáno a je nade vší pochybnost, že výtěžnost leukaferézy je přímo úměrná koncentraci CD34+ buněk v krvi těsně před zahájení výkonu. Při mobilizaci s použitím plerixaforu existuje poměrně úzká korelace charakteru přímé úměry (Spearman’s r = 0,474, p < 0,001) mezi koncentrací leukocytů v krvi a koncentrací CD34+ buněk v periferní krvi – a tedy kvalitou mobilizace (obr. 2). Tento fakt by měl brán do úvahy zejména při použití plerixaforu on-demand, kdy předčasné zahájení podávání plerixaforu v době, kdy ještě nedochází k dostatečnému vyplavování leukocytů (tedy před dosažením leukocytózy 10–15x109/l), může výrazným způsobem negativně ovlivnit mobilizační efekt plerixaforu.
2. Závislost koncentrace CD34+ buněk na koncentraci leukocytů v periferní krvi (logaritmus) v době mobilizace s plerixaforem (n = 199; r = 0,474 (Spearman), p<0,001) 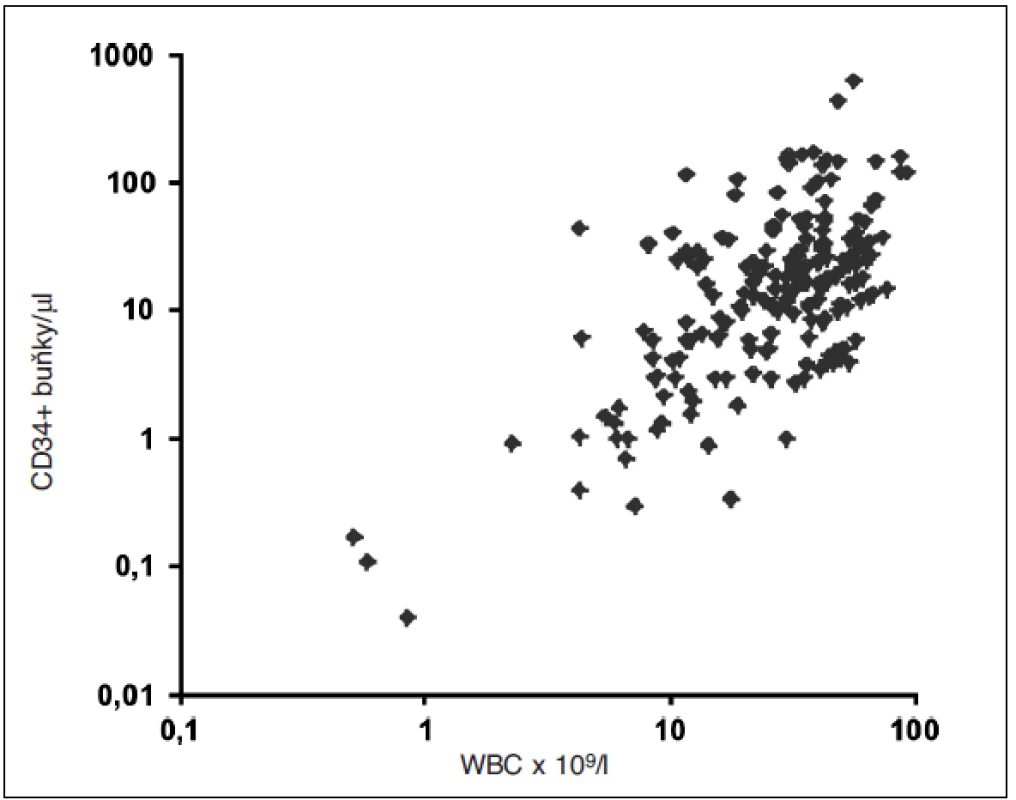
Nežádoucí účinky
Mobilizace s použitím plerixaforu nebyly zatížené výraznějšími nežádoucími účinky (NÚ), případné NÚ byly nezávažné či pouze mírné. Nejvíce pacientů zaznamenalo gastrointestinální (18,1 %) a muskuloskeletární potíže (17,0 %), jiné typy NÚ se vyskytovaly méně často (9,6 %). Podrobný přehled viz tabulka 3. Muskuloskeletární bolesti se přibližně ve stejné frekvenci vyskytují u mobilizací s použitím G-CSF bez plerixaforu. Poměrně typické NÚ vyplývající z použití plerixaforu jsou mírná nevolnost a průjem. NÚ vyplývající z případné mobilizační chemoterapie nebyly ve studii sledovány.
3. Výskyt nežádoucích účinků při použití plerixaforu. 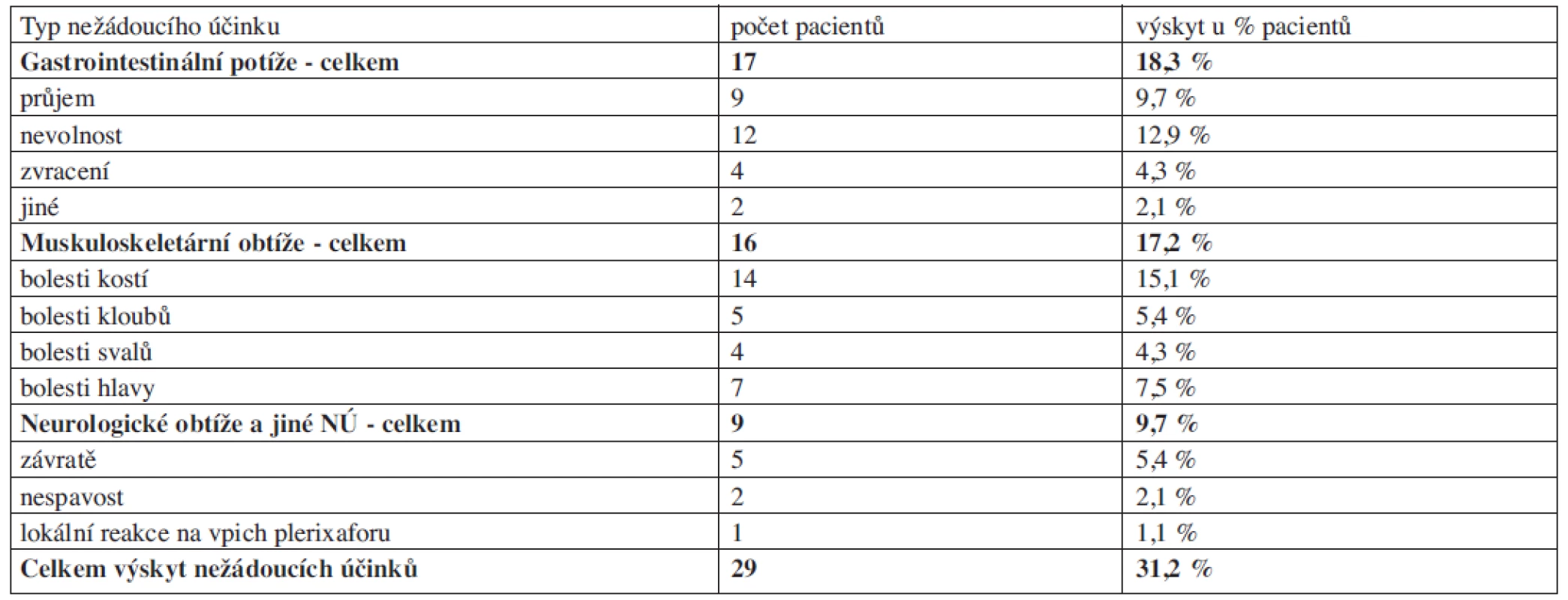
NÚ = nežádoucí účinek Transplantace PBSC získaných při mobilizaci s plerixaforem
Ve sledovaném období prodělalo 66 pacientů (71,0 %) celkem 69 vysokodávkovaných chemoterapií s autologní transplantací PBSC. Transplantaci absolvovalo 87,5 % pacientů léčených pro mnohočetný myelom (28 z 32), 59,2 % pacientů s ne-Hodgkinskými lymfomy (29 ze 49), 66,7 % pacientů s Hodgkinovým lymfomem (4 ze 6) a 83,3 % pacientů léčených pro jiné diagnózy (5 ze 6). Od mobilizace s plerixaforem do transplantace uběhly 2 týdny až 1,5 roku (medián 58 dní). Doba potřebná pro přihojení transplantátu se nelišila od intervalů běžných při transplantaci autologními PBSC odebranými při mobilizaci s využitím G-CSF bez plerixaforu. Parametry transplantátů a engraftmentu viz tabulka 4.
4. Parametry podaných transplantátů a doba do obnovy krvetvorby. 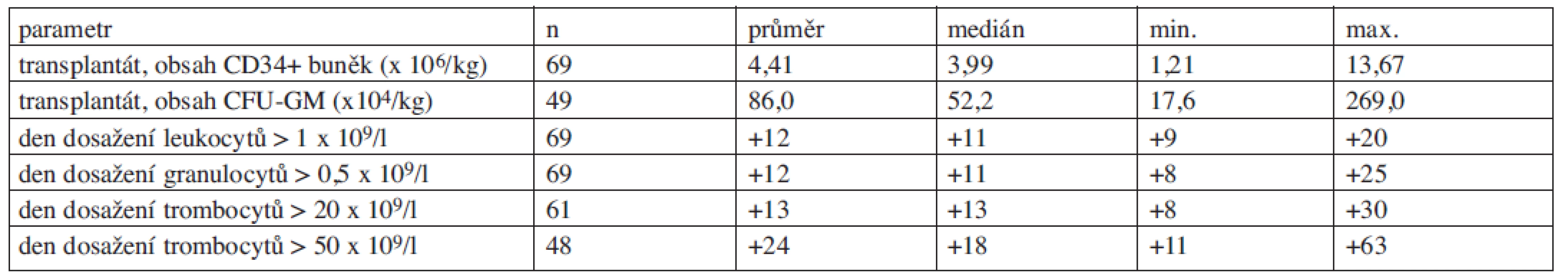
CFU-GM = buňky tvořící kolonie – granulocyty a makrofágy (colony-forming units – granulocyte-macrophage)
Diskuse
Randomizované, zaslepené a placebem kontrolované studie fáze III provedené u pacientů s lymfomy a mnohočetným myelomem ukázaly, že přidání plerixaforu ke standardní a první mobilizaci s G-CSF v porovnání se samotným G-CSF vedlo ke zvýšení podílu pacientů, u kterých se s minimem dobře tolerovaných nežádoucích účinků podařilo odebrat bezpečný transplantát autologních PBSC. Kombinace plerixaforu s G-CSF navíc vedla ke zlepšení predikovatelnosti doby sběru (odběrového okna), snížení počtu aferéz potřebných k získání požadovaného transplantátu a umožnila většímu podílu pacientů léčbu pomocí vysokodávkované chemoterapie s autologní transplantací krvetvorby. Obnova krvetvorby po transplantaci se rychlostí ani trvalostí nelišila od historických kontrol, kdy byly použity transplantáty odebrané pouze po G-CSF (6, 7). Na základě těchto výsledků byl plerixafor schválen pro použití ve Spojených státech a později i v Evropě.
Největším problémem v oblasti mobilizace a odběrů autologních PBSC však není predikce odběrového okna či snaha o snížení počtu leukaferéz a nutných dnů hospitalizace. Zásadním problémem je skupina pacientů, nazývaných poor mobilizers, u kterých standardní mobilizace typu G-CSF ± chemoterapie selhala nebo selhává. Tato skupina pacientů nebyla sice v registračních studiích speciálně zohledněna, na druhé straně však vysoký mobilizační potenciál plerixaforu a unikátní mechanismus působení v podobě inhibice vazby SDF-1/CXCR4 přinesl pro tyto pacienty šanci na zásadní změnu. V posledních letech se navíc zdá, že podíl poor mobilizerů zejména ve skupině pacientů s mnohočetným myelomem narůstá, což je pravděpodobně dáno především používáním nových léčiv typu thalidomidu a lenalidomidu (8), a z tohoto důvodu bylo potřebné přijít s novými a efektivními mobilizačními postupy. Plerixafor byl v tomto ohledu velmi slibným preparátem a proto se začala studovat jeho účinnosti u pacientů, u kterých standardní mobilizace selhala nebo u kterých bylo selhání standardní mobilizace vysoce pravděpodobné.
Jedna z prvních prací studujících účinnost plerixaforu v kombinaci s G-CSF u pacientů ze skupiny poor mobilizers byla publikována Calandrou a kol. Autoři podávali plerixafor v kombinaci s G-CSF v rámci remobilizace u pacientů s mnohočetným myelomem a lymfomy, u kterých standardní mobilizace selhala. Cílem bylo získat základní bezpečný transplantát autologních PBSC, tedy alespoň 2x106 CD34+ buněk/kg. Autoři konstatovali vysokou efektivitu kombinace plerixaforu s G-CSF, kdy byla mobilizace zakončena úspěšným odběrem u 60,3 % pacientů s NHL, 71,4 % pacientů léčených pro myelom a 76,5 % pacientů s Hodgkinovým lymfomem (9). Duarte a kol. předložili práci založenou na datech získaných v době bezplatného zpřístupnění plerixaforu v rámci evropského „named-patient compassionate use program“ (CUP). Tento program umožňoval podávat plerixafor pacientům, u kterých předchozí mobilizace selhala, a později také pacientům, u kterých běžná mobilizace právě selhávala a nedocházelo k adekvátnímu vyplavování krvetvorných buněk do krve. Celkem u 75 % pacientů s lymfomy a myelomem, u kterých byla první standardní mobilizace neúspěšná, se podařilo při zařazení plerixaforu do mobilizace odebrat bezpečný transplantát (> 2x106 CD34+ buněk/kg) během dvou leukaferéz (medián), přičemž úspěšnost u pacientů s myelomem dosáhla dokonce 84 % (10).
Tyto výsledky výrazně překonávaly dosud známé postupy, které se používaly v případě selhání standardní mobilizace: vysoké dávky G-CSF, ať už v kombinaci s chemoterapií nebo samostatně, kombinace G-CSF a SCF (stem cell factor), případně kombinace G-CSF a GM-CSF (granulocyte-macrophage colony-stimulating factor), pegylovaný G-CSF, vše v kombinaci s vysokoobjemovými leukaferézami apod. (11–15). Další publikace rovněž potvrzovaly nadřazenost kombinace plerixaforu s G-CSF nad dřívějšími postupy a výsledky byly velmi podobné – remobilizace s plerixaforem byla úspěšná u více než 70–80 % pacientů, u kterých standardní mobilizace selhala (16, 17).
Jednou z možností, jak předejít nezbytné remobilizaci u pacientů, u kterých je současná standardní mobilizace neúspěšná, je použití plerixaforu ve formě podpory (boost) probíhající mobilizace. Tato slibná metoda se někdy označuje termíny plerixafor on-demand (když to situace vyžaduje), plerixafor just-in-time (ve správnou chvíli) nebo plerixafor real-time rescue (záchrana ve správnou chvíli). Z dostupných prací i vlastních dat se zdá, že tento způsob je vhodné zvážit v těch případech, kdy pacient reaguje na standardní mobilizaci (G-CSF ± chemoterapie) nástupem leukocytózy (> 10–15 x 109/l), která však není provázená odpovídajícím vyplavováním CD34+ buněk, jejichž koncentrace v periferní krvi zůstává na nízké úrovni (< 10–15/μl). Pokud v této chvíli přidáme do kombinace plerixafor v běžné dávce (240 μg/kg/den s.c. okolo 22. hodiny), pak je vysoká pravděpodobnost, že dojde k aditivnímu mobilizačnímu efektu, který umožní odebrat bezpečný transplantát. V našem souboru pacientů se mobilizační postup on-demand osvědčil v 75 % případů, kdy byl využit jako podpora (boost) selhávající standardní mobilizace. Podobná data publikovali i jiní autoři (16–21).
Na základě výše uvedených výsledků používání plerixaforu v České republice lze konstatovat, že naše výsledky se zásadně neliší od výsledků jiných skupin. Velmi podobná je i skladba a frekvence nežádoucích účinků plerixaforu, přičemž tyto nežádoucí účinky jsou dobře tolerované a zvladatelné.
Závěr
Plerixafor je mobilizační látkou nové generace, s minimem nežádoucích účinků a přitom vysokou účinností. Jde o velmi cenný lék především pro skupinu pacientů, u kterých selhala nebo selhávají standardní mobilizační schémata založená na G-CSF, obvykle v kombinaci s chemoterapií. Pro tyto pacienty není v současnosti dostupná plnohodnotná alternativa k aplikaci plerixaforu.
Během posledních přibližně tří let získala pracoviště v České republice velmi cenné zkušenosti s podáváním plerixaforu v indikaci mobilizace PBSC. Naše výsledky jsou přitom zcela porovnatelné s výsledky jiných zahraničních pracovišť a skupin. Tato první analýza údajů obsažených ve společné databázi SIMPLIFY (Systematic Investigation and Monitoring of Plerixafor Impact and Efficacy) nemá být pouze přehledem dosažených výsledků, ale je rovněž základním východiskem pro další optimalizaci postupů souvisejících s mobilizacemi a odběry krvetvorných buněk pro autologní transplantace krvetvorby.
Poděkování
Velmi děkujeme všem spolupracovníkům na jednotlivých pracovištích za jejich pomoc a entuziasmus. Rádi bychom poděkovali také firmě GENZYME, která v rámci CUP (compassionate use program) umožnila bezplatné podávání plerixaforu u většiny pacientů. Bez této vstřícnosti bychom naše zkušenosti a takový objem údajů, který máme v současnosti k dispozici, získávali podstatně pomaleji.
MUDr. Zdeněk Kořístek, Ph.D.
Interní hematoonkologická klinika
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
Doručeno do redakce: 1. 2. 2012
Přijato po recenzi: 17. 2. 2012
Sources
1. Goodman JW, Hodgson GS. Evidence for stem cells in the peripheral blood of mice. Blood 1962; 19 : 702–714.
2. McCredie KB, Hersh EM, Freireich EJ. Cells capable of colony formation in the peripheral blood of man. Science 1971; 171 : 293–294.
3. To LB, Haylock DN, Simmons PJ, Juttner CA. The Biology and Clinical Uses of Blood Stem Cells Blood 1997; 89 : 2233–2258.
4. Liles CW, Broxmeyer HE, Rodger E, et al. Mobilization of hematopoietic progenitor cells in healthy volunteers by AMD3100, a CXCR4 antagonist. Blood 2003; 102 : 2728–2730
5. Liles WC, Rodger E, Broxmeyer HE, et al. Augmented mobilization and collection of CD34+ hematopoietic cells from normal human volunteers stimulated with granulocyte-colony-stimulating factor by single-dose administration of AMD3100, a CXCR4 antagonist. Transfusion 2005; 45 : 295–300.
6. DiPersio JF, Stadtmauer EA, Nademanee A, et al. Plerixafor and G-CSF versus placebo and G-CSF to mobilize hematopoietic stem cells for autologous stem cell transplantation in patients with multiple myeloma. Blood 2009; 113 : 5720–5726.
7. DiPersio JF, Micallef IN, Stiff PJ, et al. Phase III prospective randomized doubleblind placebo-controlled trial of plerixafor plus granulocyte colony-stimulating factor compared with placebo plus granulocyte colony-stimulating factor for autologous stem-cell mobilization and transplantation for patients with non-Hodgkin lymphoma. J Clin Oncol 2009; 27 : 4767–4773.
8. Kumar S, Dispenzieri A, Lacy MQ, et al. Impact of lenalidomide therapy on stem cell mobilization and engraftment post-peripheral blood stem cell transplantation in patients with newly diagnosed myeloma. Leukemia 2007; 21 : 2035–2042.
9. Calandra G, McCarty J, McGuirk J, et al. AMD3100 plus G-CSF can successfully mobilize CD34+ cells from non-Hodgkin’s lymphoma, Hodgkin’s disease and multiple myeloma patients previously failing mobilization with chemotherapy and/or cytokine treatment: compassionate use data. Bone Marrow Transplant 2008; 41 : 331–338.
10. Duarte RF, Shaw BE, Marín P, et al. Plerixafor plus granulocyte CSF can mobilize hematopoietic stem cells from multiple myeloma and lymphoma patients failing previous mobilization attempts: EU compassionate use data. Bone Marrow Transplant 2011; 46 : 52–58.
11. Weaver CH, Tauer K, Zhen B, et al. Second attempts at mobilization of peripheral blood stem cells in patients with initial low CD34+ cell yields. J Hematother 1998; 7 : 241–249.
12. Fraipont V, Sautois B, Baudoux E, et al. Successful mobilization of peripheral blood HPCs with G-CSF alone in patients failing to achieve sufficient numbers of CD34+ cells and/or CFU-GM with chemotherapy and G-CSF. Transfusion 2000; 40 : 339–347.
13. Boeve S, Strupeck J, Creech S, Stiff PJ. Analysis of remobilization success in patients undergoing autologous stem cell transplants who fail an initial mobilization: risk factors, cytokine use and cost. Bone Marrow Transplant 2004; 33 : 997–1003.
14. Goterris R, Hernandez-Boluda JC, Teruel A, et al. Impact of different strategies of second line stem cell harvest on the outcome of autologous transplantation in poor peripheral blood stem cell mobilizers. Bone Marrow Transplant 2005; 36 : 847–853.
15. Pusic I, Jiang SY, Landua S, et al. Impact of mobilization and remobilization strategies on achieving sufficient stem cell yields for autologous transplantation. Biol Blood Marrow Transplant 2008; 14 : 1045–1056.
16. D’Addio A, Curti A, Worel N, et al. The addition of plerixafor is safe and allows adequate PBSC collection in multiple myeloma and lymphoma patients poor mobilizers after chemotherapy and G-CSF. Bone Marrow Transplant 2011; 46 : 356–363.
17. Jantunen E, Kuittinen T, Mahlamäki E, et al. Efficacy of pre-emptively used plerixafor in patients mobilizing poorly after chemomobilization: a single centre experience. Eur J Haematol 2011; 86 : 299–304.
18. Micallef IN, Stiff PJ, DiPersio JF, et al. Successful stem cell remobilization using plerixafor (mozobil) plus granulocyte colony-stimulating factor in patients with non-hodgkin lymphoma: results from the plerixafor NHL phase 3 study rescue protocol. Biol Blood Marrow Transplant 2009; 15 : 1578–86.
19. Gopal AK, Karami M, Mayor J, et al. The effective use of plerixafor as a real-time rescue strategy for patiens poorly mobilizing autologous CD34(+) cells. J Clin Apher. 2012 doi: 10.1002/ jca.21206 (ePub).
20. Li J, Hamilton E, Vaughn L, et al. Effectiveness and cost analysis of “just-in-time” salvage plerixafor administration in autologous transplant patients with poor stem cell mobilization kinetics. Transfusion 2011; 51 : 2175–82.
21. Basak GW, Mikala G, Koristek Z, et al. Plerixafor to rescue failing chemotherapy-based stem cell mobilization: it’s not too late. Leuk Lymphoma 2011; 52 : 1711–1719.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2012 Issue 1-
All articles in this issue
- Mobilization of hematopoetic stem cells using plerixafor - experience of the Czech Republic transplantation centers
- Genetic polymorphisms of platelet receptors in young patients with AIM and resistance to antiplatelet therapy
- Venous thrombosis in children with acute lymphoblastic leukaemia
- Prevalence of red blood cell and HLA antibodies in multi-transfused haematological patients
- The role of physical activity in patients suffering from haematological malignancies
- Asymptomatic pituitary macroadenoma oppressing optic chiasm – ‘incidentaloma‘ – identified within diagnostical staging of patient with primary extranodal diffuse large B-cell lymphoma of orbit and paranasal sinuses – a case report
- Risk factors associated with increased nonrelapse mortality and with poor overall survival in children with chronic graft-versus-host disease
- Chemoimmunotherapy for hemophagocytic lymphohistiocytosis: long-term results of the HLH-94 treatment protocol
- Lack of clarity in the definition of treatment-related mortality: pediatric acute leukemia and adult acute promyelocytic leukemia as examples (Perspectives)
- Preemptive immunotherapy in childhood acute myeloid leukemia for patients showing evidence of mixed chimérism after allogeneic stem cell transplantation
- Anti-Escherichia coli asparaginase antibody levels determine the activity of second-line treatment with pegylated E. coli asparaginase: a retrospective analysis within the ALL-BFM trials
- Warfarin and acetaminophen interaction: a summary of the evidence and biologic plausibility (Evidence-based focused review)
- The role of matched sibling donor allogeneic stem cell transplantation in pediatric high-risk acute myeloid leukemia: results from the AML-BFM 98 study
- VKORC1 and CYP2C9 genotype and patient characteristics explain a large proportion of the variability in warfarin dose requirement among children
- Activity of alemtuzumab monotherapy in treatment-naive, relapsed, and refractory severe acquired aplastic anemia
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Asymptomatic pituitary macroadenoma oppressing optic chiasm – ‘incidentaloma‘ – identified within diagnostical staging of patient with primary extranodal diffuse large B-cell lymphoma of orbit and paranasal sinuses – a case report
- The role of physical activity in patients suffering from haematological malignancies
- Prevalence of red blood cell and HLA antibodies in multi-transfused haematological patients
- Mobilization of hematopoetic stem cells using plerixafor - experience of the Czech Republic transplantation centers
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

