-
Medical journals
- Career
Výsledky liečby pacientov v chronickej fáze chronickej myelocytovej leukémie na HOK v Olomouci v rokoch 2000-2009: prognostický význam Sokalovho indexu a ELN kritérií
: P. Rohoň 1; Š. Rožmanová 1; J. Zapletalová 2; I. Skoumalová 1; M. Divoká 1; M. Holzerová 1; K. Indrák 1; E. Faber 1
: Hemato-onkologická klinika FN a LF UP v Olomouci, 2Ústav lékařské biofyziky LF UP v Olomouci 1
: Transfuze Hematol. dnes,16, 2010, No. 4, p. 202-209.
: Comprehensive Reports, Original Papers, Case Reports
Chronická myelocytová leukémia (CML) je klonovou poruchou hemopoetickej kmeňovej bunky s jej diferenciáciou prevažne do myeloidného radu. V súčasnej ére imatinibu (IM) a nových inhibítorov tyrozínových kináz (TKI) sa prognóza a kvalita života pacientov s CML zásadne zlepšila. V predloženej práci analyzujeme 110 dospelých pacientov s diagnózou CML v chronickej fáze, ktorí užívali IM či TKI 2. generácie v rokoch 2000–2009. 40 pacientov 36,4 % začalo liečbu IM v 1. línii a 70 (63,6 %) po predchádzajúcej liečbe interferónom-α (IFN-α) (IM v 2. línii). Zo sledovaného súboru dlhodobo prežíva 104 pacientov (94,5 %), pravdepodobnosť 6-ročného prežitia bola 94,0 %. Pri porovnaní IM v 1. a 2. línii liečby môžeme konštatovať, že kompletnú cytogenetickú odpoveď dosiahlo 87,5 % vs. 80,0 % pacientov v mediáne 7 vs. 15 mesiacov (p = 0,02), veľkú molekulovú odpoveď 67,5 % vs. 41,4 % pacientov v mediáne 16 vs. 17 mesiacov (p = 0,34) a kompletnú molekulovú odpoveď 32,5 % vs. 40,0 % pacientov v mediáne 24 vs. 24 mesiacov (p = 0,42). Výsledky liečby IM v 1. línii korelujú s literárnymi údajmi. Dosiahnuté celkové prežitie chorých liečených IM v 2. línii po IFN-α je po 6 rokoch 95,4 % a patrí k najlepším z uvádzaných v literatúre. Z prognostických indexov sa ukázala výborná korelácia Sokalovho skóre a OS. Nezávislým prognostickým faktorom pre OS, PFS a EFS boli ELN kritériá. Cytogenetická a molekulová progresia sa pri liečbe IM v oboch skupinách vyskytla u 27 pacientov (24,5 %) a u 9 (8,2 %) z nich bola potvrdená mutácia v ABL kinázovej doméne. Zo skupiny osôb s mutáciami mali 2 pacienti komplexný karyotyp, v jednom prípade sa súčasne počas liečby objavila v Ph negatívnom klone trizómia chromozómu 8. Naše skúsenosti dokazujú vysokú účinnosť IM v 1. a 2. línii liečby v podmienkach bežnej klinickej praxe.
Kľúčové slová:
chronická myelocytová leukémia, imatinib, rezistenciaÚvod
Chronická myelocytová leukémia (CML) je najčastejšie sa vyskytujúcou chronickou myeloproliferáciou. Zahŕňa približne 15 % všetkých leukémii u dospelých. Celková incidencia osciluje medzi 0,6 až 2 novými prípadmi na 100 000 obyvateľov a rok. Medián veku v čase diagnózy je 55–60 rokov. Mierna predominancia patrí mužom (asi 1,4 : 1) (1).
Tak, ako sa menili názory na príčiny a biologickú podstatu CML, dochádzalo i k zmenám v náhľade na terapiu. Do 60. rokov minulého storočia bola liečba CML výhradne paliatívna: arzenik, busulfán, ožiarenie sleziny. Od cytoredukčných látok zo 70. rokov minulého storočia sa postupne prechádzalo k cielenejšej terapii. V druhej polovici 70. rokov sa v indikačne úzko ohraničenej skupine presadila alogénna transplantácia kmeňových buniek (ATKB). Je dôležité podotknúť, že prísne indikačné kritériá a riziko úmrtia v súvislosti s transplantáciou obmedzovali a napokon naďalej obmedzujú jej širšie uplatnenie. V prvej polovici deväťdesiatych rokov minulého storočia nastúpil do liečby CML interferón-α (IFN-α). V prípade, že pacient nebol alogénne transplantovaný, predstavoval IFN-α liek 1. voľby. Kompletná cytogenetická odpoveď (CCyR) bola dosiahnutá až u 25 % osôb, ešte výraznejší efekt bol docielený kombináciou s cytozínarabinozidom (Ara-C). Použitím IFN-α sa predĺžilo celkové prežitie (OS) na 66-89 mesiacov. Hoci má IFN-α celý rad nežiaducich účinkov, v určitých situáciách nastáva jeho renesancia (2). V roku 2001 prenikol do klinickej praxe imatinib (IM), ktorý predstavuje úplne novú liečebnú modalitu. Sledované celkové prežitie CML pacientov v chronickej fáze sa predĺžilo na 174 mesiacov. IM je malá „rozumná“ molekula, ktorá neovplyvňuje genetickú informáciu a zdravé bunky ako klasické cytostatiká, ale k liečebnému pôsobeniu dochádza inhibíciou kľúčového mechanizmu abnormálnej aktivácie signálnych dráh leukemickej bunky.
ELN (European Leukemia Net) odporúča IM v dávke 400 mg/deň v 1. línii liečby de novo diagnostikovanej CML v chronickej fáze. V súčasnosti sú pre chorých rezistentných na IM dostupné inhibítory tyrozínových kináz (TKI) 2. generácie: dasatinib a nilotinib. Sú účinnejšie ako IM a inhibujú aj väčšinu mutovaných foriem BCR/ABL kinázy s výnimkou mutácie T315I. ATKB by sa mala indikovať v chronickej fáze CML pri zlyhaní liečby TKI 1. a 2. generácie alebo progresii ochorenia do akcelerovanej či blastovej fázy (3). U všetkých pacientov je pre dosiahnutie optimálnych výsledkov nevyhnutná kontinuálna liečba adekvátnymi dávkami IM (4). Nežiaduce účinky počas liečby IM bývajú mierne až stredne ťažké, zväčša bez nutnosti redukcie dávky. Ukončenia liečby pre 3. a 4. stupeň toxicity postihuje menej ako 2 % pacientov. Najčastejšie ide o myelosupresiu, retenciu tekutín a hepatotoxicitu (5, 6). Veľmi dôležitým problémom priamo súvisiacim s výsledkami liečby je rezistencia na IM. Jej príčinou môže byť zmena efluxných a influxných bunkových púmp (primárna rezistencia). Sekundárna rezistencia najčastejšie tkvie v bodových mutáciách v ABL kinázovej doméne alebo v hyperexpresii BCR/ABL onkoproteínu v dôsledku amplifikácie BCR/ABL génu (7, 8, 9).
V predkladanom príspevku analyzujeme výsledky liečby IM v prvej a druhej línií u chorých s CML liečených v našom centre. Cieľom práce bolo porovnať naše výsledky s literárnymi údajmi a overiť platnosť súčasných prognostických kritérií v rutinnej klinickej praxi.
Materiál a metódy
Súbor pacientov
Do analýzy boli zaradení všetci po sebe diagnostikovaní chorí, ktorí boli na HOK FN v Olomouci od 1. 12. 2000 do 1. 5. 2009 liečení v prvej alebo druhej línií IM. Všetci zahrnutí pacienti boli v chronickej fáze CML. Analýza súboru bola urobená k 1. 6. 2009. Medián veku pacientov v čase diagnózy bol 52 rokov (rozsah 18–73 rokov). 40 pacientov (36,4 %) začalo liečbu IM v 1. línii (1. podanie IM v septembri 2001) a 70 (63,6 %) po predchádzajúcej liečbe IFN-α +/ – Ara-C (november 2000) (IM v 2. línii).
Liečba
Chorí boli liečení IM v dennej dávke 400 mg. V prípadoch významnej hematologickej toxicity (stupeň III podľa kritérií NCI) bola liečba trvale prerušovaná iba výnimočne, väčšinou bolo používané intermitentné dávkovanie (10). Pri perzistujúcej neutropénii bol podávaný G-CSF v individuálnom dávkovaní. U väčšiny pacientov bola monitorovaná hladina imatinibu v plazme, pri zníženej hladine, suboptimálnej odpovedi alebo zlyhaní liečby bola dávka imatinibu individuálne zvyšovaná až na 800 mg/deň.
Definície odpovede na liečbu
Boli použité štandardné kritéria podľa ELN (3), pre zjednodušenie a jednoznačnosť sú uvedené kritériá z roku 2009 v prehľadných tabuľkách 1 a 2 (11). Celkové prežitie pri liečbe IM v súbore pacientov je definované ako interval od zahájenia liečby IM do úmrtia pacienta alebo dátumu posledného hodnotenia súboru (1. 6. 2009). Taktiež sme sledovali prežitie bez progresie (PFS); progresia bola definovaná podľa štúdie IRIS ako: akcelerácia, blastová kríza, strata CHR, strata MCyR, nárast počtu leukocytov u pacienta bez dosiahnutej CHR a úmrtie. Posledným sledovaným parametrom bolo prežitie bez udalosti (EFS); udalosť bola definovaná ako: progresia, zlyhanie liečby imatinibom (ELN), intolerancia imatinibu a strata CCyR, nedosiahnutie MCyR po 12 mesiacoch liečby imatinibom, CCyR po 18 mesiacoch liečby imatinibom, CHR po 6 mesiacoch liečby imatinibom (12).
1. Hodnotenie liečebnej odpovede pacientov s CML. 
2. ELN kritériá pre hodnotenie odpovede pacientov v chronickej fáze CML liečených imatinibom. 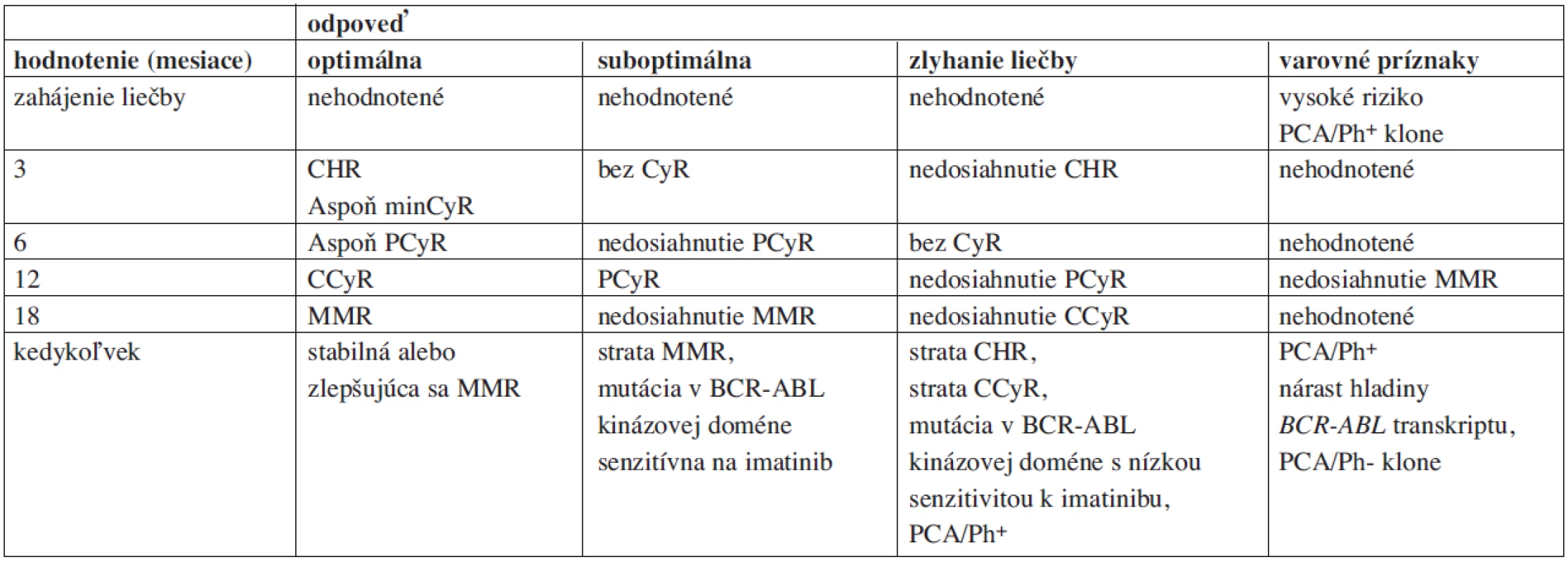
Štatistické zhodnotenie
Pre účely deskriptívnej štatistiky boli použité základné parametre (kontinuálne premenné: medián, aritmetický priemer, rozsah, štandardná odchýlka; kategorické premenné: frekvencia). Analýza prežitia bola realizovaná pomocou Kaplanovej-Meierovej metódy. Krivky prežitia boli porovnávané pomocou log-rank testu (13). Mannov-Whitneyov U test bol použitý pri porovnávaní parametrov, ktoré nevykazovali normálnu distribúciu (napr. leukocytové subpopulácie), normálnosť distribúcie bola overená Kolmogorovým-Smirnovým testom. Výsledky boli hodnotené ako štatisticky signifikantné vtedy, ak hladina významnosti bola p < 0,05. Všetky výpočty boli realizované pomocou SPSS softvéru (version 15.0 for Windows, SPSS Inc., Chicago USA).
Výsledky
Zo súboru 110 pacientov, ktorí boli liečení IM a užívali liek 3 a viac mesiacov, k 1. 6. 2009 žilo 104 osôb (94,5 %). V 5 prípadoch bola príčinou úmrtia progresia základného ochorenia a v jednom prípade bola príčinou nehematologická malignita (karcinóm laryngu). Medián sledovania pacientov bol 72 mesiacov (rozsah 10–236 mesiacov) u žijúcich a 25 mesiacov (4–93 mesiacov) u zosnulých. Pacienti predliečení IFN-α túto liečebnú modalitu ukončili vo všetkých sledovaných prípadoch. Medián časového intervalu od stanovenia diagnózy do začatia liečby IM v prvej línii (resp. po cytoredukčnej liečbe hydroxyureou) bol 1 mesiac (rozsah 0–72 mesiacov), pričom je dôležité podotknúť, že do 3 mesiacov od stanovenia diagnózy bol imatinib podávaný až 92,5 % pacientov. V skupine pacientov predliečených IFN-α bol IM zahájený do 3 mesiacov od diagnózy len u 8,6 % pacientov, čo je očakávaný údaj. Medián trvania liečby IM v 1. línii je 41 mesiacov (rozsah 3–81 mesiacov). IM bol v prvej i druhej línii dávkovaný štandardne (u 64,3 % a 65,0 % pacientov), zvýšene maximálne do dávky 800 mg/deň (u 27,1 % a 27,5 % pacientov) a redukovane s minimálnou dávkou 100 mg/deň (u 8,6 % a 7,5 % pacientov). V oboch skupinách bola najčastejšou príčinou zvýšeného dávkovania cytogenetická progresia a redukovaného dávkovania intolerancia a hematologická toxicita.
Z hľadiska hodnotenia prognostických indexov podľa Sokala bolo 43,6 % pacientov nízkorizikových, 33,6 % malo stredné a 22,8 % vysoké riziko. Podľa Hasforda v čase diagnózy malo nízke riziko 37,1 %, stredné 48,6 % a vysoké 14,3 % pacientov. PCA pri zahájení liečby IM boli prítomné u 14 pacientov (12,7 %), komplexné zmeny karyotypu u 7 pacientov (6,4 %). Leukocytóza bola prítomná u 92,3 % a splenomegália u 46,2 % pacientov v čase diagnózy. Medián sledovania celého súboru pacientov bol 72 mesiacov (rozsah 10–236 mesiacov) pri predliečení INF-α 85 mesiacov (rozsah 4–236 mesiacov), v IM ramene 43 mesiacov (rozsah 4–101 mesiacov p = 0,0001) a napokon bol 72 mesiacov (rozsah 10–236 mesiacov) u žijúcich a 25 mesiacov (4–93 mesiacov) u zosnulých. Podrobný popis súboru ukazujú tabuľky 3a a 3b.
Tab 3a. Prehľadná charakteristika dôležitých parametrov v súboru pacientov. 
Tab. 3b. Prehľadná charakteristika dôležitých parametrov v súboru pacientov. 
Vysvetlivky: Sokal N/S/V – nízke/stredné/vysoké riziko, ELN kritériá (bez ohľadu na čas hodnotenia) O/S/Z – optimálna /suboptimálna /zlyhanie, N – počet osôb. aKontinuálne premenné sú uvedené vo formáte medián (minimum – maximum) v mesiacoch, ak to nie je v tabuľke uvedené inak. b.Pre vybrané kontinuálne premenné je použitý Mannov-Whitneyov U test. Poznámka: Imatinib (100 a 400 mg tablety), dasatinib (50 a 20 mg tablety) a nilotinib (200 mg tablety) boli podávané perorálne. Hematologická odpoveď bola sledovaná v mesačných, cytogenetická v trojmesačných a neskôr v šesťmesačných a nopokon molekulová v trojmesačných intervaloch. Pre objektivizáciu dosiahnutej odpovede sa využívajú ELN kritériá, výsledky v jednotlivých podskupinách ukazuje tabuľka 4.
3. Dosiahnutie CCyR, MMR – porovnanie s ELN kritériami. 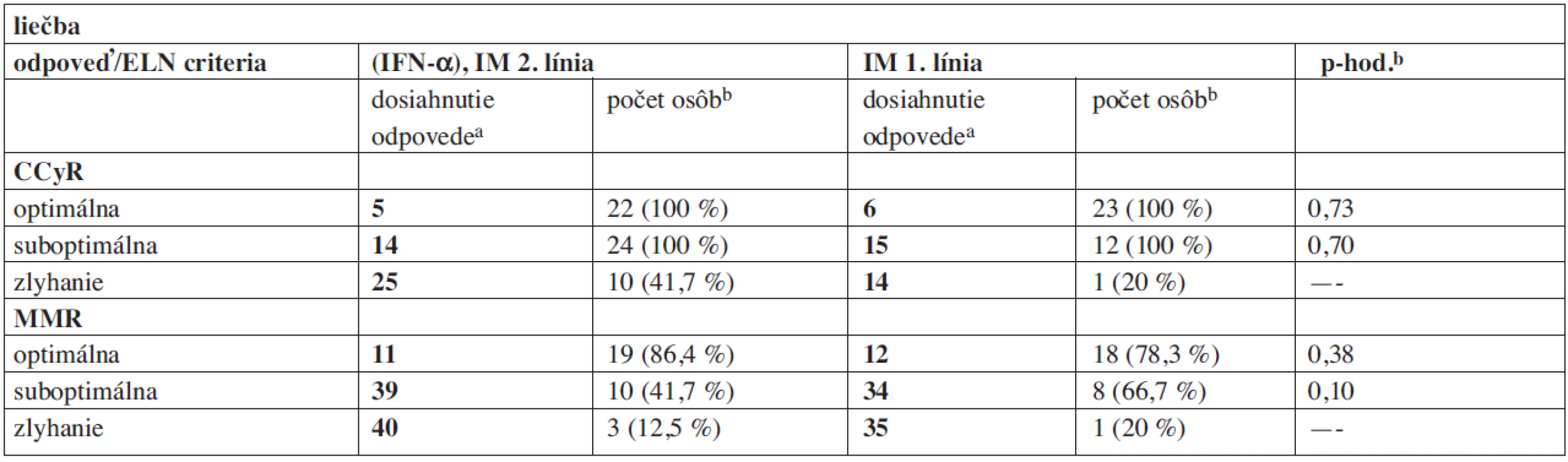
Vysvetlivky: V tabuľke sú hodnotené časové úseky do dosiahnutia CCyR a MMR: avo formáte medián (mesiace), tučné písmo, babsolútne počty pacientov dosahujúcich danú odpoveď a napokon percentuálny podiel z celkového počtu v osôb v danej skupine podľa ELN kritérii (hodnotených po 18 mesiacoch liečby IM u 102 pacientov; 8 pacientov bolo hodnotených v kratšom intervale s minimom 3 mesiacov). Štatisticky sú porovnané časové úseky – cpre kontinuálne premenné je použitý Mannov-Whitneyov U test. Z tabuľky 4 je zrejmé, že nie sú štatisticky významné rozdiely v dosiahnutí CCyR a MMR v závislosti na predliečení IFN-α. Je ale zaujímavé, že v podskupine osôb predliečených IFN-α je pacient, u ktorého podľa ELN kritérii zlyhala liečba IM (nedosiahnutie CCyR po 18 mesiacoch) a napokon bola zaznamenaná s veľkým oneskorením (po 56 mesiacoch) CMR. Taktiež neboli potvrdené štatisticky významné rozdiely v oboch podskupinách pri sledovaní intenzity dávkovania IM (štandardné, zvýšené a redukované).
Cytogenetické vyšetrenie u pacientov pred zahájením IM potvrdilo výhradnú prítomnosť Ph chromozómu u 51 (72,8 %) osôb predliečených IFN-α a 38 (95,0 %) osôb liečených výhradne IM. Recipročne bol pozorovaný výrazne vyšší podiel pacientov s PCA a komplexným karyotypom u predliečených IFN-α ako pri podaní IM v 1. línii (13 a 6 pacientov vs. 1 a 1 pacient). Cytogenetická a molekulová progresia pri liečbe IM v oboch skupinách sa vyskytla u 27 pacientov (24,5 %) a u 9 (8,2 %) z nich bola potvrdená mutácia v ABL kinázovej doméne (2x T315I, 2x F359V, F317L, P309L, E255K, Q252H a E355G). Zo skupiny osôb s mutáciami mali 2 pacienti komplexný karyotyp, v jednom prípade sa súčasne počas liečby objavila v Ph negatívnom klone trizómia chromozómu 8.
Klinicky významné nežiaduce účinky sme v priebehu liečby zaznamenali u 46 pacientov (41,8 %). Hematologická toxicita bola celkovo prítomná u 32 (29,1 %) pacientov. Závažné nežiaduce účinky (stupeň III a IV) sa vyskytovali zriedkavo: neutropénia (7,3 %), anémia (5,5 %) a trombocytopénia (8,2 %). Prejavy toxicity boli najvýraznejšie počas prvých týždňov liečby. Nehematologická toxicita zahŕňala predovšetkým retenciu tekutín, nauzeu, svalové kŕče, bolesti kostí a svalov, exantém, subkonjuktiválne hematómy, hypokalémiu, hypofosfatémiu a hepatotoxicitu. Nežiaduce účinky boli zvládnuteľné symptomatickou terapiou a v niektorých prípadoch krátkodobým prerušením liečby IM.
Prežívanie pacientov
Pravdepodobnosť 6-ročného prežívania je 94 %, u pacientov predliečených IFN-α 95,4 % a pri prvolíniovej liečbe IM 91,8 % (graf 1a, 1b). Prežívanie pacientov záviselo od rizikovosti podľa Sokalovho indexu a ELN kritérii. Štatisticky významne lepšie prežívali pacienti s nízkym a stredným rizikom podľa Sokala (predliečení IFN - vs. IM v 1. línii: nízkorizikoví 100 % a 100 %, strednerizikoví 96 % a 100 %, vysokorizikoví 78,8 % a 74,6 %, p = 0,04 a p = 0,03) (graf 2a, 2b). Podobná je i situácia po zohľadnení ELN kritérii – štatisticky významne lepšie prežívali pacienti s optimálnou odpoveďou (predliečení IFN-α vs. IM v 1. línii: optimálna odpoveď 100 % a 100 %, suboptimálna odpoveď 100 % a 91,7 %, zlyhanie odpovede 85 % a 53,3 %, p = 0,03 a p = 0,002) (graf 3a, 3b). Rozdiel v prežívaní v závislosti od rizikovosti podľa Hasforda nebol štatisticky významný. V oboch podskupinách sme pred zahájením liečby IM identifikovali komplexný karyotyp u 7 pacientov, u 6 z nich došlo počas liečby k molekulovej alebo cytogenetickej progresii, ktorá vyžadovala zvýšenie dávkovania IM a napokon i podanie 2. generácie TKI. V jednom prípade sme zaznamenali úmrtie v dôsledku progresie základnej choroby. V súbore sme ďalej sledovali i prežitie bez progresie (PFS), PFS v celom súbore po 6 rokoch sledovania bol 86 % u pacientov predliečených IFN-α 85,2 % a pri prvolíniovej liečbe IM 88,2 %. Posledným sledovaným parametrom bolo prežitie bez udalosti (EFS), EFS v celom súbore po 6 rokoch sledovania bol 53,7 % u pacientov predliečených IFN-α 46,7 % a pri prvolíniovej liečbe IM 61,9 %.
Diskusia
Výsledky liečby v našom súbore pacientov korelujú s literárnymi údajmi. Predliečenie IFN-α ovplyvňuje dosiahnutie CHR a CCyR, nie však MMR a CMR v porovnaní s prvolíniovým IM. V prípade CHR musíme mať však na zreteli fakt, že pacienti predliečení IFN-α dosiahli CHR ešte pred nasadením IM. Medián dosiahnutia CCyR je štatisticky signifikantne kratší pri liečbe IM v 1. línii. Včasné dosiahnutie CCyR ale nemá vplyv na OS. Paradoxne je OS lepší u osôb predliečených IFN-α, čo však súvisí s tým, že úmrtia v danom ramene sa vyskytli do 15 mesiacov od započatia liečby IM (u predliečených IFN-α do 38 mesiacov)(14). Pozorované nesignifikantné rozdiely v dosiahnutí MMR a CMR môžu byť predovšetkým dôsledkom intenzívnejšieho monitorovania pacientom liečených výlučne IM. Z prognostických indexov sa ukázala výborná korelácia Sokalovho skóre s celkovým prežitím, nižšia výpovedná hodnota je pre parametre PFS a EFS. Je ale pravdou, že pre parameter OS nie je pre skupinu nízkeho a stredného rizika Sokalov index optimálny, v našom prípade ale mohlo vzniknúť skreslenie v dôsledku nižšieho počtu pacientov. Pri určitom zjednodušení by sa dalo uvažovať aj o zlúčení oboch skupín. Hasfordov skórovací systém nevykazoval v žiadnom zo sledovaných parametrov náležitú koreláciu. To v určitom smere otvára cestu pre používanie a vytváranie ďalších skórovacích systémov – napr. systém vytvorený v Hammersmithskej nemocnici (15). Medzi základnými vstupnými parametrami (veľkosť sleziny a pečene, počet leukocytov) neboli signifikantné rozdiely a pre daný súbor neboli samostatnými nezávislými prognostickými ukazovateľmi. Dávkovanie IM nemalo zásadný vplyv na OS – to je nepriamy dokaz, že chorí sú liečení s maximálnym ohľadom na klinickú situáciu, rozvoj rezistencie a maximálne intenzívne. Tiež to znamená, že intermitentné dávkovanie je bezpečnou stratégiou. V podskupine pacientov predliečených IFN-α mali pacienti s redukovaným dávkovaním signifikantne najlepší PFS (p = 0,002) a najhorší EFS (p = 0,001) – údaje nie sú prezentované. Tento výsledok je len orientačný (v skupine s redukovaným dávkovaním je 6 pacientov) a navyše intolerancia IM (dominujúca príčina jeho redukcie) bola zahrnutá do kategórie udalosť (event). V našom súbore sme pozorovali, že pacienti s komplexným karyotypom pred zahájením liečby IM majú horšiu prognózu a vo väčšine prípadov vyžadujú liečbu 2. generáciou TKI. Vzhľadom k malému počtu pacientov s PCA nie je možné štatisticky zhodnotiť ich dosah na OS. Z publikovaných údajov však môžeme odvodiť, že zrejme nie je rozdiel v prežívaní medzi osobami s jedinou abnormalitou (Ph chromozómom) a PCA ako je delécia der(9q) alebo trizómia chromozómu 8 – čo sú takmer všetky abnormality vyskytujúce sa v našom súbore. Úplne odlišná je situácia v prípade identifikácie komplexného karyotypu (16). Zo 7 pacientov s komplexnými cytogenetickými zmenami došlo v jednom prípade k úmrtiu v dôsledku progresie základného ochorenia, ostatní pacienti počas liečby molekulovo alebo cytogeneticky progredovali, čo vyžadovalo zvýšenie dávkovania IM a neskôr i podanie 2. generácie TKI. Zaujímavé je zistenie, že počet mutácii nenarástol s časom sledovania ani predliečením IFN-α. ELN kritériá sú nezávislým prognostickým faktorom pre OS, PFS a EFS (údaje nie sú prezentované).Ukazuje sa však, že všetci pacienti so suboptimálnou odpoveďou (hodnotenou v 12 mesiaci) dosiahnu CCyR (po 24 mesiacov a po 15 mesiacov) a dokonca i malý počet pacientov, ktorí zlyhávajú pri liečbe IM (nedosiahnutá CCyR po 18 mesiacoch), zaznamená napokon CCyR. EFS po 6 rokoch sledovania je horší v skupine pacientov predliečených IFN-α. Tento výsledok je pravdepodobne spôsobený vyšším počtom pacientov a dlhším intervalom sledovania.
Účinnosť liečby IM u novo diagnostikovaných pacientov bola zhodnotená vo fáze III v medzinárodnej štúdii s názvom IRIS (International Randomized Study of Interferon and STI571)(17). Aktualizované výsledky po 8 rokoch sledovania ukázali, že pravdepodobnosť OS je 85 % (pri zahrnutí úmrtí výlučne v dôsledku CML je až 93 %) a pravdepodobnosť prežitia bez progresie choroby do akcelerovanej fázy či blastovej krízy je 81 % (18). V rámci rozšírenia dostupnosti imatinibu došlo k jeho uvoľneniu i pre českých pacientov koncom roku 2000 v 2 centrách, výsledky boli publikované v rokoch 2003 a 2004. Voglová potvrdila obdobné výsledky u chorých v chronickej fáze CML liečených v štúdii CZSTI5710113. 34 pacientov bolo sledovaných v mediáne 2 rokov a CHR bola dosiahnutá u 97 %, MCyR u 63 % (19, 20).
Určitou limitujúcou skutočnosťou štúdie IRIS je, že výrazný podiel pacientov liečených IFN-α bolo nasledovne liečených IM a nedá sa preto priamo porovnať prežitie pôvodne randomizovaných pacientov. Porovnanie je teda možné urobiť skôr s historickými súbormi pacientov liečených interferónom. I tu sa ukazuje, že liečba IM spojená so signifikantne lepším prežitím, lepšou šancou dosiahnuť významnú cytogenetickú odpoveď, vyššou pravdepodobnosťou prežitia bez progresie a to i pri zohľadnení prognostických skupín podľa Sokala. Je tiež významné, že veľká či CCyR dosiahnutá po 12 mesiacoch liečby (bez ohľadu na terapeutický prístup), je významným prediktívnym ukazovateľom (21).
V súčasnosti sú už vytvorené i provizórne kritériá pre hodnotenie liečby 2. generáciou TKI v prípade rezistencie k imatinibu u pacientov v chronickej fáze CML, ktoré sú podstatne prísnejšie (suboptimálna odpoveď: v 3 mesiacoch minCyR, v 6 mesiacoch PCyR, v 12 mesiacoch nedosiahnutie MMR; zlyhanie liečby: v 3 mesiacoch noCyR, v 6 mesiacoch minCyR, v 12 mesiacoch nedosiahnutie PCyR).
Od diagnostických kritérii bol len krok k vytvoreniu liečebných odporučení, tie je možné zjednodušene zhrnúť do tabuľky 5.
4. Odporúčania pre liečbu pacientov s CML v roku 2009. 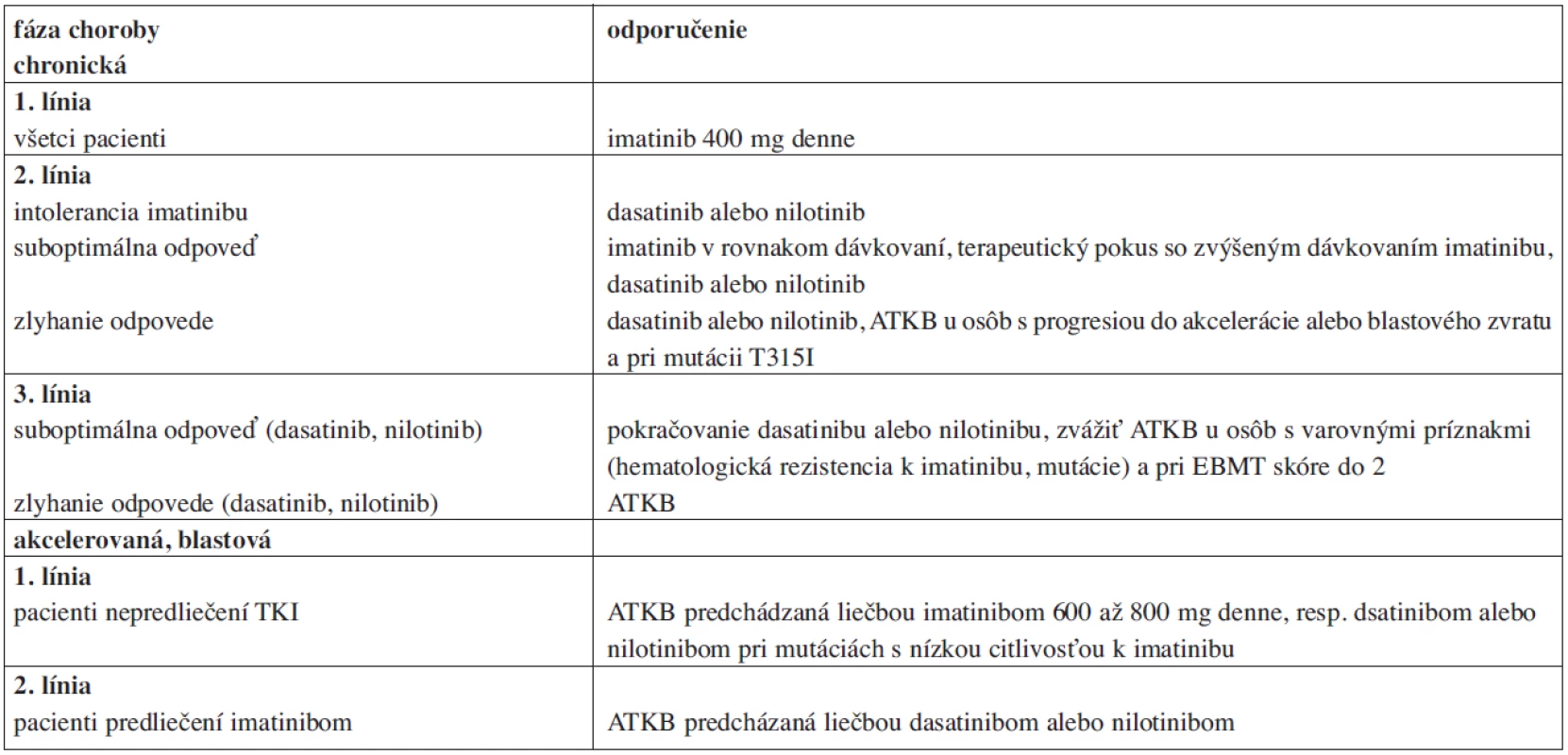
Záver
V predloženej práci analyzujeme súbor pacientov v chronickej fáze CML, ktorí boli a sú liečení v olomouckom centre. Výsledky terapie plne korelujú s literárnymi údajmi. Z prognostických indexov sa potvrdila výborná korelácia Sokalovho skóre s celkovým prežitím. ELN kritériá sú nezávislým prognostickým faktorom pre OS, PFS a EFS. Ukazuje sa, že predliečenie IFN-α nemá vplyv na celkové prežitie pacientov. Pravidelné zhodnotenie liečebných postupov je dôležitým nástrojom zlepšovania zdravotnej starostlivosti.
Skratky
Ara-C – cytozínarabinozid
ATKB – alogénna transplantácia krvotvorných buniek
CCyR – kompletná cytogenetická odpoveď (complete cytogenetic response)
CHR – kompletná hematologická odpoveď (complete hematologic response)
CML – chronická myelocytová leukémia
CMR – kompletná molekulová odpoveď (complete molecular response)
CyR – cytogenetická odpoveď (cytogenetic response)
EFS – prežitie bez udalosti, príznakov ochorenia (event-free survival)
ELN – Európska leukemická sieť (European Leukemia Net)
HR – hematologická odpoveď (hematologic response)
IFN-α – interferón alfa
IM – imatinib mesylát
IRIS – International Randomized Study of Interferon and STI571
MCyR – veľká cytogenetická odpoveď (major cytogenetic response)
MDR – mnohopočetná lieková rezistencia (multidrug resistance)
MMR – veľká molekulová odpoveď (major molecular response)
MR – molekulová odpoveď (molecular response)
OS – celkové prežitie (overal survival)
PCA – prídavné cytogenetické abnormality
Ph – chromozóm Philadelphia
TKI – inhibítor tyrozínovej kinázy
Práca je podporená: NS9949-3 IGA MZ ČR, MSM 6198959223 MŠMT ČR, MSM 6198959205 MŠMT ČR a LF_2010_004.
Doručeno do redakce: 8. 4. 2010
Přijato po recenzi: 2. 6. 2010
MUDr. Peter Rohoň
Hemato-onkologická klinika FN a LF UP v Olomouci
I. P. Pavlova 6
775 20 Olomouc
e-mail:peter.rohon@centrum.cz
Sources
1. Rohrbacher M, Hasford J. Epidemiology of chronic myeloid leukaemia. Best Practice & Research Clinical Haematology 2009; 22 : 295–302.
2. Baccarani M, Russo D, Rosti G, et al. Interferon-alfa for chronic myeloid leukemia. Semin Hematol 2003; 40 : 22-33.
3. Baccarani M, Cortes J, Pane F, et al. Chronic myeloid leukemia: an update of concepts and management recommendations of European Leukemia Net. J Clin Oncol 2009; 27 : 1-11.
4. Stone RM. Optimizing treatment of chronic myeloid leukemia: A rational approach. The Oncologist 2004; 9 : 259-270.
5. Hochhaus A, Druker B, Sawyers C, et al. Favorable long-term follow-up results over 6 years for response, survival, and safety with imatinib mesylate therapy in chronic-phase chronic myeloid leukemia after failure of interferon-alpha treatment. Blood 2008; 111 : 1039-1043.
6. Cross TJ, Bagot C, Portmann B, et al. Imatinib mesylate as a cause of acute liver failure. Am J Hematol 2006; 81 : 189–192.
7. Christophe BP, Reiffers VM, Mahon FX. Roots of Clinical Resistance to STI-571. Cancer 2001; 293 : 2163.
8. Rohoň P, Faber E, Naušová J, et al. Od monitorovania hladiny fúzneho génu Bcr/Abl u pacienta s chronickou myeloidnou leukémiou k odhaľovaniu rezistencie k imatinibu – kazuistika. Transfuze Hematol dnes 2007; 1 : 27-31.
9. Naušová J, Priwitzerová M, Jarošová M, et al. Chronická myeloidní leukémie – rezistence na imatinib mesylát (Glivec®) – přehled literatury a vlastní zkušenosti. Čas lék čes 2006; 145 : 377-382.
10. Faber E, Naušová J, Jarošová M, et al. Intermittent Dosage of Imatinib Mesylate in CML Patients with History of Significant Hematologic Toxicity after Standard Dosing. Leuk Lymphoma 2006; 47 : 1082–1090.
11. Baccarani M, Saglio G, Goldman J, et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European Leukemia Net Blood 2006; 108 : 1809-1820.
12. de Lavallade H, Apperley JF, Khorashad JS, et al. Imatinib for newly diagnosed patients with chronic myeloid leukemia: incidence of sustained responses in an intention-to-treat analysis JCO 2008; 20 : 3358-3363.
13. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Ass 1958; 53 : 457-481.
14. Palandri F, Iacobucci I, Martinelli G, et al. Long-Term Outcome of Complete Cytogenetic Responders After Imatinib 400 mg in Late Chronic Phase, Philadelphia-Positive Chronic Myeloid Leukemia: The GIMEMA Working Party on CML. JCO 2008; 26 : 106-111.
15. Marin D, Marktel S, Bua M, et al. Prognostic factors for patients with chronic myeloid leukemia in chronic phase treated with imatinib mesylate after failure of interferon alfa. Leukemia 2003; 17 : 1448-1453.
16. Holzerová M, Faber E, Veselovská J, et al. Imatinib mesylate efficacy in 72 previously treated Philadelphia-positive chronic myeloid leukemia patients with and without additional chromosomal changes: single centre results. Cancer Genetics and Cytogenetics 2009; 191 : 1-9.
17. Kantarjian HM, Talpaz M, O´Brien SG, et al. Suvival benefit with imatinib mesylate versus interferon-α-based regiment in newly diagnosed chronic-phase chronic myelogenous leukemia. Blood 2006; 108 : 1835-1840.
18. Deininger M, O’Brien SG, Guilhot F, et al. International randomized study of interferon vs STI571 (IRIS) 8-year follow up: sustained survival and low risk for progression or events in patients with newly diagnosed chronic myeloid leukemia in chronic phase (CML-CP) treated with imatinib. Blood 2009; 114 : 482, Abstract 1126.
19. Voglová J, Poznarová A, Chrobák L, et al. Imatinib mesylát (Glivec®) v léčbě chronické fáze chronické myeloidní leukémie. Vnitř Lék 2004; 50 : 21-29.
20. Faber E, Hluší A, Indrák K, et al. Imatinib mesylát (Glivec®) v léčbě nemocných s akcelerovanou fází a Ph pozitivní akutní lymfoblastické leukemie. Trans Hemat dnes 2003; 9 : 159-165.
21. Roy L, Guilhot J,Krahnke T, et al. Suvival advantage from imatinib compared with combination interferon-α plus cytarabine in chronic-phase chronic myelogenous leukemia: historical comparison between two phase 3 trials. Blood 2006; 108 : 1478-1484.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2010 Issue 4-
All articles in this issue
- Contemporary classification diagnostic and prognosis of primary monoclonal gammopathies (paraproteinemias)
- Treatment results of chronic myeloid leukemia patients in HOK Olomouc during 2000–2009: the prognostic significance of Sokalęs score and ELN criterions
-
Radioterapie u folikulárního lymfomu.
Stará historie v nové perspektivě? - Proteomic analysis of soluble proteins important in pediatric acute lymphoblastic leukemia
- Blood donation and iron stores – comparison of double erythrocytapheresis and whole blood donation
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Contemporary classification diagnostic and prognosis of primary monoclonal gammopathies (paraproteinemias)
- Blood donation and iron stores – comparison of double erythrocytapheresis and whole blood donation
-
Radioterapie u folikulárního lymfomu.
Stará historie v nové perspektivě? - Treatment results of chronic myeloid leukemia patients in HOK Olomouc during 2000–2009: the prognostic significance of Sokalęs score and ELN criterions
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career







