-
Medical journals
- Career
Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
Authors: M. Žídková; J. Voglová; P. Bělohlávková; F. Vrbacký
Authors‘ workplace: II. interní klinika- oddělení klinické hematologie, Fakultní nemocnice Hradec Králové a LF UK
Published in: Transfuze Hematol. dnes,16, 2010, No. 1, p. 42-46.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Myelodysplastický syndrom představuje heterogenní skupinu klonálních hematopoetických onemocnění. Pro optimální léčbu je důležitá správná klasifikace a určení prognózy. Na WHO klasifikaci založený prognostický skórovací systém slouží k přesnějšímu odhadu mediánu celkového přežití a progrese do akutní myeloidní leukemie nejen v době stanovení diagnózy, ale také v celém dalším průběhu onemocnění.
Klíčová slova:
myelodysplastický syndrom, klasifikaceÚvod
Myelodysplastický syndrom (MDS) je skupina heterogenních klonálních hematopoetických onemocnění, charakterizovaná postupným selháním kostní dřeně s neefektivní hematopoézou, morfologickou dysplazií a zvýšenou pravděpodobností vzniku akutní myeloidní leukemie (AML) (1, 2). MDS se dělí na primární, de novo vzniklý a sekundární, např. po léčbě cytostatiky. Incidence MDS narůstá s věkem. Jednotlivé jednotky se mezi sebou statisticky významně liší mediánem celkového přežití a pravděpodobností vývoje v akutní leukemii, proto správná klasifikace a určení prognózy je stěžejní ke zvolení optimálního terapeutického postupu.
Klasifikace MDS
Nejznámější a doposud mnohými lékaři stále používaná je FAB klasifikace (Francouzko-Americko-Britská) z roku 1982 viz tabulka 1.
Table 1. FAB klasifikace. 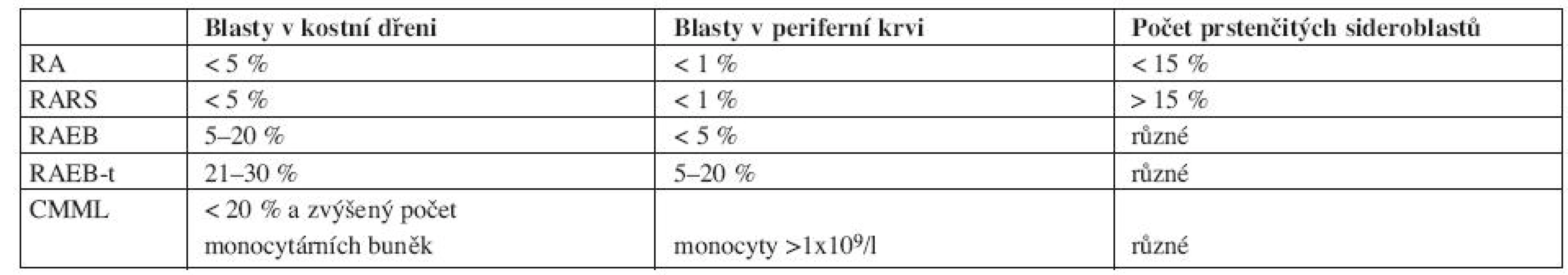
Vysvětlivky: RA- refrakterní anémie, RARS-refrakterní anémie s prstenčitými sideroblasty, RAEB-refrakterní anémie s nadbytkem blastů, RAEBt-refrakterní anémie s nadbytkem blastů v transformaci, CMML- chronická myelomonocytární leukemie. FAB klasifikace rozděluje MDS do pěti subtypů na základě procenta blastů v periferní krvi, kostní dřeni a procenta prstenčitých sideroblastů. Nevýhodou FAB klasifikace je, že i v rámci jednoho subtypu obsahuje heterogenní jednotky, které se od sebe statisticky významně liší mediánem celkového přežití a pravděpodobností vývoje do akutní leukemie. To je dáno zejména tím, že FAB klasifikace nerozlišuje počet jednotlivých dysplastických linií a uvnitř jednotlivých subtypů je široké rozmezí blastů, zejména pak ve skupině RAEB. Novější je klasifikace z roku 2002, tzv. WHO klasifikace (World Health Organization), viz tabulka 2.
Table 2. WHO klasifikace (Vardiman, 2002). 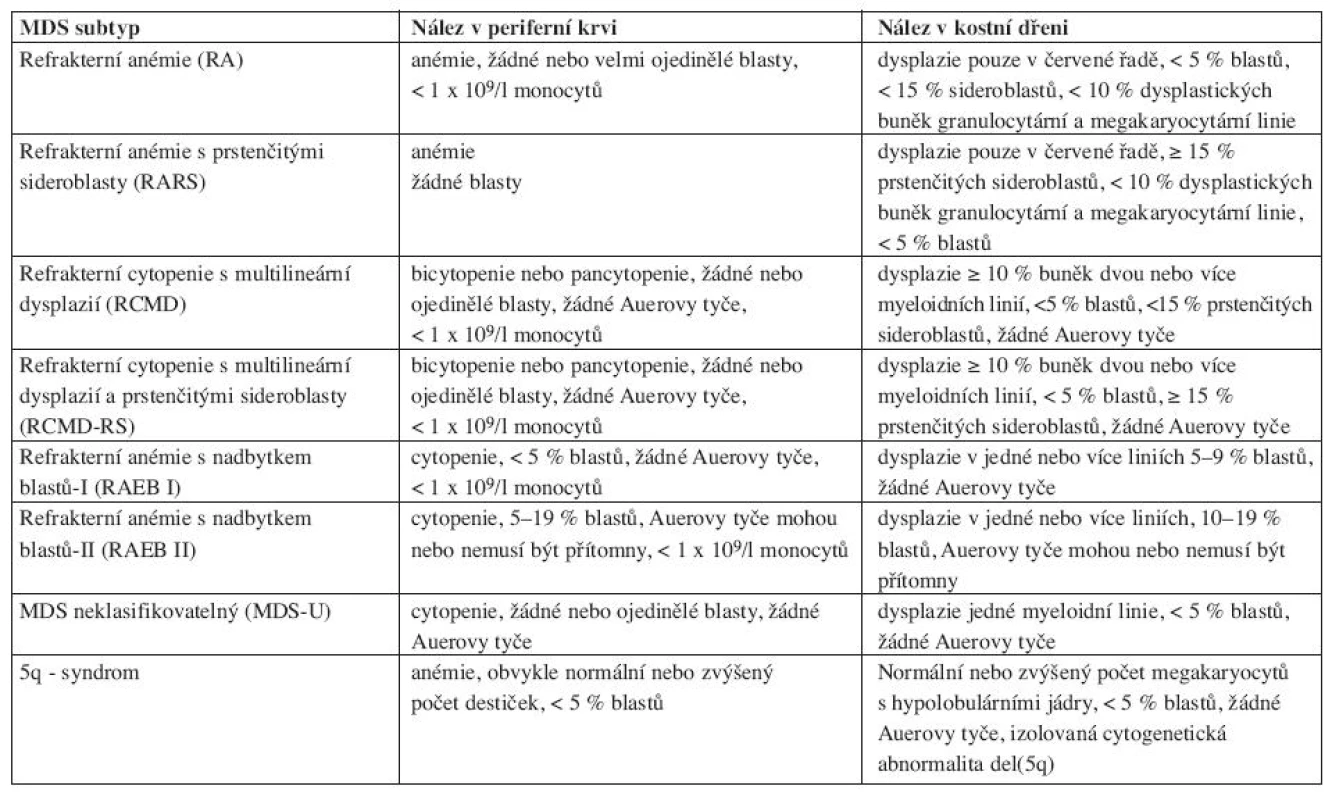
WHO klasifikace již rozlišuje dysplazie v jedné či více myeloidních řadách. Ve skupině onemocnění RAEB rozlišuje na základě procenta blastů v kostní dřeni typ RAEB I a RAEB II. WHO klasifikace MDS má nižší kritérium pro počet blastů v kostní dřeni, které již splňují podmínky pro vznik akutní myeloidní leukemie a to 20 % versus 30 % (dle FAB), proto vypouští jednotku RAEBt, která již dle WHO klasifikace splňuje kritéria pro akutní myeloidní leukemii. Dále je chronická myelomonocytární leukemie (CMML) nově zařazena mezi překryvné (overlap) myelodysplastické-myeloproliferativní stavy. CMML se dříve rozdělovala na myelodysplastický a myeloproliferativní podtyp, kdy hranicí byl počet leukocytů 13 x 109/l. Vzhledem k tomu, že nejdůležitějším prognostickým faktorem pro celkové přežití je považován počet blastů v kostní dřeni a periferní krvi, dělí se nyní CMML na CMML-1 s počtem blastů pod 5 % v periferní krvi a pod 10% v kostní dřeni a na CMML-2 s počtem blastů v periferní krvi 5–19 % a v kostní dřeni 10–19 %. Nově je ve WHO klasifikaci zařazen MDS neklasifikovatelný a tzv. 5q minus syndrom (5q-syndrom).
5q - syndrom
5q - syndrom je jediná podjednotka MDS charakterizovaná pomocí cytogenetiky a to izolovanou delecí dlouhého raménka chromozomu 5 v místě 5q31-q32. V kostní dřeni u 5q - syndromu je přítomno pod 5 % blastů, typická dysmegakaryopoéza s hypolobulárními jádry (viz obr. 1) a makrocytární anémie v periferní krvi.
Image 1. Hypolobulární megakaryocyt u 5q minus syndromu. 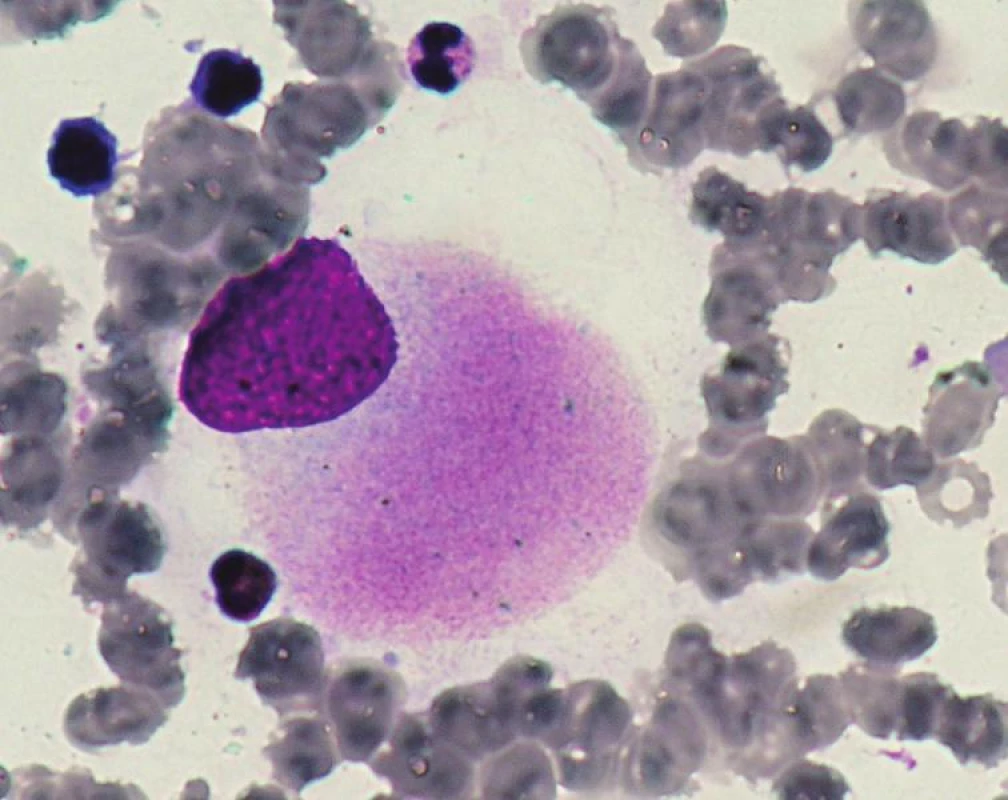
Pacienti mají velmi dobrou prognózu, medián přežití je 145 měsíců a jen 10 % progreduje do AML. Avšak často mívají závažnou makrocytární anémii, v jejíž léčbě se v poslední době uplatňuje lenalidomid (chorobu modifikující lék, používaný v terapii mnohočetného myelomu) (8, 17). V rámci 5q - syndromu byla provedena analýza deletovaného segmentu, bez nálezu mutovaného genu, a proto se předpokládá, že právě haploinsuficience některého genu v tomto úseku by mohla hrát roli. V tomto úseku se nacházejí mimo jiné dva kandidátní geny a to SPARC a RPS14. SPARC je tumor-supresor účastnící se regulace vazby buňky na extracelulární matrix, kterou negativně ovlivňuje. Zároveň však negativně ovlivňuje i buněčnou proliferaci, angiogenezi a působí proapoptoticky. Haploinsuficience genu SPARC tak může napomáhat zvýšené adhezi maligního klonu k podpůrným buňkám stromatu a usnadňovat proliferaci maligního klonu. Gen RPS14 kóduje jeden z proteinů malé podjednotky ribozomů, jehož haploinsuficience blokuje vyzrávání erytroidních prekurzorů. Společně se tyto změny mohou významně podílet na klinickém obrazu 5q - syndromu (4).
WHO klasifikace 2008
Nová WHO klasifikace MDS z roku 2008 již rozlišuje ve skupině refrakterních cytopenií jednotlivé dysplastické linie a vytváří tak novou jednotku – refrakterní cytopenie s dysplazií v jedné řadě, kam spadá refrakterní anémie, refrakterní neutropenie a refrakterní trombocytopenie (20). Pro tuto diagnózu je nutno 10 a více procent dysplastických buněk v jedné z myeloidních linií v kostní dřeni a cytopenie v jedné nebo dvou řadách (ale ne pancytopenie) v periferní krvi. Případy s refrakterní neutropenií a refrakterní trombocytopenií byly dle starší WHO klasifikace řazeny mezi MDS neklasifikovatelný. Ve skupině refrakterních anémií s nadbytkem blastů přítomnost Auerových tyčí dle WHO 2008 zařazuje jednotku do více pokročilé skupiny RAEBII bez ohledu na procento blastů v kostní dřeni či periferní krvi. Ve skupině refrakterní cytopenie s multilineární dysplazií se již dále nerozlišuje, zda jsou přítomny či chybí prstenčité sideroblasty. MDS neklasifikovatelný podle WHO 2008 zahrnuje pacienty s pancytopenií a dysplazií v jedné řadě. Pod MDS neklasifikovatelný patří i pacienti s dysplazií pod 10 % v jedné či více myeloidních řadách a cytogenetickým nálezem, který je považován za předpokládaný důkaz pro přítomnost MDS (tab. 3 (19, 20)). Dále 5q - syndrom je nově přejmenován na MDS s izolovanou delecí 5q (tab. 4 (7, 18)).
Table 3. Chromozomální abnormality považované za předpokládaný důkaz MDS za podmínek cytopenie a chybění dostatečných morfologických znaků pro diagnózu MDS. 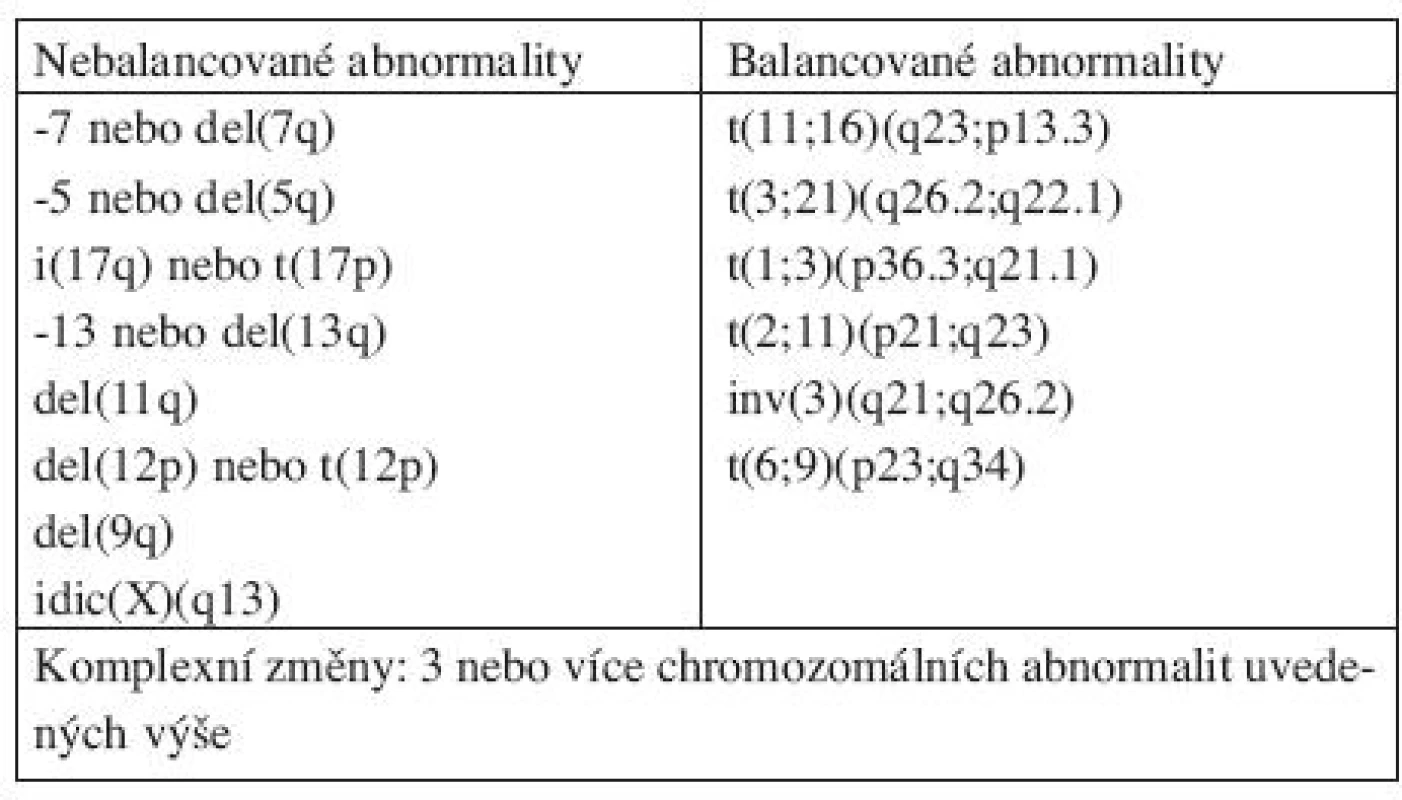
Table 4. WHO klasifikace 2008. 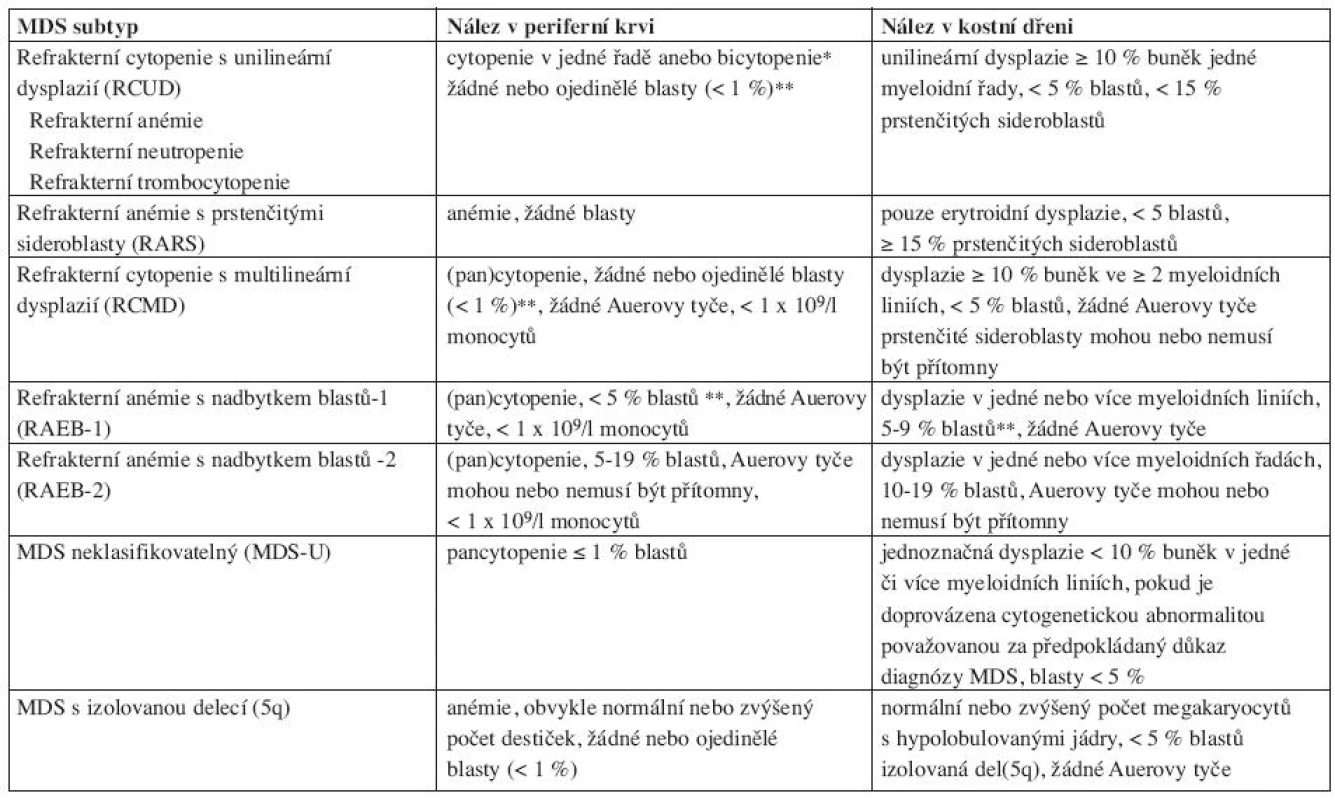
*bicytopenie může být příležitostně pozorována, případy s pancytopenií by se měly klasifikovat jako MDS-U. **jestliže jsou blasty ve dřeni pod 5 %, ale je přítomno 2–4 % blastů v periferní krvi, jde o RAEB-1. Jednotky RCUD a RCMD s 1% blastů v periferní krvi by se měly klasifikovat jako MDS-U. pokud je < 5 % blastů v periferní krvi a méně jak 10 % blastů ve dřeni a jsou přítomny Auerovy tyče, jednotka by se měla zařadit pod RAEB-2. Ačkoliv přítomnost 5–19 % blastů v periferní krvi odpovídá RAEB-2, případy RAEB-2 mohou mít < 5 % blastů v periferní krvi, pokud jsou přítomny Auerovy tyče anebo 10 %-19 % blastů ve dřeni. Podobně případy RAEB-2 mohou mít < 10 % blastů v kostní dřeni, jestliže je přítomno 5–19 % blastů v periferní krvi anebo Auerovy tyče. Ve skupině překryvných MDS/MPD syndromů v podjednotce refrakterní anémie s prstenčitými sideroblasty a významnou trombocytózou (RARST) snižuje WHO 2008 práh počtu trombocytů z 600 na 450x109 /l. U této jednotky byl také v přibližně 50 % případů zjištěn výskyt mutace V617F kinázy JAK2, což podtrhuje její částečný myeloproliferativní původ (7, 9–13). Rozdělení chronické myelomonocytární leukemie na CMML-1 a CMML-2 zůstává zachováno. Termín myeloproliferativní onemocnění byl nahrazen termínem myeloproliferativní neoplazie (19).
Určení prognózy, IPSS, WPSS
Pro správné určení rizika a zvolení optimální léčebné strategie je klíčový prognostický skórovací systém. V minulosti nepříliš rozšířené byly např. Bournemouth, Spanish, Düsseldorf nebo Lille skóre (5). Doposud používaným ,,zlatým standardem“ se stal až International Prognostic Scoring System (IPSS) z roku 1997 (6). IPSS vychází z FAB klasifikace a rozlišuje pacienty podle procenta blastů v kostní dřeni, počtu dysplastických linií a karyotypu do čtyř rizikových skupin, které se mezi sebou statisticky významně liší mediánem celkového přežití a vývoje v AML (tab. 5 a 6).
Table 5. IPSS (International Prognostic Scoring System). 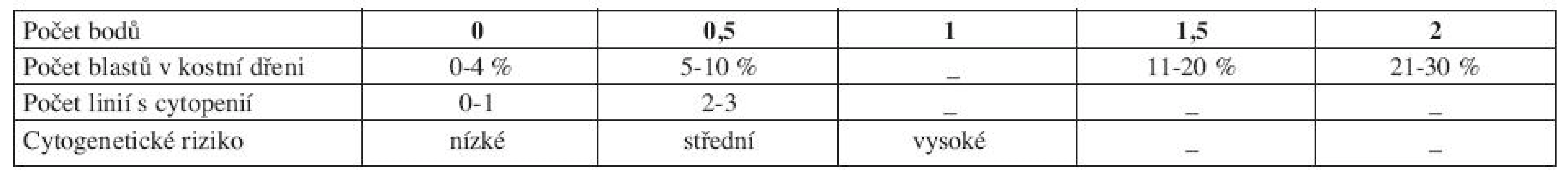
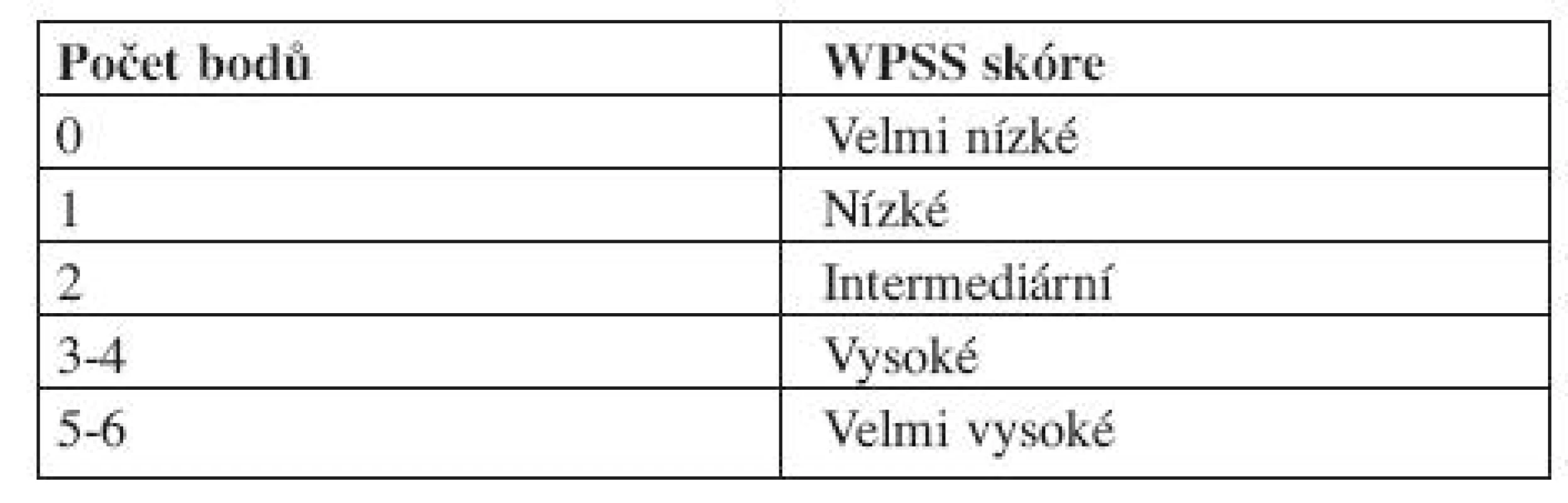
Vysvětlivky: Cytopenie: hemoglobin < 100 g/l; neutrofily < 1,8 x 109/l, trombocyty < 100 x 109/l Cytogenetické riziko: nízké - normální karyotyp, izolovaná delece chromozomuY, izolovaná del(5q), izolovaná del(20q) střední - abnormality jiné, než v ostatních kategoriích vysoké - komplexní změny (3 a více změn), abnormality chromozomu 7 Výpočet rizika dle IPSS - součet jednotlivých bodů ve třech položkách IPSS však hodnotí riziko a medián přežití pouze v čase stanovení diagnózy, nerespektuje progresi choroby, což mnohdy znesnadňuje rozhodování ohledně další léčebné strategie. IPSS je založen na FAB klasifikaci, což v současné době s platnou WHO klasifikací poněkud ztrácí na významu. Z toho důvodu vytvořil Luca Malcovati a spol. dynamický prognostický skórovací systém – tzv. WHO Classification Based Prognostic Scoring System, na WHO klasifikaci založený prognostický systém (WPSS). WPSS vychází z retrospektivní studie, která si kladla za cíl nalézt nejvýznamnější prognostické faktory pro MDS a to nejen v čase stanovení diagnózy, ale také v průběhu choroby a vytvořit tak dynamický skórovací systém k předpovědi rizika pro MDS v libovolném časovém bodě (3). Ve studii byly zahrnuty dvě kohorty pacientů, italská skupina de novo diagnostikovaných MDS pacientů (426 pacientů), na které byly rizikové faktory stanoveny a německá validační skupina 739 de novo diagnostikovaných MDS pacientů, na které byly rizikové faktory validovány. Diagnóza MDS byla překlasifikována dle WHO klasifikace z roku 2002. Data se sbírala nejen v době stanovení diagnózy, ale u určitého počtu pacientů také opakovaně v průběhu onemocnění. Na základě opakovaných odběrů dat se WPSS riziko v čase měnilo v 55 % případů pro změnu ve WHO klasifikaci, v 11 % pro změnu cytogenetického rizika a v 30 % pro závislost na krevních transfuzích (3). Tato retrospektivní analýza, uveřejněná v roce 2007, označila, že mezi nejvýznamnější rizikové faktory patří WHO klasifikace, karyotyp a počet transfuzí erytrocytů (tab. 7 a 8 (3)).
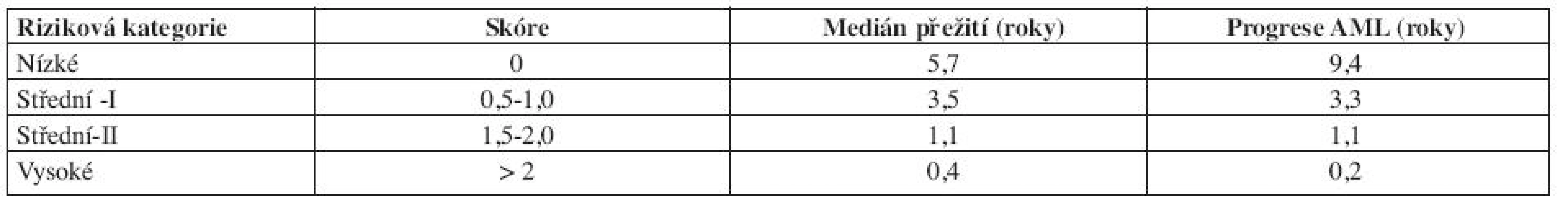
Table 7. WHO Classification-Based Prognostic Scoring System, WPSS. 
Vysvětlivky: Cytogenetické riziko: nízké - normální karyoryp, izolovaná delece chromozomuY, izolovaná del(5q), izolovaná del(20q) střední - abnormality jiné, než v ostatních kategoriích vysoké - komplexní změny (3 a více změn), abnormality chromozomu 7 Potřeba transfuzí: alespoň jedna transfuze erytrocytů každých 8 týdnů v průběhu 4 měsíců. Výpočet rizika dle WPSS- součet jednotlivých bodů všech tří položek. Počet transfuzí odráží závažnější stupeň anémie a tím i agresivnější průběh choroby, statisticky významně snižuje celkové přežití a zvyšuje riziko vývoje v akutní leukemii (16). V průběhu onemocnění se však projevuje nežádoucí efekt přetížení železem. Nejpodstatněji je potřeba transfuzí jako negativní rizikový faktor vyjádřena u nízkého rizika (3). Dle WPSS skóre jsou pacienti rozděleni do pěti prognostických skupin (tab. 9). Obě skupiny pacientů (italská a německá) se mezi sebou statisticky významně nelišily. WPSS je tak dynamický skórovací systém, který umožňuje odhadnout riziko nejen v době stanovení diagnózy, ale také v průběhu choroby. Pacienti zůstávají v určitém riziku tak dlouho, jak dlouho je jejich onemocnění stabilní. Pokud dojde k progresi choroby a splní kritéria pro rizikovější skupinu, přesunou se do této skupiny a medián přežití i pravděpodobnost vývoje v AML odpovídá nově určenému riziku (3, 14). Dále bylo zjištěno, že u pacientů s velmi nízkým rizikem, se délka celkového přežití statisticky významně neliší od běžné populace, proto tito pacienti profitují z odložení terapie do doby, než splní kritéria přeřazení do více rizikové skupiny (3).
Table 9. Medián celkového přežití a pravděpodobnost progrese do AML dle WPSS. 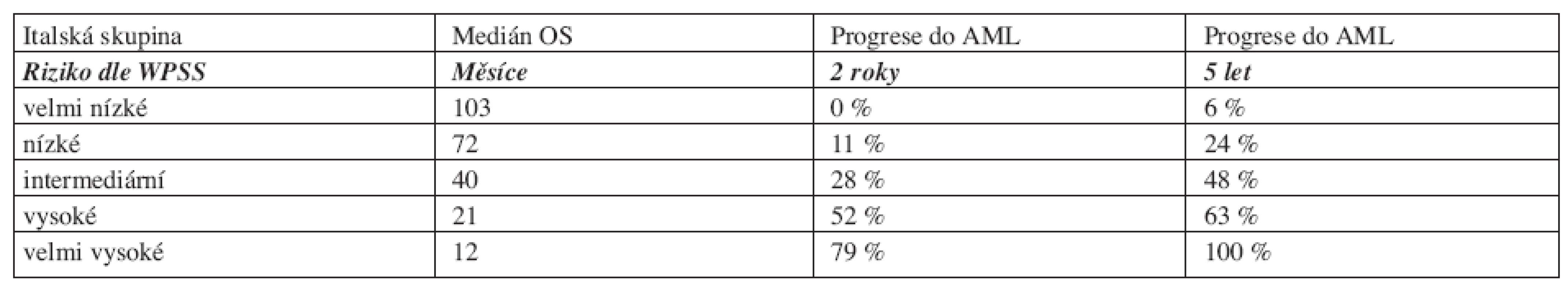
Závěr
V součastné době by měl být MDS syndrom zařazený dle WHO klasifikace a zhodnocena příslušná riziková skupina. Jen tak lze správně zvolit optimální léčebnou strategii. WPSS přestavuje dynamický skórovací systém, sloužící k přesnějšímu odhadu rizika a zvolení léčebného postupu (3, 15).
MUDr. Marie Žídková
Oddělení klinické hematologie
Fakultní nemocnice v Hradci Králové
Sokolská 581
500 05 Hradec Králové
e-mail: marie.zidkova@post.cz
Sources
1. Malcovati L, Nimer S. Myelodysplastic syndromes: diagnosis and staging. C Cont 2008; 15 : 4–13.
2. Mufti GJ, Bennet JM, Goasguen J, et al. Diagnosis and classification of myelodysplastic syndrome: International Working Group on Morphology of myelodysplastic syndrome (IWGM-MDS) consensus proposals for the definition and enumeration of myeloblasts and ring sideroblasts. Haematol 2008; 93 : 1712–1717.
3. Malcovati L, Germing U, Kuendgen A, et al. Time-dependent prognostic scoring system for predicting survival and leukemic evolution in myelodysplastic syndromes. J Clin Oncol 2007; 25 : 3503–3510.
4. Jädersten M, Hellström-Lindberg E. Myelodysplastic syndromes: biology and treatment. J Int Med 2008; 265 : 307–322.
5. Muller-Berndorf H, Hass PS, Kunzmann R, et al. Comparison of five prognostic scoring systems, the FAB and WHO classifications in patients with myelodysplastic syndromes: results of a single-center analysis. Ann Hematol 2006; 85 : 502–513.
6. Greenberg P, Cox C, LeBeau M, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89 : 2079–2088.
7. Hellström-Lindberg E, Cazzola M. The role of JAK2 mutations in RARS and other MDS. Hematology Am Soc Hematol Educ Program 2008 : 52–59.
8. Mufti GJ, Chen TL. Changing the treatment paradigm in myelodysplastic syndromes. C Cont 2008; 15(Suppl. 4): 14–27.
9. Szpurka H,Tiu R, Murugesan G, et al. Refractory anemia with ringed sideroblasts associated with marked thrombocytosis (RARS-T), another myeloproliferative condition characterized by JAK2 V617F mutation. Blood 2006; 108 : 2173–2181.
10. Schmitt-Graeff A, Teo SS, Olschewski M, et al. Jak2 V617F mutation status identifies subtypes of refractory anemia with ringed sideroblasts associated with marked thrombocytosis. Haematol 2008; 93 : 34–40.
11. Malcovati L, Cazzola M. Myelodysplastic/myeloproliferative disorders. Haematol 2008; 9 : 4–6.
12. Remacha AF, Nomdedeu JF, Puget G, et al. Occurrence of the JAK2 V617F mutation in the WHO provisional entity: myelodysplastic/myeloproliferative disease, unclassifiable–refractory anemia with ringed sideroblasts associated with marked thrombocytosis. Haematol 2006; 91 : 719–720.
13. Steensma DP, Caudill JSC, Pardanani A, et al. MPL W515 and JAK2 V617 mutation analysis in patients with refractory anemia with ringed sideroblasts and an elevated platelet count. Haematol 2006; 91 : 155–156.
14. Breccia M, Cannella L, Stefanizzi C, et al. WPSS versus simplified myelodysplastic syndrome risk score: Which is the best tool for prediction of survival in myelodysplastic patients? Leukemia Res 2008; 33 : 93–94.
15. Alessandrino EP, Della Porta MG, Bacigalupo A, et al. WHO classification and WPSS predict post-transplant outcome in patients with myelodysplastic syndrome: a study from the Gruppo Italiano Trapianto di Midollo Osseo (GITMO). Blood 2008; 112 : 895–902.
16. Malcovati L, Della Porta MG, Cazzola M. Predicting survival and leukemic evolution in patients with myelodysplastic syndrome. Haematol 2006; 91 : 1588–1590.
17. Nimer SD. Myelodysplastic syndromes. Blood 2008; 111 : 4841–4851.
18. Brunning RD, Orazi A, Germing U, et al. Myelodysplastic syndromes. In: Swerdlow SH, Campo E, Harris NL, et al.WHO classification of tumours of haematopoietic and lymphoid tissues. 4th edition. Lyon, IARC, 2008; 87–103.
19. Bennett JM. Myelodysplastic syndromes: update on classification. Leukemia Res 2009; 3: S6–S8.
20. Vardiman JW, Thiele J, Arber DA, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood 2009; 114 : 937–951.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2010 Issue 1-
All articles in this issue
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Analýza absolutního počtu lymfocytů a dalších faktorů ovlivňujících přežívání pacientů s Hodgkinovým lymfomem po autologní transplantaci periferních kmenových buněk
- Koncentrace hepatocytárního růstového faktoru a trombospondinu predikuje léčebnou odpověď u pacientů s mnohočetným myelomem
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Analýza mutací BCR-ABL u CML pacientů rezistentních k imatinibu umožňuje poskytnout „terapii šitou na míru“
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career