-
Medical journals
- Career
Vrozené polycytemie
Authors: J. Kučerová 1; M. Horváthová 1; D. Pospíšilová 2; V. Divoký 1,3
Authors‘ workplace: Ústav biologie LF UP v Olomouci, 2Dětská klinika LF UP a FN v Olomouci, 3HOK FN v Olomouci 1
Published in: Transfuze Hematol. dnes,15, 2009, No. 4, p. 216-222.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Polycytemie (ve smyslu absolutní erytrocytózy) je stav charakterizovaný zvýšeným množstvím erytrocytární masy, doprovázený nárůstem hematokritu, počtu červených krvinek a zvýšenou koncentrací hemoglobinu. Příčinou polycytemií může být zvýšená proliferace nebo snížená apoptóza erytroidních progenitorů, případně zpožděná erytroidní diferenciace. U vrozených primárních polycytemií se tak děje na základě vrozeného defektu hematopoetického progenitoru v signálních drahách účastnících se odpovědi na hypoxii nebo na hormon erytropoetin. U vrozených sekundárních polycytemií, vznikajících v důsledku přítomnosti zvýšených hladin faktorů stimulujících erytropoézu, je nejčastější příčinou mutace způsobující vysokou afinitu hemoglobinu ke kyslíku. Pro diferenciální diagnostiku polycytemií jsou důležitá biochemická, buněčná a molekulárně-biologická vyšetření, z nich některá provádíme i v naší laboratoři na LF UP a FN Olomouc, kde má studium vrozených polycytemií dlouholetou tradici. Přispěli jsme k identifikaci několika nových polycytemických mutací a tvorbou myšího modelu familiární polycytemie s dominantní dědičností pak k pochopení molekulární patofyziologie tohoto onemocnění. Identifikace příčinných mutací umožňuje zlepšení a zpřesnění diagnostiky polycytemických stavů a může v nemalé míře přispět i k rozvoji nových terapeutických přístupů.
Klíčová slova:
vrozená polycytemie, HIF dráha, EPOR dráha, hypersenzitivita na erytropoetinPolycytemie nebo erytrocytóza je stav vyznačující se zvýšeným hematokritem. Vysoký hematokrit může být důsledek zvýšeného množství erytrocytární masy (tzv. absolutní erytrocytóza) s nárůstem počtu červených krvinek a zvýšenou koncentrací hemoglobinu. Důležité je odlišit absolutní erytrocytózu od relativní neboli nepravé erytrocytózy, zapříčiněné výrazným snížením objemu plazmy například při dehydrataci či stresu (1).
Příčinou polycytemie může být zvýšená proliferace nebo snížená apoptóza erytroidních progenitorů, případně zpožděná erytroidní diferenciace se zvýšeným počtem buněčných dělení na úrovni erytroidního progenitoru (2).
Pro pochopení patologických stavů erytropoézy, mezi které patří i polycytemie, je nezbytné porozumět fyziologické regulaci erytropoézy, která bude předmětem následující kapitoly.
1. Erytropoéza
Erytropoéza je proces tvorby a diferenciace pluripotentních hematopoetických kmenových buněk ve funkční erytrocyty. Probíhá přes několik progenitorových stadií: multipotentní progenitor společný pro lymfoidní i myeloidní buňky (MPP; multipotent progenitor), společný myeloidní progenitor (CFU-GEMM; colony-forming unit granulocytic, erythroid, megakaryocyte, macrophage), časný erytroidní progenitor (BFU-E; burst-forming unit-erytroid), pozdní erytroidní progenitor (CFU-E; colony forming unit-erythroid) a dále přes prekurzorová stadia: proerytroblast a několik stadií erytroblastů. Ortochromatický erytroblast ztrácí jádro a mění se v retikulocyt, který dozrává v erytrocyt.
Primární funkcí zralých erytrocytů je transport kyslíku. Molekulou odpovědnou za transport kyslíku je hemoglobin, který tvoří až 30 % procent celkového obsahu erytrocytu. Hemoglobin se vyskytuje ve formě tetrameru; je složen ze čtyř bílkovinných řetězců – globinů a čtyř prostetických skupin – hemů. Hemová skupina obklopená podjednotkou globinu umožňuje reverzibilní vazbu kyslíku v místě s vysokým parciálním tlakem a jeho uvolňování do tkání, kde je parciální tlak nízký. Pro fungování tohoto systému je nezbytné, aby se afinita hemoglobinu ke kyslíků snížila v tkáních, což je zprostředkováno pomocí 2,3-bisfosfoglycerátu (2,3-BPG) (3). 2,3-BPG je tedy jeden z faktorů, které ovlivňují afinitu hemoglobinu ke kyslíku, váže se k molekule hemoglobinu částečně zbavené kyslíku a urychluje tak jeho kompletní uvolnění. Množství 2,3-BPG v buňce je srovnatelné s počtem molekul hemoglobinu a vzniká přesmykem z 1,3-bisfosfoglycerátu pomocí enzymu bisfosfoglycerát mutázy.
1.1 Regulace erytropoézy
Erytropoéza je ve svém průběhu regulována různými růstovými faktory, z nichž některé jsou přímo závislé na hypoxii. V časných fázích erytropoézy hraje důležitou úlohu SCF (stem cell factor), od BFU-E stadia zůstává primárním růstovým faktorem ovlivňujícím proliferaci a přežívání glykoproteinový hormon erytropoetin (EPO). U dospělých je produkován primárně v ledvinové kůře. Dalším zdrojem aktivním hlavně ve fetálním období jsou játra; EPO mohou v menší míře produkovat také erytroidní progenitory nebo některé další tkáně (4, 5). U novorozenců klesají sérové koncentrace EPO až 10x, což se podílí na vzniku přechodné, fyziologické anémie novorozenců (6, 7). Cirkulující EPO působí na růst, diferenciaci a přežívání hematopoetických progenitorů v kostní dřeni a slezině a mimo hematopoézu slouží jako ochrana před účinky hypoxie například v mozku a srdci (8, 9).
Exprese EPO je přísně regulována množstvím kyslíku v produkujících buňkách. Hlavním senzorem této dráhy je protein HIF (hypoxia-inducible factor). Tento heterodimer se skládá ze dvou podjednotek, degradovatelné alfa-podjednotky HIF-α (1α, 2α nebo 3α) a stabilní beta-podjednotky (ARNT; aryl hydrocarbon receptor nuclear translocator) (10). Aktivní dimery se vytváří pouze za hypoxických podmínek. HIF-1α a HIF-2α fungují jako transkripční faktory, které po translokaci z cytoplazmy do jádra pozitivně regulují expresi EPO, ale i dalších genů účastnících se odpovědi na hypoxii. Narozdíl od HIF-1α, který zvyšuje expresi EPO v ledvinách, HIF-2α reguluje hladiny jaterního EPO (11). Za normálního obsahu kyslíku v buňce (kolem 20 %) je HIF-α podjednotka hydroxylována některou z dioxygenáz patřících do rodiny PHD (prolyl hydroxylase domain; PHD1, PHD2 a PHD3), které hydroxylují prolinové zbytky. Zdá se, že klíčový pro hydroxylaci HIF-1α a HIF-2α je PHD2. Hydroxylace umožňuje rozpoznání HIF-α podjednotky proteinem VHL (von Hippel-Lindau), který se podílí na iniciaci degradace HIF-α v proteazomu. Jak již bylo zmíněno, za hypoxických podmínek HIF-α není degradován a může společně s ARNT v jádře pozitivně regulovat transkripci EPO a dalších genů (obr. 1). Při narušení přísně regulované degradace HIF-α dochází k excesivní expresi EPO a následné erytrocytóze (12); popsány byly i kardiopulmonální komplikace jako je například plicní hypertenze, vznikající i při chronické hypoxii (13).
Image 1. Schéma regulace aktivity HIF-1α podjednotky za rozdílné koncentrace kyslíku v buňce. Za normoxie je HIF-1α hydroxylován hydroxylázou PHD2 a označen pomocí VHL k degradaci. Za hypoxických podmínek dimerizuje HIF-1 α s ARNT a spouští expresi cílových genů. 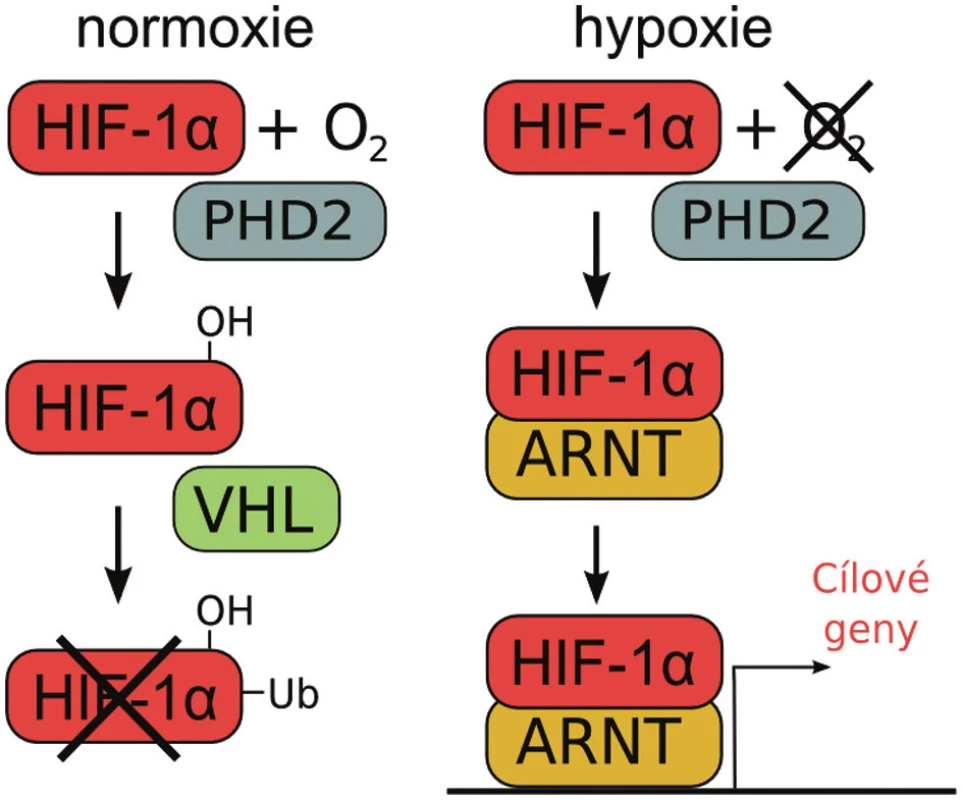
EPO spouští v buňkách vnitrobuněčnou kaskádu přes erytropoetinový receptor (EPOR; obr. 2). Tento člen rodiny tzv. cytokinových receptorů se vyskytuje ve formě dimeru a každý řetězec je asociován s tyrozinovou kinázou JAK2 (Janus kinase 2). V neaktivním stavu jsou od sebe cytoplazmatické konce receptoru s kinázou vzdálené a katalytické místo JAK2 je blokované její pseudokinázovou doménou. Při vazbě EPO dochází k přiblížení a aktivaci JAK2 kináz. Tyto následně fosforylují sebe a klíčová tyrozinová místa v cytoplazmatické doméně EPOR, která tvoří vazebná místa pro transkripční faktory a adaptorové molekuly. JAK2 přímo fosforyluje STAT1 (signal transducer and activator of transcription). Další členové rodiny, proteiny STAT3 a STAT5, jsou fosforylovány po vazbě na receptor. Tyto STAT transkripční faktory poté dimerizují a indukují v jádře transkripci genů zodpovědných za proliferaci a diferenciaci. STAT5 má také výraznou antiapoptotickou funkci, spouští expresi antiapoptotického proteinu BCL-XL (B-cell lymphoma-extra large) (14). Na fosforylaci STAT5 se podílí také kináza LYN (15). Dalšími dráhami aktivovanými přes vazbu na cytoplazmatickou doménu EPOR jsou PI3K (phosphoinositide 3-kinase)/AKT signální dráha, která blokuje apoptózu a RAS/MAPK (mitogen-activated protein kinase) dráha, podporující buněčnou proliferaci.
Image 2. Klíčové molekuly v pozitivní (+) a negativní (-) regulaci EPOR dráhy. Y znázorňuje tyrozinové zbytky. Přerušovaná čára naznačuje zkrácení receptoru u mutací způsobujících PFCP. Bližší popis v textu. 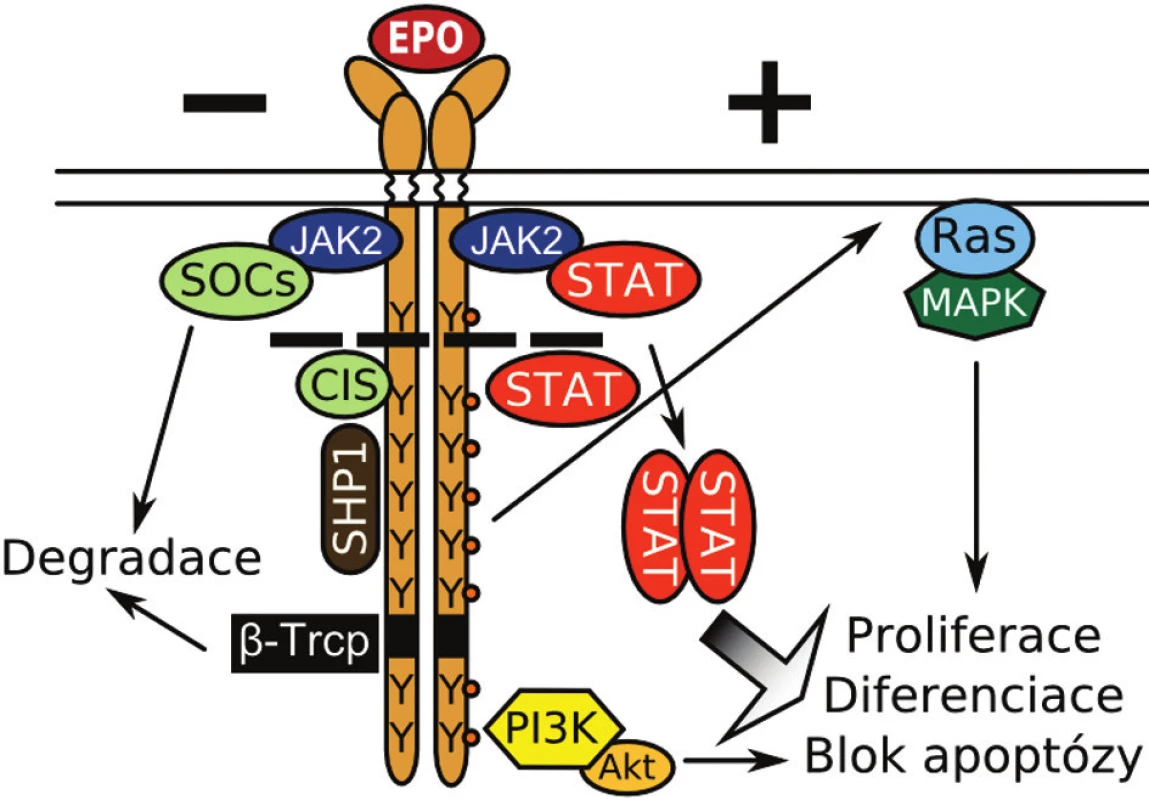
EPOR signalizace je negativně regulována celou řadou proteinů, z nichž některé se také váží na fosforylované tyroziny EPOR. Hlavním cílem je zde JAK2 kináza a jednotlivé molekuly STAT a PI3K dráhy. Skupina proteinů rodiny SOCS (suppressor of cytokine signaling) buď blokuje aktivní místo JAK2 kinázy (proteiny SOCS-1 a 3), nebo soupeří o vazebná místa se STAT5 (protein CIS; cytokine-inducible SH2 domain-containing protein). SOCS-3 je aktivním inhibitorem pouze po vazbě na fosforylované tyroziny EPOR. Asociované proteiny jsou pak spolu se SOCS degradovány v proteazomu. Exprese proteinů rodiny SOCS je spouštěna aktivními STAT dimery, tvoří tedy zpětnovazebnou smyčku s pozdějším nástupem (16). Proteinem zajišťujícím rychlou zpětnovazebnou inhibici je fosfatáza SHP-1 (SH2 domain-containing protein phosphatase-1), která po aktivaci vazbou na tyroziny defosforyluje a deaktivuje JAK2. Dimerizace STAT a jejich vazba na DNA je inhibována proteiny PIAS (protein inhibitor of activated STATs), které jsou konstitutivně exprimované a slouží jako titr množství aktivního STAT (17). Mezi negativní regulátory všech tří hlavních drah patří i adaptorový protein LNK (8).
Cytoplazmatická doména EPOR je nakonec rozpoznána proteinem β-TRCP (β-transducin repeat containing protein) a označena ubiquitinem pro proteazomovou degradaci (obr. 2). Následnou internalizací zbývající části receptoru a degradací v lysozomu končí EPO/EPOR signalizace (19).
2. Klasifikace polycytemií
Polycytemie můžeme obecně rozdělit na primární nebo sekundární.
Primární polycytemie jsou způsobené mutacemi v hematopoetickém progenitoru, které způsobují, že erytroidní progenitory neodpovídají nebo odpovídají neadekvátně na vnější regulaci. Pro primární polycytemie je charakteristická snížená hladina sérového EPO a zvýšená citlivost erytroidních progenitorů na růstové faktory in vitro.
Sekundární polycytemie vznikají v důsledku zvýšení hladin faktorů stimulujících erytropoézu, ke kterému dochází ať už jejich nadprodukcí nebo na podkladu tkáňové hypoxie. Hematopoetické progenitory nejsou in vitro hypersenzitivní na růstové faktory. Hladina EPO v séru bývá zvýšená, případně normální.
U některých familiárních onemocnění, jako je například polycytemie Čuvašů, se mohou vyskytovat rysy jak primární, tak sekundární polycytemie – sérová hladina EPO je zvýšená, ale progenitory přesto vykazují hypersenzitivitu in vitro (20).
3. Molekulárně-genetická podstata vrozených polycytemií
Abnormality vedoucí k polycytemiím mohou být vrozené nebo získané. Diskutovány budou pouze polycytemie vrozené, které se manifestují v raném věku a jsou poměrně vzácné. Jejich příčinou jsou mutace v genech kódujících proteiny klíčových drah erytropoézy nebo mutace ovlivňující udržování kyslíku v hemoglobinové molekule.
3.1 Mutace EPOR dráhy
První příčinou primární familiární a kongenitální polycytemie (PFCP) definovanou na molekulární úrovni byly mutace EPOR genu (21, 22). Tyto mutace zůstávají i nadále hlavní příčinou primárních familiárních erytrocytóz charakterizovaných sníženou hladinou EPO. Zatím bylo popsáno 13 mutací, které způsobují zkrácení distální části cytoplazmatické domény EPOR (23–25) a tím ztrátu tyrozinových míst. V důsledku této ztráty je znemožněna vazba fosfatázy SHP-1, případně dalších negativních regulátorů na EPOR (obr. 2). Nedochází proto k vypnutí EPOR dráhy, což způsobuje zvýšenou stimulaci erytroidních progenitorů a rozvoj erytrocytózy. Erytroidní progenitory ze zkráceným EPOR jsou in vitro hypersenzitivní k EPO (26, 27). Mutace se dědí autozomálně dominantně a erytrocytózám s touto příčinou patří v databázi OMIM označení ECYT-1 (28).
3.2 Mutace HIF dráhy
Mutace proteinů působících v HIF dráze způsobují chybnou detekci množství využitelného kyslíku v buňkách. Hladina HIF transkripčního faktoru je abnormálně zvýšena, což vede mimo jiné k nadprodukci EPO a k rozvoji erytocytózy. Vysoká, resp. neadekvátní hladina EPO (ve srovnání se zvýšeným množstvím hemoglobinu), je jedním z rysů sekundární polycytemie. Zvýšená citlivost erytroidních progenitorů na růstové faktory in vitro, jako základní charakteristika primárních polycytemií, byla ukázána pouze u VHL mutací (20) a HIF-2α mutací (J. Prchal, Salt Lake City, USA, ústní sdělení). U pacientů s mutací PHD2 takové vyšetření zatím chybí.
První a nejčastěji identifikovanou mutací v HIF dráze je VHL R200W nalezená u skupiny Čuvašského obyvatelstva v Rusku a výsledná porucha je nazvána podle ní jako Čuvašská polycytemie (29). Defektní protein VHL nerozpoznává hydroxylovaný HIF a nespouští tak jeho degradaci. Stejná mutace byla poté nalezena i mimo Čuvašský region na italském ostrově Ischia a sporadicky po celém světě (20, 30). Dodnes bylo publikováno 6 mutací VHL genu, jejichž dědičnost je autozomálně recesivní. Postižení jsou tedy buď homozygoti, nebo složení heterozygoti, kteří vykazují vyšší riziko trombózy, plicní hypertenze a kardiovaskulárních příhod (20, 31, 32). Tyto mutace jsou odlišné od VHL mutací odpovědných za dědičný VHL syndrom (9), který je asociován se zvýšeným rizikem tvorby různých nádorů. Zvýšená incidence nádorů nebyla u pacientů s polycytemickými VHL mutacemi prokázána.
Teprve nedávno byly popsány také mutace v dalších dvou proteinech HIF dráhy. U PHD2, bylo nalezeno 5 mutací v oblasti katalytické domény, odpovědné za hydroxylaci HIF-2α (33-35). Další čtyři mutace byly nalezeny v samotném HIF-2α (12, 36, 37). Tyto mutace korelovaly s neadekvátně normální hladinou EPO, ve srovnání se zvýšeným množstvím hemoglobinu u těchto pacientů. PHD2 s mutací v katalytické doméně není schopen hydroxylovat HIF. Stejný důsledek má mutace HIF-2α ve vazebném místě pro PHD2. HIF-2α pak není degradován a může aktivovat transkripci cílových genů i za normálního množství kyslíku v buňce. Dědičnost PHD2 a HIF-2α mutací je autozomálně dominantní a společně s VHL mutacemi zaujímají 3 kategorie familiárních erytrocytóz v databázi OMIM (ECYT2-4)(28).
Nově byl popsán případ pacienta s familiární erytrocytózou a opakovaným výskytem paragangliomu. Jako příčina erytrocytózy byla nalezena nová heterozygotní mutace v PHD2. Vznik nádoru byl asociován se ztrátou druhé normální alely PHD2 (ztráta heterozygozity). Tento objev naznačuje, že PHD2 funguje i jako tumorový supresor. Je proto pravděpodobné, že i další pacienti s jinými PHD2 mutacemi mají zvýšené riziko vzniku paragangliomu, a je proto důležité tyto pacienty detailně sledovat (38).
3.3 Mutace způsobující vysokou afinitu hemoglobinu ke kyslíku
Jednou z příčin sekundární polycytemie je tkáňová hypoxie při nedostatečném zásobení kyslíkem. Dochází proto ke zvýšení hladiny EPO s následným rozvojem kompenzační erytrocytózy, která je adekvátní odpovědí na situaci v organismu.
Nejčastější dědičnou příčinou jsou některé z abnormálních hemoglobinů vyznačující se zvýšenou afinitou ke kyslíku. Hemoglobin s vysokou afinitou ke kyslíku obsahuje mutaci v α - nebo β-globinovém řetězci, která ovlivňuje oscilaci hemoglobinu mezi dvěma alosterickými konformacemi; relaxovanou – plně okysličenou a tenzní – plně odkysličenou. Tyto mutace mají dominantní dědičnost, protože již jeden defektní globinový řetězec ovlivní konformaci celé molekuly hemoglobinu a afinitu ke kyslíku. Hemoglobinem asociovaným s erytrocytózou a detekovaným v České republice je Hb Olomouc (39).
Změna afinity hemoglobinu ke kyslíku může být i důsledkem mutací v genu pro bisfosfoglycerát mutázu. 2,3-BPG je nezbytný pro kompletní uvolnění kyslíku z hemoglobinu. Tyto homozygotní nebo složené heterozygotní mutace, vykazující recesivní dědičnost, negativně ovlivňují množství 2,3-BPG potřebného ke stabilizaci nízko-afinitiního stavu hemoglobinu v tkáních (40, 41).
Indikátorem zvýšené afinity hemoglobinu ke kyslíku je posunutí disociační křivky hemoglobinu ke kyslíku doleva, což je i základním diagnostickým testem těchto poruch.
3.4 Neznámá etiologie
Velká část vrozených erytrocytóz má stále neznámou etiologii. Předpokládá se, že příčinou by mohly být další mutace ve výše popsaných dráhách. Jedličková a kol. (42) objevili v jedné polycytemické rodině nový kandidátní lokus pro PFCP na chromozomu 7. Zkoumají se také vlivy dalších negativních regulátorů EPOR dráhy, jako je například LNK (18).
Stabilita HIF-2α je kromě hydroxylace na prolinech negativně ovlivňována dalšími postranslačními modifikacemi, jejichž nepřítomnost by mohla být také příčinou erytrocytóz se zatím neznámou etiologií. Svou roli může hrát i asparagyl hydroxyláza FIH (factor inhibiting HIF), která inaktivuje dimer HIF-2α/ARNT (43).
4. Diagnostické testy
Standardní vyšetření krevního obrazu bývá u pacientů s podezřením na erytrocytózu ještě doplněno vyšetřením hladiny sérového erytropoetinu a stanovením disociační křivky hemoglobinu nebo PO2-50 (parciální tlak kyslíku při kterém je hemoglobin saturován z 50 %). Hodnotu PO2-50 je možné jednoduše vypočítat i z hodnot krevních plynů pomocí excelovského souboru, který byl publikován Argawalem a kol. (44). K potvrzení hemoglobinopatie může sloužit elektroforéza hemoglobinu nebo vysokotlaká kapalinová chromatografie (HPLC). Důležitým faktorem pro určení diagnózy jsou i další speciální diagnostické testy prováděné i v naší laboratoři. Rozhodující je přitom odlišit primární polycytemii (vrozenou nebo získanou, pravou polycytemii) od sekundární, příp. nepravé (relativní) polycytemie.
4.1 Test hypersenzitivity erytroidních progenitorů in vitro
Ke stanovení in vitro citlivosti erytroidních progenitorů na EPO slouží test klonální proliferace erytroidních progenitorů, při kterém jsou tyto progenitory kultivovány ve stoupající koncentrační řadě EPO. Mononukleární progenitorové buňky z periferní krve nebo kostní dřeně diferencují v polotekutém médiu obsahujícím metylcelulózu, sérum, růstové faktory a další aditiva. Viskozita metylcelulózy zajišťuje, že vzniklé kolonie představují potomstvo jedné progenitorové buňky (BFU-E nebo CFU-E) (obr. 3). Kolonie narostlé v médiu bez přídavku EPO označujeme jako endogenní erytroidní kolonie (EEC). U zdravých jedinců se nevyskytují nebo jsou velice vzácné, u primárních polycytémií se vyskytují až v desítkách. Progenitory pacientů s primární polycytémií vykazují ve stoupající koncentrační řadě EPO zvýšenou citlivost na tento růstový faktor. Hypersenzitivita se projevuje vyšším relativním počtem narostlých erytroidních kolonií pacientů ve srovnání se zdravou kontrolou (obr. 4).
Image 3. Hypersenzitivita erytroidních progenitorů na EPO in vitro. Výrazný rozdíl růstu erytroidních kolonií (BFU-E) u pacienta s PFCP ve srovnání se zdravou kontrolou při stejné koncentraci EPO (0,12 U/ml). Po 14 dnech kultivace je zřetelný rozdíl jak v počtu, tak ve velikosti erytroidních kolonií označeny šipkami). 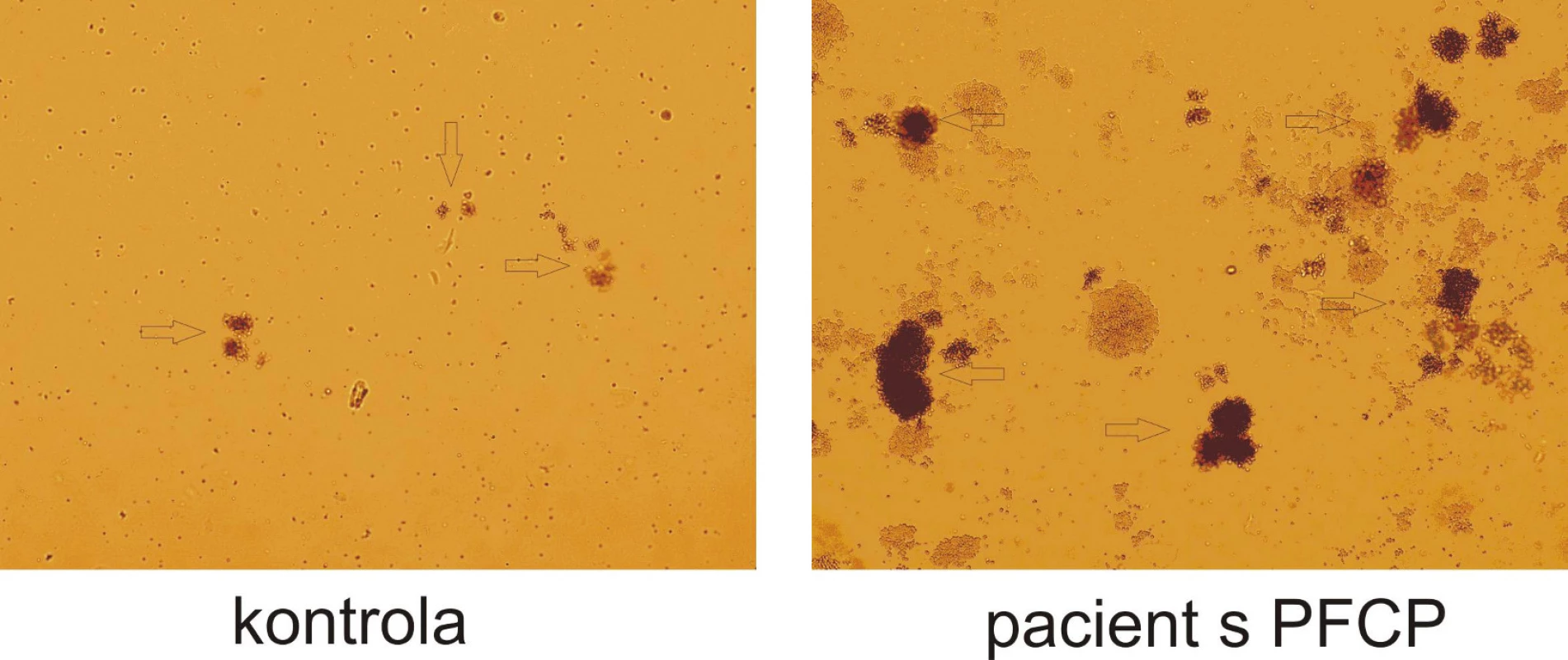
Image 4. Graf závislosti počtu BFU-E kolonií na koncentraci EPO u testu hypersenzitivity erytroidních progenitorů na EPO in vitro. Počet erytroidních kolonií vyrostlých při každé použité koncentraci EPO je procentuálně vztažen k maximu, které zodpovídá maximálnímu počtu vyrostlých kolonií v kultuře (většinou při 1 U/ml EPO). U pacienta s PFCP pozorujeme výrazný nárůst počtu kolonií už v nejnižších koncentracích EPO, ve srovnání se zdravou kontrolou. U pacienta se sekundární polycytemií (SP) a bez hypersenzitivity na EPO, kopíruje růstová křivka křivku zdravé kontroly. 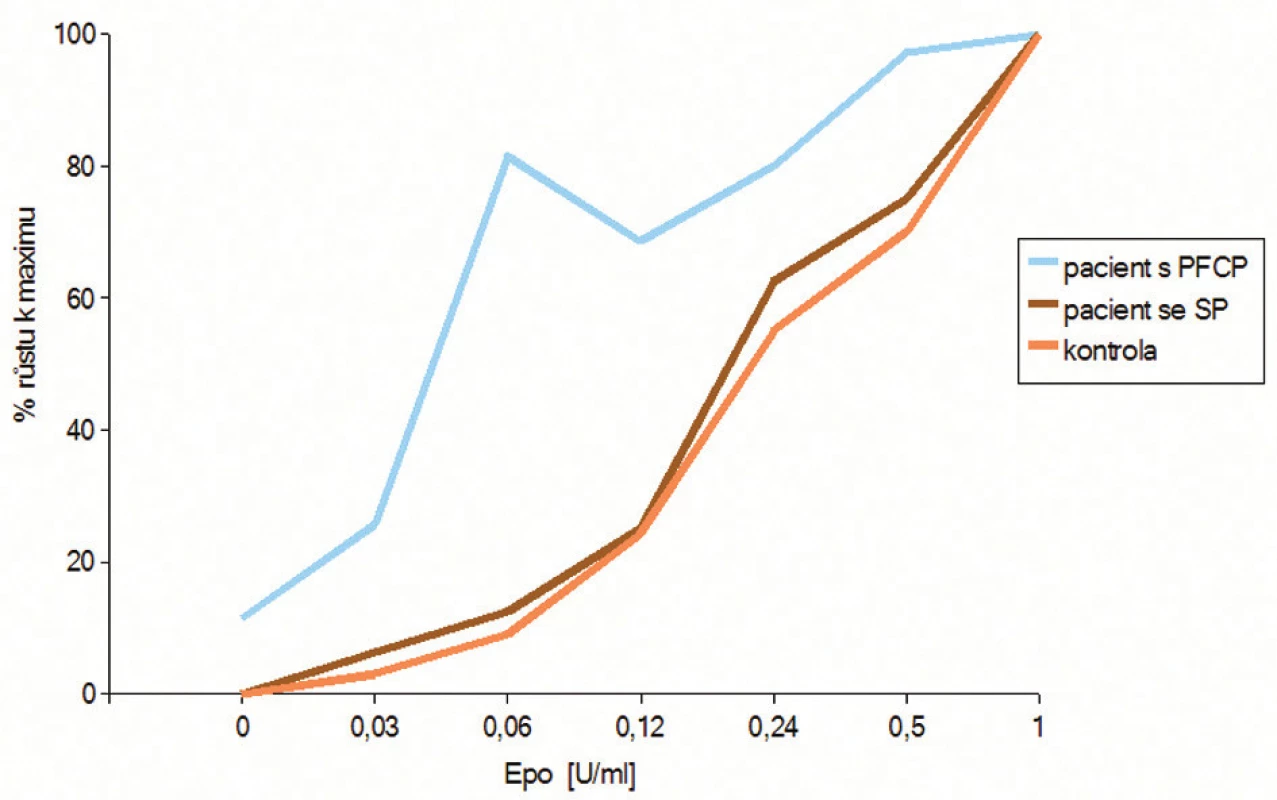
4.2 Sekvenační analýza kandidátních genů
Jednoznačnou metodou pro určení známých i neznámých mutací způsobujících polycytemie je určení DNA sekvence kompletních kódujících úseků genů, nebo jejich částí. Sledované úseky jsou amplifikovány z DNA nebo RNA pomocí polymerázové řetězové reakce (PCR) a následně analyzovány na automatickém sekvenátoru. Pro sekvenování jednotlivých genů u konkrétních pacientů se rozhodujeme i na základě dostupných laboratorních výsledků, především hladiny EPO. V případě nízké hladiny EPO se zaměřujeme zejména na koncové exony EPOR a kinázovou a pseudokinázovou doménu JAK2 (viz níže). U pacientů se zvýšenou nebo nepřiměřeně normální hladinou EPO analyzujeme celé geny VHL, PHD2 a nově i domény HIF-2α důležité pro kyslíkově-závislou degradaci.
4.3 Diferenciální diagnostika PFCP a PV
Polycytemia vera (PV) řadíme mezi získané primární polycytemie, a není proto obsahem tohoto sdělení. PV patří mezi klonální myeloproliferativní onemocnění charakterizované především zvýšeným množstvím erytrocytů, ale i dalších myeloidních elementů, které vykazují klonální charakter. Klinický obraz může být někdy podobný vrozeným primárním polycytemiím, hladina EPO bývá také snížená. Nicméně PV je maligní onemocnění s rizikem transformace do akutní leukemie a s rizikem závažných krvácivých a trombotických komplikací. Zcela odlišné jsou i léčebné postupy. Proto je správná diagnostika klíčová.
Na molekulárně genetické úrovni byla u drtivé většiny pacientů s PV, ale nikoliv u pacientů s PFCP, popsána mutace V617F v genu JAK2 a recentně i další mutace JAK2 v exonu 12 (45, 46). Tyto mutace narušují schopnost pseudokinázové domény blokovat aktivní místo kinázy při absenci vnějšího signálu. JAK2 pak fosforyluje své cílové proteiny i bez přítomnosti EPO. Pro diferenciální diagnostiku jsou proto pacienti s primární polycytemií testováni i na přítomnost těchto mutací.
5. Naše výsledky
Tradici výzkumu vrozených polycytemických stavů na LF UP a FN v Olomouci založili B. Wiedermann a K. Indrák, kteří diagnostikovali a popsali v roce 1987 novou hemoglobinopatii s vysokou afinitou ke kyslíku (Hb-Olomouc nebo a2b2 86 (F2) Ala-Asp) u otce a syna (39). Ještě o rok dříve tito autoři poprvé diagnostikovali a popsali v českém písemnictví dědičnou bezpříznakovou erytrocytózu se splenomegalií, normální saturací arteriální krve kyslíkem a s nízkou hladinou EPO, která se nezvyšovala po venepunkci (47). Ve stejné době byl Prchalem a kol. (48) popsán identický typ vrozené polycytemie s autozomálně-dominantní dědičností, a byl pojmenován jako PFCP. V roce 1997 byla identifikována příčina PFCP u zmíněné moravské rodiny jako mutace genu EPOR charakterizovaná inzercí thyminu v pozici 5967 v 8. exonu genu EPOR (49). Naše pracoviště se pak podílelo na vytvoření myšího modelu PFCP (50), který slouží k pochopení mechanizmu, jak zkrácení cytoplazmatické domény EPOR vede k polycytemickému fenotypu (50–52).
V současnosti na našem pracovišti vyšetřujeme skupinu sedmi polycytemických dětí a několika polycytemických dospělých s podezřením na vrozenou polycytemii. Všichni mají zvýšený hemoglobin a hematokrit a normální hodnotu leukocytů a trombocytů. U pacientů provádíme buněčné analýzy (testy hypersenzitivity erytroidních progenitorů na EPO in vitro, viz obr. 3 a 4), biochemické analýzy (hladiny EPO, PO2-50 a elektroforézu hemoglobinu) a molekulárně genetické analýzy pro mutace v genech VHL, PHD2, HIF-2α, JAK2 (V617F a exon 12) a koncové oblasti EPOR. U dvou dětí s normálními hodnotami EPO a v jednom případě i u matky pacienta (rodiče druhého nebylo možné vyšetřit) byla nalezena již publikovaná dominantní posunová mutace v genu EPOR, způsobující zkrácení cytoplazmatické domény receptoru (49). Přestože nemáme informace o vzájemné příbuznosti obou rodin, analýza mikrosatelitů v genu EPOR naznačuje, že se může jednat o tutéž „moravskou“ alelu stejného původu.
U několika dalších pacientů svědčí laboratorní výsledky pro mutace v EPOR nebo HIF drahách, ale v dosud známých postižených genech těchto drah mutace nalezeny nebyly. Lze předpokládat, že se jedná o mutace postihující dosud neznámé cíle v EPOR resp. HIF dráze.
Závěr
Pokrok v pochopení patogeneze polycytemických stavů velkou mírou přispěl k celkovému poznání regulace normální a patologické erytropoézy. Identifikace příčinných mutací nemocí umožňuje zlepšení a zpřesnění diagnostiky a může v nemalé míře přispět i k rozvoji nových terapeutických přístupů. Bohužel, u řady vrozených erytrocytóz etiologie nemoci zůstává i nadále neznámá. Jednou z příčin je i velká vzácnost zmíněných poruch. I z tohoto hlediska je proto velmi důležitá spolupráce jednotlivých klinik a jejich propojenost s experimentální a laboratorní hematologií.
Grantová podpora: tato práce byla podpořena grantem IGA MZ ČR NS9935-3/2008 a MSM 6198959205.
Mgr. Monika Horváthová, Ph.D.
Ústav biologie
LF UP v Olomouci
Hněvotínská 3
775 15 Olomouc
Doručeno do redakce: 10. 7. 2009
Přijato: 29. 9. 2009
Sources
1. Cario H. Childhood polycythemias/erythrocytoses: classification, diagnosis, clinical presentation, and treatment. Ann Hematol 2005; 84 : 137-145.
2. Prchal JF, Prchal JT. Molecular basis for polycythemia. Curr Opin Hematol 1999; 6 : 100–109.
3. Benesch R, Benesch RE, Yu CI. Reciprocal binding of oxygen and diphosphoglycerate by human hemoglobin. Proc Natl Acad Sci U S A 1968; 59 : 526-532.
4. Stopka T, Zivny JH, Stopkova P, Prchal JF, Prchal JT. Human hematopoietic progenitors express erythropoietin. Blood 1998; 91 : 3766-3772.
5. Lappin TR, Maxwell AP, Johnston PG. EPO’s alter ego: erythropoietin has multiple actions. Stem Cells 2002; 20 : 485-492.
6. Halvorsen S, Bechensteen AG. Physiology of erythropoietin during mammalian development. Acta Paediatr Suppl 2002; 91 : 17-26.
7. Palis J, Segel GB. Developmental biology of erythropoiesis. Blood Rev 1998; 12 : 106-114.
8. Noguchi CT, Asavaritikrai P, Teng R, Jia Y. Role of erythropoietin in the brain. Crit Rev Oncol Hematol 2007; 64 : 159-171.
9. Ruifrok WP, de Boer RA, Westenbrink BD, van Veldhuisen DJ, van Gilst WH. Erythropoietin in cardiac disease: new features of an old drug. Eur J Pharmacol 2008; 585 : 270-277.
10. Ebert BL, Bunn HF. Regulation of the erythropoietin gene. Blood 1999; 94 : 1864-1877.
11. Rankin EB, Biju MP, Liu Q, et al. Hypoxia-inducible factor-2 (HIF-2) regulates hepatic erythropoietin in vivo. J Clin Invest 2007; 4 : 1068-1077.
12. Percy MJ, Furlow PW, Lucas GS, et al. A gain-of-function mutation in the HIF2A gene in familial erythrocytosis. N Engl J Med 2008; 358 : 162-168.
13. Smith TG, Robbins PA, Ratcliffe PJ. The human side of hypoxia-inducible factor. Br J Haematol 2008; 3 : 325-334.
14. Testa U. Apoptotic mechanisms in the control of erythropoiesis. Leukemia 2004; 18 : 1176-1199.
15. Chin H, Arai A, Wakao H, Kamiyama R, Miyasaka N, Miura O. Lyn physically associates with the erythropoietin receptor and may play a role in activation of the Stat5 pathway. Blood 1998; 91 : 3734-3745.
16. Larsen L, Röpke C. Suppressors of cytokine signalling: SOCS. APMIS 2002; 110 : 833-844.
17. Hilton DJ. Negative regulators of cytokine signal transduction. Cell Mol Life Sci 1999; 55 : 1568-1577.
18. Tong W, Zhang J, Lodish HF. Lnk inhibits erythropoiesis and Epo-dependent JAK2 activation and downstream signaling pathways. Blood 2005; 105 : 4604-4612.
19. Meyer L, Deau B, Forejtníková H, et al. Beta-TRCP mediates ubiquitination and degradation of the erythropoietin receptor and controls cell proliferation. Blood 2007; 109 : 5215-5222.
20. Pastore YD, Jelinek J, Ang S, et al. Mutations in the VHL gene in sporadic apparently congenital polycythemia. Blood 2003; 101 : 1591-1595.
21. de la Chapelle A, Träskelin AL, Juvonen E. Truncated erythropoietin receptor causes dominantly inherited benign human erythrocytosis. Proc Natl Acad Sci U S A 1993; 90 : 4495-4499.
22. Gregg XT, Prchal JT. Erythropoietin receptor mutations and human disease. Semin Hematol 1997; 34 : 70-76.
23. Kralovics R, Prchal JT. Genetic heterogeneity of primary familial and congenital polycythemia. Am J Hematol 2001; 68 : 115-121.
24. Al-Sheikh M, Mazurier E, Gardie B, et al. A study of 36 unrelated cases with pure erythrocytosis revealed three new mutations in the erythropoietin receptor gene. Haematologica 2008; 93 : 1072-1075.
25. Petersen KB, Hokland P, Petersen GB, et al. Erythropoietin receptor defect: a cause of primary polycythaemia. Br J Haematol 2004; 125 : 537-538.
26. Watowich SS, Xie X, Klingmuller U, et al. Erythropoietin receptor mutations associated with familial erythrocytosis cause hypersensitivity to erythropoietin in the heterozygous state. Blood 1999; 94 : 2530-2532.
27. Sokol L, Luhovy M, Guan Y, Prchal JF, Semenza GL, Prchal JT. Primary familial polycythemia: a frameshift mutation in the erythropoietin receptor gene and increased sensitivity of erythroid progenitors to erythropoietin. Blood 1995; 86 : 15-22.
28. Percy MJ, Lee FS. Familial erythrocytosis: molecular links to red blood cell control. Haematologica 2008; 93 : 963-967.
29. Ang SO, Chen H, Gordeuk VR, et al. Endemic polycythemia in Russia: mutation in the VHL gene. Blood Cells Mol Dis 2002; 28 : 57-62.
30. Perrotta S, Nobili B, Ferraro M, et al. Von Hippel-Lindau-dependent polycythemia is endemic on the island of Ischia: identification of a novel cluster. Blood 2006; 2 : 514-519.
31. Pastore Y, Jedlickova K, Guan Y, et al. Mutations of von Hippel-Lindau tumor-suppressor gene and congenital polycythemia. Am J Hum Genet 2003; 73 : 412-419.
32. Bento MC, Chang KT, Guan Y, et al. Congenital polycythemia with homozygous and heterozygous mutations of von Hippel-Lindau gene: five new Caucasian patients. Haematologica 2005; 90 : 128-129.
33. Percy MJ, Zhao Q, Flores A, et al. A family with erythrocytosis establishes a role for prolyl hydroxylase domain protein 2 in oxygen homeostasis. Proc Natl Acad Sci USA 2006; 103 : 654-659.
34. Percy MJ, Furlow PW, Beer PA, Lappin TRJ, McMullin MF, Lee FS. A novel erythrocytosis-associated PHD2 mutation suggests the location of a HIF binding groove. Blood 2007; 110 : 2193-2196.
35. Al-Sheikh M, Moradkhani K, Lopez M, Wajcman H, Préhu C. Disturbance in the HIF-1alpha pathway associated with erythrocytosis: further evidences brought by frameshift and nonsense mutations in the prolyl hydroxylase domain protein 2 (PHD2) gene. Blood Cells Mol Dis 2008; 40 : 160-165.
36. Martini M, Teofili L, Cenci T, et al. A novel heterozygous HIF2AM535I mutation reinforces the role of oxygen sensing pathway disturbances in the pathogenesis of familial erythrocytosis. Haematologica 2008; 93 : 1068-1071.
37. Percy MJ, Beer PA, Campbell G, et al. Novel exon 12 mutations in the HIF2A gene associated with erythrocytosis. Blood 2008; 111 : 5400-5402.
38. Ladroue C, Carcenac R, Leporrier M, et al. PHD2 mutation and congenital erythrocytosis with paraganglioma. N Engl J Med 2008; 359 : 2685-2692.
39. Indrak K, Wiedermann BF, Batek F, et al. Hb Olomouc or alpha 2 beta 2(86)(F2)Ala — Asp, a new high oxygen affinity variant. Hemoglobin 1987; 11 : 151-155.
40. Hoyer JD, Allen SL, Beutler E, Kubik K, West C, Fairbanks VF. Erythrocytosis due to bisphosphoglycerate mutase deficiency with concurrent glucose-6-phosphate dehydrogenase (G-6-PD) deficiency. Am J Hematol 2004; 75 : 205-208.
41. Lemarchandel V, Joulin V, Valentin C, et al. Compound heterozygosity in a complete erythrocyte bisphosphoglycerate mutase deficiency. Blood 1992; 80 : 2643-2649.
42. Jedlickova K, Stockton DW, Prchal JT. Possible primary familial and congenital polycythemia locus at 7q22.1-7q22.2. Blood Cells Mol Dis 2003; 31 : 327-331.
43. Lando D, Peet DJ, Gorman JJ, Whelan DA, Whitelaw ML, Bruick RK. FIH-1 is an asparaginyl hydroxylase enzyme that regulates the transcriptional activity of hypoxia-inducible factor. Genes Dev 2002; 16 : 1466-1471.
44. Agarwal N, Mojica-Henshaw MP, Simmons ED, Hussey D, Ou CN, Prchal JT. Familial polycythemia caused by a novel mutation in the beta globin gene: essential role of P50 in evaluation of familial polycythemia. Int J Med Sci 2007; 4 : 232-236.
45. Kralovics R, Passamonti F, Buser AS, et al. A gain-of-function mutation of JAK2 in myeloproliferative disorders. N Engl J Med 2005; 352 : 1779-1790.
46. Scott LM, Tong W, Levine RL, et al. JAK2 exon 12 mutations in polycythemia vera and idiopathic erythrocytosis. N Engl J Med 2007; 356 : 459-468.
47. Indrak K, Wiedermann B. Novější přístupy k diagnóze a léčbě polycytemických stavů. Vnitř lék 1986; 23 : 623-624.
48. Prchal JT, Crist WM, Goldwasser E, Perrine G, Prchal JF. Autosomal dominant polycythemia. Blood 1985; 66 : 1208-1214.
49. Kralovics R, Indrak K, Stopka T, Berman BW, Prchal JF, Prchal JT. Two new EPO receptor mutations: truncated EPO receptors are most frequently associated with primary familial and congenital polycythemias. Blood 1997; 90 : 2057-2061.
50. Divoky V, Liu Z, Ryan TM, Prchal JF, Townes TM, Prchal JT. Mouse model of congenital polycythemia: Homologous replacement of murine gene by mutant human erythropoietin receptor gene. Proc Natl Acad Sci U S A 2001; 98 : 986-991.
51. Divoky V, Prchal JT. Mouse surviving solely on human erythropoietin receptor (EpoR): model of human EpoR-linked disease. Blood 2002; 99 : 3873-3875.
52. Yoon D, Bruchova H, Divoky V, Prchal JT. Truncated Human Erythropoietin Receptor Causes Fetal Erythropoiesis with Prolonged Primitive Erythropoiesis. Blood 2009. Odesláno k publikaci.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2009 Issue 4-
All articles in this issue
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Analýza nemocných s myelodysplastickým syndromem (MDS) s delecí dlouhého ramene 5. chromozomu (del(5q), sledovaných Českou MDS pracovní skupinou. Význam pro diagnostické zařazení a určení prognózy
- Využitie sekundárnej profylaxie s rekombinantným aktivovaným faktorom VII u hemofílie A s inhibítorom: naše skúsenosti a prehľad literatúry
- Vrozené polycytemie
- Význam polymorfismu buněčné protinádorové imunity u pacientů s B-nehodgkinským lymfomem léčených rituximabem
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
- Alogenní transplantace krvetvorných buněk u pacientů s mnohočetným myelomem – zkušenosti centra
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vrozené polycytemie
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

