-
Medical journals
- Career
Alogenní transplantace krvetvorných buněk u pacientů s mnohočetným myelomem – zkušenosti centra
Authors: S. Vokurka; V. Koza; P. Jindra; M. Karas; K. Steinerová; D. Lysák; M. Schutzova; T. Svoboda; V. Vozobulová; M. Švojgrová; L. Mohammadová; A. Jungová; M. Hrabětová
Authors‘ workplace: Hematologicko-onkologické oddělení, Fakultní nemocnice Plzeň
Published in: Transfuze Hematol. dnes,15, 2009, No. 4, p. 244-250.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
I přes svůj kurativní potenciál je postavení a indikace alogenních transplantací krvetvorných buněk (SCT) u pacientů s mnohočetným myelomem diskutabilním tématem. S ohledem na vysoké riziko mortality, morbidity a relapsu nemoci není alogenní SCT s myeloablativním i redukovaným přípravným režimem považována za standardní léčebný postup. Retrospektivní analýza souboru našich pacientů alogenně transplantovaných pro mnohočetný myelom potvrdila nepřijatelnou mortalitu konvečního přípravného režimu Bu/CY2 (n = 4). V případě 14 pacientů transplantovaných po přípravě s redukovanou intenzitou FLU/MEL (fludarabin, melfalan) bylo dosaženo 93 % léčebných odpovědí, 43 % kompletních remisí, transplantační mortalita (TRM) byla 21 %, pravděpodobnost dvouletého a čtyřletého přežití bez relapsu a progrese (PFS) 34 % a 17 % a pravděpodobností přežití pět let (OS) po transplantaci 47 %. Lepší efekt byl u pacientů transplantovaných mimo stav progrese nebo minimální léčebnou odpověď. Provedení alogenní SCT nelimitovalo další léčbu relapsu a progrese myelomu pomocí bortezomibu nebo thalidomidu. Naše výsledky odpovídají zkušenostem publikovaným jinými autory. Alogenní SCT by měly být prováděny podle definovaných protokolů a ideálně na úrovni multicentrické klinické a laboratorní spolupráce. Potenciál kombinace alogenní SCT s léčbou bortezomibem, thalidomidem nebo lenalidomidem je výzvou pro budoucí výzkum.
Klíčová slova:
mnohočetný myelom, alogenní transplantace, bortezomib, thalidomidÚvod
Mnohočetný myelom lze nadále považovat za nevyléčitelné onemocnění, přestože autologní transplantace krvetvorných buněk u mladších nemocných v první linii léčby a nově pak především moderní léky typu bortezomibu, thalidomidu a lenalidomidu výrazně přispěly ke zlepšení výsledků a prognózy pacientů (1, 16). Role a indikace alogenních transplantací krvetvorných buněk (SCT) naopak zůstává velmi diskutabilním tématem s ohledem na vysokou mortalitu, morbiditu a zatížení potransplantačními relapsy. Podle analýz Evropské společnosti pro transplantace kostní dřeně – EBMT (2) byla transplantační mortalita při konvenčních protokolech přípravy 37 %, u režimů s redukovanou intenzitou přípravy (RIC) pak 24 %, nicméně u RIC režimů pak byla kumulativní incidence progrese nemoci 54 % a v případě konvenčních příprav pouze 27 %. Při průkazném „graft-versus-myeloma“ (GVM) efektu však alogenní SCT představuje léčebnou metodu s kurativním potenciálem (3, 4).
Provedli jsme následnou analýzu ve snaze upozornit na problematiku alogenních transplantací u mnohočetného myelomu a přispět dalšími zkušenostmi.
Pacienti a metodika
Retrospektivní analýza 18 pacientů našeho centra, kteří byli léčeni alogenní transplantací krvetvorných buněk v období 1997–2008. Celkem 4 pacienti byli transplantováni s konveční přípravou Bu/CY2 v letech 1997–2002 (bližší charakteristiky jsou uvedeny v tab. 1). Celkem 14 pacientů bylo transplantováno po přípravě s redukovanou intenzitou FLU/MEL v období 2001–2008 (bližší charakteristiky souboru jsou uvedeny v tab. 2). Všichni pacienti FLU/MEL souboru podstoupili standardní léčbu první linie se čtyřmi cykly chemoterapie VAD následované přinejmenším jednou autologní transplantací periferních krvetvorných buněk po přípravě HD-L-PAM 200 mg/m2 (u tří pacientů byla následně doplněna ještě druhá autologní transplantace), medián doby sledování od alogenní transplantace byl 50 (11–61) měsíců.
Table 1. Charakteristiky mnohočetného myelomu u pacientů s alogenní transplantací krvetvorných buněk (SCT) po přípravě Bu/CY2. 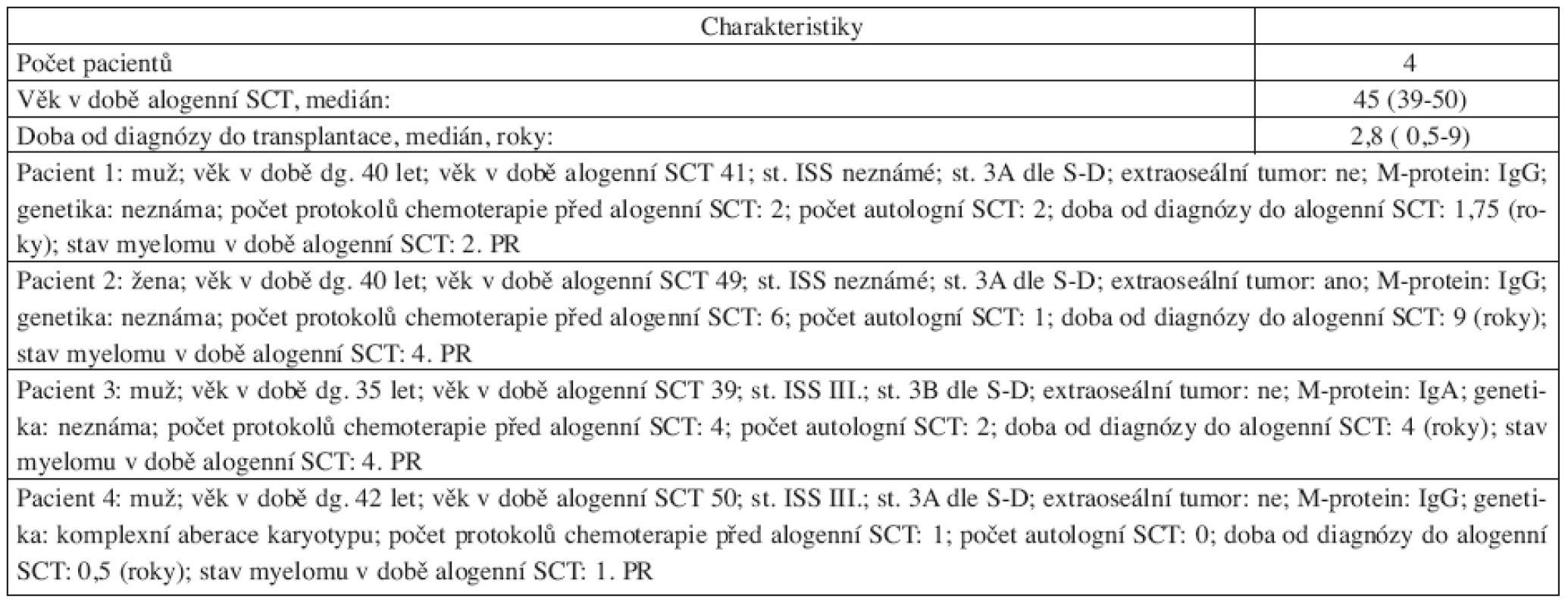
Table 2. Charakteristiky mnohočetného myelomu u pacientů s alogenní transplantací krvetvorných buněk (SCT) po přípravě FLU/MEL. 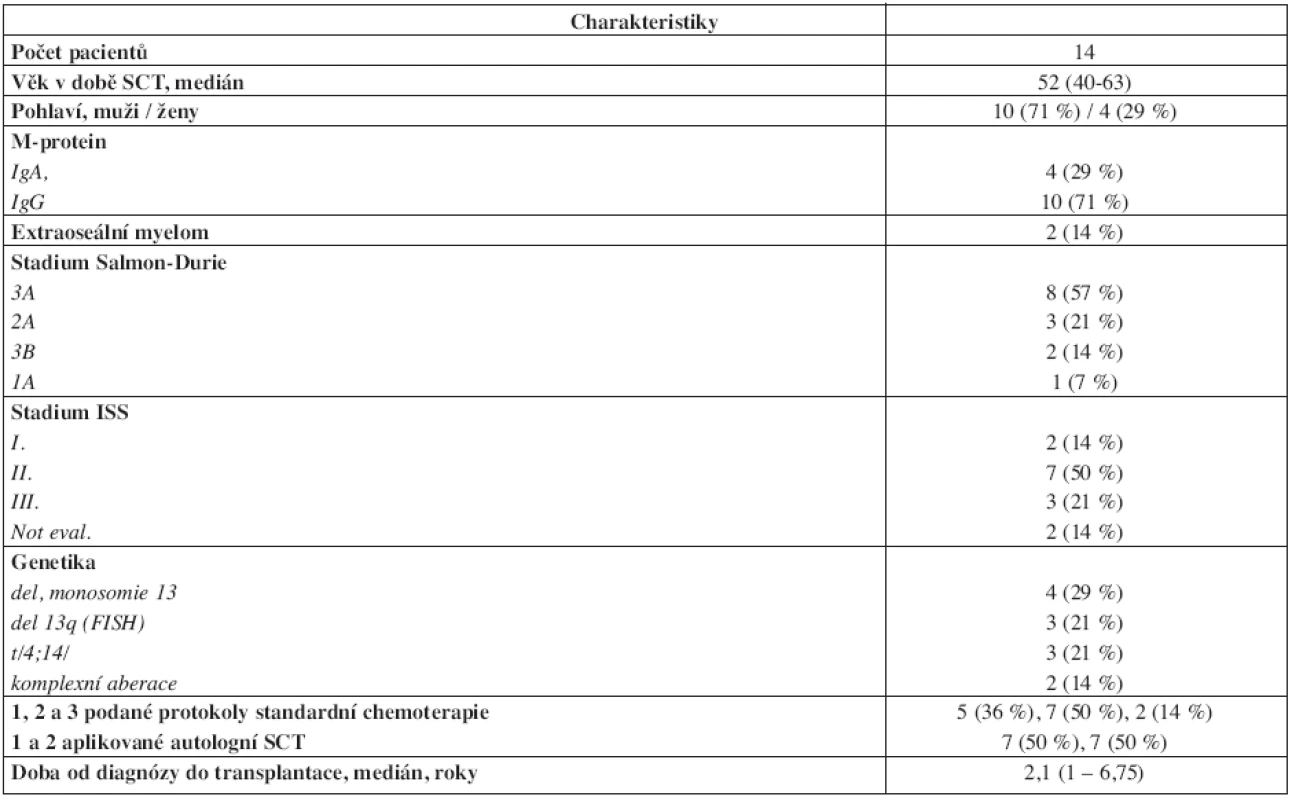
Přípravné předtransplantační protokoly
Bu/CY2: busulfan 4 mg/kg p.o. denně po dobu 4 dní (celková dávka 16 mg/kg) a cyklofosfamid 60 mg/kg/den i.v. po dobu dvou dní (celková dávka 120 mg/kg). FLU/MEL: fludarabin 30 mg/m2 i.v. 1x denně 4 dny (celková dávka 120 mg/m2) a melfalan 140 mg/m2 i.v. 1x denně den před transplantací.
Podpůrná léčba
V době transplantace byli pacienti umístěni na jednolůžkovém pokoji s účinnou filtrací vzduchu (HEPA filtry) a byli ošetřováni v režimu ochranné (reverzní) izolace. Jako prevence reakce štěpu proti hostiteli (GVHD) byl při režimu Bu/CY2 podáván metotrexát (MTX) 15 mg/m2 i.v. v den + 1 a 10 mg/m2 v den +3, +6 se zajištěním aplikace leukovorinu a dále cyklosporin A (CyA) od dne -1 s úpravou dávky dle hladin po dobu 6 měsíců při nepřítomnosti GVHD. V rámci režimu FLU/MEL byl podáván MTX 10 mg/m2 i.v. v den +1, +3, +6 se zajištěním aplikace leukovorinu a dále CyA od dne -1 před transplantací s úpravou dávky dle hladin s předpokladem podávání po dobu 3 měsíců s ohledem na rozvoj GVHD, stav malignity a chimérismu (průkaz přítomnosti genotypu dárce a příjemce molekulárně-geneticky metodikou VNTR v lymfocytární CD3 pozitivní subpopulaci) v kostní dřeni monitorovaný první rok po transplantaci ve dnech +30, +60, +90, +180,+ 270, +360. Transfundované erytrocyty a trombocyty byly vždy deleukotizované a ozářené dávkou 25 Gy. Filgrastim v dávce 5 μg/kg/den byl aplikován v potransplantačním období v případě Bu/CY2 od dne +1 po transplantaci a v případě FLU/MEL a FLU/CY od dne +5. V rámci antimikrobiální profylaxe byly do doby přihojení štěpu podávány chinolony (norfloxacin, ciprofloxacin) a dále pak do ukončení imunosuprese amoxacilin-klavulanát nebo cefuroxim, a trimethoprim-sulfomethoxazol. Dále do doby ukončení imunosupresivní léčby byli pacienti profylakticky zajištěni acyklovirem a fluconazolem. Byla uplatňována pre-emptivní léčba cytomegalovirové infekce ganciclovirem.
Definice, hodnocení, sledování
Dosažení léčebných odpovědí bylo definováno podle standardních kritérií (5) zahrnujících ve stručnosti: Kompletní remise (CR) – nepřítomnost původního M-proteinu v séru a moči imunofixací, méně než 5 % plazmocytů v kostní dřeni, nepřítomnost extraoseálního nádoru, žádná nová osteolytická nebo narůstající ložiska. Parciální remise (PR) a velmi dobrá parciální remise (VGPR): pokles M-proteinu a plazmocytomových mas měkkých tkání o nejméně 50 % (v případě VGPR pokles nejméně o 90 %) a žádná nová nebo narůstající osteolytická ložiska. Minimální odpověď (MR): pokles M-proteinu a plazmocytomových mas měkkých tkání o 25–49 %, žádná nová nebo narůstající osteolytická ložiska. Relaps: nová aktivita nemoci (infiltrace dřeně, M-protein, extraoseální tumor) po předchozí CR. Progrese: nárůst aktivity o 25 % (M-protein, infiltrace dřeně, tumor) po předchozí PR nebo MR. Doba celkového přežití (OS) byla definována jako interval od transplantace do úmrtí nebo poslední známé kontroly. Doba přežití bez progrese (PFS) byla definována jako interval od transplantace do relapsu, progrese nebo úmrtí.
V potransplantačním období byly vyšetřovány hladiny M-proteinu v séru a moči elektroforézou a imunofixací v 1–2měsíčních intervalech. Vyšetření kostní dřeně především pro potřeby určení přítomnosti genotypu dárce a příjemce (vyšetření chimérismu molekulárně-geneticky metodikou VNTR v lymfocytární CD3 pozitivní subpopulaci) bylo prováděno ve dnech +30, +60, +90, +180,+ 270, +360 po transplantaci, dále á 3 měsíce jeden rok, dále á půl roku, případně individuálně v době podezření na relaps myelomu.
Diagnostika GVHD byla prováděna s ohledem na kritéria NIH – National Institutes of Health (6) akceptovaná rovněž v rámci EBMT (7). Celková tíže akutní GVHD st. I-IV. byla hodnocena podle Glucksberga (8), chronická GVHD st. I.–III. (mírná, střední, těžká) podle NIH kritérií.
Specifické údaje o kvalitě života v období po transplantaci nebyly sledovány.
Statistické zpracování
Provedeno s využitím programu GraphPad InStat – Statistica Software a základních statistických testů – Mann-Whitney, Fisher’s Exact Test a t-test. Křivky celkového přežití (OS) a přežití bez progrese (PFS) byly zpracovány Kaplan-Meier metodikou a vyhodnocení významnosti statistických rozdílů bylo provedeno log-rank testem. Rozdíly mezi skupinami byly testovány na hladině významnosti 95% a hodnoty p < 0,05 byly považovány za staticky významné rozdíly.
Výsledky
Ve skupině 4 pacientů transplantovaných konvenčním protokolem Bu/CY2 byla mortalita 100 % (1x pneumonie, 1x krvácení do GIT, 1x sepse, 1x sepse při akutní GVHD st. IV.) časně po transplantaci s mediánem doby do úmrtí 3 (1–6) měsíce.
Analýza pacientů protokolu FLU/MEL
V souboru 14 pacientů protokolu FLU/MEL byla alogenní SCT realizována s ohledem na stav onemocnění a předchozí podstoupenou léčbu jako: konsolidace po léčbě první linie u pacienta v 1. PR – 1x; konsolidace po léčbě druhé linie u pacienta v 2. PR – 6x; samostatná léčba druhé linie při 1. progresi nemoci – 2x; samostatná léčba třetí linie při 2. progresi nemoci – 1x; samostatná léčba více než třetí linie při 3. a 4. progresi nemoci – 2x; „záchranná“ léčba při nemoci s minimální odpovědí na léčbu první linie – 1x; „záchranná“ léčba při nemoci s minimální odpovědí na léčbu druhé linie – 1x.
S HLA identickým sourozencem bylo transplantováno 50 % (7/14) pacientů, s „10/10“ identickým nepříbuzným dárcem bylo transplantováno 21 % (3/14) pacientů a s nepříbuzenským dárcem s jednou alelickou neshodou „9/10“ pak 29 % (4/14) pacientů. Všichni pacienti kromě jednoho byli transplantováni se štěpem periferních krvetvorných buněk s mediánem 4,8 (1,9–14,1 ) x 106/kg počtu CD34+ buněk. Štěp kostní dřeně v případě jednoho pacienta obsahoval 2,8 x 106/kg CD34+ buněk. Kromě primární rejekce štěpu kostní dřeně (dárce s jednou alelickou neshodou) došlo k řádnému přihojení u všech pacientů s mediánem v den +13 (11–16) a s průkazem kompletního dárcovského chimérismu v kostní dřeni do dne +30. Akutní GVHD se rozvinula u 29 % (4/14) pacientů, resp. u 31 % (4/13) pacientů žijících více než 100 dní po SCT (dárce 2x příbuzenský a 2x nepříbuzenský), s mediánem stupně postižení II. (I.–III.) dle Glucksberga. Chronická GVHD byla přítomna u 43 % (6/14) pacientů, resp. u 46 % (6/13) pacientů žijících více než 100 dní po SCT (dárce 3x příbuzenský a 3x nepříbuzenský), se stupni postižení dle NIH: I. – 2x; II. – 2x; III. – 2x. Ve skupině 29 % (4/14) pacientů transplantovaných s nepříbuzným dárcem s jednou alelickou neshodou nebyl zastižen vyšší výskyt transplantační mortality, GVHD ani kratší OS. Bližší údaje o charakteristikách dárců jsou uvedeny v tabulce 3.
Table 3. Charakteristiky dárců štěpů v rámci alogenní transplantace krvetvorných buněk po přípravě FLU/MEL. 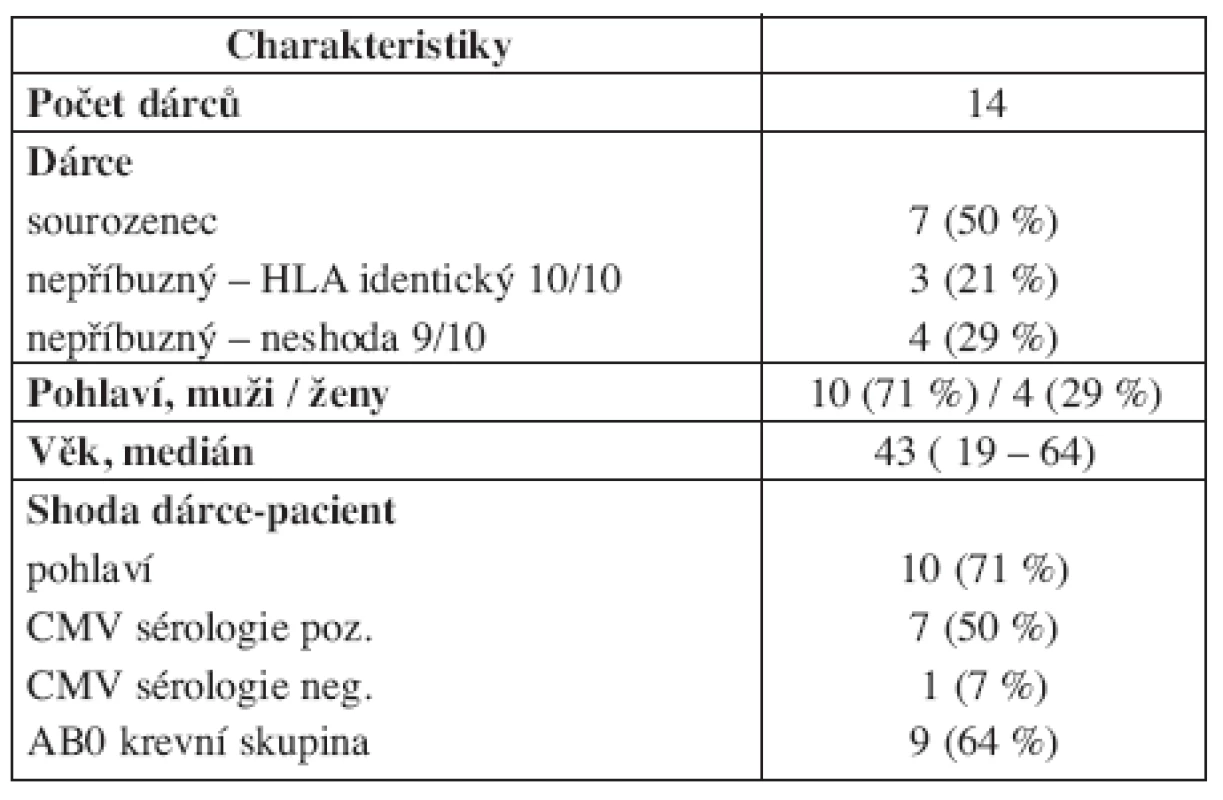
Po alogenní SCT bylo dosaženo 93 % léčebných odpovědí (CR 43 %, VGPR 7 %, PR 43 %) s mediánem doby do dosažení nejlepší odpovědi za 3 (1–15) měsíce. V případech, kdy byla alogenní SCT realizována jako „konsolidace“, bylo dosaženo statisticky významně více CR oproti SCT realizované jako „samostatná“ nebo „záchranná“ léčba (86 % (6/7) vs. 0 % (0/7), p = 0,004), respektive 86 % (6/7) pacientů v PR před SCT dosáhlo následně CR ve srovnání s žádnou dosaženou CR v případě transplantace nemoci ve stavu minimální léčebné odpovědi nebo progrese (p = 0,004).
V době analýzy provedené v 6/2009 žije celkem 43 % (6/14) pacientů s mediánem doby sledování od transplantace 50 (11–61) měsíců, s pravděpodobností přežití pět let od transplantace 47 % (graf 1) a s mediánem doby celkového přežití od transplantace 36 měsíců. Pravděpodobnost celkového přežití pět let od stanovení diagnózy byla 62 % a medián celkového přežití 76 měsíců.
Graph 1. Pravděpodobnost celkového přežívání (OS) pacientů po alogenní transplantaci krvetvorných buněk s přípravným režimem FLU/MEL. Pravděpodobnost OS pět let 47 %, medián OS 36 měsíců. 
Celkem 57 % (8/14) pacientů zemřelo s mediánem doby do úmrtí 13 (2–64) měsíců. Jednalo se o 2 (14 %) případy úmrtí v souvislosti s relapsem/progresí myelomu, 3 (21 %) úmrtí související přímo s transplantací (2x sepse, 1x multiorgánové selhání do půl roku po SCT – dva pacienti léčení kortikoidy pro GVHD, jeden pacient silně předléčený a se čtvrtou progresí myelomu před SCT) a dále 3 (21 %) jiná úmrtí (2x náhlá smrt, 1x respirační selhání za 16, 25 a 36 měsíců). Celkově dosáhla mortalita nezpůsobená relapsem onemocnění 43 %. Nesignifikantní prodloužení OS bylo patrné u pacientů transplantovaných ve stavu PR ve srovnání s pacienty s progresivní nemocí nebo minimální léčebnou odpovědí (graf 2). V univariantní analýze souboru nebyl patrný signifikantní rozdíl v OS u pacientů s dosažením CR nebo pouze PR a rozdíl nebyl patrný ani s ohledem na věk, stádium dle ISS, genetiku, typ dárce, výskyt GVHD.
Graph 2. Pravděpodobnost celkového přežívání (OS) pacientů po alogenní transplantaci krvetvorných buněk s přípravným režimem FLU/MEL a s ohledem na stav nemoci před transplantací: PR vs. ostatní (non-PR). 
U celkem 57 % (8/14) pacientů, respektive u 62 % (8/13) žijících více než 100 dní po SCT došlo k relapsu nebo progresi nemoci s mediánem 11 (5–26) měsíců po transplantaci. Pravděpodobnost dvouletého přežití bez relapsu/progrese od transplantace byla 34 % (graf 3). U 3/8 pacientů nastala progrese (2x) a relaps (1x) dominantně v extraoseální oblasti. Nebyl signifikantní rozdíl v PFS u pacientů s dosažením CR nebo pouze PR po SCT. Jiné další faktory možného ovlivnění PFS (věk, stadium dle ISS, genetika, typ dárce, výskyt GVHD) nebyly v souboru vyjádřeny a nebyla provedena multivariantní analýza. Celkem 2 pacienti (14 %) zůstávají nadále v původní CR 11 a 49 měsíců po SCT.
Graph 3. Pravděpodobnost přežívání bez progrese/relapsu (PFS) pacientů po alogenní transplantaci krvetvorných buněk s přípravným režimem FLU/MEL. Pravděpodobnost PFS dva roky 34 %, medián PFS 11 měsíců. 
U všech 8 pacientů s relapsem (3x) nebo progresí (5x) po transplantaci byla zahájena další léčba: thalidomid 200 mg/den u 1 pacienta bez terapeutického efektu (úmrtí na progresi myelomu za 11 měsíců po SCT); bortezomib v kombinaci s dexametazonem v konvenčním schématu u 5 pacientů s dosažením 1x CR, 3x PR a 1x žádná léčebná odpověď; infuze dárcovských lymfocytů (DLI) aplikovaná v eskalujících dávkách a následovaná léčbou bortezomibem v kombinaci s dexametazonem v konvenčním schématu u 2 pacientů s dosažením CR.
Diskuse
Role a indikace alogenní transplantace krvetvorných buněk u pacientů s mnohočetným myelomem je přes svůj kurativní potenciál stále velmi diskutabilní (2). Současně je velmi obtížné objektivně vyhodnocovat nebo srovnávat výsledky studií zaměřených na alogenní SCT z důvodu jejich často retrospektivního charakteru, heterogenity nebo naopak selektivity souborů a velké rozmanitosti léčebných strategií a protokolů. Obecně se jako velmi problematická jeví především vysoká mortalita, která u myeloablativních režimů dosahovala nepřijatelných hodnot a teprve zavedení režimů s redukovanou intenzitou přípravy (RIC) tuto zátěž pomohlo významně snížit na úrovně 11–24 % (2, 9, 10). Na druhé straně jsou však RIC protokoly zatíženy nezanedbatelným výskytem potransplantačních relapsů a progresí dosahujících 41 % v prospektivní studii skupiny GITMO (9), 56 % ve francouzské studii IFM99-03 (10) a 54 % v analýzách EBMT (2). U pacientů s chemorezistentním nebo pokročilým onemocněním jsou pak celkové výsledky RIC režimů obecně neuspokojivé (16). Na druhé straně, jak vyplývá z multivariantí analýzy prospektivní studie skupiny GITMO (9), která transplantovala pacienty se sourozeneckým dárcem (příprava nemyeloablativní celotělové ozáření) v rámci první linie léčby následně po transplantaci autologní (příprava melfalan 200 mg/m2), je pro dosažení déletrvajících odpovědí (přežití pět let od diagnózy 65 % ) důležité transplantovat pacienty ve stavu dosažené kompletní remise, eventuálně s velmi dobrou parciální remisí. Zkušenosti z Fred Hutchinson Cancer Research Center (17) na doposud největším a nejdéle sledovaném souboru 102 pacientů pak rovněž dokládají význam kombinace autologní a alogenní příbuzenské RIC transplantace (nemyeloablativní celotělové ozáření 2Gy, s nebo bez fludarabinu) na příznivých výsledcích s pravděpodobností 5 let OS 69 % a PFS 37 % v případě, že byla auto/alo SCT léčba realizována do deseti měsíců od zahájení indukce.
Z důvodu poměrně komplikované problematiky alogenních transplantací u mnohočetného myelomu jsme provedli retrospektivní analýzu souboru našich pacientů. Při hodnocení výsledků je nutné brát v úvahu fakt, že v době indikace většiny pacientů do transplantačního alogenního programu nebyly současné moderní léčebné postupy s využitím thalidomidu, bortezomibu a lenalidomidu běžně dostupné.
Pro velmi malý soubor pacientů transplantovaných v úvodu našeho alogenního myelomového programu s využitím konvečního režimu Bu/CY2 a s dosažením velmi nepříznivých výsledků (vysvětlením může být zastoupení více předléčených pacientů i samotná toxicita přípravného režimu) byla naše analýza zaměřena na pacienty přípravného RIC protokolu FLU/MEL (melfalan 140 mg/m2), který je u nás již prakticky zásadně používán u všech pacientů s myelomem od roku 2002.
S ohledem na politiku prakticky individuálních indikací pro alogenní SCT u mnohočetného myelomu lze odpovídajícím způsobem rovněž v našem souboru zaznamenat rozdílné situace, kdy byla alogenní SCT indikována nejčastěji jako konsolidace druhé linie léčby, ale také jako zcela samostatná, či dokonce „záchranná“ léčba při selhávání – v dané době konvečních – postupů. Současně lze v poslední době zaznamenat i trend k odklonu od indikace alogenní SCT v době běžné dostupnosti moderních léků bortezomibu a thalidomidu (v období let 2004–05 bylo na našem centru provedeno 71 % (10/14) transplantací a dále doposud již jen dvě).
U 92 % (12/13) pacientů FLU/MEL protokolu byl zastižen minimálně jeden nepříznivý prognostický faktor zahrnující genetické aberace, klinické stadium III. podle ISS, onemocnění minimálně odpovídající na konveční léčbu první linie s autologní SCT nebo opakovaně a časně progredující onemocnění. I v našem souboru jsou tedy zahrnuti pacienti, u kterých lze podle nynější zkušeností (2,9,16,17) očekávat spíše méně příznivý průběh a potransplantační výsledky. Současně se také v některých našich případech odrážela jistá zdrženlivost k časné indikaci alogenní SCT.
Aplikace přípravného režimu FLU/MEL navodila v našem souboru 93 % léčebných odpovědí a dokonce CR i v případě pacientů, kteří ji nikdy předtím nedosáhli – obdobně pozitivní časné výsledky byly popsány rovněž ve skupině FLU/MEL pacientů německých autorů Kröger et al. (11). Dosažení léčebné odpovědi nastupovalo většinou rychle s mediánem 2 měsíce, nicméně bylo i několik zřetelně pozdějších nástupů nejlepší léčebné odpovědi (např. CR dosažená za 6 měsíců a 1x PR za 15 měsíců), při kterých byla u pacientů také přítomna akutní nebo chronická GVHD, a kdy lze tedy usuzovat na přítomnost imunitního vlivu „graft-versus-myeloma“ (GVM) efektu. Nejvíce CR bylo dosaženo u pacientů, u kterých byla alogenní SCT podána jako konsolidace, tedy u pacientů v alespoň PR po předchozí podané léčbě. Současně pacienti transplantovaní v PR přežívali nesignifikantně lépe než ostatní. Dosažení stavu CR nebo jen PR po transplantaci však nemělo statisticky signifikantní vliv na OS a PFS.
Kromě jednoho případu rejekce štěpu kostní dřeně proběhlo přihojení darovaných periferních krvetvorných buněk bez zásadních komplikací. Vcelku příznivě v kontextu s doposud publikovanými daty lze hodnotit i transplantační mortalitu, která byla v našem případě 21 % (3/14). Obecně se však tento údaj jeví jako nepříznivý, obzvláště pak v rámci celkové mortality nezpůsobené relapsem choroby, která dosahovala 43 %. Vysvětlením může být zátěž vázaná obecně na samotný transplantační postup a dále také fakt, že do léčby byli zahrnuti rovněž rizikoví a silně předléčení pacienti. Vliv na transplantační morbiditu a mortalitu měla také přítomnost GVHD, nicméně na druhé straně byli paradoxně mezi pacienty s nejdelším OS právě také ti s výskytem GVHD. Jaký je skutečný vliv GVHD a potažmo subklinických imunitních dějů na prognózu myelomu po alogenní SCT však můžeme zatím nanejvýš jen spekulovat. Podle EBMT analýzy z roku 2005 (12) byl prokázán delší OS v případě chronické limitované GVHD, na druhé straně v prospektivních studiích skupiny GITMO (9) nebo IFM99-03 (10) a retrospektivní analýze Costa et. al (15) nebyl takový vliv na OS prokázán (v případě IFM99-03 byl patrný trend k delšímu trvání léčebné odpovědi). Zcela jistě lze ale souhlasit, že samotný fakt manifestního rozvoje GVHD není zárukou dlouhodobější kontroly nad myelomem. Výskyt GVHD (akutní 31 %, chronická 46 %) v našem souboru odpovídal zkušenostem s tímto protokolem (13), byl také zcela srovnatelný s údaji studie IFM99-03 využívající předtransplantační přípravu Bu/Flu/ATG a byl dokonce spíše nižší, než v případě transplantací po celotělovém ozářením v redukované intenzitě 2 Gy ve skupině GITMO (9) a z Fred Hutchinson Cancer Research Center (17) a výskytem akutní GVHD 38 % a 42 % a chronické GVHD 50 % a 74 %. V našem souboru jsme neshledali žádný významný rozdíl v rozvoji GVHD s ohledem na typ dárce.
Pravděpodobnost dvouletého a čtyřletého přežití bez relapsu a progrese od transplantace (PFS) 34 % a 17 % lze považovat za srovnatelné s údaji EBMT analýzy (2), ale současně nižší, než v případě GITMO a IFM99-03 protokolů (9, 10). Kromě individuálního rozboru možných příčin (většina pacientů s nepříznivými prognostickými faktory nebo nepříznivým průběhem, případně s alogenní SCT podanou pro opakovanou progresi nebo rezistenci nemoci) lze obecně také uvažovat o možném efektu předtransplantační přípravy a modulace GVHD, potažmo GVM. Objektivní srovnání a rozbor však není zatím dobře proveditelný z důvodu rozdílných protokolů, složení a velikostí souborů pacientů. Jak ovšem vyplývá z dosavadních souhrnných přehledů (16, 18) přípravné režimy s redukovanou intenzitou (podle definice EBMT (19) např. melfalan ≤ 140 mg/m2, busulfan ≤ 8 mg/kg, celotělové ozáření do dávky 6 Gy ) jsou obecně ve srovnání s myeloablativními režimy zatíženy vyšším podílem relapsů a progresí při nižším antimyelomovém efektu. V případě protokolů s aplikací anti-tymocytárního globulinu (ATG) a alemtuzumabu bylo rovněž kratší přežití bez progrese a relapsu, ale opět nelze provést jednoznačné závěry (nerandomizované soubory, starší pacienti s pokročilou nemocí) (18).
Každý pacient s relapsem nebo progresí po alogenní SCT podstoupil další léčbu zahrnující v naprosté většině případů kombinaci bortezomibu s dexametazonem. Z důvodu nedostupnosti dárce, odmítnutí ze strany pacienta, či přítomnosti aktivní GVHD byla infuze dárcovských lymfocytů (DLI) v eskalovaném schématu podána pouze dvěma pacientům přičemž pro nezaznamenaný zřetelný efekt následovala léčba kombinací bortezomib a dexametazon. Neuspokojivé výsledky po podání DLI potvrzuje IFM99-03 (10) s 9 pacienty léčenými s DLI bez efektu, a dále skupina GITMO (9), kde z 18 aplikací bylo pouze 24 % odpovědí a to ještě v případech předchozí cytoredukce bortezomibem nebo thalidomidem. Tento neúspěch DLI stojí jistě za povšimnutí a snad je i důsledkem změn expresí antigenů na povrchu myelomových buněk v průběhu času a tím změny cílového profilu cytotoxických T-buněk (14). Na druhé straně se lze spolehnout na poměrně uspokojivou účinnost moderních léků, při kterých bylo dosaženo druhé léčebné odpovědi u většiny pacientů (6/8) našeho souboru, ale i v rámci výše citovaných studií.
Závěrem lze shrnout, že naše zkušenosti nejsou v zásadním rozporu s dosavadními poznatky o problematice alogenních transplantací v případě mnohočetného myelomu. Domníváme se, že RIC předtransplantační režim FLU/MEL je relativně bezpečnou a s ohledem na dosažení léčebné odpovědi i účinnou formou přípravy. Na základě našeho pozorování a zkušeností autorů italské skupiny GITMO (9) a z Fred Hutchinson Cancer Research Center (17) se domníváme, že s ohledem na dosažení lepších léčebných odpovědí a výsledků není ideální indikovat alogenní SCT jako samostatnou léčbu u pacientů s progredující chorobou nebo jako záchrannou léčbu nemocných s minimální odpovědí po autologní transplantaci, ale že prospěch lze spíše očekávat u pacientů s minimální nádorovou zátěží a bez většího předléčení. Provedení alogenní SCT by mělo být zvažováno u mladých pacientů s nedostatečnou nebo časně selhávající odpovědí na moderní léčebné protokoly obzvláště v případě dostupnosti HLA identického sourozence. Přestože lze u naprosté většiny pacientů očekávat opětovný relaps nebo progresi myelomu, nevylučuje alogenní SCT možnost další úspěšné léčby moderními léky. Naopak, výzvou pro další postupy v této oblasti je využít potenciál alogenní SCT a imunomodulační efekt bortezomibu, thalidomidu nebo lenalidomidu (9, 18). Do jaké míry je alogenní SCT prospěšná u pacientů s rizikovými genetickými abnormalitami vyžaduje rozsáhlejší analýzy a studie. Transplantace pacientů s myelomem by měly být prováděny pokud možno podle jasně definovaných postupů – ideálně na úrovni multicentrické spolupráce s širokou možností klinického i laboratorního výzkumu. Vzhledem k výsledkům naší analýzy a nedávno publikovaným zkušenostem považujeme za vhodné pokusit se navrhnout protokol léčby a laboratorního sledování s plánovaným využitím alogenní SCT v přesně definované indikaci u vybrané skupiny pacientů
MUDr. Samuel Vokurka, Ph.D.
Hematologicko-onkologické odd.
Fakultní nemocnice v Plzni
alej Svobody 80
304 60 Plzeň
Do redakce doručeno: 1. 7. 2009
Přijato: 15. 9. 2009
Sources
1. Kyle R, Rajkumar SV. Multiple myeloma. Blood 2008; 111 : 2962-2972.
2. Peréz-Simón JA, San Miguel J. HSCT for multiple myeloma in adults. In: The EBMT Handbook 5th Edition – Haematopoietic Stem Cell Transplantation (J. Apperley, E. Carreras, E. Gluckman, A. Gratwohl., T.Masszi – the editors), Forum Service Editore 2008, 415-423.
3. Tricot G, Vesole DH, Jagannath S, Hilton J, Munshi N, Barlogie B. Graft-versus-myeloma effect: proof of principle. Blood 1996; 87 : 1196-1198.
4. Le Blanc R, Montminy-Metivier S, Belanger R, et al. Allogeneic transplantation for multiple myeloma: further evidence for a GVHD-associated graft-versus-myeloma effect. Bone Marrow Transplant 2001; 28 : 841-848.
5. Durie BG, Harousseau JL, Miguel JS, et al. International uniform response criteria for multiple myeloma. Leukemia 2006; 20 : 1467-1473.
6. Filipovich AH, Weisdorf D, Pavletic S, et al. National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: I. Diagnosis and staging working group report. Biol Blood Marrow Transplant 2005; 11 : 945-956.
7. Devergie A. Graft versus host disease. In: The EBMT Handbook 5th Edition – Haematopoietic Stem Cell Transplantation (J. Apperley, E. Carreras, E. Gluckman, A. Gratwohl., T. Masszi – the editors), Forum Service Editore 2008, 219-234.
8. Glucksberg H, Storb R, Fefer A, et al. Clinical manifestations of graft-versus-host disease in human recipients of marrow from HL-A-matched sibling donors. Transplantation 1974; 18 : 295-304.
9. Bruno B, Rotta M, Patriarca F, et al. Nonmyeloablative allografting for newly diagnosed multiple myeloma: the experience of the Gruppo Italiano Trapianti di Midollo. Blood 2009; 113 : 3375-3382.
10. Garban F, Attal M, Michallet M, et al. for the Intergroupe Francophone du Myélome and the Swiss Group for Clinical Cancer Research. Prospective comparison of autologous stem cell transplantation followed by dose-reduced allograft (IFM99-03 trial) with tandem autologous stem cell transplantation (IFM99-04 trial) in high-risk de novo multiple myeloma. Blood 2006; 107 : 3474-3480.
11. Kröger N, Sayer H, Schwerdtfeger R, et al. Unrelated stem cell transplantation in multiple myeloma after a reduced-intensity conditioning with pretransplantation antithymocyte globulin is highly effective with low transplantation-related mortality. Blood 2002; 100 : 3919-3924.
12. Crawley Ch, Lalancette M, Szydlo R, et al. for the Chronic Leukaemia Working Party of the EBMT. Outcomes for reduced-intensity allogeneic transplantation for multiple myeloma: an analysis of prognostic factors from the Chronic Leukaemia Working Party of the EBMT. Blood 2005; 105 : 4532-4539.
13. Giralt S, Thall PF, Issa K, et al. Melphalan and purine analog-containing preparative regimens: reduced-intensity conditioning for patients with hematologic malignancies undergoing allogeneic progenitor cell transplantation. Blood 2001; 97 : 631-637.
14. Siegel S, Wagner A, Friedrichs B, et al. Identification of HLA-A*0201-Presented T Cell Epitopes Derived from the Oncofetal Antigen-Immature Laminin Receptor Protein in Patients with Hematological Malignancies J Immunol 2006; 176 : 6935-6944.
15. Costa LJ, Kumar S, Dispenzieri A, et al. Factors associated with favorable outcome after allogeneic hematopoietic stem cell transplantation for multiple myeloma. Leuk Lymphoma 2009; 50 : 781-787.
16. Hájek R, Adam Z, Maisnar V, et al. Diagnostika a léčba mnohočetného myelomu – doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí České hematologické společnosti a Slovenskou myelómovou spoločností pro diagnostiku a léčbu mnohočetného myelomu. Transfuze a Hematol dnes 2009; 15(Suppl. 2): 3-80.
17. Rotta M, Storer B, Sahebi F, et al. Long-term outcome of patients with multiple myeloma after autologous hematopoietic cell transplantation and nonmyeloablative allografting. Blood 2009; 113 : 3383-3391.
18. Gahrton G, Björkstrand B. Allogeneic transplantation in multiple myeloma. Haematologica 2008; 93 : 1295-1300.
19. Crawley Ch, Iacobelli S, Björkstrand B, Apperley J, Niederwieser D, Gahrton G. Reduced-intensity conditioning for myeloma: lower nonrelapse mortality but higher relapse rates compared with myeloablative conditioning. Blood 2007; 109 : 3588-3594.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2009 Issue 4-
All articles in this issue
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Analýza nemocných s myelodysplastickým syndromem (MDS) s delecí dlouhého ramene 5. chromozomu (del(5q), sledovaných Českou MDS pracovní skupinou. Význam pro diagnostické zařazení a určení prognózy
- Využitie sekundárnej profylaxie s rekombinantným aktivovaným faktorom VII u hemofílie A s inhibítorom: naše skúsenosti a prehľad literatúry
- Vrozené polycytemie
- Význam polymorfismu buněčné protinádorové imunity u pacientů s B-nehodgkinským lymfomem léčených rituximabem
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
- Alogenní transplantace krvetvorných buněk u pacientů s mnohočetným myelomem – zkušenosti centra
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vrozené polycytemie
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

