-
Medical journals
- Career
Burkittův lymfom: přehled patofyziologie, diagnostiky a terapie
: L. Šmardová 1; I. Vášová 1; M. Navrátil 1; Z. Křenová 2; D. Šálek 1; A. Marečková 1; L. Křen 3; K. Bolčák 4; J. Vorlíček 1; J. Mayer 1
: Interní hematoonkologická klinika Fakultní nemocnice Brno a lékařské fakulty Masarykovy univerzity, Brno, 2Klinika dětské onkologie Fakultní nemocnice Brno a lékařské fakulty Masarykovy univerzity, Brno, 3Ústav patologie Fakultní nemocnice Brno a lékařské 1
: Transfuze Hematol. dnes,14, 2008, No. 3, p. 131-139.
: Comprehensive Reports, Original Papers, Case Reports
Burkittův lymfom patří mezi rychle proliferující a vysoce agresivní zralá B lymfoproliferativní onemocnění s charakteristickou chromozomální translokací c-myc protoonkogenu. Klinicky se projevuje většinou extranodální lokalizací, s častým postižením gastrointestinálního traktu a obvykle velkou masou tumoru. Letos uplyne 50 let od okamžiku, kdy jako první popsal endemickou variantu tohoto lymfomu irský lékař Denis Burkitt u dětí ve východní Africe a jeho spolupráce s virologem Anthony Epsteinem vedla k průkazu virové etiologie tohoto lymfomu. Diagnostika Burkittova lymfomu vyžaduje rychlé zahájení léčby, která je v současné době založena na podávání intenzivních kombinovaných chemoterapeutických režimů. Součástí léčebných protokolů je vždy profylaxe postižení centrálního nervového systému kombinací vysokodávkovaného metotrexátu, cytosinarabinosidu a intrathekální aplikace cytostatik. Vzhledem k pravidelné CD20 pozitivitě nádorových buněk je kombinací cytostatik s monoklonální protilátkou rituximab dosahováno lepších léčebných výsledků. Burkittův lymfom dnes patří mezi potenciálně kurabilní onemocnění.
Klíčová slova:
Burkittův lymfom, virus Epstein-Barrové, molekulární biologie, c-myc, syndrom nádorového rozpadu, chemoterapieHistorie
V roce 1958 irský lékař Denis Burkitt poprvé popsal vzácně se vyskytující bolestivý tumor čelisti u malých dětí v zemích východní Afriky, vyznačující se rychlým růstem a způsobující úmrtí během několika málo měsíců (1). O dva roky později zjistili jeho kolegové Greg O’Conor a Jack Neville Davies, že se nejedná o sarkom, jak Burkitt původně předpokládal, ale o nádor lymfatického původu. Další systematickou prací Burkitta a O’Conora na území celé Afriky se ukázalo, že se nádor vyskytuje zejména v oblastech kolem rovníku mezi 15° severní a jižní šířky a v oblasti cípu táhnoucího se podél východního pobřeží kontinentu (tzv. lymphoma belt). Onemocnění popsali u dětí bez ohledu na jejich etnický původ nebo sociální příslušnost, avšak výhradně v oblastech o nadmořské výšce nižší než 1500 metrů nad mořem s teplotami neklesajícími pod 15 °C (2). Právě tato epidemiologická souvislost je přivedla k myšlence, že hojný výskyt komárů přenášejících v těchto oblastech malárii, pravděpodobně podporuje vznik tohoto nádoru. Spolupráce s anglickými virology Anthony Epsteinem a Yvonne Barrovou vedla nakonec k objevu nového viru, který byl označen za hlavního původce vzniku lymfomu (3).
Burkitt dlouho označoval svůj objev jako Africký lymfom, na mezinárodním setkání UNESCO v roce 1963 však padlo rozhodnutí nazvat jej Burkittův nádor po svém objeviteli (4).
Etiologie
Burkittův lymfom je považován za první lidské nádorové onemocnění, u kterého byla prokázána souvislost s virovou infekcí. Virus Epstein-Barrové (EBV), řazený mezi herpesviry, byl izolován ze vzorků tkáně u afrických pacientů poprvé v roce 1964 (3, 4). Později bylo zjištěno, že infekce EBV kausálně souvisí i s výskytem jiných typů nádorů (PTLD – lymfoproliferativní onemocnění po transplantaci, Hodgkinský lymfom nebo nasofaryngeální karcinom).
Infekce EBV hraje pravděpodobně zásadní roli v patogeneze endemické formy Burkittova lymfomu, protože virový genom byl nalezen téměř ve všech jeho nádorových buňkách. Předpokládá se přímá souvislost mezi výskytem malárie (Plasmodium falciparum) v endemických oblastech rovníkové Afriky a zvýšenou transformační schopností tohoto viru u infikovaných B lymfocytů.
U sporadických forem Burkittova lymfomu a forem asociovaných s imunodeficitem je frekvence souvislosti s EBV výrazně nižší (asi 30 %). Infekce EBV tedy pravděpodobně není jediným patogenetickým mechanismem vzniku při lymfomu, ale roli budou hrát i další faktory jako imunosuprese či další antigenní stimulace (5, 6).
Klasifikace a epidemiologie
Vývoj klasifikace Burkittova lymfomu následuje vývoj poznání lymfatické tkáně podobně jako u jiných lymfoproliferativních onemocnění. Jeho přehled uvádí tab. 1. V současné době stále platí poslední vydání WHO klasifikace z roku 2001 (6), která definuje klinické a morfologické varianty (viz. níže) Burkittova lymfomu. Z hlediska svého původu je řazen k lymfomům z buněk zárodečného (germinálního) centra společně se zralou B-akutní lymfoblastickou leukemií.
1. Vývoj klasifikace Burkittova lymfomu (synonyma). 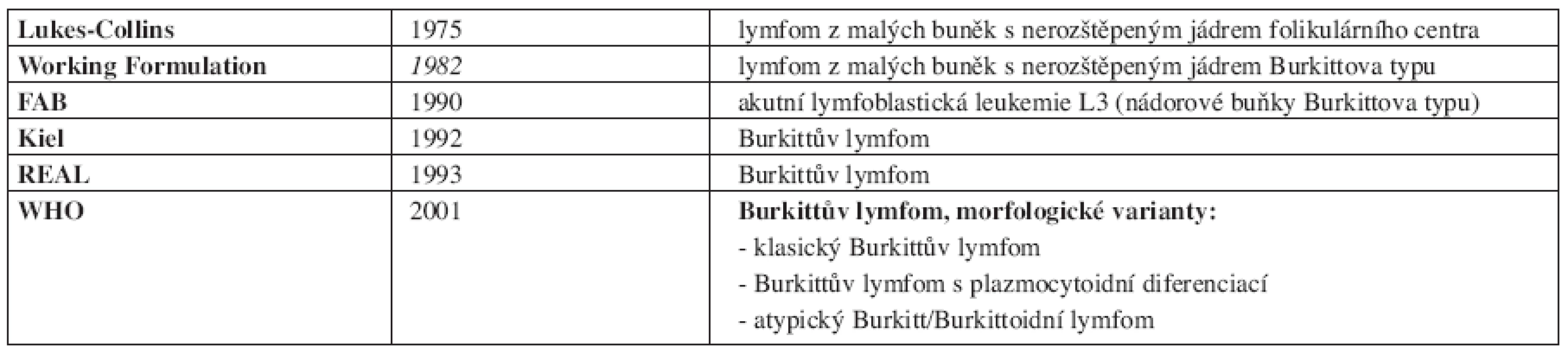
Každá z klinických variant Burkittova lymfomu se odlišuje od ostatních svojí morfologií, biologickým chováním a klinickou manifestací (tab. 2):
2. Přehled charakteristik jednotlivých klinických variant Burkittova lymfomu (5, 6). 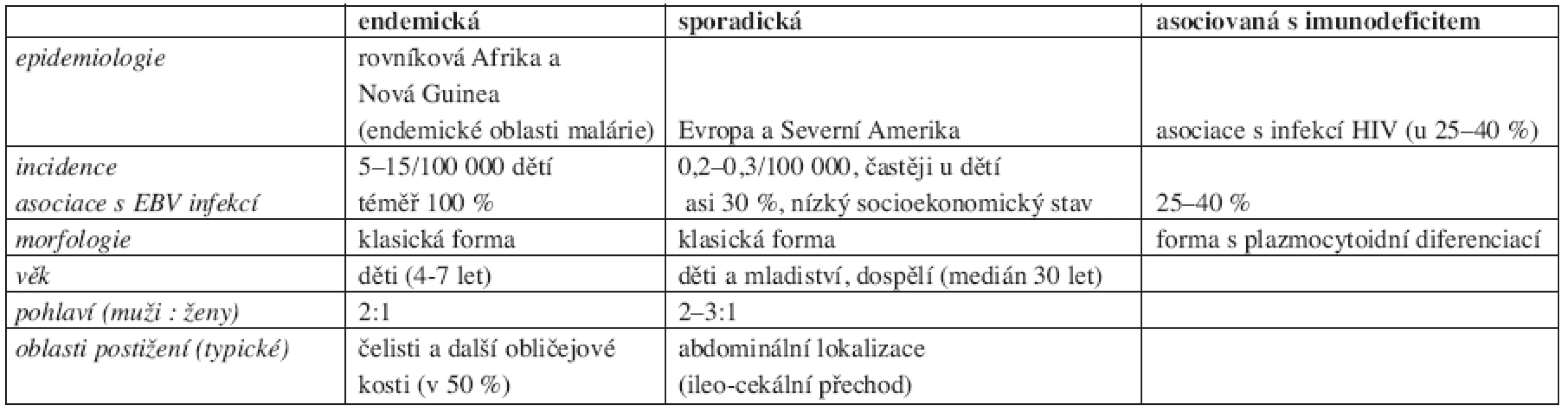
- endemický Burkittův lymfom
- sporadický Burkittův lymfom
- Burkittův lymfom asociovaný s imunodeficitem
Endemická forma související s infekcí EBV je častá v oblastech rovníkové Afriky a na Nové Guinei, kde její incidence dosahuje 5-15/100 000 dětí a kde také tvoří nejčastější dětské nádorové onemocnění. Tato forma se projevuje nejčastěji postižením čelistních kostí.
Sporadická forma se vyskytuje nejčastěji v Evropě a Severní Americe a její incidence zde činí 0,2-0,3/ /100 000 obyvatel. Zatímco u dětí představuje až 30–50 % všech nehodgkinských lymfomů, u dospělých pacientů jsou to pouhá 2,5 % (medián věku je 30 let s častějším výskytem u mužů než u žen – 2–3 : 1). Sporadická forma se obvykle projevuje mimouzlinovou lokalizací onemocnění. Někdy je onemocnění diagnostikováno v leukemizované formě, morfologicky shodné s L3 typem akutní lymfoblastické leukemie dle FAB klasifikace.
Forma Burkittova lymfomu asociovaná s imunodeficitem, nejčastěji s infekcí HIV, se objevuje často jako jeden z prvních příznaků AIDS. Časté je mimouzlinové postižení včetně infiltrace centrálního nervového systému.
Biologie
Burkittův lymfom patří mezi zralé B lymfomy, je typický svým agresivním průběhem a charakteristickou chromozomální přestavbou c-myc protoonkogenu. Zvýšená exprese tohoto genu, ke které dochází jeho připojením ke genům pro syntézu imunoglobulinů, přispívá k patogeneze Burkittova lymfomu narušením regulace buněčného cyklu, apoptózy a buněčné diferenciace.
1. Morfologie
Buňky Burkittova lymfomu jsou monomorfní, malé až středně velké, s bazofilní cytoplazmou a nápadně velkou proliferační frakcí (Ki-67 až 100 %) (6, 7). Častý je vzhled „hvězdného nebe“, který je dán přítomností velkých benigních makrofágů fagocytujících apoptotické nádorové buňky (obr. 1). Vedle této klasické formy rozeznává WHO klasifikace (2001) na základě morfologického obrazu ještě takzvaný variantní Burkittův lymfom. Tato atypická (neboli Burkitt-like) varianta se vyznačuje rovněž vysokou proliferační frakcí, vykazuje však větší pleomorfismus ve tvaru a počtu buněčných jader. Varianta Burkittova lymfomu s plazmocytoidní diferenciací se častěji nachází u dětí a je běžná u typů asociovaných s imunodeficitem.
1. Histopatologická diagnostika Burkittova lymfomu (materiál Interní hematoonkologické kliniky, zpracoval L. Křen, Ústav patologie FNB): (a) základní barvení hematoxylinem-eosinem, (b) imunohistochemický průkaz proliferačního faktoru Ki-67, (c) fluorescentní in situ hybridizace (FISH) – pozitivní translokace (8;14). 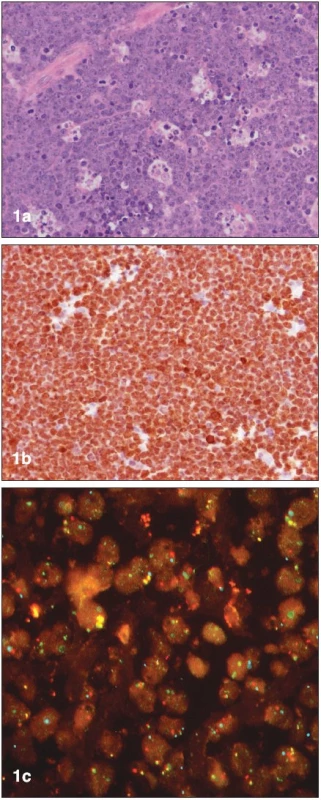
2. Imunofenotyp
Nádorové buňky exprimují membránový IgM, panB antigeny (CD19, CD20, CD22) a CD10, naopak chybí exprese CD5, CD23 a TdT (terminální deoxyribonukleotidyl transferáza). U plazmocytoidní varianty Burkittova lymfomu detekujeme intracytoplazmatický monoklonální imunoglobulin (6).
3. Cytogenetika
Pro Burkittův lymfom je charakteristická translokace c-myc protoonkogenu lokalizovaném na 8. chromozomu (8q24) (8, 9). Při typické chromozomální translokaci (obr. 2) je buněčný protoonkogen c-myc přemístěn na 14. chromozom (14q32), kde se dostává pod vliv aktivního promotoru genu pro těžký imunoglobulinový řetězec (IgH) – t(8;14). Historie objevu této translokace sahá do roku 1972 (10). O deset let později (11) byl na translokovaném lokusu 8. chromozomu nalezen protoonkogen myc a jeho přítomnost v místě zvýšené exprese imunoglobulinů u B lymfocytů upozornila na patogenezi nádorového zvratu (12).
2. Schéma charakteristické chromozomální translokace u Burkittova lymfomu. 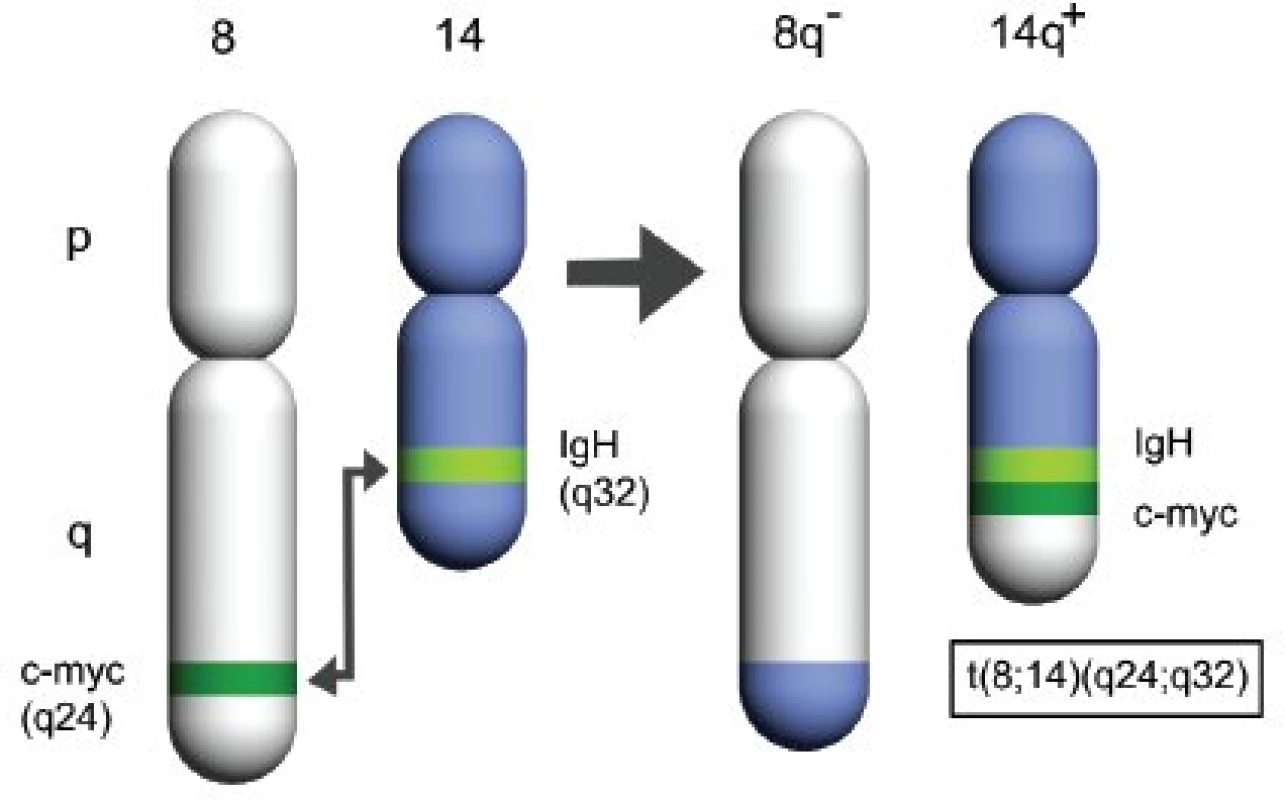
Typická varianta chromozomální aberace se nachází přibližně v 75 % případů Burkittova lymfomu, u zbylých přestaveb nacházíme zejména translokace t(2;8)(p12;q24) a t(8;22)(q24;q11), kde je c-myc přemístěn k promotoru genu pro kappa (resp. lambda) lehký řetězec imunoglobulinu. Stejné translokace se mohou vyskytovat také u atypických Burkittových lymfomů a v malém procentu (do 10 %) difuzních velkobuněčných B lymfomů a folikulárních lymfomů s vyšším gradingem vzniklých trasformací jejich nízce maligních variant (7).
Až u 65 % sporadických Burkittových lymfomů nacházíme další chromozomální abnormality, které jsou spojovány s horší prognózou (u dětí na chromozomu 13 a 22, u dospělých na chromozomu 17) (13, 14). K dalším častým genetickým změnám rovněž patří aberace nádorového supresoru p53. Některé práce naznačují, že právě vyřazení signální dráhy p14ARF-MDM2-p53 by mohlo představovat klíčový druhý zásah při vzniku Burkittova lymfomu a významný podíl případů skutečně nese bodovou mutaci v genu kódujícím nádorový supresor p53 nebo jiná poškození této dráhy (15).
4. Analýza genomu a DNA čipy (microarrays)
V posledním desetiletí se rychle rozvíjí technologie DNA čipů, která umožňuje současně studovat aktivitu tisíců různých genů a jejich produktů a může tak pomoci odlišit různé podtypy nádorových onemocnění s rozdílnou prognózou a odpovědí na léčbu. Na základě genové exprese byla též stanovena molekulární charakteristika („signatura“) Burkittova lymfomu (16). Charakteristický genový profil dále jednoznačně odlišuje Burkittův lymfom od difuzního velkobuněčného B lymfomu. Rozlišení těchto dvou typů lymfomů pomocí klinických, morfologických či cytogenetických hodnocení může být mnohdy obtížné a genová analýza může vést k přehodnocení konečné diagnózy až ve 30 % případů (17).
3. a. a b. Molekulárně biologická diagnostika Burkittova lymfomu – metoda long distance PCR (materiál Centra molekulární biologie a genové terapie Interní hematoonkologické kliniky, zpracovala A. Marečková). Metoda umožňuje detekovat nejčastější translokaci u Burkittova lymfomu t(8;14)(q24;q32). Diagnostika je založena na třech nezávislých PCR reakcích s jedním společným primerem navrženým do 2. exonu genu c-myc a třemi primery navrženými do konstantních oblastí Cα, Cμ a Cγ genu pro IgH. 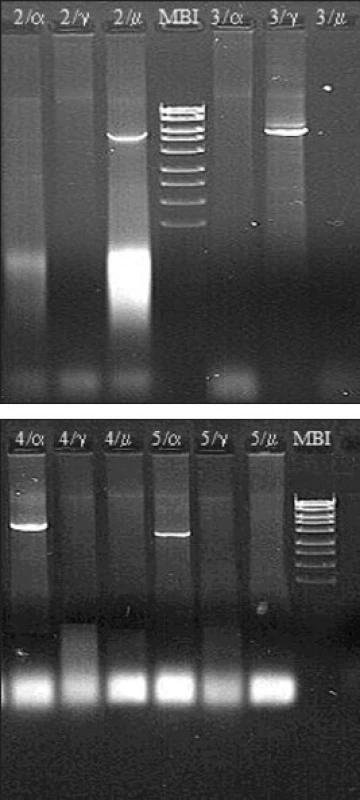
Diagnostika a určení klinického stadia
Diagnózu Burkittova lymfomu stanovíme na základě korelace histologického obrazu (typické morfologie s vysokou proliferační frakcí nádoru), imunofenotypizace a cytogenetického průkazu translokace t(8;14). Její pozitivita k definitivnímu uzavření diagnózy nestačí. Jak jsme již uvedli, může se vyskytovat také u jiných vysoce agresivních typů lymfomů.
Endemická forma Burkittova lymfomu se projevuje ve více než 50 % případů postižením čelistí nebo jiných obličejových kostí dětí. Sporadická forma tohoto lymfomu obvykle postihuje gastrointestinální trakt, nejčastěji terminální ileum a cékum, dále mesenterium či omentum a asi u 1/4 pacientů vytváří tumor hmatný v pravé jámě kyčelní. V těchto případech vyvolává různé symptomy jako jsou bolesti břicha, poruchy pasáže, nevolnost nebo zvracení. Nezřídka se onemocnění poprvé projeví známkami náhlé příhody břišní např. perforací tenkého nebo tlustého střeva či krvácením do zažívacího traktu. Vzácné nejsou ani další pro lymfomy méně typické lokality postižení jako jsou ledviny, vaječníky, děloha nebo prsy (18). Generalizovaná lymfadenopatie nebývá u tohoto typu lymfomu obvyklá. Postižení centrálního nervového systému je poměrně časté a nejčastěji se manifestuje ve formě leptomeningeální infiltrace, dále poškozením mozkových nervů nebo paraspinální infiltrací (19).
4. Diagnostika Burkittova lymfomu pomocí celotělové FDGPET (materiál Oddělení nukleární medicíny a PET, MOÚ, Brno, zpracoval K. Bolčák). Mnohočetná ložiska s enormně vysokým metabolismem glukózy (SUV 16-22) odpovídající vitální nádorové tkáni v dutině břišní, s maximem ventrálně (pravděpodobně na peritoneu) a ve středním hypogastriu, u pacienta s nově diagnostikovaným Burkittovým lymfomem. 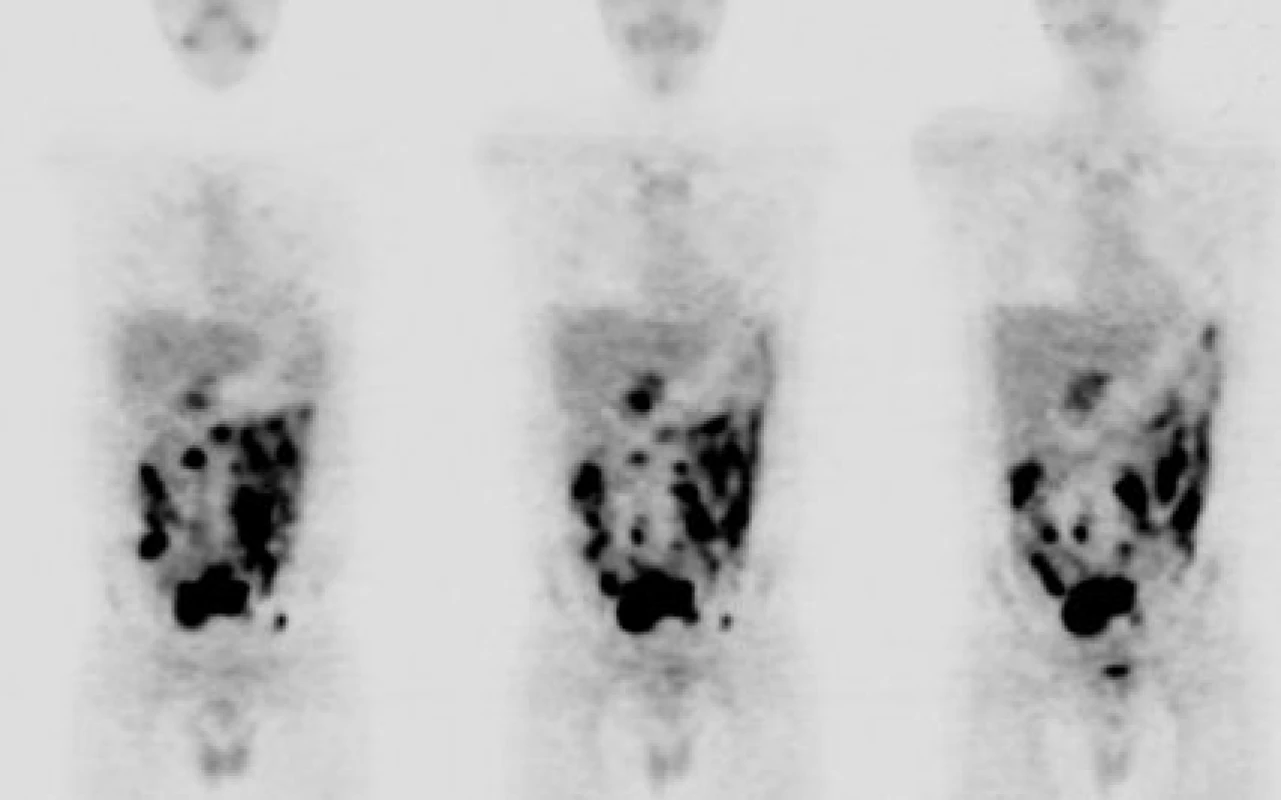
Kromě určení klinického stadia dle kritérií Ann Arbor uvádějí někteří autoři klasifikační systém užívaný pro maligní lymfomy v pediatrii – klasifikaci dle Murphyové (tab. 3) (20). Oba systémy se poněkud odlišují v hodnocení pokročilých stadií onemocnění. Doporučení diagnostických a stážovacích vyšetření pro Burkittův lymfom jsou uvedena v tabulce 4.
3. Klasifikace maligních lymfomů dle Sharon B. Murphyové (1980) (20). 
4. Diagnostická doporučení pro Burkittův lymfom podle National Comprehensive Cancer Network (verze 1.2007) (21). 
Léčba
Burkittův lymfom se od ostatních lymfomů odlišuje extrémně rychlým růstem a často velkou nádorovou masou, na druhou stranu však vysokou citlivostí k protinádorové léčbě. Právě vysoká chemosenzitivita je příčinou zvýšeného rizika vzniku syndromu nádorového rozpadu, který se typicky rozvíjí v prvních dnech zahájení protinádorové léčby, ale vyjímečně k němu může dojít i spontánně. Může provázet léčbu všech lymfomů s vysokou proliferační frakcí, poprvé však byl popsán Cohenem v roce 1980 právě u nemocných s Burkittovým lymfomem (22). Syndrom nádorového rozpadu vede často k akutnímu (oligoanurickému) ledvinnému selhání, které může vyústit v oběhový kolaps a poruchu vědomí, o to významnější je jeho včasná a důsledně prováděná prevence. Jejím základem je intenzivní intravenózní hydratace (podává se 4–6 litrů roztoků/24 hod.) s podporou diurézy a zamezení krystalizace kyseliny močové alkalizací moči a podáním alopurinolu či rasburikázy (rekombinantní urát-oxidázový enzym). Ve snaze o maximální odstranění uvolněných mediátorů z rozpadlých nádorových buněk jsou někdy vhodné kontinuální eliminační techniky (CVVH). Dalším preventivním opatřením je zahájení léčby podáním prefáze kortikosteroidů nebo jejich kombinace s cyklofosfamidem a to zvláště při vstupně velkém rozsahu nádoru.
Vzhledem k vysoké proliferační aktivitě Burkittova lymfomu by měla být léčba zahájena bezprostředně po stanovení diagnózy. Je diskutována také úvodní operace mající za cíl odstranit velkou část nádorových mas. Pokud je možné při diagnostickém zákroku odstranit současně větší masy tumoru („debulking“), je vhodné to provést. Operační výkon však nesmí svým rozsahem způsobit odklad zahájení léčby.
Léčba pacientů s Burkittovým lymfomem vyžaduje zcela odlišný přístup než u jiných zralých B lymfoproliferací nebo nádorů z prekurzorových buněk. Podobně jako u zralé B-akutní lymfoblastické leukemie (se společným původem z buněk zárodečného centra) je nutné podání vícedenních intenzivních kombinovaných režimů chemoterapie (23, 24, 25). Před zavedením intenzivních léčebných protokolů byly léčebné výsledky špatné a nemocní časně relabovali zejména v CNS. Nemocní s Burkittovým lymfomem mají až 30 % riziko postižení CNS kdykoliv v průběhu onemocnění, proto je nedílnou součástí indukční chemoterapie intrathekální profylaxe a většina léčebných protokolů zahrnuje vysokodávkovaný metotrexát a cytosinarabinosid (26).
V polovině 90. let byly publikovány výsledky několika studií, užívajících s úspěchem pro léčbu dospělých pacientů s Burkittovým lymfomem dětské terapeutické protokoly (27, 28, 29). Tyto režimy jsou založeny na intenzivním podání kombinace cytostatik v poměrně krátkých časových intervalech se snahou minimalizovat odklady léčby aplikací G-CSF a profylaxí postižení CNS (tab. 5).
5. Literární přehled chemoterapeutických protokolů používaných při léčbě dospělých pacientů s Burkittovým lymfomem (27, 28, 30, 31, 32, 33, 34, 35, 36). 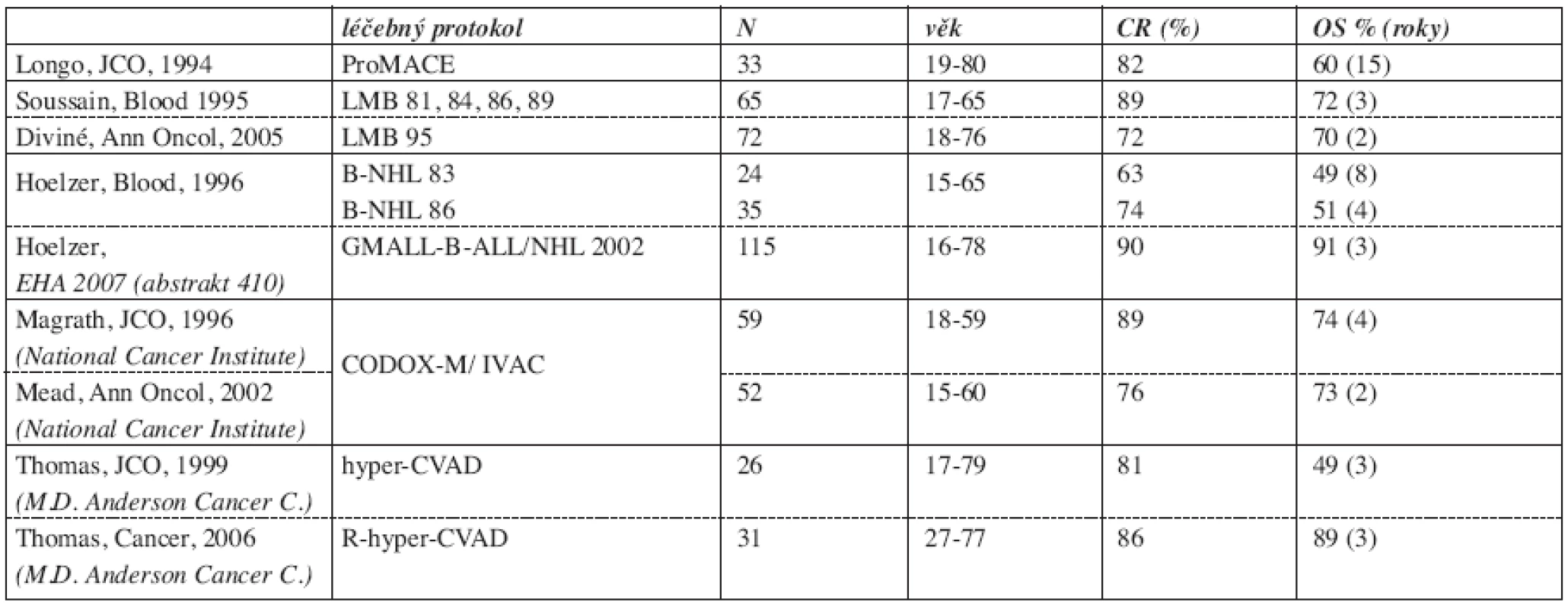
V současné době je jedním z nejpoužívanějších režimů pro léčbu dospělých nemocných protokol pocházející z National Cancer Instituce v Bethesdě (Magrath et al, 1996) (28), který je založen na stratifikaci nemocných do dvou skupin s nízkým a vysokým rizikem. Pacienti s kompletně resekovaným abdominálním tumorem nebo pouze jednou extraabdominální lokalizací postižení a současně normální hodnotu laktátdehydrogenázy byli zařazeni do nízce rizikové skupiny, všichni ostatní pacienti jsou považováni za vysoce rizikové. Nemocným s nízkým rizikem jsou podávány celkem 3 cykly kombinované chemoterapie modifikovaného režimu CODOX-M, zatímco vysoce riziková skupina nemocných je léčena celkem 4 cykly alternující chemoterapie CODOX-M a IVAC (schéma režimů v tab. 6), u všech pacientů je součástí léčby intrathekální aplikace cytosinarabinosidu a metotrexátu. EFS takto léčených dětských i dospělých pacientů dosahoval v původní studii 92 % ve 2letém mediánu sledování, bohužel však s vyšším výskytem hematologické, gastrointestinální a neurologické toxicity.
6. Léčebná doporučení pro Burkittův lymfom podle National Comprehensive Cancer Network (verze 1.2007) (21). 
Nadějné léčebné výsledky s tolerovatelnou toxicitou byly nedávno publikovány německými autory (Hoelzer et al., 2007) (33), kteří modifikovali původní protokol pro léčbu zralé B-akutní lymfoblastické leukemie (protokol B-NHL 90). Součástí léčebného protokolu je prefáze a dále 3 alternující bloky kombinované intenzivní chemoterapie, zahrnující vysokodávkovaný cytosinarabinosid a rituximab před každým léčebným blokem a v rámci udržovací léčby. Celkový počet kompletních remisí dosahoval 90 % a celkové přežití pro nemocné do 55 let je 91 % ve 3letém mediánu sledování. Významného snížení toxicity ve srovnání s jinými intenzivními režimy (zejména gastrointestinální) bylo dosaženo redukcí vysokodávkovaného methotrexátu.
Vzhledem k pravidelné CD20 pozitivitě nádorových buněk Burkittova lymfomu je monoklonální protilátka anti CD20 (rituximab) v současné době již pravidelnou součástí léčebných protokolů. Chemoimunoterapie zlepšuje léčebné výsledky zejména u starších nemocných, u kterých je obvykle intenzivní léčba hůře tolerována (36) a nemocných s imunodeficitem (HIV) (37).
V léčbě progresí nebo relapsů je používaná vysokodávkovaná chemoterapie s autologní nebo alogenní transplantací krvetvorných buněk (38). Dat o této problematice je však omezené množství a publikované soubory nemocných jsou velmi malé (39, 40). Vysokodávkovaná chemoterapie s autologní transplantací krvetvorných buněk je na některých pracovištích používána jako konsolidace první remise, při použití intenzivních pediatrických protokolů se však její použití nezdá být přínosné.
Prognóza a prediktivní faktory
Burkittův lymfom je i přes dramatický začátek, projevující se velmi rychle rostoucí masou nádoru, potenciálně kurabilním onemocněním. Zahájení léčby může být spojeno s rozvojem již zmíněného syndromu nádorového rozpadu, který může nemocného ohrožovat na životě. Diagnostika tohoto onemocnění a jeho včasná léčba by proto měla být soustředěna do center intenzivní hematologické péče, která jsou schopna zajistit veškerou podpůrnou péči.
Většina relapsů Burkittova lymfomu proběhne v 1. roce od stanovení diagnózy a nemocní v kompletní remisi, kteří do 2 let nezrelabují, mají velmi vysokou pravděpodobnost úplného vyléčení. Nepříznivými prognostickými faktory jsou podle většiny publikovaných souborů pokročilé klinické stadium (infiltrace kostní dřeně nebo CNS, neresekovatelný abdominální tumor větší než 10 cm) a zvýšená hodnota laktátdehydrogenázy. Intenzivní kombinované režimy chemoterapie dosahují léčebné odpovědi u více než 90 % pacientů v počátečním a u 60–80 % pacientů v pokročilém stadiu onemocnění (28, 29). Léčebné výsledky jsou lepší u dětských pacientů než u dospělých.
U nemocných, kteří dosáhli kompletní remise onemocnění, je doporučeno naplánovat dispenzární ambulantní kontroly první rok jednou za 2 měsíce, druhý rok jednou za 3 měsíce a poté každého půl roku (21).
Na závěr přehledu uvádíme případy pacientů léčených na Interní hematoonkologické klinice a Klinice dětské onkologie Fakultní nemocnice Brno, dokumentující některá úskalí diagnostiky a léčby Burkittova lymfomu.
Kazuistika č. 1
22letý mladý muž byl asi 4 měsíce ambulantně vyšetřován na okresním pracovišti pro zažívací obtíže. Pro výrazný hmotnostní úbytek a melénu byl nakonec hospitalizován na chirurgickém oddělení a zobrazovacími vyšetřeními zjištěn rozsáhlý tumor v dutině břišní s infiltrací žaludku, tenkého střeva a retroperitoneálních uzlin. Z bio - psie získané probatorní laparoskopií byla stanovena diagnóza Burkittova lymfomu a byla zahájena kortikoterapie. Vzhledem k extrémnímu rozsahu onemocnění a vysoké proliferační frakci nádoru došlo po podání kortiko-steroidů k rozvoji syndromu nádorového rozpadu s akutním renálním selháním, metabolickou acidózou a rozvratem vnitřního prostředí. Rychle následovala porucha vědomí s Kussmaulovým dýcháním vyžadující napojení pacienta na řízenou ventilaci.
Pacient byl v kritickém stavu převezen na oddělení JIP naší kliniky, kde byla zahájena plná léčba akutního renálního selhání včetně kontinuální eliminační metody (CVVH). Po jeho zvládnutí jsme přikročili k zahájení léčby podáním chemoterapie CODOX-M v redukovaných dávkách vzhledem ke kritickému stavu pacienta s extrémní nádorovou kachexií. Zavedena kombinovaná nutriční podpora enterálně nasogastrickou sondou i parenterálně do centrální žíly, ale výrazná malnutrice znemožňuje pokus o odpojení z řízené ventilace. Období dřeňového útlumu po chemoterapii bylo dále komplikováno rozvojem těžké oboustranné mykotické bronchopneumonie. Postupně se však stav pacienta zlepšuje, daří se zrušit tracheostomii a pacient začíná rehabilitovat chůzí v chodítku.
Během pokračující antimikrobiální léčby a nezbytné nutriční podpory však dochází k rychlé progresi základního onemocnění, objevují se nové infiltráty na hrudní stěně a opět i v dutině břišní. I přes komplikovaný dosavadní průběh onemocnění byla podána chemoterapie IVAC v plných dávkách, kterou pacient toleruje bez obtíží a vzhledem k rodinnému zázemí je možné propuštění do domácího ošetřování.
Za několik dní po propuštění byl pacient přivezen rodinou pro zjevnou další progresi základního onemocnění, s oboustrannými pleurálními výpotky, rozsáhlým kožním postižením a hmatným tumorem v dutině břišní. Ne-příznivý průběh chemorezistentního Burkittova lymfomu u mladého muže se již nepodařilo zvrátit a pacient na progresi onemocnění bohužel umírá.
I přes léčbu intezivními kombinovanými režimy chemoterapie je prognóza primárně rezistentního Burkittova lymfomu bohužel infaustní. Podcení-li se nezbytná podpůrná opatření v úvodu léčby, může dojít k syndromu nádorového rozpadu se závažnými následky pro pacienta, které vyžadují intenzivní metabolickou péči a které mohou negativně ovlivnit i jeho další léčebný průběh. Na léčebném výsledku se jistě spolupodílel i pokročilý rozsah onemocnění, ke kterému přispěla pomalá diagnostika v úvodu pacientových obtíží a odklady léčebných cyklů s redukcí dávek cytostatik vynucené infekčními komplikacemi.
Kazuistika č. 2
53letý pacient se dostavil ke své praktické lékařce s asi dvouměsíční anamnézou zažívacích obtíží, zejména nechutenství a tlaku v oblasti žaludku. Byl odeslán ke gastroskopickému vyšetření, kde byla nalezena rozsáhlá infiltrace žaludku, ale opakovaně provedené biopsie byly bohužel histologicky nevýtěžné. Na CT vyšetření břicha byly kromě infiltrované stěny žaludku prokázány zvětšené perigastrické a paraaortální lymfatické uzliny a i přes pokročilý nález byla indikovaná diagnostická laparotomie. Ze vzorku paragastrické tumorózní tkáně byla překvapivě stanovena diagnózu difuzního velkobuněčného B lymfomu s výraznou mitotickou aktivitou (Ki-67 pozitivní u více než 90 % buněk).
V pooperačním období dochází u pacienta k náhlému rozvoji spontánního tumor lysis syndromu, proto bylo přikročeno za zvýšené podpůrné péče k zahájení léčby chemoterapií CHOP (cyklofosfamid, adriamycin, vincristin a prednison). Pacient se po jeho podání klinicky zlepšil, došlo k postupné normalizaci renálních funkcí, zhojila se pooperační rána na břiše a pacient mohl být propuštěn do domácí péče.
V termínu podání dalšího cyklu chemoterapie však přichází s asymetrickým poklesem ústního koutku a očního víčka vlevo, vyšetřením mozkomíšního moku byla prokázána leptomeningeální infiltrace CNS maligními lymfomovými buňkami. Vzhledem ke klinickému průběhu, zejména rozsáhlé lokalizaci nádorové masy v dutině břišní, infiltraci CNS a vysoké proliferační frakci nádoru se vstupní spontánní tumorlýzou, bylo zažádáno o přehodnocení imunohistochemie a doplnění FISH na translokaci t(8;14) ze vstupního vzorku tkáně. Pozitivní výsledek translokace ve všech vyšetřovaných buňkách podporuje diagnózu Burkittova lymfomu.
Pacient s ohledem na přehodnocení diagnózy a klinické stadium dokončil léčbu celkem 2 cykly chemoterapie CODOX-M a 2 cykly chemoterapie IVAC (alternativně) společně s rituximabem a včetně intrathekální aplikace cytostatik. Průběh léčby byl komplikován opakovanými závažnými infekčními epizodami během těžkých dřeňových útlumů po chemoterapii (bakteriální gramnegativní sepse a invazivní plicní aspergilóza) vyžadující odklad podání dalšího léčebného cyklu a těžkou malnutricí hmotnostní úbytek více než 20 kg). Klinický stav pacienta se po ukončení léčby postupně opět zcela upravil, zlepšila se fyzická výkonnost i nutriční stav. Kontrolní CT vyšetření včetně FDG-PET dokumentují dosažení kompletní remise onemocnění, která nyní trvá déle než 1 rok.
V uvedené kazuistice jsme chtěli poukázat na obtížnou diagnostiku Burkittova lymfomu postihujícího gastrointestinální trakt, která si mnohdy vyžaduje provedení operačního výkonu. Odlišení pokročilého difuzního velkobuněčného B lymfomu a Burkittova lymfomu nemusí být na základě našich klinických zkušeností vždy jednoznačné. Nezbytnou součástí diagnostiky je proto cytogenetické a molekulární genetické vyšetření, slibnou metodou do budoucna je analýza genomu technologií DNA čipů.
Kazuistika č. 3
4letý chlapec s asi týdenní anamnézou postupně narůstající spavosti a otoků víček byl zprvu vyšetřován pro tyto potíže v okresní nemocnici a pro nález edému papil +2D na očním pozadí byl indikován k provedení CT mozku. Výsledek vyšetření popisuje tumor selly a perisellárních struktur se známkami osteolýzy kosti klínové a vyslovuje podezření na kraniopharyngeom. Chlapec je převezen na Kliniku dětské onkologie v Brně. Doplněné NMR vyšetření upřesňuje rozsah tumorózního postižení o nález intranazálního šíření tumoru a infiltraci oro - a nasopharyngu. Indikována je endonazálně vedená operační biopsie, jejíž součástí je předoperační substituce narušené sekrece kortizolu a substituce centrální hypothyreózy. Histologické vyšetření nakonec stanovuje diagnózu Burkittova lymfomu, s pozitivní translokací t(8;14) a stoprocentní mitotickou buněčnou aktivitou (Ki-67 100 %).
Léčba je zahájena dle německého pediatrického protokolu NHL BFM-95 (Non-Hodgkin Lymphoma, Berlín – Frankfurt - Münster) (41). Sestává z prefáze a celkem 6 bloků intenzivní chemoterapie kombinující dexametazon, vincristin/vindesin, vysokodávkovaný cytosinarabinosid, vepesid, doxorubicin, cyklofosfamid/ ifosfamid, a vysokodávkovaný metotrexát. Vzhledem k množství plánovaných intratekálních aplikací cytostatik byl pacientovi zaveden do levé postranní mozkové komory Ommaya reservoár. Průběh léčby je po každém bloku chemoterapie komplikován febrilní neutropenií, z nichž poslední vyžaduje extrakci infikovaného Ommaya reservoáru.
Přešetření po ukončení terapie konstatuje dosažení kompletní remise onemocnění, kontrolní NMR vyšetření popisuje normální morfologii mozku i mozečku. Při poslední plánované kontrole na ambulanci Kliniky dětské onkologie je dnes 7letý chlapec subjektivně bez potíží, vstupní lokalizace onemocnění si však vyžaduje doživotní substituci hormonů štítné žlázy a hydrokortizonu.
MUDr. Lenka Šmardová
Interní hematoonkologická klinika
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: lsmardova@fnbrno.cz
Došlo do redakce: 11. 3. 2008
Přijato: 6. 5. 2008
Sources
1. Burkitt D. A sarcoma involving the jaws in African children. Br J Surg 1958; 46(197): 218–223.
2. Burkitt D. Determining the climatic limitations of a children’s cancer common in Africa. Br Med J 1962; 2(5311): 1019–1023.
3. Epstein MA, Achong BG, Barr YM. Virus particles in cultured lymphoblasts from Burkitt’s lymphoma. Lancet 1964; 1 : 702–703.
4. Coakley D. Denis Burkitt and his contribution to haematology/oncology. Br J Haematol 2006; 135 : 17–25.
5. Kelly GL, Rickinson AB. Burkitt lymphoma: revisiting the pathogenesis of a virus-associated malignancy. Haematol 2007; 2007 : 277–284.
6. Diebold J, Jaffe ES, Raphael M. Burkitt lymphoma. In: Jaffe ES, Harris NL, Stein H, et al. World Health Organization Classification of Tumours. Pathology and genetics of tumours of haematopoietic and lymphoid tissues. IARC Press, Lyon 2001; 181–184.
7. Troxell ML, Bangs CD, Cherry AM, et al. Cytologic diagnosis of Burkitt lymphoma. Cancer 2005; 105(5): 310–318.
8. Stein H, Hummel M. Burkitt’s and Burkitt-like lymphoma. Molecular definition and value of the World Health Organisation’s diagnostic criteria. Pathologe 2007; 28(1): 41–45.
9. Cogliatti SB, Novak U, Henz S, et al. Diagnosis of Burkitt lymphoma in due time: a practical approach. Br J Haematol 2006; 134 : 294–301.
10. Manolov G, Manolova Y. Marker band in one chromosome 14 from Burkitt lymphomas. Nature 1972; 237(5349): 33–44.
11. Zech L, Haglund U, Nilsson K, et al. Characteristic chromosomal abnormalities in biopsies and lymphoid-cell lines from patients with Burkitt and non-Burkitt lymphomas. Int J Cancer 1976; 17(1): 47–56.
12. Dalla-Favera R, Bregni M, Erikson J, et al. Human c-myc onc gene is located on the region of chromosome 8 that is translocated in Burkitt lymphoma cells. Proc Natl Acad Sci USA 1982; 79(24): 7824–7827.
13. Onciu M, Schlette E, Zhou Y, et al. Secondary chromosomal abnormalities predict outcome in pediatric and adult high-stage Burkitt lymphoma. Cancer 2006; 107(5): 1084–1092.
14. Macpherson N, Lesack D, Klasa R, et al. Small noncleaved, non-Burkitt’s (Burkitt like) lymphoma: Cytogenetics predicts outcome and reflect clinical presentation. J Clin Oncol 1999; 17(5): 1558–1567.
15. Wilda M, Bruch J, Nardet L, et al. Inactivation of the ARF-MDM-2-p53 pathway in sporadic Burkitt’s lymphoma in children. Leukemia 2004; 18 : 584-588.
16. Hummel M, Bentink S, Berger H, et al. A biologic definition of Burkitt’s lymphoma from transcriptional and genomic profiling. N Engl J Med 2006; 354(23): 2419–2430.
17. Dave SS, Fu K, Wright GW, et al. Molecular diagnosis of Burkitt’s lymphoma. N Engl J Med 2006; 354(23): 2431–2442.
18. Keller C, Savage DG, Rusta-Villa M, et al. Primary Burkitt lymphoma of the uterine corpus. Leuk Lymphoma 2006; 47(1): 141–5.
19. Ferry JA. Burkitt’s lymphoma: clinicopathologic features and differential diagnosis. Oncologist 2006; 11(4): 375–383.
20. Murphy SB. Classification, staging and end results of treatment of childhood non-Hodgkin’s lymphomas: dissimilarities from lymphoma in adults. Semin Oncol 1980; 7 : 322–329.
21. National Comprehensive Cancer Network, Practice guidelines in Oncology, version 3.2007.
22. Cohen LF, Balow JE, Magrath IT, et al. Acute tumor lysis syndrome. A review of 37 patients with Burkitt’s lymphoma. Am J Med 1980; 68 : 486–491.
23. Belada D, Trněný M, et al. Diagnostické a léčebné postupy u nemocných s maligními lymfomy II. 3. vyd. Praha, 2007; 33–35.
24. Yustein JT, Dang V. Biology and treatment of Burkitt’s lymphoma. Curr Opin Hematol 2007; 14 : 375–381.
25. Blum KA, Lozanski G, Byrd JC. Adult Burkitt leukemia and lymphoma. Blood 2004; 104(10): 3009–3020.
26. Magrath IT, Haddy TB, Adde MA. Treatment of patients with high grade non-Hodgkin’s lymphomas and central nervous system involvement: is radiation an essential component of therapy? Leuk Lymphoma 1996; 21(1–2): 99–105.
27. Soussain C, Patte C, Ostronoff M, et al. Small noncleaved cell lymphoma and leukemia in adults: a retrospective study of 65 adults treated with the LMB pediatric protocols. Blood 1995; 85(3): 664–674.
28. Magrath I, Adde M, Shad A, et al. Adults and children with small non-cleaved-cell lymphoma have a similar excellent outcome when treated with the same chemotherapy regimen. J Clin Oncol 1996; 14(3): 925–934.
29. Todeschini G, Tecchio C, Degani D, et al. Eighty-one percent event-free survival in advanced Burkitt’s lymphoma/leukemia: no differences in outcome between pediatric and adult patients treated with the same intensive pediatric protocol. Ann Oncol 1997; 8 (Suppl 1): 77–81.
30. Longo DL, Duffey PL, Jaffe ES, et al. Diffuse small noncleaved-cell, non-Burkitt’s lymphoma in adults: a high-grade lymphoma responsive to ProMACE-based combination chemotherapy. J Clin Oncol 1994; 12(10): 2153–2159.
31. Diviné M, Casassus P, Koscielny S, et al. Burkitt lymphoma in adults: a prospective study of 72 patients treated with an adapted pediatric LMB protocol. Ann Oncol 2005; 16(12): 1928–1935.
32. Hoelzer D, Ludwig WD, Thiel E, et al. Improved outcome in adult B-cell acute lymphoblastic leukemia. Blood 1996; 87(2): 495–508.
33. Hoelzer D, Hiddemann W, Baumann A, et al. High cure rate of adult Burkitt’s and other high grade NHL by the combination of short intensive chemotherapy cycles with rituximab. Haematologica 2007; 92(S1): 151.
34. Mead GM, Sydes MR, Walewski J, et al. An international evaluation of CODOX-M and CODOX-M alternating with IVAC in adult Burkitt’s lymphoma: results of United Kingdom Lymphoma Group LY06 study. Ann Oncol 2002; 13(8): 1264–1274.
35. Thomas DA, Cortes J, O’Brien S, et al. Hyper-CVAD program in Burkitt’s-type adult acute lymphoblastic leukemia. J Clin Oncol 1999; 17(8): 2461–2470.
36. Thomas DA, Faderl S, O’Brien S, et al. Chemoimmunotherapy with hyper-CVAD plus rituximab for the treatment of adult Burkitt and Burkitt-type lymphoma or acute lymphoblastic leukemia. Cancer 2006; 106(7): 1569–1580.
37. Boué F, Gabarre J, Gisselbrecht C, et al. Phase II trial of CHOP plus rituximab in patients with HIV-associated non-Hodgkin’s lymphoma. J Clin Oncol 2006; 24(25): 4123–4128.
38. Sweetenham JW, Pearce R, Taghipour G, et al. Adult Burkitt’s and Burkitt-like non-Hodgkin’s lymphoma - outcome for patients treated with high-dose therapy and autologous stem-cell transplantation in first remission or at relapse: results from the European Group for Blood and Marrow Transplantation. J Clin Oncol 1996; 14(9): 2465–2472.
39. Imhoff GW, Holt B, MacKenzie MA, et al. Short intensive sequential therapy followed by autologous stem cell transplantation in adult Burkitt, Burkitt-like and lymphoblastic lymphoma. Leukemia 2005; 19(6): 945–952.
40. Song KW, Barnett MJ, Gascoyne RD, et al. Haematopoietic stem cell transplantation as primary therapy of sporadic adult Burkitt lymphoma. Br J Haematol 2006; 133(6): 634–637.
41. Woessmann W, Seidemann K, Mann G, et al. The impact of the methotrexate administration schedule and dose in the treatment of children and adolescents with B-cell neoplasms: a report of the BFM Group Study NHL-BFM95. Blood 2005; 105(3): 948–958.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2008 Issue 3-
All articles in this issue
- Third consecutive national study ALL-BFM 95 improved the outcome of acute lymphoblastic leukemia in children in the Czech Republic
- The role of positron emission tomography and combined positron emission tomography with computed tomography in staging and response assessment in patients with non-Hodgkin’s lymphoma
- Revision of criteria for the diagnosis and evaluation of response to therapy in multiple myeloma
- Minimal residual disease in chronic lymphocytic leukemia: methods of assessment and clinical significance
- Burkitt’s lymphoma: pathophysiology, diagnostics and treatment
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Burkitt’s lymphoma: pathophysiology, diagnostics and treatment
- Third consecutive national study ALL-BFM 95 improved the outcome of acute lymphoblastic leukemia in children in the Czech Republic
- The role of positron emission tomography and combined positron emission tomography with computed tomography in staging and response assessment in patients with non-Hodgkin’s lymphoma
- Minimal residual disease in chronic lymphocytic leukemia: methods of assessment and clinical significance
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

