-
Medical journals
- Career
Kontroly správné výrobní praxe v krevních bankách
: R. Zimová 1; S. Jansová 1; J. Masopust 2
: Státní ústav pro kontrolu léčiv, Praha, 2Transfuzní oddělení, Krajská zdravotní, a. s. – Masarykova nemocnice v Ústí nad Labem, o. z. 1
: Transfuze Hematol. dnes,14, 2008, No. 2, p. 86-89.
: Comprehensive Reports, Original Papers, Case Reports
Podmínky správné výrobní praxe zakotvené v legislativě ČR jsou povinné i pro krevní banky. U 51 zdravotnických zařízení, provozujících krevní banku provedl v letech 2005–2007 Státní ústav pro kontrolu léčiv kontrolu dodržování podmínek správné výrobní praxe. Byly zjištěny četné nedostatky v oblasti personální práce, provozování prostor a zařízení, řízené dokumentace, skladování a přepravy transfuzních přípravků, předtransfuzních imunohematologických vyšetření, smluvních činností a reklamací a stahování transfuzních přípravků. Příčinou nedostatků může být určitá setrvačnost procesů, nedostatečná informovanost, ale také neochota vedení zdravotnických zařízení do činnosti krevní banky investovat. Chybějí také metodická opatření či standardy v rámci ČR. Nové povinnosti pro krevní banky přináší zákon č. 378/2007 Sb. Je předpoklad, že většina nedostatků bude při následných kontrolách SÚKL odstraněna a že zapracování požadavků nové legislativy bude probíhat pružněji a odpovědněji než doposud. Další vývoj pravděpodobně povede k větší centralizaci krevních bank.
Klíčová slova:
krevní banka, Státní ústav pro kontrolu léčiv, správná výrobní praxe, legislativaÚvod
Správná výrobní praxe (SVP) je již více než 10 let pevně zakotvena v činnosti výrobců transfuzních přípravků – zařízení transfuzní služby (ZTS). Její naplňování v ZTS je také dlouhodobě sledováno při kontrolách Státního ústavu pro kontrolu léčiv (SÚKL). Až do roku 2004, kdy vstoupila v platnost vyhláška č. 411/2004 Sb., kterou se stanoví správná výrobní praxe, správná distribuční praxe a bližší podmínky povolování výroby a distribuce léčiv, včetně medikovaných krmiv a veterinárních autogenních vakcín, změn vydaných povolení, jakož i bližší podmínky vydávání povolení k činnosti kontrolních laboratoří (dále jen „vyhláška č. 411/2004 Sb.“) (1), se krevním bankám, provozovaným zdravotnickými zařízeními (ZZ), kontroly SVP vyhýbaly.
Autoři se v tomto článku zabývají zaváděním kontrol SVP v krevních bankách, jejich výsledky a dalším možným vývojem.
Soubor a metody
Na základě dotazníků rozeslaných zdravotnickým zařízením v rámci České republiky bylo k 1. 12. 2007 potvrzeno 55 ZZ provozujících krevní banku, z toho 4 ZZ krevní banku zrušila. U 51 ZZ, která provozují krevní banku, byla v letech 2005–2007 provedena kontrola dodržování podmínek SVP. Kontrola byla zaměřena na 7 základních oblastí SVP definovaných vyhláškou č. 411/2004 Sb.: pracovníky, prostory a zařízení, předpisovou a záznamovou dokumentaci, skladování a přepravu transfuzních přípravků, imunohematologická před-transfuzní vyšetření, zabezpečení činností prováděných na základě smlouvy a postupy při reklamacích a stahování transfuzních přípravků (tab. 1).
1. Rozsah kontroly – kapitoly. 
Výsledky
V kapitole Pracovníci nebyla písemně daná odpovědnost za činnost krevní banky a nebyly vypracovány aktuální náplně práce s definovanými odpovědnostmi a zástupy u 35 kontrolovaných ZZ (69 %). Ve 22 ZZ (43 %) neměli pracovníci vykonávající činnost spojenou s výdejem transfuzních přípravků písemné pověření k výdeji transfuzních přípravků. V 18 ZZ (35 %) nebylo vypracováno organizační schéma znázorňující hierarchickou strukturu. Ve 30 ZZ (59 %) nebylo provedeno školení platné legislativy, týkající se činnosti krevní banky. U 10 kontrolovaných ZZ (20 %) nebyl zaveden systém průběžného vzdělávání pracovníků a u 13 ZZ (25 %) nebyly vedeny záznamy o provedených školeních.
V kapitole Prostory a zařízení nebyl v 15 případech (29 %) zajištěn vhodný prostor pro skladování transfuzních přípravků, ve 21 případech (41 %) nebyly pro kontrolu skladovací teploty používány kalibrované teploměry nebo nebyly doloženy kalibrační listy. U 13 ZZ (25 %) nebyla zařízení pro skladování termolabilních přípravků vybavena alarmem při překročení limitů teploty, naopak v 15 případech (29 %), kdy krevní banka byla vybavena alarmem, nebyla prováděna či zaznamenávána kontrola funkčnosti alarmu. V 16 ZZ (31 %) nebyly vedeny záznamy o pravidelné údržbě, kontrole a sanitaci nebo poruchách skladovacích zařízení. Ve 22 případech (43 %) nebyla provedena kvalifikace mrazicích zařízení s ověřením rovnoměrného rozložení teplot v celém skladovacím prostoru (teplotní mapa).
V kapitole Dokumentace nebyl zaveden systém řízené dokumentace (písemný postup pro řízení dokumentů, rozdělovník, revize) ve 22 ZZ (43 %). Ve 24 ZZ (47 %) nebyl vypracován dokument pro archivaci záznamové dokumentace a/nebo nebyla provedena aktualizace archivačního řádu podle nové legislativy. 13 ZZ (25 %) nemělo k dispozici informace pro lékaře o vydávaných transfuzních přípravcích (informační materiál o transfuzních přípravcích). 22 ZZ (43 %) nemělo vypracováno dostatečné standardní operační postupy (SOP) pro příjem, skladování a výdej transfuzních přípravků. 20 ZZ (39 %) nevypracovalo písemný postup pro opatření při nedodržení předepsané teploty. V 10 případech (20 %) nebyla určena osoba odpovědná za řízení dokumentace a její aktualizaci.
V kapitole Skladování a přeprava byly také zjištěny opakující se nedostatky. V 10 ZZ (20 %) nebyl k dispozici písemný záznam o tom, kdo přijal a vydal transfuzní přípravek. Ve 23 ZZ (45 %) nebyl proveden písemný záznam o provedení kontroly transfuzních přípravků při příjmu nebo výdeji a/nebo nebyla zaznamenána teplota a čas při příjmu transfuzních přípravků na sklad. Ve 20 případech (39 %) nebyl proveden záznam o době přepravy transfuzních přípravků a/nebo nebyl stanoven limit trvání přepravy transfuzních přípravků. 16 ZZ (31 %) neprovedlo validaci přepravy transfuzních přípravků.
Smluvní činnosti související s činností krevní banky – jedná se hlavně o zajištění přepravy transfuzních přípravků – 32 ZZ (63 %) nezadává (přeprava transfuzních přípravků do krevní banky je zajišťována dodavatelem nebo vlastní dopravou). V případě smluvního vztahu nebyla u 4 ZZ vypracována písemná smlouva definující závazky a odpovědnosti obou stran v souvislosti s dodržením skladovacích podmínek i během transportu transfuzních přípravků a u 6 ZZ nebyli smluvní řidiči proškoleni v souvislosti s přepravou léčiv.
V kapitole Imunohematologická vyšetření bylo 11x (21 %) zjištěno, že nejsou vypracovány specifikace pro používaná diagnostika a/nebo nebyl zaveden systém propouštění diagnostik. Ve 28 ZZ (55 %) nebylo zajištěno uložení diagnostik v chladicím zařízení s teplotou kontrolovanou kalibrovaným teploměrem. V 19 případech (37 %) nebylo v záznamové dokumentaci uváděno kompletní číslo transfuzního přípravku (chybělo předčíslí výrobce a roku).
Postup pro reklamace, stahování a řešení závad v jakosti včetně hlášení dodavateli transfuzních přípravků nebyl vypracován v 26 případech (51 %).
Výsledky jsou shrnuty v tabulkách 2a, 2b.
2. a. Zjištění z provedených kontrol (nalezená u 10 a více ZZ). b. Zjištění z provedených kontrol (nalezená u 10 a více ZZ). 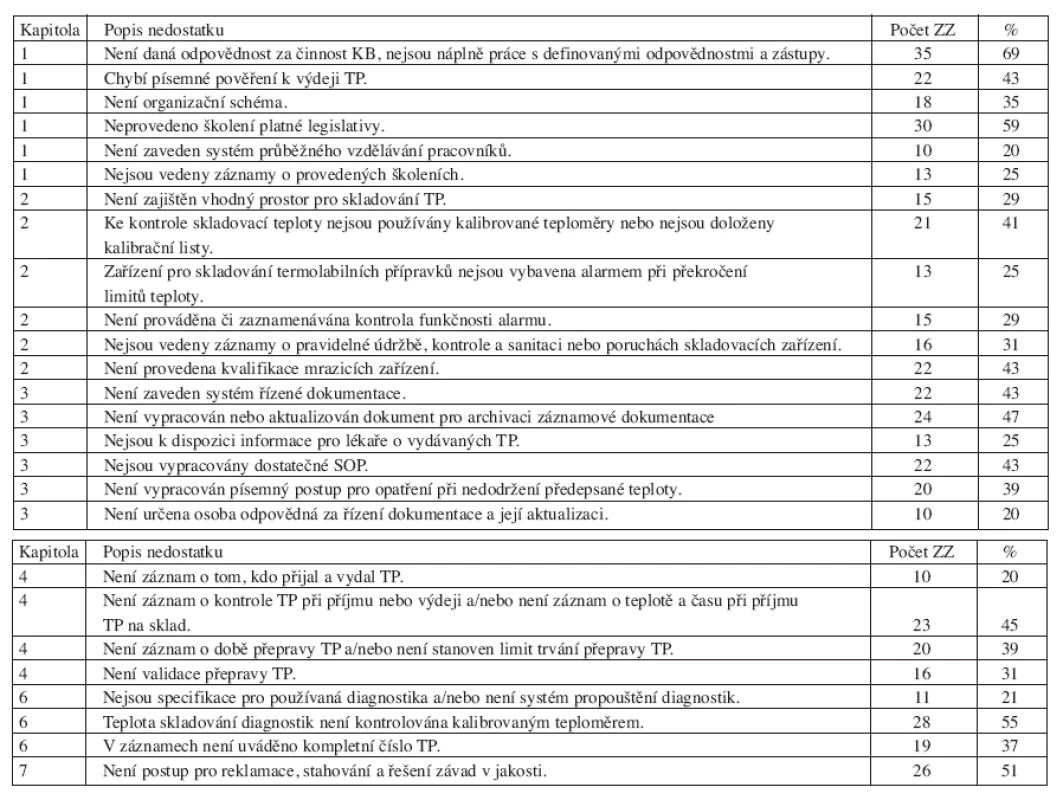
Zkratky: KB = krevní banka; TP = transfuzní přípravky; SOP = standardní operační postupy Diskuse
Krevní banka je definována jako organizační jednotka ZZ, ve které se skladují a vydávají transfuzní přípravky, a to výlučně pro použití ve zdravotnickém zařízení, popřípadě ve které se provádí předtransfuzní imunohematologické vyšetření (2). V mnoha ZZ zabezpečuje funkce krevní banky příslušné ZTS. Přestože budování systému SVP a jeho kontrola probíhaly v ZTS již od druhé poloviny devadesátých let, pro krevní banky nebyly podmínky SVP jednoznačně definovány a tudíž ani kontrolovány, ačkoliv byly a jsou nedílnou součástí transfuzního řetězce a svou činností mohou významně ovlivnit kvalitu transfuzních přípravků a tím následně i účinnost a bezpečnost vlastní hemoterapie.
V souvislosti s nabytím účinnosti vyhlášky č. 411/2004 Sb. vyplynula pro ZZ provozující krevní banku povinnost zajistit podle § 35 odst. 8 této vyhlášky soulad s SVP zejména při skladování, přepravě a vedení dokumentace.
Výsledky kontrol SÚKL ukázaly na poměrně vysokou nepřipravenost těchto ZZ splňovat podmínky SVP v oblastech jim daných z výše uvedené vyhlášky. Úroveň SVP v jednotlivých krevních bankách je velmi odlišná – od zjevné neznalosti pravidel SVP a příslušných předpisů až po vysokou úroveň dodržování pravidel SVP. V některých krevních bankách byla v době kontroly používána stará nevyhovující chladicí a mrazicí zařízení bez kontinuálního záznamu teplot, bez kalibrovaného teploměru a bez alarmu při překročení limitu teploty, tato zařízení byla umístěna na chodbách, často neměla ani potřebnou kapacitu. Skladové hospodaření bylo ve většině krevních bank vedeno v záznamových knihách, nebyly používány elektronické záznamy a čtečky čárových kódů, což přináší zvýšené riziko administrativních chyb. Krevní banka byla v některých případech průchozím místem i pro jiné zaměstnance než pro pracovníky krevní banky. Příčinou může být určitá setrvačnost nastavených procesů, nedostatečná informovanost, ale také neochota vedení ZZ investovat do skladovacích zařízení, software a stavebních úprav z důvodu malých množství skladovaných transfuzních přípravků.
Mnohé činnosti, jejichž nezajišťování v některých ZZ kontroly SÚKL odhalily, jsou běžnou součástí systémů řízení jakosti (ISO) a podmínek pro akreditaci ZZ. Proto překvapuje více než 50% zjištění chybějících náplní práce s definovanými odpovědnostmi a zástupy, nekontrolovaného či nesprávně kontrolovaného uchovávání diagnostik a vysoké procento nezavedení řízené dokumentace a postupů pro archivaci dokumentace a chybějící provozní deníky ke skladovacím zařízením. Zcela zásadní chybou, naštěstí méně častou, je chybění písemného záznamu o tom, kdo z pracovníků krevní banky přijal a kdo vydal transfuzní přípravek.
Potěšitelné je, že krevní banky kontrolované později, stejně tak i nově vzniklá zařízení, již vykazovaly lepší úroveň SVP, což se dá přisoudit především předávání informací z již kontrolovaných krevních bank a včasným odstraněním případných nedostatků SVP.
Krevní banky, často rozsahem své činnosti velmi malé, bývají součástí konsolidovaných laboratoří, jejichž hlavní náplní je laboratorní testování pro klinické účely. Personál obvykle není specializovaný, musí obsáhnout přednostně laboratorní činnosti z oboru biochemie a hematologie, případně dalších a je jen málo znalý SVP. Proto je nezbytná kvalitní předpisová dokumentace, propracovaný systém kontinuálního proškolování a erudovaný odpovědný vedoucí pracovník.
V menších ZZ chybějí pracoviště zajišťující metrologické služby, management jakosti, sledování a implementaci nových právních předpisů.
Na částečnou obranu pracovníků krevních bank je třeba říci, že chybějí podrobnější popisy některých činností krevní banky například ve formě metodických opatření či standardů v rámci ČR.
Provozování krevní banky znamená pro vedení ZZ zhodnocení nákladů a prospěchu, zhodnocení dalšího směrování ZZ v oblasti léčebné či následné péče, případné dostupnosti jiného ZZ provozujícího krevní banku či ZTS.
Nové povinnosti pro provozovatele ZZ, jehož součástí je krevní banka, přináší zákon č. 378/2007 Sb. (zákon o léčivech) (2). Podle § 68 odst. 1 je provozovatel povinen zajistit splnění požadavků na systém jakosti a správnou výrobní praxi, zahrnující zejména školení pracovníků, zabezpečení řízení dokumentace a udržování materiálních podmínek provozu, zajistit oznamování odběrateli transfuzního přípravku dodatečně zjištěné skutečnosti, které mohou být příčinou závažné nežádoucí reakce nebo jsou hodnoceny jako závažná nežádoucí událost nebo podezření na závažnou nežádoucí událost a jestliže je příjemce vystaven riziku ohrožení zdraví z již podaného transfuzního přípravku, zajistit sledovatelnost údajů o přijatých, vydaných a nepoužitých transfuzních přípravcích, zajistit potřebné podmínky skladování a přepravy transfuzních přípravků, zajistit služby kvalifikované osoby krevní banky, nejpozději do 15 dnů oznámit SÚKL zahájení a ukončení činnosti krevní banky, která je jeho součástí. Tyto povinnosti, rozpracované v nové prováděcí vyhlášce, budou předmětem kontrol SÚKL v dalších letech.
Závěr
Správná výrobní praxe je nedílnou součástí činnosti krevních bank. Její požadavky jsou definovány v legislativě ČR. Během kontrol prováděných SÚKL v letech 2005–2007 bylo zjištěno poměrně velké množství nedostatků. Jednalo se však o úvodní kontrolu SVP v těchto ZZ a první setkání pracovníků a někdy i ředitelů ZZ s pracovníky Státního ústavu pro kontrolu léčiv a požadavky příslušné legislativy. Je předpoklad, že většina nedostatků bude při následných kontrolách SÚKL již odstraněna a že zapracování požadavků nové legislativy bude probíhat pružněji a odpovědněji než doposud. Tlak na personální a přístrojové vybavení ovlivňující ekonomiku provozu, může vést k zániku některých krevních bank a k centralizaci jejich činností běžnou v mnoha vyspělých zemích.
Došlo do redakce: 18. 3. 2008
Přijato: 9. 4. 2008
MUDr. Renata Zimová
Inspekční odbor
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
e-mail: renata.zimova@sukl.cz
Sources
1. Vyhláška č. 411/2004 Sb., kterou se stanoví správná výrobní praxe, správná distribuční praxe a bližší podmínky povolování výroby a distribuce léčiv, včetně medikovaných krmiv a veterinárních autogenních vakcín, změn vydaných povolení, jakož i bližší podmínky vydávání povolení k činnosti kontrolních laboratoří (dále jen „Vyhláška 411/2004 Sb.“).
2. Zákon č. 378/2007 Sb. Zákon o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech). Sbírka zákonů, Česká republika, částka 115 ze dne 31. 12. 2007.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2008 Issue 2-
All articles in this issue
- Current view of the rituximab maintenance in follicular lymphoma
- Good manufacture practice controls in blood banks
- Transient hepatitis
- Potential of histone deacetylase inhibitors (HDACi) in the treatment of paediatric TEL/AML1–positive acute lymphoblastic leukaemia
- Advances in treatment of Ph-positive adult acute lymphoblastic leukaemia
- Essential thrombocythaemia in children
- An analysis of acute leukemia records in the National Oncology Registry (1997-2002) compared with the data in the acute leukemia clinical registry (ALERT) and the data from literature
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Essential thrombocythaemia in children
- Transient hepatitis
- Good manufacture practice controls in blood banks
- Advances in treatment of Ph-positive adult acute lymphoblastic leukaemia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

