-
Medical journals
- Career
Akútna mezenterická ischémia – stále aktuálny problém
Authors: M. Kunychka; J. Váňa; M. Žáček; M. Chromčiková
Authors‘ workplace: Chirurgia, Fakultná nemocnica s poliklinikou Žilina, Slovenská republika
Published in: Rozhl. Chir., 2023, roč. 102, č. 6, s. 228-235.
Category: Review
doi: https://doi.org/10.33699/PIS.2023.102.6.228–235Overview
Akútna mezenterická ischémia je ochorenie s pomerne nízkou incidenciou (0,02–0,9 % akútnych chirurgických hospitalizácií), ale veľmi vysokou mortalitou, ktorá bez včasnej revaskularizácie môže dosahovať až 100 %. Vzhľadom na vyššie uvedené, promptná, exaktná diagnostika a nasledujúca chirurgická intervencia je základným kameňom liečby a je nevyhnutná na zníženie vysokej úmrtnosti. Včasná revaskularizácia môže znížiť celkovú mortalitu až o 50 %. Liečba akútnej mezenterickej ischémie si vyžaduje spoluprácu gastrointestinálnych chirurgov, angiochirurgov a intervenčných rádiológov. Dôkladné klinické vyšetrenie, kontrastná počítačová tomografia realizovaná vo včasnom štádiu a súčasné možnosti intervenčnej rádiológie sú kľúčom k zlepšeniu výsledkov liečby akútnej mezenterickej ischémie. Touto prácou preto chceme oživiť vedomosti v problematike manažmentu akútnej mezenterickej ischémie a zosumarizovať najaktuálnejšie informácie o diagnostike a liečbe tohto ochorenia.
Klíčová slova:
akútna mezenterická ischémia – mezenterická arteriálna embólia – neokluzívna mezentrická ischémia – mezenterická venózna trombóza – okluzívna mezenterická ischémia
ÚVOD
Akútna mezenterická ischémia (AMI) napriek pokrokom v medicíne ostáva výzvou pre klinikov. Vzhľadom na prevažujúce postihnutie pacientov vo vysokom veku a nešpecifické prejavy, verifikácia ischémie je vo väčšine prípadov už oneskorená, čo vedie k vysokej mortalite. Diagnostické spektrum akútneho brucha je teda veľmi odlišné u 50-ročného pacienta v porovnaní s 80-ročným [1]. Rýchla diagnostika za použitia súčasných možnosti diagnostiky a liečby je nevyhnutná na zníženie úmrtnosti, ktorá presahuje 50 % [2]. Vyriešenie problému v priebehu prvých 6 hodín od nástupu klinických symptómov je charakterizované ešte pomerne nízkou mortalitou do 10–20 %. Pri pretrvaní ischémie viac ako 24 hod sa mortalita blíži už k 100 % [3]. Z tohto je jasné, že AMI je život ohrozujúci stav, ktorý si vyžaduje urgentnú liečbu, a preto musí byť diagnostikovaný čo najskôr. Kľúčom k včasnej diagnóze je vysoká klinická úroveň podozrenia a urgentná intervencia podľa aktuálnych štandardov, na čo aj je zameraná táto publikácia.
Schéma 1: Klasifikácia AMI Diagram 1: Classification of AMI 
Mezenteriálna cirkulácia a patofyziológia AMI
Splanchnická cirkulácia zahŕňa makroa mikrovaskulárnu perfúziu. Makrovaskulárna sa skladá z troch hlavných artérií, a to truncus celiacus (TC), arteria mesenterica superior (AMS), arteria mesenterica inferior (AMI) a početných kolaterál [4].
V kľude prijíma splanchnická cirkulácia približne 25 % srdcového výdaju, zatiaľ čo v postprandiálnom stave si vyžaduje ďalších 10 %. TC, AMS a AMI majú priemer 6, 7 a 1 mm, takže oklúzia AMI by znížila celkový mezenteriálny obeh iba o 4 %, zatiaľ čo stenóza TC a AMS – o 70 % a 87 % respektíve. Preto sa všeobecne považuje AMS za najdôležitejšiu z mezenterických artérií pri okluzívnej mezenterickej ischémii. Mikrovaskulárna perfúzia zahŕňa väčšie tepny na seróznej strane, veľké siete ciev vo vonkajších vrstvách (submukóznej, svalovéj a seróznej vrstve) a centrálnu arteriolu s okolitými venulami. Pri vysokých metabolických požiadavkách sliznica dostáva viac ako 2/3 prietoku krvi čreva. Na mikroskopickej úrovni kapilárna sieť v submukóze zabezpečuje prekrvenie klkov a mikroklkov čreva, čo je metabolicky najviac aktívna vrstva. Do tejto siete patria aj anastomózy pri báze klkov, ktoré umožňujú presmerovanie prietoku krvi preč zo sliznice, čo vedie k ischemickej nekróze sliznice, ale so zachovaním celistvosti čreva, čo môže byť život zachraňujúce. Tento adaptívny princíp je známy ako protiprúdový mechanizmus [4]. Pri ischémii poškodenie začína od sliznice a rozširuje sa smerom k seróze, a preto poškodenie svalovej a seróznej vrstvy je neskorým javom pri ťažkej ischémii. Vzhľadom na vyššie uvedené, detekcia ischémie sliznice by mala byť stredobodom včasnej diagnostiky [5]. Vďaka vazodilatácii kolaterálneho obehu a zvýšenej extrakcii kyslíka môže črevo kompenzovať do 75 % redukcie mezenteriálneho obehu po dobu do 12 hodín bez výrazného poškodenia [6].
Epidemiológia AMI
Mezenterická ischémia predstavuje 0,1 % všetkých akútnych hospitalizácií. Napriek tomu, že ide o zriedkavý zdravotný stav, má vysokú úmrtnosť v rozmedzí od 24 % do 94 % [6]. Hlavnými etiologickými faktormi mezenterickej ischémie sú arteriálna embólia (50 %), arteriálna trombóza (15 až 25 %), venózna trombóza (5 %) a neokluzívna mezenterická ischémia v dôsledku črevnej hypoperfúzie (20 až 30 %). Výskyt AMI sa zvyšuje exponenciálne s vekom. U pacientov vo veku 75 rokov alebo starších je AMI častejšou príčinou akútneho brucha ako apendicitída. Výskyt AMI u 80-ročného človeka je zhruba desaťnásobne vyšší ako u 60-ročného pacienta. AMI bola opísaná aj u pacientov so závažnou infekciou vírusom SARS-CoV-2, kde pravdepodobne bola spojená s hyperkoagulabilitou a poruchou fibrinolýzy [2]. AMI je menej častou trombotickou komplikáciou u pacientov s infekciou covid-19 a je opísaná len v niekoľkých kazuistikách, ale má vysokú morbiditu a mortalitu [7]. Viac ako 20 % embólií AMS je spojených so súbežnou embóliou do iného arteriálneho riečiska vrátane sleziny a obličky [2]. Mezenteriálna arteriálna trombóza bola druhou najčastejšou príčinou mezenterickej ischémie, ktorá historicky predstavovala 20–35 % a nedávno sa zvýšila na 40 %. Neokluzívna mezenterická ischémia (NOMI) predstavuje 25 % prípadov, čo sa tiež zvyšuje v porovnaní s historickou kohortou, predpokladá sa, že z dôvodu zvýšeného počtu kriticky chorých pacientov a celkového zlepšenia intenzívnej starostlivosti. Napriek tomu mechanizmus je stále neznámy. Ako rizikové faktory sa uvádza zlyhanie srdca, zlyhanie obličiek, kardiochirurgické výkony s použitím kardiopulmonálneho bypassu a použitie katecholamínov [2].
Klasifikácia
Podľa etiologického faktora AMI môže byť embolického alebo trombotického pôvodu, neokluzívna pri NOMI alebo prípadne spôsobená venóznou trombózou (MVT) (Schéma 1) [8]. V závislosti od úrovne postihnutia AMS, praktické využitie by mohla mať aj Fullensova klasifikácia, kde sa uvádza aj predpokladaná úroveň oklúzie a rozsah ischémie čreva (zatiaľ je táto klasifikácia využívaná pri traumatických poškodeniach AMS) [9].
Klinika
Klinický obraz akútnej ischémie čreva je veľmi nešpecifický. Ale prvá vec, ktorá by nás mala upozorniť na možnosť ischémie čreva, je silná náhle vzniknutá difúzna bolesť brucha, ktorá nezodpovedá klinickému nálezu na bruchu, obzvlášť u pacientov nad 60 rokov (95–97 %). Ďalšími, menej častými známkami, sú nauzea (44 %), vomitus (35 %), diarrhea (35 %), krv pri rektálnom vyšetrení (12–48 %). Vzhľadom na nešpecifické prejavy a fakt, že AMI je život ohrozujúci stav – v podobných situáciách v prvom rade musíme myslieť na mezenterickú ischémiu, až kým to nevylúčime, čo bolo konsenzuálne stanovené aj v guidelinoch Svetovej spoločnosti urgentnej chirurgie (WSES) s poslednou aktualizáciou v roku 2022 (gr.1A) [2].
Diagnostika
Laboratórne nástroje včasnej diagnostiky AMI
Laboratórne testy v súčasnosti nie sú dostatočne špecifické na to, aby presne diagnostikovali ischémiu alebo aby sa ochorenie vylúčilo. Väčšinou sa klinici spoliehajú na konvenčné nešpecifické biologické markery trombózy, zápalu, hypoxie, infekcie a niektorých ďalších parametrov. Hoci laboratórne parametre nie sú dostatočne presné, môžu pomôcť v diferenciálnej diagnostike. Viac ako 90 % pacientov bude mať abnormálne zvýšené leukocyty. Druhý najčastejšie sa vyskytujúci abnormálny nález je metabolická acidóza so zvýšeným laktátom (88 %). Zvýšený laktát v sére >2 mmol/l je spojený s ireverzibilnými zmenami čreva. Najdôležitejšie je, že lekári by si mali byť vedomí diagnostických úskalí, s ktorými sa môžu stretnúť pri mezenterickej ischémii, ako je zvýšenie troponínu I, pankreatických amyláz a normálny plazmatický laktát, čo môže lekára odviesť od správnej diagnózy [4]. D-dimér sa uvádza ako nezávislý rizikový faktor ischémie čreva, odrážajúci prebiehajúcu tvorbu zrazeniny a endogénnej degradácie prostredníctvom fibrinolýzy [10]. Vysoká citlivosť, ktorá sa blíži k 100 %, z neho robí vynikajúci vylučovací test, ale limitom je to, že mnohé ďalšie stavy sú spojené s vysokými hodnotami D-diméru. Citlivosť v sériách s akútnou oklúziou AMS vrátane pacientov s MVT, NOMI sa uvádza takmer 95 % [4]. V posledných desaťročiach sa objavilo aj niekoľko sľubných biomarkerov, vrátane proteínu viažuceho intestinálne mastné kyseliny (I-FABP), a-glutatión-S-transferázy (a-GST), La D-laktátu, citrulínu, ischémiou modifikovaného albumínu, prokalcitonínu (PCT). Tieto markery sú perspektívne z ohľadu na to, že sú zamerané na verifikáciu ischémie sliznice, a to znamená, že by mohli byť markermi včasnej diagnostiky ešte v reverzibilnom štádiu ischémie, ale zatiaľ sú v štádiu skúmania [5]. Napríklad v rade prác stanovenie I-FABP ukázalo pomerne vysokú senzitivitu okolo 80 % a špecificitu 95 %, ale ďalšie práce nie sú také optimistické [11].
Inštrumentálna diagnostika
Duplexný ultrazvuk (DUS) nie je pre svoje limitujúce faktory vhodnou zobrazovacou metódou na hodnotenie akútnych okluzívnych lézií viscerálnych ciev. RTG má nízku informatívnosť a zmeny sú väčšinou zaznamenané v prípade ireverzibilných zmien. Obyčajné röntgenové snímky brucha sú relatívne nešpecifické a môžu byť úplne normálne u viac ako 25 % pacientov [8]. Kedysi bola zlatým štandardom diagnostiky digitálna subtrakčná angiografia (DSA), ale v súčasnosti je vyhradená už iba pre pacientov, ktorí môžu profitovať z endovaskulárnej intervencie. Metódou voľby momentálne je 3-fázické CT brucha, vzhľadom na pomerne dobrú dostupnosť, vysokú informatívnosť a možnosť aj diferenciálnej diagnostiky. Podľa guidelinov WSES a European Society for Vascular Surgery (ESVS) pri podozrení na AMI by v čo najkratšom termíne malo byť realizované 3-fázické CT brucha bez per os kontrastu. V prípade prítomnosti renálnej insuficiencie CT nie je kontraindikované, nakoľko diagnostický benefit CT vyšetrenia je výrazne väčší ako zhoršenie funkcie obličiek.
V uvedenej tabuli sú znázornené CT známky ischémie čreva (Tab. 1) a CT obrázky z nášho súboru pacientov s potvrdenou AMI (Obr. 1–5).
Image 1. Trombóza TC a AMS Fig. 1: TC and AMS thrombosis 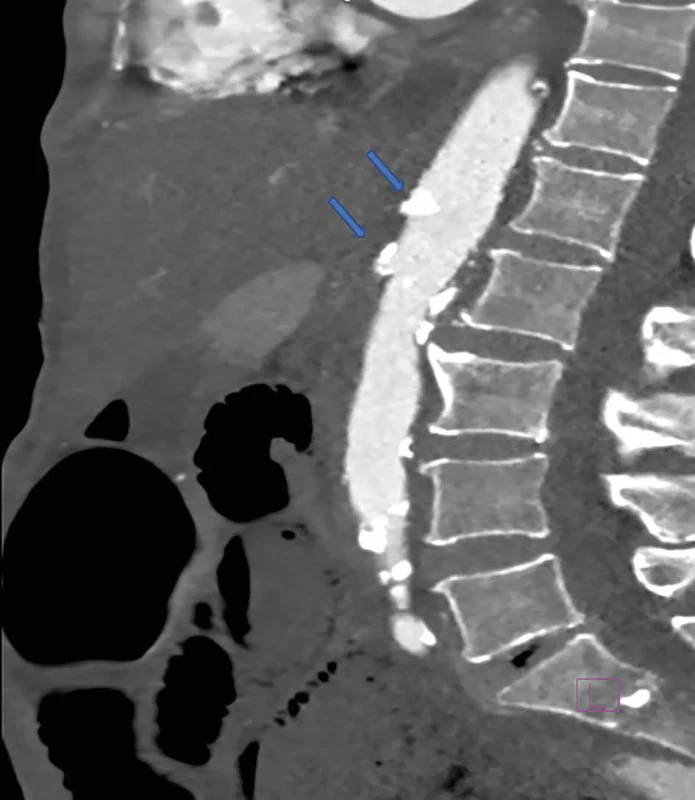
Image 2. Trombóza VMS a VP Fig. 2: SMV and PV thrombosis 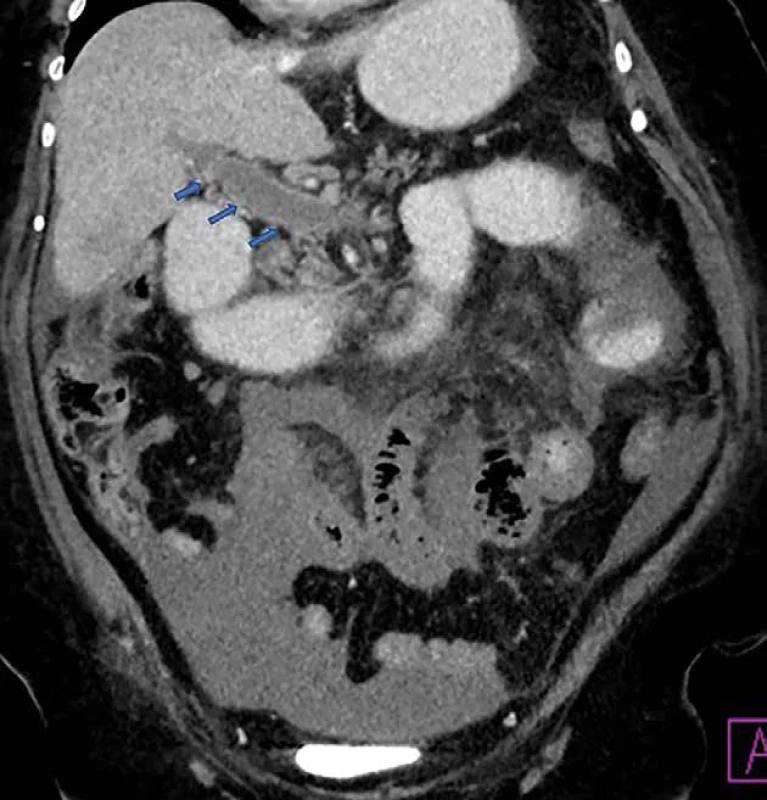
Image 3. Pneumatóza steny čreva Fig. 3: Pneumatosis of the intestinal wall 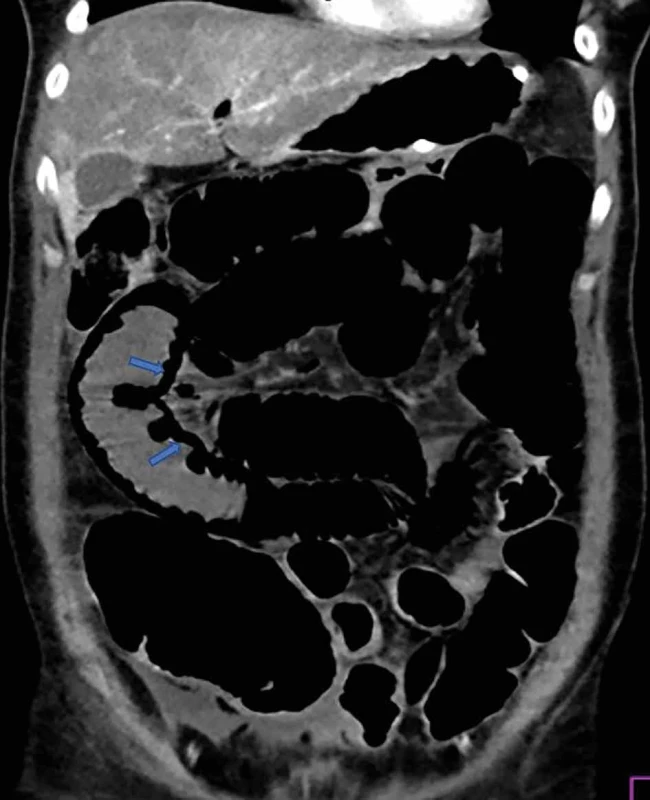
Image 4. Zhrubnutie čreva a mezentéria – MVT Fig. 4: Thickening of the intestine and mesentery – MVT 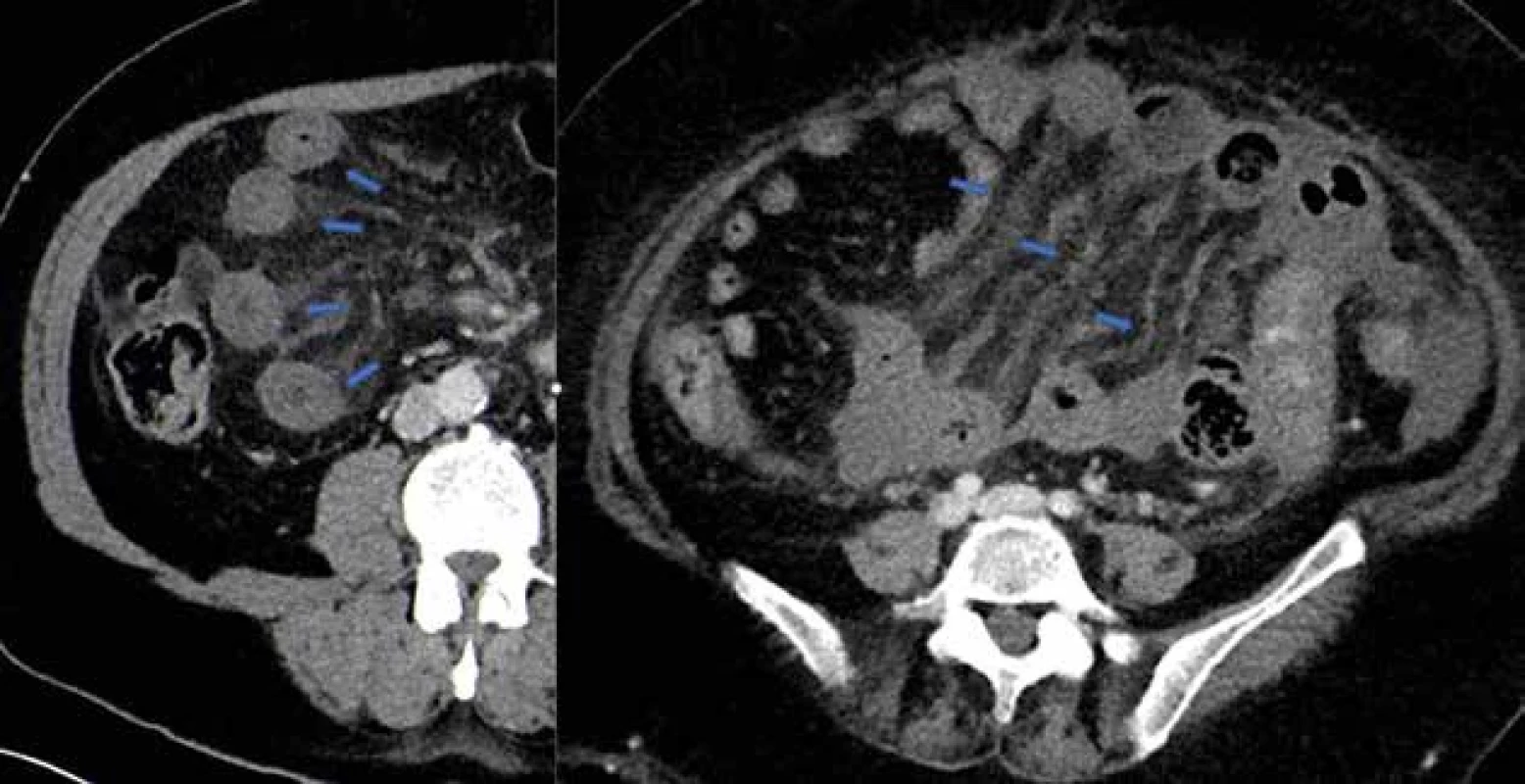
Image 5. Absencia kontrastného zosilnenia steny čreva Fig. 5: Absence of contrast enhancement of the intestinal wall 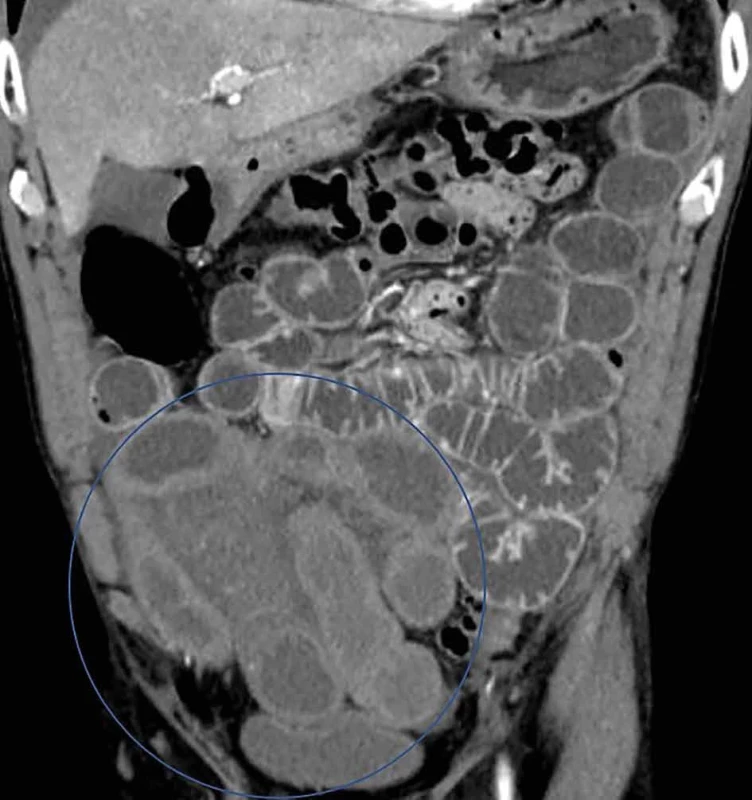
Tab. 1: CT známky AMI [1] Tab. 1: CT signs of AMI [1]
Cievne nálezy
- arteriálna embólia – najčastejšie 3–10 cm distálne od odstupu AMS
- arteriálny trombus – trombus v kalcifikovanom teréne, častejšie v oblasti odstupu AMS
- mezenteriálna venózna trombóza
- plyn v portomezenterickom riečisku
Črevné nálezy
- absencia kontrastného zosilnenie steny čreva
- zhrubnutie steny čreva, mezenteria (edém, hyperdenzné krvácanie)
- luminálna dilatácia (paralýza)
- pneumatóza čriev
Iné vnútrobrušné nálezy
- edém mezenterického tuku
- ascites
- pneumoperitoneum
- infarkt orgánov
Schéma 2: Algoritmus manažmentu pacientov s AMI [2] Diagram 2: Management algorithm for patients with AMI [2] ![Schéma 2: Algoritmus manažmentu pacientov s AMI [2] Diagram 2: Management algorithm for patients with AMI [2]](https://pl-master.mdcdn.cz/media/image/14bbba39000e85981e280049d9ac6b86.png?version=1711889456)
Vysvětlivka: World J Emerg Surg. (2022) odkaz na licenciu Creative Commons http://creativecommons.org/licenses/by/4.0/
Legend: World J Emerg Surg. (2022) reference to Creative Commons License http://creativecommons.org/licenses/by/4.0/Liečba
Iniciálna liečba je rovnaká pre všetky druhy AMI. Zahŕňa hospitalizáciu na jednotke intenzívnej starostlivosti, udržiavanie primeranej saturácie kyslíkom, korekciu abnormalít elektrolytov a acidobázickej rovnováhy, dekompresiu gastrointestinálneho traktu (GIT-u) pomocou naso-gastrickej sondy (NGS), intenzívnu tekutinovú resuscitáciu, monitoring hladiny laktátu (ako indikátora zlepšenia perfúzie), empirickú antibiotickú (ATB) liečbu (napr. cefalosporíny II generácie + metronidazole), antikoagulačnú terapiu (pri vyššom riziku následnej operácie je preferovaný nefrakcionovaný heparín UFH). Bolesť pacienta by mala byť kontrolovaná, najlepšie pomocou parenterálnych opioidov. Kedysi sa verilo, že analgézia výrazne interferuje klinický nález pri vyšetrení pacienta, ale viaceré randomizované kontrolované štúdie vyvrátili túto predstavu a sú potvrdenia, že použitie opioidov nezvyšuje počet nesprávnych rozhodnutí [8]. V prípade nutnosti podávania vazoaktívnych látok, je vhodné sa vyhnúť noradrenalínu a ako alternatívu radšej použiť nízke dávky dobutamínu alebo milrinonu, ktoré zlepšujú funkciu srdca bez výraznejšieho ovplyvnenia prekrvenia čreva. Pri známkach peritonitídy je indikovaná laparotómia, a podľa peroperačného nálezu otvorená revaskularizácia, resekcia čreva a pri potrebe aj s možnosťou použitia zásad damage control surgery [2]. V závislosti od primárneho peroperačného nálezu, alebo ak sa stav pacienta nezlepší po 48 hodinách na jednotke intenzívnej starostlivosti (JIS) je indikovaný second look. U väčšiny pacientov je potrebná intestinálna revaskularizácia, ktorá by mala byť realizovaná ešte pred resekčnou fázou. Jedinou situáciou, v ktorej môže resekcia čreva bez revaskularizácie zachrániť život pacienta, je distálny embolus s dobre priechodným úsekom AMS. Optimálna liečba by mala zahŕňať otvorenú aj endovaskulárnu chirurgiu (hybridná operačná sála). ROMS (retrograde open mesenteric stent) je metódou, ktorá je alternatívou bypassovej operácie a súčasne analógom perkutánnej endovaskulárnej terapie. ROMS je kombinaciou výhod endovaskulárnej a operačnej liečby [12]. U starých, výrazne morbídnych pacientov, u ktorých si nález vyžaduje rozsiahlu resekciu čreva, operácia môže byť z etických dôvodov nevhodná [4].
Posledné desaťročia je zaznamenaný aj nárast endovaskulárnych intervencii pri AMI. Podľa Švédskeho národného registra pre vaskulárnu chirurgiu (Swedvasc) pri porovnaní otvorenej a endovaskulárnej revaskularizácii, 30-dňová umrtnosť bola porovnateľná pri embolickej oklúzii (37 % vs. 33 %), ale významne vyššia pri trombóze (56 % vs. 23 %). V súčasnosti ESVS uvádza endovaskulárnu intervenciu ako prvolíniovú u pacientov s trombotickou AMI, nakoľko u embolickej oklúzie benefit nebol potvrdený. Pri arteriálnej mezenterickej oklúzii spektrum endovaskulárnych možností zahŕňa aspiračnú embolektómiu, lokálnu trombolýzu, rekanalizáciu a stentovanie. V prípade otvorenej revaskularizácie môže byť realizovaná otvorená embolektómia, discízia AMS distálne od oklúzie a reimplantácia do infrarenálnej aorty, trombendarterektómia s angioplastikou, alebo eventuálne bypass [4].
V prípade NOMI je „first line“ terapia konzervatívna. A to iniciálne kompenzácia pacienta z kardiálnej stránky a antikoagulačná liečba s opatrnou infúznou resuscitáciou, vzhľadom na častú kardiálnu dekompenzáciu pacienta. Niektorí pacienti však môžu vyžadovať exploratívnu laparotómiu [6]. V literatúre sú popísané štúdie s použitím lokálnej aplikácie vazodilatátorov prostredníctvom zavedenia katétra do AMS. Najčastejšie využívané sú alprostadil (podávaný ako 20μg bolus, po ktorom nasleduje infúzia 60–80 μg počas 24 hodín) a papaverín (30–60 mg za hodinu). Použitie vazodilatačnej liečby znižuje mortalitu pri NOMI zo 70 % na 50 – 55 %. Infúzia papaverínu by sa však nemala používať súčasne s heparínom kvôli zvýšenému riziku precipitácie papaverínu [4].
Pri MVT sa dôraz kladie na antikoagulačnú terapiu. Odporúča sa UFH vzhľadom na vysoké riziko urgentnej chirurgickej intervencie v prípade progresie stavu, ako alternatíva môže byť podaný nízkomolekulárny heparín (LWMH) v terapeutickej dávke. V literatúre sú popísané aj prípady endovaskulárnej intervencie, ako priama mechanická trombektómia a trombolýza transhepatálnym prístupom do VMS (cez transjugulárnu portosystémovu spojku – TIPS), alebo nepriama trombolýza cez AMS (ktorá je menej účinná s vysokým rizikom krvácavých komplikácii) [2,11]. Pri MVT sa vo väčšine prípadov dá stav zvládnuť iba konzervatívnou terapiou s akcentom na čo najrýchlejšie zahájenie antikoagulačnej liečby. Riziko resekcie sa zvyšuje pri kompletnej trombóze VMS a VP [2].
Follow-up
Optimálny interval sledovania zatiaľ nebol jednoznačne stanovený. Dlhodobý manažment je zameraný na prevenciu budúcich embolických príhod za použitia antagonistov vitamínu K alebo nových perorálnych antikoagulancií. Po revaskularizácii trombotickej arteriálnej oklúzie v dôsledku aterosklerózy sa odporúča protidoštičková a statínová terapia. Po mezenterickej revaskularizácii by pacienti mali byť pravidelne sledovaní buď pomocou duplexného ultrazvuku alebo CT angiografie. Faktorom, ktorý treba vziať do úvahy, je neointimálna hyperplázia, ktorá sa zvyčajne vyvinie 3–15 mesiacov po stentovaní [2,4].
Prognóza
Prognóza intestinálnej ischémie závisí od základného mechanizmu a od času diagnostiky a začatia liečby. Miera úmrtnosti sa pohybuje od 0 % do 10 % s okamžitým zahájením liečby, pri oneskorení liečby na 6–12 hodín sa zvyšuje na 50–60 % a ďalej na 80–100 % s oneskorením viac ako 24 hodín po nástupe symptómov. Akútna mezenterická venózna trombóza má lepšiu celkovú prognózu v porovnaní s inými formami akútnej mezenterickej ischémie [6,13].
Syndróm krátkeho čreva a „No Gut Syndrome” – Čo si môžeme dovoliť ?
Väčšina prípadov AMI konči resekciou devitalizovaného úseku čreva s vysokým rizikom pooperačného syndrómu krátkeho čreva. Dĺžka resekovaného čreva, ktorá by mohla viesť k short bowel syndrome (SBS), závisí od niekoľkých faktorov, vrátane: časti resekovaného čreva (proximálnej verzus distálnej), stavu reziduálneho čreva, prítomnosti alebo neprítomnosti ileocekálnej chlopne, predchádzajúcej radiačnej terapie a schopnosti udržiavať adekvátnu orálnu výživu. Takmer totálna enterektómia (near total enterectomy/no gut syndrome), sa na druhej strane považuje za krok nad rámec SBS a týka sa odstránenia takmer celého tenkého čreva zvyčajne od Treitzovho ligamenta až po ileokolické spojenie, ale môže sa dokonca rozšíriť až po colon transversum. Na rozdiel od SBS, táto entita ponecháva pacienta bez dostatočnej dĺžky čreva na adaptačné zmeny, a preto sa títo pacienti musia spoliehať na celoživotnú parenterálnu výživu (PN). Tento stav zostáva dilemou pre chirurgov na celom svete, najmä v dôsledku jeho vnímanej nezlučiteľnosti so životom. Existuje len niekoľko dostupných možností, ako pokračovať v liečbe, avšak udržiavanie dlhodobej parenterálnej výživy ukázalo sľubné výsledky [14]. Chorobnosť medzi tými, ktorí prežili, závisí od dĺžky resekovaného čreva, ako aj od individuálnych variácií motility a absorpcie čreva. Väčšina pacientov, ktorí prežijú resekciu menej ako 50 % tenkého čreva, bude môcť žiť relatívne normálny život [15]. Pacienti s menej ako 200 cm tenkého čreva sú vystavení riziku vzniku určitej variácie syndrómu krátkeho čreva. Vzhľadom na vyššie uvedené, kritické limity reziduálnej dĺžky čreva sú veľmi diskutabilné a vyzerá to tak, že musíme postupovať individuálne a dôsledne zvažovať benefity pre pacienta. Avšak všeobecne sa usudzuje, že za dodržania nižšie uvedených limitov, pacient po adaptačnej fáze môže žiť relatívne normálny život bez domácej PN.
Kritické limity reziduálnej dĺžky čreva [16]:
- 100 cm v prípade terminálnej jejunostómie (odstránené ileum a hrubé črevo)
- 35 cm v prípade jejuno-ileálnej anastomózy (ileocekálna chlopňa zachovaná)
- 65 cm v prípade jejuno-kolonickej anastomózy (ponechané hrubé črevo)
ZÁVER
Za posledné storočia zostáva AMI stále aktuálnym problémom aj pre súčasnú medicínu a je výzvou pre lekárov. Je to ochorenie s rýchlym spádom a extrémne vysokou úmrtnosťou. Čas do určenia diagnózy a liečby je rozhodujúci pre prežitie u pacientov s akútnou mezenterickou ischémiou. Otázka znie, či je v našej sile zvrátiť túto situáciu? Vďaka zvýšeniu povedomia lekárov, včasnej diagnostike za použitia moderných technológií a interdisciplinárnej spolupráce môžeme výrazne redukovať mortalitu. Dôkladné klinické vyšetrenie, kontrastná počítačová tomografia, vykonávaná v počiatočnom štádiu a súčasné možnosti intervenčnej rádiológie sú kľúčom k zlepšeniu výsledkov liečby akútnej mezenterickej ischémie.
Skratky:
Alpha – GST – serum alpha-glutathione S-transferase AMI – akútna mezenterická ischémiaAMI – arteria mesenterica inferior AMS – arteria mesenterica superior ATB – antibiotikaCT – computed tomographyCTA – computed tomography angiography DUS – doppler ultrasonographyESVS – European Society for Vascular Surgery I-FABP – intestinal fatty acid-binding proteinJIS – jednotka intenzívnej starostlivosti LMWH – low-molecular weight heparinMVT – mezentrická venózna trombóza NGS – naso-gastrická sondaNOMI – non-occlusive mesenteric ischemia SBS – short bowel syndromeSMV – superior mesenteric vein TC – truncus celiacusUFH – unfractionated heparin VMS – vena mesenterica superior VP – vena portaeWSES – World Society of Emergency SurgeryKonflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol publikovaný v žiadnom inom časopise, s výnimkou kongresových abstrakt a klinických odporúčaných postupov.
MUDr. Mykhailo Kunychka
Chirurgia, FNsP Žilina
Slovenská republika
e-mail: kunychka@gmail.com
Sources
- Kärkkäinen JM. Acute mesenteric ischemia: A challenge for the acute care surgeon. Scandinavian Journal of Surgery 2021;(2)110 : 150–158. doi: 10.1177/14574969211007590.
- Bala B, Catena F, Kashuk J, et al. Acute mesenteric ischemia: updated guidelines of the World Society of Emergency Surgery. World Journal of Emergency Surgery 2022;17(1):1–17. doi: 10.1186/ s13017-022-00443-x.
- Luther B, Mamopoulos A, Lehmann C, et al. The ongoing challenge of acute mesenteric ischemia. Visc Med. 2018;34 : 217–223. doi: 10.1159/000490318.
- Björck M, Koelemay M, Acosta S, et al. Editor’s choice – Management of the diseases of mesenteric arteries and veins: Clinical practice guidelines of the European Society of Vascular Surgery (ESVS). European Journal of Vascular and Endovascular Surgery 2017;53(4):460–510. doi: 10.1016/j. ejvs.2017.01.010.
- Memet O, Zhang L, Shen J. Serological biomarkers for acute mesenteric ischemia. Ann Transl Med. 2019;7(16):394–394. doi: 10.21037/ATM.2019.07.51.
- Amini A, Nagalli S. Bowel ischemia. StatPearls Publishing 2023.
- Segovia FD, Ream S, Dang T, et al. COVID-19-associated superior mesenteric artery thrombosis and acute intestinal ischemia. Cureus 2022;14(8): e27722. doi: 10.7759/CUREUS.27722.
- Overview of intestinal ischemia in adults UpToDate. https://www.uptodate.com/ contents/overview-of-intestinal-ischemia-in
- Sayegh AS, Medina LG, La Riva A, et al. Superior mesenteric artery injury during robotic radical nephrectomy: Scenarios and management strategies. J Clin Med. 2023;12(2):427. doi: 10.3390/ JCM12020427.
- Bala M, Kashuk J, Moore EE, et al. Acute mesenteric ischemia: guidelines of the World Society of Emergency Surgery. World J Emerg Surg. 2017;12(1). doi: 10.1186/S13017-017-0150-5.
- Krška Z, Ulrych J. Mezenteriální ischémie. In Náhlé příhody břišní 2. Aktuální pohled na klasifikaci, diagnostiku a léčbu. 1st ed. Praha, We Make Media 2023 : 39–76.
- Páral J. Akutní mezenteriální ischemie. Moderní diagnostika a léčba akutní ischemie střeva, 1. vydání. Praha, Grada Publishing 2012.
- Kanasaki S. Furukawa A, Fumoto K, et al. Acute mesenteric ischemia: Multidetector CT findings and endo-vascular management. RadioGraphic 2018;38(3). doi: 10.1148/rg.2018170163.
- Jain V, Huerta J. More on ‘No Gut Syndrome’: A case report. Int J Surg Case Rep. 2016;35–37. doi: 10.1016/J. IJSCR.2015.12.014.
- Thomas JF, Jordan GL. Massive resection of small bowel and total colectomy: Use of reversed segment. Archives of Surgery 1965; 90(5):781–786. doi: 10.1001/archsurg.1965.01320110117019.
- Kühn F, Schiergens TS, Klar E. Acute mesenteric ischemia. Visc Med. 2020;36 : 256–262. doi: 10.1159/000508739.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2023 Issue 6-
All articles in this issue
- Potřebujeme ještě všeobecnou chirurgii?
- Acute mesenteric ischemia – a persistent problem
- Blast syndrome – pathophysiology, diagnosis and treatment of blast injuries
- Metastatic potential of T1a and T1b non-small cell lung cancer: analysis in the Czech population
- An unusual case of gastrointestinal tract occlusion, Ladd’s syndrome and neuroendocrine tumour of the appendix in a 19-year-old female patient
- Systemic toxic effects of Mesocain® in routine surgical practice upon iatrogenic overdose requiring cardiopulmonary resuscitation – case report
- Strangulation ileus caused by malposition of the ureter
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Systemic toxic effects of Mesocain® in routine surgical practice upon iatrogenic overdose requiring cardiopulmonary resuscitation – case report
- Blast syndrome – pathophysiology, diagnosis and treatment of blast injuries
- Acute mesenteric ischemia – a persistent problem
- Strangulation ileus caused by malposition of the ureter
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

