-
Medical journals
- Career
Karcinom pankreatu v terénu chronické pankreatitidy – diagnosticko-terapeutické dilema; přehled případů
Authors: M. Loveček 1; P. Skalický 2; J. Tesaříková 1; O. Urban 3; Přemysl Falt 3; D. Kurfúrstová 4; Dušan Klos 2
Authors‘ workplace: I. chirurgická klinika Fakultní nemocnice Olomouc 1; I. chirurgická klinika Lékařské fakulty Univerzity Palackého Olomouc 2; II. interní gastroenterologická – geriatrická klinika Fakultní nemocnice Olomouc 3; Ústav klinické a molekulární patologie Lékařské fakulty Univerzity Palackého Olomouc 4
Published in: Rozhl. Chir., 2022, roč. 101, č. 11, s. 549-550.
Category: Case Report
doi: https://doi.org/10.33699/PIS.2022.101.11.549–556Overview
Úvod: Ložiskový proces v terénu chronické pankreatitidy (CHP) je obtížný diagnosticko-terapeutický problém. Cílem práce je: a) na vlastní sestavě stanovit výskyt nemaligních ložisek v terénu CHP, kdy podezření z maligního ložiska je vysoké, b) stanovit skutečný výskyt maligních tumorů v terénu CHP.
Metody: Předkládáme retrospektivní analýzu souboru operovaných 2015–2019 pro CHP, ložisko v CHP a podezření na malignitu v ložisku CHP. Součástí je prezentace obtížných případů z pohledu předoperační diagnostiky.
Výsledky: Pro některou z forem CHP bylo provedeno 33 ze 340 (9,7 %) resekcí pankreatu (2015–2019). Ložisko v hlavě pankreatu bylo u 16 (48 %), u 10 z nich (62 %) s podezřením na PDAC na základě EUS, CT či PETCT, v 6 případech i na podkladě pozitivní tkáňové diagnostiky využitím EUS-FNA. Spojkovou operaci podstoupilo 59 nemocných (HJA, PJA, Frey). U 8 (13 %) byla předoperačně tkáňová diagnostika, v 25 % podezření na malignitu. Perioperačně malignita byla potvrzena jen u jednoho pacienta, předoperačně nemaligní. Klinický průběh u jiných 3 nemocných po HJA, i když při operaci bez nádoru, ukazuje na PDAC v terénu CHP.
Závěr: Prokazatelnost nádorových buněk v ložisku vzniklém v terénu CHP je i při použití všech dostupných sofistikovaných metod nesnadná a o úspěšnosti rozhoduje velmi mnoho proměnných faktorů. Četnost „nepotřebných“ pravostranných resekcí u ložiska v CHP dosahuje v naší sestavě 48 %, zatímco spojkových operací, u nichž měl být proveden resekční výkon, je kolem 7 %. Nadále je nutné očekávat určité procento tzv. nadbytečných resekčních výkonů na pankreatu, stejně jako neprovedených resekčních výkonů pro neprokázaný/nepoznaný tumor pankreatu v terénu CHP.
Klíčová slova:
pankreas – karcinom pankreatu – chronická pankreatitida – Kazuistiky – nemaligní ložisko
ÚVOD
Chronická pankreatitida jako taková málokdy vyžaduje primárně chirurgickou terapii.
Jednou z absolutních indikací k resekci pankreatu je karcinom slinivky břišní vzniklý v terénu chronické pankreatitidy. Toto onemocnění vyžaduje identický aktivní přístup jako primární karcinom pankreatu. Ložiskové procesy v terénu chronické pankreatitidy, které byly resekovány a kdy maligní tumor v resekátu prokázán nebyl, jsou velmi obtížné situace jak z diagnostického, tak terapeutického hlediska, a především z hlediska nezanedbatelné morbidity a nenulové mortality. Do této skupiny patří autoimunitní formy chronické pankreatitidy, ložiskové/uzlové formy chronické pankreatitidy i zánětlivý pseudotumor, které předoperačně bez možností podrobného histopatologického vyšetření, které umožňuje právě jen vyšetření resekátu, není možné diagnostikovat přesně. I v době dostupnosti velmi sofistikovaných diagnostických metod – CT, EUS-FNA(B), FISH, případně PETCT – se v určitých případech dostáváme do diagnostického vakua a často ani patolog není schopen z předoperačního či peroperačního tkáňového materiálu s jistotou odlišit chronickou pankreatitidu od karcinomu.
Cílem práce je pokusit se na vlastní sestavě stanovit četnost tumorů v terénu CHP a naopak podezření z tumoru, kde se o tumor nejedná. Součástí práce je i prezentace obtížných případů.
METODY
Jde o retrospektivní analýzu souboru nemocných operovaných pro patologii na pankreatu v letech 2015–2019 s cílem: 1. identifikace nemocných operovaných radikálně (resekční výkon na pankreatu) pro podezření z karcinomu pankreatu (PDAC) v terénu chronické pankreatitidy, u nichž v resekátu tumor prokázán histologicky nebyl; 2. identifikace nemocných operovaných pro ložiskový proces v hlavě pankreatu v terénu CHP, u nichž předoperačně ani při operaci karcinom prokázán nebyl, resekční výkon proveden nebyl, ale následný klinický průběh a progredující nemoc později potvrdily onemocnění karcinomem pankreatu (PDAC). Jednotlivé klinické situace pak doprovází prezentace konkrétních případů včetně neobvyklého případu bez podezření z maligního procesu v terénu obstrukční formy chronické pankreatitidy, kde z rutinní excize nesuspektního pankreatu při konstrukci pankreatojejunální spojky byl prokázán difuzní PDAC a provedený drenážní výkon bylo nutné nahradit v druhé době resekčním.
VÝSLEDKY
Pro některou z forem chronické pankreatitidy bylo provedeno 33 resekčních výkonů z celkem 340 (9,7 %) ve sledovaném období. U 16 pacientů se jednalo o ložisko v hlavě pankreatu a byla u nich provedena DPE či TPE. U deseti z těchto 16 bylo na základě EUS, CT či PETCT vysloveno podezření z maligní povahy ložiska, u 6 pak na základě pozitivní předoperační tkáňové diagnostiky (EUS-FNA). Z výsledků definitivní histologie se však u těchto 10 resekovaných o maligní onemocnění nejednalo. Padesát devět nemocných s CHP podstoupilo ve stejném období spojkovou operaci (HJA, PJA či Frey operace), z toho 10 s ložiskovým procesem hlavy pankreatu. U 8 byla předoperačně tkáňová diagnostika (EUS-FNA/B), v 25 % podezření na malignitu, v 75 % bez, perioperačně však rozsáhlým provedením mnohočetných biopsií maligní onemocnění prokázáno nebylo. Perioperační tkáňovou diagnostikou byla malignita potvrzena u jednoho pacienta, jehož předoperační tkáňová diagnostika nebyla maligní ani podezřelá z malignity – resekční výkon však pro rozsáhlý zánětlivý infiltrát nebyl možný. Klinický průběh u jiných 3 nemocných po HJA, i když při operaci bez podezření nebo bez prokazatelného nádoru, ukazuje na PDAC v terénu CHP (Tab. 1).
Table 1. Počty výkonů a dignostických postupů
Tab. 1. The numbers of interventions and diagnostic procedures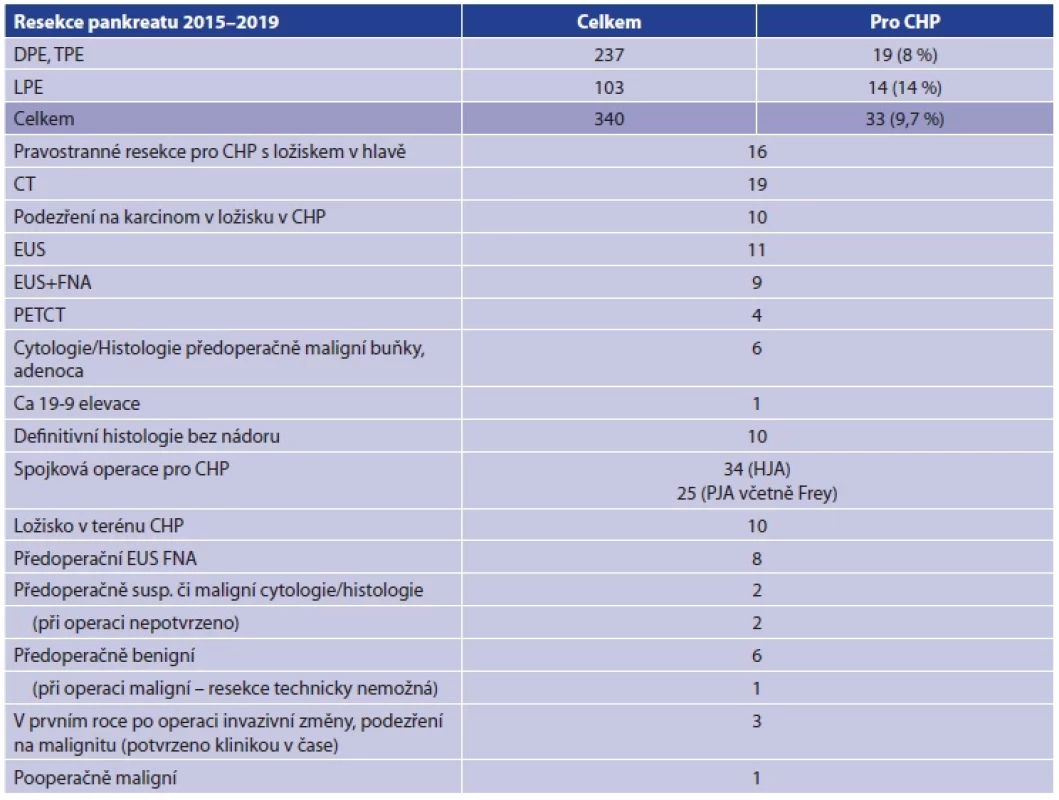
Na uvedených případech chceme prezentovat nejobvyklejší situace.
Pacient 1, muž, 58 let, toxonutritivní forma CHP, těžký kuřák, alkoholik, neléčená, nesledovaná chronická pankreatitida. Obstrukční ikterus vznikl na podkladě stenózy v intrapankreatickém průběhu žlučovodu s jaterními abscesy, brush cytologie, EUS-FNA a FISH – maligní buňky z hlavy pankreatu. Po přeléčení abscesů byl proveden resekční výkon v podobě pravostranné pankreatoduodenektomie (Obr. 1). Pacient zhojen bez komplikací, histologie – fibróza, nádor neprokázán. Příčina CHP nebyla odstraněna, pokračoval v etylismu a kouření, rozvinula se portální hypertenze, jaterní cirhóza, opakovaně krvácel do GITu a zemřel 15 měsíců po resekci.
Image 1. Resekát hlavy pankreatu se stenózou na podkladě fibrózní přestavby hlavy pankreatu při toxonutritivní formě chronické pankreatitidy
Fig. 1. Specimen of resected pancreatic head with bile duct stenosis due to fibrosis in the toxo-nutritive form of chronic pancreatitis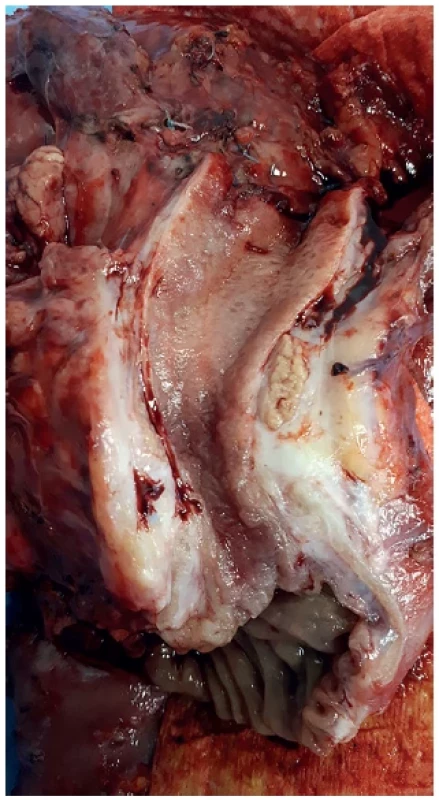
Pacient 2, muž, 58 let, toxonutritivní forma CHP, ex abuser alkoholu, neléčená, nesledovaná CHP. Prvním symptomem byl obstrukční ikterus na podkladě stenózy žlučovodu v intrapankreatickém průběhu zvětšenou slinivkou. ERCP bylo neúspěšné, pokus o rendez-vous endoskopickou CHDDA také neúspěšný s komplikací (pneumoperitoneum), došlo k perforaci duodena a žlučovodu. Došlo k lokalizované biliární peritonitidě, která si vynutila neodkladná chirurgickou revizi. Byla založena CHDDA a provedeny mnohočetné transduodenální biopsie ze zvětšené tuhé hlavy pankreatu tru-cut jehlou. Histologie byla k dispozici až několik dnů po operaci (operace byla akutní v pátek večer!) – výsledek adenokarcinom. Vzhledem k vysokému ikteru, vynucené operaci a odstupu histologie od operace cestou MDT byla doporučena neoadjuvantní chemoterapie a v druhé době resekční výkon. Nemocný však vyhledal druhý názor v zahraničí, který na základě přešetření vyloučil maligní onemocnění. Nemocný tedy navrhovaný postup neakceptoval, nicméně se vrátil po roce se snahou se dát léčit. V mezičase u něj došlo k úbytku na váze 20 kg. Na PETCT byl lokálně pokročilý nález – infiltrace VMS, částečně a. hepatica (Obr. 2). Akceptoval neoadjuvantní terapii – 6 cyklů FOLFIRINOXU. Na PETCT byl sice patrný ústup aktivity v tumorózní mase, nicméně perioperační lokální nález invaze do v. portae a a. hepatica neumožňoval bezpečný radikální výkon (Obr. 3). Byla doporučena radioterapie, kterou však pacient odmítl. V dalším průběhu jsme zaznamenali portální hypertenzi s ascitem a progresi nemoci. Po 29 měsících po objevení se prvních symptomů – obstrukční ikterus – pacient zemřel.
Image 2. PETCT u lokálně pokročilého tumoru hlavy pankreatu v terénu chronické pankreatitidy, 1 rok po stanovení diagnózy, bez léčby
Fig. 2. PETCT of a locally advanced tumor of the head of the pancreas in chronic pancreatitis, 1 year following the diagnosis, without therapy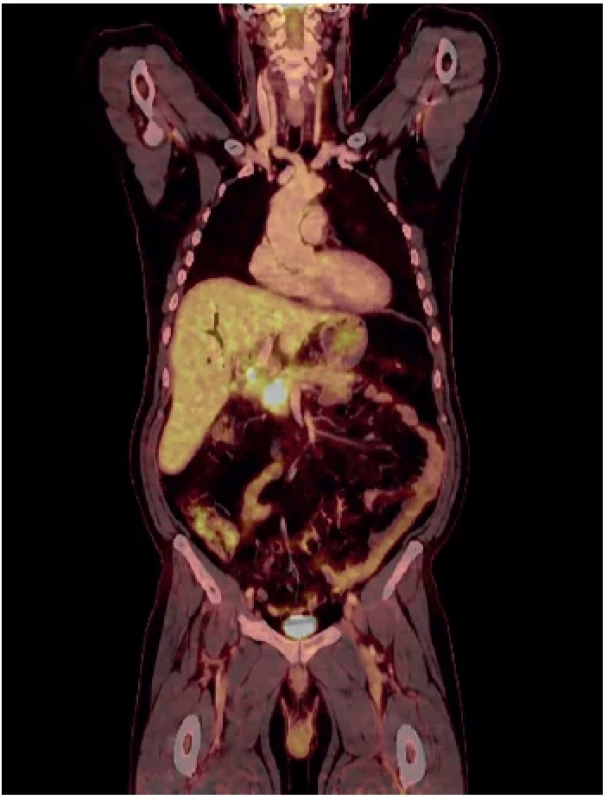
Image 3. PETCT po neoadjuvanci FOLFIRINOX. Na základě tohoto byl indikován pokus o radikální výkon
Fig. 3. PETCT following neoadjuvant therapy with FOLFIRINOX; a radical procedure was attempted based on this assessment
Pacientka 3, žena, 58 let, anamnesticky toxonutritivní forma chronické pankreatitidy s kalcifikacemi v hlavě a těle pankreatu s dilatací d. wirsungi od krčku do kaudy (Obr. 4). Klasifikováno jako kombinovaná obstrukčně algická forma s kalcifikacemi. Navrženo řešení duodenum a pankreas šetřícím výkonem podle Freye, který byl elektivně proveden. Pacientka se zhojila bez komplikací. Z rutinního bioptického odběru při zakládání PJA (excize z přední stěny pankreatu v krčku a těle) byl pooperačně patologem identifikován adenokarcinom. Na základě MDT se souhlasem nemocné jsme provedli totální pankreatektomii v druhé době. Histologicky v resekátu bylo několik ložisek 5 až 6 mm adenokarcinomu. Pacientka se zhojila (nekompliantní v terapii diabetu), 120 dnů od operace – TPE – náhle zemřela v malnutrici a sepsi na srdeční selhání či hypoglykemii.
Image 4. Předoperační CT u nemocné s bolestivou formou obstrukční chronické pankreatitidy s kalcifikacemi a pankreatikolithiázou, bez zjevného ložiska
Fig. 4. Preoperative CT of a painful form of obstructive chronic pancreatitis with calcifications and pancreaticolithiasis, without any apparent mass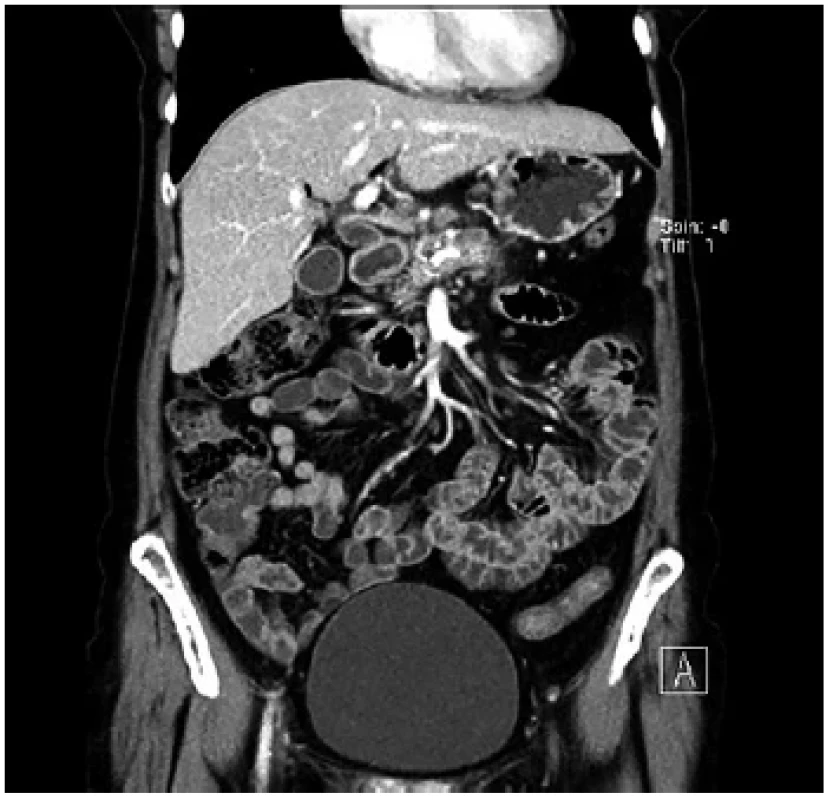
Pacient 4, muž, 70 let, nemocný se známou CHP a trombofilním stavem při Leydenské mutaci, nově při sledování pro CHP bylo zjištěno ložisko v hlavě pankreatu, elevace CA 19-9 na 200, EUS ložisko, CT ložisko, PETCT akumulace (Obr. 5). Sugestivně připomínalo malignitu. Pacient byl indikován k resekčnímu výkonu v podobě PPDPE, se kterým souhlasil. V pooperačním průběhu vznikl v dutině břišní absces vyžadující operační drenáž. Pacient se zhojil a byl dále sledován. Histologicky AIP IgG4 typ AIP1. V delším odstupu od operace – 3 měsíce – se objevila trombóza vena portae s varixy a kolaterálami. Pro opakované krvácení z varixů v oblasti HJA byla provedena revize s pokusem dekonexe a nové HJA, po níž však došlo k dekompenzaci portální hypertenze, ascitu a postupnému MODS. Pacient zemřel 12 měsíců po primární operaci.
Image 5. PETCT s ložiskem akumulace 18F-FDG v hlavě pankreatu
Fig. 5. PETCT with accumulation of 18F-FDG in head of pancreas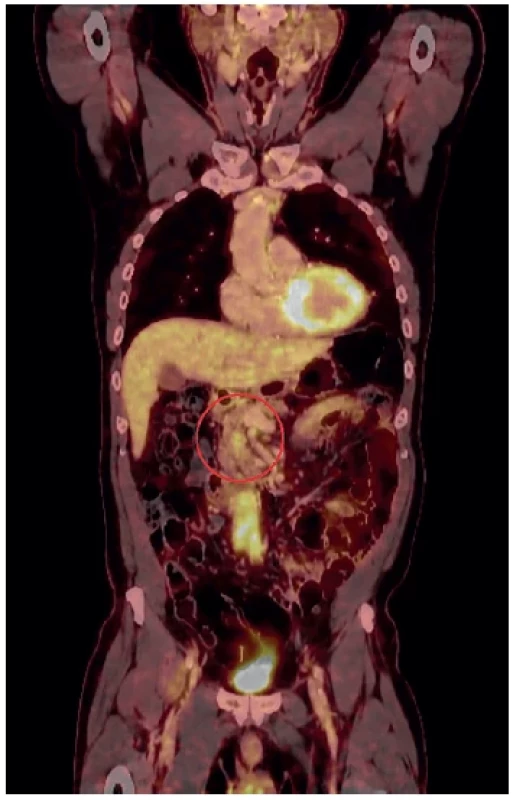
Pacient 5, muž, 44 let, toxonutritivní forma chronické pankreatitidy, neléčená, nesledovaná. Pro obstrukční ikterus a mírný úbytek na váze 5 kg/měsíc vyšetřen CT, ERCP, kde double duct sign, stent. Pro podezření na ložisko tumorózni povahy byl pacient indikován k resekčnímu výkonu. Ten však nemohl být proveden pro rozsáhlý fibrózní infiltrát hlavy pankreatu zaujímající VMS/ VP. Rozsáhlé biopsie tru-cut jehlou z hlavy pankreatu neprokázaly karciom. Vzhledem k neresekabilnímu lokálnímu nálezu byla založena HJA sec Roux-Y. CA 19-9 nezvýšeno. Nemocný byl sledován, došlo ke zvýšení v CA 19-9, nově se objevily bolesti v zádech a podle CT a PETCT (Obr. 6) byla patrná progrese masy pankreatu. EUS-FNA již prokázala PDAC, poté byla zahájena systémová onkologická léčba gemcitabinem. I přes terapii dochází k progresi nemoci a vzniku poruchy pasáže na úrovni duodena – indikována GEA 10 měsíců po primární HJA, kdy již bylo patrno ložisko v játrech. Nemoc dále progredovala a pacient zemřel 25 měsíců po primární HJA.
Image 6. PETCT – progredující neodstranitelná masa hlavy pankreatu
Fig. 6. PETCT – progression of an inoperable tumor in the head of the pancreas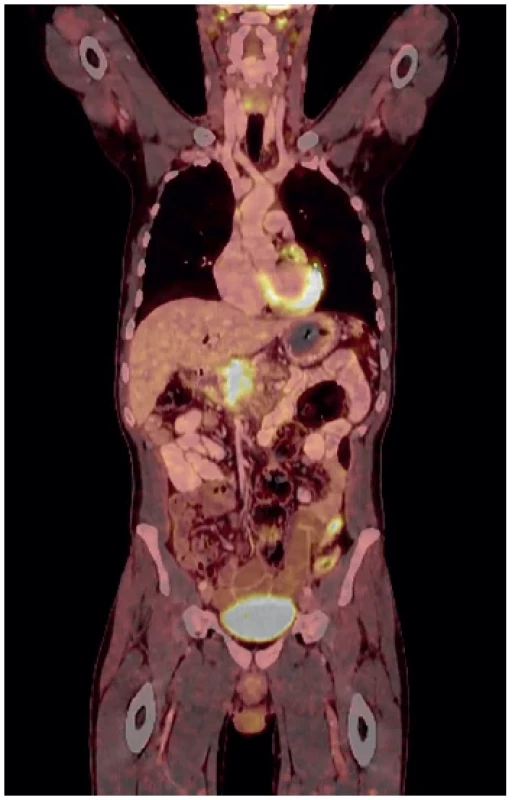
Pacient 6, muž, 67 let, bez abuzu alkoholu, bez anamnézy známé chronické pankreatitidy, anikterická cholestáza, indikováno ERCP, které prokázalo stenózu intrapankreatického žlučovodu, brush cytologie byla negativní, CT negativní, ložisko v pankreatu patrno nebylo, při EUS bylo popsáno ložisko v hlavě pankreatu, EUS-FNA s cytologickým nálezem vysoce podezřelého z maligního procesu, nepatrná elevace CA 19-9 (39). Vzhledem k nemožnosti vyloučení maligního procesu byla pacientovi nabídnuta revize pankreatu, transduodenální mnohočetné biopsie a buď resekční výkon, či spojkový výkon. Při operaci byla slinivka tuhá, hrubého povrchu, provedena CHCE, extrakce stentu, cholangioskopie, infiltrace žlučovodu se nepotvrdila, provedeny transduodenální mnohočetné biopsie vějířovitě z hlavy pankreatu tru-cut jehlou – patolog jak na perioperačním histologickém vyšetření, tak v definitivním histologickém nálezu neprokázal maligní buňky. Na základě peroperačního vyšetření byl zvolen spojkový výkon v podobě HJA Roux-Y. Definitivní histologie – fibróza s chronickou zánětlivou infiltrací a involucí. V pooperačním období je pacient sledován klinicky, periodicky sledovány onkomarkery a CT jednou ročně. Nález byl nadále bez ložiskových změn na pankreatu, CA 19-9 v mezích normy. Klinicky je pacient bez obtíží 6 let od operace. Tab. 2 shrnuje demografická data a výsledky prezentovaných pacientů.
Table 2. Demografická data pacientů s chronickou pankreatitidou a podezřením na tumor v terénu CHP
Tab. 2. Demographic data of the patients with chronic pancreatitis and a suspected tumor in CP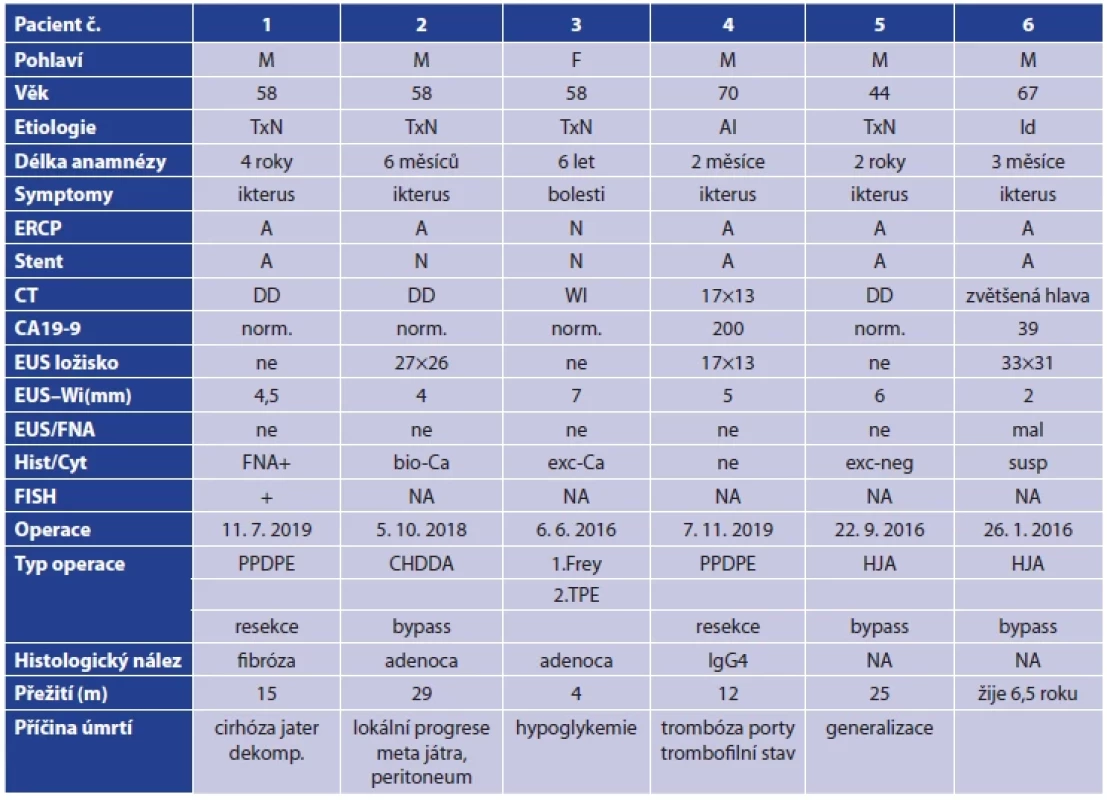
DISKUZE
Mortalita u pacientů s chronickou pankreatitidou trvající 20 let (od stanovení diagnózy) je o 38,4 % vyšší než ve věkem odpovídající kontrolní skupině [1]. Riziko vzniku karcinomu pankreatu je 16krát vyšší u nemocných s chronickou pankreatitidou a 25krát vyšší u kuřáků s chronickou pankreatitidou. Na základě kalkulací je relativní riziko vzniku karcinomu pankreatu u chronické pankreatitidy 13,3 % (95% CI 6,1 – 28,9 %) a 69 % u nemocných s hereditární pankreatitidou (95% CI 56,4 – 84,4 %) [2]. IPSG (International Pancreatitis Study Group) z roku 2004 uvádí kumulativní riziko vzniku karcinomu u nemocných s CHP 1,8 % a 4 % (při 10 a 20 let trvání CHP), jiní pak 5 % [3,4]. Celoživotní riziko vzniku karcinomu pankreatu u pacientů s chronickou pankreatitidou je uváděno kolem 5 % [1,2,5,6]. Zřetelnější vztahy ke karcinomu pankreatu pak mají hereditární (s funkční mutací genu PRSS1) a tropická chronická pankreatitida. Celoživotní riziko vzniku karcinomu u hereditární CHP je pak uváděno ve 40–55 %. Maligní tumor či podezření z maligního procesu v terénu chronické pankreatitidy je jednou z absolutních indikací k resekčnímu výkonu u chronické pankreatitidy [7]. Skutečně operabilních karcinomů pankreatu s kurativním záměrem je 15–20 % ze všech diagnostikovaných s celkovým pětiletým přežitím 5–7 % [8]. Hrubá incidence karcinomu pankreatu v české populaci je cca 22/100 000 za rok a prevalence pozvolna narůstá [9]. Celosvětově se uvádí 466 000 úmrtí ročně na karcinom pankreatu [8]. Bez operace je očekávaná délka života u pacienta s karcinomem pankreatu menší než 1 rok, po úspěšné resekci je medián 5letého přežití 20–25 % [9,10].
Roční incidence chronické pankreatitidy v rozvinutých zemích je uváděna 5–12/100 000, v ČR z roku 2009 pak 7,8/100 000 [11]. Prevalence nemocných s CHP v ČR, kteří jsou léčeni substitucí zevní sekrece, lze odhadovat mezi 7500–10 000. Celkem 11 643 pacientů by mohlo být substituováno pro exokrinní pankreatickou insuficienci při dávce 3×25 000 (Kreon 25 000) v roce 2019 v ČR podle počtu distribuovaných balení preparátu Kreon 25 000 – je nutno však brát v úvahu i terapii pankreatickými enzymy pro jiné choroby, stavy po operacích na pankreatu a existenci jiných enzymatických preparátů (Pangrol, Pancreolan, Panzytrat…).
Při uváděných frekvencích vzniku karcinomu pankreatu v terénu CHP 5,8 %/14 let a prevalenci CHP v české populaci lze velmi orientačně očekávat cca 5000–10 000 pacientů s CHP v ČR a v intervalu 15 let cca 250–500 karcinomů pankreatu v terénu CHP. To může představovat velmi hrubým odhadem 1–2 % všech karcinomů pankreatu v ČR v souvislosti s chronickou pankreatitidou.
V případě ložiskové léze vzniklé v terénu známé chronické pankreatitidy se jedná o velmi obtížnou indikační situaci, kdy je chirurg postaven před rozhodnutí o indikaci správného/adekvátního výkonu při velmi nepřesném výsledku diagnostického postupu.
V klinické praxi je však běžnější situace, podobně jako u většiny nemocných v našem souboru, kdy bezbolestný obstrukční ikterus s ložiskem v hlavě slinivky je prvním symptomem u nemocných s preexistující, ale dosud nediagnostikovanou chronickou pankreatitidou. Nejedná se tedy o záchyt ložiska/tumoru v terénu známé a sledované chronické pankreatitidy, ale o nový záchyt/první manifestaci obvykle dosud klinicky němé chronické pankreatitidy, u níž dojde k obstrukci žlučovodu v intrapankreatickém průběhu – ať již zvětšenou hlavou pankreatu, či ložiskem v hlavě pankreatu. Zároveň se však ve vztahu karcinomu pankreatu a chronické pankreatitidy může uplatňovat princip tzv. reverzní kauzality, kdy tumor obturující pankreatický vývod vede k jeho dilataci, přetlaku ve vývodném systému pankreatu, sekundárním fibrotickým a atrofizujícím změnám odpovídajícím změnám při chronické pankreatitidě [12]. V tomto případě však sekundárně v důsledku prvotní obstrukce. Tedy u každého ložiska v pankreatu i v terénu chronické pankreatitidy vyvstává podezření z maligního procesu. Odlišit však maligní tumor od zánětlivého pseudotumoru je obtížné i s využitím EUS. Využitím EUS-FNA se zvyšuje senzitivita nad 85 % s dobrou specificitou [13,14]. Pravděpodobnost falešně negativních nálezů je mezi 5–10 %. Resekce je tedy doporučována i bez předchozí verifikace [7]. MRI kombinované s MRCP vykazuje senzitivitu 93 % a specificitu 75 % pro odlišení CHP a tumoru [15]. V případě tumoru/ malignity vzniklé v terénu chronické pankreatitidy toto ovšem neplatí. I při extenzivím využití všech dostupných diagnostických možností je senzitivita detekce tumoru 67 % se specificitou jen 45 %! [7].
V naší sestavě všech nemocných, kteří podstoupili resekční výkon na pankreatu v daném období, mělo 8 % operovaných výsledný histologický nález chronických zánětlivých změn odpovídajících chronické pankreatitidě. Přibližně u poloviny těchto nemocných se jednalo o nově diagnostikovanou ložiskovou formu chronické pankreatitidy či zánětlivý pseudotumor u nemocných s dosud neidentifikovanou a neléčenou chronickou pankreatitidou. Předoperační tkáňová diagnostika u těchto nemocných, pokud byla provedena (cytologie/ histologie), obvykle vykazovala falešnou pozitivitu – podezření z maligního onemocnění. U významné menšiny, resp. jen v několika jednotlivých případech, se pak jednalo o karcinom vzniklý v terénu známé preexistující chronické pankreatitidy, ani v jednom případě se nejednalo o cílený záchyt, spíše o náhodný a překvapivý nález na histologickém vyšetření, jak prezentujeme např. u nemocné (Pacient 3), nebo došlo k potvrzení diagnózy až průběhem nemoci, zpočátku s neprokázaným nádorem (Pacient 5).
Z klinické praxe vyplývá, že ani veškerá dostupná sofistikovaná diagnostická metodika nedokáže u části pacientů identifikovat včas nemocné s tumorem vzniklým v terénu známé chronické pankreatitidy – tedy v určité rizikové skupině. U nemocných se zánětlivým pseudotumorem či podezřením na karcinom v uzlové formě chronické pankreatitidy pak ani PETCT není vyšetřením přínosným v této diagnostice. Slibnou se pak může zdát cesta kombinace dosavadních standardních vyšetření s metodami sérového stanovení miRNA [16]. Otázkou však zůstává, zdali jakýkoliv sérový/systémový marker jak v případě primárního karcinomu pankreatu, tak při identifikaci karcinomu v terénu chronické pankreatitidy je markerem časným, nebo již markerem systémové nemoci. V současné době je nutné nadále počítat se zlomkem pacientů, kteří podstoupí resekční výkon pro podezření z nádorového onemocnění, které z výsledného resekátu prokázáno nebude. V naší sestavě nemocných se tak děje u 48 % těchto nemocných. Stejně tak je nutné počítat i se zlomkem pacientů, u nichž neprovedení resekčního výkonu povede k promeškání možného radikálního výkonu z důvodu neschopnosti prokázat již maligní onemocnění, a tak zvolit adekvátní kurativní výkon. Tato situace se v naší sestavě objevuje u cca 7 % nemocných indikovaných primárně k bypassovému výkonu v podobě HJA či PJA, kdy na tumor nebylo podezření či nebyl prokázán. V případě indikovaných bypassových výkonů (HJA) zejména z důvodu obstrukce intrapankreatického průběhu žlučovodu jsou častější případy difuzního zvětšení hlavy pankreatu bez pankreatických bolestí nežli ložiska v hlavě pankreatu nenádorové povahy. Mnohočetné transduodenální biopsie hlavy pankreatu tru-cut jehlou vějířovitě směrované do hlavy pankreatu pak mohou zvýšit pravděpodobnost záchytu případného maligního onemocnění. V případě negativního nálezu je pak nutné nemocné dlouhodobě sledovat pro možnost včasného záchytu vzniku malignity v terénu CHP. Zpřesnění diagnózy pomocí tzv. liquid biopsy, sérových markerů (či ze stolice) by mohla vést k identifikaci nemocných s nádorem v terénu CHP ještě v kurativních stadiích.
ZÁVĚR
Kumulativní riziko vzniku karcinomu pankreatu u nemocných s chronickou pankreatitidou není vysoké a frekvence skutečně maligních lézí v terénu chronické pankreatitidy je nízká, kromě hereditární či tropické pankreatitidy. Prokazatelnost nádorových buněk v ložisku vzniklém v terénu chronické pankreatitidy je i při použití EUS/FNA nesnadná a o úspěšnosti rozhoduje velmi mnoho proměnných faktorů. Existují data potvrzující asociaci mezi chronickou pankreatitidou a karcinomem pankreatu, stejně tak jako reverzní kauzalitu – vznik chronické pankreatitidy obstrukční povahy v důsledku přítomnosti tumoru pankreatu. Klinický překryv, resp. obtížnost odlišení nádorových změn od zánětlivých i z pohledu patologa činí management ložiskových lézí v terénu chronické pankreatitidy velmi obtížným. Přesnost dostupných diagnostických modalit včetně tkáňových využívaných u ložiskových lézí v terénu chronické pankreatitidy není dostatečná, a lze proto očekávat nadále ne zcela nutné resekční výkony na pankreatu. Stejně tak je nutné počítat s určitým procentem nemocných, u nichž nebude proveden místo bypassového výkonu resekční výkon pro neprokázaný/ nepoznaný tumor pankreatu v terénu chronické pankreatitidy.
Seznam zkratek:
CHP – chronická pankreatitida
HJA – hepatiko-jejuno anastomóza
PJA – pankreatiko-jejuno-anastomóza
PDAC – pankreatický vývodový adenokarcinom
EUS-FNA/B – endosonograficky navigovaná tenkojehlová aspirační cytologie/biopsie
FISH – fluorescenční in situ hybridizace
PETCT – pozitronová emisní tomografie kombinovaná s počítačovou tomografií
LPE – levostranná pankreatektomie
DPE – pankreatoduodenektomie
TPE – totální pankreatektomie
CHDDA – choledochoduodenoanastomóza
MDT – multidisciplinární týmAIP – autoimunitní pankreatitida
VMS – vena mesenterica superior
PPDPE – pylorus šetřící pankreatoduodenektomie
MODS – syndrom multiorgánové dysfunkce
VP – vena portae
GEA – gastroenteroanastomóza
CHCE – cholecystektomie
CI – interval spolehlivosti
IPSG – Mezinárodní skupina pro studium pankreatitidy
MRI – magnetická rezonance
MRCP – magnetická rezonance – cholangio pankreatikografie
miRNA – jednovláknové řetězce nekódující RNAPodpořeno grantem MZ ČR, NV19-09-00088.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.Rozhl Chir. 2022;101 : 549–556
doc. MUDr. Martin Loveček, Ph.D.
I. chirurgická klinika FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: martin.lovecek@fnol.cz
ORCID: 0000-0001-9775-9643
Sources
1. Lowenfels AB, Maisonneuve P, Cavallini G, et al. Prognosis of chronic pancreatitis: an international multicenter study. International Pancreatitis Study Group. Am J Gastroenterol. 1994;89(9):1467–1471.
2. Lowenfels AB, Sullivan T, Fiorianti J, et al. The epidemiology and impact of pancreatic diseases in the United States. Curr Gastroenterol Rep. 2005;7(2):90–95. doi:10.1007/s11894-005-0045-6.
3. Howes N, Lerch MM, Greenhalf W, et al. Clinical and genetic characteristics of hereditary pancreatitis in Europe. Clin Gastroenterol Hepatol. 2004;2(3):252–261. doi:10.1016/s1542-3565(04)00013-8.
4. Raimondi S, Lowenfels AB, Morselli-Labate AM, et al. Pancreatic cancer in chronic pancreatitis; aetiology, incidence, and early detection. Best Pract Res Clin Gastroenterol. 2010;24(3):349–358. doi:10.1016/j.bpg.2010.02.007.
5. Levy P, Milan C, Pignon JP, et al. Mortality factors associated with chronic pancreatitis. Unidimensional and multidimensional analysis of a medical-surgical series of 240 patients. Gastroenterology 1989;96(4):1165–1172.
6. Seicean A, Tantau M, Grigorescu M, et al. Mortality risk factors in chronic pancreatitis. J Gastrointestin Liver Dis. 2006;15(1):21–26.
7. Hoffmeister A, Mayerle J, Beglinger C, et al. English language version of the S3-consensus guidelines on chronic pancreatitis: Definition, aetiology, diagnostic examinations, medical, endoscopic and surgical management of chronic pancreatitis. Z Gastroenterol. 2015;53(12):1447 – 1495. doi:10.1055/s-0041-107379.
8. www.cancer.net. 9. www.uzis.cz.
10. Burris HA 3rd, Moore MJ, Andersen J, et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol. 1997;15(6):2403–2413. doi:10.1200/JCO.1997.15.6.2403.
11. Dítě P, Novotný I, Přecechtělová M, et al. Incidence pankreatického karcinomu u osob s chronickou pankreatitidou. Vnitř Lék. 2009;55(1):18–21.
12. Dhar P, Kalghatgi S, Saraf V. Pancreatic cancer in chronic pancreatitis. Ind J Surg Onc. 2015;6(1):57–62. doi:10.1007/ s13193-014-0373-9.
13. Will U, Mueller A, Topalidis T, et al. Value of endoscopic ultrasonography-guided fine needle aspiration (FNA) in the diagnosis of neoplastic tumor(-like) pancreatic lesions in daily clinical practice. Ultraschall Med. 2010;31(2):169–174. doi:10.1055/s-0028-1109491.
14. Fritscher-Ravens A, Brand L, Knofel WT, et al. Comparison of endoscopic ultrasound - guided fine needle aspiration for focal pancreatic lesions in patients with normal parenchyma and chronic pancreatitis. Am J Gastroenterol. 2002;97(11):2768–2775. doi:10.1111/j.1572-0241.2002.07020.x.
15. Kim JK, Altun E, Elias J, et al. Focal pancreatic mass: distinction of pancreatic cancer from chronic pancreatitis using gadolinium - enhanced 3D-gradient-echo MRI. J Magn Reson Imaging 2007;26(2):313 – 322. doi:10.1002/jmri.21010.
16. Li X, Gao P, Wang Y, et al. Blood derived microRNAs for pancreatic cancer diagnosis: a narrative review and meta-analysis. Front Physiol. 2018;9 : 685. doi:10.3389/ fphys.2018.00685.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2022 Issue 11-
All articles in this issue
- Chirurgie a chronická pankreatitida
- Historický přehled operací pro chronickou pankreatitidu
- Latexový a silikonový drén v chirurgii − je zákaz pryžového drénu opravdu krokem dopředu, nebo spíše zpět?
- Enzymatická suplementace u nemocných po totální pankreatektomii; populační analýza
- Sternotomie při operaci štítné žlázy
- Autoimunitní pankreatitida – chirurgický omyl?
- Karcinom pankreatu v terénu chronické pankreatitidy – diagnosticko-terapeutické dilema; přehled případů
- Současný stav chirurgické léčby chronické pankreatitidy v České republice
- Extrakorporální litotrypse rázovou vlnou v kombinaci s endoskopií jako léčebná modalita u algické obstruktivní chronické pankreatitidy − kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Karcinom pankreatu v terénu chronické pankreatitidy – diagnosticko-terapeutické dilema; přehled případů
- Latexový a silikonový drén v chirurgii − je zákaz pryžového drénu opravdu krokem dopředu, nebo spíše zpět?
- Současný stav chirurgické léčby chronické pankreatitidy v České republice
- Historický přehled operací pro chronickou pankreatitidu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

