-
Medical journals
- Career
Autoimunitní pankreatitida – chirurgický omyl?
Authors: L. Havlůj 1; A. Whitley 1; J. Hajer 2; T. Hráček 1; R. Gürlich 1
Authors‘ workplace: Chirurgická klinika Fakultní nemocnice Královské Vinohrady a 3. lékařské fakulty, Praha 1; Gastrocentrum Fakultní nemocnice Královské Vinohrady a 3. lékařské fakulty, Praha 2
Published in: Rozhl. Chir., 2022, roč. 101, č. 11, s. 540-544.
Category: Case Report
doi: https://doi.org/10.33699/PIS.2022.101.11.540–544Overview
Autoimunitní pankreatitida je specifickou formou chronického zánětlivého onemocnění slinivky břišní. Svými klinickými projevy může imitovat i maligní onemocnění pankreatu, a proto je pro stanovení diagnózy nezbytný multidisciplinární přístup. Autoimunitní pankreatitidu lze diagnostikovat na základě kombinace klinických příznaků, zobrazovacích a endoskopických metod, sérologického a v neposlední řadě histopatologického vyšetření. Klinicky a histomorfologicky existují dvě různé formy autoimunitní pankreatitidy – typ 1 a typ 2. První typ je lymfoplazmocytární sklerotizující pankreatitida a u druhého typu se jedná o idiopatickou centroduktální sklerotizující pankreatitidu. Onemocnění probíhá nejčastěji ve formě chronické pankreatitidy a akutními exacerbacemi. Autoři v tomto článku prezentují dvě kazuistiky pacientů operovaných pro podezření na maligní postižení pankreatu, u kterých až následně na základě histopatologického vyšetření byla diagnostikována autoimunitní pankreatitida. Cílem sdělení je proto poukázat na diagnostická úskalí tohoto onemocnění. Chirurgická léčba není dle současných doporučení považována za standardní léčebný postup.
Klíčová slova:
autoimunitní onemocnění – chronická pankreatitida – autoimunitní pankreatitida – IgG4
ÚVOD
Autoimunitní pankreatitida (AIP) je vzácnou formou chronické pankreatitidy. Typickými klinickými projevy tohoto onemocnění jsou bezbolestný ikterus, dyspeptické potíže, váhový úbytek a nově vzniklý DM.
Sir Henry Sarles byl historicky první, kdo popsal tuto zvláštní formu chronické pankreatitidy spojenou s obstrukčním ikterem a hypergamaglobulinemií v roce 1961 [1]. Yoshida a spol. definovali AIP na základě hyperbilirubinemie, pozitivity imunoglobulinů a diagnostickou efektivní léčebnou reakcí na kortikoidy až v roce 1995 [2]. Prof. Dítě publikoval první případ AIP v ČR, a to u mladé zdravotní sestry v roce 2004 [3].
Nejvyšší výskyt AIP je zaznamenán v Asii. V Japonsku je incidence 1,4 na 100 000 obyvatel a prevalence 4,6 na 100 000 obyvatel. AIP tvoří přibližně 5–6 % všech forem chronické pankreatitidy [4,5]. AIP je součástí systémové nebo lokální formy IgG4 asociované nemoci (IgG4-RD) a je často spojena s exokrinní a endokrinní dysfunkcí pankreatu, která se vyskytuje u téměř 80 % případů) [6].
Další extrapankreatické manifestace onemocnění závisejí na formě AIP. U typu 1 (LPSP) se ve více než polovině případů vyskytují sklerotizující cholangoitida, retroperitoneální fibróza, IgG4 pozitivní tubulointersticiální nefritida, chronická sklerotizující sialadenitida a syndrom sicca. Tento typ je častější, častěji se vyskytuje u mužů a je typický ve vyšším věku. V laboratoři je typická elevace sérového IgG4 nad 280 mg/dl. K relapsu onemocnění dochází až v 50 % případů [7].
AIP typ 2 (IDCP) se častěji vyskytuje v Evropě a Severní Americe než v Asii. Typickým klinickým projevem je akutní zánět slinivky břišní. Vyskytuje se u obou pohlaví stejně často a postihuje spíše mladší pacienty. Mezi nejčastější extrapankreatické projevy patří IBD (75 % ulcerózní kolitida, 15 % M. Crohn). Zásadní význam pro diagnostiku má histopatologické vyšetření (EUS a FNAB). K relapsu dochází vzácněji, a to kolem deseti procent [8].
Diagnóza AIP je obvykle stanovena na základě laboratorních testů (elevace amylázy, cholestáza, elevace IgG4, eozinofilie), zobrazovacích metod (MDCT, MRI, EUS) a histologie (FNAB). Sérová hladina IgG4 bývá až v 80 % zvýšená u typu 1, falešně pozitivní může být u 10 % karcinomů pankreatu a u 5 % zdravé populace. Elevace hladiny IgG4 u typu 2 je vzácná. Histopatologicky je pro oba typy AIP charakteristická přítomnost periduktálního lymfoplazmocytárního infiltrátu. Pro typ 1 specificky chybějí granulocytární epiteliální léze (GEL) a jsou přítomny IgG4 plazmatických buněk (>10 na HPF). Naopak pro typ 2 jsou typicky přítomné GEL a IgG4 plazmatické buňky jsou v normě. Velmi často se vyskytuje i neutrofilní acinární infiltrace. Pro diagnostiku je významná i léčebná odpověď na kortikoidy [9]. Diagnostická kritéria AIP „HISORt“ byla definována v roce 2006, Mayo Clinic a dosahují vysoké specificity a senzitivity (Tab. 1) [10].
Table 1. HISORt kritéria pro stanovení diagnózy autoimunitní pankreatitidy
Tab. 1: HISORt criteria for the diagnosis of autoimmune pancreatitis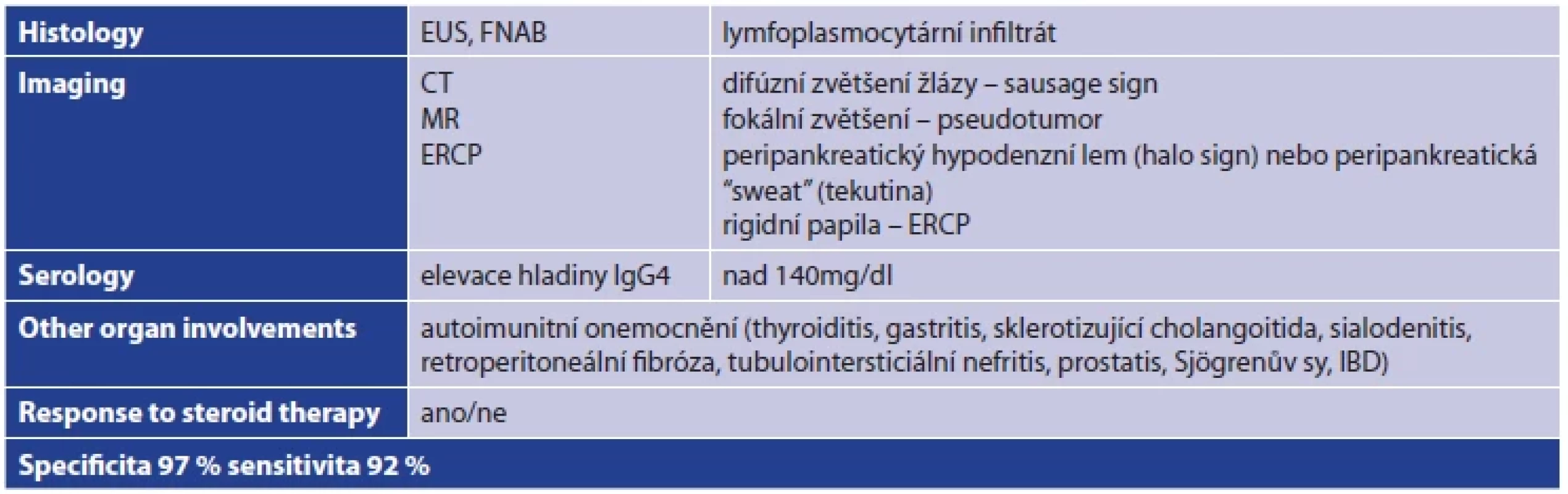
Poznámka: Diagnostická kritéria autoimunitní pankreatitidy HISORt – Mayo Clinic 2006 Hlavní léčebnou modalitou AIP je imunosuprese kortikosteroidy. Indukční léčebná dávka Prednisonu se iniciálně pohybuje obvykle v rozmezí 0,6–1 mg/kg/den po dobu 4–6 týdnů. Poté se léčba deeskaluje o 5 mg za týden [10]. Klinický efekt léčby se obvykle dostaví během dvou týdnů. Efekt lze monitorovat sérovou hladinou IgG4 nebo zobrazovacím vyšetřením. Přetrvávající symptomatologie může v diferenciální diagnostice podpořit možnost maligního onemocnění. Dostatečně dlouhá udržovací léčba je nutná ke snížení rizika relapsu, obvyklá dávka je v rozmezí 5 až 7,5 mg za den, a to po dobu 3 let, Masamune a spol. [11].
V případě rezistence na léčbu kortikoidy jsou alternativními možnostmi léčby imunomodulátory (Azathioprin – Imuran) nebo monoklonální protilátky proti CD 20 antigenu na B-lymfocyty (Rituximab). Imunomodulátory nejsou v monoterapii obvykle účinné, a musejí být proto kombinovány s kortikosteroidy. Indukční léčba Rituximabem jsou obvykle čtyři dávky 375 mg na metr čtvereční tělesného povrchu (BSA) za týden a udržovací 375 mg na metr čtvereční tělesného povrchu každé 2 až 3 měsíce po dobu 2 let [12].
KAZUISTIKA 1
Pacientka, 73 let, s osobní anamnézou chronické autoimunitní tyreoiditidy a s diabetem mellitem 2. typu na inzulinoterapii od ledna 2011 s denní potřebou 18 jednotek inzulinu byla vyšetřována pro dyspeptický syndrom horního typu. Pro současnou elevaci jaterních testů bylo iniciálně provedeno ERCP s nálezem dilatace intrahepatických i extrahepatických žlučových cest s těsnou stenózou distálního žlučovodu se zavedením plastového biliárního stentu. Dále bylo indikováno MDCT s nálezem suspektního tumoru hlavy pankreatu, d. pancreaticus bez dilatace, regionální uzliny nezvětšené, bez známek generalizace (Obr. 1). Vzhledem k nejasné příčině stenózy byla ještě doplněna endoskopická ultrasonografie (EUS). EUS opět neprokázalo typické ložisko pankreatu nebo lymfadenopatii, přesto k vyloučení malignity byla provedena tenkojehlová aspirační biopsie (FNAB) z hlavy pankreatu.
Image 1. MDCT s nálezem tumoru hlavy pankreatu V červeném kruhu zachycena oblast hlavy pankreatu.
Fig. 1: MDCT with pancreatic head tumor The pancreatic head is captured in the red circle.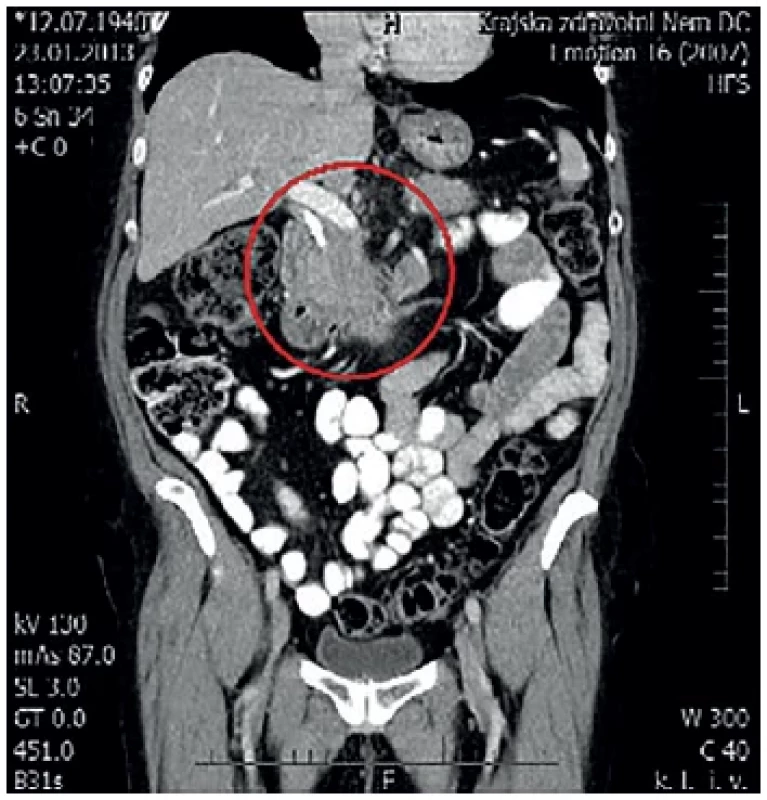
Dle provedené biopsie a na základě histopatologického vyšetření průkaz maligních buněk. Kromě iniciální elevace JT (po ERCP normalizace) byla laboratorně patrná elevace Ca19-9 (160 kU/l). Hodnoty CEA byly ve fyziologických mezích. Na základě rozhodnutí multioborového týmu bylo vzhledem k podezření na malignitu pankreatu indikováno operační řešení.
Pro peroperační nález těžké fibrózy těla a kaudy pankreatu a vzhledem k již premorbidní přítomnosti DM na insulinoterapii byla provedena totální pankreatektomie se splenektomií a s radikální lymfadenektomií. Výkon trval přibližně 240 minut s krevní ztrátou okolo 300 ml. Pooperační průběh byl komplikován povrchovou infekcí laparotomie (infikovaný serom). Chirurgická hospitalizace trvala 10 dní. K nastavení následné pooperační inzulinoterapie byla pacientka přeložena na interní oddělení.
V definitivním histologickém nálezu byla nalezena lymfoplazmocytární sklerotizující pankreatitida s atrofií acinu a difuzními změnami, dále periduktální fibróza a lymfoplasmocytární infiltrát s převahou plazmatických buněk. Všech 14 uzlin bylo bez průkazu maligního postižení. Uzavřeno patologem jako AIP typ I. Případná imunohistochemická typizace bude provedena dle potřeby ošetřujícího lékaře. Pacientka dále dispenzarizována na gastroenterologii a diabetologii.
KAZUISTIKA 2
Pacient, 68 let, s anamnézou chronické gastritis typu A a diabetu mellitu 2. typu kompenzovaného dietou byl na naší klinice vyšetřován pro ikterus a váhový úbytek 7 kg za sedm týdnů. Laboratorní vyšetření prokázalo elevaci bilirubinu (97,1 μkat/l) a jaterního souboru (ALT 3,90 μkat/l, AST 2,35 μkat/l, ALP 2,70 μkat/l, GGT 5,14 μkat/l). Současně amyláza v séru byla 1,95 μkat/l a lipáza 1,90 μkat/l. Při ERCP byl nalezen edém duodena, rigidní papila, při pokusu o precut jehlovým nožem došlo ke krvácení, které bylo ošetřeno opichem adrenalinu a argon plazma koagulací (APC). Krvácení bylo endoskopicky zastaveno. Odebrané onkomarkery byly v normě. Dle MDCT s nálezem zvětšené hlavy pankreatu 53×38×31 mm, atrofie těla a kaudy pankreatu, přítomen „double duct sign“ s dilatací pankreatického vývodu na 3 mm a dilatací intra i extrahepatických žlučových cest s dilatací hepatocholedochu na 11 mm. Bez známek generalizace nebo patologické lymfadenopatie (Obr. 2, 3). Zajímavým vedlejším nálezem na MDCT byl truncus hepatomesentericus (společný kmen truncus ceoliacus a horní mezenterické tepny).
Image 2. MDCT s nálezem double duct sign V červeném kruhu dilatace hepatocholedochu.
Fig. 2: MDCT with double duct sign Dilatation of the common bile duct is captured in the red circle.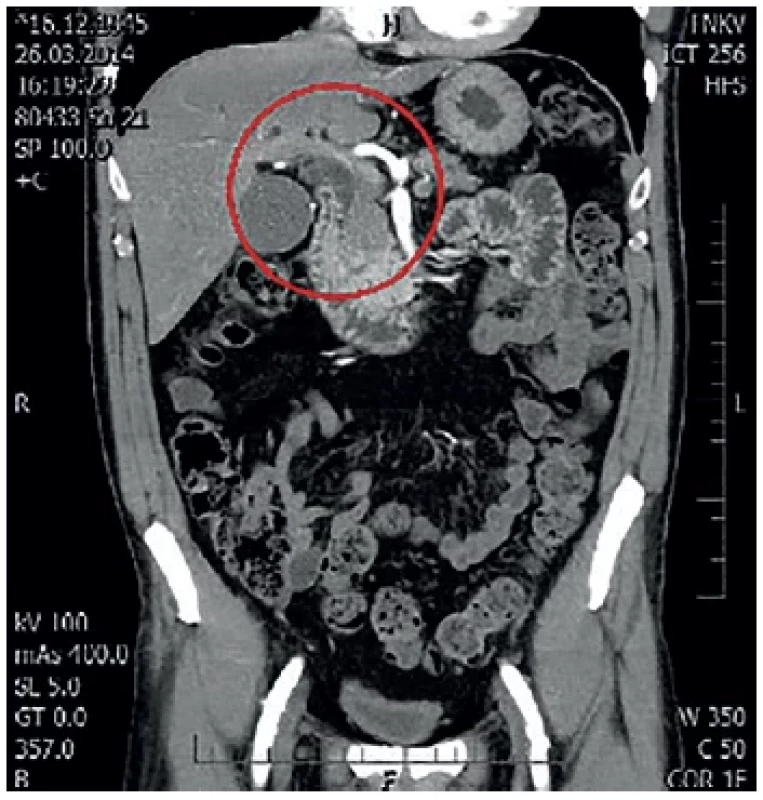
Image 3. MDCT s nálezem duble duct sign V červeném kruhu dilatace d. Wirsungi.
Fig. 3: MDCT with double duct sign Dilatation of the pancreatic duct is captured in the red circle.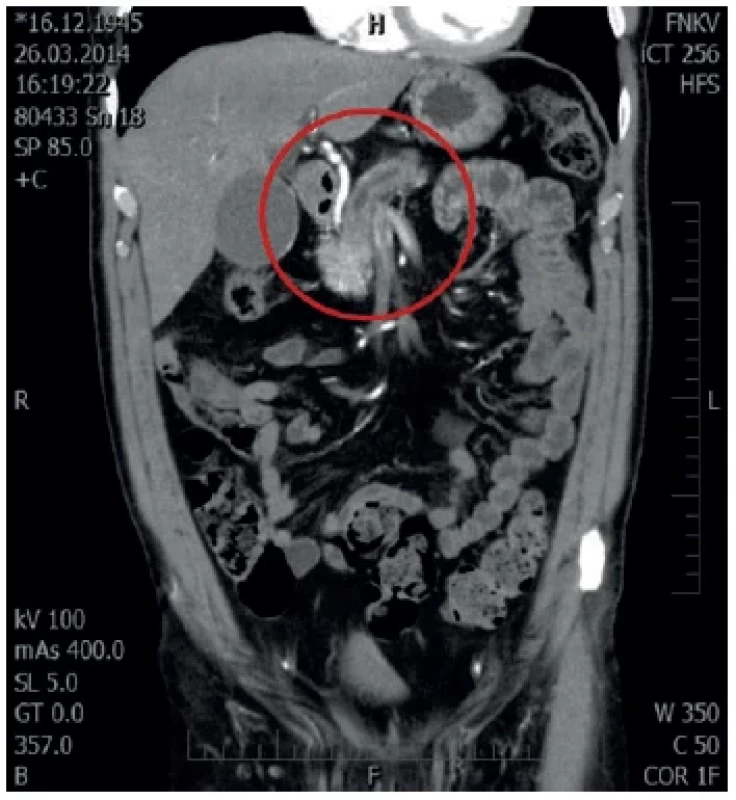
Na základě rozhodnutí multioborového týmu byl pacient indikován k operačnímu řešení.
Dle peroperačního nálezu byly přítomny těžké difuzní změny celého parenchymu pankreatu. Zejména z těchto důvodů byla indikována totální pankreatektomie se splenektomií a standardní lymfadenektomií. Operační výkon trval 290 minut s krevní ztrátou kolem 400 ml. Pooperační průběh byl zcela bez komplikací. 14. pooperační den byl pacient přeložen na interní oddělení k nastavení pooperační léčby DM. Dle histologického nálezu bylo popisováno ložisko v hlavě pankreatu s floridní chronickou fibroproduktivní pankreatitidou. Dále byly přítomny regresivní změny (atrofie a lipomatóza) těla a kaudy. Vyšetřeno bylo celkem 21 lymfatických uzlin, které byly všechny bez známek malignity. Imunohistochemicky bylo zjištěno více než 10 IgG4 pozitivních plazmatických buněk na zorné pole. Pacient byl dále dispenzarizován na gastroenterologii a diabetologii. Pacient zemřel 24. 12. 2016 na komplikace spojené s hypoglykemií.
DISKUZE
Existence diagnózy AIP nemá zásadní dopad na dlouhodobé přežívání [13]. Dlouhodobé přežívání ale mohou ovlivnit dvě okolnosti. Až třetina pacientů s AIP je do jisté míry zbytečně indikovaná k operační léčbě pro podezření na maligní onemocnění pankreatu. Totální pankreatektomie je výkon, který prakticky eliminuje relaps onemocnění za cenu dlouhodobého zhoršení kvality života [14]. Hlavními důvody při rozhodování o rozsahu resekčního výkonu jsou stav pankreatického remnantu (zejména atrofie) a premorbidní přítomnost DM léčeného inzulinoterapií.
Je však důležitým faktem, že AIP je rizikovým faktorem vzniku karcinomu pankreatu. Kromě efektu chronického zánětu byla u AIP častěji pozorována mutace K-ras [15]. Na základě těchto okolností není chirurgické řešení chybou, zvláště pokud nelze vyloučit maligní postižení pankreatu či naopak nelze potvrdit pouze AIP. Vzhledem k rychlé dynamice maligních onemocnění pankreatu může kontrola nálezu s časovým odstupem vést ke zpoždění diagnózy a k zhoršení onkologické prognózy pacienta.
Obě uvedené kazuistiky poukazují na shodné klinické projevy maligního onemocnění pankreatu a AIP. V těchto případech se jednalo o identické nespecifické klinické příznaky bezbolestného ikteru spojeného s váhovým úbytkem. V laboratorních hodnotách byla patrná elevace bilirubinu, jaterního souboru a současně i onkomarkerů. Zobrazovací vyšetření prokázala ložiskový pseudotumorózní proces s typickým nálezem „double duct sign“. Při histologicko-cytologickém vyšetření z FNAB byla u jednoho pacienta popsána i suspekce na přítomnost maligních buněk.
Ani u jedné uvedené kazuistiky nebylo možné z předoperačních vyšetření vyloučit maligní postižení pankreatu. Oba uvedení pacienti byli proto na základě konsenzuálního názoru onkologického týmu indikováni k operačnímu řešení. Až z definitivního histopatologického vyšetření byla stanovena v obou případech diagnóza AIP.
ZÁVĚR
Léčba AIP je zejména nechirurgická. Přesto je zřejmé, že „nechtěná“ chirurgická léčba AIP je a bude v budoucnu realitou na všech chirurgických pracovištích zabývajících se chirurgií slinivky břišní. Přes všechna uvedená fakta není operační řešení AIP chybou. Provedení TPE je zárukou, že nedojde k následnému relapsu onemocnění. Současně AIP má potvrzen maligní potenciál. O možné diagnóze AIP je třeba uvažovat, pokud má pacient v anamnéze autoimunitní onemocnění nebo na zobrazovacích vyšetřeních je nález typický pro AIP. V těchto případech je nutné provedení EUS a FNAB. Stanovení IgG4 v séru má pro diagnostiku AIP nízkou senzitivitu a specificitu. Definitivní histologie může být nepříjemným výsledkem a jistou formou zklamání z dobře provedené operace.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
Rozhl Chir. 2022;101 : 540–544
MUDr. Lukáš Havlůj
Chirurgická klinika FN KV a 3. LF UK
Šrobárova 50
100 34 Praha 10
e-mail: lukashavluj@atlas.cz
Sources
1. Sarles H, Sarles JC, Camatte R, et al. Chronic inflammatory sclerosing of the pancreas – An autonomous pancreatic disease? Am J Dig Dis. 1961;6 : 688–698. doi:10.1007/BF02232341.
2. Yoshida K, Toki F, Takeuchi T, et al. Chronic pancreatitis caused by an autoimmune abnormality. Proposal of the concept of autoimmune pancreatitis. Dig Dis Sci. 1995;40 : 1561–1568. doi:10.1007/ BF02285209.
3. Dítě P, Ševčíková A, Novotný I, et al. Autoimunitní chronická pankreatitida. Bulletin HPB 2004;12(3):78–80.
4. Kamisawa T, Shimosegawa T. Epidemiology of autoimmune pancreatitis. Pancreas 2018;503–5099. doi:10.1002/ 9781119188421.ch63.
5. Nishimori I, Tamakoshi A, Otsuki M. Prevalence of autoimmune pancreatitis in Japan from a nationwide survey in 2002. J. Gastroenterol. 2007 May;42(18):6–8. doi:10.1007/s00535-007-2043-y.
6. Okazaki K, Kawa S, Kamisawa T, et al. Japanese clinical guidelines for autoimmune pancreatitis. Pancreas 2009;38(8):849–866. doi:10.1097/MPA. 0b013e3181b9ee1c.
7. Sah RP, Chari ST, Pannala R, et al. Differences in clinical profile and relapse rate of type 1 versus type 2 autoimmune pancreatitis. Gastroenterology 2010 Jul; 139(1):140–148;e12–23. doi:10.1053/j.gastro. 2010.03.054.
8. Masood M. Autoimmune pancreatitis: What we know so far. JGH Open. 2021;6(1):3–10. doi:10.1002/jgh3.12688.
9. Kamisawa T, Shimosegawa T, Okazaki K, et al. Standard steroid treatment for autoimmune pancreatitis. Gut 2009 Nov;58(11):1504–1537. doi:10.1136/ gut.2008.172908.
10. Chari ST, Smyrk TC, Levy MJ, et al. Diagnosis of autoimmune pancreatitis: the Mayo Clinic experience. Clin Gastroenterol Hepatol. 2006;4(8):1010–1016;934. doi:10.1016/j.cgh.2006.05.017.
11. Masamune A, Nishimori I, Kikuta K, et al. Research Committee of Intractable Pancreas Diseases in Japan. Randomised controlled trial of long-term maintenance corticosteroid therapy in patients with autoimmune pancreatitis. Gut 2017;66(3):487–494. doi:10.1136/gutjnl - -2016-312049.
12. Hart PA, Topazian MD, Witzig TE, et al. Treatment of relapsing autoimmune pancreatitis with immunomodulators and rituximab: the Mayo Clinic experience. Gut 2013;62(11):1607–1615. doi:10.1136/gutjnl - 2012-302886.
13. Sah RP, Chari ST, Pannala R, et al. Differences in clinical profile and relapse rate of type 1 versus type 2 autoimmune pancreatitis. Gastroenterology 2010;139(1):140 – 148. doi:10.1053/j.gastro.2010.03.054.
14. Scholten L, Latenstein AEJ, van Eijck C, et al. Dutch Pancreatic Cancer Group. Outcome and long-term quality of life after total pancreatectomy (PANORAMA): a nationwide cohort study. Surgery 2019;166(6):1017–1026. doi:10.1016/j. surg.2019.07.025.
15. Yu T, Wu Y, Liu J, et al. The risk of malignancy in patients with IgG4-related disease: a systematic review and metaanalysis. Arthritis Res Ther. 2022;24(1):14. doi:10.1186/s13075-021-02652-2.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2022 Issue 11-
All articles in this issue
- Chirurgie a chronická pankreatitida
- Historický přehled operací pro chronickou pankreatitidu
- Latexový a silikonový drén v chirurgii − je zákaz pryžového drénu opravdu krokem dopředu, nebo spíše zpět?
- Enzymatická suplementace u nemocných po totální pankreatektomii; populační analýza
- Sternotomie při operaci štítné žlázy
- Autoimunitní pankreatitida – chirurgický omyl?
- Karcinom pankreatu v terénu chronické pankreatitidy – diagnosticko-terapeutické dilema; přehled případů
- Současný stav chirurgické léčby chronické pankreatitidy v České republice
- Extrakorporální litotrypse rázovou vlnou v kombinaci s endoskopií jako léčebná modalita u algické obstruktivní chronické pankreatitidy − kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Karcinom pankreatu v terénu chronické pankreatitidy – diagnosticko-terapeutické dilema; přehled případů
- Současný stav chirurgické léčby chronické pankreatitidy v České republice
- Latexový a silikonový drén v chirurgii − je zákaz pryžového drénu opravdu krokem dopředu, nebo spíše zpět?
- Historický přehled operací pro chronickou pankreatitidu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

